Method Article
SerbestÇe Hareket Eden Farelerde Davranışı Modüle Etmek Için Nöronal Aktivitenin Optogenetik Manipülasyonu
Bu Makalede
Özet
Belirli nöronal popülasyonların veya beyin bölgelerinin optogenetik manipülasyonu ile, davranış serbestçe hareket eden hayvanlarda yüksek zamansal ve mekansal çözünürlük ile değiştirilebilir. Kronik implante optik lifler ile birlikte farklı optogenetik araçlar kullanılarak, nöronal modülasyonlar ve davranışsal testler çeşitli yapılabilir.
Özet
Serbestçe hareket eden farelerde nöronal devrelerin optogenetik modülasyonu akut ve uzun süreli davranışları etkiler. Bu yöntem, merkezi sinir sisteminde ki tüm nöronal devrelere kadar tek nöronların ve bölgeye özgü verici salınımının manipülasyonlarını gerçekleştirebilmekte ve davranışsal sonuçların doğrudan ölçülmesine olanak sağlamaktadır. Nöronlar, Channelrhodopsin2 (ChR2) gibi tercih edilen DNA'yı taşıyan viral vektörlerin enjeksiyonu yla optogenetik araçları ifade eder. Işık, hedef bölgenin hemen üzerinde sonlandırılabilen kronik optik implantlar aracılığıyla belirli beyin bölgelerine getirilir. Kurtarma ve uygun araç ekspresyonu iki hafta sonra, fareler tekrar tekrar ilgi nöronların optogenetik stimülasyon ile davranıştestleri için kullanılabilir.
Optogenetik modülasyon, kimyasal veya elektriksel stimülasyon gibi yaygın olarak kullanılan yöntemlerle karşılaştırıldığında, yüksek hücre özgüllüğü ile gerçekleştirilebilir yüksek zamansal ve mekansal çözünürlüğe sahiptir. Işık nöronal dokuya zarar vermez ve bu nedenle uzun süreli deneylerin yanı sıra bir farede birden fazla davranışsal deney için de kullanılabilir. Optogenetik araçların olanakları neredeyse sınırsızdır ve tüm nöronların aktivasyonuna veya susturulmasını, hatta belirli bir reseptör tipinin ışıkla manipüle edilmesini sağlar.
Entegre optogenetik stimülasyon ile yapılan bu tür davranışsal deneylerin sonuçları, manipülasyonun neden olduğu davranış değişikliklerini doğrudan görselleştirir. Bir temel olarak ışık stimülasyonu olmadan aynı hayvanın davranışı indüklenen değişiklikler için iyi bir kontrol. Bu nöronal türleri veya nörotransmitter sistemlerinbelirli davranışlar dahil ayrıntılı bir bakış sağlar, anksiyete gibi. Nöronal ağların plastisite de optik stimülasyon sonra uzun vadeli stimülasyon veya davranışsal gözlemler yoluyla ayrıntılı olarak araştırılabilir. Optogenetik nörolojik hastalıkların çeşitli nöronal sinyal aydınlatmak için yardımcı olacaktır.
Giriş
Merkezi sinir sisteminde nöronal devrelerin modülasyonu ve davranışsal sonuçları beynin nasıl çalıştığını anlamak için önemlidir, özellikle psikiyatrik hastalıklar ve öğrenme ve hafıza gibi bilişsel görevler. Optogenetik ile, tek hücre veya hücre popülasyonları kadar tüm devreler ışık tarafından modüle edilebilir. Channelrhodopsin2 (ChR2) veya Archaerhodopsin (Arch) gibi yaygın optogenetik araçlar nöronları etkinleştirmek veya susturmak, ya da artırmak veya farklı beyin bölgelerine projektör terminallerinde verici salınımı inhibe edebiliyoruz1,2,3,4. Ancak, Arch presinaptik terminallerde aktivasyonu spontan vericisalınımınıartırır gösterildiği gibi dikkatle kullanılması gerekir 5 . Arch, hücre içindeki pH değerini değiştiren dışa doğru düzeltici bir proton pompasıdır. Bu alkali ortam kalsiyum akını neden olur ve verici serbestartırır 5. Özellikle hücre içi sinyal yollarını modüle etmek için, rodopsin veya koni opsin gibi hafif bir aktive optogenetik araçtan oluşan reseptör kimeraları, yeterli bir G-protein birleştirilmiş reseptör ile birlikte, oluşturulabilir6,7,8. Mevcut optogenetik araçların miktarı ve varyasyonu son on yılda önemli ölçüde artmıştır9.
Optogenetik amacı davranış sırasında nöronal devreleri manipüle etmektir. Optogenetik, örneğin anksiyete davranışındaki değişiklikler gibi akut davranış değişikliklerinin ölçülmesini sağlar. Optogenetik aletler viral vektörler aracılığıyla beynin hedef bölgelerine ulaştırıldı. Özel organizatörler ve arttırıcılar veya Cre-loxP sistemi yardımıyla, optogenetik araçların ekspresyonu için hücre tipi özgüllüğü sağlanabilir (Şekil 1A). Sadece belirli hücre tiplerinde Cre-Rekombinaz enzimini ifade eden birkaç genetiği değiştirilmiş fare hattı vardır. Örneğin, Nex-Cre fareler Nex-promotor kontrolü altında korteks ve hipokampus piramidal nöronlarda Cre-Rekombimaz ifade10. Bu enzim, loxP kenarları11ile çevrili DNA dizilerini tersine çevirebilir. Sonuç olarak, ters ve loxP taraf tarafından çevrili bir çift floxed optogenetik aracın DNA dizisi, sadece Cre-Rekombinazsahip nöronlar tarafından transkripsiyonu olabilir , ama diğer nöronal türleri tarafından12,13. Nex-Cre fareler durumunda, optogenetik araç sadece piramidal nöronlar ifade edilecektir. Bazı beyin bölgelerinin ışık stimülasyonu daha sonra optik liflerin doğrudan ilgi alanının üzerinde kronik implantasyonu ile elde edilir. Hayvanlar daha sonra uygun bir ışık kaynağına birleştiğinde ve serbestçe davranış testleri hemen hemen her türlü davranış.
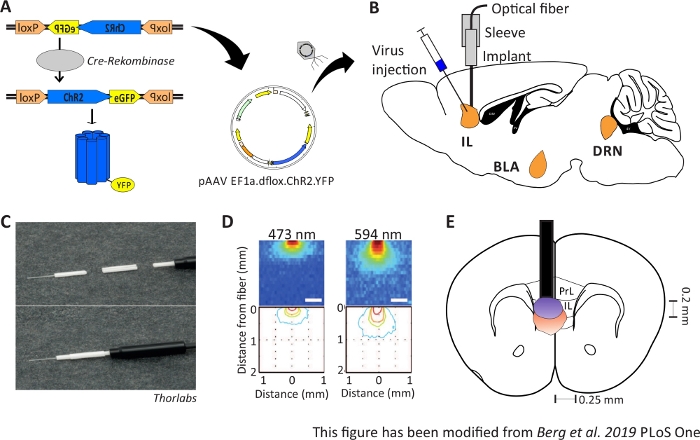
Şekil 1: Enjeksiyon ve implantasyon. A) ChR2-YFP için cre-loxP sistemi. Çift floxed optogenetik araç beyin dokusuiçine enjeksiyon için bir adeno ilişkili virüs (AAV) içinde paketlenir. B) MPFC'nin IL bölgesine/üstüne optik nöronal arayüz enjeksiyonunun ve implantasyonunun sagittal görünümü. Enjeksiyon ve implantasyon yukarıdan yapıldı. Tüm ilgi alanları IL, BLA ve DRN gösterilir. C)İmplante edilen optik fiber, kol ve ışık kaynağının ayrıntılı görünümü. D) Gri madde beyin dokusunda 200 μm ışık lifi ile mavi ve kırmızı lazer ışık stimülasyonunun yayılması (Yizhar ve ark. 2011). Mavi ışık, maksimum, doku içine 0,5 mm, yaklaşık 1 mm kırmızı ışık yayılır. Renk kodlaması: kırmızı %50, sarı %10, yeşil %5, ışık bu alana ulaşırsa mavi %1. E)200 μm optik fiber ile sol IL'nin hemen üzerinde tek taraflı implantasyonun koronal görünümü. IL bölgesi her yarımkürede 0,25 mm genişliğe ve 0,2 mm derinliğe sahiptir. Mavi ve kırmızı ampuller % 5 ışık yayılan yatılı ve Doğru boyuta Yizhar ve ark aktarılır. LoxP: X-over P1 locus; ChR2: Channelrhodopsin; YFP: sarı floresan protein; dflox: çift floxed; IL: infralimbic korteks; BLA: basolateral amigdala; DRN: dorsal raphe çekirdekleri; PrL: prelimbic bölge. Bu rakam Berg 201948'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Hem yüksek zamansal hem de mekansal çözünürlük14 ve hücre tipine özgü modülasyon sağlayan optogenetik yaklaşımlardan yararlanılır. Ayrıca, implante edilen cihazı daha fazla tedavi edilmeden tekrar tekrar kullanmak mümkündür. Optogenetik alettaşıyan adeno-ilişkili bir virüsün enjeksiyonu ve optik fiber inplantasyonunun yapıldığı stereotaktik cerrahiden sonra fareler iki hafta boyunca iyileşebilir. Biz sadece 2 haftalık bir iyileşme süresi seçtik, bu ameliyat tan kurtarmak için yeterli zaman çünkü ve virüs ifade etmek için. Davranışsal deneyler immünohistokimya tarafından takip edilir gibi, fareler deney sırasında çok yaşlı olsun emin olmak gerekir; aksi takdirde doku kalitesi azalır. İmplanttan belirgin davranış bozuklukları göstermez ler ve tipik kafes davranışlarına girişinler. Tabii ki, implantasyon önemli bir cerrahi lezyon eşlik eder; bu nedenle, fareler yoğun bir şekilde izlenir. Ameliyattan sonra, grup fareler birbirlerinin taze yaraları ve implantları zarar eğilimindedir gibi, fareler, tek ev olması gerekir. Ancak, konut koşulları erkek farelerin anksiyete düzeyi üzerinde büyük bir etkisi var, tek ev fareler düşük anksiyete düzeyleri göstermek gibi15 ve genel olarak daha az depresif benzeri belirtiler16.
Beyin devrelerinin kimyasal veya elektriksel manipülasyon optogenetik yüksek hücre tipi özgüllüğü eksikliği ve daha düşük bir zamansal ve mekansal çözünürlükvar 14,17,18. Deneysel soruya bağlı olarak, elektrikveya kimyasal stimülasyon farklı avantajlara sahip olabilir. Belirli bir bölgede lif terminalleri geçerken de uyarılması gerekir, elektrikstimülasyon en iyi yöntemdir. Kimyasal stimülasyon, tüm bölgedeki vericiye özgü reseptörlerin agonistler tarafından aktive edilmesi için iyi bir seçimdir. Optogenetik kimyasal veya elektrikstimülasyon ile karşılaştırıldığında bir diğer büyük avantajı, endojen, nöronlar ışığa duyarlı değildir, hangi yan etkilerin oluşumunu önler19. Gerçekten de, yüksek ışık yoğunlukları ısıtma etkileri neden olabilir8,20, ama uygun kontrol grupları nedeniyle, optogenetik manipülasyon nedeniyle davranışsal etkileri ortadan kaldırılabilir.
Kemirgen davranışlarını araştırmak, özellikle psikiyatrik hastalıklar açısından, serbestçe hareket eden hayvanlarda optogenetik ile büyük ölçüde düzelmiştir, belirli hücre popülasyonlarına kadar tek reseptörlerin doğrudan modülasyonu sağlar gibi21 ve devreler22. Bu tür modülasyonların akut etkilerini ölçme imkanı, ayrıca tanımlanmış bir süre23 veya kronik stimülasyon24sonra uzun vadeli davranışsal etkileri , deneysel tasarımları geniş bir esneklik sağlar ve beyin devreleri içine çok ayrıntılı anlayışlar sağlar. Işık stimülasyonu optogenetik aracın enjeksiyon yerinde bulunan nöronları modüle etmek için kullanılabilir. Enjeksiyon ve implantasyon aynı beyin bölgesine hitap ettiğinde, hücre organları ve bu bölgedeki ilke nöronve internöronların aksonları projelendirme3,6,,8hedeflenebilir. Ancak, ışık lifi de enjekte edilenden farklı bir bölgeye yerleştirilmesi olabilir. Bu durumda, ışık stimülasyonu enjekte edilen bölgenin projeksiyon alanlarında akson terminallerinde verici salınımını modüle edebilir25,26,27.
Burada yapılan çalışmada, optogenetik anksiyete ile ilgili davranışları analiz etmek için deneyler ile birlikte kullanılır. Anksiyete ile ilgili psikiyatrik hastalıklar dünya nüfusunun üçte birinden fazlasını etkiler28,29,30 ve yüksek bir ekonomik yük neden31. Bu etkilenen uyarılma hissi muzdarip, gerginlik ve endişe kaçınma davranışı takip32,33. Bu kronik olarak meydana gelen olumsuz duygular, esas olarak gelecekteki olaylar a odaklanmıştır34, güçlü hastaların günlük yaşam ını müdahale. Benzodiazepinler veya selektif serotonin geri alım inhibitörleri gibi yaygın tedaviler (SSRI) sadece bazı hastalarda başarılı. İnsanların büyük bir kısmı tedaviye35yaşında yanıt vermez , bu tür hastalıkların altında yatan mekanizmanın henüz tam olarak anlaşılamadığını gösterir. Medial prefrontal korteks (mPFC) anksiyete gelişimi ve tezahürü önemli bir rol oynadığı bilinmektedir21,25,27,36,37,38. Özellikle, mPFC infralimbic korteks (IL) bölgenin aşırı aktivasyonu anksiyete ile ilgili bozuklukların bir parçası olabilir39,40. Burada açıklanan örnek deney, mPFC'nin IL bölgesindeki modülasyonların anksiyete davranışını nasıl etkilediğini anlamanızda yardımcı olabilir. Ayrıca, anksiyete ile ilgili psikiyatrik hastalıklar için yeni tedavi stratejilerinin geliştirilmesi de potansiyel olarak desteklenebilir.
2-6 aylık erkek Nex-Cre fareler mPFC41IL bölge içinde piramidal nöronlar özellikle ChR2 ifade etmek için kullanılır. Nex-Cre fareler c57Bl/6 arka plana sahiptir ve özellikle piramidal nöronlarda Cre-rekombinaz enzimini ifade eder. Stereotaktik cerrahi sırasında, çift floxed ChR2-DNA adeno ilişkili viral vektörler ile IL bölgeye enjekte edilir. Optik implant ilgi alanının(Şekil 1B)üzerine yerleştirilir ve implant diş çimentosu ile sabitlenir. Kontrol hayvanları hücreye özgü ifadeyi taklit etmek için aynı bölgede çift floxed tdTomato-DNA enjeksiyonu alırlar.
Hayvanlar ameliyat gününe kadar grup içinde dirve daha sonra diğer farelerin yaralanmalarını önlemek için tek kişilik tir. Fareler tek ev fareler için TypI-L kafeslerde bireysel havalandırmalı kafes (IVC) raflarda yer almaktadır. Açık-koyu çevrim 12:12 saat ritmi, 10 başlayan ışık fazı izler. Tüm davranışsal deneyler, kemirgenlerin aktif evresini andıran karanlık evrede gerçekleştirilir. Su ve standart gıda peletleri reklam libitum mevcuttur. Piramidal nöronlarda ChR2'nin yeterli bir ekspresyonunu sağlayan iki haftalık iyileşmeden sonra, fareler davranışsal deneyler için kullanılır.
Açık Alan (OF), 50 cm x 50 cm kare lik bir labirent ve 40 cm yüksekliğinde kum püskürtmeli bir labirenttir. Zemin iç 4 merkezi temsil 16 kareler ayrılmıştır. Ölçülen davranış: 1) merkezde harcanan zaman, 2) merkez girişsayısı ve 3) toplam mesafe taşındı. Bu deney sırasında, toplam 20 dakika süren 4 deneme vardır. 1 ve 3 numaralı çalışmalarda ışık stimülasyonu yapılmaz ve 2 ve 4 numaralı çalışmalarda 5 ms ışık darbesi ve 1 mW ışık yoğunluğu 473 nm olan 20 Hz stimülasyon gerçekleştirilir(Şekil 2A). Daha sonraki çalışmalarda, test alanına alışma dikkate alınmıştır, ancak sahte enjekte kontrol hayvanlarının kullanımı nasıl alışkanlık ifade edilir gösterir.
Barnes Labirent öğrenme ve bellek için bir deneydir. Çapı 92 cm olan ve çevresi etrafında 20 eşit uzaklıkta delik bulunan dairesel bir platformdur. Deliklerden 19'u kapatılır ve bir deliğin altında bir kaçış kutusu sunulur. 4 gün üst üste, fareler kaçış kutusunun yerini öğrenmek için 4 eğitim denemeleri var. 5.th günde, kaçış kutusu kaldırılır ve fareler doğru deliği bulmak için ne kadar zamana ihtiyaçları olduğu test edilir. Ölçülen davranış: 1) Kaçış kutusu/doğru delik bulunana kadar olan süre, 2) Hedef ziyaret ve hata sayısı ve 3) Mesafe kaçış kutusuna kadar taşınır. Farklı gruplardaki ışık stimülasyonu ya 1-4 eğitim günlerinde gerçekleşen satın alma veya konsolidasyon sırasında ya da 5. gün olan test gününde geri alma sırasında yapılır(Şekil 2D).
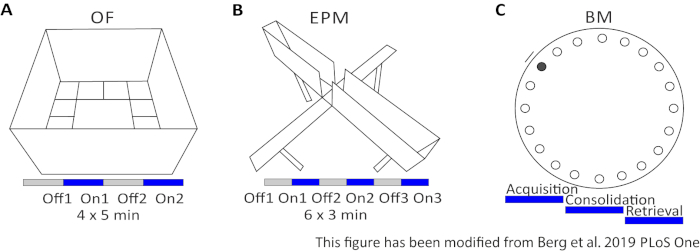
Şekil 2: Optogenetik protokollerle davranışsal deneyler. A) Açık Alan deneyinin ilgili ışık stimülasyon protokolü ile şematik çizimi. C) İlgili ışık stimülasyon protokolü ile Yükseltilmiş Artı Labirent deneyinşematik çizimi. D) Ilgili ışık stimülasyon protokolü ile Barnes Maze deney şematik çizim. EPM: Yükseltilmiş-Plus Labirent; OF: Açık Alan; BM: Barnes Labirent Testi. Bu rakam Berg 201948'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Optogenetik stimülasyon için ışık yoğunluğu ve sıklığının araştırılan optogenetik araca ve nöronal tipe uyarlanmalıdır. Dokuya zarar vermemek için mümkün olan en düşük ışık yoğunluğu kullanılmalıdır, çünkü çeşitli çalışmalar güçlü ışık yoğunluğu nedeniyle olası ısıtma etkileri olduğunu göstermiştir8,20. ChR2 için, 5 ms ışık darbesi ile 20 Hz stimülasyon yaygın olarak kullanılır2. ChR2 ışığa oldukça duyarlı olduğundan, 1 mW ışık yoğunluğu yeterlidir. Işık stimülasyon protokolü, davranış değişikliklerini doğrudan ölçmek için ışık kapalı ve denemeler arasında değişir. Davranışsal deneyler için dış oda koşulları hayvanların tüm grup için istikrarlı kalmalıdır. Dikkate alınması gereken önemli koşullar gürültü (cihazların kendilerini gürültü yapabilir akılda tutmak), koku (her zaman etanol ile davranış kurulumları temiz), ışık yoğunluğu, ve deneyci. Deneyci her zaman aynı kişi olmalıdır. Ayrıca, deneylerin gün saati bir gruptaki tüm hayvanlar için aynı olmalıdır, tesiste karanlık fazBaşladıktan birkaç saat sonra tercih edilir.
Bu deneyin amacı, uyarıcı piramidal nöronların güçlü aktivasyonu ile IL bölgesindeki uyarma/inhibisyon (E/I) oranını artırmaktır. Bu özel korteks bölgesinde gelişmiş bir E / I oranı farelerde anksiyete düzeylerini artırmak için bilinmektedir40,42,43,44.
Protokol
Hayvan denekleri ile ilgili prosedürler kurumsal hayvan araştırma tesisi ve Bremen Üniversitesi 'nde "Senatorin für Wissenschaft, Gesundheit und Verbraucherschutz" tarafından onaylanmıştır (#146)
1. Optik implantın hazırlanması9 (Şekil 1C)
- Bir tezgah mengene bir seramik ferrule düz tarafı yerleştirin.
- Bir lif sıyırma aracı ile 200 μm çapında cam elyaf ceket şerit ve seramik elyaf katip ile 2-3 cm uzunluğunda parçalar kesti.
- Cam elyaf parçasını her iki tarafta eşit bir çıkıntı ile seramik ferrule içine yerleştirin.
- Bir enjeksiyon kanula ile seramik ferrule düz tarafında superglue bir damla yerleştirin.
NOT: Protokol burada duraklatılabilir. - Ön implantı tezgah kalıbından ve seramik feronun yuvarlak tarafına alın, seramik elyaf kâtip ile cam elyafı mümkün olduğunca kısa kesti.
- Ön implantı bir ferrule parlatma diskine yerleştirin ve kağıt başına sekiz 20 kez (30 μm kum, 6 μm kum, 1 μm kum ve son 0,02 m kum) çizerek yuvarlak tarafı 4 farklı parlatma kağıdına parlatayın.
- Ön implantı ferrule parlatma diskinden çıkarın ve seramik ferrule'nin düz tarafındaki cam elyafı implantasyon için gereken uzunluğa kesin. Çıkıntılı yapıştırıcının arkasındaki uzunluğu ölçmeye başlayın.
- Eşit bir kesme yüzeyi için sadece cam elyaf 2-3 kez çizik ve sonra kırmak.
NOT: İmplantın uzunluğunu hesaplamak için Paxinos ve Franklin45'in fare beyin atlasını kullanın. İmplant ilgi alanının hemen üzerinde son vermeli ve kafatasının kalınlığı uzunluk hesaplamasına dahil edilmelidir. IL bölgesini uyarmak için cam elyafın uzunluğu 1,8 mm'dir(Şekil 3).
- Eşit bir kesme yüzeyi için sadece cam elyaf 2-3 kez çizik ve sonra kırmak.
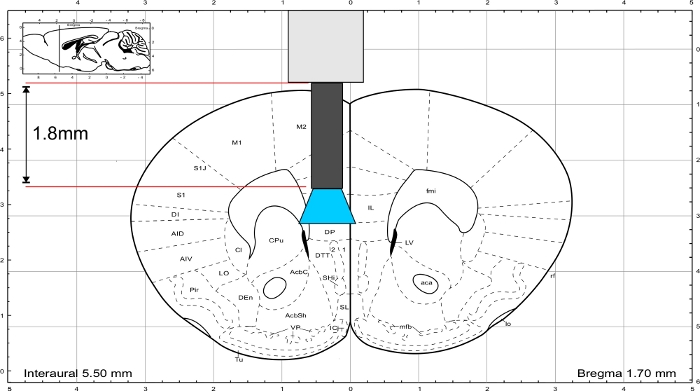
Şekil 3: Fare beyin atlası (Paxinos ve Franklin) IL bölgesine ulaşmak için implant Temsil uzunluğu ile. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Bitmiş implantı 10 dakika etanolde dezenfekte edin ve implantasyondan önce havanın kurumasına izin verin.
2. Enjeksiyon ve implantasyon
- Tek bir fareyi cerrahi odaya taşıyın ve tarttırın. Ketamin/Ksilazin intraperitoneal (i.p.) enjeksiyonu (Ketamin 0.12 mg/g, Ksilazin 0.01 mg/g) ile anestezi uygulayın.
- Fareyi sol elinizle sabitleyip başını düşük taklı olarak sırtına çevirin.
- Şırınga ile karın sol alt kadran hedef ve enjeksiyon kanula girin 1 cm deri altında.
- Karın boşluğuna yavaş ve sürekli bir hareketle anestezi enjekte edin.
- Fareyi kafesine geri yerleştirin ve derin bir anestezi durumuna ulaşana kadar bekleyin.
NOT: Anestezinin derinliği yanıp sönen ve ayak arası reflekslerin yokluğundan belirlenebilir.
- Fareyi ısıtma plakasının üzerine yerleştirin ve başı stereotaktik bir çerçevede düzeltin. Ön burun ve dişleri ve her iki tarafta kulakları düzeltin.
NOT: Doğru stereotaktik koordinatları sağlamak için baş sol-sağ ve rostral-kaudal eksenüzerinde düz olmalıdır. - 2 mg/kg Karprofen ile analjezi farenin arkasına subkutan olarak uygulayın ve kurumasını korumak için her iki göze opak göz merhemi uygulayın.
- Islak bir kağıt havlu ile kafa derisi üzerinde saç nemlendirin ve sonra makas kullanarak kesti. Islık kağıt havlu ile tüm gevşek saç ları kaldırmaya özen güvendir Kafa derisini dezenfekte etmek için, bir pamuk çubuğu kullanın ve iyot içeren bir tentür 0.5 mL kadar sürebilir (Betaisodona 100 mg / mL Povidon iyot ve 11 mg / mL iyot) ve hava kuru izin.
NOT: Makas yerine, uygun epilasyon için bir elektrikli makas da kullanılabilir. - Bir cızırtı ile ilgi bölgesi üzerinde kafa derisi yükseltmek ve orta hat boyunca 1 cm kesti. Kafatasıortaya çıkarmak için bir kenara deri itmek için iki cımbız kullanın. Ayrıca kafatası üzerinde ince deri kaldırmak ve maruz kafatası kuruizin emin olun.
- Daha sonra implantasyon için kafatasını pürüzlendirin.
- 2 mm x 2 mm damla fosforik asit (%37) uygulayın kafatası üzerindeki yapışkan kitinden (örn. Optibond) şırınganın ucuyla dağıtın ve 15 s boyunca etkisini belirtin.
- Bir pamuk sopa ile tüm asit çıkarın ve 1 mL ile kafatası durulamak 0.9% NaCl iki kez.
- Bir pamuk sopa ve basınçlı hava ile kafatası kuru.
Dikkat: Fosforik asit tehlikelidir ve doku hasarlarını önlemek için tamamen çıkarılmalıdır.
- Bireysel koordinatlar için F-Faktör'u hesaplayın.
- Stereotaktik çerçeve ye bir cam kanula yerleştirin ve bregma üzerinde doğrudan bulmak.
- Koordinat sistemini sıfırlayın ve cam kanulayı lambda'ya taşıyın.
- Aşağıdaki formülle F-faktör46'yı hesaplayın:
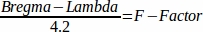
- Tek tek fareye ayarlamak için fare beyin atlası koordinatları ile F-Factor çarpın.
- Enjeksiyon için kafatasında bir delik aç.
- Kafatasının üzerindeki konumu doğrudan ilgi yapısının üzerinde bulmak için ayarlanmış koordinatları kullanın ve kemik yüzeyinin üzerine çizerek bir enjeksiyon kanula ucunu kullanarak işaretleyin.
- Noktada kanula döndürerek işaretli yerde kafatası içine bir delik delmek için enjeksiyon kanula kullanın. Çapak deliğinden kan sızarsa, 1 mL %0.9 NaCl ile durulayın ve daha sonra kafatasını kurulayın.
- Virüs çözeltisini cam kanulaya götürün.
- Kafatasının üzerine %0,9 NaCl'lik 100°L'lik bir damla ve üstte, steril tarafa bir parafilm (1 cm x 1 cm) yerleştirin.
- 1-2 μL virüs çözeltisini parafilm üzerine yerleştirin ve cam kanulanın ucunu içine indirin.
- Bir şırınga cam kanula bağlayın, en az negatif basınç uygulayın ve virüs çözeltisi kanül (saniye içinde) tarafından alınana kadar bekleyin.
NOT: Hava kanulaya alınmadan önce negatif basınç uygulamasını durdurmak önemlidir. Bu nedenle, her zaman virüs çözeltisi küçük bir kalıntı olacaktır.
- Virüs çözeltisini ilgi çekici bölgeye enjekte edin.
- Virüs dolu cam kanulayı çapak deliğinin üzerine yerleştirin.
- Kanulanın ucu kafatası seviyesindeyken kanulayı yavaşça çapak deliğine indirin ve z-koordinatını sıfırla.
- Kanulayı enjeksiyon bölgesinin en düşük konumuna dikkatlice indirin.
- Odak kanula içinde virüs çözeltisi menisküs de dürbün.
- Menisküs marjinal indirilir kadar şırınga ile pozitif basınç küçük bir miktar uygulayın.
- Bir sonraki konuma cam kanula yukarı taşımadan önce virüs 2-3 dakika boyunca yayıldı sağlar.
- Virüs çözeltisini ilgi alanı boyunca her 200-300 μm'de bir uygulayın.
- Cam kanula çok yavaş çıkarın ve son enjeksiyondan sonra atın.
- Kafatasını yapışma kiti (örneğin, OptibondTMFL) ile implantasyona hazırlayın.
- Kafatasını basınçlı havayla kurutun.
- 5 μL astar uygulayın (örn. Optibond, %1-30 (Etanol, Silikasasi, Gliserinfosfatdimethacrylat, 2-(2-(Methacryloyloxy)ethoxycarbonyl)benzoesäure, 2-Hidroksitilmethacrylat)) ile 15 s kurusun.
- 5 μL bond uygulayın (örneğin, Optibond, 15-20% 2-Hidroksietilmethacrylat + 1-2% Alkalihexafluorosilikat(Na)) aynı sopa ile ve UV ışık (420-480 nm) ile 20 s için tedavi.
NOT: Kafatasının kuru olması ve astar ve bağının çok ince bir tabaka halinde uygulanması esastır.
Dikkat: UV ışığı gözlere zarar verebilir gibi, doğrudan UV ışığına bakmayın.
- İmplantı doğrudan ilgi alanının üzerine yerleştirin.
- İmplantı ilgili tutucuda sabitle.
- Kafatasını basınçlı havayla kurutun.
- Cam elyafın ucunu doğrudan çapak deliğinin üzerine yerleştirin ve dikkatlice indirin.
- Kalan süper yapıştırıcı kafatasına dokunduğunda implantı düşürmeyi bırakın. Kafatasına baskı yapmayın!
NOT: Enjeksiyon ve implantasyon farklı bölgelerde yapılıyorsa (örneğin, dorsal raphe ve hipokampus),fosforik asit uyguladıktan sonra gerekli tüm delikleri delin, ancak 2 bileşenli yapışmadan önce, daha önce açıklandığı gibi talimatları uygulayın (adım 2.8-2.14).
- İmplantı tamir edin.
- Kafatasının hala kuru olup olmadığını kontrol et.
- İmplantın etrafına ve çevresine sıvı diş çimentosu (örneğin, Gradia direkt flo) uygulayın ve UV ışığı (420-480 nm) ile 20 s'ye iyibakın.
NOT: Diş çimentosu miktarı serbest kafatası alanına bağlıdır. Tüm kafatası diş çimentosu ile kaplı olmalıdır. - Çimento iki kat daha uygulayın ve tamamen serbest ve kurutulmuş kafatası alanı doldurun. Uv ışığı (420-480 nm) ile her katmanı kür.
- Ameliyatı bitir.
- Yaranın tamamına 0,5 g iyot merhem (Betaisodona 100 mg/mL povidon iyot ve 11 mg/mL iyot) uygulayın.
- Hızlı iyileşme için boyuniçine 0.1 mL glukoz enjekte edin % 0.9 NaCl subkutan olarak çözünmüş.
- Burun ve kulak fiksasyon bırakın, taze bir kafes içine fare getirmek ve vücut ısı kaybını önlemek için bir ısıtma lambası altına yerleştirin.
- Fare uyandığında, onu tesise geri getir.
- Günde en az bir kez sağlık durumunu kontrol edin. Fareler herhangi bir kötü anayasa lar gösteriyorsa uygun eylemi gerçekleştirin (örneğin, farelerağrı belirtisi gösteriyorsa Carprofen ile 3 güne kadar ameliyat sonrası analjezi den emin olun).
NOT: İki haftalık iyileşmeden sonra, fareler davranışsal deneyler için kullanılabilir.
3. Yeni bir deney kurma (Örnek ChR2 stimülasyon ve Açık Alan)
- Darbeli
- Program darbeli (örneğin, Prizmatix) ışık stimülasyonu için.
- Yazılımı açın ve ışık kaynağının takılmış olduğu USB COM bağlantı noktasını seçin.
- İşlem Modu Seçiniz (3) | Yüksek tetikledikten sonra darbe sırasını çalıştırın, ardından harici bir yazılımın ışık kaynağını kontrol etmesine izin vermek için LOW'da durun.
- Işık protokolünü programla. 5 ms ışık darbesi ile 20 Hz stimülasyon için: TI = 23 ms, P1D = 5 ms, P1I = 22 ms ve P2D = 0 ms seçin.
- Başlat DizisineBasın. Bu durum, denemeler tamamlanana kadar kalır.
NOT: Darbeli yazılım (Prizmatix Pulser) video izleme yazılımı önce başlatılmalıdır; aksi takdirde video izleme yazılımı aygıtı tanıyamaz.
- Video izleme yazılımı (örn. Ethovision XT)
- Önceden tanımlanmış bir şablondan yeni bir deneme oluşturun.
- Yazılımı açın, Dosya'yagidin , Şablon'dan Yeni'yiseçin. Önceden tanımlanmış bir şablon uygula'yıseçin.
- Canlı izleme yi seçin ve Kaynak'a basarak kamerayı seçin ve bağlı Basler GenICam'i onaylayın.
NOT: Kameranın canlı görüntüsü artık sağ üstteki pencerede görüntülenir. - İleri tuşuna basın ve kaydedilmesi gereken hayvanı seçin(Kemirgenler, Fare).
- İleri tuşuna basın ve arena şablonu Open Field, kareseçin. Bölge şablon merkezi, Kenarlık, Köşeler'i seçin ve İleriile onaylayın.
- İleriile izlenmesi gereken 1 konuyu onaylayın.
- Merkez noktası, burun noktası ve kuyruk tabanını seçin ve Arka planla karşılaştırıldığında hayvan rengini Nextile daha koyu olarak onaylayın.
- Önerilen 12,5 numune oranını Next ile onaylayın ve adımı bitirin.
- Denemeyi uygun adlayın ve kaydetmek için bir konum seçin.
- Deneysel ayarları tanımlayın.
- Kurulum ve Deneysel Ayarlar'agidin. İzlenen özellikler olarak Merkez noktası, burun noktası ve kuyruk taban algılama'yı seçin.
- Deneme Denetimi Donanımı Kullanımı'nı seçin ve Ayarlar'agidin.
- Noldus USB-IO kutusunu seçin ve Okile onaylayın.
- Darbeli aygıta bağlanan TTL Bağlantı Noktasında Aygıt Türü olarak Özel Donanım'ı seçin ve Okile onaylayın.
- Arena ayarlarını tanımlayın.
- Arena Ayarları'na gidin ve Arena Ayarları 1'iseçin.
NOT: Kamera artık otomatik olarak bir arka plan görüntüsü açacaktır. - Görüntüyü Grabile onaylayın.
- Önceden tanımlanmış bölgeleri boyutlarını değiştirerek gerçek arenaya uyarla. Ok ve sağdaki iki sembol kullanın. Bazı bölgeler gereksizse, bunları silin.
- 1 tuşuna basın. Kalibre etmek için Ölçek çizin ve labirentin bir köşesinden diğerine bir çizgi çekin. Cm gerçek mesafe uzunluğu girin.
- Bunu diğer eksen için tekrarlayın.
- Arena Ayarları'na gidin ve Arena Ayarları 1'iseçin.
- Işık stimülasyonunun çalışıp çalışmayolmadığını test edin.
- Arena' ya gidin - Donanım Haritalama ve gri çubuktaki Test'i seçin.
- Komut Çıktısı 1 Yüksek'i seçin ve Testtuşuna basın.
NOT: Optik fiberin ucundan ışık yayan olmalıdır. Çıkış 1 Düşük ve Testseçerken, uyarım durmalıdır.
- Deneme denetimi ayarlarını 20 dakikalık deneme için tanımlayın. Off1, On1, Off2 ve On2 denemelerini her biri 5 dakika uzunluğunda olacak şekilde ayarlayın.
- Deneme Denetimi Ayarı'na gidin ve Izleme süresini 30 dakikaseçin.
- Ayarlar'ı seçerek Koşul: Zamanı 20 dakikaya ayarlayarak ana kuralı hazırlayın ve 30-20 dakikayı değiştirin. Tamamile onaylayın.
NOT: Başlangıç parçasının koşulu, denek 2 saniye boyunca arenada ykenolmalıdır. Bu şekilde, fare arenadayken sistem otomatik olarak izlemeye başlar. - Işık stimülasyonu için bir alt kural oluşturun: Yapılaragit, daha fazla ve Alt kuralıseçin.
- Işık stimülasyon protokolügibi bir isim verin.
- Ana kuralın altına yerleştirin ve fare courser ile mavi alanı seçerek iki kutu yayıldı.
- Koşullargit , Zaman ve 1 ışıkgibi bir isim vermek .
- Durumu Ayarla 5 dakika sonra karşılanır. Tamamile onaylayın.
- Kutuyu siyah çizgiye çekerek alt kuralın Kural Başlangıç kutusunun hemen arkasına yerleştirin.
- Eyleme Git | Özel Donanım ve adı: ışık ON 1.
- Çıkış 1 Yüksek olarak gerçekleştirmek ve Okile onaylamak için Eylem'i seçin.
- Kutuyu koşul kutusunun tam arkasına yerleştirin.
NOT: Deneyden 5 dakika sonra ışık stimülasyonu başlamalıdır. - 5 dakika sonra zaman koşulunu tanımlamak için adımları ve eylem Çıktı 1 Düşük başka bir 5 dakika sonra ışık stimülasyonu durdurmak için tekrarlayın.
- Başka bir ışık Kapalı ve Hafif Deneme programlamak için adımları tekrarlayın.
- Yapılara Git | Alt kural başvuru ve başvuru doğru alt kurala ait olup olmadığını denetleyin.
- Başlangıç koşulu başına bir kez Yürütülürgibi Gecikmesiz olarak Başlat koşullarını seçin. Tamamile onaylayın.
- Başvuru kutusunu ana kuralın eylem kutusu 1 ve koşul kutusu 2 arasına yerleştirin ve Action'dan bir çizgi çizin - Başvuru'ya parçayı başlatın.
NOT: Şimdi ana kural parçayı başladıktan sonra doğrudan alt kuralı başlatır.
- Sisteme izlemesi gerekenleri göstermek için algılama ayarlarını tanımlayın.
- Algılama ayarlarına gidin ve Algılama ayarlarını seçin 1.
- Arenaya bir test faresi yerleştirin ve Otomatik Kurulum'useçin.
- Hayvan türü olarak Kemirgen seçin ve arenada fare etrafında bir kutu çizmek için fare lanetleyici kullanın. Sonuçları Onaylayın Tamam? Yes
- İzlenmesi gereken tüm deneysel hayvanlar için deneme listesini tanımlayın.
- Deneme Listesi'ne gidin ve bugün kaydetmek için tüm hayvanları planlayın: Deneme eklemeyi seçin ve bir sayı seçin.
- Her fare için daha önce tanımlanan tüm koşulları seçin.
- Daha sonra analizi basitleştirmek için Animal-ID ve Tedavi'yi doğru adlandırın.
NOT: Animal-ID sistem için önemsizdir ve yalnızca deneyci tarafından daha sonraki veri analizleri için önemlidir. Tedavi ve Kontrol grubunda gruplandırma, sistemin nasıl gruplaşacağını ve daha sonraki analiz adımlarında tüm parçaların nasıl karşılaştırılabildiğini bilmesi için önemlidir.
- Edinme'ye gidin ve deneyle başlayın.
- Önceden tanımlanmış bir şablondan yeni bir deneme oluşturun.
4. Açık Alan deneyi (anksiyete)
- Uygun bir anksiyete düzeyini sağlamak için deneyden hemen önce deney fareyi davranış odasına getirin.
NOT: Davranışsal deneyler fareler uyanıkken karanlık evrede ve karşılaştırılabilirliği sağlamak için her zaman aynı zaman diliminde yapılmalıdır. - Kafesin ızgara üzerine hafifçe basarak ışık kaynağına bir kol ile çift fare.
- Işık kablosuna alışmak için 10 dakika boyunca taze çöplü bir bekleme kafesine yerleştirin.
- Video izleme yazılımındaki (örneğin, Ethovision XT) Başlat düğmesine basarak satın almaya başlayın.
- Fareyi bekleme kafesinden açık alanın sol üst köşesine aktarın. Fare yerine bir kolu izlememek için kolu 2 saniye içinde çıkarın.
- Deneme sırasında farenin görsel alanını bırakın ve sakin olun.
- 20 dakika sonra, deneme bittiğinde, fareyi labirentten çıkarın, ışık kablosunu çıkarın ve ev kafesine geri koyun.
- Fareyi tesise geri getirin.
5. Barnes Maze (öğrenme)
- Deneyden yaklaşık 1 saat önce tüm deneysel fareleri davranış odasına getirin.
- Altında bir kaçış kutusu yerleştirilir biri hariç tüm delikleri kapatarak Barnes Labirent hazırlayın. Farenin başlangıç alanı olan platformun ortasına bir karton duvar yerleştirin.
- Her iki implanttaki ışık kaynağına (ışık kablosu üzerindeki kol) bir farebağlayın.
- Fareyi doğrudan Barnes Maze'nin ortasına karton duvara yerleştirin, bu da farenin deneme başlamadan önce etrafta dolaşmasını önler.
- Video izleme yazılımında Başlat'a (örneğin, Ethovision XT) basın ve kartonu çıkarın.
NOT: Yazılım, doğru deliğe ulaşılAna kadar fareyi izler, ancak yazılımın delik geçişini tanımaması durumunda denemeyi el ile durdurmaya hazır olun. - Fareyi labirentten çıkarın ve ışık kablosuna olan bağlantıyı çıkarın.
NOT: Bu, fare başına birkaç denemenin olduğu bir eğitim günüyse, bir sonraki eğitim oturumu başlayana kadar fareyi davranış odasının yanındaki bekleme odasında bırakın. Bu, fare başına yalnızca bir test denemesi olan test günüyse, fareyi tesise geri getirin.
6. Veri analizi (Örnek Açık Alan verileri ile 4 ayırt edilebilir denemeler)
- Video izleme yazılımı (örn. Ethovision XT)
- Veri profilindeki deney gruplarını ve deneylerini tanımlayın.
- Soldaki Veri Profilleri'ne gidin ve Treated vs. Control'useçin.
- Orta solda yeni pencerede Yuvalama'ya gidin ve Deneme denetimi durumunuseçin.
- Öğe Eylemi'nden durum aralığını seçin: Öğe Eylemine İzleme'yi başlatın: ışık 1'e gider.
- Yuvalama kutusunu Filtre kutusu Tedavisi ile ilgili sonuç kutusu arasına yerleştirin.
NOT: Bu tanımlanan aralık, ışığın uyarılmasının olmadığı deneyin ilk 2,5 dakikasını açıklayan Off1'dir. - On1 aralıkları için adımları tekrarlayın (eylem öğesinden: ışık 1'den eyleme gider: ışık söner 1), Off2 (Eylem öğesinden: ışık 1'den eleman ışığına gider 2)ve On2 (Eylem öğesinden: ışık 2'yi elemana gider Eylem: dur parça).
- Kontrol filtresi grubu için 4 aralığı tekrarlayın.
NOT: Her iç içe geçme kutusunun Off1, On1, Off2, On2 adlarını içeren kendi sonuç kutusuna ihtiyacı vardır. Şimdi hem tedavi hem de kontrol grubu ayrı ayrı analiz edilen 4 farklı ışık stimülasyon denemesine ayrılmıştır.
- Analiz profilinde çözümlemek için parametreleri tanımlayın.
- Soldaki Çözümleme Profilleri'ne gidin ve Bölgelerde'yiseçin.
- Bölgede Bağımlı Değişken'i seçin ve bölge olarak Merkez'i seçin.
- In center'a çift tıklayın ve seçilen noktalardan herhangi birini seçin ve yalnızca merkezdeseçin.
- Pencereden ayrılmadan önce Deneme İstatistikleri'ne gidin ve önce Sıklık, Kümülatif süre ve Gecikme Süresi'niseçin.
- Taşınan Bağımlı Değişken Mesafe'yiekleyin.
NOT: Grup İstatistiklerinde,standart hatayı mı yoksa standart sapmayı hata olarak mı kullanacağınızı seçin. Bu profille, merkezde harcanan Zaman, Merkez girişleri ve taşınan toplam mesafe için veriler kullanılabilir.
- Veri ayıklama
- Sonuçlara gidin ve İstatistikler ve Grafiklerseçin.
- Analiz Calculate edilen verileri görmek için Hesapla'ya basın.
NOT: Deneme istatistikleri her fare hakkında bilgi verir ve grup istatistikleri, ilgili çubuk çizimi ile 4 denemeye bölünmüş, her iki grup için ortalama ve hata analiz eder. - Dışa Aktar verilerine basın ve deneme istatistiklerini ve kaydedilen konumu seçin.
NOT: Dışa aktarılan veriler excel dosyası olarak ve her fare için tek tek değerlerle kaydedilir. Bu Excel dosyasında Hayvan Kimliği fareleri tanımlamaya yardımcı olur. - Heatmap Visualization gidin ve Arsa Heatmapsbasın.
- Her fare ve deneme için tek tek ısı haritalarını görmek için sağdaki Denemeler'i seçin.
- Fareye sağ tıklayın ve ısı haritalarını görüntü olarak dışa aktarın.
- Veri profilindeki deney gruplarını ve deneylerini tanımlayın.
- Çizim
- Elektronik tablo dosyasını bilgisayarda açın ve ölçülen her koşul ve gruptaki 4 denemenin tümü için araç ve standart hataları (SEM) hesaplayın.
- Bir istatistik programında (örneğin, Sigma Çizimi) grafikler oluşturun.
- Aracı ve SEM'i elektronik tablo dosyasından Sigma Plot'a doğru sıraya kopyalayın. Satırlar Off1, On1 vb. verileri içermelidir ve sütunlar baş olarak deneme, ortalama ve SEM içerir.
- Üç sütunun hepsini seçin ve Grafik Oluştur'agidin.
- Çubuk kutusunu seçin ve gruplandırılmamış çubukları yanlışlıkla (üst sıra, üçüncü kutu) seçin.
- Yeni bir grafik sayfası açmak için Finish ile onaylayın.
- Grafiğin tamamını etiketleyin, ardından Ana Sayfa'yagidin, soldaki Grafik kutusunu seçin ve DışaAktar'a basın. Bir hedef klasör seçin ve biçim olarak MetaFile'yı (*.wmf) seçin.
NOT: .wmf biçimi daha sonra CorelDraw gibi bir grafik yazılımında işlenebilir.
- Elde edilen veriler için istatistikleri hesaplayın.
- Elektronik tablodaki ham verileri (Off1, On1 vb.) Sigma Plot'ın tek sütunlarına kopyalayın.
- Karşılaştırmak ve Çözümleme'yegitmek için sütunları işaretleyin, t-test'i seçin ve Çalıştır'abasın.
- Veri biçimini Raw ile Next ile onaylayın ve testi Finishile çalıştırın.
Sonuçlar
Bu protokolün amacı, bir optogenetik deney sırasında genetiği değiştirilmiş farelerin davranışlarındaki değişiklikleri ölçmektir. Optogenetik manipülasyon bir adeno ilişkili viral vektör enjeksiyonu ile yapılır. Serbestçe hareket eden farelerde ışık stimülasyonu, ilgi alanının hemen üzerinde bir ışık lifi implantasyonu ile mümkündür.
Şekil 4'teoptogenetik deneyin sonuçları sunulmuştur. ChR2 ile IL bölgesinde uyarıcı piramidal nöronların güçlü bir aktivasyonu Açık Alanda anksiyete ile ilgili davranış arttı. ChR2 piramidal nöronlarda ekspresyon için Nex-Cre farelerde mPFC IL bölgesinde enjekte edildi(Şekil 4A). İki anksiyete testi sırasında, Açık Alan(Şekil 4B,C)ve Yenilik-Bastırılmış Beslenme testi (Şekil 4F,G), ChR2 mavi ışık ile uyarılır ve piramidal nöronları aktive eder. Kontrol olarak, farelerin başka bir grup ChR2 yerine florofor tdTomato bir enjeksiyon aldı(Şekil 4D,G). Böyle bir deneyde, anksiyete parlak merkezi alankaçınma olarak tanımlanır. Fareler, yırtıcılardan endişe ettikleri için açık alanlardan içsel bir kaçınma gösterirler.
Şekil 4B'degösterilen Açık Alan deneyinde, fareler her biri 5 dakikalık 4 deneme gerçekleştirmiştir. 1 ve 3 numaralı çalışmalarda ışık stimülasyonu (Off1,2) ve 2 ve 4 numaralı çalışmalarda, 20 Hz (5 ms ışık darbesi) ve 1 mW yoğunlukta mavi ışık stimülasyonu yapıldı (On1,2). Isı haritaları, deney grubunda, merkez süresinin Off ve On denemeleri arasında farklılık gösterdiğini göstermektedir. Işık stimülasyonu sırasında, fareler tercihen sınır bölgesinde kalırlar. Kontrol hayvanları da sınırı tercih ederler, ancak ışık uyarımı üzerine davranışlarını değiştirmezler. Şekil 4C'de,Açık Alan deneyi sırasındaki ana davranış ölçümleri deney grubu için gösterilmiştir. Veriler normallik için Shapiro-Wilk testini geçtiyse, istatistikler bağımsız iki kuyruklu t-testi ile yapılmıştır. Normallik testi başarısız olduysa, Mann-Whitney-Rank Sum testi parametrik olmayan alternatif olarak kullanılmıştır. Bu tür deneyler için, ışık stimülasyonunun zaman içinde anksiyete davranışını doğrudan değiştirip değiştirip değiştiremeyebileceğini araştırmak için, deneysel ve kontrol hayvanlarının temel kaygılarından bağımsız olarak grup karşılaştırması seçilmiştir. Merkezi süresi önemli ölçüde her iki ışık stimülasyon denemeleri sırasında azaldı, artan anksiyete düzeyleri gösteren. Taşınan toplam mesafe değiştirilmeerek lokomotor davranışın etkilenmediğini gösterdi. Merkez girişlerinin sayısı önemli olmasa da artırıldı. Şekil 4D'dekontrol grubunun verileri gösterilmiştir. Kontrol hayvanları, analiz edilen parametrelerin hiçbirinde Off ve On denemeleri arasında herhangi bir davranış değişikliği göstermemiş, ışık stimülasyonu nun veya implantasyonun gözlenen etkilere neden olmadığını göstermektedir. Özetle, Bu test ChR2 ile IL piramidal nöronların ışık stimülasyonu sırasında artan anksiyete gösterir.
Şekil5'te, Başarısız bir optogenetik deneyin verileri Yükseltilmiş Artı Labirentiçin gösterilmiştir. Şekil 5A'dasunulan Yükseltilmiş Artı Labirent deneyi sırasında fareler her biri 3 dakikalık 6 denemeyi tamamladılar. 1, 3 ve 5 numaralı çalışmalarda ışık stimülasyonu yapılmadı (Off1, Off2, Off3) ve 2, 4 ve 6 numaralı çalışmalarda, 20 Hz (5 ms ışık darbesi) ve 1 mW yoğunlukta mavi ışık stimülasyonu yapıldı (On1, On2, On3). Bu örnek sonuçlarda, optogenetik protokolün uzunluğu ve labirentin kendisi yapımı transgenik fare hattı için uygun değildi. Şekil 5B'de,birkaç farenin arka pençeleriyle labirentten kaydığı, hatta düştüğü görülebilir. Bu olduğunda, fareler bir gün sonra EPM gerçekleştirmek için ikinci bir şans var. Eğer tekrar düştülerse, analizden çıkarıldılar. Fareler birkaç kez kayıp ama labirentte kalmayı başardığında, veriler normal analiz edildi. Yine de, veriler çok dikkatli yorumlanmalıdır ve kontrol hayvanları daha fazla önem kazanır. Nex-Cre farelerdar açık kollarda kalmak için motor zorluklar yaşadı. Bunu önlemek için, küçük duvarlar, 1 cm yüksekliğinde, labirentin kollarında arka pençeleri güvenli bir tutun için yardımcı olurdu. Hem ısı haritaları hem de grafikler deneysel ve kontrol fareleri, deneme 2 (On1) açık kollar önlemek için başladı göstermektedir (Şekil 5C-E). Açık kollarda zaman önemli ölçüde her iki grup için azalır, açık kol girişleri gibi. Deney grubunun analizi, On1 denemesi sırasında açık kol ve açık kol girişlerinde zaman önemli ölçüde azaldığından, sadece ışık stimülasyonunun büyük bir anksiyojenik etkisini gösteren veriler elde etti. Ancak, bu verileri aynı davranışı gösteren kontrol grubuyla karşılaştırırken, gözlenen davranışın optogenetik uyarım tarafından değil, labirente alışma nedeniyle genel olarak açık kollardan kaçınılmasıyla ortaya çıktığı açıktır. Bu veriler, optogenetik stimülasyon un aracılık ettiği davranışsal etkiler ile olası davranışsal adaptasyon uyruklarını ayırt etmek için uygun bir kontrol grubunun öneminivurgulamaktadır. Ayrıca, bu veriler, belirli bir mus hattı ve deneysel soru uygun bir deneysel kurulum düzgün adapte önemine ışık tutuyor.
Toplanan davranışsal verileri doğrulamak ve güçlendirmek için, farelerin beyinleri doğru enjeksiyon ve implantasyon için kontrol etmek için son deneyden sonra çıkarılır(Şekil 6). Beyinler %4 paraformaldehitle sabitlenir ve kafatasından çıkarılır. Beyinler 1-2 gün boyunca %30 sakarozda susuz kalır ve daha sonra kriyodilimlenir. 40 μm kalınlığındaki koronal beyin dilimleri yıkanır ve hücre çekirdeklerini lekeler DAPI içeren bir montaj ortamı ile superfrost nesnel slaytlar üzerine monte edilir. Bu, koronal dilimlerde hedef alanların belirlenmesini sağlar. YFP-tag veya tdTomato kendisi floresan virüs enjeksiyonyerini gösterir. Şekil 6B'de solda ChR2-YFP ve sağda tdTomato (kırmızı) örnek enjeksiyon bölgeleri sunulmuştur. Paxinos ve Franklin45 fare beyin atlasından uyarlanan bir şablon yardımıyla IL bölgesi tanımlanabilir. Her iki slaytta da optogenetik araç IL bölgesinde değil, komşu beyin bölgelerinde de ifade edilir. Doğru bir yorum için, beyin dokusunda mavi ışığınyayılmasına 8 danışılır (Şekil 1D,E). Mavi ışığın IL'nin altındaki DP bölgesine fiber uçtaki ilk 1 mW ışık yoğunluğunun sadece %5'inden daha az (Şekil 1D'dekiMaviçizgi)8 ile ulaşacağı görülmektedir. Ayrıca, hafif miktarda ışık geri saçılma nedeniyle PrL bölgeye yukarı gidebilir47. Sonuç olarak, IL bölgesinin en güçlü şekilde aydınlatılmış olduğu, ancak DP ve PrL bölgesi gibi komşu bölgelerin de biraz uyarılabileceği söylenebilir. Bu nedenle, IL-hücre spesifik stimülasyon garanti edilmez ve komşu bölgelerin immünohistokimyasal analizi yapılmalıdır, PrL ve DP hücrelerinin aktivitesi ışık yoluyla modüle olup olmadığını görmek için. Şekil 6C'de,başka bir önemli denetim gösterilir: Nex-Cre fare çizgisinin özgüllüğü. IL bölgesinde iki hücre tipleri karşı antikor boyama yoluyla, glutamaterjik ilke nöronlar ve GABAerjik internöronlar, bu görülebilir, ChR2-YFP ekspresyonu sadece glutamaterjik nöronlarda değil, GABAerjik olanlar oluşur.
Sonuç olarak, deneylerimiz davranış saldirisi sırasında optogenetik manipülasyonla anksiyeteye bağlı davranislarda degisiklikler inebilecegini göstermektedir. Aynı davranış için birden fazla test kullanılarak, güvenilir bir sonuç çizilebilir. Buna ek olarak, immünohistokimyasal analiz elde edilen verileri doğrular. Deneylerimiz, infralimbik korteksteki piramidal nöronların spesifik aktivasyonunun bazı tahlillerde anksiyeteye bağlı davranışları artırdığını gösteriyor.
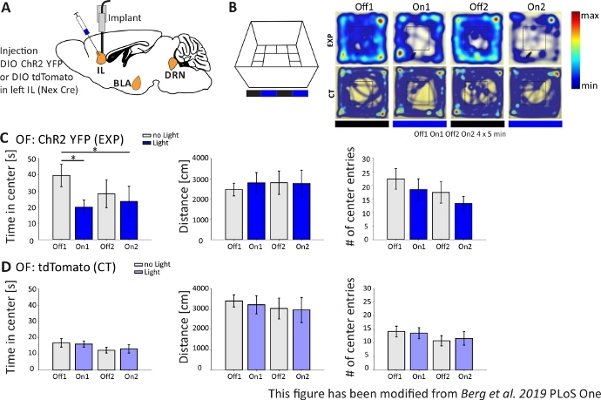
Şekil 4: IL piramidal nöronların optogenetik aktivasyonu anksiyete davranışını artırır. Deneyler sırasında ışık stimülasyonu: 473 nm, 1 mW, 20 Hz stimülasyon. A)ChR2-YFP veya tdTomato için enjeksiyon ve implantasyon bölgesinin IL'ye şematik çizimi. Deney sırasında, mPFC IL bölgesinde piramidal nöronlar ChR2 tarafından aktive edilir. Paxinos ve Franklin fare beyin atlası uyarlanmış Saggital beyin dilimleri, saggital: lateral o,6. B) Açık Alan labirent ışık stimülasyon protokolü ile (20 dk ile 4x5 dk kapalı ve denemeler de alternatif; sol) ve örnek ChR2 enjekte (EXP) ve tdTomato enjekte (CT) deneme (sağ) tüm 4 denemede ısı haritaları. EXP hayvanlar mavi lazer ışığı ile uyarıldığında OF merkezinde daha az zaman harcamak. CT hayvanlar için, merkezinde harcanan zaman ışık Kapalı ve On denemeler arasında farklılık göstermez. C) EXP hayvanlar için grup verileri OF, n=11. Fareler mavi ışık (Off1 39,49±6,9 s, On1 11,87±4,47 s, Off2 28,13±8,55 s, On2 23,42±9,32 s, Off1:On1, t-test, p = 0,033, *; Kapalı1:On2, MWRS, p=0,049, *). Taşınan mesafe etkilenmez (Off1 2703.09±292.65 cm, On1 3113.4±491.15 cm, Off2 3331.86 ±482.62 cm, On2 3082.17±658,61 cm). # merkezi girişleri zamanla azalır, ancak önemli bir fark göstermez (Kapalı 1 22,36±3,78, On1 18,45±3,95, Off2 17,36±1,99, On2 13,27±2,64). D) OF'deki CT hayvanlar için grup verileri, n=15. Zaman fareler OF merkezinde harcamak, mesafe taşındı, # merkezi girişleri ışık On ve Off denemeler arasında değişmez (Zaman merkezoff116.73±2.65 s, On1 11.02±1.89 s, Off2 12.02±1.76 s, On2 13.04±2.58 s; Mesafe Off1 3399.69±296.77 cm, On1 3210.6±446.9 cm, Off2 3030.28±513.83 cm, On2 2955±617.7 cm; # merkezi girişleri Off1 14±1,98, On1 13±6±2,02, Off2 10,8±1,88, On2 11,67±2,5). BT farelerde önemli ölçüde daha yüksek temel anksiyete (Off1 EXP:CT, MWRS, p=0.005, **). Değerler ortalamadır±S.E.M. * önemli farklılıkları gösterir (p≤0.05), ** önemli farklılıkları gösterir (p≤0.01). t-test her zaman iki kuyruklu, MWRS: Mann-Whitney Rank Sum testi; IL: infralimbic korteks; BLA: basolateral amigdala; DRN: dorsal raphe çekirdekleri; OF: Açık Alan; CT: kontrol hayvanları; EXP: deneysel hayvan; L: ışık. Bu rakam Berg ve ark. 2019, PLoS One43 ve Berg 201948'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
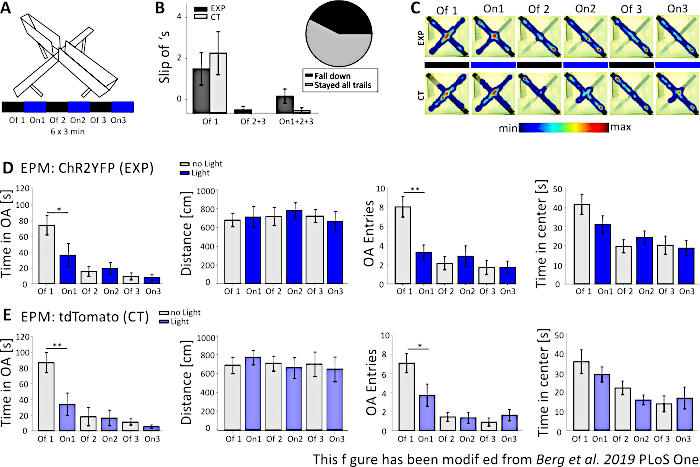
Şekil 5: EPM deneyi Nex-Cre farelerde davranışsal etkiler gösteremedi. Deneyler sırasında ışık stimülasyonu: 473 nm, 1 mW, 20 Hz stimülasyon. A) Yüksek-Artı Maze ışık stimülasyon protokolü ile (18 dk, 6x3 dk, kapalı ve denemeler üzerinde alternatif). B) Farelerin "kayma" verilerini, toplam n=23'ü veriye dahil eden grup verileri. Nex-Cre fareler, deneysel gruptan bağımsız olarak arka pençeleriyle açık koldan kayma eğilimine sahiptiler (solda). Daha sonraki analizlerde sadece 6 denemede de labirentte kalan fareler ele alındı. Slip off ilk Off1 aşamasında açık kollar (Off1 EXP 1.63±0.6, CT 2.2±0.79, Off2+3 EXP 0.125±0.125, CT 0±0, On1+2+3 EXP 0.625±0.26, CT 0.1±0.1) kaçınma nedenidir. Pasta grafiği (sağda) farelerin 18 dakika boyunca %42,42 ile labirentten düştüğünü gösterir. Sadece %57,57'si deneyi tamamladı. C)Deneyin 6 denemesinde örnek EXP ve CT farelerin ısı haritaları. Her iki grup da Off1 denemesinden sonra açık kol süresinde bir azalma gösterir. D) EPM'deki EXP hayvanları için grup verileri, n=12. Açık kollarda geçirilen süre ilk iki denemede ve sonrasında sürekli olarak önemli ölçüde azaldı (Off1 73.91±12.22 s, On1 36.15±14.65 s, Off2 15.61±6.23 s, On2 19.49±7.51 s, Off3 9.36±4.44 s, On3 7.96±3.47 s. Off1:On1, t-test, p=0,041, *). Taşınan mesafe etkilenmez (Off1 679,96±71,63 cm, On1 712,24±112,82 cm, Off2 717,49±97,39 cm, On2 782,51±81,11 cm, Off3 722,11±68,60 cm, On3 663,9±010cm,57 cm). Açık kol girişlerinin miktarı Off1'den On1'e önemli ölçüde düşer ve sabit kalır (Off1 8.08±1.08, On1 3.33±0.76, Off2 2.16±0.69, On2 2.91±1.09, Off3 1.73±0.75, On3 1.73±0,66. Kapalı1:On1, t-testi, p=0.002, **). EPM'nin merkezinde geçirilen süre denemeler boyunca azalır ancak Off'tan Deneme Sürümüne kadar anlamlı bir fark göstermez (Off1 41.71±5.34 s, On1 31.2±4.59 s, Off2 19.8±3.44 s, On2 24.49±3.38 s, Off3 20.37±4.77 s, On3 18.85± s± 07. E) EPM'deki CT hayvanlar için grup verileri, n=11. BT verileri EXP verileriyle aynı önemli düşüşleri gösterir ve denemenin düzgün çalışmadığını gösterir (Açık kollarda süre Off1 86.92±12.74 s, On1 33.78±14.38 s, Off2 18.01±111.61 s, On2 16.41±9.61 s, Off3 11.36±4.01 s, On3 5.43±2.07 s. Off1:On1, MWRS, p=0.009, **; Mesafe Off1 705.11±888.36 cm, On1 789.45±7777.53 cm, Off2 724.74±80.49 cm, On2 676.57±1111.99 cm, Off3 716.99±132.47 cm, On3 663.03±132.cm; Açık kol girişleri Off1 7.09±1, On1 3.72±1.17, Off2 1.45±0.47, On2 1.36±0.58, Off3 0.91±0.43, Off3 1.64±0.59. Kapalı1:On1, MWRS, p=0.01, *; Merkezde zaman harcaması Off1 35,89 s, On1 29,25±3,96 s, Off2 22,17±3,58 s, On2 15,9±2,57 s, Off3 13,86±4,2 s, On3 16,89±5,75 s). Değerler s.e.m. * ± anlamlı farklar (p≤0.05), ** önemli farkları (p≤0.01) gösterir. t-testi her zaman iki kuyruklu, MWRS: Mann-Whitney Rank Sum testi; EPM: Yükseltilmiş-Plus Labirent; CT: kontrol hayvanları; EXP: deneysel hayvan; OA: açık kollar. Bu rakam Berg ve ark. 2019, PLoS One43 ve Berg 201948'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
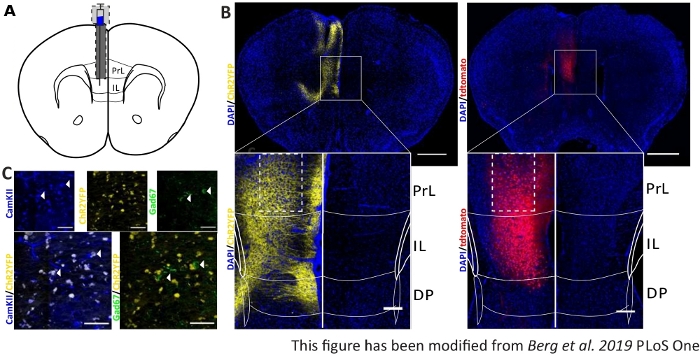
Şekil 6: IL ve Nex-Cre özgüllükch2 ve tdTomato enjeksiyon tarafı. A)Ap + 1.66 mm, mL 0.3 mm, DV -1.8 mm, tek taraflı enjeksiyon ve implantasyon (fare beyin atlası, Paxinos ve Franklin, Bregma +1.54 mm uyarlanmıştır) koronal beyin dilimleri üzerinde implantasyon sitenin şematik çizim. B) Nex-Cre farelerde DAPI lekeli hücre çekirdekleri (mavi) ile birleştirilmiş ChR2-YFP (sol, sarı) ve tdTomato (sağ, kırmızı) örnek enjeksiyon siteleri. Ölçek çubuğu 1 mm. Insets IL bölgenin yüksek büyütme gösterir. Ölçek çubuğu 150 μm. Beyaz kutular insets yerinigösterir. C) Üst satır: glutamaterjik nöronlar için bir belirteç olarak CamKII ile boyanmış bir Nex-Cre fare sol IL bölgenin konfokal görüntüleri (mavi), ve ChR2-YFP (sarı) veya Gad67 GABAerjik nöronlar için bir belirteç olarak (yeşil), Bir Nex-Cre fare. Alt satır: CamKII (sol, mavi) ile ChR2-YFP (sarı) colocalization, ama Gad67 ile değil (sağ, yeşil), glutamaterjik nöronlar için Nex-Cre farelerin özgüllük gösteren. Ölçek çubuğu 50 μm. PrL: prelimbik korteks; IL: infralimbic korteks; DP: dorsal pedunküler korteks. Bu rakam Berg ve ark. 2019, PLoS One43 ve Berg 201948'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Nöronal sinyalizasyon işlemek için ışık kullanarak yaklaşık on yıldır tercih edilen bir yöntem olmuştur. 2005 yılından bu yana, yeni optogenetik araçların geliştirilmesi ile ilgili yayınlanan makalelerin sayısı4,6,8,14,49,50,51 ve bu tür araçların beyin devreleri araştırmak için kullanılan çalışmalar21,23,40,43,52, yüksek artmıştır. Bir yandan, enjekte edilebilir optogenetik aletlerin muazzam çeşitliliği, implantasyon varyantları, transgenik fare çizgileri ve davranışsal deneyler, deneyler için olasılık manifoldu ve sınırsızdır. Öte yandan, deneysel koşulların seçiminde hata yapma olasılığı çok yüksektir ve deneyler o kadar spesifiktir ki, genellikle diğer çalışmalarla karşılaştırılabilirlik zordur.
Kritik adımlar
Bu protokolün önemli bir kritik adımı doğru planlamadır. Optogenetik aracın seçimi bilimsel soruyla eşleşmelidir. Sadece bir nöron veya sinaps genel aktivitesini işlemek için gerekli mi? Sonra ticari ChR221,25,,27 ve Arch37 gibi araçlar sağlanan iyi bir seçimdir. Ama bunun dışında, eğer özel bir nörotransmitter sistemi ya da tek bir reseptör manipüle edilmelidir, bireysel bir reseptör chimera genellikle daha iyi birseçim3,6. GPCR ile çeşitli reseptör chimeras, sözde Opto-XRs denir, ve bunları üretmek için kurallar zaten mevcuttur4,50. Optogenetik araçların seçimi dışında, davranışsal deney ile birlikte fare hattı da önemlidir. Farklı arka plan suşları, örneğin C57Bl/6 ve BALB / cByJ gibi, bazı açılardan farklı davranışsal fenotipler görüntülemek53,54. C57Bl/6 farelerdüşük bazal anksiyeteye sahiptir ve anksiyojenik manipülasyon için kullanılabilirken, BALB/cByJ daha yüksek anksiyete düzeyleri gösterir ve bu nedenle anksiyolitik ilaçlara karşı daha duyarlıdır. Ayrıca, bu arka plan suşlarının transgenik varyantları da kendi fenotip48değişebilir. Optogenetik bir alet ve transgenik fare hattı ile birlikte spesifik organizatörlerin uygun bir kombinasyonu ile, hemen hemen her istenilen hücre popülasyonu hedeflenebilir.
Ameliyat sırasında kritik bir adım doğru yeri hedeflemektir. Fare beyin atlası yardımıyla, ön-posterior eksen için uygun koordinatlar, ve medial-lateral eksen, ve yapının derinliği45kurulabilir . Gerçekte, her kafatası biraz farklı bir form ve boyuta sahiptir. Bu nedenle, Stereotaktik koordinatları ayarlamak için F-faktör46 stereotaktik cerrahi sırasında doğru burun ve kulak fiksasyonu olduğu gibi oldukça önemlidir. Farenin başı eğikse, enjeksiyon kanulası istenilen ilgi bölgesini hedeflemede başarısız olur.
Ayrıca, enjeksiyon kanula çapı da önemlidir. Çok küçükse, dokuya virüs salınamaz, çok genişse, kanula virüs çözeltisi sızdıracaktır. İmplante edilen optik fiber hedef bölgenin hemen üzerinde sonlanırsa, yukarıdaki korteks bölgelerindeki virüs ifadesi önemli değildir. Ancak implant akson terminallerini uyarmak için diğer bölgelerin üzerine yerleştirilirse, üst korteks bölgelerinin aksonlarında ışıkla aktive edilecek ve elde edilen verileri tahrif edecektir. Örnek olarak: IL bölgesi ve prelimbic (PrL) bölge bazal amigdala hem proje55,56 ama anksiyete modülasyonu tamamen farklı işlevleri ve rolleri var26,57. İmplant IL bölgesinden akson terminallerini aktive etmek için amigdalanın üzerine yerleştirilirse ve enjeksiyon virüsü çözeltisi de yanlış enjeksiyon kanulası nedeniyle PrL'ye yerleştirilirse, PrL'den akson terminallerinin aktive edilme riski de çok yüksektir.
İmplantfiksasyon için kafatası hazırlanması sırasında, astar ve bağ seyrek kullanımı güvenilir ve dayanıklı bir fiksasyon için çok önemlidir. 2 bileşenli yapışma sistemi ince uygulanmazsa, diş çimentosu birkaç gün veya hafta sonra kafatasından kopabilir. Buna ek olarak, kafatası da tamamen implant sabitleme önce kurutulmalıdır, aksi takdirde çimento kafatası düzgün eklemek olmaz gibi.
Bu protokolün davranışsal kısmında da kritik adımlar vardır. İlk olarak, labirentin inşası çok önemlidir. Her davranışsal kurulumda, çeşitli varyantları literatürde boyut ve form ile ilgili olarak, hem de yordamın kendisi için58,59,60var . Verileri karşılaştırılabilir ve tekrarlanabilir kılan bir varyant seçmek önemlidir. Ayrıca, kullanılan fare hatları için özel gereksinimler dikkate alınmalıdır43,48. EPM'nin temsili verilerinde birkaç Nex-Cre faresinin labirentten düştüğü veya birkaç kez kaydığı görülebilir(Şekil 2b). Bu fareler için, açık kollar etrafında küçük bir duvar ile bir labirent daha iyi bir alternatif olurdu.
İkincisi, tüm dış oda koşulları sabit tutmak için önemlidir61, aksi takdirde farelerin farklı gruplar hiç karşılaştırılabilir olmaz. Bu bakımdan, deney düzeninin boş olduğu ve deneycinin her zaman mevcut olduğu bir zaman olarak deneme zamanını seçmek çok önemlidir. Ayrıca, elde edilen verilere müdahale edilmemesi için binadaki inşaat çalışmaları, herhangi bir sistemlerin test edilmesi (yangın alarmı) veya fare tesisinin temizleme günü gibi olaylar göz önünde bulundurulmalıdır.
Son olarak, kullanım ve barınma koşulları davranışsal deneyler için çok önemlidir. İmplantasyon yapıldığında, diğer farelerin yaralanma riski nedeniyle farelerin tek kişilik olması gerekir. Gruplar arasında iyi bir karşılaştırma ve bir grup içinde düşük hata sağlamak için, her fareaynı kafes boyutu ve zenginleştirme olması gerekir. Anksiyete ile ilgili deneyler için, tek konut singe ev erkek fareler olarak bazı avantajları vardır daha düşük bir temel anksiyete düzeyi göstermek, onların anksiyete düzeyinde daha az varyasyon, ve daha az depresif benzeri belirtiler15,16. Grup erkek fareler güçlü fareler arasındaki hiyerarşi nedeniyle anksiyete düzeyi farklı olabilir. Gövdenin yanı sıra, tüm fare ve grupların sürekli ve eşit şekilde kullanılması da önemlidir. İmplant üzerindeki ışık lifini bağlamak için fareyi kapmak çok streslidir. Bu nedenle, bu yordam her fare için aynı olması gerekir, aynı teknik ve aynı deneyci anlamına gelir. Ayrıca, stresli bağlantı prosedürü aşağı fare sakinleştirmek içindir bekleme kafesi, alışma süresi, aynı zamanda süre, çöp ve labirente pozisyon eşit koşullara sahip olması gerekir. Fare tesisi içinde işleme de daha sonraki davranışsal performans için önemlidir. Deneysel ve kontrol hayvanları farklı günlerde veya farklı insanlar tarafından temizlenmemelidir, bu da fareler için stresli olduğu için. Ayrıca, temizlik günü davranış farklılıklarını önlemek için deneysel gün olmamalıdır.
Sorun giderme
Protokol sırasında oluşabilecek çeşitli sorunlar vardır. Örneğin, stereotaktik cerrahi sırasında kafatasında bir bütün delme kan damarlarızarar verebilir. Genellikle, güçlü kanama oluşur, özellikle bregma ve lambda yukarıda. Bu durumda, onlar emicilik nedeniyle damar dışında daha fazla kanama uzatmak eğilimindedir gibi pamuk çubukları ile kanama durdurmaya çalışmayın, bunun yerine, doğrudan NaCl ile durulamak.
Ayrıca virüs çözeltisinin basınç enjeksiyonu çalışmıyor olabilir. Bu durumda, parafilm olabilir, çapak deliğinden veya beyin dokusundan bir yara, kanula nın ucunu tıkıyor. Bu durumda, x veya y-eksenini değiştirmeden kanula'yı yavaşça beynden çıkarın ve kanula ucunun ön kısmının 1-2 mm'sini çıkarmak için bir cızırtı kullanın. Tekrar kanula düşürmeden önce, virüs canula ucu çıkar olmadığını görmek için basınç küçük miktarda uygulayarak işlevsellik için test edin. Kabızlık önlemek için, sabit bir hız ile kanula düşürmek ve enjeksiyon tarafının en derin derinliğine ulaşılana kadar hareketi durdurmayın. Kanula ucuçok fazla kaldırılır ve çapı çok büyük ise, kanula doku zarar ve aynı anda virüs uygulama riski artacaktır. Böylece, ucun yalnızca tıkanmış kısmının dikkatlice çıkarıldığından emin olun.
Davranışsal deney sırasında, video izleme yazılımındaki (örneğin, Ethovision XT) deneyin kurulumu sorunlara neden olabilir. Örneğin, ışık çıkışı düzgün çalışmıyorsa, bunun nedeni çeşitli nedenlerden olabilir. Pulser, Ethovision XT açılmadan önce açılmalı, programlanmalıdır ve başlatılmalıdır. Donanımın "Deneysel kurulum" (adım 3.2.2.4) doğru şekilde seçilmesi gerekir. Yanlış IO-Box veya "Kostüm Donanımı" dışında bir şey seçilirse, Pulser cihazı Ethovision tarafından kontrol edilemez. Işık çıkışının testi başarılı olursa, ancak "Deneme denetimi ayarları"ndaki programlanmış ışık protokolü satın alma sırasında çalışmıyorsa, alt kural veya alt kural başvurusu yanlış bulunabilir veya koşullar ve eylemler belirsiz olabilir. Örneğin: başvuru doğru alt kurala mı ait? Başvuru doğru programlandı mı (örn. alt kural ne sıklıkta yürütülür)?
Ayrıca, bu "algılama ayarları" sırasında hayvan yeterince izlenir, ancak satın alma sırasında konu bulunamadı örnekleri vardır olabilir. Bu durumda, deney odasındaki aydınlatmanın değiştirilip değiştirilmediğini veya labirentin içinde istenmeyen gölgeler üretilip üretilmediğini kontrol edin. Labirentin tüm alt kısmı aynı renge sahip olmalı, çünkü ayar yalnızca belirli bir kombinasyon için çalışacaktır. Her ne sebeple olursa olsun farklı alt renkler veya gölgeler kaçınılamaz ise, labirentin en karanlık kısmında algılama ayarı tanımlayın.
İlk hayvanların edinimi nden sonra herhangi bir ayarı değiştirmek için, bu değişiklikleri zaten kullanılan ayarlarda uygulamayın. Ayarlamak için kopyalayın. Bu, zaten kaydedilmiş deneme veri çözümlemesi için artık geçerli olmadığı anlamına gelir. Böyle bir durumda, orijinal ayarları ile bu deneysel grup için tüm hayvanları kaydedin ve daha sonra kaydedilen videolar canlı izleme yerine analiz yeni bir deney oluşturun. Bu "videodan" denemesinde, hayvanlar ve hatta veriler arasındaki karşılaştırılabilirliği kaybetmeden analiz için çeşitli ayarlar kullanılabilir.
Sınırlamalar ve gelecekteki uygulamalar
Serbestçe hareket eden hayvanlarda optogenetik ile davranış manipüle Bu yöntem de sınırlamalar içerir. Ameliyat sırasında iki implantın yakınlığı kısıtlanır. Çift implantasyon için, iki implant arasındaki mesafe en az implanttutmak için cihazın genişliği olmalıdır. Cihaz, ilk implantlar zaten sabit iken, çapak deliğine ikinci implant ı düşürmeli. Bunun için bir çözüm açılı bir implantasyon olabilir, cam elyaf uçları çok yakın olabilir kafatası üzerinde seramik ferules daha büyük mesafe varken23,55,56,57,62,63. Açılı bir implantasyonun dezavantajı ışığın yayılmasıdır. Lif ucu düz yukarıdan yerine eğimli olduğunda, uyarılmış alan farklıdır. Yakın mesafede iki hedef bölge olması durumunda, ışık stimülasyonunun değişen konumu göz önünde bulundurulmalıdır.
Davranışsal deney sırasında, labirentin inşası hayvana bağlı optik kabloyu etkileyebilir. Açık-koyu kutu gibi bazı davranış testleri kapalı alan64,65ve diğer labirentler fare nin girmesi gereken bölmeleri içerir. Bu tür denemeler bu kurulumla gerçekleştirilemez. Alternatif olarak, kablosuz sistem bir seçenek22,,26,66olabilir. Ama neyse ki bazı labirentler, Barnes Maze gibi, böyle bir şekilde düzenlenebilir, fareler ilgili bölmeleri girmek edebiliyoruz67.
Kapalı bölgeleri olanların yanı sıra, çok geniş labirentler de sorunlara neden olabilir. Labirentin alanı ne kadar genişse, kablonun hayvanın labirentteki her pozisyona gitmesine izin vermek için o kadar uzun olması gerekir. Hayvanın kabloya basamaz, yakap ısıramaz. Bunun için bir çözüm gereksiz kablo yuvarlanır bir yapı olabilir. Bir dezavantajı kabloyu boşaltmak için sürükleme fareler için zor olmasıdır. Bu çözüm fareler için uygun daha iyi olur. Başka bir olası seçenek önceden ışık stimülasyon yapmak olabilir, deneme sırasında yerine, tabii ki bu sadece ışık stimülasyonu nedeniyle uzun vadeli bir etki oluşur seve si uygulanabilir23.
Mevcut/alternatif yöntemlerle karşılaştırma
Alternatif yöntemler davranış sırasında kimyasal veya elektriksel stimülasyon olacaktır8,18. Kimyasal agonistler veya antagonistler ivel reseptörler aracılığıyla nöronları etkinleştirmek veya susturmak edebiliyoruz ve aynı zamanda tek nörotransmitter sistemleri,38,68manipüle edebilirsiniz. Bir yandan, reseptör özgüllüğü kimyasallar için oldukça yüksektir, çünkü spesifik agonist veya antagonist sadece bazı reseptörleri etkinleştirmek39. Öte yandan, aynı nörotransmitter grubunun reseptör alt tipleri için özgüllük genellikle yetersizdir. Çoğu kimyasal farklı olasılıklar69ile en az iki alt tipe bağlanır. Ayrıca, kimyasallar aynı reseptör tiplerine sahip oldukları sürece nöronal hücre tiplerini ayırt edemezler. Bunun ötesinde, zamansal ve mekansal çözünürlük optogenetik göre kimyasal manipülasyonlar için kötüdür. Agonistler veya antagonistler genellikle sözlü olarak uygulanır35 veya sistemik enjeksiyonlar yoluyla57,70. Kimyasal infüzyon doğrudan beyin dokusunda yapılırsa, etkileri oral uygulamalar ile daha hızlı görünür, ama yine de ışık stimülasyonu ile daha yavaş bir zaman ölçeğinde. Uygulanan kimyasallar beyinde yaygın ve nöronal türleri veya beyin bölgeleri için özel değildir gibi, belirli beyin devrelerinin manipülasyon mümkün değildir.
Elektriksel stimülasyon, kimyasal stimülasyondan daha yüksek bir zamansal çözünürlüğe sahiptir9,14. Nöronal doku içinde yayılması kimyasal stimülasyon ile daha az dır ve mekansal çözünürlük kimyasal stimülasyon ile daha iyidir. Ancak, elektrikstimülasyon özellikle farklı nöronal hücre tipleri veya reseptör tipleri ele olasılığı yoksun, elektrot yakın her nöron elektriksel uyarılma yanıt verecektir gibi.
Serbestçe hareket eden farelerde davranışa alternatif yöntemler, örneğin tek nöronların veya aksonların optogenetik ile modüle edilebildiği ve ortaya çıkarılan etkilerin kayıt elektrotları6,71ile ölçülebildiği beyin dilimlerindeki elektrofizyolojik kayıtlardır. In vitro deneyler optogenetik stimülasyonların moleküler ve hücresel temelini araştırma olanağı sunar, ancak diğer beyin bölgelerinden gelen içsel bağlantı ve girdinin eksik olduğu sınırlamasına sahiptir. Başka bir seçenek multifotongörüntüleme,1 ,72ile birlikte optogenetik kullanmaktır. Bu durumda, farelerin başsabit ve anestezi veya basit görevleri çözmek için uyanık olabilir.
Başarılı bir optogenetik deney gerçekleştirmek için, araç ve uygulamalar geniş bir yelpazede günümüzde mevcuttur. Optogenetik araçların seçimi ve davranışsal kurulum belirli araştırma sorularını yanıtlamak için çok önemlidir. Eğer aletlerin ve deneylerin doğru kombinasyonu seçilirse, optogenetik yüksek zamansal ve uzamsal çözünürlüğe sahip nöronal devrelerin daha önce görülmemiş, derinlemesine araştırılmasına olanak sağlar. Bu anlamak ve psikiyatrik hastalıklar ve biliş için yeni tedavi stratejileri geliştirmeye yardımcı olacaktır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Prof Klaus-Armin Narve ve Dr Sandra Goebbels (Max-Plank-Deneysel Tıp Enstitüsü, Goettingen, Almanya) nazik Nex-Cre fareler sağlamak için büyük teşekkür ederiz. Ayrıca, video ekibimiz Yunus Dikici ve Ruben Wiesner'e bu makale için JoVE videosunun kaydedilmesi ve işlenmesi için teşekkür ederiz. Buna ek olarak, kristin Claussen onu seslendirme ve Kimberly Anne Go için el yazması redreading için büyük teşekkürler.
Sunulan sonuçlar Bochum'daki Ruhr-Üniversitesi'nde elde edildi ve video Bremen Üniversitesi'nde kaydedildi.
Bu çalışma Deutsche Forschungsgemeinschaft (DFG, Alman Araştırma Vakfı) - Projektnummer 122679504 - SFB 874 ve DFG MA 4692/3-2 tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ketamin | Sigma-Aldrich | K2753-64 | Anestasia |
| 20 % Glucose | AlleMan Pharma | Injection s.c. for fast recovery | |
| Behavioral mazes | Costum made | Measure anxiety | |
| Bepanthen | Bayer | Ophthalmic oinment | |
| Betaisodona | Monodipharma | Sterilant containing iodine | |
| Betaisodona | Monodipharma | Iodine oinment | |
| Binocular | Olympus | SZ52, 110AL0.62x WD160 | Surgery |
| Ceramic ferrules | Thorlabs | CFLC230-10 | Implant |
| Ceramic Fiber Scribe | Thorlabs | CSW12.5 | Cutting of the glass fiber |
| Channelrhodopsin2-YFP virus | Penn Vector Core | Addgene 20298 | Optogenetic tool |
| Compressed air | Kontakt Chemie | Druckluft 67 | Drying of the skull |
| Coordinate system | Stoelting | Stereotactic coordinates for the surgery | |
| Correl Draw | Graphical software version 13 | ||
| Cryoslicer | MICROM | HM500OM | Production of brain slices for staining |
| Ethovision XT 14 | Noldus | Software for behavioral tracking | |
| Exel | Statistical Software | ||
| Ferrule Polishing Puck | Thorlabs | D50-F | Polishing implants round side |
| Fiber Patch Cord dual | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cables, which are connected with the two implants of a bilateral implantation |
| Fiber Patch Cord single | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cable, which is connected with the implant via a sleeve |
| Fiber Stripping Tool | Thorlabs | T06S13 | Stripping glass fiber for implant |
| Filter paper | VWR European | 516-0300 | Cut into pieces for the Novelty-Suppressed Feeding test |
| Food pellets | Mühle Levers | Höveler Nagerfutter | Nutrition for the mice |
| Glass pipettes | Harvard Apparatus | GC150-10 | Injection pipettes |
| Gradia direct-Flo | Henry Schein | 103322 | Fluid dental cementum |
| Heating lamp | efbe-Schott/Phillips | R95E | Prevent the mice from cooling after the surgery |
| Heating plate | Stoelting | Integrated into coordinate system | |
| Injection canula | Braun | 100 Sterican, 0,4 x 20 mm, Gr. 20 | All injections and to bore hole into the skull |
| Litter | T 1350 | Grounding for the Novelty-Supressed Feeding test | |
| Mouse cages | Zoonlab | 405 cm^2 | Single housing for experiments |
| Optibond FL | Kerr | 26684E | Preparation of the skull for implantation |
| Optical glass fiber | Thorlabs | FT200EMT | Light fiber for implant |
| Optogenetics-LED.STSI | Prizmatix | Optogenetic toolbox for light stimulation during behavioral experiments | |
| Paraformaldehyde | Sigma-Aldrich | 16005-1KG-R | Perfusion of mice to remove the brains |
| Polishing sheet 0.02 µm grit | Thorlabs | LFCF | Polishing implants round side |
| Polishing sheet 1 µm grit | Thorlabs | LF1D | Polishing implants round side |
| Polishing sheet 30 µm grit | Thorlabs | LF30D | Polishing implants round side |
| Polishing sheet 6 µm grit | Thorlabs | LF6D | Polishing implants round side |
| Pulser Software | Prizmatix | Software for light device control | |
| Rimadyl-Carprofen | Zoetis | Analgesia | |
| Sigma Plot | Software for statistics | ||
| Sleeve | Thorlabs | FT200EMT | Connection of implant and light cable |
| SodiumCloride (NaCl) | Braun | 3570410 | Rinsing of the skull |
| Superglue | Pattex Henkel | To Fix the glass fiber in the ferrule | |
| td-Tomato virus | Penn Vector Core | Addgene 51503 | Optogenetic tool |
| UV light | KoQGHJ | wireless, 1200 mW/cm^2 | Polymeration lamp for dental cementum |
| Xylavet-Xylazin | cp pharma | Anesthesia |
Referanslar
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature Letters. 463, 98-102 (2010).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Spoida, K., Masseck, O. A., Deneris, E. S., Herlitze, S. Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. Proceedings of the National Academy of Science of the United States of America. 111, 6479-6484 (2014).
- Kleinlogel, S. Optogenetic user's guide to Opto-GPCRs modified GPCRs. Frontiers in Bioscience. 21, 794-805 (2016).
- Mahn, M., Prigge, M., Ron, S., Levy, R., Yizhar, O. Biophysical constraints of optogenetic inhibition at presynaptic terminals. Nature Neuroscience. 19, 554-556 (2016).
- Masseck, O. A., et al. Vertebrate Cone Opsins Enable Sustained and Highly Sensitive Rapid Control of Gi/o Signaling in Anxiety Circuitry. Neuron. 81, 1263-1273 (2014).
- Oh, E., Maejima, T., Liu, C., Deneris, E., Herlitze, S. Substitution of 5-HT 1A Receptor signaling by a light-activated G protein-coupled receptor. Journal of Biological Chemistry. 285, 30825-30836 (2010).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in Neural Systems. Neuron Primer. 71, 9-34 (2011).
- Masseck, O. A. A Guide to Optogenetic Applications, With special Focus on Behavioral and In Vivo Electrophysiological Experiments. HandboOk of In Vivo Neural Plasticity Techniques - A Systems Neuroscheince Approach to the Neural Basis of Memory and Cognition. Manahan-Vaughan, D. , Academic Press. 557(2019).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. , 611-621 (2006).
- Yang, Y. S., Hughes, T. E. Cre Stoplight: A red/green fluorescent reporter of Cre recombinase expression in living cells. Biotechniques. 31, 1036-1041 (2001).
- Schnütgen, F., et al. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 21, 562-565 (2003).
- Taniguchi, H., et al. A Resource of Cre Driver Lines for Genetic Targeting of GABAergic Neurons in Cerebral Cortex. Neuron. 71, 995-1013 (2011).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 268-273 (2011).
- Palanza, P., Gioiosa, L., Parmigiani, S. Social stress in mice: Gender differences and effects of estrous cycle and social dominance. Physiology and Behavior. 73, 411-420 (2001).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415, 197-201 (2001).
- Masseck, O. A., Rubelowski, J. M., Spoida, K., Herlitze, S. Light- and drug-activated G-protein-coupled receptors to control intracellular signalling. Experimental Physiology. 96, 51-56 (2011).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4, (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature Article. 446, 633-639 (2007).
- Owen, S. F., Liu, M. H., Kreitzer, A. C. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience. 22, 1061-1065 (2019).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nature Communication. 10, 1-12 (2019).
- Allsop, S. A., Vander Weele, C. M., Wichmann, R., Tye, K. M. Optogenetic insights on the relationship between anxiety-related behaviors and social deficits. Frontiers in Behavioral Neuroscience. 8, 1-14 (2014).
- Fuchikami, M., et al. Optogenetic stimulation of infralimbic PFC reproduces ketamine's rapid and sustained antidepressant actions. Proceedings of the National Academy of Science of the United States of America. 112, 8106-8111 (2015).
- Correia, P. A., et al. Transient inhibition and long-term facilitation of locomotion by phasic optogenetic activation of serotonin neurons. Elife. 6, 1-26 (2017).
- Felix-Ortiz, A. C., Burgos-Robles, A., Bhagat, N. D., Leppla, C. A., Tye, K. M. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 321, 197-209 (2016).
- Marek, R., Xu, L., Sullivan, R. K. P., Sah, P. Excitatory connections between the prelimbic and infralimbic medial prefrontal cortex show a role for the prelimbic cortex in fear extinction. Nature Brief Communication. , (2018).
- Parfitt, G. M., et al. Bidirectional Control of Anxiety-Related Behaviors in Mice: Role of Inputs Arising from the Ventral Hippocampus to the Lateral Septum and Medial Prefrontal Cortex. Neuropsychopharmacology. 42, 1715-1728 (2017).
- Bandelow, B., Michaelis, S. Epidemiology of anxiety disorders in the 21st century. Dialogues in Clinical Neuroscience. 17, 327-335 (2015).
- Kessler, R. C., et al. Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 62, 593-602 (2005).
- Kessler, R. C., Petukhova, M., Sampson, N. A., Zaslavsky, A. M., Wittchen, H. U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. International Journal of Methods Psychiatric Research. 21, 169-184 (2014).
- Andlin-Sobocki, P., Wittchen, H. U. Cost of anxiety disorders in Europe. European Journal of Neurology. 12, 39-44 (2005).
- Forster, G. L., Novick, A. M., Scholl, J. L., Wall, M. J. The Role of the Amygdala in Anxiety Disorders. Intech. , 61-102 (2012).
- Liberzon, I. Neural circuits in anxiety and stress disorders a focused review. Therapeutics and Clinical Risk Management. 11, 115-126 (2015).
- Sylvers, P., Lilienfeld, S. O., LaPrairie, J. L. Differences between trait fear and trait anxiety: Implications for psychopathology. Clinical Psychology Review. 31, 122-137 (2011).
- Daws, L. C., Koek, W., Mitchell, N. C. Revisiting Serotonin Reuptake Inhibitors and the Therapeutic Potential of 'Uptake-2' in Psychiatric Disorders. ACS Chemical Neuroscience. 4, 16-21 (2013).
- Felix-Ortiz, A. C., et al. BLA to vHPC inputs modulate anxiety-related behaviors. Neuron Report. 79, 658-664 (2013).
- Padilla-Coreano, N., et al. Direct Ventral Hippocampal-Prefrontal Input Is Required for Anxiety-Related Neural Activity and Behavior. Neuron Article. 89, 857-866 (2016).
- Lisboa, S. F., Stecchini, M. F., Corrêa, F. M. A., Guimarães, F. S., Resstel, L. B. M. Different role of the ventral medial prefrontal cortex on modulation of innate and associative learned fear. Neuroscience. 171, 760-768 (2010).
- Bi, L. L., et al. Enhanced excitability in the infralimbic cortex produces anxiety-like behaviors. Neuropharmacology. 72, 148-156 (2013).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature Article. 477, 171-178 (2011).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. 44, 611-621 (2006).
- Rubenstein, J. L. R., Merzenich, M. M. Model of autism: increased ratio of excitation/ inhibition in key neural systems. Genes, Brain and Behavior. 2, 255-267 (2003).
- Berg, L., Eckardt, J., A, M. O. Enhanced activity of pyramidal neurons in the infralimbic cortex drives anxiety behavior. PLoS One. 14, 1-19 (2019).
- Meunier, C. N. J., Amar, M., Lanfumey, L., Hamon, M., Fossier, P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71, 37-45 (2013).
- Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J. Mouse Brain in Stereotaxic Coordinates. 2, Academic Press. (2004).
- Gore, B. B., Soden, M. E., Zweifel, L. S. Manipulating gene expression in projection-specific neuronal populations using combinatorial viral approaches. Current Protocols in Neuroscience. 435, 1-6 (2014).
- Stujenske, J. M., Spellman, T., Gordon, J. A. Modeling the Spatiotemporal Dynamics of Light and Heat Propagation for InVivo Optogenetics. Cell Report. 12, 525-534 (2015).
- Berg, L. Imbalance of excitation and inhibition within the prefrontal cortex supports anxiety behavior. Ruhr-University Bochum. , Doctoral dissertation (2019).
- Boyden, E. S. A history of optogenetics: The development of tools for controlling brain circuits with light. F1000 Biology Reports. 3, 1-12 (2011).
- Airan, R. D., Thompson, K. R., Fenno, L. E., Bernstein, H., Deisseroth, K. Temporally precise in vivo control of intracellular signalling. Nature. 458, 1025-1029 (2009).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7, 12-23 (2012).
- Covington, H. E., et al. Antidepressant Effect of Optogenetic Stimulation of the Medial Prefrontal Cortex. Journal of Neuroscience. 30, 16082-16090 (2010).
- Lepicard, E. M., Joubert, C., Hagneau, I., Perez-Diaz, F., Chapouthier, G. Differences in anxiety-related behavior and response to diazepam in BALB/cByJ and C57BL/6J strains of mice. Pharmacology, Biochemistry and Behavior. 67, 739-748 (2000).
- Schmidt, M. V., Müller, M. B. Animal models of anxiety. Elsevier. 3, 369-374 (2006).
- Cho, J. H., Deisseroth, K., Bolshakov, V. Y. Synaptic Encoding of Fear Extinction in mPFC-amygdala Circuits. Neuron Article. 80, 1491-1507 (2013).
- Adhikari, A., et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature. 527, 179-185 (2015).
- Suzuki, S., et al. The infralimbic and prelimbic medial prefrontal cortices have differential functions in the expression of anxiety-like behaviors in mice. Behavioural Brain Research. 304, 120-124 (2016).
- Carola, V., D'Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134, 49-57 (2002).
- Prut, L., Belzung, C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: A review. European Journal of Pharmacology. 463, 3-33 (2003).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature Letter. 471, 358-362 (2011).
- Bouwknecht, J. A., et al. Differential effects of exposure to low-light or high-light open-field on anxiety-related behaviors: Relationship to c-Fos expression in serotonergic and non-serotonergic neurons in the dorsal raphe nucleus. Brain Research Bulletin. 72, 32-43 (2007).
- Overstreet, D. H., Knapp, D. J., Angel, R. A., Navarro, M., Breese, G. R. Reduction in repeated ethanol-withdrawal-induced anxiety-like behavior by site-selective injections of 5-HT1A and 5-HT2C ligands. Psychopharmacology. 187, Berlin. 1-12 (2006).
- Takahashi, A., et al. Glutamate Input in the Dorsal Raphe Nucleus As a Determinant of Escalated Aggression in Male Mice. Journal of Neuroscience. 35, 6452-6463 (2015).
- Klemenhagen, K. C., Gordon, J. A., David, D. J., Hen, R., Gross, C. T. Increased Fear Response to Contextual Cues in Mice Lacking the 5-HT1A Receptor. Neuropsychopharmacology. 31, 101-111 (2006).
- Ramos, A. Animal models of anxiety: do I need multiple tests. Trends in Pharmacological Science. 29, 493-498 (2008).
- Isosaka, T., et al. Htr2a-Expressing Cells in the Central Amygdala Control the Hierarchy between Innate and Learned Fear. Cell. 163, 1153-1164 (2015).
- Regev, L., Goshen, I. Employing Optogenetics in Memory Research. Optogenetics: A Roadmap. , 219-256 (2017).
- Shah, A. A., Sjovold, T., Treit, D. Inactivation of the medial prefrontal cortex with the GABA A receptor agonist muscimol increases open-arm activity in the elevated plus-maze and attenuates shock-probe burying in rats. Brain Research. 1028, 112-115 (2004).
- Knight, A. R., et al. Pharmacological characterisation of the agonist radioligand binding site of 5-HT2A, 5-HT2B and 5-HT2C receptors. Naunyn-Schmiedebergs Archiv of Pharmacology. 370, 114-123 (2004).
- Graeff, F. G., Viana, M. B., Mora, P. O. Dual Role of 5-HT in Defense and Anxiety. Neuroscience and Biobehavioral Reviews. 21, 791-799 (1997).
- Cheriyan, J., Sheets, P. L. Altered Excitability and Local Connectivity of mPFC-PAG Neurons in a Mouse Model of Neuropathic Pain. Journal of Neuroscience. 38, 4829-4839 (2018).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır