A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיית תא חי של מערכים חד-תאיים (LISCA) - טכניקה רב-תכליתית לכימות קינטיקה תאית
In This Article
Summary
אנו מציגים שיטה לרכישת קורסי זמן לכתב פלואורסצנטי מתאים בודדים באמצעות מערכים micropatterned. הפרוטוקול מתאר הכנת מערכים חד-תאיים, התקנה ותפעול של מיקרוסקופיית זמן-לשגות של סריקת תאים חיים וכלי לניתוח תמונות בקוד פתוח לצורך בחירה מראש אוטומטית, בקרה חזותית ומעקב אחר קורסי זמן פלואורסצנטיים משולבים בתאים לכל אתר הידבקות.
Abstract
דימות תא חי של מערכים חד-תאיים (LISCA) היא שיטה רב-תכליתית לאיסוף קורסי זמן של אותות פלואורסצנטיים מתאים בודדים בתפוקה גבוהה. באופן כללי, רכישת קורסי זמן חד-תאיים מתאים מתורבתים מעוכבת על ידי תנועתיות התא ומגוון צורות התאים. מיקרו-מערכים דביקים מתקננים תנאים של תא יחיד ומאפשרים ניתוח תמונה. LISCA משלבת מיקרו-סדרה חד-תאית עם מיקרוסקופיה של זמן לשגות ועיבוד תמונה אוטומטי. כאן, אנו מתארים את הצעדים הניסיוניים של לקיחת קורסי זמן פלואורסצנטיות חד-תאיים בפורמט LISCA. אנו חוצצים תאים הדבקים במערך micropatterned באמצעות קידוד mRNA עבור חלבון פלואורסצנטי ירוק משופר (eGFP) ומנטרים את הקינטיקה של ביטוי eGFP של מאות תאים במקביל באמצעות סריקת מיקרוסקופיה של זמן לשגות. ערימות נתוני התמונה מעובדות באופן אוטומטי על-ידי תוכנה חדשה שפותחה המשלבת עוצמת פלואורסצנטיות על-פני קווי מתאר נבחרים של תאים כדי ליצור קורסי זמן פלואורסצנטיים של תא יחיד. אנו מראים כי קורסי זמן ביטוי eGFP לאחר transfection mRNA מתוארים היטב על ידי מודל תרגום קינטי פשוט החושף ביטוי ושיעורי השפלה של mRNA. יישומים נוספים של LISCA עבור מתאמי זמן אירוע של סמנים מרובים בהקשר של אפופטוזיס איתות נדונים.
Introduction
בשנים האחרונות ניכרת החשיבות של ניסויים חד-תאיים. נתונים מתאים בודדים מאפשרים חקירה של שונות תא לתא, רזולוציה של מתאמי פרמטרים תאיים וזיהוי קינטיקה תאית שנותרו מוסתרים במדידות אנסמבל1,2,3. על מנת לחקור קינטיקה תאית של אלפי תאים בודדים במקביל, יש צורך בגישות חדשות המאפשרות ניטור התאים בתנאים מתוקננים לאורך תקופה של מספר שעות עד מספר ימים ולאחר מכן ניתוח נתונים כמותי 4. כאן, אנו מציגים הדמיה של תא חי של מערכים חד-תאיים (LISCA), המשלבת שימוש במערכים מיקרו-מובנים עם מיקרוסקופיה של זמן לשגות וניתוח תמונה אוטומטי.
מספר שיטות ליצירת מערכים חד-תאיים מיקרו-מובנים הוקמו ופורסמו בספרות5,6. כאן, אנו מתארים בקצרה דוגמאות חלבון מיקרומטריות ביוזמת פלזמה (μPIPP). פרוטוקול מפורט של ייצור מערך תא יחיד באמצעות μPIPP נמצא גם בהתייחסות7. השימוש במערכים חד-תאיים מאפשר יישור של אלפי תאים בנקודות הידבקות סטנדרטיות המציגות מיקרו-וירוסים מוגדרים לכל תא ובכך מפחית את מקור השונות הניסיונית (איור 1A). מערכים חד-תאיים משמשים לניטור משך הזמן של סמנים פלואורסצנטיים המיועדים להצביע על מגוון תהליכים תאיים. מיקרוסקופיה לטווח ארוך במצב סריקת זמן לשגות מאפשר ניטור שטח גדול של מערכי תא יחיד ומכאן דגימת נתונים חד-תאיים בתפוקה גבוהה על פני זמן תצפית של מספר שעות או אפילו ימים. פעולה זו יוצרת ערימות של תמונות לאורך זמן מכל מיקום של המערך (איור 1B). כדי להפחית את הכמות הגדולה של נתוני התמונה ולחלץ את קורסי זמן הפלואורסצנטיות הרצויים של תא יחיד בצורה יעילה, נדרש עיבוד תמונה אוטומטי המנצל את מיקום התאים (איור 1C).
האתגר של LISCA הוא להתאים את הפרוטוקולים הניסיוניים והכלים החישוביים כדי ליצור מבחני תפוקה גבוהה המייצרים נתונים כמותיים וניתנים לשחזור של קינטיקה תאית. במאמר זה אנו מספקים תיאור שלב אחר שלב של השיטות הבודדות וכיצד הן משולבות ב- LISCA assay. כדוגמה, אנו דנים במהלך הזמן של ביטוי חלבון פלואורסצנטי ירוק משופר (eGFP) לאחר אספקת mRNA מלאכותית. ביטוי eGFP לאחר מסירת mRNA מתואר על ידי תרגום מידול משוואות קצב תגובה והשפלה של mRNA. התאמת פונקציית המודל עבור משך הזמן של ריכוז eGFP לקריאת LISCA של עוצמת הפלואורסצנטיות עבור כל תא בודד לאורך זמן מניבה את ההערכות הטובות ביותר של פרמטרי מודל כגון שיעור השפלת mRNA. כתוצאה מייצגת אנו דנים ביעילות אספקת mRNA של שני סוכני transfection מבוססי שומנים שונים וכיצד התפלגות הפרמטרים שלהם שונה.
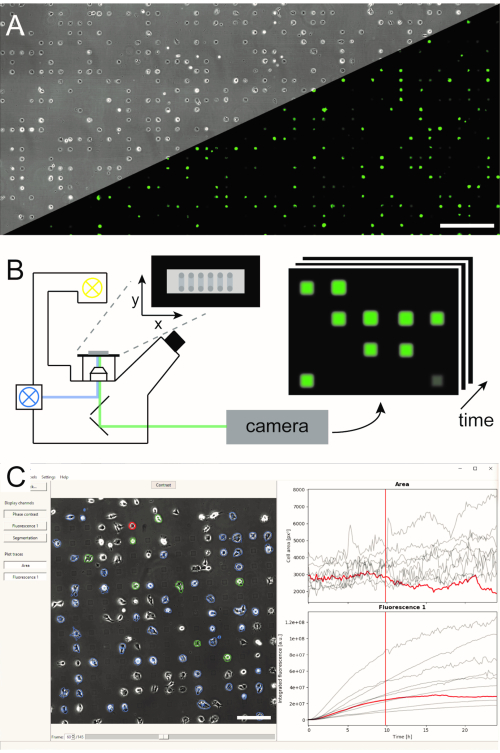
איור 1: ייצוג זרימת העבודה של LISCA המשלבת (A) מערכים חד-תאיים בעלי תבנית מיקרו (B) סורקים מיקרוסקופיה של זמן לשגות ו- (C) ניתוח תמונה אוטומטי של סדרות תמונות מוקלטות. מערכי התאים הבודדים מורכבים מתבנית דו-ממדית של ריבועי דבק תאים עם מרחב בין-מרחבי דוחה תאים המוביל לסידור התאים במיקרופטרן, כפי שניתן לראות בתמונת ניגודיות הפאזה, כמו גם בתמונת הפלואורסצנטיות של תאים המבטאים eGFP (A). האזור המיקרו-מובנה כולו נראה במצב סריקה של זמן לשגות שוב ושוב ומצלם תמונות ברצף של מיקומים (B). סדרות תמונות מוקלטות מעובדות כדי לקרוא את עוצמת הפלואורסצנטיות לכל תא לאורך זמן (C). סרגלי קנה מידה: 500 מיקרומטר (A), 200 מיקרומטר (C). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
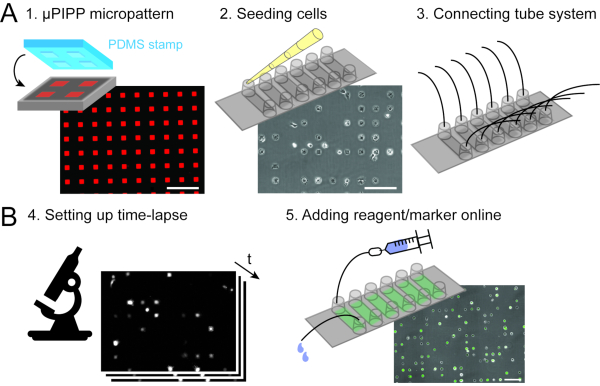
איור 2: רכישת נתונים המשלבת מיקרו-סדרה חד-תאית (A) עם מיקרוסקופיית זמן לשגות סריקה (B). כהכנת ניסוי זמן לשגות, מערך חד-תאי עם מיקרופטרן דו-ממדי של ריבועי הידבקות מוכן (1), ואחריו זריעת תאים ויישור התאים על micropattern (2) כמו גם את החיבור של מערכת זלוף לשקופית שישה ערוצים, המאפשר טיפול נוזלי במהלך מדידת זמן לשגות (3). ניסוי זמן לשגות סריקה מוגדר (4) ואת התאים הם transfected על המיקרוסקופ על ידי הזרקת פתרון ליפופלקס mRNA באמצעות מערכת זלוף במהלך ניסוי זמן לשגות (5). סרגלי קנה מידה: 200 מיקרומטר.
1. ייצור מערך חד-תאי מיקרו-מובנה (איור 2A)
- הכן את החומרים הדרושים לייצור מערך μPIPP.
- הכן מלוחים סטריליים עם אגירת פוספט (PBS) ב- pH 7.4.
- הכן מים סטריליים אולטרה-דקים עם התנגדות של לפחות 18 MΩcm ב 25 °C (60 °F).
- הכן PLL(20 kDa)-g[3.5] PEG(2 kDa) (PLL-PEG) פתרון עבודה עם ריכוז 2 מ"ג/מ"ל של PLL-PEG במים אולטרה-סגולים המכילים 150 מ"מ NaCl ו 10 מ"מ 4-(2-hydroxyethyl)-1-piperazineethanesulfonic חומצה (HEPES).
- הכינו תמיסת חלבון מטריצה חוץ-תאית לציפוי פני השטח: 1 מ"ג/מ"ל פיברונקטין (FN) ב-PBS.
- הכינו רקיק סיליקון עם מיקרופטרן מפוברק על ידי פוטוליטוגרפיה8 המתפקדת כמאסטר לשימוש חוזר. micropattern מורכב ריבועים עם אורך קצה של 30 מיקרומטר, עומק של 12 מיקרומטר ומרחק בין מרובע של 60 מיקרומטר, מסודרים בשישה פסים כל אחד בעל רוחב של 6 מ"מ וגובה של 18 מ"מ.
- מערבבים מונומר פוליאדימיאתילסילוקסן (PDMS) עם 9% צולבת (מסה %) באמצעות ערכת אלסטומר סיליקון ו degas אותו במשך כ 30 דקות עד שהוא ללא בועה באמצעות יבוש. השליכו את רקיק הסיליקון בשכבת PDMS בעובי של כ-3-5 מ"מ ורוקנו אותו שוב למשך כ-30 דקות עד שהוא יהיה ללא בועה.
- שים את רקיק הסיליקון עם PDMS בתנור אפייה ב 50 מעלות צלזיוס כדי לרפא את PDMS לפחות 4 שעות.
- חותכים את חותמות PDMS.
- השתמש באזמל וגזור משכבת PDMS יצירת מופת PDMS אחת המכילה את ששת פסי המיקרופטרן.
- הניחו את יצירת המופת של PDMS על ספסל כאשר המיקרופטרן פונה כלפי מעלה.
- חותכים כל אחד מששת פסי המיקרופטרן של יצירת המופת PDMS עם סכין גילוח לחותמת PDMS. דאג לכך שהקצוות של חותמות PDMS פתוחים על-ידי ניתוק חלק מהאזור המעוצב.
- הנח את חותמות PDMS על עטיפה של שקופית בת שישה ערוצים (איור 3-1).
- השתמש ב- coverslip לא ציפוי וסמן את מיקומי הערוץ של שקופית ששת הערוצים על-ידי גירוד בזהירות של רדיד ההגנה של החלקה. לאחר מכן הניחו את הכיסוי על הספסל כשנייר ההגנה פונה כלפי מטה.
- הנח את חותמות ה- PDMS כאשר המיקרופטרן פונה כלפי מטה על מכסה הערוץ המסומן באמצעות פינצטה.
- בדוק את הקובץ המצורף של חותמות PDMS תחת מיקרוסקופ. אם חותמת PDMS מחוברת במלואה לכיסוי, הריבועים במגע נראים כהים יותר מהאינטר-רווח. ההחזקה של חותמת PDMS לכיסוי חיונית לאיכות המיקרופטרן.
- מניחים את הכיסוי עם שש חותמות PDMS עליו לתוך מנקה פלזמה ולטפל בו עם פלזמת חמצן (לחץ 0.2 mbar, ~ 40 W במשך 3 דקות) כדי להפוך את המשטחים בין חותמות PDMS ואת coverslip הידרופילי(איור3-2).
- בצע את כל השלבים הנוספים של ייצור micropattern בארון biosafety. השתמש ב- 15 μL של פתרון PLL-PEG ובטיפה אחת שלו לצד כל חותמת PDMS כך שתמיסת PLL-PEG נספגת בתבנית ההידרופילית של חותמת PDMS(איור 3-3). תן דגירה PLL-PEG במשך 20 דקות בטמפרטורת החדר.
- יש לשטוף 1 מ"ל של מים אולטרה-דקים מעל המכסה עם חותמות PDMS ולהסיר את חותמות ה-PDMS באמצעות פינצטה(איור3-4). לאחר מכן לשטוף את הכיסויים בפעם השנייה עם 1 מ"ל של מים אולטרה סגולים ולתת לו להתייבש.
- כאשר הכיסוי התייבש לחלוטין, הדבק שקופית דביקה בת שישה ערוצים לכיסוי (איור 3-4). יש לדאוג כי האזורים micropatterned ליישר עם החלק התחתון של הערוצים.
- פונקציונליזציה ריבועי הידבקות עם FN.
- למלא 40 μL של PBS לתוך כל ערוץ.
- הכינו פתרון FN של 100 מיקרוגרם/מ"ל ב-PBS.
- הוסף 40 μL של פתרון FN לכל ערוץ (איור 3-5). מערבבים את פתרון FN עם PBS בערוץ ביסודיות על ידי הסרת 40 μL ממאגר אחד והוספתו למאגר הנגדי של אותו ערוץ במשך 3 פעמים כדי ליצור פתרון הומוגני. דגירה פתרון FN במשך 45 דקות בטמפרטורת החדר.
- לשטוף כל ערוץ שלוש פעמים עם 120 μL של PBS (איור 3-6).
- כדי לבדוק את איכות התבנית, השתמש ב- FN בעל תווית פלואורסצנטית בשלב 9.2. (איור4א).
הערה: מומלץ להכין את מערך μPIPP לא יותר מיום אחד לפני זריעת תאים כמו PLL-PEG ו- FN אינם מאוגדים בקובאליות למצע ואיכות התבנית עשויה לרדת עם הזמן. אחסן במקרר את מערך ה- μPIPP המוכן.
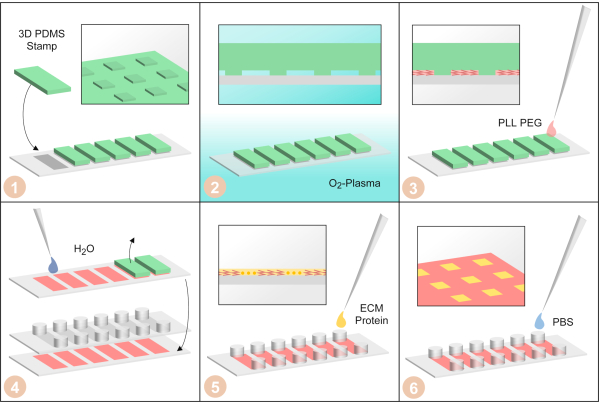
איור 3: ייצור מיקרו-סדרה חד-תאי על-ידי μPIPP. (1) חותמות PDMS עם מבנה מיקרופטרן תלת-ממדי על פני השטח מסודרות על משטח כיסוי של שקופית בת שישה ערוצים. (2) הכיסוי עם חותמות PDMS עליו מטופל בפלזמת חמצן כדי להפוך את המשטחים הידרופיליים. (3) נוסף PLL-PEG. הוא נספג לתוך המיקרו-מבנה על ידי כוחות נימי והופך את המשטחים לא מכוסים על ידי חותמת PDMS דוחה תאים. (4) הכיסוי שטוף במים כדי להסיר את ה- PLL-PEG הנותר. לאחר מכן, חותמות PDMS מוסרות ושקופית דביקה בת שישה ערוצים תקועה אל כיסוי. (5) Fibronectin, חלבון של מטריצה חוץ תאית, מתווסף כדי להפוך את האזורים ללא PLL-PEG תא דבק. (6) השקופית בת ששת הערוצים נשטפת בתמיסת מלח עם אגירת פוספט. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. זריעת תאים (איור 2A)
הערה: עבור שלבי הכביסה הבאים, הוסף את הנוזל המתאים למאגר אחד ולאחר מכן הסר נפח שווה של נוזל מהמאגר הנגדי של ערוץ.
- לשטוף כל ערוץ עם 120 μL של 37 °C (70 °F) מדיום צמיחת תאים בתוספת מלאה. לפני הוספת המתלה התא, ודא כי רק הערוצים מלאים בינוני אבל לא את המאגרים.
- נתק תאי HuH7 מבקבוק תרבות תאים בהתאם לפרוטוקול הסטנדרטי שלך להעברת תאים והתאם את ריכוז המתלים של התא ל- 4 x 105 תאים/מ"ל.
- הוסף 40 μL של השעיית תאים וערבב את מדיום צמיחת התא עם המתלה התא על ידי הסרת 40 μL ממאגר אחד והוספתו למאגר הנגדי של אותו ערוץ במשך 3 פעמים כדי להגיע להפצת תא הומוגני (איור 4B).
- הסר 40 μL של השעיה מהערוץ, כך שרק הערוץ מלא השעיית תא.
- שים את השקופית באינקובטור ולבדוק הידבקות התא 1 שעה לאחר הזריעה באמצעות מיקרוסקופ ניגודיות פאזה.
- הוסף 120 μL של 37 °C בינוני צמיחת תא חם.
- אבל הגלישה חזרה באינקובטור למשך 3 שעות נוספות כדי לאפשר ארגון עצמי סלולרי במיקרופטרן(איור 4C).

איור 4: ארגון עצמי תאי ובקרת איכות של מערך μPIPP. (A) המשטח המיקרו-מובנה מורכב מנקודות הידבקות בריבוע מצופות FN המוצגות באדום ומוקפות בפולימר דוחה תאים. (B) לאחר זריעת תאים, תאי HuH7 מופצים באופן אקראי ו - (C) לדבוק בעיקר על כתמי הידבקות על פני תקופה של 4 שעות. הודפס מחדש עם הרשאה 7. סרגלי קנה מידה: 200 מיקרומטר.
3. מערכת זלוף (איור 2A)
הערה: השימוש במערכת זלוף נדרש רק אם יש להוסיף ריאגנטים או סמנים פלואורסצנטיים במהלך מדידת זמן לשגות. בהתאם לצרכים שלך, אתה יכול לחבר כל ערוץ למערכת זלוף נפרדת או לחבר מספר ערוצים בסדרה לאותה מערכת זלוף. מספר מערכות הזלוף תואם למספר תנאי הניסוי העצמאיים. חבר את הצינורות בתנאים סטריליים בארון biosafety ולהימנע הכללת בועות אוויר במערכת זלוף. אם לא נעשה שימוש במערכת זלוף, הוסיפו את ריאגנטים/סמנים בארון biosafety לפני מדידת זמן לשגות. מערכת הזלוף מפוברקת, החומר המשומש מופיע בטבלת החומרים. ההרכבה של מערכת זלוף תוארה בעבר9.
- השתמש מזרק 1 מ"ל (עם sporn חלופי) ולמלא את המזרק עם 1 מ"ל של 37 °C (בינוני צמיחת תאים.
- לחבר את המזרק לצינור מפרצון באמצעות השסתום ולמלא את הצינור עם בינוני.
- חבר את צינור כניסת למאגר של ערוץ ולוודא כי אין בועות אוויר לכודים.
- כדי לחבר ערוץ נוסף בסידרה למערכת זלוף זו, חבר מחבר טורי למאגר שממול לצינור התוך של הערוץ הנוכחי. המשך לערוץ הבא וחבר את הקצה החופשי של המחבר הטורי לאחד המאגרים שלו.
- חזור על השלבים הקודמים עד שמספר הערוצים הנדרש יתחבר בסידרה.
- חבר את צינור היציאה ישירות למאגר החינמי של הערוץ הנוכחי. מלאו את הצינור המחובר באמצעי כדי לבדוק שמערכת הזלוף אינה דולפת.
- חזור על השלבים הקודמים עד שכל ששת הערוצים של השקופית יחוברו למערכת זלוף.
- מניחים את השקופית עם מערכת זלוף מחוברת בחזרה באינקובטור עד לשימוש נוסף או למקם אותו ישירות בתא החימום של המיקרוסקופ מראש מחומם ל 37 °C (69 °F) למדידת זמן לשגות.
4. מיקרוסקופיה לשגות בזמן (איור 2B)
הערה: למדידות ארוכות טווח, שמרו על טמפרטורה יציבה של 37°C ורמת CO2 יציבה. כחלופה למדיום צמיחת תאים תלוי CO2,השתמש במדיום L15 שעבורו אין צורך במערכת דגירה של גז.
הערה: להדמיה כמותית, השתמש במדיום צמיחת תאים ללא פנול אדום במהלך מדידת הזמן-לשגות כדי להפחית את פלואורסצנטיות הרקע ולהשתמש באותן הגדרות של פרוטוקול זמן לשגות, כמו גם את אותו מיקרוסקופ עבור משכפלים טכניים.
- הגדר פרוטוקול זמן לשגות להקלטת תמונת ניגודיות פאזה ותמונת פלואורסצנטיות עם זמני חשיפה של 750 אלפיות השנייה (בהתאם למצלמה), מרווח זמן של 10 דקות בין לולאות עוקבות דרך רשימת המיקומים וזמן תצפית של 30 שעות, באמצעות יעד 10x ומסנני פלואורסצנטיות מתאימים.
- שים את השקופית בת ששת הערוצים עם התאים במערכים החד-תאיים במחזיק המדגם של תא החימום החם ב- 37 °C (60 °F). אם מערכות זלוף מחוברות לשקופית בעלת ששת הערוצים, תקן את הצינורות לבמה באמצעות סרט הדבקה כלשהו כדי להבטיח שהשקופית בעלת ששת הערוצים לא תועבר במהלך חילופי נוזלים. הכנס את הקצוות החופשיים של צינורות היציאה דרך חור של צינור תגובה 15 מ"ל כדי לאסוף את הפסולת הנוזלית.
- קבעו את רשימת המיקומים למדידת זמן ההקפדה של הסריקה. ודא שניתן לסרוק את מספר המיקומים בתוך מרווח הזמן המוגדר בין לולאות עוקבות דרך רשימת המיקומים. עם מטרה 10x, 10-30 עמדות לערוץ ניתן להגדיר כדי לסרוק את האזור micropattern הכולל בהתאם לגודל שבב המצלמה.
- התחל את מדידת הזמן-לשגות. לקבלת איכות תמונה טובה יותר של מדידות ארוכות טווח, השתמש במערכת תיקון מיקוד אוטומטית.
5. סמן פלואורסצנטי - העברת mRNA (איור 2B)
הערה: עבור transfection בשני ערוצים המחוברים על ידי מערכת צינורות, נפח כולל של 600 μL תערובת transfection יש צורך (300 μL עבור ערוץ אחד). אמצעי האחסון שצוינו מתייחסים לטרנס-פליטה בשני ערוצים מחוברים.
- הכן פתרון סוכן transfection על ידי דילול 1 μL של סוכן transfection ב 200 μL של בינוני מופחת סרום ולתת את הדגירה פתרון במשך 5 דקות בטמפרטורת החדר.
- הכן פתרון mRNA על ידי דילול 300 ng של קידוד mRNA עבור eGFP ב 150 μL של בינוני מופחת סרום.
- הכן את תערובת transfection על ידי הוספת 150 μL של פתרון סוכן transfection לפתרון mRNA ומערבבים אותו היטב. תן לתערובת transfection לערבב דגירה במשך 20 דקות בטמפרטורת החדר.
- לשטוף את מערכת הצינור עם 1 מ"ל של 37 °C PBS חם באמצעות מזרק במהלך הדגירה של תערובת transfection. בעת שטיפת הצינורות, ודא כי שלב המיקרוסקופ אינו זז. השהה את מדידת הזמן לשגות במידת הצורך.
- לדלל את תערובת transfection לריכוז mRNA הסופי של 0.5 ng/μL על ידי הוספת 300 μL סרום מופחת בינוני.
- לשטוף את מערכת הצינור עם תערובת transfection באמצעות מזרק ולתת ליפופלקסים mRNA דגירה במשך 1 שעות (להשהות את מדידת זמן לשגות במידת הצורך).
- לעצור את הדגירה transfection ולשטוף את lipoplexes mRNA מאוגדים על ידי כביסה עם 1 מ"ל של 37 °C חם מלא תא צמיחה בינוני באמצעות מזרק (להשהות את מדידת זמן לשגות במידת הצורך).
6. ניתוח תמונה וקריאת פלואורסצנטיות
- בעת הפעלת ניתוח התמונה בפעם הראשונה, התקן את גירסה 0.1.6 של תוכנת הקוד הפתוח "ניתוח מיקרו-מבנה אוטומטי בפייתון" (PyAMA) מהמיקום המצוטט10 בהתאם להוראות המפורטות שם.
- ודאו שערוצי התמונה (ניגודיות פאזה ופלואורסצנטיות) זמינים כקובצי TIFF מרובי תמונות של 16 סיביות. במידת הצורך, המר אותם בהתאם.
- הפעל את PyAMA ולחץ על פתח מחסנית...
- כדי שכל קובץ TIFF מרובה תמונות ייפתח, לחץ על פתח ובחר את הקובץ כך שיוצג ברשימת הקבצים הטעונים בצד שמאל של הדו-שיח (איור 5-1).
- סמן את הערוצים שייכללו בניתוח. עבור כל ערוץ, בצע את השלבים הבאים.
- בחר ברשימת הקבצים שנטענו את קובץ TIFF המכיל את הערוץ.
- במקטע הוספת ערוץ חדש, בחר את אינדקס הערוץ בקובץ TIFF. יצירת אינדקס היא מבוססת אפס; הערוץ הראשון כולל אינדקס 0, הערוץ השני יש אינדקס 1 וכן הלאה.
- בחר את סוג הערוץ. בחרו 'ניגודיות פאזה' או 'פלואורסצנטיות' לערוצי התמונה ולפילוח המתאימים לערוץ בינארי המציין את קווי המתאר של התא.
- לחלופין, הזן תווית של הערוץ להבחנה בין ערוצי פלואורסצנטיות שונים: eGFP ו- DAPI.
- לאחר קביעת התצורה של הערוץ, לחץ על הוסף.
- כאשר כל הערוצים שנוספו מוצגים ברשימת הערוצים בצד השמאלי של תיבת הדו-שיח, לחץ על אישור כדי לטעון את המחסנית.
- כדי לבצע פילוח באמצעות אלגוריתם הפילוח המובנה של PyAMA לזיהוי תאים בהתבסס על תמונות חדות הפאזה (איור 5-2),עבור אל כלים | בינריזציה... והזינו שם קובץ לקובץ NumPy עם הערוץ הבינארי.
הערה: בגירסה הנוכחית, טעינת הערוץ הבינארי דורשת טעינה מחדש של כל הערוצים. - לביצוע תיקון רקע11 בערוץ פלואורסצנטי (איור 5.3), ודאו שערוץ הפלואורסצנטיות וערוץ הפילוח נטענים. אם לא נטען ערוץ פילוח, ודא שערוץ חדות פאזה נטען עבור פילוח אוטומטי. עבור אל "כלים > תיקון רקע..." ובחר שם קובץ עבור קובץ TIFF שנוצר עם ערוץ הפלואורסצנטי המתוקן.
הערה: בגירסה הנוכחית, טעינת הערוץ המתוקן ברקע דורשת טעינה מחדש של כל הערוצים. - בדוק את התאים שנבחרו מראש (איור 5-4) ואת אות הפלואורסצנטי המשולב שלהם (איור 5-5) על-ידי גלילה במסגרות הזמן, הצגת הערוצים המפורטים בתפריט הערוצים בצד שמאל ולחיצה על תאים כדי להדגיש את קורסי זמן הפלואורסצנטיות שלהם (איור 1C). השתמש בבחירת התא כדי לא לכלול תאים שאינם בני קיימא, אינם מוגבלים לנקודת הידבקות או מחוברים לתא אחר מניתוח נוסף. החלף את מצב בחירת התאים לקריאה על-ידי הקשה על Shift ולחיצה על התא, או על-ידי סימון התא והקשה על Enter.
- שמור את קורסי הזמן של תא יחיד עבור אזור התא ואת הפלואורסצנטיות המשולבת (איור 5-6) על-ידי לחיצה על קובץ | שמור ובחר ספריה לשמירה.

איור 5: עיבוד תמונה אוטומטי של סדרת תמונות עם זמן לשגות באמצעות סדרת תמונות ניגודיות פאזה ופלואורסצנטיותשל PyAMA. (1) עבור כל מיקום הדמיה מיובאים. (2) קווי המתאר של התא נקבעים לפי פילוח במחסנית התמונה של חדות הפאזה. (3) תיקון רקע מוחל על תמונות הפלואורסצנטיות. (4) קווי המתאר של התא נמצאים במעקב לאורך זמן ונבחרים מראש לייצוא. (5) עוצמת הפלואורסצנטיות משולבת בהתבסס על קווי המתאר של התאים מסומנים. (6) אזורי תא יחיד ועוצמות פלואורסצנטיות משולבות מוערכים וקורסי זמן עבור כל תא מיוצאים. סרגלי קנה מידה: 100 מיקרומטר.
- כדי לנתח את קינטיקה התרגום לאחר transfection mRNA, להתאים מודל תרגום המבוסס על משוואות קצב ביוכימי לכל קורס זמן תא יחיד כפי שתואר בעבר על ידי רייזר ואח'12. הנתונים והקוד המשמשים במחקר זה זמינים לציבור13.
- עבור כל קורס זמן של תא יחיד, אחזר את פרמטרי ההתאמה המשוערים של מודל התרגום המייצגים את קצב ההפחתה של mRNA ואת נקודת הזמן של תחילת התרגום. ערכת נתונים לדוגמה נדונה במקטע התוצאות הייצוגיות.
- בצע ניתוח נוסף על התפלגות ההערכות הטובות ביותר של הפרמטרים עבור תנאים ניסיוניים מגוונים כדי לחקור את השונות בין תא לתא בתוך אוכלוסיות התאים.
תוצאות
גישת LISCA מאפשרת לאסוף ביעילות קורסי זמן פלואורסצנטיים מתאים בודדים. כדוגמה מייצגת אנו מתארים כיצד שיטת LISCA מוחלת כדי למדוד ביטוי eGFP של תא יחיד לאחר transfection. הנתונים של הניסוי LISCA משמש להערכת קינטיקה משלוח mRNA, אשר חשוב לפיתוח תרופות mRNA יעיל.
בפרט אנו מדגימים את ההשפעה השונה של ש...
Discussion
כאן תיארנו את LISCA כטכניקה רב-תכליתית לעקוב אחר קינטיקה תאית של תוויות פלואורסצנטיות תאיות ברמת תא יחיד. על מנת לבצע ניסוי מוצלח של LISCA, יש לקבוע כל אחד מהשלבים המתוארים בסעיף הפרוטוקול בנפרד ולאחר מכן לשלב את כל השלבים. כל אחד משלושת ההיבטים העיקריים של LISCA כולל שלבים מכריעים.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענקים של קרן המדע הגרמנית (DFG) למרכז מחקר שיתופי (SFB) 1032. תמיכה של משרד החינוך, המחקר והטכנולוגיה הפדרלי הגרמני (BMBF) במסגרת הפרויקט השיתופי 05K2018-2017-06716 Medisoft, כמו גם מענק מ Bayerische Forschungstiftung מוכרים בהכרת תודה. אניטה רייזר נתמכה על ידי מלגת DFG באמצעות בית הספר לתואר שני למדעי הביולוגיה הכמותיים במינכן (QBM).
Materials
| Name | Company | Catalog Number | Comments |
| Adtech Polymer Engineering PTFE Microtubing | Fisher Scientific | 10178071 | |
| baking oven | Binder | 9010-0190 | |
| CFI Plan Fluor DL 10x | Nikon | MRH20100 | |
| Desiccator | Roth | NX07.1 | |
| Eclipse Ti-E | Nikon | ||
| eGFP mRNA | Trilink | L-7601 | |
| Female Luer to Tube Connector | MEDNET | FTL210-6005 | |
| Fetal bovine serum | Thermo Fisher | 10270106 | |
| Fibronectin | Yo Proteins | 663 | |
| Filter set eGFP | AHF | F46-002 | |
| Fisherbrand Translucent Platinum-Cured Silicone Tubing | Fisher Scientific | 11768088 | |
| HEPES (1 M) | Thermo Fisher | 15630080 | |
| Incubation Box | Okolab | OKO-H201 | |
| incubator | Binder | 9040-0012 | |
| L-15 without phenol red | Thermo Fisher | 21083027 | |
| Lipofectamine 2000 | Thermo Fisher | 11668027 | |
| Male Luer | in-house fabricated consisting of teflon | ||
| Male Luer to Tube Connector | MEDNET | MTLS210-6005 | alternative to in-house fabricated male luers |
| NaCl (5 M) | Thermo Fisher | AM9760G | |
| Needleless Valve to Male Luer Connector | MEDNET | NVFMLLPC | |
| NIS Elements | Nikon | Imaging software Version 5.02.00 | |
| NOA81 | Thorlabs | NOA81 | Fast Curing Optical Adhesive for tube system assembly |
| Opti-MEM | Thermo Fisher | 31985062 | |
| PCO edge 4.2 M-USB-HQ-PCO | pco | ||
| Phosphate buffered saline (PBS) | in-house prepared | ||
| Plasma Cleaner | Diener Femto | Pico-BRS | |
| PLL(20 kDa)-g[3.5]-PEG(2 kDa) | SuSoS AG | ||
| silicon wafer mit mircorstructures | in-house fabricated | ||
| Sola Light Engine | Lumencor | ||
| sticky slide VI 0.4 | ibidi | 80608 | |
| Sylgard 184 Silicone Elastomer Kit | Dow Corning | 1673921 | |
| Tango 2 | Märzhäuser | 00-24-626-0000 | |
| Ultrapure water | in-house prepared | ||
| uncoated coverslips | ibidi | 10813 | |
| Injekt-F Solo, 1 mL | Omilab | 9166017V | with replacement sporn |
References
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference. Cell. 141 (4), 559-563 (2010).
- Locke, J. C., Elowitz, M. B. Using movies to analyse gene circuit dynamics in single cells. Nature Reviews Microbiology. 7 (5), 383-392 (2009).
- Spencer, S. L., Gaudet, S., Albeck, J. G., Burke, J. M., Sorger, P. K. Non-genetic origins of cell-to-cell variability in TRAIL-induced apoptosis. Nature. 459 (7245), 428-432 (2009).
- El-Ali, J., Sorger, P. K., Jensen, K. F. Cells on chips. Nature. 442 (7101), 403-411 (2006).
- Segerer, F. J., et al. Versatile method to generate multiple types of micropatterns. Biointerphases. 11 (1), 011005 (2016).
- Piel, M., Théry, M. . Micropatterning in cell biology, part A/B/C. , (2014).
- Reiser, A., Zorn, M. L., Murschhauser, A., Rädler, J. O., Ertl, P., Rothbauer, M. . Cell-Based Microarrays: Methods and Protocols. , 41-54 (2018).
- Picone, R., Baum, B., McKendry, R. . Methods in cell biology. 119, 73-90 (2014).
- Reiser, A. . Single-cell time courses of mRNA transport and translation kinetics. , (2019).
- . Softmatter LMU-Raedler Group Available from: https://github.com/SoftmatterLMU-RaedlerGroup/pyama (2020)
- . MIAAB, 29262 Available from: https://github.com/SoftmatterLMU-RaedlerGroup/pyama (2020)
- Reiser, A., et al. Correlation of mRNA delivery timing and protein expression in lipid-based transfection. Integrative Biology. 11 (9), 362-371 (2019).
- Reiser, A., Woschée, D., Mehrotra, N., Krzysztoń, R. S., Strey, H. H., Rädler, J. O. Supplementing data and code for: "Correlation of mRNA delivery timing and protein expression in lipid-based transfection". Zenodo. , (2019).
- Ferizi, M., et al. Stability analysis of chemically modified mRNA using micropattern-based single-cell arrays. Lab on a Chip. 15 (17), 3561-3571 (2015).
- Fröhlich, F., et al. Multi-experiment nonlinear mixed effect modeling of single-cell translation kinetics after transfection. NPJ systems biology and applications. 4 (1), 1-12 (2018).
- Krzysztoń, R., et al. Single-cell kinetics of siRNA-mediated mRNA degradation. Nanomedicine: Nanotechnology, Biology and Medicine. 21, 102077 (2019).
- Röttgermann, P. J., Alberola, A. P., Rädler, J. O. Cellular self-organization on micro-structured surfaces. Soft Matter. 10 (14), 2397-2404 (2014).
- Röttgermann, P. J., Dawson, K. A., Rädler, J. O. Time-resolved study of nanoparticle induced apoptosis using microfabricated single cell arrays. Microarrays. 5 (2), 8 (2016).
- Murschhauser, A., et al. A high-throughput microscopy method for single-cell analysis of event-time correlations in nanoparticle-induced cell death. Communications Biology. 2 (1), 1-11 (2019).
- Chatzopoulou, E. I., et al. Chip-based platform for dynamic analysis of NK cell cytolysis mediated by a triplebody. Analyst. 141 (7), 2284-2295 (2016).
- Sztilkovics, M., et al. Single-cell adhesion force kinetics of cell populations from combined label-free optical biosensor and robotic fluidic force microscopy. Scientific Reports. 10 (1), 1-13 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved