A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה חיה בעלת תפוקה גבוהה של מיקרוקולוניות למדידת הטרוגניות בצמיחה ובביטוי גנים
In This Article
Summary
פנוטיפים של צמיחת שמרים נמדדים במדויק באמצעות הדמיה מקבילה מאוד של תאים משותקים הגדלים למיקרוקולוניות. במקביל, ניתן לעקוב אחר עמידות ללחץ, ביטוי חלבון ולוקליזציה של חלבונים, וליצור ערכות נתונים משולבות כדי לחקור כיצד הבדלים סביבתיים וגנטיים, כמו גם הטרוגניות של ביטוי גנים בקרב תאים איסוגניים, מווסתים את הצמיחה.
Abstract
מדידות מדויקות של הטרוגניות בין ומתח בתוך זן בשיעורי צמיחה מיקרוביאלית חיוניות להבנת תשומות גנטיות וסביבתיות לסובלנות מתח, פתוגניות ורכיבי מפתח אחרים של כושר. כתב יד זה מתאר בדיקה המבוססת על מיקרוסקופ העוקבת אחרכ-10 5מיקרוקולוניותסכרומיאציות של Saccharomyces בכל ניסוי. לאחר הדמיה אוטומטית של שמרים משותקים בצלחת מרובת גלים, שיעורי הצמיחה של מיקרו-מושבה מנותחים בקלות באמצעות תוכנה מותאמת אישית לניתוח תמונות. עבור כל מיקרו-מושבה, ניתן גם לעקוב אחר ביטוי ולוקליזציה של חלבונים פלואורסצנטיים והישרדות של מתח חריף. בדיקה זו מאפשרת הערכה מדויקת של שיעורי הצמיחה הממוצעים של הזנים, כמו גם מדידה מקיפה של הטרוגניות בצמיחה, ביטוי גנים וסובלנות מתח בתוך אוכלוסיות שיבוטים.
Introduction
פנוטיפים לצמיחה תורמים באופן קריטי לכושר שמרים. הברירה הטבעית יכולה להבחין ביעילות בין שושלת עם שיעורי צמיחה שונים על ידי ההופכי של גודל האוכלוסייה האפקטיבי, אשר יכול לחרוג 108 אנשים1. יתר על כן, שונות בשיעורי הצמיחה בקרב אנשים בתוך אוכלוסייה היא פרמטר רלוונטי מבחינה אבולוציונית, שכן הוא יכול לשמש כבסיס לאסטרטגיות הישרדות כגון גידור הימור2,3,4,5,6. לכן, מבחנים המאפשרים מדידות מדויקות מאוד של פנוטיפים צמיחה והתפלגותם הם מרכזיים לחקר מיקרואורגניזמים. מבחני הצמיחה של המיקרו-מושבה המתוארים כאן יכולים ליצור מדידות קצב צמיחה פרטניות עבור ~ 105 מיקרוקולוניות לכל ניסוי. בדיקה זו מספקת אפוא פרוטוקול רב עוצמה לחקר הגנטיקה והגנומיקה האבולוציונית של השמרים. זה משאיל את עצמו טוב במיוחד כדי לבדוק כיצד שונות בתוך אוכלוסיות של תאים בודדים זהים גנטית נוצר, מתוחזק, ותורם כושר האוכלוסייה7,8,9,10.
השיטה המתוארת כאן (איור 1) משתמשת מעת לעת בתמונות brightfield בעלות הגדלה נמוכה של תאים הגדלים במדיה נוזלית על צלחת תחתית זכוכית של 96 או 384 באר כדי לעקוב אחר צמיחה למיקרוקולוניות. התאים נצמדים ללקטין קונקאנאבלין A, אשר מצופה את החלק התחתון של צלחת המיקרוסקופ, ויוצרים מושבות דו מימדיות. מכיוון שהמיקרוקולוניות גדלות במונולייר, אזור המיקרו-מושבה מתואם מאוד עם תא מספר7. לכן, הערכות מדויקות של קצב הצמיחה של מיקרו-מושבה וזמן השהיה יכולות להיווצר באמצעות תוכנה מותאמת אישית לניתוח תמונות העוקבת אחר קצב השינוי של האזור של כל מיקרו-מושבה. יתר על כן, ההתקנה הניסיונית יכולה לפקח על השפע ואפילו על לוקליזציות תת-תאיות של חלבונים בעלי תווית פלואורסצנטית המתבטאים במיקרוקולוניות אלה. עיבוד במורד הזרם של נתונים ממערך צמיחה מיקרו-מושבה זה יכול להיות מושגת על ידי ניתוח מותאם אישית או על ידי תוכנה קיימת לניתוח תמונה, כגון עיבוד תמונות בקלות (PIE)11, אלגוריתם לזיהוי אזור מושבה חזק וניתוח צמיחה בתפוקה גבוהה מהגדלה נמוכה, תמונות brightfield, אשר זמין באמצעות GitHub12.
מכיוון שהערכות קצב הצמיחה הנגזרות ממסירת הצמיחה של מיקרו-מושבה נוצרות ממספר רב של מדידות חד-מושבתיות, הן מדויקות ביותר, עם שגיאות סטנדרטיות במספר סדרי גודל קטנים יותר מההערכות עצמן לניסוי בגודל סביר. לכן, כוחה של ההסתעפות לזהות הבדלי קצב צמיחה בין גנוטיפים שונים, טיפולים או תנאים סביבתיים הוא גבוה. הפורמט multiwell-צלחת מאפשר שילובים רבים ושונים סביבה וגנוטיפ להיות מושווה בניסוי אחד. אם זנים מבטאים באופן מכונן סמנים פלואורסצנטיים שונים, הם עשויים להיות מעורבים באותה באר ומאופיינים על ידי ניתוח תמונה עוקב, אשר יכול להגדיל את הכוח עוד יותר על ידי מתן נורמליזציה נתונים היטב.
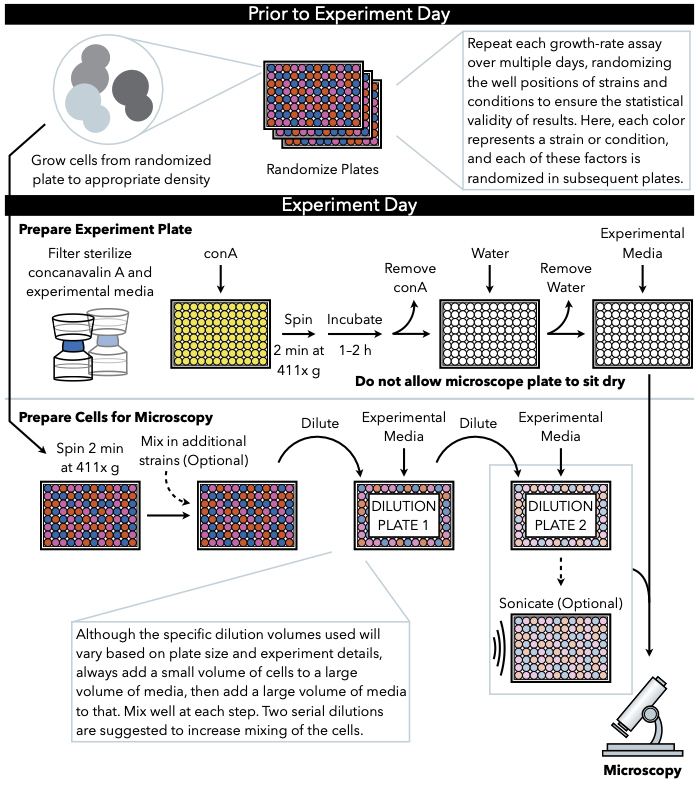
איור 1: ייצוג סכמטי של הפרוטוקול. פרוטוקול זה עוקב אחר שני שלבים עיקריים, שהם הכנת צלחת הניסוי והכנת התאים לתמונה. אקראיות של צלחות וצמיחה של תאים צריך להתבצע לפני ומוביל ליום הניסוי. ערבוב חוזר ונשנה של תאים בכל שלב במהלך הדילול הוא הכרחי בשלבים עד לציפוי, ולכן מומלץ להכין את צלחת הניסוי תחילה, כך שהוא מוכן לציפוי מיד עם השלמת דילול התא. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
1. הכנת צלחות אקראיות (לפני יום הניסוי)
- תכנן את הזנים והתנאים להיבדק עם מבחני הצמיחה. בשלב זה, באופן אקראי להקצות זנים ותנאים לכל באר.
הערה: כאשר שוקלים הגדרת צלחת, מומלץ לכלול יותר משכפול אחד לכל זן ומצב צמיחה על צלחת אחת כדי להסביר רעש הקשורים היטב במדידות. ראה דיון לקבלת פרטים נוספים. - אקראיות חישובית את המיקום של כל זן ומצב סביבתי עבור משכפלים צלחת שיופעלו בימים שונים.
- לגדל את כל התאים שישמשו בניסוי לרוויה תמצית שמרים-פפטון-דקסטרוז (YEPD; 2% גלוקוז) בינוני בשייקר ב 30 מעלות צלזיוס (או כל טמפרטורה מתאימה אחרת).
- צור את לוחות המלאי האקראיים באופן ידני או באמצעות רובוט לטיפול בנוזלים. הוסף 10 μL של התאים הרוויים המיועדים לכל באר של צלחת תרבות רקמה סטרילית U-bottom. אם זנים מרובים ייבדקו בבאר אחת, אל תשלב אותם בשלב זה; שילוב זה ייעשה ממש לפני דילול התאים ביום הניסוי כדי להבטיח שכל הזנים נמצאים בריכוזים הנכונים כאשר מצופים כתאים מייסדי מיקרו-מושבה.
- מוסיפים 10 μL של 30% גליצרול לכל באר של כל צלחת. צינור למעלה ולמטה, כך התאים גליצרול להיות מעורב היטב.
- לאטום כל צלחת עם כיסוי נייר כסף להקפיא מיד ב -70 מעלות צלזיוס עד מוכן לשימוש.
הערה: חשוב ליצור את כל הצלחות האקראיות באותו יום, ולהקפיא אותן, כך שתנאי טרום הצמיחה של התאים בכל צלחת יהיו זהים ולא ייצרו וריאציה טכנית במח"ש קצב הצמיחה.
2. טרום צמיחה של שמרים
הערה: בדרך כלל, זה מתחיל לפני יום הניסוי והוא תלוי מאוד בשאלה הניסיונית. ראה דיון לקבלת פרטים.
- הסר צלחת מלאי (10 שמרי μL, 10 μL גליצרול לבאר) מן המקפיא -70 מעלות צלזיוס ולהוסיף 180 μL של המדיה כדי לשמש לניסוי. אם הניסוי יתבצע באמצעות מדיה מגבילה חומרים מזינים, אין לגדל מראש שמרים לרוויה במדיה המגבילה את החומרים המזינים, שכן התכווצות של שמרים יכולה להתרחש. במקום זאת, הגדל מראש במדיה שאינה מגבילה.
- לגדל שמרים תוך טלטול ב 30 מעלות צלזיוס. שקול אם להפעיל את הבדיקה החל מתאים בשלב יומן הרישום או בשלב נייח כדי לקבוע אם דילול התאים מספר פעמים לפני הניסוי יהיה צורך. אם זני שמרים או תנאים ב assay צפויים להיות שיעורי צמיחה שונים באופן משמעותי, אז תקופה של יומיים לפני הצמיחה יהיה צורך על מנת שכל התנאים השונים להגיע לשלב נייח.
3. הגדרת מיקרוסקופ
- הכנת צלחת מיקרוסקופ
- ודא כי חממת המיקרוסקופ מופעלת ומחממת את תא המיקרוסקופ לטמפרטורת הגדילה הרצויה לתנאי הניסוי. עבור ניסויים סטנדרטיים באמצעות תאי Saccharomyces cerevisiae, החממה צריכה לחמם את תא המיקרוסקופ ל 30 °C (60 °F) כדי להבטיח כי תנאי הצמיחה של התאים יהיה נכון במהלך מבחני קצב הצמיחה.
- לחטא את שולחן העבודה, פיפטות, וכלים אחרים עם 70% אתנול. מחזירים צלחת מיקרוסקופ ומניחים אותה על הספסל על גבי מגבון נטול מוך וסטטי.
הערה: לעולם אל תיגע בתחתית לוחית המיקרוסקופ, אפילו עם כפפות, ותמיד תציב את לוחית המיקרוסקופ על גבי מוך- וללא סטטיות בכל פעם שהוא נוגע בכל משטח. פעולה זו מונעת כתמים או שריטות מלהכשיל מדידות קצב צמיחה לאחר הדמיית הניסוי. - להפשיר 5 מ"ל של 5x concanavalin פתרון, לדלל 1x עם מים, לסנן לעקר באמצעות מזרק מצויד מסנן 0.2 מיקרומטר.
- מסנן לעקר את כל הנוזלים האחרים שישמשו ב assay עם מסנן 0.2 מיקרומטר, כולל מדיה ניסיונית, כדי להסיר את כל גבישים או פסולת שאולי התממשו בפתרונות. נוכחותם של גבישים תפחית את איכות התמונות המיקרוסקופיות.
- פיפט 200 μL של concanavalin פתרון לתוך כל באר של צלחת מיקרוסקופ.
- צנטריפוגה הצלחת במשך 2 דקות ב 411 x כוח הכבידה(g)עם מוך- וסטטי ללא לנגב מתחת לצלחת, כדי להבטיח כי concanavalin פתרון מכסה באופן שווה את החלק התחתון של כל באר וכי אין בועות אוויר.
- מכסים את הצלחת עם המכסה שלה ולתת לו לשבת במשך 1-2 שעות. הזמן המדויק שבו הלוחית יושבת הוא גמיש, אך חשוב להיות עקבי בין ריצות שונות של הניסוי.
- הסר את כל concanavalin פתרון מהצלחת או על ידי יניקה או על ידי פריקה בכוח אותו לתוך הכיור או כלי קיבול. היזהר לא לגעת בחלק הזכוכית של הצלחת. זה מקובל אם כמה טיפות של concanavalin פתרון להישאר בבארות.
- לשטוף את בארות צלחת מיקרוסקופ על ידי הוספת 400 μL של מים סטריליים. הסר את המים כפי שנעשה עם concanavalin A בשלב הקודם. אל תתנו לצלחת לשבת יבשה.
- מיד להוסיף 185 μL מדיה צמיחה ניסיונית לתוך הצלחת. 15 μL של תאים מדוללים כראוי יתווספו לצלחת זו.
- דילול תאי שמרים
הערה: השלבים הבאים מתארים דילול של שמרים מתרבות רוויה (כ -108 תאים / מ"ל) פי 400 כדי להשיג ריכוז של 250,000 תאים / מ"ל, 15 μL מתוכם ידולל לתוך 400 μL בצלחת תחתית הזכוכית, נותן מספר סופי של כ 4000 תאים לבאר בצלחת 96-well. אם באמצעות צלחת 384-well המספר הסופי של תאים לכל באר צריך להיות כ 700 ואת דילול צריך להיות מותאם בהתאם. יחס זה צריך להיות מותאם עבור תאים שנאספו בשלב יומן, גדל במדיה עשירה או עניים יותר לפני הצמיחה, או זנים שונים. יש להפחית את הצפיפות הסופית של תאים לבאר בעת הפעלת מבחני קצב הגדילה לפרקי זמן ארוכים מ- 10 שעות.- הגדר שתי צלחות תרבות של 96 באר עבור דילול סדרתי: סמן כצלחת 1 ו- 2, והוסף מדיית צמיחה ניסיונית של 90 μL (כלומר, המדיה שבה יגדלו השמרים במיקרוסקופ) לכל צלחת דילול סדרתית.
הערה: לא משנה באיזה דילול סופי נעשה שימוש, מומלץ לפחות שני דילולים סדרתיים של תאים, שבכל אחד מהם נפח קטן של שמרים מועבר לנפח גדול יותר של מדיה ניסיונית ולאחר מכן נפח גדול של מדיה ניסיונית מעורבב במרץ עם צינור (כמו בשלבים 3.2.5 ו 3.2.6 להלן). - לאחזר את הצלחת של תאים טרום צמיחה צנטריפוגה הצלחת במשך 2 דקות ב 411 x g.
הערה: חשוב מאוד לא להצליב בארות שונות בצלחת. מטרת צעד צנטריפוגה זה לפני הסרת כיסוי נייר כסף מצלחות היא להבטיח כי טיפות מלא שמרים מבאר אחת לא לעוף את רדיד אלומיניום בסופו של דבר בארות אחרות. היזהר לעולם לא להטות או להתסיס את הצלחות כדי למנוע שמרים באים במגע עם נייר כסף כיסוי לאחר צנטריפוגה. - בזהירות לקלף בחזרה את נייר כסף resuspend תאים על ידי צינור נמרץ תאים עם צינור להגדיר כמחצית הנפח הכולל בצלחת תוך הזזת הצינור סביב הבאר לערבב. בדוק שכל התאים נוצל מחדש מתחתית הבארות.
- אם ייעשה שימוש בזנים מרובים בתוך בארות בודדות, יש לערבב זנים בשלב זה ביחס הדרוש לניסוי. אם זן התייחסות ישמש ליצירת מדידות קצב צמיחה, היחס בין התייחסות לזן הבדיקה צריך להיות 1:1.
- פיפט 10 μL של שמרים ממדיית צמיחה לתוך צלחת דילול 1. הוסף 100 μL של מדיה צמיחה ניסיונית לכל באר לנפח הסופי של 200 μL לבאר. פיפט למעלה ולמטה במרץ.
- פיפט 10 μL של שמרים מצלחת 1 לצלחת 2. הוסף 100 μL של מדיה צמיחה ניסיונית לכל באר, ו pipet למעלה ולמטה במרץ לערבב.
הערה: שלבי דילול אלה הם קריטיים כדי לעזור אשכולות נפרדים של שמרים כי הם תקועים יחד בסוף השלב טרום הצמיחה ולהבטיח כי מספר שווה בקירוב של תאי שמרים בסופו של דבר בכל באר. מספר עקבי של שמרים בכל באר מסייע בהסרת רעשים והטיות ניסיוניים במדידות קצב צמיחה (ראה תוצאות מייצגות).
- הגדר שתי צלחות תרבות של 96 באר עבור דילול סדרתי: סמן כצלחת 1 ו- 2, והוסף מדיית צמיחה ניסיונית של 90 μL (כלומר, המדיה שבה יגדלו השמרים במיקרוסקופ) לכל צלחת דילול סדרתית.
- סוניקציה (פירושונים)
הערה: Sonication הוא אופציונלי, ורק צריך להתבצע עבור זני שמרים שיש להם נטייה גבוהה לדבוק זה בזה (למשל, כמה זנים פראיים). עבור זנים במעבדה, sonication הוא בדרך כלל לא הכרחי, ניתן לדלג על ידי המשיך לשלב 3.4.- לחטא ראש sonicator 96 פינים עם 70% אתנול על ידי הצבת אותו בצלחת 96-well מלא 70% אתנול ויבש עם מוך- וסטטי ללא לנגב.
- הגדר תוכנית sonication כי הוא חזק מספיק כדי לפרק תאי שמרים flocculated, אבל לא הורג תאים או לגרום לתגובות מתח גבוהות. בדיקות מסוימות עשויות להידרש כדי לזהות את תוכנית sonication הטובה ביותר עבור ניסוי נתון. תוכנית sonication המשמש בניסוי זה היא: משרעת = 10, זמן תהליך = 10 s, דופק על = 1 s, דופק-off = 1 s. תוכנית מדויקת זו ככל הנראה אינה ישימה לכל sonicators כך בדיקות מוצע לפני יום הניסוי.
- מערבבים את השמרים בצלחת דילול סדרתי 2 פעם נוספת על ידי pipetting למעלה ולמטה במרץ חמש פעמים.
- מניחים צלחת דילול 2 על הפלטפורמה ולאבטח אותו עם סיכות sonicator במתלה התא אבל לא נוגע בתחתית הצלחת. הפעל את תוכנית sonication באמצעות הגנה על האוזן המתאימה.
- לאחר הפעלת התוכנית, לנקות את ראש sonicator עם 70% אתנול ולאחר מכן עם מים, ולאחר מכן מיד להמשיך להכנת צלחת מיקרוסקופ, כך התאים לא flocculate שוב.
- הכן צלחת למיקרוסקופ:
- Pipet 15 μL של שמרים מלוח דילול סדרתי 2 לתוך צלחת מיקרוסקופ לנפח של 200 μL. הוסף 200 μL של מדיה צמיחה ניסיונית לכל באר לנפח סופי של 400 μL לבאר, ו pipet למעלה ולמטה במרץ לערבב.
- מכסים את הצלחת בקרום נושם. חשוב לאטום את הצלחת היטב עם קרום זה, למשל באמצעות רולר גומי.
- כדי לדבוק בתאי השמרים ל concanavalin A על משטח הזכוכית, צנטריפוגה הצלחת עם מוך- וסטטי ללא לנגב מתחתיו במשך 2 דקות ב 411 x גרם.
- במיקרוסקופ, לנגב את החלק העליון והתחתון של הצלחת עם מוך- וסטטי ללא לנגב, ולפוצץ אוויר דחוס על הצלחת כדי להיפטר פסולת.
- מניחים את הצלחת על המיקרוסקופ, לוודא שהוא ברמה וכי הבאר A1 היא בפינה השמאלית העליונה.
4. מדידות קצב צמיחה של מיקרוסקופיה לשגות בזמן
הערה: במהלך מיקרוסקופיה של זמן לשגות התכונות הבאות נשלטות על-ידי המחשב: x, y, מיקום z, תריסים ומסנני פלואורסצנטיות. מערכת מיקוד אוטומטי מבוססת חומרה היא אופטימלית למניעת נדידת מישור מוקד במהלך הדמיה של זמן לשגות. לחלופין, ניתן להשתמש בלולאת התמקדות אוטומטית מבוססת תוכנה. כדי לשמור על לחות בתא המיקרוסקופ, מומלץ לשמור עם מים מטוהרים בתא לאורך כל הניסוי.
- צור רשימה של מיקומים (x,y) לתמונה, כך שכל באר לוח מיקרוסקופ תדמיע במלואה. הימנע מתמונות חופפות כך שאף תא לא ינותח מספר פעמים.
- תמונה בשדה בהיר עם תאורה דיאסקופית (DIA) בהגדלה של 15x. הגדר חשיפה ל- ~ 5 אלפיות השנייה.
- הגדל את התצוגה של התמונה באופן דיגיטלי כך שהתאים יהיו גלויים בבירור. השתמש ידיות התמקדות כדי לזהות את המוקד האידיאלי עבור הניסוי בארבע בארות בפינת הצלחת ובבאר אחת במרכז הצלחת. התמקד באופן כזה כדי לקבל ניגודיות מרבית של התאים.
- הגדר את מיקום z (או מיקום פוקוס אוטומטי) עבור הניסוי להיות ממוצע של עמדות z / פוקוס אוטומטי שזוהו עבור כל בארות אלה. אם צלחת המיקרוסקופ עשויה היטב ובתחתית הזכוכית אין פגמים, תנוחות המיקוד האידיאליות צריכות להיות דומות לכל באר.
הערה: בעת ניתוח תמונות עם עיבוד תמונות בקלות (PIE) צינור ניתוח תמונה11,12, זה מועיל עבור התאים להיות מעט מחוץ להתמקד במיקרוסקופ, כך שיש שפה כהה מחוץ לתא פנים בהיר, אשר מסייע זיהוי מושבה מדויק הערכות גודל. - אם אתם משתמשים בזנים פלואורסצנטיים, זהה את הערוצים ואת החשיפות שבהם לתמונה, וודא שלא נחשפו יתר על ה-50 פיקסלים. בעת הגדרת זמן חשיפה לערוצי פלואורסצנטיים, כבה את מצב "לכידה חיה" במיקרוסקופ כדי למנוע חשיפת תאים להתרגשות פלואורסצנטית לפרקי זמן ארוכים, שכן זה יכול גם לצלם את התאים ולגרום ללחץ.
- הגדר את רכישת רצף הזמן כדי ללכוד תמונות במרווח הזמן הרצוי למשך הזמן הרצוי.
- תריץ את הניסוי.
תוצאות
החידוש בפרוטוקול זה הוא שניתן לחשב את קצב הגדילה עבור תאים בודדים בתוך אוכלוסייה על ידי מעקב אחר צמיחתם למיקרוקולוניות באמצעות הדמיה של זמן לשגות (איור 2A). בגלל מיקרוקולוניות לגדול במשך שעות רבות באופן מישורי בשל נוכחותו של concanavalin A, האזורים שלהם ניתן לעקוב לאורך כל הניסוי,...
Discussion
הפרוטוקול המתואר כאן הוא מבחנים רב-תכליתיים המאפשרים מעקב אחר צמיחת תאים וביטוי גנים בו זמנית ברמה של מיקרוקולוניות בודדות. שילוב שתי שיטות אלה מניב תובנות ביולוגיות ייחודיות. לדוגמה, עבודה קודמת השתמשה ב- assay זה כדי להראות מתאם שלילי בין ביטוי של הגן TSL1 לבין קצב הצמיחה של מיקרו-מושבה ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לנעמי זיו, סשה לוי ושואנג לי על תרומתם לפיתוח פרוטוקול זה, לדוד גרשם על הציוד המשותף, ומריסה קנול על העזרה בהפקת וידאו. עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות מענק R35GM118170.
Materials
| Name | Company | Catalog Number | Comments |
| General Materials | |||
| 500 mL Bottletop Filter .22 µm PES Sterilizing, Low Protein Binding, w/45mm Neck | Fisher | CLS431154 | used to filter the media |
| BD Falcon*Tissue Culture Plates, microtest u-bottom | Fisher | 08-772-54 | 96-well culture tubes used to freeze cells, pre-grow cells, and dilutions |
| BD Syringes without Needle, 50 mL | Fisher | 13-689-8 | Used to filter the Concanavalin A |
| Costar Sterile Disposable Reagent Reservoirs | Fisher | 07-200-127 | reagent reservoirs used to pipette solutions with multichannel pipette |
| Costar Thermowell Aluminum Sealing Tape | Fisher | 07-200-684 | 96-well plate seal for pre-growth and freezing |
| lint and static free Kimwipes | Fisher | 06-666A | lint and static free wipes to keep microscope plate bottom free of debris and scratches |
| Nalgene Syringe Filters | ThermoFisher Scientific | 199-2020 | 0.2 μm pore size, 25 mm diameter; used to filter concanavalin A solution |
| Media Components | |||
| Minimal chemically defined media (MD; 2% glucose) | alternative microscopy media used for yeast pre-growth and growth during microscopy | ||
| Synthetic Complete Media (SC; 2% glucose) | microscopy media used for yeast pre-growth and growth during microscopy | ||
| Yeast extract-peptone-dextrose (YEPD; 2% glucose) medium | cell growth prior to freezing down randomized plates | ||
| Microscopy Materials | |||
| Breathe-Easy sealing membrane | Millipore Sigma | Z380059-1PAK | breathable membranes used to seal plate during microscopy experiment. At this stage breathable membranes are recommended because they prevent condensation in the wells and allow for better microscopy images |
| Brooks 96-well flat clear glass bottom microscope plate | Dot Scientific | MGB096-1-2-LG-L | microscope plate |
| Concanavalin A from canavalia ensiformis (Jack Bean), lyophilized powder | Millipore Sigma | 45-C2010-1G | Make 5x concanavalin A solution and freeze 5ml of 5x concanavalin A in 50 mL conical tubes at -80 °C |
| Strains Used | |||
| MAH.5, MAH.96, MAH.52, MAH.66, MAH.11, MAH.58, MAH.135, MAH.15, MAH.44, MAH.132 | Haploid mutation accumulation strains in a laboratory background, described in Hall and Joseph 2010 | ||
| EP026.2A-2C | Progeny of the ancestral Hall and Joseph 2010 mutation accumulation strain, transformed with YFR054cΔ::Scw11P::GFP | ||
| Equipment | |||
| Misonix Sonicator S-4000 with 96-pin attachment | Sonicator https://www.labx.com/item/misonix-inc-s-4000-sonicator/4771281 | ||
| Nikon Eclipse Ti-E with Perfect Focus System | Inverted microscope with automated stage and autofocus system |
References
- Geiler-Samerotte, K. A., Hashimoto, T., Dion, M. F., Budnik, B. A., Airoldi, E. M., Drummond, D. A. Quantifying condition-dependent intracellular protein levels enables high-precision fitness estimates. PloS one. 8 (9), 75320 (2013).
- Kussell, E., Leibler, S. Phenotypic diversity, population growth, and information in fluctuating environments. Science. 309 (5743), 2075-2078 (2005).
- Thattai, M., van Oudenaarden, A. Stochastic gene expression in fluctuating environments. Genetics. 167 (1), 523-530 (2004).
- King, O. D., Masel, J. The evolution of bet-hedging adaptations to rare scenarios. Theoretical population biology. 72 (4), 560-575 (2007).
- Acar, M., Mettetal, J. T., van Oudenaarden, A. Stochastic switching as a survival strategy in fluctuating environments. Nature genetics. 40 (4), 471-475 (2008).
- Avery, S. V. Microbial cell individuality and the underlying sources of heterogeneity. Nature reviews. Microbiology. 4 (8), 577-587 (2006).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS biology. 10 (5), 1001325 (2012).
- van Dijk, D., et al. Slow-growing cells within isogenic populations have increased RNA polymerase error rates and DNA damage. Nature communications. 6, 7972 (2015).
- Ziv, N., Shuster, B. M., Siegal, M. L., Gresham, D. Resolving the Complex Genetic Basis of Phenotypic Variation and Variability of Cellular Growth. Genetics. 206 (3), 1645-1657 (2017).
- Li, S., Giardina, D. M., Siegal, M. L. Control of nongenetic heterogeneity in growth rate and stress tolerance of Saccharomyces cerevisiae by cyclic AMP-regulated transcription factors. PLoS genetics. 14 (11), 1007744 (2018).
- Plavskin, Y., Li, S., Ziv, N., Levy, S. F., Siegal, M. L. Robust colony recognition for high-throughput growth analysis from suboptimal low-magnification brightfield micrographs. bioRxiv. , (2018).
- Ziv, N., Siegal, M. L., Gresham, D. Genetic and nongenetic determinants of cell growth variation assessed by high-throughput microscopy. Molecular biology and evolution. 30 (12), 2568-2578 (2013).
- Hall, D. W., Joseph, S. B. A high frequency of beneficial mutations across multiple fitness components in Saccharomyces cerevisiae. Genetics. 185 (4), 1397-1409 (2010).
- Saleemuddin, M., Husain, Q. Concanavalin A: a useful ligand for glycoenzyme immobilization--a review. Enzyme and microbial technology. 13 (4), 290-295 (1991).
- Geiler-Samerotte, K. A., Bauer, C. R., Li, S., Ziv, N., Gresham, D., Siegal, M. L. The details in the distributions: why and how to study phenotypic variability. Current opinion in biotechnology. 24 (4), 752-759 (2013).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biological reviews of the Cambridge Philosophical Society. 85 (4), 935-956 (2010).
- Bolker, J. A. Exemplary and surrogate models: two modes of representation in biology. Perspectives in biology and medicine. 52 (4), 485-499 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved