Method Article
הכנת עוברי עוף אקס אובו וכלי קרום כוריואלנטואיים כמודל In Vivo להדמיית אולטרסאונד משופר ניגודיות ומחקרי אספקת תרופות בתיווך מיקרו-בועות
In This Article
Summary
פרוטוקול זה מתאר שלוש שיטות כיצד להשיג ולהשתמש בעוברי עוף בני 5 עד 8 ימים ובממברנה הכוריאואלנטואית שלהם (CAM) כמודל in vivo לחקר הדמיית אולטרסאונד משופרת ניגודיות ואספקת תרופות בתיווך מיקרו-בועות.
Abstract
עובר העוף והממברנה הכוריאואלנטואית העשירה בכלי הדם (CAM) הם מודל in vivo רב ערך לחקר תהליכים ביו-רפואיים, תוכניות פעימות אולטרסאונד חדשות, או מתמרים חדשניים להדמיית אולטרסאונד משופרת בניגוד ואספקת תרופות בתיווך מיקרו-בועות. הסיבות לכך הן הנגישות של רשת העוברים וכלי הדם של ה- CAM וכן העלויות הנמוכות של המודל. צעד חשוב כדי לקבל גישה לעוברים וכלי CAM הוא להוציא את תכולת הביצים מתוך קליפת הביצה. בפרוטוקול זה מתוארות שלוש שיטות להוצאת תוכן קליפת הביצה בין יום 5 ל-8 של הדגירה ובכך מאפשרות לעוברים להתפתח בתוך קליפת הביצה עד לימים אלה. השיטות המתוארות דורשות רק כלים וציוד פשוטים ומניבות שיעור הצלחה הישרדותי גבוה יותר של 90% עבור 5 ימים, 75% עבור 6 ימים, 50% עבור 7 ימים ו-60% עבור ביציות דגירה בנות 8 ימים בהשוואה לעוברים מתורבתים ex ovo (~50%). הפרוטוקול מתאר גם כיצד להזריק גרעיני קוויטציה, כגון מיקרו-שבבים, למערכת כלי הדם של CAM, כיצד להפריד את הממברנה המכילה את העובר וה-CAM משאר תכולת הביצית לצורך מחקרים שקופים אופטית, וכיצד להשתמש בעובר התרנגולת וב-CAM במגוון ניסויי אולטרסאונד קצרי טווח. מודל ה- in vivo chicken embryo ו- CAM רלוונטי ביותר כדי לחקור פרוטוקולי הדמיה חדשניים, חומרי ניגוד אולטרסאונד ותוכניות פעימות אולטרסאונד להדמיית אולטרסאונד משופרת בניגוד, ולפענח את המנגנונים של אספקת תרופות בתיווך אולטרסאונד.
Introduction
עוברי עוף לשעבר של אובו והממברנה הכוריואלנטואית העשירה בכלי הדם (CAM) הוכיחו את עצמם כמודל מתאים לחקור תהליכים ביולוגיים וביו-רפואיים שונים כמו אמבריוגנזה, אונקולוגיה ואספקת תרופות 1,2,3,4. אולטרסאונד שימש להדמיה של התפתחות הלב העוברי4,5 ולהפעלת גרעיני קוויטציה בעת הזרקה, כגון מיקרו-שבבים, למתן תרופות וסקולריות 6,7. עוברי עוף הם זולים, דורשים פחות תשתיות וציוד, ויש להם חקיקה פחות קפדנית בהשוואה למודלים אחרים של בעלי חיים8. עוברי התרנגולות וכלי ה-CAM נגישים בקלות לאחר פתיחת הביצית, בעוד שהדבר מתגלה כקשה הרבה יותר עם עוברים וכלי דם של יונקים. מלבד זאת, עובר העוף וכלי ה- CAM מספקים פעימות לב וזרימת דם פועמת. ה-CAM מראה קווי דמיון באנטומיה של כלי שיט עם יונקים וניתן להשתמש בו לבדיקת סמים 8,9,10. בגלל מאפיינים אלה, כלי CAM הוכיחו גם להיות מודל מתאים לחקור הדמיית אולטרסאונד משופרת ניגודיות (CEUS)11,12,13,14,15,16. בנוסף, המודל יכול לשמש כדי לחקור באופן אופטי את ההתנהגות של חומרי ניגוד אולטרסאונד בשדה אולטרסאונד באמצעות מצלמה במהירות גבוהה במיוחד ואת ההשפעה של כוח קרינה אקוסטית על הנעה, קשירה ואקסטרווזיה של תרופות 7,17,18,19. למרות שעובר העוף וה-CAM פחות מתאימים לניסויים ארוכי טווח, הם יכולים להועיל לניסויים קצרי טווח in vivo.
כדי להגביר את הנראות והשליטה על עובר התרנגולת ועל CAM במהלך הניסויים, חשוב להוציא את תכולת הביציות המכילה את העובר וה-CAM מתוך קליפת הביצה18. מחקרים קודמים בעוברי עוף שכללו חומרי ניגוד באולטרסאונד השתמשו בעוברים בני 5 עד 6 ימים 7,11,12,17,19 ובעוברים בני 14 עד 18 יום13,14,15,16. מספר גישות תוארו בפירוט כדי להוציא את תכולת הביצים מהקליפה 18,20,21. עם זאת, למיטב ידיעתנו, הגישות שפורסמו בעבר מתמקדות בהוצאת תכולת הביצים מקליפת הביצה לאחר 3 ימי דגירה (כלומר, Hamburger & Hamilton (HH) שלב 19-2022), ולהמשיך את התרבות ex ovo. לגישה זו של תרבית אובו לשעבר יש חסרונות רבים, כולל סיכון מוגבר לתמותה במהלך התרבית (~50%)1,18, שימוש באנטיביוטיקה18,20, וירידה באורך כלי הדם הכולל בהשוואה לגידול ב-ovo 23. מכיוון שהתרבות העובר בתוך קליפת הביצה מספקת את הסביבה הטבעית ביותר, הכי קל לדגור את העובר בתוך קליפת הביצה עד ליום הניסוי. מסיבה זו, גישה שבה מוציאים את תכולת הביצה מקליפת הביצה ב-5 עד 8 ימי דגירה תועיל במיוחד לניסויים בעוברים בני 5 עד 8 ימים.
בפרוטוקול זה אנו מתארים שלוש שיטות להוצאת תכולת הביצה מקליפת הביצה כאשר העובר נמצא ביום 5 עד 8 להתפתחות (HH 26-3522) ומאפשרות לעובר להתפתח בתוך קליפת הביצה עד ליום הניסוי. גודל כלי ה-CAM נע בין קוטר של 10-15 מיקרומטר, בנימים הקטנים יותר של עובר בן 8 ימים בן 24, לקוטר של 115-136 מיקרומטר בכלי הגדול יותר של 6 ועוברים בני 8 ימיםשל 24,25. שלוש השיטות המתוארות דורשות רק כלי מעבדה בסיסיים ומפחיתות את הסיכון לסיבוכים לפני תחילת הניסוי, ובכך מפחיתות עלויות ועבודה מיותרות. אנו גם מפרטים שיטה להפרדת הממברנה המכילה את העובר וה-CAM מתוך שק החלמון מה שהופך את ה-CAM לשקוף אופטית לצורך מחקרי מיקרוסקופיה. מכיוון שניתן להצמיד את הממברנה המכילה את העובר ואת ה-CAM למשל למחזיק עם ממברנה אקוסטית, ניתן גם להפוך את הממברנה לשקופה אקוסטית26, מה שמאפשר שילוב של מחקרי מיקרוסקופיה ואולטרסאונד כאשר נתיב האור יושפע מהחלמון. לבסוף, אנו מתארים מספר הגדרות אולטרסאונד אחרות שניתן להשתמש בהן עבור אולטרסאונד או הדמיה CEUS.
Protocol
כל הניסויים בבעלי חיים נערכו בהתאם לחוק הולנד לניסויים בבעלי חיים ובהתאם למועצה האירופית (2010/63/EU) בנושא הגנה על שימוש בבעלי חיים למטרות מדעיות.
1 . פרוטוקול הכנת עוברים
- דגירה של ביצי עוף מופרות
- אחסנו ביצי עוף מופרות טריות בטמפרטורה של 15 מעלות צלזיוס למשך עד שבוע.
- כדי לדגור על הביצים המופרות, הניחו אותן אנכית עם הצד המחודד כלפי מטה לתוך אינקובטור 37 מעלות צלזיוס, לחות. הפיכת הביצים במהלך הדגירה אינה הכרחית.
הערה: כתוב את תאריך תחילת הדגירה של החלק העליון של הביצה באמצעות סמן קבוע.
- הכנה עד 5 ימים (120 שעות) של עוברים ישנים (שלב HH 26-28)22
- הכנת אזור עבודה
- מחממים צלחת חימום ל-37 מעלות צלזיוס.
- הניחו על לוח החימום מחזיק ביצי מתכת (איור 1A,B), מחזיק סירת שקילה ממתכת (איור 1C,D) ו-Erlenmeyer בגודל 10 מ"ל מלא ב-PBS.
- מלאו סירת שקילה (85 מ"מ × 85 מ"מ × 25 מ"מ) בשכבה של 10 מ"מ של ג'ל אולטרסאונד והניחו את סירת השקילה המלאה במחזיק סירת השקילה המתכתית שחוממה מראש.
הערה: מילוי סירת השקילה בג'ל אולטרסאונד יעלה את העובר ואת CAM. זה יכול להועיל להזרקה או הדמיה של העובר וה-CAM, אך אינו הכרחי להוצאת העובר וה-CAM מקליפת הביצה. - מכינים כמה חתיכות נייר דבק (באורך של כ-3 ס"מ) כשחלק מקצה אחד מקופל לאחור על עצמו כך שלא נדבק יותר.
- הוצאת תכולת הביצה מקליפת הביצה
- קחו ביצית מופרית בת 5 ימים והעבירו אותה למחזיק ביצת המתכת שחוממה מראש (איור 1A,B). הקפידו לשמור על הביצה באותו כיוון (כלומר, תאריך למעלה).
הערה: חשוב לשמור על הביצית באותו כיוון כדי לשמור על שק האוויר ועל העובר וה-CAM באותו מיקום בחלק העליון של הביצית. - השתמש בגב המחודד של פינצטה (או דומה; איור 1E) כדי ליצור כניסה קטנה בחלק העליון של הביצה (היכן שהתאריך כתוב) (איור 2A).
- השתמשו בחלק האחורי המחודד של הפינצטה כדי לבצע כניסה שנייה בצד הביצית בסביבות 2/3 במורד הביצה (איור 2B).
הערה: היזהר לא להפוך את הכניסה לגדולה מדי וליצור חור. אם במקרה נוצר חור, אטמו את החור בנייר דבק ואל תבצעו כניסה נוספת. - בעזרת הפינצטה הגדולה יותר (איור 1E), הוציאו חתיכה קטנה של קליפת ביצה מהאזור המוסט מעל הביצה (עם תאריך כתוב). יש לוודא ששק האוויר בחלק העליון של קליפת הביצה יוצר מגע עם האוויר שמחוץ לביצה, אך לא לחדור את הקליפה עמוק מדי.
הערה: אם הקונכייה חודרת עמוק מדי בעת ביצוע הכניסה העליונה, העובר וה-CAM עלולים להינזק והעובר לא ישרוד את ההסרה מהקליפה. חשוב שהחור הקטן בחלק העליון ייצור קשר אוויר בין החלק הפנימי והחיצוני של הביצה. אם זה לא נעשה, ייווצר ואקום בשלבים הבאים של ההליך אשר יגרום לבועות אוויר גדולות להילכד מתחת ל- CAM מה שהופך את העובר ואת ה- CAM לחסרי תועלת. כדי לבדוק את מיקום שק האוויר בתוך הביצה, ניתן להשתמש במקור אור מכיוון שמיקומו לא תמיד בדיוק בחלק העליון ויכול להיות גם יותר בצד. - השתמשו במזרק של 5 מ"ל ובמחט של 19 גרם כדי לחדור את הקליפה דרך הכניסה השנייה בצד 2/3 במורד הביצה ולמשוך ~2 מ"ל של חלבון ביצה (איור 2C).
הערה: ודא שהמחט מכוונת כלפי מטה לכיוון תחתית הביצית כדי למנוע סיכוי לפגיעה בעובר וב- CAM. שלב זה יוצר כיס אוויר גדול יותר בחלק העליון של הביצה הדרוש להסרת תכולת הביצה. אם נוצר בטעות חור במקום כניסה בשלב 1.2.2.3, נקב את הקלטת עם המחט לנסיגה של לבן הביצה. אטמו מחדש את הנקב עם פיסת נייר דבק נוספת. - הוציאו את המחט והשתמשו בנייר דבק כדי לאטום את הרווח בצד (איור 2D).
הערה: כדי למנוע דליפה של חלבון ביצה מתוך הביצה, ניתן לסגור את החור העליון באמצעות אצבע לפני הוצאת המחט. אם חלבון הביצה ממשיך לדלוף החוצה כשהקלטת כבר במקום, יש להסיר תחילה את חלבון הביצה עם פיסת טישו כדי לוודא שהקלטת נדבקת כראוי. - מרוקנים את המזרק על ידי הוספת חלבון הביצה לסירת השקילה.
- השתמשו בפינצטה הגדולה (איור 1E) כדי להגדיל את הפתח הקטן בחלק העליון של הביצה (איור 2E). כאשר מסתכלים לתוך הביצית דרך הפתח בחלק העליון, העובר וה- CAM נראים לעין. המשיכו לאתר את העובר ואת ה-CAM תוך שאתם לוקחים כמה שיותר מקליפות הביצה (איור 2F).
הערה: המשך להזיז את הביצית כדי לשמור על נראות מרבית על מיקום העובר וה-CAM בתוך הקליפה. ודא שקצה הפתח במעטפת אינו יורד נמוך יותר מה- CAM. מלבד זאת, אין לחדור את הקרום הפנימי ולמנוע קצוות חדים. - לאחר יצירת הפתח, סובבו את הביצה בזווית של 180° והחזירו את הביצה למחזיק הביצה באופן כזה שהפתח שנוצר בחלק העליון של הביצה פונה כעת לכיוון החלק התחתון. העובר יצוף למעלה ויהפוך לבלתי נראה מלמטה (איור 2G) מה שלוקח 1-2 דקות. ודאו שכל העובר וה-CAM (כולל כל כלי הדם) נעלמו ורק החלמון נראה לעין לפני שתמשיכו לשלב הבא (איור 2H).
הערה: אם העובר עדיין נראה מלמטה לאחר 2 דקות, סובב את הביצית בכיוון השעון למשך 1-2 דקות. זה יעזור לעובר ול- CAM לצוף למעלה. - הסר את הקלטת מהפתח הצדדי. בדקו אם החלק הפנימי של הביצה בולט כעת מתוך הפתח התחתון. אם זה המקרה, המשך לשלב הבא. אם לא, השתמש במחט על המזרק כדי לנקב את הפתח בצד פעם נוספת כדי לשחרר את הוואקום בביצה. הקפידו להצביע כלפי מעלה עם המחט כדי למנוע סיכוי לנקב את שק החלמון. ממשיכים עד שהביצה בולטת מתוך הפתח התחתון.
- בזמן שאתם מחזיקים את תחתית הביצה קרוב לסירת השקילה במחזיק סירת השקילה המתכתית (איור 1C,D), יוצרים שריטה אופקית עדינה אך מהירה בקרום על פני כל רוחב הפתח באמצעות אחת הנקודות החדות של הפינצטה הקטנה (איור 1F) ומפילים בעדינות את תכולת הביצה לתוך סירת השקילה (איור 2I).
הערה: אם תכולת הביצה לא יוצאת, השתמש במחט שעל המזרק כדי לנקב שוב את הפתח הצדדי כשהמחט מצביעה כלפי מעלה. - אם העובר נמצא בסירת השקילה לצדדים, הוא בדרך כלל יעלה מעצמו. אם זה לא קורה, השתמש בפיסת נייר טישו כדי למקם מחדש את העובר. שים צד אחד של נייר הטישו על העובר, גרור את נייר הרקמה לקצה השני, ושחרר את נייר הטישו עם כמה טיפות של ~ 30 μL של PBS (37 מעלות צלזיוס) באמצעות פיפט פסטר פלסטיק.
- בדוק חזותית אם העובר חי על ידי וידוא פעימות הלב עדיין קיים, כלי CAM שלמים ואין דימום, ואין דליפה של חלמון. אם אחד מהדברים האלה לא נכון, להשליך את העובר ואת CAM כי זה לא יהיה בר קיימא.
- וודאו שהעובר וה-CAM נשמרים בטמפרטורה של 37 מעלות צלזיוס ולא יתייבשו כי זה יגרום לכלי ה-CAM להתדרדר ובסופו של דבר העובר ימות. כדי למנוע זאת, באופן קבוע לשים טיפות קטנות של ~ 30 μL של 37 ° C PBS על העובר ו- CAM.
- קחו ביצית מופרית בת 5 ימים והעבירו אותה למחזיק ביצת המתכת שחוממה מראש (איור 1A,B). הקפידו לשמור על הביצה באותו כיוון (כלומר, תאריך למעלה).
- הכנת אזור עבודה
- הכנת עוברים בני 6 עד 7 ימים (144-168 שעות) (שלב HH 28-32)22
- הכנת אזור עבודה
- הכן את השלב כמתואר בסעיף 1.2.1.
- הוצאת תכולת הביצה מקליפת הביצה
- שעתיים לפני הניסוי, קחו ביצת דגירה בת 6 עד 7 ימים וסובבו את הביצה ב-180° בתוך האינקובטור כך שהחלק העליון של הביצה פונה לכיוון החלק התחתון. לאחר שעה, סובבו את הביצה בחזרה למקומה המקורי והשאירו למשך שעה נוספת.
הערה: סיבוב הביצה שעתיים לפני הניסוי יקל על הוצאת תכולת הביצה מהקליפה. - לאחר סיבוב, לקחת את הביצה מן האינקובטור.
- בצע את שלב 1.2.2.2 עד שלב 1.2.2.4.
- השתמשו במזרק של 5 מ"ל ובמחט של 19 גרם כדי לחדור את הקליפה דרך הכניסה השנייה בצד 2/3 במורד הביצה ולמשוך בין 5-6 מ"ל של חלבון ביצה. מוודאים שהמחט מכוונת כלפי מטה לכיוון תחתית הביצה.
הערה: עם מזרק 5 מ"ל שבו השתמשנו, ניתן למשוך עד 6 מ"ל ולכן יש צורך בחדירה אחת בלבד. - הוציאו את המחט והשתמשו בפיסת נייר דבק כדי לאטום את הרווח בצד (איור 2D).
- רוקנו את המזרק על ידי הוספת חלבון הביצה לג'ל האולטרסאונד בסירת השקילה.
- השתמשו בפינצטה הגדולה (איור 1E) כדי להגדיל את הפתח הקטן בחלק העליון של הביצה (איור 2E). נסו להפוך את הפתח לגדול ככל האפשר אך וודאו שקצה הפתח במעטפת אינו יורד נמוך יותר מה-CAM. מלבד זאת, אין לחדור את הקרום הפנימי ולנסות למנוע קצוות חדים.
- מלא מזרק עם ~ 1 מ"ל יותר של 37 °C PBS מאשר נפח נסוג במהלך שלב 1.3.2.4.
- הסר את הקלטת מהפער הצדדי, חודר את הפער עם המזרק המלא, ורוקן אותו לתוך הקליפה. מוודאים שהמחט מכוונת כלפי מטה לכיוון תחתית הביצה.
הערה: מאחר שלחלבון ביצה יש צמיגות גבוהה יותר (~160 cP)27 מאשר PBS (~1 cP), החלפת חלבון הביצה ב-PBS מפחיתה הן את המתח והן את הלחץ על העובר ועל ה-CAM תוך הוצאת תכולת הביצה מהקליפה. - הוציאו את המחט ואטמו מחדש במהירות את המרווח בעזרת פיסת סרט הדבקה (איור 2D).
- סובבו את הביצה ב-180° והחזירו את הביצה למחזיק הביצה באופן כזה שהפתח שנוצר בחלק העליון של הביצה פונה כעת לכיוון החלק התחתון. הופכים את הביצית בכיוון השעון עד שכל העובר וה-CAM (כולל כל כלי הדם) נעלמו ורק החלמון נראה לעין.
- בצע את שלב 1.2.2.10 עד שלב 1.2.2.14.
- שעתיים לפני הניסוי, קחו ביצת דגירה בת 6 עד 7 ימים וסובבו את הביצה ב-180° בתוך האינקובטור כך שהחלק העליון של הביצה פונה לכיוון החלק התחתון. לאחר שעה, סובבו את הביצה בחזרה למקומה המקורי והשאירו למשך שעה נוספת.
- הכנת אזור עבודה
- הכנת עוברים ישנים בני 8 ימים (192 שעות) (שלב HH 32-35)22
- הכנת אזור עבודה
- מחממים צלחת חימום ל-37 מעלות צלזיוס.
- הניחו על לוח החימום מחזיק סירת שקילה ממתכת (איור 1C,D) ו-Erlenmeyer בגודל 10 מ"ל מלא ב-PBS.
- קח מיכל רדוד של 170 x 110 x 70 מ"מ, או דומה, ומלא את המיכל עם 1 L של 37 °C PBS.
- מניחים סירת שקילה (85 × 85 × 25 מ"מ) בצלחת פטרי בקוטר 90 מ"מ. הניחו את צלחת הפטרי ואת סירת השקילה בתחתית המכולה וודאו שהם שקועים לחלוטין.
- הוצאת תכולת הביצה מקליפת הביצה
- שעתיים לפני הניסוי, קחו ביצת דגירה בת 8 ימים וסובבו את הביצה ב-180° בתוך האינקובטור כך שהחלק העליון של הביצה פונה לכיוון החלק התחתון. לאחר שעה, סובבו את הביצה בחזרה למקומה המקורי והשאירו למשך שעה נוספת.
הערה: סיבוב הביצה שעתיים לפני הניסוי יקל על הוצאת תכולת הביצה מהקליפה. - קח ביצית דגירה בת 8 ימים מהאינקובטור.
- החזיקו את הביצה בצורה אופקית והשתמשו בגב המחודד של הפינצטה הגדולה (איור 1E) כדי ליצור כניסה קטנה 1/2 במורד הביצה. ממשיכים ליצור כניסות קטנות בתבנית טבעת 360° סביב קליפת הביצה. השתמש בריווח של ~ 10 מ"מ בין הכניסות.
הערה: במהלך הליך זה, סדקים קטנים יכולים להתחיל להיווצר בין הכניסות. - לאחר יצירת הכניסות הקטנות מסביב לקליפה, צור חור אחד גדול יותר על ידי פיצוח הקליפה בין שתי כניסות קטנות באמצעות הגב המחודד של הפנצנוץ הגדול.
- לטבול לחלוטין את הביצה ב 37 מעלות צלזיוס PBS ולשמור אותו שקוע במשך 5 דקות. לאחר 5 דקות, לשמור את הביצה קרוב לסירת השקילה בתוך המכולה. מכניסים את החלק העליון של שני האגודלים לחור הגדול ופותחים בעדינות את הביצה. הביצה תיסדק לאורך הכניסות הקטנות.
- כאשר הסדק נוצר כל הדרך סביב קליפת הביצה, נסו בעדינות להפריד בין שתי חתיכות קליפת הביצה והמשיכו להזיז בעדינות את שתי החתיכות קדימה ואחורה עד שתכולת הביצה מופרדת מהקליפה. לאחר מכן, מפילים בעדינות את תכולת הביצה לתוך סירת השקילה.
הערה: על ידי הזזת שתי חתיכות קליפת הביצה קדימה ואחורה, יותר PBS יזרום לתוך קליפת הביצה, מה שיעזור להפריד את תכולת הביצה מהקליפה. לפעמים, מעט חלבון ביצה יידבק לחלק הפנימי של קליפת הביצה. כשזה קורה, השתמשו בפינצטה כדי להפריד בין חלבון הביצה לקליפה. - הרימו באיטיות את צלחת הפטרי המכילה את סירת השקילה ותכולת הביצים מה-PBS. כאשר מחוץ ל- PBS, הטה מעט את סירת השקילה כדי להסיר את עודף ה- PBS.
- מניחים את סירת השקילה המכילה את תכולת הביצים במחזיק סירת השקילה המתכתית ועוברים למערך הניסוי הרצוי.
- שעתיים לפני הניסוי, קחו ביצת דגירה בת 8 ימים וסובבו את הביצה ב-180° בתוך האינקובטור כך שהחלק העליון של הביצה פונה לכיוון החלק התחתון. לאחר שעה, סובבו את הביצה בחזרה למקומה המקורי והשאירו למשך שעה נוספת.
- הכנת אזור עבודה
2. יישומים נבחרים
- הזרקת מיקרו-שבבים ו/או תמיסות אחרות לכלי ה-CAM
- הכנת מערך ההזרקה
- משוך מחטי זכוכית מצינורות נימי זכוכית באמצעות מיקרו-זיוף (איור 3A) או קנה מחטים נימי זכוכית משוכות.
- במקרה שקצה מחט נימי הזכוכית אינו משופע, יש לשבור חלק קטן מקצה המחט. ממלאים את מחט הזכוכית בשמן מינרלי ומניחים אותה במערכת הזרקת מיקרו. וודאו שאין בועות אוויר בשמן המינרלי במחט הזכוכית.
הערה: השמן המינרלי מתווסף בהתאם להוראות היצרן של מערכת ההזרקה בה השתמשנו. - רוקנו את מחט הנימים מזכוכית משוכה ככל שמערכת ההזרקה הזעירה מאפשרת ומלאו חלקית את מחט הזכוכית באוויר.
הערה: מעט האוויר ימנע את התערובת של השמן המינרלי ואת התמיסה המוזרקת. - שים 10 μL של התמיסה הרצויה, בפרוטוקול זה microbubbles, על חתיכת סרט שעווה (איור 3B). אם יש צורך ביותר מפתרון אחד, ניתן לערבב פתרונות לפני צנרת7.
הערה: לפני מילוי המחט ב-microbubbles, השאירו את טיפת ה-microbubble על סרט השעווה למשך ~1 דקה, כך שה-microbubbles יצופו לראש הטיפה ויתרכזו. עבור סוכן ניגודיות אולטרסאונד מותאם אישית מסוג F28, שלב ריכוז זה יגדיל את ריכוז המיקרו-בועות המוזרק עם ~ 30%. ריכוז העופות בדם עוברי העוף לאחר ההזרקה יהיה בין 32 x 10 3 מיקרו-באבל/μL לעוברים בני 5 ימים ו-19 x 103 מיקרו-באבלים/μL לעוברים בני 6 ימים. - מלאו את מחט הזכוכית במיקרו-בועה ו/או בתמיסה אחרת על ידי מיקום קצה מחט הזכוכית לתוך הטיפה שעל סרט השעווה. כשאתם שואפים מיקרו-שבבים, הקפידו למקם את קצה המחט בחלק העליון של טיפת הנוזל כדי לשאוף את התמיסה המועשרת במיקרו-בועות.
הערה: לפני הזרקת מיקרו-שבבים, הרימו את קצה מחט הזכוכית לנקודה הגבוהה ביותר שלה והמתינו ~2 דקות. זה יבטיח שהמיקרו-שבבים יתרכזו בקצה מחט הזכוכית.
- הכנת מערך ההזרקה
- הזרקה לתוך כלי CAM
- לפני ההזרקה, התבונן ב- CAM תחת מיקרוסקופ סטריאו ובחר את כלי ההזרקה הטוב ביותר. תמיד להזריק לאחד הוורידים של העובר. אלה הם כלי הדם שבהם זרימת הדם נעה לכיוון העובר. הוורידים בצבעים בהירים יותר מהעורקים בשל הדם המחומצן29. בנוסף, ורידים נמצאים תמיד בחלק העליון של העורק, עם שני יוצאים מן הכלל: הוורידים הקדמיים והאחוריים (כלומר, הוורידים המסועפים פחות, המסומנים בכוכביות באיור 6A,B) שאין להם עורק בסביבתם.
הערה: הזרקה לאחד הענפים תגביל את חסימת זרימת הדם במהלך ההזרקה. אתרי הזרקה טובים צוינו עם ראשי חץ באיור 6A,B. זה חיוני להזריק לתוך הווריד, שכן זה יאלץ את החומר המוזרק לזרום לכיוון העובר. מלבד זאת, הזרקה לעורק תגרום לדימום מסיבי בעת הסרת מחט הזכוכית אשר תהרוג את העובר. - מקם את מחט הזכוכית ואת העובר באופן כזה שקצה מחט הזכוכית והווריד שנבחר נמצאים באותו מישור מוקד ובאותו קו כיוון. נסו למקם את המחט אופקית ככל האפשר במקביל לווריד שנבחר. קצה המחט צריך לגעת בדופן כלי השיט.
הערה: על ידי מיקום מחט הזכוכית אופקית ככל האפשר, הסיכוי לחדור דרך הכלי כולו נמוך יותר. - לאחר המיקום, להתקדם לאט לחדור את דופן כלי השיט עם מחט הזכוכית. במהלך החדירה, ה- CAM יידחף תחילה על ידי תנועת מחט הזכוכית. ממשיכים לקדם את מחט הזכוכית עד לחדירה לדופן כלי הדם.
הערה: אם במקרה כלי השיט מנוקב דרך ודרך, לאט לאט לסגת את המחט כדי לחזור לתוך לומן. כאשר חוזרים לתוך הלומן, מרימים מעט את המחט למעלה ונעים קדימה לאורך כלי הדם כדי למקם מחדש את המחט. - לאחר החדירה, נסוג מעט ממחט הזכוכית כדי למקם טוב יותר את הקצה בתוך לומן כלי הדם והזז את מחט הזכוכית הצידה כדי לבדוק שהיא אינה מחוברת לדופן הכלי. הזריקו באיטיות כמות קטנה של התמיסה כדי לאשר שהקצה ממוקם בתוך לומן כלי הדם (איור 3C).
- ודא שהתמיסה המוזרקת עוקבת אחר זרימת הדם. אם לא, הזיזו מעט את מחט הזכוכית והמשיכו להזריק כמויות קטנות עד שמיט הזכוכית ממוקמת נכון17.
- כאשר הכמות הרצויה מוזרקת, השאירו את מחט הזכוכית בכלי למשך ~ 15 שניות כדי למנוע דימום מסיבי. לאחר מכן, הזיזו את מחט הזכוכית מעט הצידה, למעלה ולמטה, וקדימה ואחורה כמה פעמים כדי לאפשר נסיגה עדינה של מחט הזכוכית.
הערה: דימום מסוים הוא תקין. לכל זריקה השתמשו במחט זכוכית חדשה מכיוון שמחט הזכוכית נסתמת בקלות ומקהה מחלבון ביצה.
- לפני ההזרקה, התבונן ב- CAM תחת מיקרוסקופ סטריאו ובחר את כלי ההזרקה הטוב ביותר. תמיד להזריק לאחד הוורידים של העובר. אלה הם כלי הדם שבהם זרימת הדם נעה לכיוון העובר. הוורידים בצבעים בהירים יותר מהעורקים בשל הדם המחומצן29. בנוסף, ורידים נמצאים תמיד בחלק העליון של העורק, עם שני יוצאים מן הכלל: הוורידים הקדמיים והאחוריים (כלומר, הוורידים המסועפים פחות, המסומנים בכוכביות באיור 6A,B) שאין להם עורק בסביבתם.
- הדמיה מיקרוסקופית של העובר ו/או כלי ה-CAM
- מחזיק הכנה עם ממברנה אקוסטית
- קח תא תרבית תאים המורכב ממחזיק פלסטיק מרובע עם שני ממברנות פוליקרבונט שקופות אקוסטית מקבילות בעובי 50 מיקרומטר26, המכונה גם מחזיק עם ממברנה אקוסטית. סגור את שתי היציאות באמצעות מכסה.
- השתמש באזמל כדי להסיר אחד משני הממברנות מהמחזיק עם קרום אקוסטי.
הערה: כדי להסיר את הממברנה, חתכו את הממברנה ממש ליד קו הדבק שעל הפלסטיק. היזהרו לא להחליק מהקצה כדי למנוע נזק לממברנה השנייה. - הכינו ~ 15 מ"ל של 2% agarose בתמיסת מים דמי על ידי חימום בין 80-95 מעלות צלזיוס בכוס זכוכית קטנה. מצננים את הזכוכית עם תמיסת האגרוז המומסת מתחת לברז מים קרים זורם.
הערה: אם האגרוז חם מדי הוא ימיס את הממברנה האקוסטית שתיצור משטח לא אחיד. - כאשר התמיסה מקוררת לטמפרטורה של כ-37 מעלות צלזיוס, יש לשפוך באיטיות את התמיסה לתוך המחזיק באמצעות קרום אקוסטי עד שהיא ממלאת את כל המחזיק. הטה מעט את המחזיק באמצעות קרום אקוסטי כך ששכבת האגרוז תתפזר באופן שווה בתוך מסגרת הפלסטיק (איור 4A). וודאו ששכבת האגרוז שטוחה ותנו לאגרוז לשקוע בטמפרטורת החדר.
- הוצאת עובר ו-CAM מתוך שק החלמון והנחתו על המחזיק עם קרום אקוסטי
- הוציאו את תכולת הביצה מהביצה כמתואר בסעיף 1.2, 1.3 או 1.4.
- במידת הצורך, יש להזריק ל-CAM מיקרו-שבבים ו/או תמיסות אחרות כמתואר בסעיף 2.1.2.
- ממלאים צלחת פטרי 1 ליטר עם ~ 500 מ"ל של 37 מעלות צלזיוס PBS ומניחים את המחזיק עם קרום אקוסטי עם אגרוז בתחתית המנה. ודא ששכבת האגרוז פונה כלפי מעלה.
- השתמשו במספריים קטנים כדי לחתוך במהירות לתוך הממברנה של שק החלמונים, שנקרא גם קרום ויטלוס, סביב כל ה-CAM בזמן שתכולת הביצים נמצאת בסירת השקילה (איור 4B). שמור על המספריים באותו מיקום וסובב את סירת השקילה תוך כדי חיתוך לדיוק טוב יותר ומהירות רבה יותר.
הערה: מרגע החיתוך הראשון, החלמון יתחיל לדלוף. זה מקטין את הנראות של העובר ואת CAM. נסה לחתוך את כל הדרך סביב CAM בתוך 6-7 חתכים. זה לא צריך לקחת הרבה יותר מ 20 שניות. הפינצטה הקטנה (איור 1F) יכולה לשמש כדי להחזיק את קצה קרום הוויטלין ולמנוע חיתוך לתוך ה-CAM. - השתמשו בכף כדי לאסוף את הממברנה החתוכה המכילה את העובר ואת ה-CAM מסירת השקילה. הרימו באיטיות את הכפית מסירת השקילה ובדקו באופן חזותי אם הממברנה החתוכה המכילה את העובר וה-CAM עדיין מחוברת לקרום שק החלמון הנותר. כאשר זה המקרה, להשתמש מספריים כדי לבצע חתך נוסף. בזמן הכנת כף המדידה, הטה מעט את הכף כדי להיפטר מכמה שיותר חלמון, אך אל תיתן לו להתייבש. מעבירים את הממברנה החתוכה המכילה את העובר וה-CAM לצלחת פטרי 1 ליטר, טובלים ב-PBS של 37 מעלות צלזיוס, ומסירים את הכפית.
- כאשר הממברנה המכילה את העובר וה-CAM שקועה ב-PBS של 37 מעלות צלזיוס, השתמשו בפינצטה הקטנה (איור 1F) כדי לתפוס קצה אחד של הממברנה ולהסתחרר בעדינות סביב הממברנה כדי להיפטר מהחלמון שעדיין מחובר.
- כאשר כל החלמון מוסר, השתמש בפינצטה הקטנה כדי להזיז את הממברנה המכילה את העובר ואת CAM ולמקם אותו מעל המחזיק עם קרום אקוסטי.
- השתמש בסיכת דגימת חרקים אחת כדי להצמיד את הממברנה המכילה את העובר ואת ה- CAM בפינה אחת. הימנע פירסינג כלי ב CAM רק להצמיד את הממברנה.
- השתמש בסיכת דגימת חרקים שנייה כדי להצמיד את הממברנה המכילה את העובר ואת CAM בפינה ההפוכה באלכסון.
- הרם באיטיות את המחזיק עם הממברנה האקוסטית המכילה את העובר ו- CAM מ- PBS של 37 מעלות צלזיוס. הטה מעט את המחזיק כדי להיפטר מרוב ה- PBS.
- השתמשו בפינצטה הקטנה (איור 1F) כדי למתוח ולפזר באופן שווה את הממברנה המכילה את העובר ואת ה-CAM על פני המחזיק באמצעות ממברנה אקוסטית ולהצמיד את שאר הממברנה. ודאו שהממברנה המכילה את העובר וה-CAM מתוחה מעט כדי להבטיח שהיא שטוחה (איור 4C).
- מניחים את המחזיק עם קרום אקוסטי עם הממברנה המוצמדת המכילה את העובר ואת CAM לתוך מערך מיקרוסקופיה אשר נשמר ב 37 מעלות צלזיוס.
- הניחו כיסוי או קרום שקוף מבחינה אקוסטית ואופטית (בהתאם למטרה הרצויה ושימוש באולטרסאונד או לא) על גבי אזור העניין בעובר או ב-CAM (איור 4D) כדי לאפשר הדמיה אופטית.
- מחזיק הכנה עם ממברנה אקוסטית
- הדמיית אולטרסאונד של עובר העוף ו/או כלי ה-CAM
- הדמיית אולטרסאונד מהצד של עובר העוף וכלי CAM
- הוציאו את תכולת הביצים כמתואר בסעיף 1.2, 1.3 או 1.4. עם זאת, אין להשתמש בסירת שקילה סטנדרטית. במקום זאת, השתמש בסירת שקילה בהתאמה אישית עם קיר אחד שקוף מבחינה אקוסטית.
הערה: סירת השקילה הסטנדרטית הותאמה על ידי חיתוך צד אחד של סירת השקילה והחלפתו בחלון של רדיד אלומיניום מפוליאסטר שהודבק יחד באמצעות דבק אפוקסי. - טבלו את מתמר האולטרסאונד המועדף באמבט מים בטמפרטורה של 37 מעלות צלזיוס והתמקמו במקום הרצוי עם מרחק העמידה הנדרש.
- הניחו את סירת השקילה באמבט המים באופן כזה שהקיר השקוף פונה אל המתמר. ודאו שסירת השקילה עמוקה מספיק כדי להיות בגובה עם המתמר, אך הימנעו מלהכניס מים לסירת השקילה (איור 5A).
- אם תרצו, הוסיפו הגדרה נוספת לחלק העליון של כלי העובר או ה-CAM, כמו מיקרוסקופ או לייזר (איור 5A).
- הוציאו את תכולת הביצים כמתואר בסעיף 1.2, 1.3 או 1.4. עם זאת, אין להשתמש בסירת שקילה סטנדרטית. במקום זאת, השתמש בסירת שקילה בהתאמה אישית עם קיר אחד שקוף מבחינה אקוסטית.
- הדמיית אולטרסאונד מראש העובר וכלי ה-CAM ללא הפרעה אקוסטית
- מלאו 2 ליטר ב-PBS ב-37 מעלות צלזיוס. הניחו 500 מ"ל הפוכה בתחתית זכוכית הכוס בנפח 2 ליטר. הימנע מאוויר בתוך זכוכית הכוס של 500 מ"ל.
הערה: זכוכית הכוס בגודל 500 מ"ל נועדה להרים את סירת השקילה המכילה את תכולת הביצים קרוב יותר לפני השטח של PBS. על ידי החלפת הכוס בעצמים בגדלים אחרים, המרחק בין המתמר לתכולת הביצה יכול להיות מגוון. - הניחו את הכוס המלאה של 2 ליטר עם זכוכית הכוס של 500 מ"ל בפנים באמבט מים בטמפרטורה של 37 מעלות צלזיוס.
- הוציאו את תכולת הביצים כמתואר בסעיף 1.2, 1.3 או 1.4.
- הרטיבו את תכולת הביצית ב-37 מעלות צלזיוס PBS וכסו את העובר בסרט נצמד שקוף. זה יכול להיעשות כדי לשמור על העובר באותה תנוחה ולמנוע ממנו להסתובב או לצוף משם.
הערה: על ידי הרטבת תוכן הביצה עם PBS, היא תהפוך לפחות דביקה מה שמקל על כיסוי תוכן הביצה בסרט נצמד שקוף. - הניחו את סירת השקילה עם תכולת הביצים בצלחת פטרי בקוטר 90 מ"מ והטביעו באיטיות את צלחת הפטרי ב-PBS (איור 5B).
הערה: שימוש בשני מלחציים בצידי צלחת הפטרי מנוגדים זה לזה מקל על טבילת צלחת פטרי. - מקם את מתמר האולטרסאונד עם מרחק העמידה הרצוי.
- מלאו 2 ליטר ב-PBS ב-37 מעלות צלזיוס. הניחו 500 מ"ל הפוכה בתחתית זכוכית הכוס בנפח 2 ליטר. הימנע מאוויר בתוך זכוכית הכוס של 500 מ"ל.
- הדמיית אולטרסאונד של עובר העוף וכלי CAM עם מתמר נייד
- הוציאו את תכולת הביצים כמתואר בסעיף 1.2, 1.3 או 1.4.
- הכינו תמיסת אגרוז 2% במים דמי על ידי חימום התמיסה עד בין 80-95 מעלות צלזיוס בכוס זכוכית קטנה. מצננים את הזכוכית עם תמיסת האגרוז המומסת מתחת ללשונית מים קרים זורמים.
- יוצקים את תמיסת האגרוז למיכל שטוח כדי ליצור כרית אגרוז בעובי של כ-1 מ"מ. לאחר שהתקרר לחלוטין והתכונן, חתכו את כרית האגרוז לגודל הרצוי באמצעות אזמל.
הערה: ניתן לשנות את עובי כרית האגרוז כדי להשיג את מרחק המוקד הרצוי הדרוש לתפקוד נכון של מתמר האולטרסאונד. - הניחו את כרית האגרוז על גבי העובר וה-CAM (איור 5C). הוסף כמה טיפות של ~ 30 μL של 37 °C PBS על החלק העליון של כרית agarose כדי ליצור שכבת PBS דקה בין כרית agarose לבין מתמר.
הערה: שימוש ב-PBS ימנע מהמתמר להידבק למשטח האגרוז. זה מועיל כאשר, למשל, משתמשים במנוע כדי להזיז באופן מכני מתמר דו-ממדי כדי לבצע סריקה תלת-ממדית (איור 9B)11. כאשר המתמר אינו צריך להיות מועבר, PBS יכול גם להיות מוחלף עם ג'ל אולטרסאונד. - מקם את מתמר האולטרסאונד הרצוי.
- הדמיית אולטרסאונד מהצד של עובר העוף וכלי CAM
תוצאות
בפרוטוקול זה אנו מתארים שלוש שיטות להוצאת תכולת הביצה מהקליפה ביום 5-8 של הדגירה (HH 26-3522). איור 6 מראה את תכולת הביצים בסירות שקילה לאחר שהוצאו מהקליפה. העובר בן 5 הימים וה-CAM (איור 6A) הוצאו בשיטה המתוארת בסעיף 1.2. העוברים וה-CAM בני 6 ו-7 הימים (איור 6B,C) הוצאו בשיטה המתוארת בסעיף 1.3. העובר בן 8 הימים וה-CAM (איור 6D) הוצאו בשיטה המתוארת בסעיף 1.4. לא ניתן לראות דימום או נזק לעובר או ל- CAM, מה שמצביע על כך שניתן להשתמש בשיטות אלה כדי להוציא בבטחה את תוכן הביצית מהקליפה מבלי לפגוע בעובר או בכלי ה- CAM. כאשר היא מבוצעת כראוי, השיטה לעוברים בני 5 ימים תספק עובר בר קיימא ו- CAM שלם ב -90% מכלל ההליכים. שיעור הכדאיות מבוסס על המספר הכולל של ביציות מופרות שחולצו בהצלחה מקליפת הביצה. בשיטה השנייה, עבור ביציות דגירה של 6 ו-7 ימים, הסיכוי לעובר בר קיימא ו-CAM שלם הוא כ-75% לילד בן 6 ימים וכ-50% לילד בן 7 ימים. בשיטה השלישית המתוארת עבור עוברים בני 8 ימים, הסיכוי לעובר בר קיימא ו- CAM שלם הוא סביב 60%. ניתן לראות הבדלים בשלבי ההתפתחות בין העוברים בני 5 ו -8 הימים אשר מסכימים עם המבורגר והמילטון22. גם גודל העובר וגם המורכבות של כלי ה-CAM גדלים במהלך ההתפתחות (איור 6A-D). איור 6C מראה כתם דק של אגרוז על גבי תכולת הביצית שמאפשר לדמות את העובר וה-CAM באמצעות מערך האולטרסאונד שמוצג באיור 5C. לאחר שתכולת הביצה הוצאה מהקליפה, פעימות הלב של העובר נראות בעין בלתי. קצב הלב של עוברי ex ovo אלה דומה לעוברים של ovo ב 183 פעימות לדקה (bpm) ביום 5 עד ~ 208 פעימות לדקה ביום 830. כאשר הוא נשמר לח ובטמפרטורה של 37 מעלות צלזיוס, העובר ישמור על קצב לב זה במשך ~ 5 שעות במערכי האולטרסאונד הניסיוניים.
סיבוכים מרובים יכולים להתרחש במהלך שלוש השיטות שתוארו לעיל. איור 7A מראה אוויר כלוא מתחת ל-CAM, מה שהופך את העובר לבלתי מתאים להדמיית אולטרסאונד, והלחץ של בועות האוויר יכול גם הוא לפגוע בעובר ו/או ב-CAM. בעיה זו מתעוררת כאשר שק האוויר בתוך הקליפה אינו יוצר מגע עם האוויר שמחוץ לקליפה כאשר מוציאים את תוכן הביצה מהקליפה. איור 7B מראה דליפה קטנה של חלמון משק החלמון בפינה השמאלית העליונה של התמונה. זה יכול להתרחש בעת הוצאת תוכן הביצה מהקליפה כאשר שק החלמון נפגע על ידי קצוות חדים של הקליפה או כאשר שק החלמון חודר על ידי הפינצטה. דליפה של החלמון יכולה להשפיע על הנראות של העובר וכלי CAM. איור 7C מראה עובר שבו בועת אוויר נלכדת מתחת ל-CAM. זה קורה לפעמים בהתפתחות העוברית. סיבוך נוסף שיכול להתרחש הוא נזק לכלי השיט. הנזק הזה יכול להיווצר בעת הוצאת תוכן הביצה מהקליפה או בעת ביצוע הזרקה (איור 7D). מלבד זאת, גם העובר וכלי הדם יכולים להתייבש עם הזמן (איור 7E). זה קורה כאשר תוכן הביצה אינו מפוזר עם PBS. התייבשות העובר יכולה לגרום לחסימות נימי מסיביות (איור 7F) שמשפיעות על הכדאיות של העובר. חסימות נימים מסיביות יכולות להתרחש גם במהלך ההתפתחות או כאשר פעימות הלב של העובר אינן יציבות.
לאחר שתכולת הביצים הוצאה מהקליפה ללא כל סיבוך, ניתן להזריק לעובר, למשל, חומרי ניגוד אולטרסאונד כגון מיקרו-שבבים (איור 3C). איור 8 מראה מיקרו-שבבים במחזור הדם בלומן של כלי הדם בעת ההזרקה. מיקרו-שבבים אלה נישאים יחד עם זרימת הדם ונשארים נוכחים במחזור הדם במשך מספר שעות (סרטון משלים 1). נוכחותם של מיקרו-שבבים אלה במחזור הדם יוצרת את האפשרות לבצע סוגים שונים של CEUS וניסויי אספקת תרופות 7,11,12. ה- CAM אידיאלי לחקור שיטות חדשות לזיהוי ניגודיות אולטרסאונד שעבורן אנו מראים שלוש דוגמאות. איור 9A מראה הדמיה תת-הרמונית של אולטרסאונד בתדר גבוה של עובר עוף בן 6 ימים במצב B וב-CEUS לפני ואחרי הזרקת מיקרו-בועות. כאן, כלי CAM הוזרקו עם 5 μL של חומר ניגוד אולטרסאונד והדמיה בוצעה עם מכונת אולטרסאונד חיה פרה-קלינית עם בדיקה MS250 (שידור 30 MHz ו 15 MHz לקבל תדר, 10% כוח). לפני הזרקת המיקרו-באבל, ניתן כבר לראות ניגודיות בתוך הלב העוברי בתמונות של מצב B (איור 9A-I). תופעה זו נובעת מנוכחות גרעין בתא הדם האדום של העופות אשר מגביר את הניגודיות של הדם בהדמיית אולטרסאונד 5,31. תוספת המיקרו-שבבים הגבירה את הניגודיות ואת הנראות של העובר, הן בהדמיית B-Mode והן בהדמיה של CEUS. איור 9B מראה תמונה תת-הרמונית תלת-ממדית אופטית ותדר גבוה של עובר בן 6 ימים וכלי הדם הסובבים אותו. ה- CAM הוזרק עם חומר ניגוד אולטרסאונד 5 μL וההדמיה בוצעה עם מכשיר אולטרסאונד פרה-קליני של בעלי חיים עם בדיקה MS550s (תדר שידור של 40 מגהרץ, לחץ שלילי שיא ~ 300 kPa). תוצאות אלה מראות כי הדמיית CEUS בשילוב עם חומר ניגוד יכולה לשמש גם ליצירת תמונות תת-הרמוניות תלת-ממדיות בתדר גבוה ולהדמיה של כלי הדם מחוץ לעובר. איור 9C מראה תמונה אופטית ותמונת אולטרסאונד תוך-וסקולרי אולטרה-הרמוני (IVUS) שנעשתה באמצעות בדיקה מותאמת אישית של מיקרו-כלי דם מסוג CAM של עובר בן 6 ימים (שידור של 26 מגה-הרץ ותדר קליטה של 39 ו-65 מגה-הרץ). כלי CAM הוזרקו עם 4 ± 1 μL חומר ניגוד אולטרסאונד. התמונה האופטית ותמונת IVUS הן מאותו עובר ומאותו אזור עניין המציג רשתות כלי שיט תואמות.
עוברי העוף וכלי ה-CAM יכולים לשמש גם כדי לחקור אספקת תרופות בתיווך אולטרסאונד, שעבורה אנו מראים דוגמה אחת. מכיוון שהחלמון חוסם את נתיב האור במהלך ההדמיה, הסרת שק החלמון נחוצה כדי לחקור באופן אופטי את העברת התרופה בכלי העובר וה-CAM. עבור מחקר זה, העובר וה-CAM הוכנו להדמיה מיקרוסקופית כפי שמוסבר בסעיף 2.2 על-ידי הפרדת הממברנה המכילה את העובר וה-CAM משק החלמון (איור 4C). בעוברים אלה, קצב הלב יציב סביב 80 פעימות לדקה והעוברים נשארים בחיים עד שעתיים כאשר הם נשמרים בטמפרטורה של 37 מעלות צלזיוס7. איור 10 מראה מחקר אולטרסאונד ומיקרו-בועות בתיווך תרופות בתאי האנדותל של כלי ה-CAM. מיקרו-שבבים מצופים שומנים, שהותקפו לדופן כלי הדם באמצעות נוגדנים αVβ3 ומוכתמים בצבע הפלואורסצנטי DiI7, הוזרקו לכלי ה-CAM (איור 10A,C). גרעיני תאי אנדותל של כלי CAM הוכתמו ב-Hoechst 33342 (איור 10B) ותרופת המודל Propidium Iodide (PI) שימשה להדמיית סונופורציה7. שני הצבעים האלה הוזרקו בו זמנית עם המיקרו-שבבים. לאחר טיפול באולטרסאונד (1 MHz, לחץ שלילי שיא של 200 kPa, פרץ יחיד של 1000 מחזורים), ספיגת PI נצפתה בגרעינים הקרובים ביותר למיקרו-בועות הממוקדות (איור 10D). זה מראה שהתנודות הנגרמות על ידי אולטרסאונד של המיקרו-שבבים הממוקדים הצליחו ליצור נקבובית בקרום תא האנדותל.
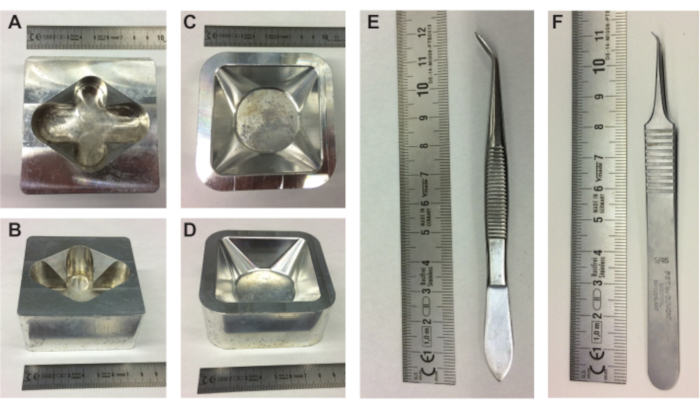
איור 1. ציוד להכנת עוברים. (א-ב) מבט עליון וצדדי של מחזיק ביצי המתכת ומבט עליון וצדדי (C-D) של מחזיק סירת השקילה המתכתית. (E-F) פינצטה הייתה צריכה להוציא את תכולת הביצים מהקליפה. קנה מידה בס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
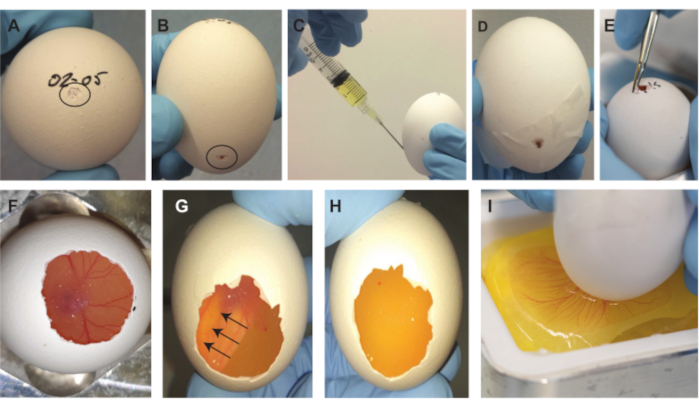
איור 2. הליך הסרת עוברים. (A) כניסה קטנה על גבי הביצה, המסומנת על ידי העיגול השחור. (B) כניסה קטנה 2/3 במורד הביצה, המסומנת על ידי העיגול השחור. (C) משיכת ~ 2 מ"ל של חלבון ביצה. (D) מרווח אטום בצד עם סרט הדבקה. (E) הגדלת הפתח הקטן בחלק העליון של הביצה. (F) העובר הופך גלוי לאחר הסרת חלק מהקליפה. (ז-ה) לאחר סיבוב הביצית ב-180 מעלות, העובר צף למעלה ויהפוך לבלתי נראה (החצים מציינים את כיוון התנועה של העובר). לאחר 1-2 דקות, העובר הוא בלתי נראה מלמטה. (I) לאחר גירוד הממברנה, תכולת הביצה צונחת לתוך סירת השקילה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
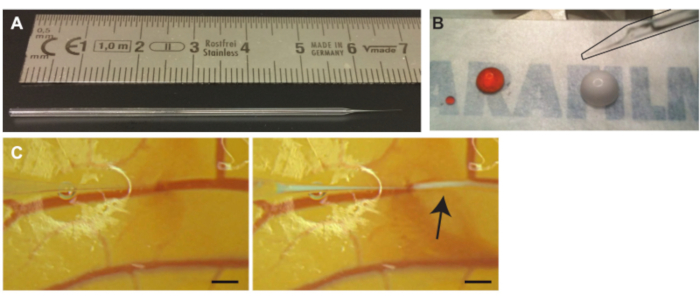
איור 3. הזרקה של microbubbles לתוך כלי CAM. (A) מחט נימי זכוכית. יש למדוד בס"מ (B) תמיסת פרופידיום יודיד (PI) (טיפה שמאלית) ומיקרו-בועות (טיפה ימנית ) לפני השאיפה לפני ההזרקה. מחט (מסומנת בשחור) ניתן לראות בפינה הימנית העליונה (C) הזרקת Microbubble. קצה המחט הנימי ממוקם בתוך לומן של אחד הוורידים (משמאל). מיקרו-שבבים, הענן הלבן המסומן בחץ, מוזרקים ומתפזרים בעקבות זרם הדם (מימין). סרגל קנה המידה מייצג 1 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
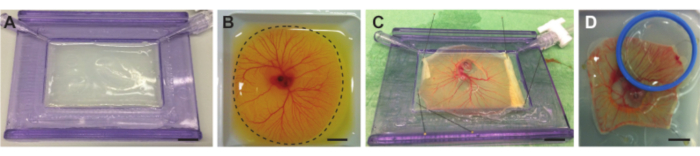
תרשים 4. הוצאת עובר ו- CAM מתוך שק החלמון והנחתו על המחזיק עם קרום אקוסטי. (A) מחזיק עם קרום אקוסטי מלא בשכבת אגרוז. (B) עובר עוף וכלי CAM בסירת שקילה לפני החיתוך. קו מקווקו מציין את קו החיתוך סביב ה- CAM. (C) עובר עוף ו-CAM מופרדים מחלמון ומוצמדים על קרום אקוסטי. (D ) הוצמד לעובר עוף באמצעות קרום שקוף מבחינה אקוסטית ואופטית במחזיק (כחול) המונח על גבי ה-CAM. ניתן למלא את המחזיק במי דמי כך שניתן יהיה להשתמש במטרה לטבול במים. כל פסי קנה המידה מייצגים 1 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5. הגדרות שונות עבור עובר עוף והדמיית אולטרסאונד CAM. (A) הגדרה להדמיית אולטרסאונד מהצד. עובר עוף הונח בסירת שקילה מותאמת אישית עם קיר אחד שקוף אקוסטית והונח באמבט מים בטמפרטורה של 37 מעלות צלזיוס. מתמר האולטרסאונד היה ממוקם בצד שמאל (א) ליד הקיר השקוף מבחינה אקוסטית והלייזר (b) להדמיה פוטואקוסטית למעלה. (B) הגדרה להדמיית אולטרסאונד מלמעלה. העובר וה- CAM היו שקועים בכוס של PBS שהונחה באמבט מים בטמפרטורה של 37 מעלות צלזיוס. קווי מתאר מקווקווים מראים את הזכוכית 2 L (a) עם הזכוכית בגודל 500 מ"ל (b) בפנים. (C) התקנה להדמיית אולטרסאונד מלמעלה עם מתמר נייד. כרית אגרוז דקה (קו מקווקו) הונחה על גבי העובר עם שכבה דקה של PBS כצימוד בין המתמר למשטח האגרוז. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
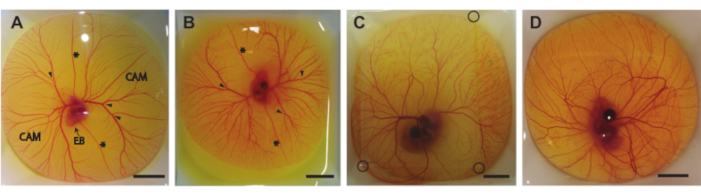
תרשים 6. תכולת הביצים מחוץ לקליפה. (A) תכולת הביצים שהוצאה מהקליפה לאחר 5 ימי דגירה. הממברנה הכוריאלנטואית (CAM), גוף העובר (EB), ורידים ויטלין קדמיים ואחוריים (*), ואתרים מתאימים להזרקה (ראשי חץ) מסומנים. (B) תכולת הביצים שהוצאה מהקליפה לאחר 6 ימי דגירה. הוורידים הקדמיים והאחוריים (*) ואתרים מתאימים להזרקה (ראשי חץ) מסומנים. (C) תכולת הביצה שהוצאה מהקליפה לאחר 7 ימי דגירה. כתם של agarose מונח על גבי כדי לאפשר הדמיה אולטרסאונד. פינות טלאי האגרוז מסומנות בעיגולים שחורים. (D) תכולת הביצה שהוצאה מהקליפה לאחר 8 ימי דגירה. כל פסי קנה המידה מייצגים 1 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
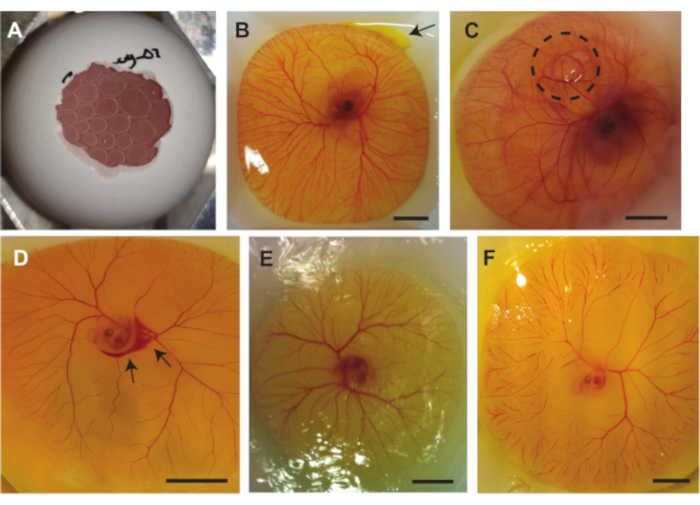
תרשים 7. סיבוכים אשר יכולים להתרחש במהלך ההליכים עם עובר עוף מודל CAM. (A ) בועות אוויר הכלואות מתחת ל-CAM בעת הוצאת תכולת הביציות מהקליפה בשיטה 1.2 (עובר בן 5 ימים) או 1.3 (עובר בן 6 עד 7 ימים). (B) דליפה קטנה של חלמון מסומנת בחץ בצד ימין למעלה (עובר בן 6 ימים). (C) אוויר הכלוא מתחת ל-CAM, מסומן על ידי העיגול השחור המנוקד (עובר בן 7 ימים). (D) דימום, מסומן בחצים השחורים (עובר בן 5 ימים. (E) עובר מיובש ו-CAM (עובר בן 5 ימים). (F) חסימות נימי מסיביות (עובר בן 5 ימים). כל פסי קנה המידה מייצגים 1 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
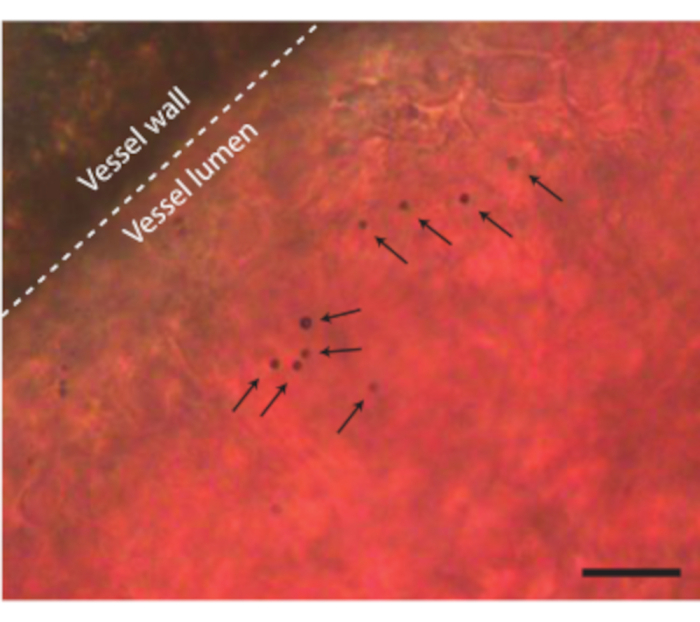
תרשים 8. מיקרו-שבבים בכלי דם CAM. קיר כלי השיט מסומן בקו מקווקו ומיקרו-בועות בודדות מסומנות בחצים. סרגל קנה המידה מייצג 20 מיקרומטר. ניתן למצוא את הקלטת המיקרוסקופיה המתאימה בווידאו משלים 1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
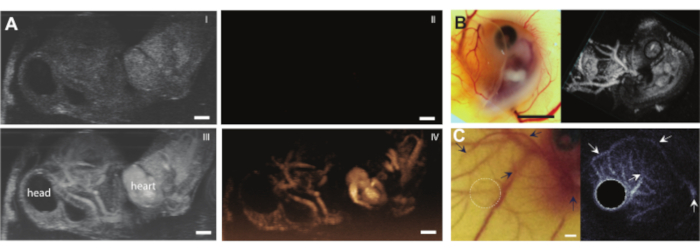
תרשים 9. הדמיית אולטרסאונד משופרת ניגודיות בעוברי עוף וכלי CAM. (A) הקרנה בעוצמה מרבית של תמונות במצב B (I, III) ותמונות תת-הרמוניות בזמן אמת (II, IV) (מכונת אולטרסאונד פרה-קלינית של בעלי חיים עם בדיקה MS250, שידור 30 MHz ותדר קליטה של 15 MHz, 10% הספק) של עובר בן 6 ימים עם טלאי של אגרוז למעלה. תמונות עליונות (I, II) מציגות תוצאות לפני ולמטה (III, IV) לאחר הזרקה של חומר ניגוד אולטרסאונד 5 μL. סרגל קנה המידה מייצג 1 מ"מ. תמונה זו שונתה באישור Daeichin et al. 201511(B) אופטי (משמאל) והדמיה תת-הרמונית תלת-ממדית (מימין) של עובר עוף בן 6 ימים עם טלאי של אגרוז למעלה. כלי CAM הוזרקו עם חומר ניגוד אולטרסאונד 5 μL וההדמיה בוצעה עם בדיקה בתדר גבוה (מכונת אולטרסאונד פרה-קלינית של בעלי חיים עם בדיקה MS550s, תדר שידור של 40 MHz, לחץ שלילי שיא ~ 300 kPa, שניתנו במכונת אולטרסאונד פרה-קלינית של בעלי חיים במצב תלת-ממדי). סרגל קנה המידה מייצג 5 מ"מ. תמונה זו שונתה באישור Daeichin et al. 201511. (C) תמונה אופטית (משמאל) והקרנת עוצמה ממוצעת של אולטרסאונד תוך-וסקולרי אולטרה-הרמוני (IVUS) (מימין) של מיקרו-וסקולטורה CAM של עובר בן 6 ימים. כלי CAM הוזרקו עם 4 ± 1 μL חומר ניגוד. הדמיית IVUS אולטרה-הרמונית בוצעה עם גשושית IVUS מותאמת אישית (תדר שידור 35 מגה-הרץ, לחץ שלילי שיא 600 kPa). שתי התמונות עשויות מאותו עובר ומאותו אזור עניין. חצים מציינים כלים תואמים בשתי התמונות. סרגל קנה המידה מייצג 1 מ"מ. תמונה זו שונתה באישור Maresca et al. 201412. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
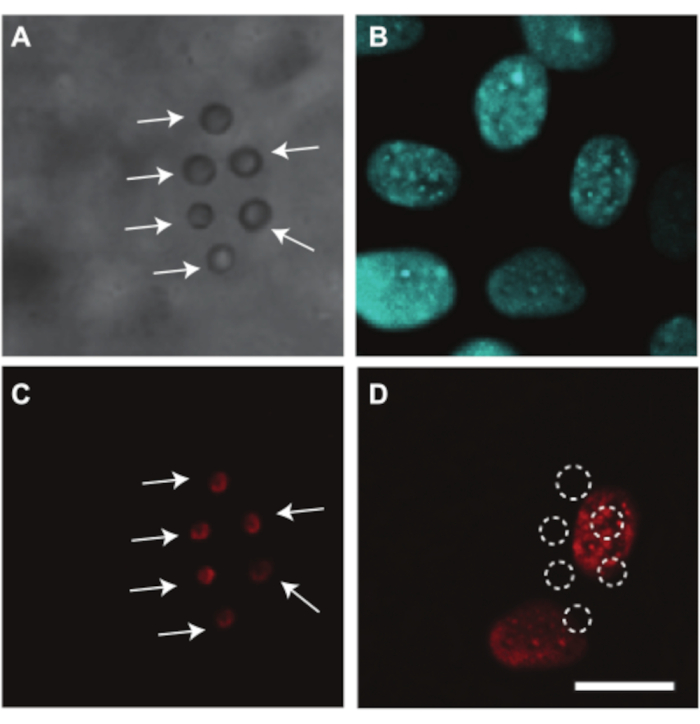
איור 10. אספקת תרופות לתאי אנדותל בכלי CAM בעובר בן 6 ימים. (A) תמונת שדה בהיר של שישה αvβ מיקרו-באבלים ממוקדיםב-3, מסומנים בחצים לבנים, נצמדים לדופן כלי השיט לפני טיפול באולטרסאונד. (B) גרעיני תאי אנדותל מוכתמים פלואורסצנטית לפני טיפול באולטרסאונד. (C) תמונה פלואורסצנטית של המיקרו-בועות המוכתמות, המסומנות בחצים לבנים, לפני טיפול באולטרסאונד. (D) ספיגה של תרופת המודל פרופידיום יודיד (PI) לתוך גרעיני התא מתחת למיקרו-שבבים הממוקדים לאחר טיפול באולטרסאונד (1 MHz, לחץ שלילי שיא של 200 kPa, פרץ יחיד של 1000 מחזורים). סרגל קנה המידה מייצג 10 מיקרומטר והוא חל על כל התמונות. תמונה זו שונתה באישור Skachkov et al. 20147. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
קבצים משלימים
סרטון משלים 1. מיקרו-שבבים בכלי דם CAM. סרגל קנה המידה מייצג 20 מיקרומטר. אנא לחץ כאן כדי להוריד סרטון זה.
Discussion
פרוטוקול זה מתאר שלוש שיטות כיצד להשיג ולהשתמש בעוברי עוף בני 5 עד 8 ימים וב- CAM שלהם כמודל in vivo לחקר הדמיית אולטרסאונד משופרת בניגוד ואספקת תרופות בתיווך מיקרו-בועות. הצעדים הקריטיים ביותר להוצאת עוברים בני 5 ימים (סעיף 1.2) ועוברים בני 6 עד 7 ימים (סעיף 1.3) מהקליפה הם: 1) לעשות את החור הקטן בחלק העליון של הביצה כדי לעבור את כל קליפת הביצה לתוך שק האוויר לפני משיכת לבן ביצה; 2) ליצור קצוות חלקים עבור הפתח הגדול בקליפה. עבור השיטה להוצאת עוברים בני 8 ימים מהקליפה (סעיף 1.4) השלבים הקריטיים ביותר הם: 1) בצע מספר מספיק של כניסות כדי ליצור סדק נחמד לאורך הביצית; 2) שמור את הביצה שקועה ב- PBS. כדי להבטיח את כדאיות העובר עבור כל השיטות חשוב לשמור על הביצית ותכולתה ב 37 מעלות צלזיוס. בנוסף, הימנעו מהזרקה לעורק CAM. ניטור חזותי של קצב הלב של העובר במהלך המחקרים מומלץ כדי להבטיח את חיוניות העובר. כדי לאשר את השלב ההתפתחותי המדויק של העובר, ניתן להשתמש באינדיקציה של המבורגר והמילטון22.
חשוב למנוע נזק לעובר, ל-CAM ולשק החלמון. נזק זה יכול להשפיע על הכדאיות, זרימת הדם והנראות של העובר וה-CAM. בנוסף, פגיעה בשק החלמון וכתוצאה מכך קשיחות נמוכה של הממברנה הופכת את ההזרקה לכלי ה- CAM לבלתי אפשרית. לעובר בן 5 ימים יש שק אוויר קטן יחסית ולכן כדי להיות מסוגל לעשות חור גדול מספיק בקליפה שדרכו ניתן להסיר את תוכן הביצה, יש לסגת 2 מ"ל של חלבון ביצה. כתוצאה מכך, נוצר רווח רב יותר בין קליפת הביצה לעובר. לאחר נסיגה של חלבון ביצה, חתיכת קלטת צריך לסגור את החור שבו המחט נכנסה. אם חלבון ביצה עדיין דולף החוצה, יש למרוח פיסת נייר דבק נוספת. לצד זאת, מריחת סרט הדבקה על החור בצד יוצרת ואקום בתוך הביצה אשר מונע מתכולת הביצה לנשור בשל משקלה העצמי כאשר החור הגדול נוצר בשלב 1.2.2.8. נזק לעובר או ל-CAM יכול להתרחש גם כאשר קצה קליפת הביצה היה חד מדי או כאשר תכולת הביצה נשמטת לתוך סירת השקילה בקפדנות רבה מדי, ולכן יש לשמור את קליפת הביצה קרוב מאוד לסירת השקילה. בין היום ה-5 ל-6 של הפיתוח, ה-CAM מתחיל להתחבר לקרום הקליפה32. התקשרות זו מגבירה את הסיכון לפגיעה בעובר וב-CAM כאשר מוציאים את תכולת הביציות מקליפת הביצה. על ידי פתיחת הביצה לאחר הזרקת PBS לתוכה עבור ביצית דגירה של 6 עד 7 ימים או במיכל מלא PBS כמתואר עבור ביצית דגירה של 8 ימים, הסיכון לנזק מצטמצם. לגבי זריקה לווריד CAM: אם הזריקה הראשונה נכשלת, ניתן לבצע זריקה שנייה בהמשך הזרם באותו וריד אם הנזק היה מינורי או בווריד CAM אחר. הפרדת העובר וה-CAM מהחלמון הופכת את כלי העובר וה-CAM לשקופים אופטית. כתוצאה מכך, העובר מאבד את המקור העיקרי שלו של חומרים מזינים33. אובדן זה של חומרים מזינים יכול להיות הסבר לקצב הלב הנמוך שנצפה של 80 פעימות לדקה בהשוואה ל ~ 190 עבור עובר בן 6 ימים שעדיין נמצא במגע עם החלמון30 ואת זמן ההישרדות המופחת של 2 שעות לאחר הליך הפרדה זה. גורם נוסף שיכול לשחק תפקיד בירידה בקצב הלב ובזמן ההישרדות הוא האתגר לשמור על כלי העובר ו-CAM המופרדים בחלמון בטמפרטורה של 37 מעלות צלזיוס. אינקובטור שלב מיקרוסקופ עשוי להיות לעזר. בנוסף לכך, ניתוק ה- CAM מהחלמון מוביל ככל הנראה לשינויים מכניים ברקמה מכיוון שמתח הממברנה הופך פחות. מתח הממברנה הנמוך יותר עלול לגרום לקצב גזירה מוגבר של כלי הדם הפנימיים, מה שמוביל לקצב לב נמוך יותר.
לעוברי עוף לשעבר של אובו וכלי CAM יש כמה מגבלות כמו במודל in vivo, כולל תצפיות בזמן קצר בלבד, לצורך הדמיית אולטרסאונד משופרת ומחקרי אספקת תרופות בתיווך מיקרו-בועות. בשל נפח הדם הקטן של 100±23 μL ביום 5 ו 171±23 μL ביום 634, נפח מקסימלי של ~ 5 μL ניתן להזריק. בשלבים מאוחרים יותר של ההתפתחות (יום 7 ומעלה), נוקשות כלי הדם עולה וגמישות החלמון פוחתת. זה יכול לסבך הזרקה מוצלחת בעוברים מבוגרים יותר. לאחר הזרקת המיקרו-שבבים, הם מסתובבים במשך שעות מכיוון שלעובר העוף אין מערכת חיסונית מפותחת לחלוטין בשלב זה35. לכן, מיקרו-בועות אינן מנוקות תוך ~6 דקות כמו בבני אדם 36,37 מה שהופך מחקרי הדמיה מולקולרית אופייניים של אולטרסאונד עם תקופת המתנה של 5-10 דקות למיקרו-בועות ממוקדות שאינן קשורות לפינוי38 אינן אפשריות. על מנת להתמקד במיקרו-שבבים, יש להשתמש בליגנדות מתאימות המסוגלות להיקשר לתאי אנדותל של עופות, כפי שתואר קודם לכן עבור סמן האנגיוגנזה αvβ37. היבטים נוספים שיש לקחת בחשבון במודל זה הם הקושי המוגבר להפריד את כלי העובר וה-CAM מהחלמון בעוברים מבוגרים יותר (> 8 ימים) וההמטוקריט התחתון של ~20%39 בהשוואה לבני אדם. זה האחרון עשוי להשפיע על תנודות microbubbles כי זה ידוע כי תנודות microbubble הם רטובים בסביבה צמיגה יותר40. עורקי CAM פחות מחומצנים מאשר ורידים CAM41,42. הבדל זה צריך להילקח בחשבון כאשר למשל לומדים הדמיה פוטואקוסטית של חמצון הדם.
השיטות המתוארות כאן מאפשרות להוציא את תכולת הביצית מקליפת הביצה ביום הדמיית האולטרסאונד או מחקר אספקת התרופות, בדרך כלל ביום 5 עד 8 של הדגירה. זה שונה מהשיטות הקיימות שבהן תכולת הביצים נלקחת מהקליפה לאחר דגירה של 3 ימים ומתפתחת עוד יותר כתרבית ex ovo 18,20,21. היתרונות הם שיעור הישרדות גבוה יותר של 90% עבור 5 ימים, 75% עבור 6 ימים, 50% עבור 7 ימים, ו 60% עבור ביצי דגירה בנות 8 ימים לעומת ~ 50% עבור עוברים בני 3 ימים שהוצאו מתוך קליפת הביצה ודגירה נוספת ex ovo1,18 הימנעות אנטיביוטיקה במהלך תרבית18, 20 וחממה סטרילית גדולה לתרביתe x ovo. ההישרדות של העוברים בני 6 עד 8 הימים נמוכה יותר מכיוון שה-CAM מתחיל להיצמד לקליפה21 מה שמשאיר את קרום ה-CAM מועד יותר לקרע בעת השאיבה. ההפרדה של העובר עם צורת CAM החלמון מתוארת גם הפיכת העובר ו- CAM לשקופים אופטית.
על ידי הצבת תכולת הביצית בתצורות שונות, ניתן להשתמש בעובר התרנגולת וב- CAM למספר רב של מחקרי דימות אולטרסאונד, כמו IVUS, פוטואקוסטי, ללא או עם חומרי ניגוד אולטרסאונד בדו-ממד ובתלת-ממד. ההתמקדות יכולה להיות בפיתוח תוכניות פעימות אולטרסאונד חדשות או בדיקת מתמרים חדשים. מלבד זאת, המודל יכול לשמש גם כדי לחקור חומרי ניגוד אולטרסאונד חדשניים והתנהגותם בכלי דם תחת זרימה. מאחר שהמנגנון של אספקת תרופות בתיווך מיקרו-בועות עדיין אינו ידוע43, השימוש במודל in vivo CAM עשוי לסייע בהבהרת המנגנון על ידי חקר התנהגות המיקרו-בועות ביחס לתגובה התאית. לבסוף, כלי CAM הוכיחו את עצמם כמערכת מתאימה לחקור השתלת גידול xenograft44. זה יוצר את האפשרות להשתמש בכלי CAM כמודל לחקור הדמיית גידול באמצעות אולטרסאונד ולחקור את זרימת הדם בתוך הגידול באמצעות CEUS. הגידולים מושתלים בדרך כלל בכלי CAM של עוברים בני 8 או 9 ימים 1,14,45, שעבורם מוציאים את העובר מקליפת הביצה ביום 3 של הדגירה ומפותחים עוד יותר ex ovo. השיטות המתוארות בפרוטוקול זה יכולות לשמש לגידול עוברים ב- ovo עד ליום השתלת הגידול.
המחברים סומכים על כך שמאמר זה יעזור לחוקרים שרוצים להשתמש בעוברי עוף ובממברנה הכוריאלנטואית שלהם (CAM) כמודל in vivo ליישומים של חומרי ניגוד ומחקרי זרימה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי המדעים היישומיים וההנדסיים (TTW) (פרויקט וידי 17543), חלק מ- NWO. המחברים רוצים להודות לרוברט בורסקנס, לוקסי וויי ורזא פקדמן זנגבאד מהמחלקה להנדסה ביו-רפואית ולמיכאיל מנטן וגרט ספרינגלינג מהמחלקה למכשור רפואי ניסיוני על סיוע טכני, כולם מהמרכז הרפואי האוניברסיטאי ארסמוס MC רוטרדם, הולנד.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Clamp (Kocher clamp) | |||
| Cling film | |||
| Holder with acoustic membrane (CLINIcell 25 cm2) | MABIO, Tourcoing, France | CLINIcell25-50-T FER 00106 | |
| Demi water | |||
| Disposable plastic Pasteur pipets | VWR | 612-1747 | |
| Eggs | Drost Pluimveebedrijf Loenen BV, the Netherlands | Freshly fertilized | |
| Fridge 15 °C | |||
| Glass capillary needles | Drummond | 1-000-1000 | Inside diameter: 0.0413 inch |
| Heating plate 37 °C | |||
| Humidified incubator 37 °C | |||
| Insect specimen pins | |||
| Metal egg holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 A,B | ||
| Metal weighing boat holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 C,D | ||
| Microinjection system | FUJIFILM VisualSonics | ||
| Mineral oil | Sigma-Aldrich | M8410-100ML | |
| Needle, 19 G | VWR (TERUMO) | 613-5392 | |
| Phosphate-bufferes saline (PBS), 1x | ThermoFisher | 10010023 | |
| Petri dish, 1 L | Glass | ||
| Petri dish, 90 mm diameter | VWR | 391-0559 | |
| Preclinical animal ultrasound machine (Vevo 2100) | FUJIFILM VisualSonics | ||
| Probe (MS250) | FUJIFILM VisualSonics | 30 MHz transmit and 15 MHz receive frequency | |
| Probe (MS550s) | FUJIFILM VisualSonics | transmission frequency of 40 MHz | |
| Scalpel | VWR (SWANN-MORTON) | 233-5363 | |
| Scissors, small | Fine Science Tools (FST) | 14558-09 | |
| Syringe, 5 mL | VWR (TERUMO) | 613-0973 | |
| Table spoon | |||
| Tape (Scotch Magic tape) | Scotch | ||
| Tissue paper | Tork | ||
| Tweezers large | VWR (USBECK Laborgeräte) | 232-0107 | See figure 1E |
| Tweezers small | DUMONT Medical, Switzerland | 0103-5/45 | See figure 1F |
| Ultrasound contrast agent (custum made F-type) | Produced as described by: Daeichin, V. et al. Microbubble Composition and Preparation for Imaging : In Vitro and In Vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555–567 (2017). | ||
| Ultrasound contrast agent (MicroMarker) | FUJIFILM VisualSonics, Inc. | ||
| Ultrasound contrast agent (Definity) | Lantheus medical imaging, United States | ||
| Ultrasound gel | Aquasonic | ||
| Waxi film (Parafilm) | Parafilm | ||
| Weighing boats (85 × 85 × 24 mm) | VWR | 611-0094 |
References
- Martowicz, A., Kern, J., Gunsilius, E., Untergasser, G. Establishment of a Human Multiple Myeloma Xenograft Model in the Chicken to Study Tumor Growth, Invasion and Angiogenesis. Journal of Visualized Experiments. (99), e1 (2015).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A Submerged Filter Paper Sandwich for Long-term Ex ovo Time-lapse Imaging of Early Chick Embryos. Journal of Visualized Experiments. (118), e1 (2016).
- Brauer, R., Chen, P. Influenza Virus Propagation in Embryonated Chicken Eggs. Journal of Visualized Experiments. (97), e1 (2015).
- Oosterbaan, A. M., Ursem, N. T. C., Struijk, P. C., Bosch, J. G., van der Steen, A. F. W., Steegers, E. A. P. Doppler flow velocity waveforms in the embryonic chicken heart at developmental stages corresponding to 5-8 weeks of human gestation. Ultrasound in Obstetrics and Gynecology. 33 (6), 638-644 (2009).
- McQuinn, T. C., Bratoeva, M., DeAlmeida, A., Remond, M., Thompson, R. P., Sedmera, D. High-Frequency Ultrasonographic Imaging of Avian Cardiovascular Development. Developmental Dynamics. 236 (12), 3503-3513 (2007).
- Stieger, S. M., Caskey, C. F., Adamson, R. H., Curry, F. E., Wisner, E. R., Ferrara, K. W. Enhancement of Vascular Permeability with Low-Frequency Contrast-enhanced Ultrasound in the Chorioallantoic Membrane Model. Radiology. 243 (1), 112-121 (2007).
- Skachkov, I., Luan, Y., van der Steen, A. F. W., De Jong, N., Kooiman, K. Targeted microbubble mediated sonoporation of endothelial cells in vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (10), 1661-1667 (2014).
- Vargas, A., Zeisser-Labouèbe, M., Lange, N., Gurny, R., Delie, F. The chick embryo and its chorioallantoic membrane (CAM) for the in vivo evaluation of drug delivery systems. Advanced Drug Delivery Reviews. 59 (11), 1162-1176 (2007).
- Rytelewski, M., Buensuceso, A., Leong, H. S., Deroo, B. J., Chambers, A. F., Koropatnick, J. Evaluating the Effectiveness of Cancer Drug Sensitization In Vitro and In vivo. Journal of Visualized Experiments. (96), e1 (2015).
- Schmitd, L. B., Liu, M., Scanlon, C. S., Banerjee, R., Silva, N. J. D. The Chick Chorioallantoic Membrane In vivo Model to Assess Perineural Invasion in Head and Neck Cancer. Journal of Visualized Experiments. (148), e1 (2019).
- Daeichin, V., Bosch, J. G., Needles, A., Foster, F. S., van der Steen, A., de Jong, N. Subharmonic, non-linear fundamental and ultraharmonic imaging of microbubble contrast at high frequencies. Ultrasound in Medicine and Biology. 41 (2), 486-497 (2015).
- Maresca, D., et al. Imaging microvasculature with contrast-enhanced ultraharmonic ultrasound. Ultrasound in Medicine and Biology. 40 (6), 1318-1328 (2014).
- Lindsey, B. D., et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography. Annals of Biomedical Engineering. 45 (4), 939-948 (2017).
- Paproski, R. J., Jovel, J., Wong, G. K. S., Lewis, J. D., Zemp, R. J. Enhanced detection of cancer biomarkers in blood-borne extracellular vesicles using nanodroplets and focused ultrasound. Cancer Research. 77 (1), 3-13 (2017).
- Huang, C., et al. Short Acquisition Time Super-Resolution Ultrasound Microvessel Imaging via Microbubble Separation. Scientific Reports. 10, 1-13 (2020).
- Lowerison, M. R., Huang, C., Kim, Y., Lucien, F., Chen, S., Song, P. In vivo Confocal Imaging of Fluorescently Labeled Microbubbles: Implications for Ultrasound Localization Microscopy. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 67 (9), 1811-1819 (2020).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo Characterization of Ultrasound Contrast Agents: Microbubble Spectroscopy in a Chicken Embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yalcin, H. C., Shekhar, A., Rane, A. A., Butcher, J. T. An ex-ovo Chicken Embryo Culture System Suitable for Imaging and Microsurgery Applications. Journal of Visualized Experiments. (44), e4 (2010).
- Kokhuis, T. J. A., et al. Intravital microscopy of localized stem cell delivery using microbubbles and acoustic radiation force. Biotechnology and Bioengineering. 112 (1), 220-227 (2015).
- Cloney, K., Franz-Odendaal, T. A. Optimized Ex-ovo Culturing of Chick Embryos to Advanced Stages of Development. Journal of Visualized Experiments. (95), e6 (2015).
- Dohle, D. S., et al. Chick ex ovo Culture and ex ovo CAM Assay: How it Really Works. Journal of Visualized Experiments. (33), e2 (2010).
- Hamburger, V., Hamilton, H. A Series Of Normal Stages In The Developent Of The Chick Embryo. Journal of Morphology. 88 (1), 231-272 (1951).
- Ribatti, D. A morphometric study of the expansion of the chick vasculosa in shell-less culture. Journal of Anatomy. 186, 639-644 (1995).
- Ribatti, D., Nico, B., Vacca, A., Roncali, L., Burri, P. H., Djonov, V. Chorioallantoic Membrane Capillary Bed: A Useful Target for Studying Angiogenesis and Anti-Angiogenesis In vivo. Anatomical Record. 324, 317-324 (2001).
- DeFouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the Microcirculation in the Chick Chorioallantoic Membrane during Normal Angiogenesis. Microvascular research. 38, 136-147 (1989).
- Beekers, I., van Rooij, T., van der Steen, A. F. W., de Jong, N., Verweij, M. D., Kooiman, K. Acoustic characterization of the CLINIcell for ultrasound contrast agent studies. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (1), 244-246 (2019).
- Lang, E. R., Rha, C. Apparent shear viscosity of native egg white. Journal of Food Science and Technology. 17, 595-606 (1982).
- Daeichin, V., et al. Microbubble Composition and Preparation for Imaging: In Vitro and In vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555-567 (2017).
- Mcferrin, H. E., Olson, S. D., Gutschow, M. V., Semon, J. A., Sullivan, D. E., Prockop, D. J. Rapidly Self-Renewing Human Multipotent Marrow Stromal Cells (hMSC) Express Sialyl Lewis X and Actively Adhere to Arterial Endothelium in a Chick Embryo Model System. PLoS ONE. 9 (8), 1-11 (2014).
- Akiyama, R., Mitsubayashi, H., Tazawa, H., Burggren, W. W. Heart rate responses to altered ambient oxygen in early (days 3-9) chick embryos in the intact egg. Journal of Comparative Physiology - B Biochemical, Systemic, and Environmental Physiology. 169 (2), 85-92 (1999).
- Foster, F. S., Hossack, J., Adamson, S. L. Micro-ultrasound for preclinical imaging. Interface Focus. 1, 576-601 (2011).
- Gabrielli, M. G., Accili, D. The Chick Chorioallantoic Membrane: A Model of Molecular, Structural, and Functional Adaptation to Transepithelial Ion Transport and Barrier Function during Embryonic Development. Journal of Biomedicine and Biotechnology. , 1-12 (2010).
- van der Wagt, I., de Jong, I. C., Mitchell, M. A., Molenaar, R., van den Brand, H. A review on yolk sac utilization in poultry. Poultry Science. 99, 2162-2175 (2020).
- Kind, C. The development of the circulating blood volume of the chick embryo. Anatomy and Embryology. 147, 127-132 (1975).
- Ribatti, D. Chick Embryo Chorioallantoic Membrane as a Useful Tool to Study Angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Schneider, M. Characteristics of SonoVue(TM). Echocardiography. 16 (7), 743-746 (1999).
- Kitzman, D. W., Goldman, M. E., Gillam, L. D., Cohen, J. L., Aurigemma, G. P., Gottdiener, J. S. Efficacy and Safety of the Novel Ultrasound Contrast Agent Perflutren (Definity) in Patients With Suboptimal Baseline Left Ventricular Echocardiographic Images. American Journal of Cardiology. 86, 669-674 (2000).
- Kosareva, A., Abou-Elkacem, L., Chowdhury, S., Lindner, J. R., Kaufmann, B. A. Seeing the Invisible-Ultrasound Molecular Imaging. Ultrasound in Medicine and Biology. 46 (3), 479-497 (2020).
- Al-Roubaie, S., Jahnsen, E. D., Mohammed, M., Henderson-Toth, C., Jones, E. A. V. Rheology of embryonic avian blood. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2473-2481 (2011).
- Helfield, B., Chen, X., Qin, B., Villanueva, F. S. Individual lipid encapsulated microbubble radial oscillations: Effects of fluid viscosity. The Journal of the Acoustical Society of America. 139 (1), 204-214 (2016).
- Metcalfe, J., Stock, M. K. Oxygen exchange in the chorioallantoic membrane, avian homologue of the mammalian placenta. Placenta. 14, 605-613 (1993).
- Tazawa, H. Oxygen and CO2 exchange and acid-base regulation in the avian embryo. American Journal of Zoology. 20, 395-404 (1980).
- Kooiman, K., et al. Ultrasound-Responsive Cavitation Nuclei for Therapy and Drug Delivery. Ultrasound in Medicine and Biology. 46 (6), 1296-1325 (2020).
- Li, M., Pathak, R. R., Lopez-rivera, E., Friedman, S. L., Aguirre-ghiso, J. A., Sikora, A. G. The In ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of Visualized Experiments. (104), e1 (2015).
- Sys, G. M. L., et al. The In ovo CAM-assay as a Xenograft Model for Sarcoma. Journal of Visualized Experiments. (77), e1 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved