Method Article
造影剤増強超音波イメージングおよびマイクロバブル媒介薬物送達研究のためのin vivoモデルとしてのニワトリEx Ovo胚および絨毛尿膜血管の調製
要約
このプロトコルでは、造影剤増強超音波イメージングとマイクロバブル媒介薬物送達を研究するためのin vivoモデルとして、5〜8日齢のニワトリ胚とその絨毛尿膜(CAM)を取得して使用する方法に関する3つの方法について説明しています。
要約
ニワトリ胚と血管に富む絨毛尿膜(CAM)は、生物医学的プロセス、新しい超音波パルススキーム、または造影剤増強超音波イメージングおよびマイクロバブル媒介薬物送達のための新しいトランスデューサーを調査するための貴重な in vivo モデルです。この理由は、CAMの胚と血管ネットワークのアクセシビリティと、モデルの低コストです。胚とCAM血管にアクセスするための重要なステップは、卵殻から卵の内容物を取り出すことです。このプロトコルでは、孵卵の5日目から8日目の間に卵殻から内容物を取り出すための3つの方法が説明されており、したがって、胚は今日まで卵殻内で発達することを可能にする。記載された方法は、単純な道具と機器のみを必要とし、 卵外 培養胚(~50%)と比較して、5日で90%、6日間で75%、7日齢で50%、8日齢で60%の高い生存成功率をもたらします。このプロトコルでは、マイクロバブルなどのキャビテーション核をCAM血管系に注入する方法、光学的に透明な研究のために胚とCAMを含む膜を残りの卵の内容物から分離する方法、およびさまざまな短期超音波実験で鶏胚とCAMを使用する方法についても説明します。 in vivoニワトリ胚およびCAMモデルは、造影剤増強超音波イメージングのための新しいイメージングプロトコル、超音波造影剤、および超音波パルススキームを調査し、超音波を介した薬物送達のメカニズムを解明するために非常に重要です。
概要
Ex ovo ニワトリ胚と血管に富む絨毛尿膜(CAM)は、胚発生、腫瘍学、薬物送達などのさまざまな生物学的および生物医学的プロセスを調査するのに適したモデルであることが証明されています1,2,3,4。超音波は、胚性心臓発達の画像化4,5、および血管薬物送達のためのマイクロバブルなどの注射時のキャビテーション核の活性化に使用されています6,7。ニワトリ胚は、他の動物モデルと比較して安価で、必要なインフラストラクチャと機器が少なく、法律の厳格さも低くなっています8。鶏の胚とCAMの血管は卵を開けた後は簡単にアクセスできますが、これは哺乳類の胚と血管でははるかに困難であることが証明されています。これに加えて、ニワトリ胚とCAM血管は心拍と脈動血流を提供します。CAMは、血管の解剖学的構造において哺乳類との類似性を示し、薬物スクリーニングに使用することができる8,9,10。これらの特性により、CAM血管は、造影剤増強超音波画像診断(CEUS)11,12,13,14,15,16を調査するのに適したモデルであることも証明されています。さらに、このモデルを使用して、超高速カメラを使用した超音波場での超音波造影剤の挙動、および薬物の推進、結合、および血管外漏出に対する音響放射力の影響を光学的に調査することができます7,17,18,19。ニワトリ胚とCAMは長期実験にはあまり適していませんが、短期間のin vivo実験には有益です。
実験中のニワトリ胚およびCAMに対する視認性および制御性を高めるためには、胚およびCAMを含む卵内容物を卵殻18から取り出すことが重要である。超音波造影剤を含む以前のニワトリ胚研究は、5〜6日齢の胚7、11、12、17、19および14〜18日齢の胚13、14、15、16を使用した。卵内容物を殻から取り出すための複数のアプローチが詳細に説明されている18、20、21。しかし、我々の知る限り、以前に発表されたアプローチは、3日間のインキュベーション後に卵殻から卵の内容物を取り出し(すなわち、Hamburger & Hamilton(HH)ステージ19-2022)、そして培養をexovoで継続することに焦点を当てている。この卵外培養アプローチには、卵子増殖と比較して、培養中の死亡リスクの増加(~50%)1,18、抗生物質の使用18,20、および総血管長の減少など、複数の欠点があります23。卵殻内で胚を培養することは最も自然な環境を提供するため、実験当日まで卵殻内で胚をインキュベートするのが最も簡単です。このため、孵卵の5〜8日で卵の内容物を卵殻から取り出すアプローチは、特に5〜8日齢の胚での実験に有益です。
このプロトコルでは、胚が発生の5〜8日目(HH 26-3522)にあるときに卵殻から卵の含有量を取り出す3つの方法を説明し、実験の日まで卵殻内で胚を発達させます。CAM血管のサイズは、8日齢の胚24の小さい毛細血管の直径10〜15μmから、6日齢および8日齢の胚24,25の大きな血管の直径115〜136μmの範囲です。説明されている3つの方法は、基本的なラボツールのみを必要とし、実験を開始する前に合併症のリスクを低減し、それによって不要なコストと労力を削減します。また、胚とCAMを含む膜を卵黄袋から分離し、顕微鏡研究のためにCAMを光学的に透明にする方法についても詳しく説明します。胚とCAMを含む膜は、例えば音響膜を備えたホルダーに固定することができるので、セットアップは音響的に透明にすることもでき26、光路が卵黄の影響を受けるときに顕微鏡検査と超音波研究の組み合わせを可能にする。最後に、超音波またはCEUSイメージングに使用できる他のいくつかの超音波セットアップについて説明します。
プロトコル
すべての動物実験は、オランダ動物実験法および科学的目的のための動物使用の保護に関する欧州理事会(2010/63 / EU)に従って実施されました。
1 .胚調製プロトコル
- 受精鶏卵のインキュベーション
- 受精したばかりの鶏卵を15°Cで最長1週間保存します。
- 受精卵を孵化させるには、先のとがった面を下にして垂直に37°Cの加湿インキュベーターに入れます。孵卵中に卵を回転させる必要はありません。
注:永久マーカーを使用して卵の上の孵卵の開始日を書きます。
- 最大5日(120時間)の胚の準備(HHステージ26-28)22
- 作業エリアの準備
- 加熱プレートを37°Cに温めます。
- 金属製の卵ホルダー(図1A、B)、金属製の計量ボートホルダー(図1C、D)、およびPBSで満たされた10mLの三角ボックスを加熱プレートに置きます。
- 計量ボート(85 mm× 85 mm × 25 mm)に10 mmの超音波ゲル層を充填し、充填された計量ボートを予熱した金属製計量ボートホルダーに入れます。
注:計量ボートに超音波ゲルを充填すると、胚とCAMが上昇します。これは、胚とCAMの注射またはイメージングに有益ですが、胚とCAMを卵殻から取り出すためには必要ありません。 - 一端の一部を折り返して、もうくっつかないようにテープ(長さ約3 cm)をいくつか用意します。
- 卵殻から卵の内容物を取り出す
- 生後5日齢の孵化受精卵を取り、予熱した金属製の卵ホルダーに移します(図1A、B)。卵を同じ向き(つまり、日付を上に)に保つようにしてください。
注:気嚢と胚およびCAMを卵の上部の同じ位置に保つには、卵を同じ方向に保つことが重要です。 - ピンセットの先のとがった背面(または同様のもの; 図1E)卵の最上部(日付が書かれている場所)に小さなくぼみを作ります(図2A)。
- ピンセットの先のとがった裏側を使用して、卵の約2/3下の卵の側面に2番目のくぼみを作ります(図2B)。
注: インデントを大きくしすぎて穴が開かないように注意してください。誤って穴が開いた場合は、テープで穴を塞ぎ、別のくぼみをしないでください。 - 大きなピンセット(図1E)を使用して、卵の上のくぼんだ領域から卵殻の小片を取り出します(日付が書かれています)。卵殻の上部にある気嚢が卵の外側の空気と接触していることを確認してくださいが、殻を深く貫通しすぎないようにしてください。
注:上部のくぼみを作るときに殻が深く貫通しすぎると、胚とCAMが損傷する可能性があり、胚は殻からの除去に耐えられません。上部の小さな穴が卵の内側と外側の間に空気接触を作り出すことが重要です。これを行わないと、手順の次のステップで真空が発生し、CAMの下に大きな気泡が閉じ込められ、胚とCAMが役に立たなくなります。卵の中の気嚢の位置を確認するには、その位置が常に正確に上にあるとは限らず、さらに横にある可能性があるため、光源を使用できます。 - 5 mLのシリンジと19 Gの針を使用して、卵の2/3側の2番目のくぼみから殻を貫通し、~2 mLの卵白を引き抜きます(図2C)。
注意: 胚とCAMを損傷する可能性を防ぐために、針が卵の底に向かって下を向いていることを確認してください。このステップにより、卵の内容物の除去に必要な卵の上部に大きなエアポケットが作成されます。手順1.2.2.3で誤ってくぼみの代わりに穴が開いた場合は、卵白を引き出すために針でテープを刺します。別のテープでパンクを再シールします。 - 針を取り出し、テープを使用して側面の隙間を塞ぎます(図2D)。
注意: 卵白が卵から漏れるのを防ぐために、針を取り出す前に指を使って上部の穴を閉じることができます。テープを貼ったまま卵白が漏れ続ける場合は、まずティッシュで卵白を取り除き、テープが正しくくっつくことを確認します。 - 計量ボートに卵白を加えて注射器を空にします。
- 大きなピンセット(図1E)を使用して、卵の上部にある小さな開口部を拡大します(図2E)。上部の開口部から卵の中を見ると、胚とCAMが見えます。できるだけ多くの卵殻を取り除きながら、胚とCAMの位置を特定し続けます(図2F)。
注:殻の中の胚とCAMの位置を最大限に見やすくするために、卵を動かし続けます。シェルの開口部の端がCAMより低くならないようにしてください。これに加えて、内膜を貫通せず、鋭いエッジを防ぎます。 - 開口部を作成したら、卵を180°回転させ、卵の上部に作成された開口部が下部を向くように卵を卵ホルダーに戻します。胚は浮き上がり、底から見えなくなります(図2G)1〜2分かかります。次のステップに進む前に、胚全体とCAM(すべての血管を含む)が消え、卵黄だけが見えることを確認してください(図2H)。
注:2分経っても胚が下から見える場合は、卵を時計回りに1〜2分間回します。これは胚とCAMが浮き上がるのを助けます。 - 側面の開口部からテープをはがします。卵の内側が底の開口部から膨らんでいるかどうか見てください。この場合は、次の手順に進みます。そうでない場合は、注射器の針を使用して側面の開口部をもう一度穴を開け、卵の真空を解放します。卵黄袋に穴を開ける可能性を防ぐために、針で上を向いてください。卵が底の開口部から膨らむまで続けます。
- 金属製の計量ボートホルダーの計量ボートの近くに卵の底を保持しながら(図1C、D)、小さなピンセットの鋭いポイントの1つを使用して、開口部の幅全体にわたって膜に水平方向の引っかき傷をそっと作り(図1F)、卵の内容物を計量ボートにそっと落とします(図2I)。
注意: 卵の内容物が出ない場合は、注射器の針を使用して、針を上に向けて側面の開口部を再度穴を開けます。 - 胚が計量ボートに横向きにある場合、通常は自然に上がります。これが起こらない場合は、ティッシュペーパーを使用して胚の位置を変えます。ティッシュペーパーの片面を胚の上に置き、ティッシュペーパーをもう一方の端に引きずり、プラスチック製のパスツールピペットを使用して数滴~30 μLのPBS(37°C)でティッシュペーパーを放出します。
- 心拍がまだ存在し、CAM血管が無傷で出血がなく、卵黄の漏れがないことを確認することにより、胚が生きているかどうかを視覚的に確認します。これらのことのいずれかが正しくない場合は、胚とCAMが生存できないため破棄してください。
- 胚とCAMが37°Cに保たれ、CAM血管が劣化し、最終的に胚が死んでしまうため、乾燥しないようにしてください。これを防ぐには、37°C PBSの~30 μLの小滴を胚とCAMに定期的に入れます。
- 生後5日齢の孵化受精卵を取り、予熱した金属製の卵ホルダーに移します(図1A、B)。卵を同じ向き(つまり、日付を上に)に保つようにしてください。
- 作業エリアの準備
- 6〜7日(144〜168時間)の古い胚の準備(HHステージ28〜32)22
- 作業エリアの準備
- セクション 1.2.1 の説明に従ってステージを準備します。
- 卵殻から卵の内容物を取り出す
- 実験の2時間前に、生後6〜7日の孵化卵を取り、卵の上部が下を向くようにインキュベーター内で卵を180°回転させます。1時間後、卵を元の位置に回転させ、さらに1時間放置します。
注:実験の2時間前に卵を回転させると、卵の内容物を殻から取り出しやすくなります。 - 回転した後、インキュベーターから卵を取り出します。
- ステップ 1.2.2.2 からステップ 1.2.2.4 まで実行します。
- 5 mLシリンジと19 G針を使用して、卵の2/3側の2番目のくぼみからシェルを貫通し、5〜6 mLの卵白を引き出します。針が卵の底に向かって下を向いていることを確認してください。
注:使用した5 mLシリンジを使用すると、最大6 mLまで引き出すことができるため、1回の浸透のみが必要です。 - 針を取り出し、テープを使用して側面の隙間を塞ぎます(図2D)。
- 計量ボートの超音波ゲルに卵白を加えて注射器を空にします。
- 大きなピンセット(図1E)を使用して、卵の上部にある小さな開口部を拡大します(図2E)。開口部をできるだけ大きくするようにしてくださいが、シェルの開口部の端がCAMより低くならないようにしてください。これに加えて、内膜を貫通せず、鋭いエッジを防ぐようにしてください。
- ステップ1.3.2.4で抜き出した容量よりも~1 mL多い37°C PBSをシリンジに充填します。
- サイドギャップからテープを剥がし、充填されたシリンジでギャップを貫通し、シェルに空にします。針が卵の底に向かって下を向いていることを確認してください。
注:卵白はPBS(~1cP)よりも粘度が高い(~160cP)27ため、卵白をPBSに置き換えると、卵の内容物を殻から取り出しながら、胚とCAMへの緊張とストレスの両方を軽減します。 - 針を取り出し、テープで隙間をすばやく再シールします(図2D)。
- 卵を180°回転させ、卵の上部に作成された開口部が下部を向くように卵を卵ホルダーに戻します。胚全体とCAM(すべての血管を含む)が消え、卵黄だけが見えるまで卵を時計回りに回します。
- ステップ 1.2.2.10 からステップ 1.2.2.14 まで実行します。
- 実験の2時間前に、生後6〜7日の孵化卵を取り、卵の上部が下を向くようにインキュベーター内で卵を180°回転させます。1時間後、卵を元の位置に回転させ、さらに1時間放置します。
- 作業エリアの準備
- 8日(192時間)の古い胚の準備(HHステージ32-35)22
- 作業エリアの準備
- 加熱プレートを37°Cに温めます。
- 金属製の計量ボートホルダー(図1C、D)とPBSで満たされた10mLの三角ボタンを加熱プレートに置きます。
- 170 x 110 x 70 mmなどの浅い容器を取り、容器に1 Lの37°C PBSを満たします。
- 計量ボート(85 × 85 × 25 mm)を直径90 mmのペトリ皿に入れます。ペトリ皿と計量ボートを容器の底に置き、それらが完全に水没していることを確認します。
- 卵殻から卵の内容物を取り出す
- 実験の2時間前に、生後8日目の孵化卵を取り、卵の上部が下を向くようにインキュベーター内で卵を180°回転させます。1時間後、卵を元の位置に回転させ、さらに1時間放置します。
注:実験の2時間前に卵を回転させると、卵の内容物を殻から取り出しやすくなります。 - インキュベーターから生後8日のインキュベート卵を取ります。
- 卵を水平に持ち、大きなピンセットの先のとがった背面(図1E)を使用して、卵の1/2下に小さなくぼみを作ります。卵殻を360°周回してリング状に小さなくぼみを作り続けます。インデント間には~10 mm の間隔を空けます。
注意: この手順中に、くぼみの間に小さな亀裂が形成され始める可能性があります。 - シェルの周りに小さなくぼみを作成したら、大きなピンセットの先のとがった背面を使用して、2つの小さなくぼみの間にシェルを割って、1つの大きな穴を開けます。
- 卵を37°CのPBSに完全に沈め、5分間水没させます。5分後、卵を容器内の計量ボートの近くに置いておきます。両方の親指の上部を大きな穴に入れ、卵をそっと開きます。卵は小さなくぼみに沿って割れます。
- 卵殻の周りに亀裂が形成されたら、2つの卵殻をそっと引き離し、卵の内容物が殻から分離するまで2つの部分をゆっくりと前後に動かし続けます。次に、卵の内容物を計量ボートにそっと落とします。
注意: 2枚の卵殻を前後に動かすと、より多くのPBSが卵殻に流れ込み、卵の内容物を殻から分離するのに役立ちます。時々、卵白が卵殻の内側にくっつくことがあります。このような場合は、ピンセットを使用して卵白を殻から分離します。 - 計量ボートと卵の含有量が入ったペトリ皿をPBSからゆっくりと持ち上げます。PBSから出たら、計量ボートを少し傾けて余分なPBSを取り除きます。
- 卵の内容物を含む計量ボートを金属製の計量ボートホルダーに入れ、目的の実験セットアップに移動します。
- 実験の2時間前に、生後8日目の孵化卵を取り、卵の上部が下を向くようにインキュベーター内で卵を180°回転させます。1時間後、卵を元の位置に回転させ、さらに1時間放置します。
- 作業エリアの準備
2. 選択したアプリケーション
- マイクロバブルやその他の溶液をCAM容器に注入する
- インジェクション設定の準備
- マイクロフォージを使用してガラスキャピラリーチューブからガラス針を引き出すか(図3A)、引っ張られたガラス毛細管針を購入します。
- ガラス毛細管針の先端が斜角になっていない場合は、針の先端のごく一部を折ってください。ガラス針を鉱物油で満たし、マイクロインジェクションシステムに入れます。ガラス針の鉱物油に気泡がないことを確認してください。
注意: 鉱油は、使用した注入システムの製造元の指示に従って追加されます。 - マイクロインジェクションシステムが許す限り、引っ張られたガラス毛細管針を空にし、ガラス針に空気を部分的に補充します。
注意: 少量の空気は、鉱油と注入される溶液の混合物を防ぎます。 - このプロトコルマイクロバブルに10μLの所望の溶液をワックス状のフィルムの上に置きます(図3B)。複数の溶液が必要な場合は、ピペッティング前に溶液を混合することができます7。
注意: 針にマイクロバブルを充填する前に、マイクロバブルドロップをワックスフィルムに~1分間放置して、マイクロバブルがドロップの上部に浮かんで集中するようにします。F型カスタムメイド超音波造影剤28の場合、この濃縮工程により、注入されるマイクロバブル濃度が~30%増加する。鶏胚血中の注射後濃度は、5日齢の胚の場合は32 x 10 3マイクロバブル/ μL、6日齢の胚の場合は19 x 103マイクロバブル/ μLになります。 - ガラス針の先端をワックス状フィルムの液滴に配置して、ガラス針にマイクロバブルおよび/または他の溶液を満たします。マイクロバブルを吸引するときは、針先を液滴の上部に配置して、マイクロバブル濃縮溶液を吸引してください。
注:マイクロバブルを注入する前に、ガラス針の先端を最高点まで上げ、~2分間待ちます。これにより、マイクロバブルがガラス針の先端に集中するようになります。
- インジェクション設定の準備
- CAM容器への注入
- 注入する前に、実体顕微鏡でCAMを見て、注入するのに最適な容器を選択します。常に胚の 静脈 の1つに注射してください。これらは血流が胚に向かって移動する血管です。静脈は、酸素化された血液のために動脈よりも色が薄い29。さらに、静脈は常に動脈の上にありますが、周囲に動脈がない前部および後部の硝子体静脈(つまり、 図6A、Bにアスタリスクで示されている分岐の少ない静脈)の2つの例外があります。
注:枝の1つに注射すると、注射中の血流の閉塞が制限されます。良好な注射部位は、 図6A、Bに矢印で示されている。注入された物質が胚に向かって流れるように強制するため、静脈に注射することが重要です。これに加えて、動脈に注射すると、ガラス針を外すときに大量の出血が発生し、胚が死滅します。 - ガラス針と胚を、ガラス針の先端と選択した静脈が同じ焦点面と同じ方向線になるように配置します。選択した静脈と平行に針をできるだけ水平に配置するようにしてください。針先が血管壁に触れる必要があります。
注意: ガラス針をできるだけ水平に配置することにより、容器全体を貫通する可能性が低くなります。 - 位置決め後、ゆっくりと前進し、ガラス針で容器壁を貫通します。貫通中、CAMは最初にガラス針の動きによって押しのけられます。容器の壁が貫通するまでガラス針を前進させ続けます。
注意: 誤って血管に穴を開けた場合は、針をゆっくりと引っ込めて内腔に戻します。内腔内に戻ったら、針を少し持ち上げ、血管に沿って前方に移動して針の位置を変更します。 - 貫通後、ガラス針をわずかに引っ込めて先端を血管内腔内に配置しやすくし、ガラス針を横に動かして血管壁に取り付けられていないことを確認します。少量の溶液をゆっくりと注入して、先端が血管内腔の内側に配置されていることを確認します(図3C)。
- 注入された溶液が血流に従うことを確認してください。そうでない場合は、ガラス針をわずかに動かし、ガラス針が正しく配置されるまで少量を注入し続けます17。
- 希望の量を注入したら、大量の出血を防ぐために、ガラス針を容器内に~15秒間放置します。次に、ガラス針を少し横、上下、前後に数回動かして、ガラス針を静かに引っ込めます。
注:一部の出血は正常です。ガラス針は卵白で簡単に詰まり、鈍くなるため、注射ごとに新しいガラス針を使用してください。
- 注入する前に、実体顕微鏡でCAMを見て、注入するのに最適な容器を選択します。常に胚の 静脈 の1つに注射してください。これらは血流が胚に向かって移動する血管です。静脈は、酸素化された血液のために動脈よりも色が薄い29。さらに、静脈は常に動脈の上にありますが、周囲に動脈がない前部および後部の硝子体静脈(つまり、 図6A、Bにアスタリスクで示されている分岐の少ない静脈)の2つの例外があります。
- 胚および/またはCAM血管の顕微鏡イメージング
- 音響膜付きホルダーの準備
- 2つの平行な50μm厚の音響透過性ポリカーボネート膜を備えた正方形のプラスチックホルダーからなる細胞培養チャンバー26を取り、さらに音響膜付きホルダーと称する。ふたで両方のポートを閉じます。
- メスを使用して、音響膜でホルダーから2つの膜の1つを取り除きます。
注意: メンブレンを取り外すには、プラスチックの接着剤ラインのすぐ隣でメンブレンをカットします。他の膜の損傷を防ぐために、端から滑り落ちないように注意してください。 - 小さなガラスビーカーで80〜95°Cに加熱することにより、デミ水溶液中の2%アガロースを~15 mL調製します。ガラスビーカーを溶かしたアガロース溶液で冷水栓で冷却します。
注意: アガロースが熱すぎると、音響膜が溶けて表面に凹凸が生じます。 - 溶液を約37°Cまで冷却したら、ホルダー全体がいっぱいになるまで、音響膜を使用してホルダーに溶液をゆっくりと注ぎます。アガロース層がプラスチックフレーム内に均等に分布するように、音響膜でホルダーを少し傾けます(図4A)。アガロース層が平らであることを確認し、アガロースを室温に設定します。
- 卵黄袋から胚とCAMを取り出し、音響膜でホルダーに置く
- セクション1.2、1.3、または1.4で説明されているように、卵から卵の内容物を取り出します。
- 必要に応じて、セクション2.1.2で説明されているように、マイクロバブルやその他の溶液をCAMに注入します。
- 1 Lのペトリ皿に~500 mLの37°C PBSを満たし、アガロースを含む音響膜を皿の底に置きます。アガロース層が上を向いていることを確認してください。
- 小さなハサミを使用して、卵の含有量物が計量ボートに入っている間に、CAM全体の周りの卵黄袋(Vitellus膜とも呼ばれます) の膜にすばやく 切り込みます(図4B)。はさみを同じ位置に保ち、計量ボートを回転させながら切断すると、精度と速度が向上します。
注:最初のカットが行われた瞬間から、卵黄が漏れ始めます。これにより、胚とCAMの視認性が低下します。6〜7カット以内にCAMの周りを完全にカットしてみてください。これには20秒以上かかることはありません。小さなピンセット(図1F)を使用して、硝子膜の端を保持し、CAMへの切断を防ぐことができます。 - 大さじを使用して、計量ボートから胚とCAMを含む切り欠き膜をすくい上げます。計量ボートからスプーンをゆっくりと持ち上げ、胚とCAMを含む切り欠き膜が残りの卵黄袋膜にまだ付着しているかどうかを目視検査します。このような場合は、はさみを使用して追加のカットを作成します。すくいながら、スプーンを少し傾けてできるだけ多くの卵黄を取り除きますが、乾かさないでください。切り出した胚とCAMを入れた膜を1Lシャーレに移し、37°C PBSに沈め、スプーンを取り出した。
- 胚とCAMを含む膜を37°CのPBSに沈めたら、小さなピンセット(図1F)を使用して膜の一方の端をつかみ、膜の周りをゆっくりと渦巻いて、まだ付着している卵黄を取り除きます。
- 卵黄をすべて取り除いたら、小さなピンセットを使用して胚とCAMを含む膜を移動し、音響膜を備えたホルダーの上に配置します。
- 昆虫標本ピンを1本使用して、胚とCAMを含む膜を片隅に固定します。CAMの血管に穴を開けることは避け、メンブレンのみを固定してください。
- 2番目の昆虫標本ピンを使用して、胚とCAMを含む膜を斜め反対側の角に固定します。
- 胚とCAMを含む音響膜でホルダーを37°C PBSからゆっくりと持ち上げます。ホルダーを少し傾けて、ほとんどのPBSを取り除きます。
- 小さなピンセット(図1F)を使用して、胚とCAMを含む膜を引き伸ばして、音響膜を備えたホルダー全体に均等に分配し、膜の残りの部分を固定します。胚とCAMを含む膜が平らになるようにわずかに引き伸ばされていることを確認してください(図4C)。
- 胚とCAMを含む膜を固定した音響膜を備えたホルダーを、37°Cに保たれた顕微鏡セットアップに入れます。
- カバーガラスまたは音響的および光学的に透明な膜(目的の対物レンズと超音波の使用に応じて)を胚またはCAM(図4D)の関心領域の上に配置して、光学的視覚化を可能にします。
- 音響膜付きホルダーの準備
- ニワトリ胚および/またはCAM血管の超音波イメージング
- ニワトリ胚およびCAM血管の側面からの超音波イメージング
- セクション1.2、1.3、または1.4の説明に従って卵の含有量を取り出します。ただし、標準の計量ボートは使用しないでください。代わりに、音響的に透明な壁が1つあるカスタムメイドの計量ボートを使用してください。
注:標準の計量ボートは、計量ボートの片側を切り取り、エポキシ接着剤を使用して接着されたポリエステルホイルの窓と交換することによって調整されました。 - 好みの超音波トランスデューサを37°Cの水浴に沈め、必要なスタンドオフ距離で目的の場所に配置します。
- 透明な壁が探触子に面するように計量ボートを水浴に入れます。計量ボートが探触子と同じ高さになるのに十分な深さであることを確認してくださいが、計量ボートに水が入らないようにします(図5A)。
- 必要に応じて、顕微鏡やレーザーなど、胚またはCAM血管の上部に別のセットアップを追加します(図5A)。
- セクション1.2、1.3、または1.4の説明に従って卵の含有量を取り出します。ただし、標準の計量ボートは使用しないでください。代わりに、音響的に透明な壁が1つあるカスタムメイドの計量ボートを使用してください。
- 音響干渉のない胚およびCAM血管の上部からの超音波イメージング
- 2 Lビーカーグラスに37°C PBSを充填します。500 Lビーカーグラスの底に2 mLビーカーグラスを逆さまに置きます。500mLビーカーグラス内の空気を避けてください。
注意: 500 mLビーカーガラスは、卵の含有量が入った計量ボートをPBS表面に近づけることを目的としています。ビーカーを他のサイズの物体に置き換えることにより、トランスデューサーと卵の含有量の間の距離を変えることができます。 - 充填した2 Lビーカーグラスと500 mLビーカーグラスを37°Cの水浴に入れます。
- セクション1.2、1.3、または1.4の説明に従って卵の含有量を取り出します。
- 卵の内容物を37°C PBSで濡らし、胚を透明な粘着フィルムで覆います。これは、胚を同じ位置に保ち、胚が回転したり浮いたりするのを防ぐために行うことができます。
注意: 卵の内容物をPBSで濡らすことで、べたつきが少なくなり、卵の内容物を透明な粘着フィルムで覆いやすくなります。 - 卵の含有量が入った計量ボートを直径90mmのペトリ皿に入れ、ペトリ皿をPBSにゆっくりと沈めます(図5B)。
注意: 2つのclを使用しますamp 向かい合ったペトリ皿の側面に、ペトリ皿を沈めやすくなります。 - 超音波トランスデューサを希望のスタンドオフ距離に配置します。
- 2 Lビーカーグラスに37°C PBSを充填します。500 Lビーカーグラスの底に2 mLビーカーグラスを逆さまに置きます。500mLビーカーグラス内の空気を避けてください。
- 可動トランスデューサーによるニワトリ胚およびCAM血管の超音波イメージング
- セクション1.2、1.3、または1.4の説明に従って卵の含有量を取り出します。
- 小さなガラスビーカーで溶液を80〜95°Cまで加熱することにより、デミ水中の2%アガロース溶液を調製します。ガラスビーカーを溶かしたアガロース溶液で流水タブで冷却します。
- アガロース溶液を平らな容器に注ぎ、厚さ約1mmのアガロースパッドを作ります。完全に冷却してセットしたら、メスを使用してアガロースパッドを希望のサイズにカットします。
注意: アガロースパッドの厚さを変更して、超音波トランスデューサーが正しく機能するために必要な目的の焦点距離を得ることができます。 - アガロースパッドを胚とCAMの上に置きます(図5C)。アガロースパッドの上部に37°CのPBSを~30 μLを数滴加え、アガロースパッドと探触子の間に薄いPBS層を作成します。
注意: PBSを使用すると、探触子がアガロースパッドに付着するのを防ぐことができます。これは、例えば、モーターを使用して2次元トランスデューサを機械的に動かし、3次元スキャンを行う場合に有益です(図9B)11。トランスデューサを移動する必要がない場合は、PBSを超音波ゲルで置き換えることもできます。 - 目的の超音波トランスデューサーを配置します。
- ニワトリ胚およびCAM血管の側面からの超音波イメージング
結果
このプロトコルでは、孵卵の5〜8日目に卵の内容物を殻から取り出す3つの方法について説明します(HH 26-3522)。図6は、殻から取り出した後の計量ボートの卵含有量を示しています。5日齢の胚およびCAM(図6A)を、セクション1.2に記載の方法を用いて取り出した。6日齢および7日齢の胚およびCAM(図6B、C)を、セクション1.3に記載の方法を用いて取り出した。8日齢の胚およびCAM(図6D)を、セクション1.4に記載の方法を用いて取り出した。胚またはCAMへの出血または損傷は観察されず、これらの方法を使用して、胚またはCAM血管に損傷を与えることなく卵の内容物を安全に殻から取り出すことができることを示しています。正しく実行されると、5日齢の胚の方法は、すべての手順の90%で生存可能な胚と無傷のCAMを提供します。生存率は、卵殻から正常に抽出された受精卵の総数に基づいています。2番目の方法では、6日齢および7日齢の孵化卵の場合、生存可能な胚と無傷のCAMの可能性は、6日齢で約75%、7日齢で約50%です。8日齢の胚について説明した3番目の方法では、生存可能な胚と無傷のCAMの可能性は約60%です。5日齢と8日齢の胚の発生段階の違いが観察され、ハンバーガーとハミルトン22と一致します。胚のサイズとCAM血管の複雑さの両方が発生中に増加します(図6A-D)。 図6Cは、図5Cに示す超音波セットアップを使用して胚とCAMを画像化できるようにする、卵の内容物の上にアガロースの薄いパッチを示しています。卵の内容物が殻から取り出された後、胚の心拍が肉眼で見えます。これらの卵外胚の心拍数は、5日目の183拍/分(bpm)から8日目の~208bpmまでの卵胎胚と同様です30。加湿して37°Cに保つと、胚はこの心拍数を実験的な超音波セットアップで~5時間維持します。
前述の3つの方法の間に複数の合併症が発生する可能性があります。 図7A は、CAMの下に閉じ込められた空気を示しており、胚を超音波イメージングに適さず、気泡の圧力も胚および/またはCAMを損傷する可能性があります。この問題は、卵の内容物を殻から取り出すときに、殻の中の気嚢が殻の外の空気と接触しない場合に発生します。 図7B は、画像の右上にある卵黄袋からの卵黄の小さな漏れを示しています。これは、卵黄袋が殻の鋭いエッジによって損傷を受けたとき、または卵黄袋がピンセットによって貫通されたときに、卵の内容物を殻から取り出しているときに発生する可能性があります。卵黄の漏出は、胚とCAM血管の視認性に影響を与える可能性があります。 図7C は、CAMの下に気泡が閉じ込められた胚を示す。これは時々胚発生で起こります。発生する可能性のある別の合併症は、血管の損傷です。この損傷は、卵の内容物を殻から取り出しているとき、または注射を行っているときに発生する可能性があります(図7D)。これに加えて、胚と血管も時間の経過とともに乾燥する可能性があります(図7E)。これは、卵の含有量にPBSが振りかけられていない場合に発生します。胚の乾燥は、胚の生存能力に影響を与える大規模な毛細血管閉塞を引き起こす可能性があります(図7F)。大規模な毛細血管閉塞は、発生中または胚の心拍が安定していないときにも発生する可能性があります。
卵の内容物を何の合併症もなく殻から取り出した後、胚に、例えばマイクロバブルなどの超音波造影剤を注射することができる(図3C)。図8は、注入時に血管の内腔に循環するマイクロバブルを示す。これらのマイクロバブルは血流とともに運ばれ、数時間血液循環に存在し続けます(補足ビデオ1)。循環中のこれらのマイクロバブルの存在は、異なるタイプのCEUSおよび薬物送達実験を実行する可能性を生み出す7,11,12。CAMは、3つの例を示す新しい超音波コントラスト検出法の研究に理想的です。図9Aは、マイクロバブル注入前後のBモードおよびCEUSにおける6日齢のニワトリ胚の高周波超音波サブハーモニックイメージングを示す。ここでは、CAM血管に5μLの超音波造影剤を注入し、MS250プローブを備えた前臨床動物超音波装置(送信周波数30 MHz、受信周波数15 MHz、電力10%)でイメージングを行いました。マイクロバブル注入前は、Bモード画像で胚の心臓の内部にコントラストがすでに見られます(図9A-I)。この現象は、超音波画像における血液のコントラストを増加させる鳥赤血球中の核の存在によるものです5,31。マイクロバブルの追加により、BモードとCEUSイメージングの両方で、胚のコントラストと視認性が向上しました。図9Bは、6日齢の胚およびその周囲の血管の光学的および高周波3Dサブハーモニック画像を示す。CAMに5 μLの超音波造影剤を注入し、MS550sプローブを備えた前臨床動物超音波装置(送信周波数40 MHz、ピーク負圧~300 kPa)でイメージングを行いました。これらの結果は、造影剤と組み合わせたCEUSイメージングを使用して、高周波3Dサブハーモニック画像を作成し、胚の外側の血管をイメージングすることもできることを示しています。図9Cは、6日齢の胚のCAM微小血管のカスタムプローブ(送信周波数26MHzおよび受信周波数39および65MHz)で作製した光学画像および超高調波血管内超音波(IVUS)画像を示す。CAM血管に4±1μLの超音波造影剤を注入した。光学画像およびIVUS画像は、対応する血管ネットワークを示す同じ胚および同じ関心領域からのものである。
ニワトリ胚およびCAM血管は、超音波媒介薬物送達を調べるためにも使用でき、その一例を示す。卵黄はイメージング中に光路を遮るため、胚およびCAM血管における薬物送達を光学的に調べるためには、卵黄袋の除去が必要である。この研究のために、胚とCAMを含む膜を卵黄袋から分離することによって、セクション2.2で説明されているように、胚とCAMを顕微鏡イメージング用に準備しました(図4C)。これらの胚では、心拍数は約80bpmで安定しており、37°Cに保つと最大2時間生存します7。 図10は、CAM血管の内皮細胞における超音波およびマイクロバブル媒介薬物送達研究を示す。脂質被覆マイクロバブルを、αvβ3抗体を用いて血管壁に標的とし、蛍光色素DiI7で染色し、CAM容器に注入した(図10A、C)。CAM血管内皮細胞核をHoechst 33342(図10B)で染色し、モデル薬物ヨウ化プロピジウム(PI)を使用してソノポレーションを視覚化しました7。これらの色素は両方ともマイクロバブルと同時に注入した。超音波処理(1MHz、200kPaピーク負圧、1000サイクルのシングルバースト)では、標的マイクロバブルに最も近い核にPI取り込みが観察されました(図10D)。これは、標的マイクロバブルの超音波誘発振動が内皮細胞膜に孔を作ることができたことを示しています。
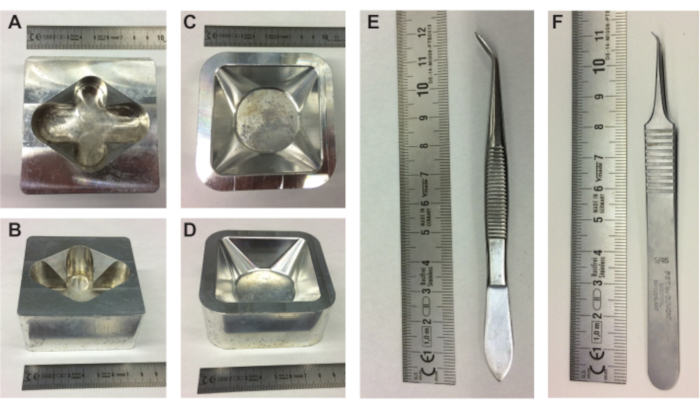
図 1.胚準備装置。(A-B) 金属製の卵ホルダーの上面図と側面図、および金属製の計量ボートホルダーの上面図と側面図(C-D)。 (E-F)卵の内容物を殻から取り出すために必要なピンセット。cm単位で拡大します。この図の拡大版を表示するには、ここをクリックしてください。
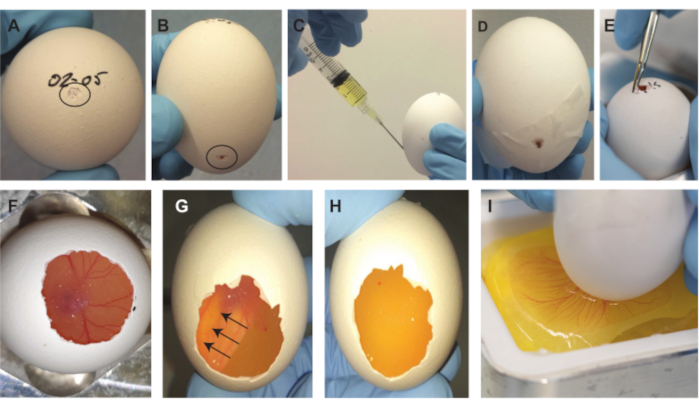
図 2.胚除去手順。(A) 卵の上に小さなくぼみがあり、黒い円で示されています。 (B) 卵の2/3下の小さなくぼみ、黒い円で示されています。 (C) 卵白~2mLを抜き取る。 (D) 側面の隙間をテープで塞いだ。 (E) 卵の上部にある小さな開口部を拡大します。 (F) 殻の一部を摘出した後、胚が見えるようになる。 (G-H) 卵子を180°回転させると、胚は浮き上がり、見えなくなります(矢印は胚の移動方向を示します)。1〜2分後、胚は下から見えなくなります。 (I) 膜を引っ掻いた後、卵の内容物は計量ボートに落ちます。この図の拡大版を表示するには、ここをクリックしてください。
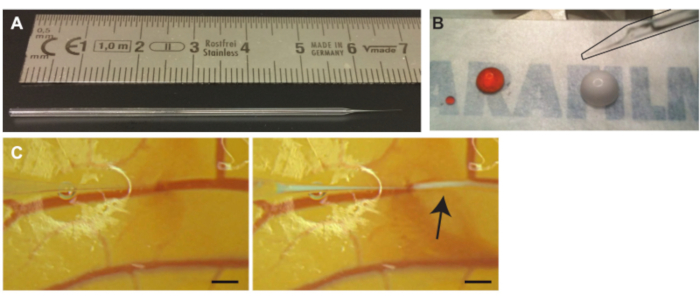
図 3.CAM容器へのマイクロバブルの注入。(A) ガラス毛細管針。(B)注射前の吸引前のヨウ化プロピジウム(PI)溶液(左滴)とマイクロバブル(右滴)のスケール ( cm単位)。右上に針(黒で輪郭が描かれている)が見えます (C) マイクロバブル注入。毛細血管針の先端は、静脈の1つの内腔の内側に位置しています(左)。矢印で示した白い雲のマイクロバブルが注入され、血流に沿って分散します(右)。スケールバーは1mmを表します。 この図の拡大版を表示するには、ここをクリックしてください。
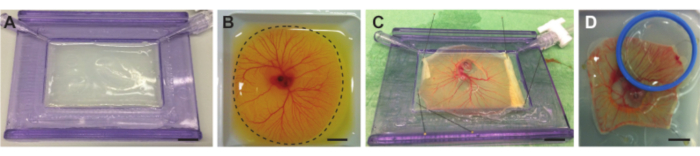
図 4.卵黄袋から胚とCAMを取り出し、音響膜でホルダーに置きます。(a) アガロース層を充填した吸音膜付きホルダー。 (B) 切断前の計量ボート内の鶏胚およびCAM容器。点線はCAM周辺の切断線を示す。 (C) 卵黄からニワトリ胚とCAMを分離し、音響膜上に固定する。(D)CAMの上に置かれたホルダー (青) に音響的および光学的に透明な膜で鶏胚を固定した。ホルダーはデミ水で満たすことができるので、水浸対物レンズを使用できます。すべてのスケールバーは1cmを表します。 この図の拡大版を表示するには、ここをクリックしてください。

図 5.鶏胚とCAM超音波イメージングのための異なるセットアップ。(A) 側面からの超音波イメージングのセットアップ。ニワトリ胚を、音響的に透明な壁を1つ備えたカスタム調整された計量ボートに入れ、37°Cの水浴に入れた。超音波トランスデューサは、音響的に透明な壁の隣の左側(a)側に配置され、その上に光音響イメージング用のレーザー(b)を配置しました。 (B) 上からの超音波イメージングのセットアップ。胚およびCAMを、37°Cの水浴中に置いたPBSのビーカーに沈めた。破線のアウトラインは、2 Lガラスビーカー(a)と500 mLガラスビーカー(b)を内側に示しています。 (C) 可動トランスデューサーで上から超音波画像撮影を行うためのセットアップ。薄いアガロースパッド(点線)を、トランスデューサとアガロース表面との間の結合としてPBSの薄層と共に胚の上に置いた。この図の拡大版を表示するには、ここをクリックしてください。
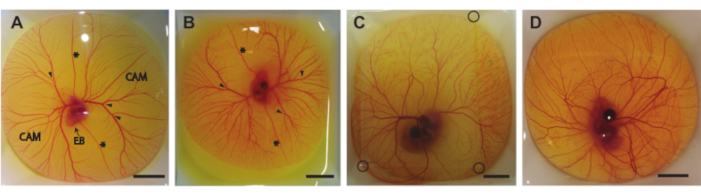
図 6.殻の外側の卵の含有量。(A) 5日間のインキュベーション後に殻から取り出した卵の内容物。絨毛尿膜(CAM)、胚体(EB)、前部および後部の卵子静脈(*)、および注射に適した部位(矢じり)が示されます。 (B) 6日間のインキュベーション後に殻から取り出した卵の内容物。前部および後部の硝子体静脈(*)および注射に適した部位(矢じり)が示されます。 (C) 7日間のインキュベーション後に殻から取り出した卵の内容物。超音波イメージングを可能にするために、アガロースのパッチが上に置かれます。アガロースパッチの角は黒い円で示されています。 (D) 8日間のインキュベーション後に殻から取り出した卵の内容物。すべてのスケールバーは1cmを表します。 この図の拡大版を表示するには、ここをクリックしてください。
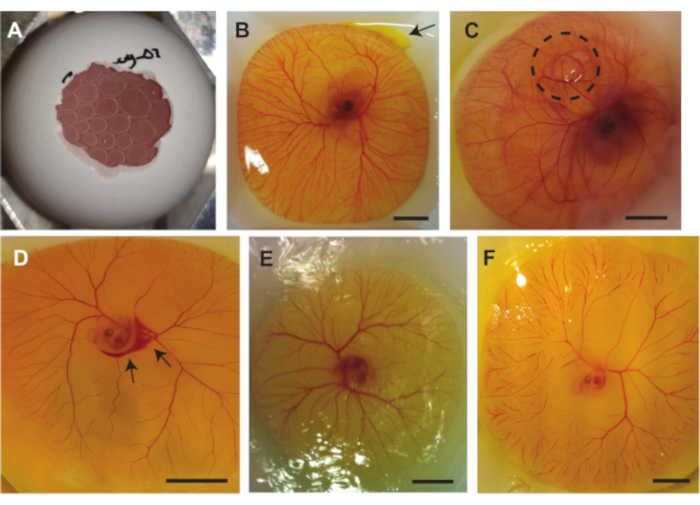
図 7.ニワトリ胚とCAMモデルによる処置中に起こりうる合併症。(A) 方法1.2(5日齢の胚)または1.3(6〜7日齢の胚)を使用して卵の内容物を殻から取り出すときにCAMの下に閉じ込められた気泡。( B) 右上に矢印で示された卵黄の小さな漏れ(6日齢の胚)。( C) CAMの下に閉じ込められた空気、黒い点線の円で示した(7日齢の胚)。( d) 出血、黒矢印で示す(5日齢の胚。 (E) 乾燥した胚とCAM(5日齢の胚)。( F) 巨大な毛細血管閉塞(5日齢の胚)。すべてのスケールバーは1cmを表します。 この図の拡大版を表示するには、ここをクリックしてください。
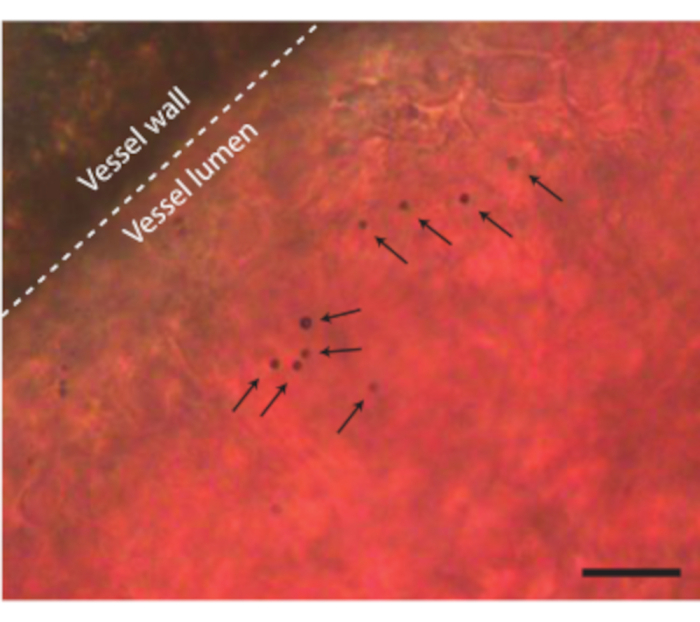
図 8.CAM血管内のマイクロバブル。 血管壁は点線で示され、単一のマイクロバブルは矢印で示されます。スケールバーは20μmを表す。対応する顕微鏡記録は、補足ビデオ1にあります。この図の拡大版を表示するには、ここをクリックしてください。
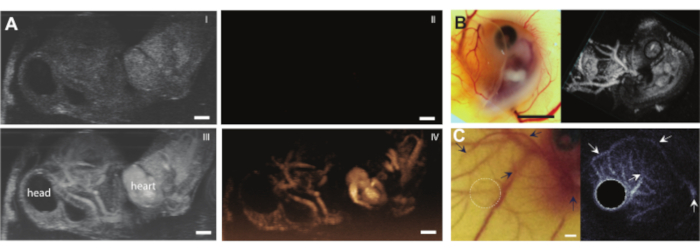
図 9.ニワトリ胚およびCAM血管における造影超音波イメージング。(A)アガロースのパッチを上にした6日齢の胚のBモード(I、III)およびリアルタイムサブハーモニック(II、IV)画像(MS250プローブを備えた前臨床動物超音波装置、30 MHzの送信および15 MHzの受信周波数、10%の電力)の最大強度投影。上の画像(I、II)は、5μL超音波造影剤の注入前と下段(III、IV)の結果を示しています。スケールバーは1mmを表します。この画像は、Daeichin et al. 201511(B)光学(左)および3Dサブハーモニックイメージング(右)の許可を得て変更されており、上部にアガロースのパッチが付いた6日齢のニワトリ胚の。CAM血管に5 μLの超音波造影剤を注入し、高周波プローブ(MS550sプローブを備えた前臨床動物超音波装置、送信周波数40 MHz、ピーク負圧~300 kPa、前臨床動物超音波装置3-Dモードでレンダリング)でイメージングを行いました。スケールバーは5mmを表します。この画像はDaeichin et al. 201511の許可を得て修正されています。(C)6日齢の胚のCAM微小血管系の超高調波血管内超音波(IVUS)の光学画像(左)と平均強度投影。CAM容器に4±1μLの造影剤を注入した。超高調波IVUSイメージングは、カスタムIVUSプローブ(送信周波数35MHz、ピーク負圧600kPa)を用いて実施した。両方の画像は、同じ胚と関心領域から作られています。矢印は、2つの画像における対応する船舶を示す。スケールバーは1mmを表します。この画像は、Maresca et al. 201412の許可を得て変更されています。この図の拡大版を表示するには、ここをクリックしてください。
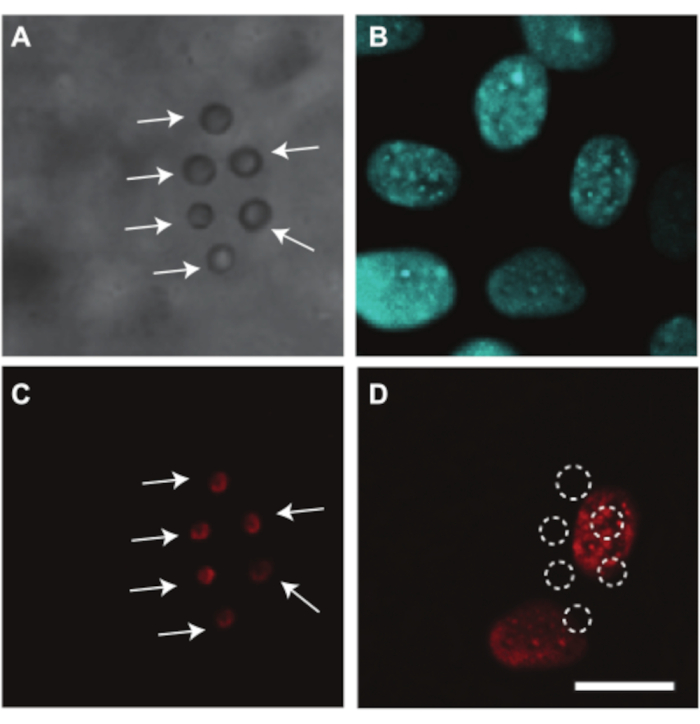
図 10.6日齢胚におけるCAM血管内皮細胞への薬物送達。 (A)超音波治療前に血管壁に付着した6つのαvβ3ターゲットマイクロバブルの明視野画像(白い矢印で示)。(B)超音波処理前に蛍光染色された内皮細胞核。(C)超音波処理前の染色された標的マイクロバブルの蛍光像(白い矢印で示)。(D)超音波処理後の標的マイクロバブルの下の細胞核へのモデル薬物ヨウ化プロピジウム(PI)の取り込み(1MHz、200kPaピーク負圧、1000サイクルのシングルバースト)。スケールバーは10μmを表し、すべての画像に適用されます。この画像は、Skachkov et al. 20147の許可を得て変更されています。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル
補足ビデオ 1. CAM血管内のマイクロバブル。 スケールバーは20μmを表します。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルでは、造影剤増強超音波イメージングとマイクロバブルを介した薬物送達を研究するための in vivoモデルとして、5〜8日齢のニワトリ胚とそのCAMを取得して使用する方法に関する3つの方法について説明しています。5日齢(セクション1.2)および6〜7日齢(セクション1.3)の胚を殻から取り出すための最も重要なステップは次のとおりです:1)卵白を引き出す前に、卵の上部に小さな穴を開けて卵殻全体を気嚢に入れます。2)シェルの大きな開口部に滑らかなエッジを作成します。8日齢の胚を殻から取り出す方法(セクション1.4)にとって最も重要なステップは次のとおりです:1)卵に沿って素敵な亀裂を作るのに十分な数のくぼみを作ります。2)卵をPBSに沈めたままにします。すべての方法で胚の生存率を確保するためには、卵とその内容物を37°Cに保つことが重要です。 また、CAM動脈への注入は避けてください。胚の活力を確保するために、研究中に胚の心拍数を視覚的に監視することをお勧めします。胚の正確な発生段階を確認するには、Hamburger & Hamilton22の表示を使用することができます。
胚、CAM、および卵黄袋への損傷を防ぐことが重要です。この損傷は、胚とCAMの生存率、血流、および視認性に影響を与える可能性があります。さらに、卵黄袋の損傷、ひいては膜の剛性が低いため、CAM容器への注入が不可能になります。5日齢の胚は気嚢が比較的小さいため、卵の内容物を取り除くことができる十分に大きな穴を殻に開けるには、2mLの卵白を引き出す必要があります。その結果、卵殻と胚の間により多くのスペースが作成されます。卵白を引き抜いた後、針が入った穴をテープで塞ぐ必要があります。それでも卵白が漏れる場合は、別のテープを貼ってください。これに加えて、側面の穴にテープを貼ると、卵の内部に真空が発生し、ステップ1.2.2.8で大きな穴が開いたときに卵の内容物が自重で脱落するのを防ぎます。胚またはCAMの損傷は、卵殻の端が鋭すぎる場合、または卵の内容物を計量ボートに厳密に落としすぎた場合にも発生する可能性があるため、卵殻を計量ボートのすぐ近くに保つ必要があります。開発の5日目と6日目の間に、CAMは卵殻膜32に付着し始める。この付着は、卵殻から卵の内容物を取り出すときに胚とCAMを損傷するリスクを高めます。6〜7日間の孵化卵のために、または8日間の孵化卵について説明したようにPBS充填容器にPBSを注入した後に卵を開くことにより、損傷のリスクが低減される。CAM静脈への注射について:最初の注射が失敗した場合、損傷が軽微な場合、または別のCAM静脈にある場合は、同じ静脈のさらに上流で2回目の注射を行うことができます。卵黄から胚とCAMを分離すると、胚とCAMの血管が光学的に透明になります。結果として、胚はその主要な栄養源を失います33。この栄養素の損失は、まだ卵黄30と接触している6日齢の胚の~190と比較して、観察された心拍数が80bpmと低く、この分離手順後の生存時間が2時間短縮されたことの説明である可能性があります。心拍数と生存時間の低下に影響を与える可能性のある別の要因は、卵黄分離された胚とCAM血管を37°Cに保つという課題です。 顕微鏡ステージインキュベーターは助けになるかもしれません。これに加えて、卵黄からのCAMの剥離は、膜張力が低くなるため、組織の機械的変化につながる可能性があります。膜張力が低いと、内血管のせん断速度が上昇し、心拍数が低下する可能性があります。
ex ovo ニワトリ胚およびCAM血管には、コントラスト増強超音波イメージングおよびマイクロバブル媒介薬物送達研究のための短時間観察のみを含む、in vivoモデルとしていくつかの制限があります。5日目に100±23μL、6日目に171±23μLと血液量が少ないため34、最大容量~5μLを注入することができます。発達の後期(7日目以上)では、血管の剛性が増し、卵黄の弾力性が低下します。これは、古い胚への注射の成功を複雑にする可能性があります。マイクロバブルが注入されると、ニワトリ胚はこの段階では完全に発達した免疫システムを持っていないため、何時間も循環します35。したがって、マイクロバブルはヒトのように~6分以内にクリアされません36,37、非結合標的マイクロバブルがクリアされるまで5〜10分の待機期間を持つ典型的な超音波分子イメージング研究を行う38は実行不可能である。マイクロバブルを標的とするためには、鳥類内皮細胞に結合することができる適切なリガンドを、血管新生マーカー αvβ37について前述したようなものを使用する必要がある。このモデルで考慮すべき他の側面は、古い胚(>8日)で卵黄から胚とCAM血管を分離することの難しさの増加と、ヒトと比較して~20%39のヘマトクリット値が低いことです。後者は、マイクロバブル振動がより粘性のある環境40で減衰することが知られているため、マイクロバブル振動に影響を与え得る。CAM動脈はCAM静脈41,42よりも酸素化が少ない。この違いは、例えば血液酸素化の光音響イメージングを研究するときに考慮に入れるべきである。
ここで説明する方法は、超音波画像化または薬物送達研究の日、典型的にはインキュベーションの5〜8日目に卵殻から卵の内容物を取り出すことを可能にする。これは、3日間のインキュベーション後に卵の内容物を殻から取り出し、exovo培養としてさらに発展させる既存の方法とは異なります18,20,21。利点は、卵殻から取り出し、さらにexovo 1,18培養中の抗生物質の回避と比較して、5日齢で90%、6日間で75%、7日間で50%、7日間で50%、8日齢で60%の生存率が高いことです。 Ex OVO培養用の20および大型滅菌インキュベーター。6〜8日齢の胚の生存率は、CAMが殻21に付着し始め、抽出時にCAM膜が破裂しやすくなるため、低くなります。卵黄のCAM形態による胚の分離は、胚とCAMを光学的に透明にすることも記載されている。
卵の内容物を異なるセットアップに配置することにより、ニワトリ胚とCAMは、IVUS、光音響、2Dおよび3Dの超音波造影剤の有無にかかわらず、多数の超音波画像検査に使用できます。焦点は、新しい超音波パルススキームの開発または新しいトランスデューサのテストにあります。これに加えて、このモデルは、新しい超音波造影剤と、流れている血管内でのそれらの挙動を調査するためにも使用できます。マイクロバブルを介した薬物送達のメカニズムはまだ不明であるため43、in vivo CAMモデルの使用は、細胞応答に関連するマイクロバブルの挙動を研究することにより、メカニズムの解明に役立つ可能性があります。最後に、CAM血管は、異種移植腫瘍移植を調査するのに適したシステムであることが証明されています44。これにより、CAM血管をモデルとして使用して、超音波を使用した腫瘍イメージングを調査したり、CEUSを使用して腫瘍内の血流を調べたりする可能性が生まれます。腫瘍は通常、8日齢または9日齢の胚1,14,45のCAM血管に移植され、そのために胚は孵卵の3日目に卵殻から取り出され、さらにexovoが発達します。このプロトコルに記載されている方法は、腫瘍移植の日まで卵子で胚を成長させるために使用できます。
著者らは、この論文が、造影剤やフロー研究の応用のための in vivoモデルとして、ニワトリ胚とその絨毛尿膜(CAM)を使用したい研究者に役立つと信じています。
開示事項
著者は開示するものは何もありません。
謝辞
この作業は、NWOの一部である応用工学科学(TTW)(Vidiプロジェクト17543)によってサポートされました。著者らは、オランダのエラスムスMC大学医療センターロッテルダムの技術支援について、生物医学工学科のRobert Beurskens、Luxi Wei、Reza Pakdaman Zangabad、実験医療機器学科のMichiel Manten、Geert Springelingに感謝の意を表します。
資料
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Clamp (Kocher clamp) | |||
| Cling film | |||
| Holder with acoustic membrane (CLINIcell 25 cm2) | MABIO, Tourcoing, France | CLINIcell25-50-T FER 00106 | |
| Demi water | |||
| Disposable plastic Pasteur pipets | VWR | 612-1747 | |
| Eggs | Drost Pluimveebedrijf Loenen BV, the Netherlands | Freshly fertilized | |
| Fridge 15 °C | |||
| Glass capillary needles | Drummond | 1-000-1000 | Inside diameter: 0.0413 inch |
| Heating plate 37 °C | |||
| Humidified incubator 37 °C | |||
| Insect specimen pins | |||
| Metal egg holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 A,B | ||
| Metal weighing boat holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 C,D | ||
| Microinjection system | FUJIFILM VisualSonics | ||
| Mineral oil | Sigma-Aldrich | M8410-100ML | |
| Needle, 19 G | VWR (TERUMO) | 613-5392 | |
| Phosphate-bufferes saline (PBS), 1x | ThermoFisher | 10010023 | |
| Petri dish, 1 L | Glass | ||
| Petri dish, 90 mm diameter | VWR | 391-0559 | |
| Preclinical animal ultrasound machine (Vevo 2100) | FUJIFILM VisualSonics | ||
| Probe (MS250) | FUJIFILM VisualSonics | 30 MHz transmit and 15 MHz receive frequency | |
| Probe (MS550s) | FUJIFILM VisualSonics | transmission frequency of 40 MHz | |
| Scalpel | VWR (SWANN-MORTON) | 233-5363 | |
| Scissors, small | Fine Science Tools (FST) | 14558-09 | |
| Syringe, 5 mL | VWR (TERUMO) | 613-0973 | |
| Table spoon | |||
| Tape (Scotch Magic tape) | Scotch | ||
| Tissue paper | Tork | ||
| Tweezers large | VWR (USBECK Laborgeräte) | 232-0107 | See figure 1E |
| Tweezers small | DUMONT Medical, Switzerland | 0103-5/45 | See figure 1F |
| Ultrasound contrast agent (custum made F-type) | Produced as described by: Daeichin, V. et al. Microbubble Composition and Preparation for Imaging : In Vitro and In Vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555–567 (2017). | ||
| Ultrasound contrast agent (MicroMarker) | FUJIFILM VisualSonics, Inc. | ||
| Ultrasound contrast agent (Definity) | Lantheus medical imaging, United States | ||
| Ultrasound gel | Aquasonic | ||
| Waxi film (Parafilm) | Parafilm | ||
| Weighing boats (85 × 85 × 24 mm) | VWR | 611-0094 |
参考文献
- Martowicz, A., Kern, J., Gunsilius, E., Untergasser, G. Establishment of a Human Multiple Myeloma Xenograft Model in the Chicken to Study Tumor Growth, Invasion and Angiogenesis. Journal of Visualized Experiments. (99), e1 (2015).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A Submerged Filter Paper Sandwich for Long-term Ex ovo Time-lapse Imaging of Early Chick Embryos. Journal of Visualized Experiments. (118), e1 (2016).
- Brauer, R., Chen, P. Influenza Virus Propagation in Embryonated Chicken Eggs. Journal of Visualized Experiments. (97), e1 (2015).
- Oosterbaan, A. M., Ursem, N. T. C., Struijk, P. C., Bosch, J. G., van der Steen, A. F. W., Steegers, E. A. P. Doppler flow velocity waveforms in the embryonic chicken heart at developmental stages corresponding to 5-8 weeks of human gestation. Ultrasound in Obstetrics and Gynecology. 33 (6), 638-644 (2009).
- McQuinn, T. C., Bratoeva, M., DeAlmeida, A., Remond, M., Thompson, R. P., Sedmera, D. High-Frequency Ultrasonographic Imaging of Avian Cardiovascular Development. Developmental Dynamics. 236 (12), 3503-3513 (2007).
- Stieger, S. M., Caskey, C. F., Adamson, R. H., Curry, F. E., Wisner, E. R., Ferrara, K. W. Enhancement of Vascular Permeability with Low-Frequency Contrast-enhanced Ultrasound in the Chorioallantoic Membrane Model. Radiology. 243 (1), 112-121 (2007).
- Skachkov, I., Luan, Y., van der Steen, A. F. W., De Jong, N., Kooiman, K. Targeted microbubble mediated sonoporation of endothelial cells in vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (10), 1661-1667 (2014).
- Vargas, A., Zeisser-Labouèbe, M., Lange, N., Gurny, R., Delie, F. The chick embryo and its chorioallantoic membrane (CAM) for the in vivo evaluation of drug delivery systems. Advanced Drug Delivery Reviews. 59 (11), 1162-1176 (2007).
- Rytelewski, M., Buensuceso, A., Leong, H. S., Deroo, B. J., Chambers, A. F., Koropatnick, J. Evaluating the Effectiveness of Cancer Drug Sensitization In Vitro and In vivo. Journal of Visualized Experiments. (96), e1 (2015).
- Schmitd, L. B., Liu, M., Scanlon, C. S., Banerjee, R., Silva, N. J. D. The Chick Chorioallantoic Membrane In vivo Model to Assess Perineural Invasion in Head and Neck Cancer. Journal of Visualized Experiments. (148), e1 (2019).
- Daeichin, V., Bosch, J. G., Needles, A., Foster, F. S., van der Steen, A., de Jong, N. Subharmonic, non-linear fundamental and ultraharmonic imaging of microbubble contrast at high frequencies. Ultrasound in Medicine and Biology. 41 (2), 486-497 (2015).
- Maresca, D., et al. Imaging microvasculature with contrast-enhanced ultraharmonic ultrasound. Ultrasound in Medicine and Biology. 40 (6), 1318-1328 (2014).
- Lindsey, B. D., et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography. Annals of Biomedical Engineering. 45 (4), 939-948 (2017).
- Paproski, R. J., Jovel, J., Wong, G. K. S., Lewis, J. D., Zemp, R. J. Enhanced detection of cancer biomarkers in blood-borne extracellular vesicles using nanodroplets and focused ultrasound. Cancer Research. 77 (1), 3-13 (2017).
- Huang, C., et al. Short Acquisition Time Super-Resolution Ultrasound Microvessel Imaging via Microbubble Separation. Scientific Reports. 10, 1-13 (2020).
- Lowerison, M. R., Huang, C., Kim, Y., Lucien, F., Chen, S., Song, P. In vivo Confocal Imaging of Fluorescently Labeled Microbubbles: Implications for Ultrasound Localization Microscopy. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 67 (9), 1811-1819 (2020).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo Characterization of Ultrasound Contrast Agents: Microbubble Spectroscopy in a Chicken Embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yalcin, H. C., Shekhar, A., Rane, A. A., Butcher, J. T. An ex-ovo Chicken Embryo Culture System Suitable for Imaging and Microsurgery Applications. Journal of Visualized Experiments. (44), e4 (2010).
- Kokhuis, T. J. A., et al. Intravital microscopy of localized stem cell delivery using microbubbles and acoustic radiation force. Biotechnology and Bioengineering. 112 (1), 220-227 (2015).
- Cloney, K., Franz-Odendaal, T. A. Optimized Ex-ovo Culturing of Chick Embryos to Advanced Stages of Development. Journal of Visualized Experiments. (95), e6 (2015).
- Dohle, D. S., et al. Chick ex ovo Culture and ex ovo CAM Assay: How it Really Works. Journal of Visualized Experiments. (33), e2 (2010).
- Hamburger, V., Hamilton, H. A Series Of Normal Stages In The Developent Of The Chick Embryo. Journal of Morphology. 88 (1), 231-272 (1951).
- Ribatti, D. A morphometric study of the expansion of the chick vasculosa in shell-less culture. Journal of Anatomy. 186, 639-644 (1995).
- Ribatti, D., Nico, B., Vacca, A., Roncali, L., Burri, P. H., Djonov, V. Chorioallantoic Membrane Capillary Bed: A Useful Target for Studying Angiogenesis and Anti-Angiogenesis In vivo. Anatomical Record. 324, 317-324 (2001).
- DeFouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the Microcirculation in the Chick Chorioallantoic Membrane during Normal Angiogenesis. Microvascular research. 38, 136-147 (1989).
- Beekers, I., van Rooij, T., van der Steen, A. F. W., de Jong, N., Verweij, M. D., Kooiman, K. Acoustic characterization of the CLINIcell for ultrasound contrast agent studies. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (1), 244-246 (2019).
- Lang, E. R., Rha, C. Apparent shear viscosity of native egg white. Journal of Food Science and Technology. 17, 595-606 (1982).
- Daeichin, V., et al. Microbubble Composition and Preparation for Imaging: In Vitro and In vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555-567 (2017).
- Mcferrin, H. E., Olson, S. D., Gutschow, M. V., Semon, J. A., Sullivan, D. E., Prockop, D. J. Rapidly Self-Renewing Human Multipotent Marrow Stromal Cells (hMSC) Express Sialyl Lewis X and Actively Adhere to Arterial Endothelium in a Chick Embryo Model System. PLoS ONE. 9 (8), 1-11 (2014).
- Akiyama, R., Mitsubayashi, H., Tazawa, H., Burggren, W. W. Heart rate responses to altered ambient oxygen in early (days 3-9) chick embryos in the intact egg. Journal of Comparative Physiology - B Biochemical, Systemic, and Environmental Physiology. 169 (2), 85-92 (1999).
- Foster, F. S., Hossack, J., Adamson, S. L. Micro-ultrasound for preclinical imaging. Interface Focus. 1, 576-601 (2011).
- Gabrielli, M. G., Accili, D. The Chick Chorioallantoic Membrane: A Model of Molecular, Structural, and Functional Adaptation to Transepithelial Ion Transport and Barrier Function during Embryonic Development. Journal of Biomedicine and Biotechnology. , 1-12 (2010).
- van der Wagt, I., de Jong, I. C., Mitchell, M. A., Molenaar, R., van den Brand, H. A review on yolk sac utilization in poultry. Poultry Science. 99, 2162-2175 (2020).
- Kind, C. The development of the circulating blood volume of the chick embryo. Anatomy and Embryology. 147, 127-132 (1975).
- Ribatti, D. Chick Embryo Chorioallantoic Membrane as a Useful Tool to Study Angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Schneider, M. Characteristics of SonoVue(TM). Echocardiography. 16 (7), 743-746 (1999).
- Kitzman, D. W., Goldman, M. E., Gillam, L. D., Cohen, J. L., Aurigemma, G. P., Gottdiener, J. S. Efficacy and Safety of the Novel Ultrasound Contrast Agent Perflutren (Definity) in Patients With Suboptimal Baseline Left Ventricular Echocardiographic Images. American Journal of Cardiology. 86, 669-674 (2000).
- Kosareva, A., Abou-Elkacem, L., Chowdhury, S., Lindner, J. R., Kaufmann, B. A. Seeing the Invisible-Ultrasound Molecular Imaging. Ultrasound in Medicine and Biology. 46 (3), 479-497 (2020).
- Al-Roubaie, S., Jahnsen, E. D., Mohammed, M., Henderson-Toth, C., Jones, E. A. V. Rheology of embryonic avian blood. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2473-2481 (2011).
- Helfield, B., Chen, X., Qin, B., Villanueva, F. S. Individual lipid encapsulated microbubble radial oscillations: Effects of fluid viscosity. The Journal of the Acoustical Society of America. 139 (1), 204-214 (2016).
- Metcalfe, J., Stock, M. K. Oxygen exchange in the chorioallantoic membrane, avian homologue of the mammalian placenta. Placenta. 14, 605-613 (1993).
- Tazawa, H. Oxygen and CO2 exchange and acid-base regulation in the avian embryo. American Journal of Zoology. 20, 395-404 (1980).
- Kooiman, K., et al. Ultrasound-Responsive Cavitation Nuclei for Therapy and Drug Delivery. Ultrasound in Medicine and Biology. 46 (6), 1296-1325 (2020).
- Li, M., Pathak, R. R., Lopez-rivera, E., Friedman, S. L., Aguirre-ghiso, J. A., Sikora, A. G. The In ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of Visualized Experiments. (104), e1 (2015).
- Sys, G. M. L., et al. The In ovo CAM-assay as a Xenograft Model for Sarcoma. Journal of Visualized Experiments. (77), e1 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved