Method Article
La préparation d’embryons ex ovo de poulet et de vaisseaux membranaires chorio-allantoïdiens comme modèle in vivo pour l’imagerie par ultrasons à contraste amélioré et les études d’administration de médicaments médiées par microbulles
Dans cet article
Résumé
Ce protocole décrit trois méthodes sur la façon d’obtenir et d’utiliser des embryons de poulet âgés de 5 à 8 jours et leur membrane chorio-allantoïdienne (CAM) comme modèle in vivo pour étudier l’imagerie par ultrasons à contraste amélioré et l’administration de médicaments médiée par microbulles.
Résumé
L’embryon de poulet et la membrane chorio-allantoïdienne (CAM) riche en vaisseaux sanguins constituent un modèle in vivo précieux pour étudier les processus biomédicaux, les nouveaux schémas de pulsations ultrasonores ou les nouveaux transducteurs pour l’imagerie par ultrasons à contraste amélioré et l’administration de médicaments médiée par microbulles. Cela s’explique par l’accessibilité du réseau d’embryons et de vaisseaux du CAM ainsi que par les faibles coûts du modèle. Une étape importante pour accéder à l’embryon et aux vaisseaux CAM est de retirer le contenu de l’œuf de la coquille d’œuf. Dans ce protocole, trois méthodes pour retirer le contenu de la coquille d’œuf entre le jour 5 et le jour 8 de l’incubation sont décrites, permettant ainsi aux embryons de se développer à l’intérieur de la coquille d’œuf jusqu’à ces jours. Les méthodes décrites ne nécessitent que des outils et de l’équipement simples et donnent un taux de réussite de survie plus élevé de 90% pour 5 jours, 75% pour 6 jours, 50% pour 7 jours et 60% pour les œufs incubés âgés de 8 jours par rapport aux embryons cultivés ex ovo (~50%). Le protocole décrit également comment injecter des noyaux de cavitation, tels que des microbulles, dans le système vasculaire CAM, comment séparer la membrane contenant l’embryon et la CAM du reste de la teneur en œufs pour des études optiquement transparentes, et comment utiliser l’embryon de poulet et la CAM dans diverses expériences échographiques à court terme. Le modèle in vivo d’embryon de poulet et de MCP est extrêmement pertinent pour étudier de nouveaux protocoles d’imagerie, des agents de contraste à ultrasons et des schémas de pulsation par ultrasons pour l’imagerie échographique à contraste amélioré, et pour démêler les mécanismes d’administration de médicaments médiés par ultrasons.
Introduction
Les embryons de poulet ex ovo et la membrane chorio-allantoïdienne (CAM) riche en vaisseaux sanguins se sont révélés être un modèle approprié pour étudier divers processus biologiques et biomédicaux tels que l’embryogenèse, l’oncologie et l’administration de médicaments 1,2,3,4. L’échographie a été utilisée pour l’imagerie du développement du cœur embryonnaire 4,5 et pour activer les noyaux de cavitation lors de l’injection, tels que les microbulles, pour l’administration vasculairede médicaments 6,7. Les embryons de poulet sont peu coûteux, nécessitent moins d’infrastructures et d’équipements et ont une législation moins stricte que les autres modèles animaux8. L’embryon de poule et les vaisseaux CAM sont facilement accessibles après ouverture de l’œuf alors que cela s’avère beaucoup plus difficile avec les embryons et les vaisseaux de mammifères. En outre, l’embryon de poulet et les vaisseaux CAM fournissent un rythme cardiaque et un flux sanguin pulsant. Le CAM montre des similitudes dans l’anatomie des vaisseaux avec les mammifères et peut être utilisé pour le dépistage de drogues 8,9,10. En raison de ces caractéristiques, les vaisseaux CAM se sont également révélés être un modèle approprié pour étudier l’imagerie par ultrasons à contraste amélioré (CEUS)11,12,13,14,15,16. En outre, le modèle peut être utilisé pour étudier optiquement le comportement des agents de contraste ultrasonores dans un champ d’ultrasons à l’aide d’une caméra ultra-rapide et l’effet de la force de rayonnement acoustique sur la propulsion, la liaison et l’extravasation des médicaments 7,17,18,19. Bien que l’embryon de poulet et la MCP conviennent moins aux expériences à long terme, ils peuvent être bénéfiques pour les expériences in vivo à court terme.
Pour augmenter la visibilité et la contrôlabilité de l’embryon de poulet et de la MCP pendant les expériences, il est important de retirer la teneur en œufs contenant l’embryon et la MCP de la coquille d’œuf18. Des études antérieures sur des embryons de poulet impliquant des agents de contraste à ultrasons ont utilisé des embryons âgés de 5 à 6 jours 7,11,12,17,19 et des embryons âgés de 14 à 18 jours13,14,15,16. Plusieurs approches ont été décrites en détail pour retirer la teneur en œufs de la coquille 18,20,21. Cependant, à notre connaissance, les approches publiées précédemment se concentrent sur le retrait de la teneur en œufs de la coquille après 3 jours d’incubation (c.-à-d. Hamburger & Hamilton (HH) stade 19-2022), et poursuivent la culture ex ovo. Cette approche de culture ex ovo présente de multiples inconvénients, notamment un risque accru de décès pendant la culture (~50 %)1,18, l’utilisation d’antibiotiques 18,20 et une diminution de la longueur totale des vaisseaux par rapport à la croissance in ovo 23. Étant donné que la culture de l’embryon dans la coquille d’œuf fournit l’environnement le plus naturel, il est plus facile d’incuber l’embryon dans la coquille d’œuf jusqu’au jour de l’expérience. Pour cette raison, une approche dans laquelle la teneur en œufs est retirée de la coquille de l’œuf à 5 à 8 jours d’incubation serait bénéfique en particulier pour les expériences sur des embryons âgés de 5 à 8 jours.
Dans ce protocole, nous décrivons trois méthodes pour retirer le contenu de l’œuf de la coquille lorsque l’embryon est au jour 5 à 8 du développement (HH 26-3522) permettant à l’embryon de se développer dans la coquille d’œuf jusqu’au jour de l’expérience. La taille du vaisseau CAM varie de 10-15 μm de diamètre, dans les plus petits capillaires d’un embryon de 8 jours 24, à 115-136 μm de diamètre dans le plus grand vaisseau des embryons âgés de 6 et 8 jours24,25. Les trois méthodes décrites ne nécessitent que des outils de laboratoire de base et réduisent le risque de complications avant le début de l’expérience, réduisant ainsi les coûts et la main-d’œuvre inutiles. Nous détaillons également une méthode pour séparer la membrane contenant l’embryon et la FAO du sac vitellin, ce qui rend la FAO optiquement transparente pour les études de microscopie. Étant donné que la membrane contenant l’embryon et la FAO peut être épinglée sur un support avec une membrane acoustique, la configuration peut également être rendue acoustiquement transparente26, permettant la combinaison d’études microscopiques et échographiques lorsque le trajet de la lumière sera affecté par le jaune. Enfin, nous décrivons plusieurs autres installations d’échographie qui peuvent être utilisées pour l’imagerie par ultrasons ou CEUS.
Protocole
Toutes les expériences sur les animaux ont été menées conformément à la loi néerlandaise sur les expériences sur les animaux et au Conseil européen (2010/63/UE) sur la protection de l’utilisation des animaux à des fins scientifiques.
1 . Protocole de préparation des embryons
- Incubation des œufs de poule fécondés
- Conservez les œufs de poule fraîchement fécondés à 15 °C jusqu’à une semaine.
- Pour incuber les œufs fécondés, placez-les verticalement avec le côté pointu vers le bas dans un incubateur humidifié à 37 °C. Il n’est pas nécessaire de retourner les œufs pendant l’incubation.
REMARQUE: Écrivez la date de début de l’incubation du dessus de l’œuf à l’aide d’un marqueur permanent.
- Préparation d’embryons âgés de jusqu’à 5 jours (120 h) (stade HH 26-28)22
- Préparation de la zone de travail
- Réchauffer une plaque chauffante à 37 °C.
- Placer un porte-oeuf en métal (figure 1A,B), un porte-bateau de pesée en métal (figure 1C,D) et un erlenmeyer de 10 ml rempli de PBS sur la plaque chauffante.
- Remplissez un bateau de pesage (85 mm × 85 mm × 25 mm) avec une couche de gel à ultrasons de 10 mm et placez le bateau de pesage rempli dans le support de pesage métallique préchauffé.
REMARQUE: Remplir le bateau de pesage avec du gel à ultrasons augmentera l’embryon et la CAM. Cela peut être bénéfique pour l’injection ou l’imagerie de l’embryon et de la MCP, mais n’est pas nécessaire pour retirer l’embryon et la MCP de la coquille d’œuf. - Préparez quelques morceaux de ruban adhésif (d’environ 3 cm de longueur) avec une partie d’une extrémité repliée sur elle-même pour qu’elle ne colle plus.
- Retirer la teneur en œufs de la coquille d’œuf
- Prenez un œuf fécondé incubé âgé de 5 jours et transférez-le dans le porte-œuf en métal préchauffé (figure 1A,B). Assurez-vous de garder l’œuf dans la même orientation (c.-à-d. date en haut).
REMARQUE: Il est important de garder l’œuf dans la même orientation pour garder le sac aérien et l’embryon et la MCP dans la même position dans le haut de l’œuf. - Utilisez le dos pointu d’une pince à épiler (ou similaire; Figure 1E) pour faire un petit retrait tout en haut de l’œuf (où la date est écrite) (Figure 2A).
- Utilisez le dos pointu de la pince à épiler pour faire un deuxième retrait sur le côté de l’œuf vers les 2/3 vers le bas de l’œuf (Figure 2B).
REMARQUE: Veillez à ne pas rendre l’indentation trop grande et créer un trou. Si par accident un trou est créé, scellez-le avec du ruban adhésif et ne faites pas un autre retrait. - À l’aide de la plus grande pince à épiler (figure 1E), retirez un petit morceau de coquille d’œuf de la zone dentelée sur le dessus de l’œuf (avec la date écrite). Assurez-vous que le sac d’air dans le haut de la coquille d’œuf entre en contact avec l’air à l’extérieur de l’œuf, mais ne pénètrez pas trop profondément dans la coquille.
REMARQUE: Si la coquille est pénétrée trop profondément lors de l’indentation supérieure, l’embryon et le CAM pourraient être endommagés et l’embryon ne survivra pas au retrait de la coquille. Il est important que le petit trou sur le dessus crée un contact d’air entre l’intérieur et l’extérieur de l’œuf. Si cela n’est pas fait, un vide sera créé dans les étapes suivantes de la procédure, ce qui entraînera le piégeage de grosses bulles d’air sous le CAM, rendant l’embryon et le CAM inutiles. Pour vérifier la position du sac d’air à l’intérieur de l’œuf, une source lumineuse peut être utilisée car sa position n’est pas toujours exactement au sommet et peut également être plus sur le côté. - Utilisez une seringue de 5 mL et une aiguille de 19 G pour pénétrer dans la coquille par le deuxième tiret sur le côté 2/3 vers le bas de l’œuf et prélevez ~2 mL de blanc d’œuf (figure 2C).
REMARQUE: Assurez-vous que l’aiguille pointe vers le bas de l’œuf pour éviter le risque d’endommager l’embryon et la CAM. Cette étape crée une plus grande poche d’air dans le haut de l’œuf nécessaire pour éliminer le contenu de l’œuf. Si un trou est créé accidentellement au lieu d’un retrait à l’étape 1.2.2.3, percer le ruban avec l’aiguille pour le retrait du blanc d’œuf. Refermez la perforation avec un autre morceau de ruban adhésif. - Retirez l’aiguille et utilisez du ruban adhésif pour sceller l’espace sur le côté (Figure 2D).
REMARQUE: Pour empêcher le blanc d’œuf de s’écouler de l’œuf, le trou supérieur peut être fermé à l’aide d’un doigt avant de retirer l’aiguille. Si le blanc d’œuf continue de couler avec le ruban déjà en place, retirez d’abord le blanc d’œuf avec un morceau de tissu pour vous assurer que le ruban adhésif correctement. - Vider la seringue en ajoutant le blanc d’œuf au bateau de pesée.
- Utilisez la grande pince à épiler (figure 1E) pour agrandir la petite ouverture sur le dessus de l’œuf (figure 2E). Lorsque vous regardez à l’intérieur de l’œuf à travers l’ouverture sur le dessus, l’embryon et la MCP sont visibles. Continuez à localiser l’embryon et la MCP tout en enlevant autant de coquille d’œuf que possible (Figure 2F).
REMARQUE: Continuez à déplacer l’œuf pour maintenir une visibilité maximale sur la position de l’embryon et de la MCA à l’intérieur de la coquille. Assurez-vous que le bord de l’ouverture dans la coque ne descend pas plus bas que le CAM. En outre, ne pénétrez pas dans la membrane interne et évitez les arêtes vives. - Après avoir créé l’ouverture, tournez l’œuf à 180° et replacez-le dans le porte-œuf de telle sorte que l’ouverture créée en haut de l’œuf soit maintenant tournée vers le bas. L’embryon flottera vers le haut et deviendra invisible par le bas (Figure 2G), ce qui prend 1 à 2 minutes. Assurez-vous que l’embryon entier et la MCA (y compris tous les vaisseaux) ont disparu et que seul le jaune est visible avant de passer à l’étape suivante (Figure 2H).
REMARQUE: Si l’embryon est toujours visible du bas après 2 min, tournez l’œuf dans le sens des aiguilles d’une montre pendant 1-2 min. Cela aidera l’embryon et la FAO à flotter. - Retirez le ruban de l’ouverture latérale. Regardez si l’intérieur de l’œuf se gonfle maintenant hors de l’ouverture inférieure. Si tel est le cas, passez à l’étape suivante. Sinon, utilisez l’aiguille de la seringue pour percer à nouveau l’ouverture sur le côté afin de libérer le vide dans l’œuf. Assurez-vous de pointer vers le haut avec l’aiguille pour éviter le risque de perforer le sac vitellin. Continuez jusqu’à ce que l’œuf se gonfle par l’ouverture inférieure.
- Tout en tenant le fond de l’œuf près du bateau de pesée dans le porte-embarcation métallique (figure 1C,D), effectuez doucement mais rapidement une égratignure horizontale dans la membrane sur toute la largeur de l’ouverture à l’aide de l’une des pointes tranchantes de la petite pince à épiler (figure 1F) et déposez doucement le contenu de l’œuf dans le bateau de pesée (figure 2I).
REMARQUE: Si le contenu de l’œuf ne sort pas, utilisez l’aiguille de la seringue pour percer à nouveau l’ouverture latérale avec l’aiguille pointée vers le haut. - Si l’embryon est dans le bateau de pesée latéralement, il montera généralement tout seul. Si cela ne se produit pas, utilisez un morceau de papier de soie pour repositionner l’embryon. Placez un côté du papier de soie sur l’embryon, faites glisser le papier de soie vers l’autre extrémité et libérez le papier de soie avec quelques gouttes de ~30 μL de PBS (37 °C) à l’aide d’une pipette Pasteur en plastique.
- Vérifiez visuellement si l’embryon est vivant en vous assurant que le rythme cardiaque est toujours présent, que les vaisseaux CAM sont intacts et qu’il n’y a pas de saignement, et qu’il n’y a pas de fuite de jaune. Si l’une de ces choses n’est pas correcte, jetez l’embryon et la MCP parce qu’ils ne seront pas viables.
- Assurez-vous que l’embryon et la MCA sont maintenus à 37 °C et ne se dessèchent pas, car cela entraînerait une détérioration des vaisseaux de la MCP et finirait par faire mourir l’embryon. Pour éviter cela, mettez régulièrement de petites gouttes de ~30 μL de PBS à 37 °C sur l’embryon et la CAM.
- Prenez un œuf fécondé incubé âgé de 5 jours et transférez-le dans le porte-œuf en métal préchauffé (figure 1A,B). Assurez-vous de garder l’œuf dans la même orientation (c.-à-d. date en haut).
- Préparation de la zone de travail
- Préparation d’embryons âgés de 6 à 7 jours (144-168 h) (stade HH 28-32)22
- Préparation de la zone de travail
- Préparer l’étape comme décrit à la section 1.2.1.
- Retirer la teneur en œufs de la coquille d’œuf
- Deux heures avant l’expérience, prenez un œuf couvé âgé de 6 à 7 jours et faites pivoter l’œuf de 180° à l’intérieur de l’incubateur de sorte que le haut de l’œuf soit tourné vers le bas. Après 1 h, retournez l’œuf dans sa position initiale et laissez reposer encore 1 h.
REMARQUE: La rotation de l’œuf 2 heures avant l’expérience facilitera le retrait du contenu de l’œuf de la coquille. - Après la rotation, prenez l’œuf de l’incubateur.
- Exécuter l’étape 1.2.2.2 jusqu’à l’étape 1.2.2.4.
- Utilisez une seringue de 5 ml et une aiguille de 19 g pour pénétrer dans la coquille par le deuxième tiret sur le côté 2/3 de l’œuf et prélevez entre 5 et 6 ml de blanc d’œuf. Assurez-vous que l’aiguille pointe vers le bas de l’œuf.
REMARQUE: Avec la seringue de 5 mL que nous avons utilisée, il est possible de prélever jusqu’à 6 mL, donc une seule pénétration est nécessaire. - Retirez l’aiguille et utilisez un morceau de ruban adhésif pour sceller l’espace sur le côté (figure 2D).
- Videz la seringue en ajoutant le blanc d’œuf au gel à ultrasons dans le bateau de pesée.
- Utilisez la grande pince à épiler (figure 1E) pour agrandir la petite ouverture sur le dessus de l’œuf (figure 2E). Essayez de rendre l’ouverture aussi grande que possible, mais assurez-vous que le bord de l’ouverture dans la coque ne descend pas plus bas que le CAM. En outre, ne pénétrez pas dans la membrane interne et essayez d’éviter les arêtes vives.
- Remplir une seringue avec ~1 mL de PBS de plus à 37 °C que le volume prélevé à l’étape 1.3.2.4.
- Retirez le ruban de l’espace latéral, pénétrez dans l’espace avec la seringue remplie et videz-le dans la coque. Assurez-vous que l’aiguille pointe vers le bas de l’œuf.
REMARQUE: Étant donné que le blanc d’œuf a une viscosité plus élevée (~ 160 cP)27 que le PBS (~ 1 cP), le remplacement du blanc d’œuf par du PBS réduit à la fois la tension et le stress sur l’embryon et la MCP tout en éliminant la teneur en œufs de la coquille. - Retirez l’aiguille et refermez rapidement l’espace avec un morceau de ruban adhésif (Figure 2D).
- Tournez l’œuf de 180° et replacez-le dans le porte-œuf de telle sorte que l’ouverture créée en haut de l’œuf soit maintenant tournée vers le bas. Tournez l’œuf dans le sens des aiguilles d’une montre jusqu’à ce que l’embryon entier et la MCA (y compris tous les vaisseaux) aient disparu et que seul le jaune soit visible.
- Effectuez l’étape 1.2.2.10 jusqu’à l’étape 1.2.2.14.
- Deux heures avant l’expérience, prenez un œuf couvé âgé de 6 à 7 jours et faites pivoter l’œuf de 180° à l’intérieur de l’incubateur de sorte que le haut de l’œuf soit tourné vers le bas. Après 1 h, retournez l’œuf dans sa position initiale et laissez reposer encore 1 h.
- Préparation de la zone de travail
- Préparation d’embryons âgés de 8 jours (192 h) (stade HH 32-35)22
- Préparation de la zone de travail
- Réchauffer une plaque chauffante à 37 °C.
- Placez un porte-bateau de pesée en métal (figure 1C,D) et un erlenmeyer de 10 ml rempli de PBS sur la plaque chauffante.
- Prenez un récipient peu profond de 170 x 110 x 70 mm ou un récipient similaire et remplissez le récipient avec 1 L de PBS à 37 °C.
- Placer un bateau de pesée (85 × 85 × 25 mm) dans une boîte de Petri de 90 mm de diamètre. Placez la boîte de Petri et le bateau de pesée au fond du récipient et assurez-vous qu’ils sont complètement submergés.
- Retirer la teneur en œufs de la coquille d’œuf
- Deux heures avant l’expérience, prenez un œuf couvé âgé de 8 jours et faites pivoter l’œuf de 180° à l’intérieur de l’incubateur de sorte que le haut de l’œuf soit orienté vers le bas. Après 1 h, retournez l’œuf dans sa position initiale et laissez reposer encore 1 h.
REMARQUE: La rotation de l’œuf 2 heures avant l’expérience facilitera le retrait du contenu de l’œuf de la coquille. - Prenez un œuf couvé de 8 jours de l’incubateur.
- Tenez l’œuf horizontalement et utilisez le dos pointu de la grosse pince à épiler (figure 1E) pour faire un petit retrait 1/2 vers le bas de l’œuf. Continuez à faire de petits retraits dans un motif d’anneau à 360° autour de la coquille d’œuf. Utilisez un espacement de ~10 mm entre les retraits.
REMARQUE: Au cours de cette procédure, de petites fissures peuvent commencer à se former entre les retraits. - Après avoir créé les petits retraits tout autour de la coque, faites un trou plus grand en craquant la coquille entre deux petits retraits à l’aide du dos pointu de la grande pince à épiler.
- Immergez complètement l’œuf dans le PBS à 37 °C et maintenez-le immergé pendant 5 min. Après 5 min, gardez l’œuf près du bateau de pesée à l’intérieur du conteneur. Mettez le haut des deux pouces dans le grand trou et ouvrez doucement l’œuf. L’œuf va se fissurer le long des petits retraits.
- Lorsque la fissure se forme tout autour de la coquille d’œuf, essayez doucement de séparer les deux morceaux de coquille d’œuf et continuez à déplacer doucement les deux morceaux d’avant en arrière jusqu’à ce que le contenu de l’œuf soit séparé de la coquille. Ensuite, déposez doucement le contenu de l’œuf dans le bateau de pesée.
REMARQUE: En déplaçant les deux morceaux de coquille d’œuf d’avant en arrière, plus de PBS coulera dans la coquille d’œuf, ce qui aidera à séparer le contenu de l’œuf de la coquille. Parfois, un peu de blanc d’œuf collera à l’intérieur de la coquille d’œuf. Lorsque cela se produit, utilisez la pince à épiler pour séparer le blanc d’œuf de la coquille. - Soulevez lentement la boîte de Petri contenant le bateau de pesée et la teneur en œufs du PBS. Lorsque vous sortez du PBS, inclinez légèrement le bateau de pesage pour enlever l’excès de PBS.
- Placez le bateau de pesage contenant la teneur en œufs dans le support de pesage métallique et passez à la configuration expérimentale souhaitée.
- Deux heures avant l’expérience, prenez un œuf couvé âgé de 8 jours et faites pivoter l’œuf de 180° à l’intérieur de l’incubateur de sorte que le haut de l’œuf soit orienté vers le bas. Après 1 h, retournez l’œuf dans sa position initiale et laissez reposer encore 1 h.
- Préparation de la zone de travail
2. Applications sélectionnées
- Injection de microbulles et/ou d’autres solutions dans les vaisseaux CAM
- Préparation de la configuration de l’injection
- Tirez des aiguilles de verre des tubes capillaires en verre à l’aide d’une microforge (figure 3A) ou achetez des aiguilles capillaires en verre tiré.
- Dans le cas où la pointe de l’aiguille capillaire en verre n’est pas biseautée, cassez une petite partie de la pointe de l’aiguille. Remplissez l’aiguille en verre avec de l’huile minérale et placez-la dans un système de micro-injection. Assurez-vous qu’il n’y a pas de bulles d’air dans l’huile minérale dans l’aiguille de verre.
REMARQUE: L’huile minérale est ajoutée selon les instructions du fabricant du système d’injection que nous avons utilisé. - Vider l’aiguille capillaire en verre tiré autant que le système de micro-injection le permet et remplir partiellement l’aiguille en verre avec de l’air.
REMARQUE: Le petit peu d’air empêchera le mélange de l’huile minérale et de la solution à injecter. - Mettez 10 μL de la solution désirée, dans ce protocole de microbulles, sur un morceau de film cireux (Figure 3B). Si plus d’une solution est nécessaire, les solutions peuvent être mélangées avant de pipeter7.
REMARQUE: Avant de remplir l’aiguille avec des microbulles, laissez la goutte de microbulle sur le film cireux pendant ~ 1 min afin que les microbulles flottent vers le haut de la goutte et se concentrent. Pour l’agent de contraste à ultrasons sur mesure de typeF 28, cette étape de concentration augmentera la concentration de microbulles à injecter de ~30%. La concentration post-injection dans le sang d’embryon de poulet sera comprise entre 32 x 10 3 microbulles/μL pour les embryons âgés de 5 jours et 19 x 103 microbulles/μL pour les embryons âgés de 6 jours. - Remplissez l’aiguille de verre avec la microbulle et/ou une autre solution en positionnant la pointe de l’aiguille en verre dans la goutte sur le film cireux. Lorsque vous aspirez des microbulles, assurez-vous de positionner l’extrémité de l’aiguille dans le haut de la goutte de liquide pour aspirer la solution enrichie en microbulles.
REMARQUE: Avant d’injecter des microbulles, soulevez la pointe de l’aiguille de verre à son point le plus haut et attendez ~2 min. Cela garantira que les microbulles se concentreront dans la pointe de l’aiguille de verre.
- Préparation de la configuration de l’injection
- Injection dans les vaisseaux CAM
- Avant l’injection, examinez le CAM au microscope stéréoscopique et sélectionnez le meilleur vaisseau à injecter. Toujours injecter dans l’une des veines de l’embryon. Ce sont les vaisseaux dans lesquels le flux sanguin se déplace vers l’embryon. Les veines sont de couleur plus claire que les artères en raison du sang oxygéné29. De plus, les veines sont toujours au-dessus de l’artère à deux exceptions près, à savoir les veines vitellines antérieures et postérieures (c’est-à-dire les veines moins ramifiées, indiquées par des astérisques sur la figure 6A, B) qui n’ont pas d’artère dans leur environnement.
REMARQUE: L’injection dans l’une des branches limitera l’obstruction du flux sanguin pendant l’injection. De bons sites d’injection ont été indiqués avec des pointes de flèches dans la figure 6A,B. Il est crucial d’injecter dans la veine, car cela forcera la substance injectée à s’écouler vers l’embryon. En outre, l’injection dans l’artère entraînera un saignement massif lors du retrait de l’aiguille de verre qui tuera l’embryon. - Placez l’aiguille de verre et l’embryon de manière à ce que l’extrémité de l’aiguille en verre et la veine choisie soient dans le même plan focal et dans la même direction. Essayez de positionner l’aiguille aussi horizontalement que possible parallèlement à la veine sélectionnée. La pointe de l’aiguille doit toucher la paroi du vaisseau.
REMARQUE: En positionnant l’aiguille de verre aussi horizontalement que possible, le risque de percer tout le récipient est plus faible. - Après le positionnement, avancez lentement et pénétrez la paroi du vaisseau avec l’aiguille en verre. Lors de la pénétration, le CAM sera d’abord repoussé par le mouvement de l’aiguille en verre. Continuez à avancer l’aiguille de verre jusqu’à ce que la paroi du vaisseau soit pénétrée.
REMARQUE: Si par accident le vaisseau est percé de fond en comble, rétractez lentement l’aiguille pour revenir dans la lumière. De retour à l’intérieur de la lumière, soulevez légèrement l’aiguille et avancez le long du vaisseau pour repositionner l’aiguille. - Après la pénétration, rétractez légèrement l’aiguille de verre pour mieux positionner la pointe à l’intérieur de la lumière du récipient et déplacez l’aiguille de verre sur le côté pour vérifier qu’elle n’est pas fixée à la paroi du vaisseau. Injectez lentement une petite quantité de solution pour confirmer que l’embout est positionné à l’intérieur de la lumière du vaisseau (Figure 3C).
- Assurez-vous que la solution injectée suit le flux sanguin. Si ce n’est pas le cas, déplacez légèrement l’aiguille en verre et continuez à injecter de petites quantités jusqu’à ce que l’aiguille en verre soit positionnée correctement17.
- Lorsque la quantité désirée est injectée, laissez l’aiguille en verre dans le récipient pendant ~15 s pour éviter un saignement massif. Ensuite, déplacez l’aiguille de verre un peu sur le côté, de haut en bas, et d’avant en arrière plusieurs fois pour permettre une rétraction douce de l’aiguille en verre.
REMARQUE: Certains saignements sont normaux. Pour chaque injection, utilisez une nouvelle aiguille en verre, car l’aiguille en verre se bouche facilement et s’émousse à partir du blanc d’œuf.
- Avant l’injection, examinez le CAM au microscope stéréoscopique et sélectionnez le meilleur vaisseau à injecter. Toujours injecter dans l’une des veines de l’embryon. Ce sont les vaisseaux dans lesquels le flux sanguin se déplace vers l’embryon. Les veines sont de couleur plus claire que les artères en raison du sang oxygéné29. De plus, les veines sont toujours au-dessus de l’artère à deux exceptions près, à savoir les veines vitellines antérieures et postérieures (c’est-à-dire les veines moins ramifiées, indiquées par des astérisques sur la figure 6A, B) qui n’ont pas d’artère dans leur environnement.
- Imagerie microscopique de l’embryon et/ou des vaisseaux CAM
- Support de préparation avec membrane acoustique
- Prenons une chambre de culture cellulaire constituée d’un support carré en plastique avec deux membranes parallèles en polycarbonate acoustiquement transparent de 50 μmd’épaisseur 26, également appelé support avec membrane acoustique. Fermez les deux ports avec un couvercle.
- Utilisez un scalpel pour retirer l’une des deux membranes du support avec membrane acoustique.
REMARQUE: Pour enlever la membrane, coupez la membrane juste à côté de la ligne de colle sur le plastique. Veillez à ne pas glisser du bord pour éviter d’endommager l’autre membrane. - Préparer ~15 mL d’agarose à 2 % dans une solution de demi-eau en chauffant entre 80 et 95 °C dans un petit bécher en verre. Refroidir le bécher en verre avec la solution d’agarose dissoute sous un robinet d’eau froide qui coule.
REMARQUE: Si l’agarose est trop chaude, elle fera fondre la membrane acoustique, ce qui créera une surface inégale. - Lorsque la solution est refroidie à environ 37 °C, versez lentement la solution dans le support avec une membrane acoustique jusqu’à ce qu’elle remplisse tout le support. Inclinez légèrement le support avec une membrane acoustique afin que la couche d’agarose se répartisse uniformément à l’intérieur du cadre en plastique (Figure 4A). Assurez-vous que la couche d’agarose est plate et laissez l’agarose prendre à température ambiante.
- Retrait de l’embryon et de la FAO du sac vitellin et placement sur support avec membrane acoustique
- Retirez la teneur de l’œuf de l’œuf comme décrit à la section 1.2, 1.3 ou 1.4.
- Si nécessaire, injecter au CAM des microbulles et/ou d’autres solutions comme décrit à la rubrique 2.1.2.
- Remplir une boîte de Petri de 1 L avec ~500 mL de PBS à 37 °C et placer le support avec une membrane acoustique avec agarose sur le fond de la boîte. Assurez-vous que la couche d’agarose est orientée vers le haut.
- Utilisez de petits ciseaux pour couper rapidement la membrane du sac vitellin, également appelé membrane Vitellus, autour de l’ensemble du CAM pendant que la teneur en œufs est dans le bateau de pesée (Figure 4B). Gardez les ciseaux dans la même position et faites pivoter le bateau de pesage tout en coupant pour une meilleure précision et plus de vitesse.
REMARQUE: À partir du moment où la première coupe est faite, le jaune commencera à fuir. Cela réduit la visibilité de l’embryon et de la CAM. Essayez de couper tout autour du CAM dans les 6-7 coupes. Cela ne devrait pas prendre beaucoup plus de 20 s. La petite pince à épiler (Figure 1F) peut être utilisée pour maintenir le bord de la membrane vitelline et empêcher la coupure dans la FAO. - Utilisez une cuillère à soupe pour ramasser la membrane découpée contenant l’embryon et la FAO du bateau de pesée. Soulevez lentement la cuillère du bateau de pesée et inspectez visuellement si la membrane découpée contenant l’embryon et la MCP est toujours attachée à la membrane du sac vitellin restant. Lorsque c’est le cas, utilisez les ciseaux pour faire une coupe supplémentaire. Pendant la collecte, inclinez légèrement la cuillère pour éliminer autant de jaune que possible, mais ne le laissez pas sécher. Transférer la membrane découpée contenant l’embryon et la MCP dans la boîte de Petri de 1 L, plonger dans le PBS à 37 °C et retirer la cuillère.
- Lorsque la membrane contenant l’embryon et la MCP est immergée dans le PBS à 37 °C, utilisez la petite pince à épiler (Figure 1F) pour saisir un bord de la membrane et tourbillonnez doucement autour de la membrane pour vous débarrasser du jaune qui est encore attaché.
- Lorsque tout le jaune est retiré, utilisez la petite pince à épiler pour déplacer la membrane contenant l’embryon et la CAM et positionnez-la au-dessus du support avec une membrane acoustique.
- Utilisez une épingle de spécimen d’insecte pour épingler la membrane contenant l’embryon et la MCP dans un coin. Évitez de percer les vaisseaux dans le CAM et n’épinglez que la membrane.
- Utilisez une deuxième épingle de spécimen d’insecte pour épingler la membrane contenant l’embryon et la MCA sur le coin diagonalement opposé.
- Soulevez lentement le support avec la membrane acoustique contenant l’embryon et la FAO du PBS à 37 °C. Inclinez légèrement le support pour vous débarrasser de la majeure partie du PBS.
- Utilisez la petite pince à épiler (Figure 1F) pour étirer et répartir uniformément la membrane contenant l’embryon et la MCP sur le support avec membrane acoustique et épingler le reste de la membrane. Assurez-vous que la membrane contenant l’embryon et la MCP est légèrement étirée pour s’assurer qu’elle est plate (Figure 4C).
- Placer le support avec membrane acoustique avec la membrane épinglée contenant l’embryon et la FAO dans une installation de microscopie qui est maintenue à 37 ° C.
- Placer une lamelle de couverture ou une membrane acoustiquement et optiquement transparente (selon l’objectif recherché et l’utilisation d’ultrasons ou non) au-dessus de la région d’intérêt sur l’embryon ou CAM (Figure 4D) pour permettre la visualisation optique.
- Support de préparation avec membrane acoustique
- Imagerie échographique de l’embryon de poulet et/ou des vaisseaux CAM
- Imagerie échographique du côté de l’embryon de poulet et des vaisseaux CAM
- Retirez la teneur en œufs comme décrit à la section 1.2, 1.3 ou 1.4. Cependant, n’utilisez pas de bateau de pesée standard. Utilisez plutôt un bateau de pesage sur mesure avec une paroi acoustiquement transparente.
REMARQUE: Le bateau de pesage standard a été ajusté en coupant un côté du bateau de pesage et en le remplaçant par une fenêtre de feuille de polyester qui a été collée ensemble à l’aide de colle époxy. - Immergez le transducteur à ultrasons préféré dans un bain-marie à 37 °C et positionnez-le à l’endroit souhaité avec la distance de sécurité requise.
- Placez le bateau de pesage dans le bain-marie de manière à ce que la paroi transparente fasse face au transducteur. Assurez-vous que l’embout de pesage est suffisamment profond pour être au niveau du transducteur, mais évitez que de l’eau ne pénètre dans le bateau de pesage (Figure 5A).
- Si vous le souhaitez, ajoutez une autre configuration au sommet de l’embryon ou des vaisseaux CAM, comme un microscope ou un laser (Figure 5A).
- Retirez la teneur en œufs comme décrit à la section 1.2, 1.3 ou 1.4. Cependant, n’utilisez pas de bateau de pesée standard. Utilisez plutôt un bateau de pesage sur mesure avec une paroi acoustiquement transparente.
- Imagerie échographique du haut de l’embryon et des vaisseaux CAM sans interférence acoustique
- Remplissez un verre de bécher de 2 L avec du PBS à 37 °C. Placez un verre de bécher de 500 ml à l’envers sur le fond du verre de bécher de 2 L. Évitez l’air à l’intérieur du verre de bécher de 500 mL.
REMARQUE : Le verre de bécher de 500 ml est destiné à soulever le bateau de pesée contenant la teneur en œufs plus près de la surface du PBS. En remplaçant le bécher par des objets de tailles différentes, la distance entre le transducteur et la teneur en œufs peut être modifiée. - Placez le verre de bécher rempli de 2 L avec le verre de bécher de 500 ml à l’intérieur dans un bain-marie à 37 °C.
- Retirez la teneur en œufs comme décrit à la section 1.2, 1.3 ou 1.4.
- Mouiller le contenu de l’œuf avec 37 °C PBS et couvrir l’embryon d’un film alimentaire transparent. Cela peut être fait pour garder l’embryon dans la même position et l’empêcher de tourner ou de flotter.
REMARQUE: En mouillant la teneur en œufs avec du PBS, il deviendra moins collant, ce qui facilitera la couverture de la teneur en œufs avec un film alimentaire transparent. - Placer le bateau de pesée avec la teneur en œufs dans une boîte de Petri de 90 mm de diamètre et immerger lentement la boîte de Petri dans le PBS (figure 5B).
REMARQUE: L’utilisation de deux pinces sur les côtés de la boîte de Pétri opposés l’une à l’autre facilite l’immersion de la boîte de Pétri. - Positionnez le transducteur à ultrasons avec la distance de sécurité souhaitée.
- Remplissez un verre de bécher de 2 L avec du PBS à 37 °C. Placez un verre de bécher de 500 ml à l’envers sur le fond du verre de bécher de 2 L. Évitez l’air à l’intérieur du verre de bécher de 500 mL.
- Imagerie échographique de l’embryon de poulet et des vaisseaux CAM avec un transducteur mobile
- Retirez la teneur en œufs comme décrit à la section 1.2, 1.3 ou 1.4.
- Préparer une solution d’agarose à 2% dans de l’eau demi en chauffant la solution jusqu’à entre 80-95 °C dans un petit bécher en verre. Refroidir le bécher en verre avec la solution d’agarose dissoute sous une languette d’eau froide courante.
- Verser la solution d’agarose dans un récipient plat pour créer un tampon d’agarose d’environ 1 mm d’épaisseur. Une fois complètement refroidi et pris, coupez le tampon d’agarose à la taille désirée à l’aide d’un scalpel.
REMARQUE: L’épaisseur du tampon d’agarose peut être modifiée pour obtenir la distance focale souhaitée nécessaire au bon fonctionnement du transducteur à ultrasons. - Placez le tampon d’agarose sur l’embryon et la MCP (figure 5C). Ajouter quelques gouttes de ~30 μL de PBS à 37 °C sur le dessus du tampon d’agarose pour créer une fine couche de PBS entre le tampon d’agarose et le transducteur.
REMARQUE: L’utilisation de PBS empêchera le transducteur de coller au tampon d’agarose. Ceci est bénéfique lorsque, par exemple, l’utilisation d’un moteur pour déplacer mécaniquement un transducteur bidimensionnel pour effectuer un balayage tridimensionnel (Figure 9B)11. Lorsque le transducteur n’a pas besoin d’être déplacé, le PBS peut également être remplacé par un gel à ultrasons. - Positionnez le transducteur à ultrasons souhaité.
- Imagerie échographique du côté de l’embryon de poulet et des vaisseaux CAM
Résultats
Dans ce protocole, nous décrivons trois méthodes pour retirer le contenu de l’œuf de la coquille aux jours 5-8 de l’incubation (HH 26-3522). La figure 6 montre la teneur en œufs dans les bateaux de pesage après qu’ils ont été retirés de la coquille. L’embryon de 5 jours et la MCP (Figure 6A) ont été prélevés selon la méthode décrite à la rubrique 1.2. Les embryons âgés de 6 et 7 jours et la MCP (Figure 6B,C) ont été prélevés selon la méthode décrite à la rubrique 1.3. L’embryon de 8 jours et la MCP (Figure 6D) ont été prélevés selon la méthode décrite à la rubrique 1.4. Aucun saignement ou dommage à l’embryon ou CAM ne peut être observé, ce qui indique que ces méthodes peuvent être utilisées pour extraire en toute sécurité le contenu de l’œuf de la coquille sans nuire à l’embryon ou aux vaisseaux CAM. Lorsqu’elle est exécutée correctement, la méthode pour les embryons âgés de 5 jours fournira un embryon viable et une MCP intacte dans 90% de toutes les procédures. Le taux de viabilité est basé sur le nombre total d’œufs fécondés extraits avec succès de la coquille d’œuf. Avec la deuxième méthode, pour les œufs incubés de 6 et 7 jours, la probabilité d’un embryon viable et d’une MCP intacte est d’environ 75% pour les enfants de 6 jours et d’environ 50% pour les enfants de 7 jours. Avec la troisième méthode décrite pour les embryons âgés de 8 jours, la probabilité d’un embryon viable et d’une MCP intacte est d’environ 60%. Des différences dans les stades de développement entre les embryons âgés de 5 et 8 jours peuvent être observées, ce qui concorde avec Hamburger et Hamilton22. La taille de l’embryon et la complexité des vaisseaux CAM augmentent au cours du développement (Figure 6A-D). La figure 6C montre une fine tache d’agarose au-dessus de la teneur en œuf qui permet d’imager l’embryon et la MCP à l’aide de l’appareil échographique illustré à la figure 5C. Une fois que le contenu de l’œuf est retiré de la coquille, le rythme cardiaque de l’embryon est visible à l’œil nu. La fréquence cardiaque de ces embryons ex ovo est similaire à celle des embryons in ovo à 183 battements par minute (bpm) au jour 5 jusqu’à ~208 bpm au jour 830. Lorsqu’il est maintenu humidifié et à 37 °C, l’embryon maintiendra cette fréquence cardiaque pendant ~5 h dans les installations expérimentales d’échographie.
De multiples complications peuvent survenir au cours des trois méthodes décrites précédemment. La figure 7A montre l’air emprisonné sous la CAM, ce qui rend l’embryon impropre à l’imagerie par ultrasons et la pression de la ou des bulles d’air peut également endommager l’embryon et/ou la CAM. Ce problème survient lorsque le sac d’air à l’intérieur de la coquille n’entre pas en contact avec l’air à l’extérieur de la coquille lors du retrait du contenu de l’œuf de la coquille. La figure 7B montre une petite fuite de jaune du sac vitellin en haut à droite de l’image. Cela peut se produire lors de la sortie de la teneur en œufs de la coquille lorsque le sac de jaune est endommagé par les bords tranchants de la coquille ou lorsque le sac de jaune est pénétré par la pince à épiler. La fuite du jaune peut affecter la visibilité de l’embryon et des vaisseaux CAM. La figure 7C montre un embryon dans lequel une bulle d’air est piégée sous le CAM. Cela se produit parfois dans le développement embryonnaire. Une autre complication qui peut survenir est l’endommagement des vaisseaux. Ces dommages peuvent être créés lors du retrait de la teneur de l’œuf de la coquille ou lors d’une injection (figure 7D). En outre, l’embryon et les vaisseaux peuvent également se dessécher avec le temps (Figure 7E). Cela se produit lorsque la teneur en œufs n’est pas saupoudrée de PBS. Le dessèchement de l’embryon peut entraîner des obstructions capillaires massives (Figure 7F) qui affectent la viabilité de l’embryon. Les obstructions capillaires massives peuvent également se produire pendant le développement ou lorsque le rythme cardiaque de l’embryon n’est pas stable.
Une fois que la teneur de l’œuf est retirée de la coquille sans aucune complication, l’embryon peut être injecté, par exemple, avec des agents de contraste à ultrasons tels que des microbulles (Figure 3C). La figure 8 montre les microbulles circulantes dans la lumière du vaisseau sanguin lors de l’injection. Ces microbulles sont transportées avec le flux sanguin et restent présentes dans la circulation sanguine pendant plusieurs heures (Vidéo supplémentaire 1). La présence de ces microbulles dans la circulation crée la possibilité d’effectuer différents types d’expériences CEUS et d’administration de médicaments 7,11,12. Le CAM est idéal pour étudier de nouvelles méthodes de détection de contraste par ultrasons pour lesquelles nous montrons trois exemples. La figure 9A montre l’imagerie subharmonique par ultrasons à haute fréquence d’un embryon de poulet âgé de 6 jours en mode B et CEUS avant et après injection de microbulles. Ici, les vaisseaux CAM ont été injectés avec 5 μL d’agent de contraste ultrasonore et l’imagerie a été réalisée avec un appareil à ultrasons animal préclinique avec une sonde MS250 (fréquence d’émission et de réception de 15 MHz, puissance de 10%). Avant l’injection de microbulles, le contraste peut déjà être vu à l’intérieur du cœur embryonnaire dans les images en mode B (Figure 9A-I). Ce phénomène est dû à la présence d’un noyau dans le globule rouge aviaire qui augmente le contraste du sang en échographie 5,31. L’ajout des microbulles a augmenté le contraste et la visibilité de l’embryon, à la fois dans l’imagerie en mode B et CEUS. La figure 9B montre une image optique et une image sous-harmonique 3D haute fréquence d’un embryon âgé de 6 jours et des vaisseaux environnants. Le CAM a été injecté avec 5 μL d’agent de contraste ultrasonore et l’imagerie a été réalisée avec un appareil à ultrasons animal préclinique avec sonde MS550s (fréquence de transmission de 40 MHz, pression négative de crête ~ 300 kPa). Ces résultats montrent que l’imagerie CEUS combinée à un agent de contraste peut également être utilisée pour créer des images sous-harmoniques 3D à haute fréquence et pour imager les vaisseaux sanguins à l’extérieur de l’embryon. La figure 9C montre une image optique et une image d’échographie intravasculaire ultraharmonique (IVUS) réalisées avec une sonde personnalisée de microvaisseaux CAM d’un embryon âgé de 6 jours (26 MHz d’émission et 39 et 65 MHz de fréquence de réception). Les vaisseaux CAM ont reçu une injection de produit de contraste ultrasonore de 4 ± 1 μL. L’image optique et l’image IVUS proviennent du même embryon et de la même région d’intérêt montrant les réseaux de vaisseaux correspondants.
L’embryon de poulet et les vaisseaux CAM peuvent également être utilisés pour étudier l’administration de médicaments par ultrasons, pour lesquels nous montrons un exemple. Étant donné que le jaune obstrue le trajet de la lumière pendant l’imagerie, le retrait du sac vitellin est nécessaire pour étudier optiquement l’administration du médicament dans l’embryon et les vaisseaux CAM. Pour cette étude, l’embryon et la MCP ont été préparés pour l’imagerie microscopique comme expliqué à la section 2.2 en séparant la membrane contenant l’embryon et la MCP du sac vitellin (Figure 4C). Dans ces embryons, la fréquence cardiaque est stable autour de 80 bpm et les embryons restent en vie jusqu’à 2 heures lorsqu’ils sont maintenus à 37 °C7. La figure 10 montre une étude d’administration de médicaments par ultrasons et microbulles dans les cellules endothéliales des vaisseaux CAM. Des microbulles enrobées de lipides, ciblées sur la paroi du vaisseau à l’aide d’anticorpsα vβ3-et colorées avec le colorant fluorescent DiI7, ont été injectées dans les vaisseaux CAM (Figure 10A,C). Les noyaux des cellules endothéliales des vaisseaux CAM ont été colorés avec Hoechst 33342 (Figure 10B) et le médicament modèle Propidium Iodide (PI) a été utilisé pour visualiser la sonoporation7. Ces deux colorants ont été injectés simultanément avec les microbulles. Lors du traitement par ultrasons (1 MHz, pression négative de crête de 200 kPa, rafale unique de 1000 cycles), l’absorption de PI a été observée dans les noyaux les plus proches des microbulles ciblées (Figure 10D). Cela montre que les oscillations induites par les ultrasons des microbulles ciblées ont pu créer un pore dans la membrane cellulaire endothéliale.
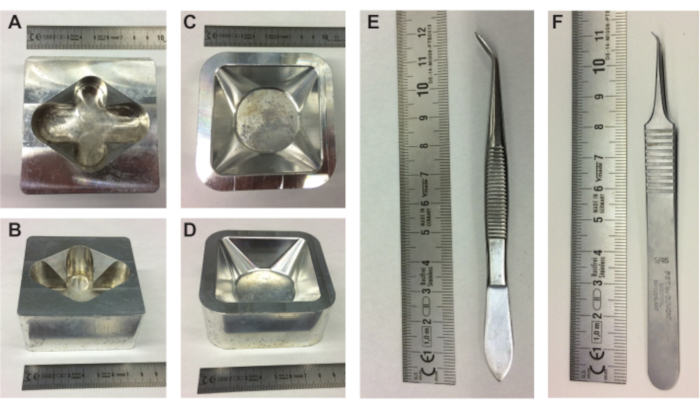
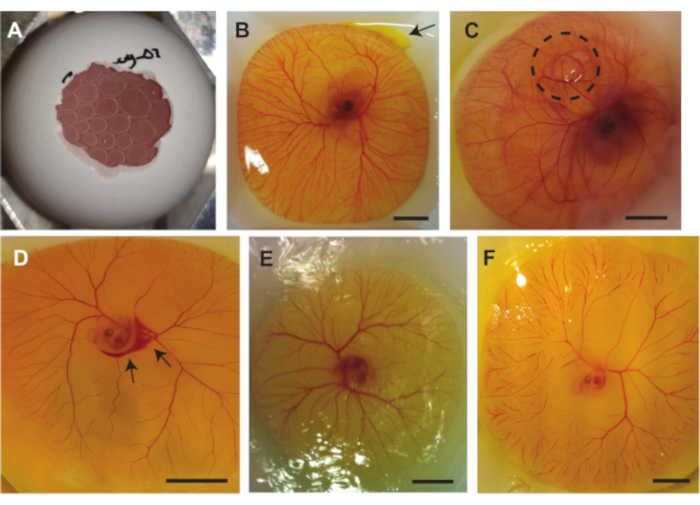
Graphique 1. Matériel de préparation d’embryons. (A-B) vue supérieure et latérale du porte-oeuf en métal et (C-D) vue supérieure et latérale du porte-bateau de pesage en métal. (E-F) pince à épiler nécessaire pour retirer le contenu de l’œuf de la coquille. Échelle en cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
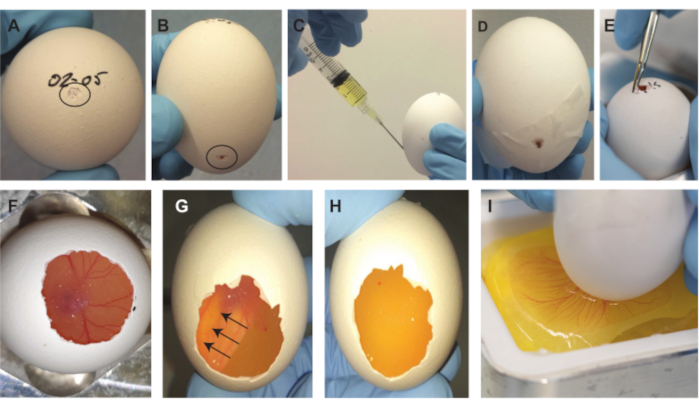
Graphique 2. Procédure d’ablation d’embryons. (A) Petit tiret sur le dessus de l’œuf, indiqué par le cercle noir. (B) Petit tiret 2/3 vers le bas de l’œuf, indiqué par le cercle noir. (C) Retrait de ~2 mL de blanc d’œuf. (D) Ouverture d’un espace scellé sur le côté avec du ruban adhésif. E) Agrandir la petite ouverture sur le dessus de l’œuf. (F) L’embryon devient visible après avoir enlevé une partie de la coquille. (G-H) Après avoir fait pivoter l’œuf de 180°, l’embryon flotte vers le haut et devient invisible (les flèches indiquent la direction de déplacement de l’embryon). Après 1-2 min, l’embryon est invisible du bas. (I) Après avoir gratté la membrane, la teneur de l’œuf tombe dans le bateau de pesée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
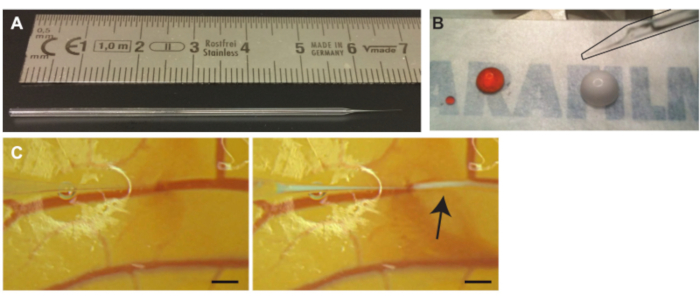
Graphique 3. Injection de microbulles dans les vaisseaux CAM. (A) Aiguille capillaire en verre. Echelle en cm. (B) Solution d’iodure de propidium (PI) (goutte gauche) et microbulles (goutte droite ) avant l’aspiration avant l’injection. L’aiguille (soulignée en noir) peut être vue dans le coin supérieur droit (C) Injection de microbulles. L’extrémité de l’aiguille capillaire est positionnée à l’intérieur de la lumière de l’une des veines (à gauche). Des microbulles, le nuage blanc indiqué par une flèche, sont injectées et dispersées en suivant la circulation sanguine (à droite). La barre d’échelle représente 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
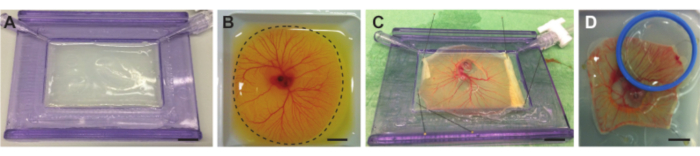
Graphique 4. Retrait de l’embryon et de la MCP du sac vitellin et placement sur support avec membrane acoustique. (A) Support avec membrane acoustique remplie d’une couche d’agarose. (B) Embryon de poulet et récipient CAM dans le bateau de pesage avant la découpe. La ligne pointillée indique la ligne de coupe autour de la FAO. (C) Embryon de poulet et MCA séparés du jaune et épinglés sur la membrane acoustique. (D ) Épinglé l’embryon de poulet avec une membrane acoustiquement et optiquement transparente dans un support (bleu) placé sur le dessus du CAM. Le support peut être rempli d’eau demi afin qu’un objectif de trempage d’eau puisse être utilisé. Toutes les barres d’échelle représentent 1 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 5. Différentes configurations pour l’embryon de poulet et l’imagerie par ultrasons CAM. (A) Configuration pour l’imagerie par ultrasons de côté. L’embryon de poulet a été placé dans un bateau de pesée ajusté sur mesure avec une paroi acoustiquement transparente et placé dans un bain-marie à 37 °C. Le transducteur à ultrasons était positionné sur le côté gauche (a) à côté de la paroi acoustiquement transparente et le laser (b) pour l’imagerie photoacoustique sur le dessus. (B) Configuration pour l’imagerie par ultrasons par le haut. L’embryon et le CAM ont été immergés dans un bécher de PBS qui a été placé dans un bain-marie à 37 °C. Le contour en pointillés montre le bécher en verre de 2 L (a) avec le bécher en verre de 500 ml (b) à l’intérieur. (C) Configuration pour l’imagerie par ultrasons par le haut avec un transducteur mobile. Un mince tampon d’agarose (ligne pointillée) a été placé sur le dessus de l’embryon avec une fine couche de PBS comme couplage entre le transducteur et la surface de l’agarose. Veuillez cliquer ici pour voir une version agrandie de cette figure.
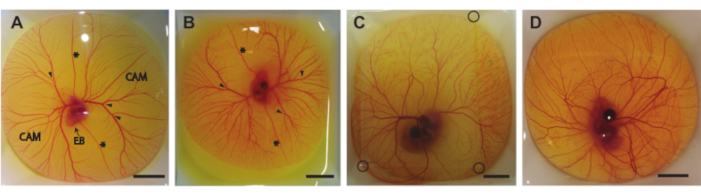
Graphique 6. Contenu de l’œuf à l’extérieur de la coquille. (A) Contenu des œufs prélevés hors de la coquille après 5 jours d’incubation. La membrane chorio-allantoïdienne (CAM), le corps embryonnaire (EB), les veines vitellines antérieures et postérieures (*) et les sites d’injection appropriés (pointes de flèches) sont indiqués. (B) Contenu des oeufs prélevés hors de la coquille après 6 jours d’incubation. Les veines vitellines antérieures et postérieures (*) et les sites d’injection appropriés (pointes de flèches) sont indiqués. (C) Contenu des œufs prélevés hors de la coquille après 7 jours d’incubation. Une tache d’agarose est placée sur le dessus pour permettre l’imagerie par ultrasons. Les coins de la tache d’agarose sont indiqués par des cercles noirs. (D) Contenu des oeufs prélevé hors de la coquille après 8 jours d’incubation. Toutes les barres d’échelle représentent 1 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Graphique 7. Complications pouvant survenir pendant les procédures avec l’embryon de poulet et le modèle CAM. (A ) Bulles d’air piégées sous le CAM lors du prélèvement du contenu de l’œuf hors de la coquille selon la méthode 1.2 (embryon de 5 jours) ou 1.3 (embryon de 6 à 7 jours). (B) Petite fuite de jaune indiquée par une flèche en haut à droite (embryon de 6 jours). (C) Air emprisonné sous le CAM, indiqué par le cercle pointillé noir (embryon âgé de 7 jours). (D) Saignement, indiqué par les flèches noires (embryon de 5 jours. (E) Embryon desséché et CAM (embryon de 5 jours). (F) Obstructions capillaires massives (embryon de 5 jours). Toutes les barres d’échelle représentent 1 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
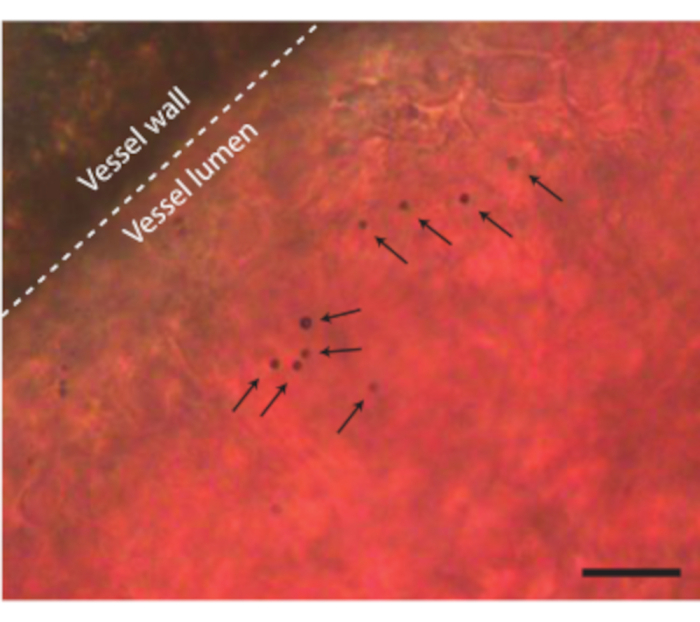
Graphique 8. Microbulles dans les vaisseaux sanguins CAM. La paroi du vaisseau est indiquée par une ligne pointillée et les microbulles simples sont indiquées par des flèches. La barre d’échelle représente 20 μm. L’enregistrement microscopique correspondant se trouve dans la vidéo supplémentaire 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
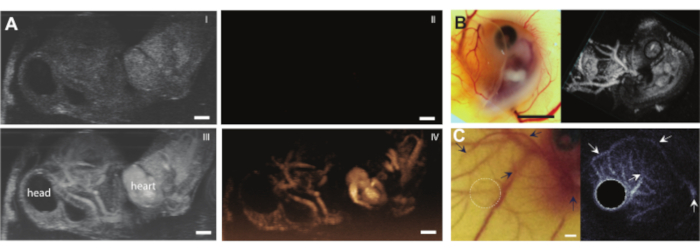
Graphique 9. Imagerie échographique à contraste amélioré dans les embryons de poulet et les vaisseaux CAM. (A) Projection d’intensité maximale d’images en mode B (I, III) et en temps réel (II, IV) (échographe animal préclinique avec sonde MS250, fréquence d’émission et de réception de 30 MHz, puissance de 10 %) d’un embryon âgé de 6 jours avec une tache d’agarose sur le dessus. Les images du haut (I, II) montrent les résultats avant et en bas (III, IV) après l’injection d’un produit de contraste à ultrasons de 5 μL. La barre d’échelle représente 1 mm. Cette image a été modifiée avec la permission de Daeichin et al. 201511(B) Imagerie optique et 3D subharmonique (à droite) d’un embryon de poulet âgé de 6 jours avec une tache d’agarose sur le dessus. Les vaisseaux CAM ont été injectés avec un produit de contraste à ultrasons de 5 μL et l’imagerie a été réalisée avec une sonde à haute fréquence (appareil à ultrasons préclinique pour animaux avec sonde MS550s, fréquence de transmission de 40 MHz, pression négative de crête ~300 kPa, rendu en mode 3D de l’appareil à ultrasons préclinique pour animaux). La barre d’échelle représente 5 mm. Cette image a été modifiée avec la permission de Daeichin et al. 201511. (C) Image optique (à gauche) et projection de l’intensité moyenne de l’échographie intravasculaire ultraharmonique (IVUS) (à droite) du système microvasculaire CAM d’un embryon âgé de 6 jours. Les vaisseaux CAM ont reçu une injection de produit de contraste de 4 ± 1 μL. L’imagerie IVUS ultraharmonique a été réalisée avec une sonde IVUS personnalisée (fréquence de transmission 35 MHz, pression négative de crête 600 kPa). Les deux images sont réalisées à partir du même embryon et de la même région d’intérêt. Les flèches indiquent les vaisseaux correspondants dans les deux images. La barre d’échelle représente 1 mm. Cette image a été modifiée avec la permission de Maresca et al. 201412. Veuillez cliquer ici pour voir une version agrandie de cette figure.
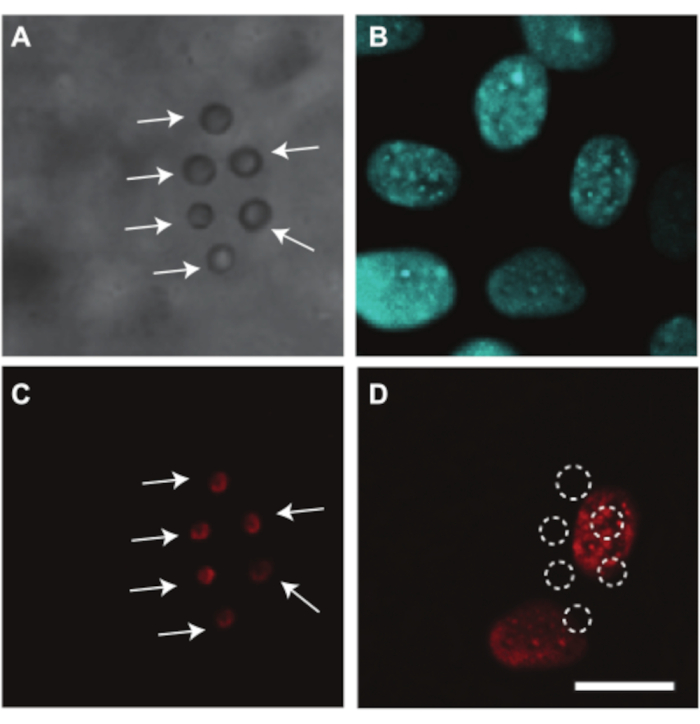
Graphique 10. Administration du médicament aux cellules endothéliales des vaisseaux CAM chez un embryon de 6 jours. (A) Image en fond clair de six microbullesciblées α vβ3, indiquées par des flèches blanches, adhérant à la paroi du vaisseau avant le traitement par ultrasons. (B) Noyaux de cellules endothéliales colorés par fluorescence avant traitement par ultrasons. (C) Image fluorescente des microbulles ciblées colorées, indiquées par des flèches blanches, avant traitement par ultrasons. (D) Absorption de l’iodure de propidium (PI) du médicament modèle dans les noyaux cellulaires sous les microbulles ciblées après traitement par ultrasons (1 MHz, pression négative de crête de 200 kPa, rafale unique de 1000 cycles). La barre d’échelle représente 10 μm et s’applique à toutes les images. Cette image a été modifiée avec la permission de Skachkov et al. 20147. Veuillez cliquer ici pour voir une version agrandie de cette figure.
FICHIERS SUPPLÉMENTAIRES
Vidéo supplémentaire 1. Microbulles dans les vaisseaux sanguins CAM. La barre d’échelle représente 20 μm. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Ce protocole décrit trois méthodes sur la façon d’obtenir et d’utiliser des embryons de poulet âgés de 5 à 8 jours et leur MCP comme modèle in vivo pour étudier l’imagerie par ultrasons à contraste amélioré et l’administration de médicaments médiée par microbulles. Les étapes les plus critiques pour sortir de la coquille des embryons âgés de 5 jours (section 1.2) et de 6 à 7 jours (section 1.3) sont les suivantes: 1) faire le petit trou dans le haut de l’œuf pour traverser toute la coquille de l’œuf dans le sac aérien avant de retirer le blanc d’œuf; 2) Créez des bords lisses pour la grande ouverture dans la coque. Pour la méthode de prélèvement d’embryons âgés de 8 jours hors de la coquille (section 1.4), les étapes les plus critiques sont: 1) Faire un nombre suffisant d’empreintes pour créer une belle fissure le long de l’œuf; 2) Gardez l’œuf immergé dans PBS. Pour assurer la viabilité de l’embryon pour toutes les méthodes, il est important de maintenir l’œuf et son contenu à 37 °C. De plus, évitez d’injecter dans une artère CAM. Il est recommandé de surveiller visuellement la fréquence cardiaque de l’embryon pendant les études pour assurer la vitalité de l’embryon. Pour confirmer le stade de développement exact de l’embryon, l’indication de Hamburger & Hamilton22 peut être utilisée.
Il est important de prévenir les dommages à l’embryon, au MCA et au sac vitellin. Ces dommages peuvent affecter la viabilité, le flux sanguin et la visibilité de l’embryon et de la CAM. De plus, des dommages au sac vitellin et, par conséquent, une faible rigidité de la membrane rendent impossible une injection dans les vaisseaux CAM. Un embryon de 5 jours a un sac aérien relativement petit, de sorte que pour pouvoir faire un trou suffisamment grand dans la coquille à travers lequel le contenu de l’œuf peut être retiré, 2 ml de blanc d’œuf doivent être retirés. En conséquence, plus d’espace entre la coquille d’œuf et l’embryon est créé. Après le retrait du blanc d’œuf, un morceau de ruban adhésif doit fermer le trou où l’aiguille est entrée. Si le blanc d’œuf coule encore, appliquez un autre morceau de ruban adhésif. En outre, l’application de ruban adhésif sur le trou sur le côté crée un vide à l’intérieur de l’œuf qui empêche le contenu de l’œuf de tomber en raison de son propre poids lorsque le grand trou est créé à l’étape 1.2.2.8. Des dommages à l’embryon ou CAM peuvent également survenir lorsque le bord de la coquille d’œuf était trop tranchant ou lorsque la teneur de l’œuf est lâchée trop rigoureusement dans le bateau de pesée, de sorte que la coquille d’œuf doit être maintenue très près du bateau de pesée. Entre le jour 5 et le jour 6 du développement, le CAM commence à se fixer à la membrane de la coquille32. Cet attachement augmente le risque d’endommager l’embryon et la MCP lors du retrait du contenu de l’œuf de la coquille de l’œuf. En ouvrant l’œuf après injection de PBS pour un œuf incubé de 6 à 7 jours ou dans un récipient rempli de PBS comme décrit pour un œuf incubé de 8 jours, le risque de dommages est réduit. Concernant une injection dans une veine CAM : si la première injection échoue, une seconde injection peut être faite plus en amont dans la même veine si la lésion était mineure ou dans une autre veine CAM. La séparation de l’embryon et de la MCA du jaune rend l’embryon et les vaisseaux de la MCP optiquement transparents. En conséquence, l’embryon perd sa principale source de nutriments33. Cette perte de nutriments pourrait expliquer la fréquence cardiaque inférieure observée de 80 bpm par rapport à ~190 pour un embryon de 6 jours qui est encore en contact avec le jaune30 et le temps de survie réduit de 2 h après cette procédure de séparation. Un autre facteur qui peut jouer un rôle dans la réduction de la fréquence cardiaque et du temps de survie est le défi de maintenir l’embryon séparé par le jaune et les vaisseaux CAM à 37 ° C. Un incubateur à étage de microscope peut être utile. En plus de cela, le détachement du CAM du jaune entraîne probablement des changements mécaniques dans le tissu puisque la tension membranaire diminue. La tension plus faible de la membrane peut provoquer une augmentation du taux de cisaillement des vaisseaux internes, ce qui entraîne une baisse de la fréquence cardiaque.
L’embryon de poulet ex ovo et les vaisseaux CAM présentent certaines limites en tant que modèle in vivo, y compris des observations de courte durée seulement, pour l’imagerie par ultrasons à contraste amélioré et les études d’administration de médicaments médiées par microbulles. En raison du faible volume sanguin de 100±23 μL au jour 5 et de 171±23 μL au jour 634, un volume maximal de ~5 μL peut être injecté. Dans les derniers stades de développement (jour 7 et plus), la rigidité des vaisseaux augmente et l’élasticité du jaune diminue. Cela peut compliquer une injection réussie chez les embryons plus âgés. Une fois les microbulles injectées, elles circulent pendant des heures car l’embryon de poulet n’a pas un système immunitaire complètement développé à ce stade35. Par conséquent, les microbulles ne sont pas éliminées en ~6 minutes comme chez l’homme 36,37, ce qui rend les études d’imagerie moléculaire par ultrasons typiques avec une période d’attente de 5 à 10 minutes pour que les microbulles ciblées non liées soient éliminées38 impossibles. Afin de cibler les microbulles, il convient d’utiliser des ligands appropriés capables de se lier aux cellules endothéliales aviaires, tels que décrits précédemment pour le marqueur d’angiogenèse αvβ37. D’autres aspects à considérer pour ce modèle sont la difficulté accrue de séparer l’embryon et les vaisseaux CAM du jaune chez les embryons plus âgés (> 8 jours) et l’hématocrite inférieur de ~20%39 par rapport aux humains. Ces dernières peuvent affecter les oscillations des microbulles car on sait que les oscillations des microbulles sont amorties dans un environnement plus visqueux40. Les artères CAM sont moins oxygénées que les veines CAM41,42. Cette différence doit être prise en compte lors de l’étude, par exemple, de l’imagerie photoacoustique de l’oxygénation du sang.
Les méthodes décrites ici permettent de retirer la teneur de l’œuf de la coquille le jour de l’étude d’imagerie échographique ou d’administration du médicament, généralement au jour 5 au jour 8 de l’incubation. Ceci est différent des méthodes existantes où la teneur en œufs est retirée de la coquille après une incubation de 3 jours et développée en culture ex ovo 18,20,21. Les avantages sont un taux de survie plus élevé de 90% pour les œufs incubés de 5 jours, 75% pour les œufs de 6 jours, 50% pour les œufs incubés de 7 jours et 60% pour les œufs incubés âgés de ~50% pour les embryons de 3 jours prélevés dans la coquille d’œuf et incubés ex ovo1,18 l’évitement des antibiotiques pendant la culture18, 20 et grand incubateur stérile pour la culture ex ovo. La survie des embryons âgés de 6 à 8 jours est plus faible car le CAM commence à se fixer à la coquille21, ce qui laisse la membrane CAM plus sujette à la rupture lors de l’extraction. La séparation de l’embryon avec la forme CAM du jaune est également décrite rendant l’embryon et la CAM optiquement transparents.
En plaçant la teneur de l’œuf dans différentes configurations, l’embryon de poule et la FAO peuvent être utilisés pour une multitude d’études d’imagerie par ultrasons, comme IVUS, photoacoustique, sans ou avec des agents de contraste échographiques en 2D et 3D. L’accent peut être mis sur le développement de nouveaux schémas de pulsations ultrasonores ou sur l’essai de nouveaux transducteurs. En outre, le modèle peut également être utilisé pour étudier de nouveaux agents de contraste à ultrasons et leur comportement dans les vaisseaux sanguins sous flux. Étant donné que le mécanisme d’administration de médicaments médié par microbulles est encore inconnu43, l’utilisation du modèle CAM in vivo peut aider à élucider le mécanisme en étudiant le comportement des microbulles par rapport à la réponse cellulaire. Enfin, les vaisseaux CAM se sont révélés être un système approprié pour étudier la transplantation de tumeurs xénogreffées44. Cela crée la possibilité d’utiliser le vaisseau CAM comme modèle pour étudier l’imagerie tumorale à l’aide d’ultrasons et pour étudier le flux sanguin à l’intérieur de la tumeur en utilisant CEUS. Les tumeurs sont généralement greffées sur les vaisseaux CAM d’embryons âgés de 8 ou 9 jours 1,14,45, pour lesquels l’embryon est retiré de la coquille d’œuf au jour 3 de l’incubation et développé ex ovo. Les méthodes décrites dans ce protocole pourraient être utilisées pour cultiver des embryons in ovo jusqu’au jour de la greffe de tumeur.
Les auteurs espèrent que cet article sera utile aux chercheurs qui souhaitent utiliser des embryons de poulet et leur membrane chorio-allantoïdienne (CAM) comme modèle in vivo pour les applications d’agents de contraste et les études de flux.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par l’Applied and Engineering Sciences (TTW) (Vidi-projet 17543), qui fait partie du NWO. Les auteurs tiennent à remercier Robert Beurskens, Luxi Wei et Reza Pakdaman Zangabad du Département de génie biomédical et Michiel Manten et Geert Springeling du Département d’instrumentation médicale expérimentale pour leur assistance technique, tous du Centre médical universitaire Erasmus MC de Rotterdam, aux Pays-Bas.
matériels
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Clamp (Kocher clamp) | |||
| Cling film | |||
| Holder with acoustic membrane (CLINIcell 25 cm2) | MABIO, Tourcoing, France | CLINIcell25-50-T FER 00106 | |
| Demi water | |||
| Disposable plastic Pasteur pipets | VWR | 612-1747 | |
| Eggs | Drost Pluimveebedrijf Loenen BV, the Netherlands | Freshly fertilized | |
| Fridge 15 °C | |||
| Glass capillary needles | Drummond | 1-000-1000 | Inside diameter: 0.0413 inch |
| Heating plate 37 °C | |||
| Humidified incubator 37 °C | |||
| Insect specimen pins | |||
| Metal egg holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 A,B | ||
| Metal weighing boat holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 C,D | ||
| Microinjection system | FUJIFILM VisualSonics | ||
| Mineral oil | Sigma-Aldrich | M8410-100ML | |
| Needle, 19 G | VWR (TERUMO) | 613-5392 | |
| Phosphate-bufferes saline (PBS), 1x | ThermoFisher | 10010023 | |
| Petri dish, 1 L | Glass | ||
| Petri dish, 90 mm diameter | VWR | 391-0559 | |
| Preclinical animal ultrasound machine (Vevo 2100) | FUJIFILM VisualSonics | ||
| Probe (MS250) | FUJIFILM VisualSonics | 30 MHz transmit and 15 MHz receive frequency | |
| Probe (MS550s) | FUJIFILM VisualSonics | transmission frequency of 40 MHz | |
| Scalpel | VWR (SWANN-MORTON) | 233-5363 | |
| Scissors, small | Fine Science Tools (FST) | 14558-09 | |
| Syringe, 5 mL | VWR (TERUMO) | 613-0973 | |
| Table spoon | |||
| Tape (Scotch Magic tape) | Scotch | ||
| Tissue paper | Tork | ||
| Tweezers large | VWR (USBECK Laborgeräte) | 232-0107 | See figure 1E |
| Tweezers small | DUMONT Medical, Switzerland | 0103-5/45 | See figure 1F |
| Ultrasound contrast agent (custum made F-type) | Produced as described by: Daeichin, V. et al. Microbubble Composition and Preparation for Imaging : In Vitro and In Vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555–567 (2017). | ||
| Ultrasound contrast agent (MicroMarker) | FUJIFILM VisualSonics, Inc. | ||
| Ultrasound contrast agent (Definity) | Lantheus medical imaging, United States | ||
| Ultrasound gel | Aquasonic | ||
| Waxi film (Parafilm) | Parafilm | ||
| Weighing boats (85 × 85 × 24 mm) | VWR | 611-0094 |
Références
- Martowicz, A., Kern, J., Gunsilius, E., Untergasser, G. Establishment of a Human Multiple Myeloma Xenograft Model in the Chicken to Study Tumor Growth, Invasion and Angiogenesis. Journal of Visualized Experiments. (99), e1 (2015).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A Submerged Filter Paper Sandwich for Long-term Ex ovo Time-lapse Imaging of Early Chick Embryos. Journal of Visualized Experiments. (118), e1 (2016).
- Brauer, R., Chen, P. Influenza Virus Propagation in Embryonated Chicken Eggs. Journal of Visualized Experiments. (97), e1 (2015).
- Oosterbaan, A. M., Ursem, N. T. C., Struijk, P. C., Bosch, J. G., van der Steen, A. F. W., Steegers, E. A. P. Doppler flow velocity waveforms in the embryonic chicken heart at developmental stages corresponding to 5-8 weeks of human gestation. Ultrasound in Obstetrics and Gynecology. 33 (6), 638-644 (2009).
- McQuinn, T. C., Bratoeva, M., DeAlmeida, A., Remond, M., Thompson, R. P., Sedmera, D. High-Frequency Ultrasonographic Imaging of Avian Cardiovascular Development. Developmental Dynamics. 236 (12), 3503-3513 (2007).
- Stieger, S. M., Caskey, C. F., Adamson, R. H., Curry, F. E., Wisner, E. R., Ferrara, K. W. Enhancement of Vascular Permeability with Low-Frequency Contrast-enhanced Ultrasound in the Chorioallantoic Membrane Model. Radiology. 243 (1), 112-121 (2007).
- Skachkov, I., Luan, Y., van der Steen, A. F. W., De Jong, N., Kooiman, K. Targeted microbubble mediated sonoporation of endothelial cells in vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (10), 1661-1667 (2014).
- Vargas, A., Zeisser-Labouèbe, M., Lange, N., Gurny, R., Delie, F. The chick embryo and its chorioallantoic membrane (CAM) for the in vivo evaluation of drug delivery systems. Advanced Drug Delivery Reviews. 59 (11), 1162-1176 (2007).
- Rytelewski, M., Buensuceso, A., Leong, H. S., Deroo, B. J., Chambers, A. F., Koropatnick, J. Evaluating the Effectiveness of Cancer Drug Sensitization In Vitro and In vivo. Journal of Visualized Experiments. (96), e1 (2015).
- Schmitd, L. B., Liu, M., Scanlon, C. S., Banerjee, R., Silva, N. J. D. The Chick Chorioallantoic Membrane In vivo Model to Assess Perineural Invasion in Head and Neck Cancer. Journal of Visualized Experiments. (148), e1 (2019).
- Daeichin, V., Bosch, J. G., Needles, A., Foster, F. S., van der Steen, A., de Jong, N. Subharmonic, non-linear fundamental and ultraharmonic imaging of microbubble contrast at high frequencies. Ultrasound in Medicine and Biology. 41 (2), 486-497 (2015).
- Maresca, D., et al. Imaging microvasculature with contrast-enhanced ultraharmonic ultrasound. Ultrasound in Medicine and Biology. 40 (6), 1318-1328 (2014).
- Lindsey, B. D., et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography. Annals of Biomedical Engineering. 45 (4), 939-948 (2017).
- Paproski, R. J., Jovel, J., Wong, G. K. S., Lewis, J. D., Zemp, R. J. Enhanced detection of cancer biomarkers in blood-borne extracellular vesicles using nanodroplets and focused ultrasound. Cancer Research. 77 (1), 3-13 (2017).
- Huang, C., et al. Short Acquisition Time Super-Resolution Ultrasound Microvessel Imaging via Microbubble Separation. Scientific Reports. 10, 1-13 (2020).
- Lowerison, M. R., Huang, C., Kim, Y., Lucien, F., Chen, S., Song, P. In vivo Confocal Imaging of Fluorescently Labeled Microbubbles: Implications for Ultrasound Localization Microscopy. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 67 (9), 1811-1819 (2020).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo Characterization of Ultrasound Contrast Agents: Microbubble Spectroscopy in a Chicken Embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yalcin, H. C., Shekhar, A., Rane, A. A., Butcher, J. T. An ex-ovo Chicken Embryo Culture System Suitable for Imaging and Microsurgery Applications. Journal of Visualized Experiments. (44), e4 (2010).
- Kokhuis, T. J. A., et al. Intravital microscopy of localized stem cell delivery using microbubbles and acoustic radiation force. Biotechnology and Bioengineering. 112 (1), 220-227 (2015).
- Cloney, K., Franz-Odendaal, T. A. Optimized Ex-ovo Culturing of Chick Embryos to Advanced Stages of Development. Journal of Visualized Experiments. (95), e6 (2015).
- Dohle, D. S., et al. Chick ex ovo Culture and ex ovo CAM Assay: How it Really Works. Journal of Visualized Experiments. (33), e2 (2010).
- Hamburger, V., Hamilton, H. A Series Of Normal Stages In The Developent Of The Chick Embryo. Journal of Morphology. 88 (1), 231-272 (1951).
- Ribatti, D. A morphometric study of the expansion of the chick vasculosa in shell-less culture. Journal of Anatomy. 186, 639-644 (1995).
- Ribatti, D., Nico, B., Vacca, A., Roncali, L., Burri, P. H., Djonov, V. Chorioallantoic Membrane Capillary Bed: A Useful Target for Studying Angiogenesis and Anti-Angiogenesis In vivo. Anatomical Record. 324, 317-324 (2001).
- DeFouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the Microcirculation in the Chick Chorioallantoic Membrane during Normal Angiogenesis. Microvascular research. 38, 136-147 (1989).
- Beekers, I., van Rooij, T., van der Steen, A. F. W., de Jong, N., Verweij, M. D., Kooiman, K. Acoustic characterization of the CLINIcell for ultrasound contrast agent studies. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (1), 244-246 (2019).
- Lang, E. R., Rha, C. Apparent shear viscosity of native egg white. Journal of Food Science and Technology. 17, 595-606 (1982).
- Daeichin, V., et al. Microbubble Composition and Preparation for Imaging: In Vitro and In vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555-567 (2017).
- Mcferrin, H. E., Olson, S. D., Gutschow, M. V., Semon, J. A., Sullivan, D. E., Prockop, D. J. Rapidly Self-Renewing Human Multipotent Marrow Stromal Cells (hMSC) Express Sialyl Lewis X and Actively Adhere to Arterial Endothelium in a Chick Embryo Model System. PLoS ONE. 9 (8), 1-11 (2014).
- Akiyama, R., Mitsubayashi, H., Tazawa, H., Burggren, W. W. Heart rate responses to altered ambient oxygen in early (days 3-9) chick embryos in the intact egg. Journal of Comparative Physiology - B Biochemical, Systemic, and Environmental Physiology. 169 (2), 85-92 (1999).
- Foster, F. S., Hossack, J., Adamson, S. L. Micro-ultrasound for preclinical imaging. Interface Focus. 1, 576-601 (2011).
- Gabrielli, M. G., Accili, D. The Chick Chorioallantoic Membrane: A Model of Molecular, Structural, and Functional Adaptation to Transepithelial Ion Transport and Barrier Function during Embryonic Development. Journal of Biomedicine and Biotechnology. , 1-12 (2010).
- van der Wagt, I., de Jong, I. C., Mitchell, M. A., Molenaar, R., van den Brand, H. A review on yolk sac utilization in poultry. Poultry Science. 99, 2162-2175 (2020).
- Kind, C. The development of the circulating blood volume of the chick embryo. Anatomy and Embryology. 147, 127-132 (1975).
- Ribatti, D. Chick Embryo Chorioallantoic Membrane as a Useful Tool to Study Angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Schneider, M. Characteristics of SonoVue(TM). Echocardiography. 16 (7), 743-746 (1999).
- Kitzman, D. W., Goldman, M. E., Gillam, L. D., Cohen, J. L., Aurigemma, G. P., Gottdiener, J. S. Efficacy and Safety of the Novel Ultrasound Contrast Agent Perflutren (Definity) in Patients With Suboptimal Baseline Left Ventricular Echocardiographic Images. American Journal of Cardiology. 86, 669-674 (2000).
- Kosareva, A., Abou-Elkacem, L., Chowdhury, S., Lindner, J. R., Kaufmann, B. A. Seeing the Invisible-Ultrasound Molecular Imaging. Ultrasound in Medicine and Biology. 46 (3), 479-497 (2020).
- Al-Roubaie, S., Jahnsen, E. D., Mohammed, M., Henderson-Toth, C., Jones, E. A. V. Rheology of embryonic avian blood. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2473-2481 (2011).
- Helfield, B., Chen, X., Qin, B., Villanueva, F. S. Individual lipid encapsulated microbubble radial oscillations: Effects of fluid viscosity. The Journal of the Acoustical Society of America. 139 (1), 204-214 (2016).
- Metcalfe, J., Stock, M. K. Oxygen exchange in the chorioallantoic membrane, avian homologue of the mammalian placenta. Placenta. 14, 605-613 (1993).
- Tazawa, H. Oxygen and CO2 exchange and acid-base regulation in the avian embryo. American Journal of Zoology. 20, 395-404 (1980).
- Kooiman, K., et al. Ultrasound-Responsive Cavitation Nuclei for Therapy and Drug Delivery. Ultrasound in Medicine and Biology. 46 (6), 1296-1325 (2020).
- Li, M., Pathak, R. R., Lopez-rivera, E., Friedman, S. L., Aguirre-ghiso, J. A., Sikora, A. G. The In ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of Visualized Experiments. (104), e1 (2015).
- Sys, G. M. L., et al. The In ovo CAM-assay as a Xenograft Model for Sarcoma. Journal of Visualized Experiments. (77), e1 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon