Method Article
La preparazione di embrioni di pollo ex ovo e vasi della membrana corioallantoica come modello in vivo per l'imaging ecografico con mezzo di contrasto e studi di somministrazione di farmaci mediati da microbolle
In questo articolo
Riepilogo
Questo protocollo descrive tre metodi su come ottenere e utilizzare embrioni di pollo di età compresa tra 5 e 8 giorni e la loro membrana corioallantoica (CAM) come modello in vivo per studiare l'imaging ecografico con contrasto e la somministrazione di farmaci mediata da microbolle.
Abstract
L'embrione di pollo e la membrana corioallantoica ricca di vasi sanguigni (CAM) sono un prezioso modello in vivo per studiare processi biomedici, nuovi schemi di pulsazione ad ultrasuoni o nuovi trasduttori per l'imaging a ultrasuoni con mezzo di contrasto e la somministrazione di farmaci mediata da microbolle. Le ragioni di ciò sono l'accessibilità della rete di embrioni e vasi della CAM e i bassi costi del modello. Un passo importante per ottenere l'accesso all'embrione e ai vasi CAM è quello di estrarre il contenuto dell'uovo dal guscio d'uovo. In questo protocollo, vengono descritti tre metodi per estrarre il contenuto dal guscio d'uovo tra il giorno 5 e l'8 dell'incubazione, consentendo così agli embrioni di svilupparsi all'interno del guscio d'uovo fino a questi giorni. I metodi descritti richiedono solo strumenti e attrezzature semplici e producono un tasso di successo di sopravvivenza più elevato del 90% per 5 giorni, 75% per 6 giorni, 50% per 7 giorni e 60% per uova incubate di 8 giorni rispetto agli embrioni in coltura ex ovo (~ 50%). Il protocollo descrive anche come iniettare nuclei di cavitazione, come microbolle, nel sistema vascolare CAM, come separare la membrana contenente l'embrione e la CAM dal resto del contenuto di uova per studi otticamente trasparenti e come utilizzare l'embrione di pollo e la CAM in una varietà di esperimenti ecografici a breve termine. L'embrione di pollo in vivo e il modello CAM sono estremamente rilevanti per studiare nuovi protocolli di imaging, agenti di contrasto ad ultrasuoni e schemi di pulsazione ad ultrasuoni per l'imaging a ultrasuoni con mezzo di contrasto e per svelare i meccanismi di somministrazione di farmaci mediata da ultrasuoni.
Introduzione
Gli embrioni di pollo ex ovo e la membrana corioallantoica ricca di vasi sanguigni (CAM) hanno dimostrato di essere un modello adatto per studiare vari processi biologici e biomedici come l'embriogenesi, l'oncologia e la somministrazione di farmaci 1,2,3,4. L'ecografia è stata utilizzata per l'imaging dello sviluppo cardiaco embrionale4,5 e per attivare i nuclei di cavitazione dopo l'iniezione, come le microbolle, per la somministrazione di farmaci vascolari 6,7. Gli embrioni di pollo sono poco costosi, richiedono meno infrastrutture e attrezzature e hanno una legislazione meno severa rispetto ad altri modelli animali8. L'embrione di pollo e i vasi CAM sono facilmente accessibili dopo l'apertura dell'uovo, mentre questo si rivela molto più difficile con embrioni e vasi di mammiferi. Oltre a questo, l'embrione di pollo e i vasi CAM forniscono un battito cardiaco e un flusso sanguigno pulsante. La CAM mostra somiglianze nell'anatomia dei vasi con i mammiferi e può essere utilizzata per lo screening farmacologico 8,9,10. A causa di queste caratteristiche, i vasi CAM hanno anche dimostrato di essere un modello adatto per studiare l'imaging a ultrasuoni con mezzo di contrasto (CEUS)11,12,13,14,15,16. Inoltre, il modello può essere utilizzato per studiare otticamente il comportamento degli agenti di contrasto ad ultrasuoni in un campo di ultrasuoni utilizzando una telecamera ad altissima velocità e l'effetto della forza della radiazione acustica sulla propulsione, il legame e lo stravaso dei farmaci 7,17,18,19. Sebbene l'embrione di pollo e la CAM siano meno adatti per esperimenti a lungo termine, possono essere utili per esperimenti in vivo a breve termine.
Per aumentare la visibilità e la controllabilità sull'embrione di pollo e sulla CAM durante gli esperimenti, è importante estrarre il contenuto di uova contenente l'embrione e la CAM dal guscio d'uovo18. Precedenti studi sugli embrioni di pollo che hanno coinvolto agenti di contrasto ad ultrasuoni hanno utilizzato embrioni di 5-6 giorni 7,11,12,17,19 e embrioni di 14-18 giorni13,14,15,16. Sono stati descritti in dettaglio diversi approcci per estrarre il contenuto di uova dal guscio 18,20,21. Tuttavia, per quanto ne sappiamo, gli approcci precedentemente pubblicati si concentrano sull'estrazione del contenuto dell'uovo dal guscio d'uovo dopo 3 giorni di incubazione (cioè Hamburger & Hamilton (HH) fase 19-2022) e continuano la coltura ex ovo. Questo approccio di coltura ex ovo presenta molteplici svantaggi, tra cui un aumento del rischio di decessi durante la coltura (~50%)1,18, l'uso di antibiotici18,20 e una diminuzione della lunghezza totale dei vasi rispetto alla crescita in ovo 23. Poiché la coltura dell'embrione all'interno del guscio d'uovo fornisce l'ambiente più naturale, è più facile incubare l'embrione all'interno del guscio d'uovo fino al giorno dell'esperimento. Per questo motivo, un approccio in cui il contenuto dell'uovo viene estratto dal guscio d'uovo a 5-8 giorni di incubazione sarebbe utile soprattutto per gli esperimenti su embrioni di 5-8 giorni.
In questo protocollo, descriviamo tre metodi per estrarre il contenuto dell'uovo dal guscio d'uovo quando l'embrione è al giorno 5-8 di sviluppo (HH 26-3522) consentendo all'embrione di svilupparsi all'interno del guscio d'uovo fino al giorno dell'esperimento. La dimensione del vaso CAM varia da 10-15 μm di diametro, nei capillari più piccoli di un embrione di 8 giorni 24, a 115-136 μm di diametro nel vaso più grande di embrioni di 6 e 8 giorni24,25. I tre metodi descritti richiedono solo strumenti di laboratorio di base e riducono il rischio di complicanze prima dell'inizio dell'esperimento, riducendo così costi e manodopera inutili. Descriviamo anche un metodo per separare la membrana contenente l'embrione e la CAM dal sacco vitellino rendendo la CAM otticamente trasparente per gli studi di microscopia. Poiché la membrana contenente l'embrione e la CAM può essere appuntata, ad esempio, su un supporto con una membrana acustica, la configurazione può anche essere resa acusticamente trasparente26, consentendo la combinazione di studi di microscopia e ultrasuoni quando il percorso della luce sarà influenzato dal tuorlo. Infine, descriviamo diverse altre configurazioni a ultrasuoni che possono essere utilizzate per l'ecografia o l'imaging CEUS.
Protocollo
Tutti gli esperimenti sugli animali sono stati condotti in conformità con la legge olandese sugli esperimenti sugli animali e in conformità con il Consiglio europeo (2010/63/UE) sulla protezione dell'uso degli animali a fini scientifici.
1 . Protocollo di preparazione degli embrioni
- Incubazione delle uova di gallina fecondate
- Conservare le uova di gallina appena fecondate a 15 °C per un massimo di una settimana.
- Per incubare le uova fecondate, posizionarle verticalmente con il lato appuntito verso il basso in un'incubatrice umidificata a 37 °C. Non è necessario girare le uova durante l'incubazione.
NOTA: Scrivi la data di inizio dell'incubazione della parte superiore dell'uovo usando un pennarello permanente.
- Preparazione di embrioni di 5 giorni (120 ore) (stadio HH 26-28)22
- Preparazione dell'area di lavoro
- Riscaldare una piastra riscaldante a 37 °C.
- Posizionare un portauova in metallo (Figura 1A,B), un portabarche di pesatura in metallo (Figura 1C,D) e un Erlenmeyer da 10 mL riempito con PBS sulla piastra riscaldante.
- Riempire un banco di pesatura (85 mm × 85 mm × 25 mm) con uno strato di gel per ultrasuoni da 10 mm e posizionare il battello di pesatura riempito nel supporto del pesatore metallico preriscaldato.
NOTA: Riempire il battello di pesatura con gel ad ultrasuoni solleverà l'embrione e la CAM. Questo può essere utile per l'iniezione o l'imaging dell'embrione e della CAM, ma non è necessario per estrarre l'embrione e la CAM dal guscio d'uovo. - Preparare alcuni pezzi di nastro adesivo (circa 3 cm di lunghezza) con parte di un'estremità ripiegata su se stessa in modo che non si attacchi più.
- Estrarre il contenuto dell'uovo dal guscio d'uovo
- Prendi un uovo fecondato incubato di 5 giorni e trasferiscilo sul portauova metallico preriscaldato (Figura 1A, B). Assicurati di mantenere l'uovo nello stesso orientamento (cioè la data in alto).
NOTA: È importante mantenere l'uovo nello stesso orientamento per mantenere la sacca d'aria e l'embrione e la CAM nella stessa posizione nella parte superiore dell'uovo. - Usa il dorso appuntito di una pinzetta (o simile; Figura 1E) fare un piccolo rientro sulla parte superiore dell'uovo (dove è scritta la data) (Figura 2A).
- Usa il dorso appuntito delle pinzette per fare una seconda rientranza sul lato dell'uovo intorno a 2/3 verso il basso dell'uovo (Figura 2B).
NOTA: fare attenzione a non rendere il rientro troppo grande e creare un foro. Se per caso viene creato un foro, sigillare il foro con del nastro adesivo e non fare un altro rientro. - Usando le pinzette più grandi (Figura 1E), estrarre un piccolo pezzo di guscio d'uovo dall'area rientrata sopra l'uovo (con data scritta). Assicurati che la sacca d'aria nella parte superiore del guscio d'uovo entri in contatto con l'aria esterna all'uovo, ma non penetrare troppo in profondità nel guscio.
NOTA: Se il guscio viene penetrato troppo in profondità quando si effettua il trattino superiore, l'embrione e la CAM potrebbero essere danneggiati e l'embrione non sopravviverà alla rimozione dal guscio. È importante che il piccolo foro sulla parte superiore crei un contatto d'aria tra l'interno e l'esterno dell'uovo. Se ciò non viene fatto, verrà creato un vuoto nelle fasi successive della procedura che si tradurrà in grandi bolle d'aria intrappolate sotto la CAM rendendo l'embrione e la CAM inutili. Per controllare la posizione della sacca d'aria all'interno dell'uovo, è possibile utilizzare una fonte di luce poiché la sua posizione non è sempre esattamente nella parte superiore e può anche essere più laterale. - Utilizzare una siringa da 5 ml e un ago da 19 G per penetrare nel guscio attraverso il secondo trattino sul lato 2/3 verso il basso dell'uovo e prelevare ~ 2 ml di albume (Figura 2C).
NOTA: Assicurarsi che l'ago sia rivolto verso il basso verso il fondo dell'uovo per evitare la possibilità di danneggiare l'embrione e la CAM. Questo passaggio crea una sacca d'aria più grande nella parte superiore dell'uovo necessaria per la rimozione del contenuto dell'uovo. Se si crea accidentalmente un foro al posto di un rientro al punto 1.2.2.3, forare il nastro con l'ago per il prelievo dell'albume. Risigillare la puntura con un altro pezzo di nastro. - Estrarre l'ago e utilizzare del nastro adesivo per sigillare lo spazio sul lato (Figura 2D).
NOTA: Per evitare che l'albume fuoriesca dall'uovo, il foro superiore può essere chiuso con un dito prima di estrarre l'ago. Se l'albume continua a fuoriuscire con il nastro già in posizione, prima rimuovi l'albume con un pezzo di tessuto per assicurarti che il nastro aderisca correttamente. - Svuotare la siringa aggiungendo l'albume alla barca di pesata.
- Usa le pinzette grandi (Figura 1E) per ingrandire la piccola apertura sulla parte superiore dell'uovo (Figura 2E). Quando si guarda all'interno dell'uovo attraverso l'apertura sulla parte superiore, l'embrione e la CAM sono visibili. Continuare a localizzare l'embrione e la CAM mentre si rimuove quanto più possibile del guscio d'uovo (Figura 2F).
NOTA: Continuare a muovere l'uovo per mantenere la massima visibilità sulla posizione dell'embrione e della CAM all'interno del guscio. Assicurarsi che il bordo dell'apertura nel guscio non scenda più in basso del CAM. Oltre a questo, non penetrare nella membrana interna e prevenire spigoli vivi. - Dopo aver creato l'apertura, ruotare l'uovo di 180° e riposizionare l'uovo nel portauova in modo tale che l'apertura creata nella parte superiore dell'uovo sia ora rivolta verso il basso. L'embrione fluttuerà verso l'alto e diventerà invisibile dal basso (Figura 2G) che richiede 1-2 minuti. Assicurarsi che l'intero embrione e la CAM (compresi tutti i vasi) siano scomparsi e che sia visibile solo il tuorlo prima di procedere alla fase successiva (Figura 2H).
NOTA: Se l'embrione è ancora visibile dal basso dopo 2 minuti, ruotare l'uovo in senso orario per 1-2 minuti. Questo aiuterà l'embrione e la CAM a galleggiare. - Rimuovere il nastro dall'apertura laterale. Guarda se l'interno dell'uovo ora sporge dall'apertura inferiore. In questo caso, procedere al passaggio successivo. In caso contrario, utilizzare l'ago sulla siringa per perforare nuovamente l'apertura sul lato per rilasciare il vuoto nell'uovo. Assicurati di puntare verso l'alto con l'ago per evitare la possibilità di perforare il sacco vitellino. Continuare fino a quando l'uovo si gonfia fuori dall'apertura inferiore.
- Tenendo il fondo dell'uovo vicino al battello di pesatura nel supporto del battello di pesatura in metallo (Figura 1C,D), effettuare delicatamente ma rapidamente un graffio orizzontale nella membrana su tutta la larghezza dell'apertura utilizzando una delle punte acuminate della pinzetta piccola (Figura 1F) e far cadere delicatamente il contenuto dell'uovo nel battello di pesatura (Figura 2I).
NOTA: Se il contenuto dell'uovo non fuoriesce, usi l'ago sulla siringa per perforare nuovamente l'apertura laterale con l'ago rivolto verso l'alto. - Se l'embrione si trova lateralmente nella barca di pesaggio, di solito sale da solo. Se ciò non accade, utilizzare un pezzo di carta velina per riposizionare l'embrione. Mettere un lato della carta velina sull'embrione, trascinare la carta velina all'altra estremità e rilasciare la carta velina con alcune gocce di ~30 μL di PBS (37 °C) usando un pipet Pasteur di plastica.
- Controllare visivamente se l'embrione è vivo assicurandosi che il battito cardiaco sia ancora presente, che i vasi CAM siano intatti e che non vi siano sanguinamenti e non vi siano perdite di tuorlo. Se una di queste cose non è corretta, scartare l'embrione e la CAM perché non sarà vitale.
- Assicurarsi che l'embrione e la CAM siano mantenuti a 37 ° C e non si asciughino perché ciò farà sì che i vasi CAM si deteriorino e alla fine l'embrione morirà. Per evitare ciò, mettere regolarmente piccole gocce di ~ 30 μL di 37 ° C PBS sull'embrione e CAM.
- Prendi un uovo fecondato incubato di 5 giorni e trasferiscilo sul portauova metallico preriscaldato (Figura 1A, B). Assicurati di mantenere l'uovo nello stesso orientamento (cioè la data in alto).
- Preparazione dell'area di lavoro
- Preparazione di embrioni vecchi da 6 a 7 giorni (144-168 h) (stadio HH 28-32)22
- Preparazione dell'area di lavoro
- Preparare la fase come descritto al punto 1.2.1.
- Estrarre il contenuto dell'uovo dal guscio d'uovo
- Due ore prima dell'esperimento, prendi un uovo incubato di 6-7 giorni e ruota l'uovo di 180 ° all'interno dell'incubatrice in modo che la parte superiore dell'uovo sia rivolta verso il basso. Dopo 1 ora, ruotare l'uovo nella sua posizione originale e lasciare per altre 1 ora.
NOTA: Ruotare l'uovo 2 ore prima dell'esperimento renderà più facile estrarre il contenuto dell'uovo dal guscio. - Dopo aver ruotato, prendi l'uovo dall'incubatrice.
- Eseguire il passaggio 1.2.2.2 fino al passaggio 1.2.2.4.
- Utilizzare una siringa da 5 ml e un ago da 19 G per penetrare nel guscio attraverso il secondo trattino sul lato 2/3 verso il basso dell'uovo e prelevare tra 5-6 ml di albume. Assicurati che l'ago sia rivolto verso il fondo dell'uovo.
NOTA: Con la siringa da 5 ml che abbiamo utilizzato, è possibile prelevare fino a 6 ml, quindi è necessaria una sola penetrazione. - Estrarre l'ago e utilizzare un pezzo di nastro adesivo per sigillare lo spazio sul lato (Figura 2D).
- Svuotare la siringa aggiungendo l'albume al gel ad ultrasuoni nella barca di pesata.
- Usa le pinzette grandi (Figura 1E) per ingrandire la piccola apertura sulla parte superiore dell'uovo (Figura 2E). Cerca di rendere l'apertura il più grande possibile, ma assicurati che il bordo dell'apertura nel guscio non scenda più in basso del CAM. Oltre a questo, non penetrare nella membrana interna e cercare di prevenire spigoli vivi.
- Riempire una siringa con ~1 mL in più di 37 °C PBS rispetto al volume prelevato durante il punto 1.3.2.4.
- Togliere il nastro dalla fessura laterale, penetrare nello spazio con la siringa piena e svuotarlo nel guscio. Assicurati che l'ago sia rivolto verso il fondo dell'uovo.
NOTA: Poiché l'albume ha una viscosità maggiore (~160 cP)27 rispetto al PBS (~1 cP), la sostituzione dell'albume con PBS riduce sia la tensione che lo stress sull'embrione e sulla CAM mentre si estrae il contenuto dell'uovo dal guscio. - Estrarre l'ago e richiudere rapidamente lo spazio con un pezzo di nastro adesivo (Figura 2D).
- Ruotare l'uovo di 180° e riposizionare l'uovo nel portauova in modo tale che l'apertura creata nella parte superiore dell'uovo sia ora rivolta verso il basso. Ruotare l'uovo in senso orario fino a quando l'intero embrione e la CAM (compresi tutti i vasi) sono scomparsi e solo il tuorlo è visibile.
- Eseguire il passaggio 1.2.2.10 fino al passaggio 1.2.2.14.
- Due ore prima dell'esperimento, prendi un uovo incubato di 6-7 giorni e ruota l'uovo di 180 ° all'interno dell'incubatrice in modo che la parte superiore dell'uovo sia rivolta verso il basso. Dopo 1 ora, ruotare l'uovo nella sua posizione originale e lasciare per altre 1 ora.
- Preparazione dell'area di lavoro
- Preparazione di embrioni di 8 giorni (192 h) (stadio HH 32-35)22
- Preparazione dell'area di lavoro
- Riscaldare una piastra riscaldante a 37 °C.
- Posizionare un supporto per pesatori in metallo (Figura 1C,D) e un Erlenmeyer da 10 mL riempito con PBS sulla piastra riscaldante.
- Prendere un contenitore poco profondo di 170 x 110 x 70 mm, o simile, e riempire il contenitore con 1 L di 37 °C PBS.
- Posizionare un battello di pesatura (85 × 85 × 25 mm) in una capsula di Petri di 90 mm di diametro. Posizionare la capsula di Petri e la barca di pesatura sul fondo del contenitore e assicurarsi che siano completamente sommersi.
- Estrarre il contenuto dell'uovo dal guscio d'uovo
- Due ore prima dell'esperimento, prendi un uovo incubato di 8 giorni e ruota l'uovo di 180 ° all'interno dell'incubatrice in modo che la parte superiore dell'uovo sia rivolta verso il basso. Dopo 1 ora, ruotare l'uovo nella sua posizione originale e lasciare per altre 1 ora.
NOTA: Ruotare l'uovo 2 ore prima dell'esperimento renderà più facile estrarre il contenuto dell'uovo dal guscio. - Prendi un uovo incubato di 8 giorni dall'incubatrice.
- Tenere l'uovo orizzontalmente e utilizzare il dorso appuntito della pinzetta grande (Figura 1E) per fare una piccola rientranza 1/2 lungo l'uovo. Continua a fare piccoli rientri ad anello a 360 ° attorno al guscio d'uovo. Utilizzare una spaziatura di ~10 mm tra i rientri.
NOTA: durante questa procedura, possono iniziare a formarsi piccole crepe tra i rientri. - Dopo aver creato le piccole rientranze intorno al guscio, fai un buco più grande rompendo il guscio tra due piccole rientranze usando il dorso appuntito della pinzetta grande.
- Immergere completamente l'uovo nel PBS a 37 °C e tenerlo immerso per 5 minuti. Dopo 5 minuti, tenere l'uovo vicino alla barca di pesatura all'interno del contenitore. Metti la parte superiore di entrambi i pollici nel foro grande e apri delicatamente l'uovo. L'uovo si spezzerà lungo i piccoli trattini.
- Quando la fessura si è formata intorno al guscio d'uovo, cercare delicatamente di separare i due pezzi di guscio d'uovo e continuare a spostare delicatamente i due pezzi avanti e indietro fino a quando il contenuto dell'uovo non viene separato dal guscio. Quindi, far cadere delicatamente il contenuto di uova nella barca di pesata.
NOTA: Spostando i due pezzi di guscio d'uovo avanti e indietro, più PBS fluirà nel guscio d'uovo, che aiuterà a separare il contenuto dell'uovo dal guscio. A volte, un po 'di albume si attaccherà all'interno del guscio d'uovo. Quando ciò accade, usa le pinzette per separare l'albume dal guscio. - Sollevare lentamente la capsula di Petri contenente la barca di pesata e il contenuto di uova dal PBS. Quando si è fuori dal PBS, inclinare leggermente il battello di pesatura per rimuovere il PBS in eccesso.
- Posizionare il battello di pesatura contenente il contenuto di uova nel supporto del battello di pesatura in metallo e passare alla configurazione sperimentale desiderata.
- Due ore prima dell'esperimento, prendi un uovo incubato di 8 giorni e ruota l'uovo di 180 ° all'interno dell'incubatrice in modo che la parte superiore dell'uovo sia rivolta verso il basso. Dopo 1 ora, ruotare l'uovo nella sua posizione originale e lasciare per altre 1 ora.
- Preparazione dell'area di lavoro
2. Applicazioni selezionate
- Iniezione di microbolle e/o altre soluzioni nei recipienti CAM
- Preparazione della configurazione dell'iniezione
- Tirare aghi di vetro da tubi capillari di vetro usando una micro fucina (Figura 3A) o acquistare aghi capillari di vetro tirati.
- Nel caso in cui la punta dell'ago capillare di vetro non sia smussata, rompere una piccola parte della punta dell'ago. Riempire l'ago di vetro con olio minerale e metterlo in un sistema di microiniezione. Assicurarsi che non ci siano bolle d'aria nell'olio minerale nell'ago di vetro.
NOTA: L'olio minerale viene aggiunto secondo le istruzioni del produttore del sistema di iniezione che abbiamo utilizzato. - Svuotare l'ago capillare di vetro tirato per quanto consentito dal sistema di microiniezione e riempire parzialmente l'ago di vetro con aria.
NOTA: Il piccolo po' d'aria impedirà la miscela dell'olio minerale e della soluzione da iniettare. - Mettere 10 μL della soluzione desiderata, in questo protocollo microbolle, su un pezzo di pellicola cerosa (Figura 3B). Se è necessaria più di una soluzione, le soluzioni possono essere miscelate prima del pipettaggio7.
NOTA: Prima di riempire l'ago con microbolle, lasciare la goccia di microbolle sul film ceroso per ~ 1 minuto in modo che le microbolle galleggino verso la parte superiore della goccia e si concentrino. Per il mezzo di contrasto ad ultrasuoni personalizzato di tipo F28, questa fase di concentrazione aumenterà la concentrazione di microbolle da iniettare con ~ 30%. La concentrazione post-iniezione nel sangue dell'embrione di pollo sarà compresa tra 32 x 10 3 microbolle/μL per gli embrioni di 5 giorni e 19 x 103 microbolle/μL per gli embrioni di 6 giorni. - Riempire l'ago di vetro con la microbolla e/o altra soluzione posizionando la punta dell'ago di vetro nella goccia sulla pellicola cerosa. Quando si aspirano le microbolle, assicurarsi di posizionare la punta dell'ago nella parte superiore della goccia di liquido per aspirare la soluzione arricchita di microbolle.
NOTA: Prima di iniettare microbolle, sollevare la punta dell'ago di vetro fino al punto più alto e attendere ~ 2 minuti. Ciò assicurerà che le microbolle si concentrino sulla punta dell'ago di vetro.
- Preparazione della configurazione dell'iniezione
- Iniezione nei recipienti CAM
- Prima dell'iniezione, guardare il CAM al microscopio stereo e selezionare il miglior recipiente da iniettare. Iniettare sempre in una delle vene dell'embrione. Questi sono i vasi in cui il flusso sanguigno si muove verso l'embrione. Le vene sono di colore più chiaro rispetto alle arterie a causa del sangue ossigenato29. Inoltre, le vene sono sempre sopra l'arteria con due eccezioni, vale a dire le vene vitelline anteriori e posteriori (cioè le vene meno ramificate, indicate con asterischi nella Figura 6A,B) che non hanno un'arteria nei loro dintorni.
NOTA: L'iniezione in uno dei rami limiterà l'ostruzione del flusso sanguigno durante l'iniezione. I siti di iniezione buoni sono stati indicati con punte di freccia nella Figura 6A,B. È fondamentale iniettare nella vena, poiché ciò costringerà la sostanza iniettata a fluire verso l'embrione. Oltre a questo, l'iniezione nell'arteria si tradurrà in un sanguinamento massiccio quando si rimuove l'ago di vetro che ucciderà l'embrione. - Posizionare l'ago di vetro e l'embrione in modo tale che la punta dell'ago di vetro e la vena selezionata si trovino sullo stesso piano focale e sulla stessa linea di direzione. Cerca di posizionare l'ago il più orizzontalmente possibile parallelamente alla vena selezionata. La punta dell'ago dovrebbe toccare la parete del vaso.
NOTA: Posizionando l'ago di vetro il più orizzontale possibile, la possibilità di perforare l'intero recipiente è inferiore. - Dopo il posizionamento, avanzare lentamente e penetrare nella parete del vaso con l'ago di vetro. Durante la penetrazione, il CAM verrà prima spinto via dal movimento dell'ago di vetro. Continuare a far avanzare l'ago di vetro fino a penetrare la parete del vaso.
NOTA: Se per caso il vaso viene perforato in tutto e per tutto, ritrarre lentamente l'ago per tornare nel lume. Quando si torna all'interno del lume, sollevare leggermente l'ago e spostarsi in avanti lungo il recipiente per riposizionare l'ago. - Dopo la penetrazione, ritrarre leggermente l'ago di vetro per posizionare meglio la punta all'interno del lume del vaso e spostare l'ago di vetro lateralmente per verificare che non sia attaccato alla parete del vaso. Iniettare lentamente una piccola quantità di soluzione per confermare che la punta è posizionata all'interno del lume del recipiente (Figura 3C).
- Assicurarsi che la soluzione iniettata segua il flusso sanguigno. In caso contrario, spostare leggermente l'ago di vetro e continuare a iniettare piccole quantità fino a quando l'ago di vetro non è posizionato correttamente17.
- Quando viene iniettata la quantità desiderata, lasciare l'ago di vetro nel recipiente per ~ 15 s per evitare un sanguinamento massiccio. Quindi, spostare l'ago di vetro un po 'lateralmente, su e giù, e avanti e indietro un paio di volte per consentire una delicata retrazione dell'ago di vetro.
NOTA: un certo sanguinamento è normale. Per ogni iniezione utilizzare un nuovo ago di vetro perché l'ago di vetro si intasa facilmente e si smussa con l'albume d'uovo.
- Prima dell'iniezione, guardare il CAM al microscopio stereo e selezionare il miglior recipiente da iniettare. Iniettare sempre in una delle vene dell'embrione. Questi sono i vasi in cui il flusso sanguigno si muove verso l'embrione. Le vene sono di colore più chiaro rispetto alle arterie a causa del sangue ossigenato29. Inoltre, le vene sono sempre sopra l'arteria con due eccezioni, vale a dire le vene vitelline anteriori e posteriori (cioè le vene meno ramificate, indicate con asterischi nella Figura 6A,B) che non hanno un'arteria nei loro dintorni.
- Microscopia per immagini dell'embrione e/o dei vasi CAM
- Supporto per preparazione con membrana acustica
- Prendere una camera di coltura cellulare costituita da un supporto quadrato in plastica con due membrane parallele in policarbonato acusticamente trasparente spesse 50 μm26, in seguito denominato supporto con membrana acustica. Chiudere entrambe le porte con un coperchio.
- Utilizzare un bisturi per rimuovere una delle due membrane dal supporto con membrana acustica.
NOTA: Per rimuovere la membrana, tagliare la membrana proprio accanto alla linea di colla sulla plastica. Fare attenzione a non scivolare via dal bordo per evitare danni all'altra membrana. - Preparare ~15 mL di agarosio al 2% in soluzione di acqua demi riscaldando a 80-95 °C in un piccolo becher di vetro. Raffreddare il bicchiere di vetro con la soluzione di agarosio sciolta sotto un rubinetto di acqua fredda corrente.
NOTA: Se l'agarosio è troppo caldo scioglierà la membrana acustica che creerà una superficie irregolare. - Quando la soluzione viene raffreddata a circa 37 °C, versare lentamente la soluzione nel supporto con membrana acustica fino a riempire l'intero supporto. Inclinare leggermente il supporto con membrana acustica in modo che lo strato di agarosio si distribuisca uniformemente all'interno del telaio in plastica (Figura 4A). Assicurarsi che lo strato di agarosio sia piatto e lasciare che l'agarosio si depositi a temperatura ambiente.
- Rimozione dell'embrione e della CAM dal sacco del tuorlo e posizionamento sul supporto con membrana acustica
- Estrarre il contenuto dell'uovo dall'uovo come descritto nei paragrafi 1.2, 1.3 o 1.4.
- Se necessario, iniettare il CAM con microbolle e/o altre soluzioni come descritto al paragrafo 2.1.2.
- Riempire una capsula di Petri da 1 L con ~500 mL di PBS a 37 °C e posizionare il supporto con membrana acustica con agarosio sul fondo del piatto. Assicurati che lo strato di agarosio sia rivolto verso l'alto.
- Utilizzare piccole forbici per tagliare rapidamente la membrana del sacco vitellino, chiamata anche membrana di Vitello, attorno all'intero CAM mentre il contenuto dell'uovo è nella barca di pesatura (Figura 4B). Mantenere le forbici nella stessa posizione e ruotare il battello di pesatura durante il taglio per una migliore precisione e una maggiore velocità.
NOTA: Dal momento in cui viene effettuato il primo taglio, il tuorlo inizierà a perdere. Ciò riduce la visibilità dell'embrione e della CAM. Prova a tagliare tutto intorno al CAM entro 6-7 tagli. Questo non dovrebbe richiedere molto più di 20 s. Le piccole pinzette (Figura 1F) possono essere utilizzate per tenere il bordo della membrana vitellina e prevenire il taglio nel CAM. - Utilizzare un cucchiaio per raccogliere la membrana ritagliata contenente l'embrione e la CAM dalla barca di pesatura. Sollevare lentamente il cucchiaio dalla barca di pesatura e ispezionare visivamente se la membrana ritagliata contenente l'embrione e la CAM è ancora attaccata alla membrana del sacco del tuorlo rimanente. Quando questo è il caso, usa le forbici per fare un taglio extra. Durante la raccolta, inclinare leggermente il cucchiaio per eliminare quanto più tuorlo possibile, ma non lasciarlo asciugare. Trasferire la membrana di ritaglio contenente l'embrione e la CAM nella capsula di Petri da 1 L, immergere nel PBS a 37 °C e rimuovere il cucchiaio.
- Quando la membrana contenente l'embrione e la CAM è immersa nel PBS a 37 °C, utilizzare le piccole pinzette (Figura 1F) per afferrare un bordo della membrana e ruotare delicatamente intorno alla membrana per eliminare il tuorlo ancora attaccato.
- Quando tutto il tuorlo è stato rimosso, utilizzare le piccole pinzette per spostare la membrana contenente l'embrione e la CAM e posizionarla sopra il supporto con membrana acustica.
- Utilizzare un perno per campione di insetto per fissare la membrana contenente l'embrione e la CAM in un angolo. Evitare di perforare i vasi nel CAM e fissare solo la membrana.
- Utilizzare un secondo perno per campioni di insetto per fissare la membrana contenente l'embrione e la CAM sull'angolo diagonalmente opposto.
- Sollevare lentamente il supporto con la membrana acustica contenente l'embrione e la CAM dal PBS a 37 °C. Inclinare leggermente il supporto per eliminare la maggior parte del PBS.
- Utilizzare le piccole pinzette (Figura 1F) per allungare e distribuire uniformemente la membrana contenente l'embrione e la CAM sul supporto con membrana acustica e fissare il resto della membrana. Assicurarsi che la membrana contenente l'embrione e la CAM sia leggermente allungata per assicurarsi che sia piatta (Figura 4C).
- Posizionare il supporto con membrana acustica con la membrana bloccata contenente l'embrione e la CAM in una configurazione microscopica che viene mantenuta a 37 °C.
- Posizionare un coprivetrino o una membrana acusticamente e otticamente trasparente (a seconda dell'obiettivo desiderato e dell'uso degli ultrasuoni o meno) sopra la regione di interesse sull'embrione o CAM (Figura 4D) per consentire la visualizzazione ottica.
- Supporto per preparazione con membrana acustica
- Ecografia dell'embrione di pollo e/o dei vasi CAM
- Imaging ad ultrasuoni dal lato dell'embrione di pollo e dei vasi CAM
- Estrarre il contenuto di uova come descritto nei paragrafi 1.2, 1.3 o 1.4. Tuttavia, non utilizzare una barca di pesatura standard. Invece, utilizzare una barca di pesatura su misura con una parete acusticamente trasparente.
NOTA: Il battello di pesatura standard è stato regolato tagliando un lato del battello di pesatura e sostituendolo con una finestra di pellicola di poliestere incollata insieme con colla epossidica. - Immergere il trasduttore a ultrasuoni preferito in un bagno d'acqua a 37 °C e posizionarlo nel punto desiderato con la distanza di standoff richiesta.
- Posizionare la barca di pesatura nel bagno d'acqua in modo tale che la parete trasparente sia rivolta verso il trasduttore. Assicurarsi che il battello di pesatura sia sufficientemente profondo da essere all'altezza del trasduttore, ma evitare che l'acqua penetri nel battello di pesatura (Figura 5A).
- Se lo si desidera, aggiungere un'altra configurazione alla parte superiore dell'embrione o dei vasi CAM, come un microscopio o un laser (Figura 5A).
- Estrarre il contenuto di uova come descritto nei paragrafi 1.2, 1.3 o 1.4. Tuttavia, non utilizzare una barca di pesatura standard. Invece, utilizzare una barca di pesatura su misura con una parete acusticamente trasparente.
- Imaging ad ultrasuoni dalla parte superiore dell'embrione e dei vasi CAM senza interferenze acustiche
- Riempire un bicchiere da 2 L con PBS a 37 °C. Posizionare un bicchiere da bicchiere da 500 ml capovolto sul fondo del bicchiere da 2 litri. Evitare l'aria all'interno del bicchiere da 500 ml.
NOTA: Il bicchiere da 500 ml ha lo scopo di sollevare il battello di pesatura contenente il contenuto di uova più vicino alla superficie PBS. Sostituendo il becher con oggetti di altre dimensioni, la distanza tra il trasduttore e il contenuto di uova può essere variata. - Collocare il bicchiere riempito da 2 L con il bicchiere da 500 mL all'interno in un bagnomaria a 37 °C.
- Estrarre il contenuto di uova come descritto nei paragrafi 1.2, 1.3 o 1.4.
- Bagnare il contenuto di uova con 37 °C di PBS e coprire l'embrione con pellicola trasparente. Questo può essere fatto per mantenere l'embrione nella stessa posizione e impedirgli di ruotare o galleggiare via.
NOTA: bagnando il contenuto dell'uovo con PBS, diventerà meno appiccicoso, il che rende più facile coprire il contenuto dell'uovo con pellicola trasparente trasparente. - Posizionare il battello di pesata con il contenuto di uova in una capsula di Petri di 90 mm di diametro e immergere lentamente la capsula di Petri nel PBS (Figura 5B).
NOTA: L'uso di due morsetti sui lati della piastra di Petri opposti l'uno all'altro rende più facile immergere la capsula di Petri. - Posizionare il trasduttore a ultrasuoni con la distanza di standoff desiderata.
- Riempire un bicchiere da 2 L con PBS a 37 °C. Posizionare un bicchiere da bicchiere da 500 ml capovolto sul fondo del bicchiere da 2 litri. Evitare l'aria all'interno del bicchiere da 500 ml.
- Imaging ecografico dell'embrione di pollo e dei vasi CAM con un trasduttore mobile
- Estrarre il contenuto di uova come descritto nei paragrafi 1.2, 1.3 o 1.4.
- Preparare una soluzione di agarosio al 2% in acqua demi riscaldando la soluzione fino a 80-95 °C in un piccolo bicchiere di vetro. Raffreddare il becher di vetro con la soluzione di agarosio sciolta sotto una linguetta di acqua fredda corrente.
- Versare la soluzione di agarosio in un contenitore piatto per creare un tampone di agarosio di circa 1 mm di spessore. Una volta completamente raffreddato e impostato, tagliare il cuscinetto di agarosio alla dimensione desiderata usando un bisturi.
NOTA: Lo spessore del tampone di agarosio può essere modificato per ottenere la distanza focale desiderata necessaria per il corretto funzionamento del trasduttore ad ultrasuoni. - Posizionare il tampone di agarosio sopra l'embrione e la CAM (Figura 5C). Aggiungere alcune gocce di ~30 μL di 37 °C PBS sulla parte superiore del tampone di agarosio per creare un sottile strato di PBS tra il tampone di agarosio e il trasduttore.
NOTA: L'uso di PBS impedirà al trasduttore di attaccarsi al cuscinetto di agarosio. Ciò è vantaggioso quando, ad esempio, si utilizza un motore per spostare meccanicamente un trasduttore bidimensionale per effettuare una scansione tridimensionale (Figura 9B)11. Quando il trasduttore non deve essere spostato, il PBS può anche essere sostituito con gel per ultrasuoni. - Posizionare il trasduttore a ultrasuoni desiderato.
- Imaging ad ultrasuoni dal lato dell'embrione di pollo e dei vasi CAM
Risultati
In questo protocollo, descriviamo tre metodi per estrarre il contenuto di uova dal guscio al giorno 5-8 di incubazione (HH 26-3522). La figura 6 mostra il contenuto di uova nelle barche di pesatura dopo che è stato estratto dal guscio. L'embrione di 5 giorni e la CAM (Figura 6A) sono stati estratti utilizzando il metodo descritto nel paragrafo 1.2. Gli embrioni di 6 e 7 giorni e la CAM (Figura 6B,C) sono stati prelevati utilizzando il metodo descritto nella sezione 1.3. L'embrione di 8 giorni e la CAM (Figura 6D) sono stati estratti utilizzando il metodo descritto nel paragrafo 1.4. Non si possono osservare sanguinamenti o danni all'embrione o alla CAM, indicando che questi metodi possono essere utilizzati per ottenere in modo sicuro il contenuto di uova dal guscio senza danneggiare l'embrione o i vasi CAM. Se eseguito correttamente, il metodo per gli embrioni di 5 giorni fornirà un embrione vitale e CAM intatta nel 90% di tutte le procedure. Il tasso di vitalità si basa sul numero totale di uova fecondate estratte con successo dal guscio d'uovo. Con il secondo metodo, per gli ovuli incubati di 6 e 7 giorni, la possibilità di un embrione vitale e di CAM intatta è di circa il 75% per i bambini di 6 giorni e di circa il 50% per i 7 giorni. Con il terzo metodo descritto per gli embrioni di 8 giorni, la possibilità di un embrione vitale e di CAM intatta è di circa il 60%. Si possono osservare differenze negli stadi di sviluppo tra gli embrioni di 5 e 8 giorni che concordano con Hamburger e Hamilton22. Sia la dimensione dell'embrione che la complessità dei vasi CAM aumentano durante lo sviluppo (Figura 6A-D). La Figura 6C mostra una sottile macchia di agarosio sopra il contenuto dell'uovo che consente di visualizzare l'embrione e la CAM utilizzando la configurazione ecografica mostrata nella Figura 5C. Dopo che il contenuto dell'uovo è stato estratto dal guscio, il battito cardiaco dell'embrione è visibile ad occhio nudo. La frequenza cardiaca di questi embrioni ex ovo è simile a quella degli embrioni ovo a 183 battiti al minuto (bpm) al giorno 5 fino a ~ 208 bpm al giorno 830. Se mantenuto umidificato e a 37 ° C, l'embrione manterrà questa frequenza cardiaca per ~ 5 ore nelle impostazioni ecografiche sperimentali.
Complicazioni multiple possono verificarsi durante i tre metodi precedentemente descritti. La figura 7A mostra l'aria intrappolata sotto la CAM che rende l'embrione inadatto per l'ecografia e la pressione delle bolle d'aria può anche danneggiare l'embrione e / o la CAM. Questo problema sorge quando la sacca d'aria all'interno del guscio non entra in contatto con l'aria esterna al guscio quando si estrae il contenuto dell'uovo dal guscio. La figura 7B mostra una piccola perdita di tuorlo dal sacco del tuorlo in alto a destra dell'immagine. Ciò può verificarsi mentre si estrae il contenuto dell'uovo dal guscio quando il sacco del tuorlo viene danneggiato da spigoli vivi del guscio o quando il sacco del tuorlo viene penetrato dalle pinzette. La perdita del tuorlo può influire sulla visibilità dell'embrione e dei vasi CAM. La figura 7C mostra un embrione in cui una bolla d'aria è intrappolata sotto il CAM. Questo a volte si verifica nello sviluppo embrionale. Un'altra complicazione che può verificarsi è il danneggiamento delle navi. Questo danno può essere creato mentre si estrae il contenuto dell'uovo dal guscio o quando si esegue un'iniezione (Figura 7D). Oltre a questo, l'embrione e i vasi possono anche asciugarsi nel tempo (Figura 7E). Ciò si verifica quando il contenuto di uova non è cosparso di PBS. L'essiccazione dell'embrione può provocare massicce ostruzioni capillari (Figura 7F) che influiscono sulla vitalità dell'embrione. Le massicce ostruzioni capillari possono verificarsi anche durante lo sviluppo o quando il battito cardiaco dell'embrione non è stabile.
Dopo che il contenuto dell'uovo è stato estratto dal guscio senza alcuna complicazione, l'embrione può essere iniettato, ad esempio, con agenti di contrasto ad ultrasuoni come le microbolle (Figura 3C). La figura 8 mostra le microbolle circolanti nel lume del vaso sanguigno dopo l'iniezione. Queste microbolle vengono trasportate insieme al flusso sanguigno e rimangono presenti nella circolazione sanguigna per diverse ore (Video supplementare 1). La presenza di queste microbolle in circolo crea la possibilità di eseguire diversi tipi di CEUS ed esperimenti di drug delivery 7,11,12. Il CAM è ideale per studiare nuovi metodi di rilevamento del contrasto ad ultrasuoni per i quali mostriamo tre esempi. La Figura 9A mostra l'imaging subarmonico ad ultrasuoni ad alta frequenza di un embrione di pollo di 6 giorni in B-Mode e CEUS prima e dopo l'iniezione di microbolle. Qui, i vasi CAM sono stati iniettati con 5 μL di mezzo di contrasto ad ultrasuoni e l'imaging è stato eseguito con una macchina ad ultrasuoni animale preclinica con una sonda MS250 (trasmissione a 30 MHz e frequenza di ricezione a 15 MHz, potenza 10%). Prima dell'iniezione di microbolle, il contrasto può già essere visto all'interno del cuore embrionale nelle immagini B-Mode (Figura 9A-I). Questo fenomeno è dovuto alla presenza di un nucleo nel globulo rosso aviario che aumenta il contrasto del sangue nell'ecografia 5,31. L'aggiunta delle microbolle ha aumentato il contrasto e la visibilità dell'embrione, sia nell'imaging B-Mode che CEUS. La figura 9B mostra un'immagine subarmonica ottica e 3D ad alta frequenza di un embrione di 6 giorni e dei vasi circostanti. La CAM è stata iniettata con 5 μL di mezzo di contrasto ecografico e l'imaging è stato eseguito con una macchina ad ultrasuoni animale preclinica con sonda MS550s (frequenza di trasmissione di 40 MHz, pressione negativa di picco ~ 300 kPa). Questi risultati mostrano che l'imaging CEUS combinato con un agente di contrasto può anche essere utilizzato per creare immagini subarmoniche 3D ad alta frequenza e per visualizzare i vasi sanguigni al di fuori dell'embrione. La figura 9C mostra un'immagine ottica e un'immagine ultraarmonica a ultrasuoni intravascolari (IVUS) realizzati con una sonda personalizzata di microvasi CAM di un embrione di 6 giorni (frequenza di trasmissione a 26 MHz e frequenza di ricezione a 39 e 65 MHz). I vasi CAM sono stati iniettati con mezzo di contrasto ad ultrasuoni 4 ± 1 μL. L'immagine ottica e l'immagine IVUS provengono dallo stesso embrione e dalla stessa regione di interesse, mostrando le corrispondenti reti vascolari.
L'embrione di pollo e i vasi CAM possono anche essere utilizzati per studiare la somministrazione di farmaci mediata da ultrasuoni per la quale mostriamo un esempio. Poiché il tuorlo ostruisce il percorso della luce durante l'imaging, la rimozione del sacco vitellino è necessaria per studiare otticamente la somministrazione di farmaci nell'embrione e nei vasi CAM. Per questo studio, l'embrione e la CAM sono stati preparati per l'imaging microscopico come spiegato nella sezione 2.2 separando la membrana contenente l'embrione e la CAM dal sacco vitellino (Figura 4C). In questi embrioni, la frequenza cardiaca è stabile intorno agli 80 bpm e gli embrioni rimangono in vita fino a 2 ore se mantenuti a 37 °C7. La Figura 10 mostra uno studio di somministrazione di farmaci mediato da ultrasuoni e microbolle nelle cellule endoteliali dei vasi CAM. Nei vasi CAM sono state iniettate microbolle rivestite di lipidi, mirate alla parete del vaso utilizzando anticorpi αvβ 3 e colorate con il colorante fluorescente DiI7. I nuclei delle cellule endoteliali dei vasi CAM sono stati colorati con Hoechst 33342 (Figura 10B) e il farmaco modello Propidium Iodide (PI) è stato utilizzato per visualizzare la sonoporazione7. Entrambi questi coloranti sono stati iniettati contemporaneamente alle microbolle. Dopo il trattamento ad ultrasuoni (1 MHz, pressione negativa di picco di 200 kPa, singola raffica di 1000 cicli), è stata osservata l'assorbimento di PI nei nuclei più vicini alle microbolle bersaglio (Figura 10D). Ciò dimostra che le oscillazioni indotte dagli ultrasuoni delle microbolle mirate sono state in grado di creare un poro nella membrana cellulare endoteliale.
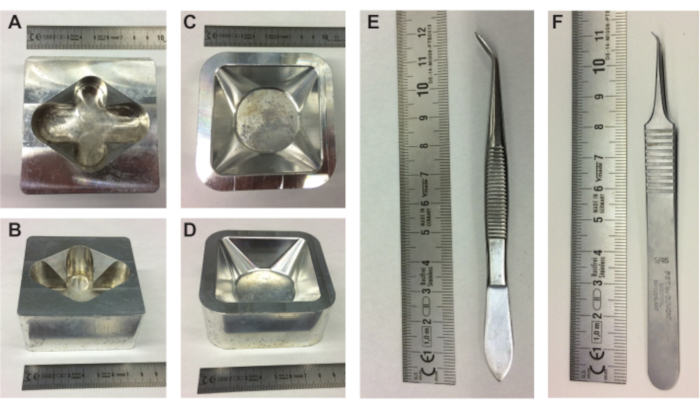
Figura 1. Attrezzature per la preparazione degli embrioni. (A-B) vista superiore e laterale del portauova in metallo e vista superiore e laterale (C-D) del portapacchi in metallo. (E-F) pinzette necessarie per estrarre il contenuto dell'uovo dal guscio. Scala in cm. Fare clic qui per visualizzare una versione più grande di questa figura.
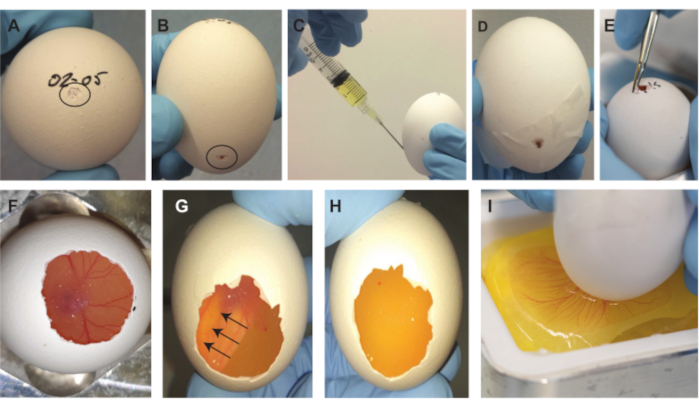
Figura 2. Procedura di rimozione degli embrioni. (A) Piccolo trattino sulla parte superiore dell'uovo, indicato dal cerchio nero. (B) Piccolo trattino 2/3 lungo l'uovo, indicato dal cerchio nero. (C) Prelevare ~2 ml di albume. (D) Spazio sigillato sul lato con nastro adesivo. (E) Ingrandire la piccola apertura sulla parte superiore dell'uovo. (F) L'embrione diventa visibile dopo aver rimosso parte del guscio. (G-H) Dopo aver ruotato l'uovo di 180°, l'embrione galleggia e diventa invisibile (le frecce indicano la direzione in movimento dell'embrione). Dopo 1-2 minuti, l'embrione è invisibile dal basso. (I) Dopo aver graffiato la membrana, il contenuto di uova scende nel battello di pesata. Fare clic qui per visualizzare una versione ingrandita di questa figura.
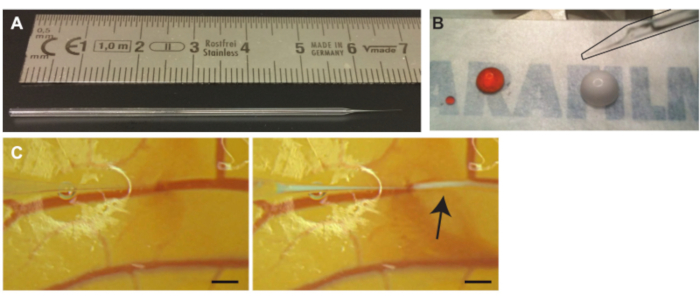
Figura 3. Iniezione di microbolle nei vasi CAM. (A) Ago capillare di vetro. Scala in cm. ( B ) Soluzione di ioduro di propidio (PI) (goccia sinistra) e microbolle (goccia destra) prima dell'aspirazione prima dell'iniezione. L'ago (delineato in nero) può essere visto nell'angolo in alto a destra (C) Iniezione di microbolle. La punta dell'ago capillare è posizionata all'interno del lume di una delle vene (a sinistra). Le microbolle, la nuvola bianca indicata con una freccia, vengono iniettate e disperdono seguendo il flusso sanguigno (a destra). La barra della scala rappresenta 1 mm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
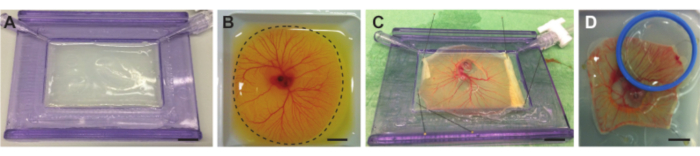
Figura 4. Rimozione dell'embrione e della CAM dal sacco del tuorlo e posizionamento sul supporto con membrana acustica. (A) Supporto con membrana acustica riempita con strato di agarosio. (B) Embrione di pollo e recipiente CAM in barca di pesatura prima del taglio. La linea tratteggiata indica la linea di taglio attorno al CAM. (C) Embrione di pollo e CAM separati dal tuorlo e appuntati sulla membrana acustica. D ) Embrione di pollo appuntato con una membrana acusticamente e otticamente trasparente in un supporto (blu) posto sopra il CAM. Il supporto può essere riempito con acqua demi in modo da poter utilizzare un obiettivo di immersione dell'acqua. Tutte le barre della scala rappresentano 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5. Diverse configurazioni per l'imaging a ultrasuoni dell'embrione di pollo e CAM. (A) Configurazione per l'imaging ecografico laterale. L'embrione di pollo è stato collocato in un battello di pesatura su misura con una parete acusticamente trasparente e posto in un bagno d'acqua a 37 °C. Il trasduttore a ultrasuoni è stato posizionato sul lato sinistro (a) accanto alla parete acusticamente trasparente e il laser (b) per l'imaging fotoacustico in alto. (B) Configurazione per l'imaging ecografico dall'alto. L'embrione e la CAM sono stati immersi in un becher di PBS che è stato posto in un bagno d'acqua a 37 ° C. Il contorno tratteggiato mostra il becher di vetro da 2 L (a) con il becher di vetro da 500 ml (b) all'interno. (C) Configurazione per l'imaging ecografico dall'alto con un trasduttore mobile. Un sottile cuscinetto di agarosio (linea tratteggiata) è stato posto sopra l'embrione con un sottile strato di PBS come accoppiamento tra il trasduttore e la superficie dell'agarosio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
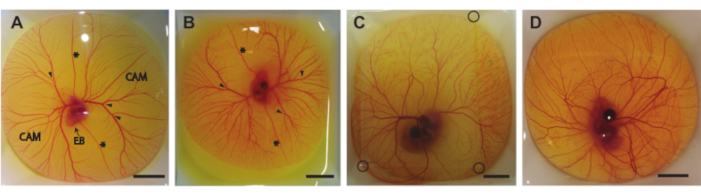
Figura 6. Contenuto di uova al di fuori del guscio. (A) Contenuto di uova estratte dal guscio dopo 5 giorni di incubazione. Sono indicate la membrana corioallantoica (CAM), il corpo embrionale (EB), le vene vitelline anteriori e posteriori (*) e i siti appropriati per l'iniezione (punte di freccia). B) Contenuto di uova estratte dal guscio dopo 6 giorni di incubazione. Sono indicate le vene vitelline anteriori e posteriori (*) e i siti appropriati per l'iniezione (punte di freccia). C) Tenore di uova estratte dal guscio dopo 7 giorni di incubazione. Una macchia di agarosio è posizionata sulla parte superiore per consentire l'imaging ad ultrasuoni. Gli angoli della macchia di agarosio sono indicati con cerchi neri. D) Contenuto di uova estratte dal guscio dopo 8 giorni di incubazione. Tutte le barre della scala rappresentano 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
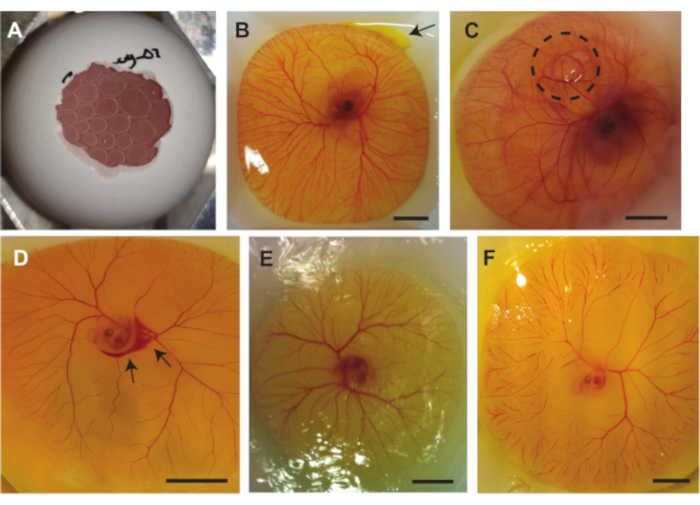
Figura 7. Complicazioni che possono verificarsi durante le procedure con l'embrione di pollo e il modello CAM. (A ) Bolle d'aria intrappolate sotto il CAM quando si estrae il contenuto di uova dal guscio utilizzando il metodo 1.2 (embrione di 5 giorni) o 1.3 (embrione di 6-7 giorni). (B) Piccola perdita di tuorlo indicata con una freccia in alto a destra (embrione di 6 giorni). (C) Aria intrappolata sotto il CAM, indicata dal cerchio tratteggiato nero (embrione di 7 giorni). (D) Sanguinamento, indicato con le frecce nere (embrione di 5 giorni. (E) Embrione essiccato e CAM (embrione di 5 giorni). (F) Ostruzioni capillari massicce (embrione di 5 giorni). Tutte le barre della scala rappresentano 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
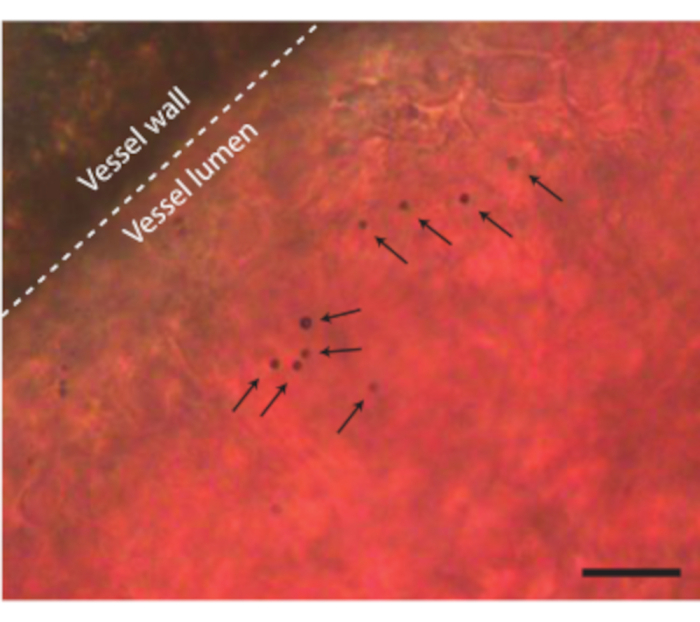
Figura 8. Microbolle nel vaso sanguigno CAM. La parete del vaso è indicata con una linea tratteggiata e le singole microbolle sono indicate con frecce. La barra della scala rappresenta 20 μm. La registrazione al microscopio corrispondente si trova nel video supplementare 1. Fare clic qui per visualizzare una versione ingrandita di questa figura.
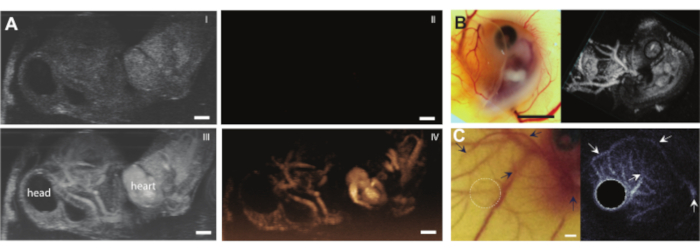
Figura 9. Imaging ecografico con mezzo di contrasto negli embrioni di pollo e nei vasi CAM. (A) Proiezione a massima intensità di immagini B-Mode (I, III) e subarmoniche in tempo reale (II, IV) (macchina ad ultrasuoni animale preclinica con sonda MS250, trasmissione 30 MHz e frequenza di ricezione 15 MHz, potenza 10%) di un embrione di 6 giorni con una chiazza di agarosio in cima. Le immagini in alto (I, II) mostrano i risultati prima e in basso (III, IV) dopo l'iniezione di mezzo di contrasto ecografico da 5 μL. La barra della scala rappresenta 1 mm. Questa immagine è stata modificata con il permesso di Daeichin et al. 201511 (B) Imaging ottico (a sinistra) e subarmonico 3D (a destra) di un embrione di pollo di 6 giorni con una macchia di agarosio in cima. I vasi CAM sono stati iniettati con un mezzo di contrasto ecografico da 5 μL e l'imaging è stato eseguito con una sonda ad alta frequenza (macchina ad ultrasuoni animale preclinica con sonda MS550s, frequenza di trasmissione di 40 MHz, pressione negativa di picco ~ 300 kPa, resa in modalità 3D della macchina ad ultrasuoni animale preclinica). La barra della scala rappresenta 5 mm. Questa immagine è stata modificata con il permesso di Daeichin et al. 201511. (C) Immagine ottica (a sinistra) e proiezione dell'intensità media dell'ecografia intravascolare ultraarmonica (IVUS) (destra) della microvascolarizzazione CAM di un embrione di 6 giorni. I vasi CAM sono stati iniettati con mezzo di contrasto da 4 ± 1 μL. L'imaging IVUS ultraarmonico è stato eseguito con una sonda IVUS personalizzata (frequenza di trasmissione 35 MHz, pressione negativa di picco 600 kPa). Entrambe le immagini sono realizzate dallo stesso embrione e dalla stessa regione di interesse. Le frecce indicano i vasi corrispondenti nelle due immagini. La barra della scala rappresenta 1 mm. Questa immagine è stata modificata con il permesso di Maresca et al. 201412. Fare clic qui per visualizzare una versione ingrandita di questa figura.
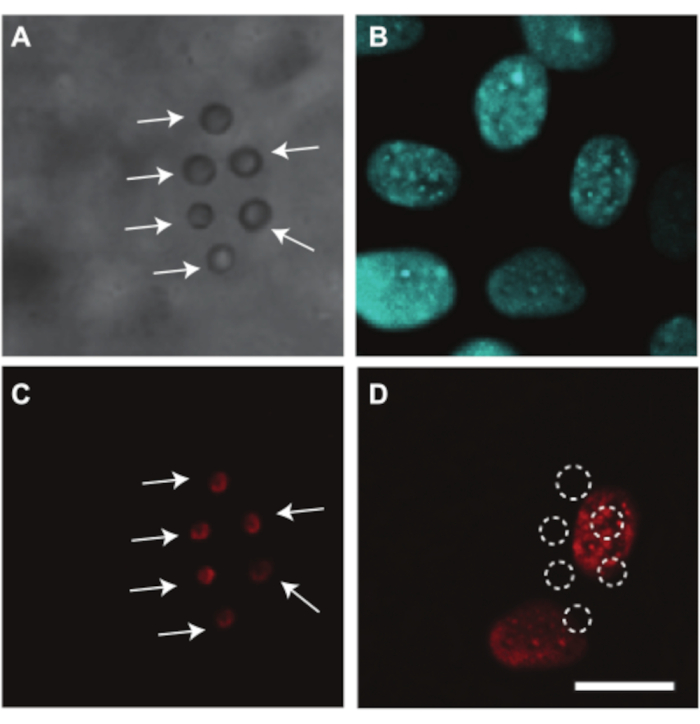
Figura 10. Somministrazione di farmaci alle cellule endoteliali dei vasi CAM in embrione di 6 giorni. (A) Immagine in campo chiaro di microbolle a sei αvβ3-mirate, indicate con frecce bianche, aderenti alla parete del vaso prima del trattamento ecografico. (B) Nuclei di cellule endoteliali colorati con fluorescenza prima del trattamento ecografico. (C) Immagine fluorescente delle microbolle mirate colorate, indicate con frecce bianche, prima del trattamento ecografico. (D) Assorbimento dello ioduro di propidio (PI) del farmaco modello nei nuclei cellulari sotto le microbolle bersaglio dopo trattamento ad ultrasuoni (1 MHz, pressione negativa di picco 200 kPa, singola raffica di 1000 cicli). La barra di scala rappresenta 10 μm e si applica a tutte le immagini. Questa immagine è stata modificata con il permesso di Skachkov et al. 20147. Fare clic qui per visualizzare una versione ingrandita di questa figura.
FASCICOLI SUPPLEMENTARI
Video supplementare 1. Microbolle nel vaso sanguigno CAM. La barra della scala rappresenta 20 μm. Clicca qui per scaricare questo video.
Discussione
Questo protocollo descrive tre metodi su come ottenere e utilizzare embrioni di pollo di età compresa tra 5 e 8 giorni e la loro CAM come modello in vivo per studiare l'imaging a ultrasuoni con contrasto e la somministrazione di farmaci mediata da microbolle. I passaggi più critici per prelevare embrioni di 5 giorni (sezione 1.2) e da 6 a 7 giorni (sezione 1.3) dal guscio sono: 1) fare il piccolo foro nella parte superiore dell'uovo per passare attraverso l'intero guscio d'uovo nel sacco d'aria prima di prelevare l'albume; 2) creare bordi lisci per la grande apertura nel guscio. Per il metodo per prelevare embrioni di 8 giorni dal guscio (sezione 1.4) i passaggi più critici sono: 1) Fare un numero sufficiente di rientranze per creare una bella crepa lungo l'uovo; 2) Tenere l'uovo immerso in PBS. Per garantire la vitalità dell'embrione per tutti i metodi è importante mantenere l'uovo e il suo contenuto a 37 ° C. Inoltre, evitare l'iniezione in un'arteria CAM. Si raccomanda di monitorare visivamente la frequenza cardiaca dell'embrione durante gli studi per garantire la vitalità dell'embrione. Per confermare l'esatto stadio di sviluppo dell'embrione, è possibile utilizzare l'indicazione di Hamburger & Hamilton22.
È importante prevenire danni all'embrione, alla CAM e al sacco del tuorlo. Questo danno può influenzare la vitalità, il flusso sanguigno e la visibilità dell'embrione e della CAM. Inoltre, il danneggiamento del sacco vitellino e di conseguenza una bassa rigidità della membrana rendono impossibile un'iniezione nei vasi CAM. Un embrione di 5 giorni ha una sacca d'aria relativamente piccola, quindi per poter praticare un foro sufficientemente grande nel guscio attraverso il quale è possibile rimuovere il contenuto dell'uovo, è necessario prelevare 2 ml di albume. Di conseguenza, viene creato più spazio tra il guscio d'uovo e l'embrione. Dopo il ritiro dell'albume, un pezzo di nastro adesivo deve chiudere il foro in cui è entrato l'ago. Se l'albume fuoriesce ancora, applicare un altro pezzo di nastro adesivo. Oltre a ciò, l'applicazione di nastro adesivo sul foro sul lato crea un vuoto all'interno dell'uovo che impedisce al contenuto dell'uovo di cadere a causa del suo stesso peso quando viene creato il foro grande nel punto 1.2.2.8. Danni all'embrione o alla CAM possono verificarsi anche quando il bordo del guscio d'uovo era troppo affilato o quando il contenuto dell'uovo viene lasciato cadere nel battello di pesatura troppo rigorosamente, quindi il guscio d'uovo deve essere tenuto molto vicino al battello di pesatura. Tra il giorno 5 e il 6 di sviluppo, il CAM inizia ad attaccarsi alla membrana del guscio32. Questo attaccamento aumenta il rischio di danneggiare l'embrione e la CAM quando si estrae il contenuto dell'uovo dal guscio d'uovo. Aprendo l'uovo dopo l'iniezione di PBS in esso per un uovo incubato da 6 a 7 giorni o in un contenitore pieno di PBS come descritto per un uovo incubato di 8 giorni, il rischio di danni è ridotto. Per quanto riguarda un'iniezione in una vena CAM: se la prima iniezione fallisce, una seconda iniezione può essere eseguita più a monte nella stessa vena se il danno è stato minore o in un'altra vena CAM. La separazione dell'embrione e della CAM dal tuorlo rende l'embrione e i vasi CAM otticamente trasparenti. Di conseguenza, l'embrione perde la sua fonte primaria di nutrienti33. Questa perdita di nutrienti potrebbe essere una spiegazione per la frequenza cardiaca più bassa osservata di 80 bpm rispetto a ~ 190 per un embrione di 6 giorni che è ancora in contatto con il tuorlo30 e il tempo di sopravvivenza ridotto di 2 ore dopo questa procedura di separazione. Un altro fattore che può svolgere un ruolo nella riduzione della frequenza cardiaca e del tempo di sopravvivenza è la sfida di mantenere l'embrione separato dal tuorlo e i vasi CAM a 37 ° C. Un incubatore da stadio per microscopio può essere di aiuto. Oltre a questo, il distacco della CAM dal tuorlo probabilmente porta a cambiamenti meccanici nel tessuto poiché la tensione della membrana diminuisce. La minore tensione della membrana può causare un aumento della frequenza di taglio dei vasi interni che porta ad una frequenza cardiaca più bassa.
L'embrione di pollo ex ovo e i vasi CAM hanno alcune limitazioni come modello in vivo, comprese solo osservazioni a breve termine, per l'imaging ecografico con mezzo di contrasto e studi di somministrazione di farmaci mediati da microbolle. A causa del piccolo volume di sangue di 100±23 μL al giorno 5 e 171±23 μL al giorno 634, può essere iniettato un volume massimo di ~5 μL. Nelle fasi successive dello sviluppo (giorno 7 e oltre), la rigidità della nave aumenta e l'elasticità del tuorlo diminuisce. Questo può complicare un'iniezione di successo negli embrioni più anziani. Una volta iniettate, le microbolle circolano per ore perché l'embrione di pollo non ha un sistema immunitario completamente sviluppato in questa fase35. Pertanto, le microbolle non vengono eliminate entro ~ 6 minuti poiché negli esseri umani 36,37 rendendo i tipici studi di imaging molecolare ad ultrasuoni con un periodo di attesa di 5-10 minuti per le microbolle mirate non legate da eliminare38 non fattibile. Per colpire le microbolle, è necessario utilizzare ligandi adatti in grado di legarsi alle cellule endoteliali aviarie come precedentemente descritto per il marcatore di angiogenesi αvβ37. Altri aspetti da considerare per questo modello sono la maggiore difficoltà di separare l'embrione e i vasi CAM dal tuorlo negli embrioni più anziani (> 8 giorni) e l'ematocrito inferiore di ~ 20% 39 rispetto agli esseri umani. Quest'ultimo può influenzare le oscillazioni delle microbolle perché è noto che le oscillazioni delle microbolle sono smorzate in un ambiente più viscoso40. Le arterie CAM sono meno ossigenate delle vene CAM41,42. Questa differenza dovrebbe essere presa in considerazione quando, ad esempio, si studia l'imaging fotoacustico dell'ossigenazione del sangue.
I metodi qui descritti consentono di estrarre il contenuto dell'uovo dal guscio d'uovo il giorno dell'imaging ecografico o dello studio di somministrazione del farmaco, in genere dal 5 al giorno 8 dell'incubazione. Questo è diverso dai metodi esistenti in cui il contenuto di uova viene estratto dal guscio dopo un'incubazione di 3 giorni e ulteriormente sviluppato come coltura ex ovo 18,20,21. I vantaggi sono un tasso di sopravvivenza più elevato del 90% per 5 giorni, 75% per 6 giorni, 50% per 7 giorni e 60% per uova incubate di 8 giorni rispetto a ~ 50% per embrioni di 3 giorni estratti dal guscio d'uovo e ulteriormente incubati ex ovo 1,18 l'evitare antibiotici durante la coltura 18, 20 e grande incubatore sterile per la coltura ex ovo. La sopravvivenza degli embrioni di 6-8 giorni è inferiore perché la CAM inizia ad attaccarsi al guscio21 che lascia la membrana CAM più incline alla rottura dopo l'estrazione. La separazione dell'embrione con la CAM dal tuorlo è anche descritta rendendo l'embrione e la CAM otticamente trasparenti.
Posizionando il contenuto dell'uovo in diverse configurazioni, l'embrione di pollo e la CAM possono essere utilizzati per una moltitudine di studi di imaging ad ultrasuoni, come IVUS, fotoacustica, senza o con agenti di contrasto ad ultrasuoni in 2D e 3D. L'attenzione può essere rivolta allo sviluppo di nuovi schemi di pulsazione a ultrasuoni o alla sperimentazione di nuovi trasduttori. Oltre a questo, il modello può anche essere utilizzato per studiare nuovi agenti di contrasto ad ultrasuoni e il loro comportamento nei vasi sanguigni sotto flusso. Poiché il meccanismo di somministrazione del farmaco mediato da microbolle è ancora sconosciuto43, l'uso del modello CAM in vivo può aiutare a chiarire il meccanismo studiando il comportamento delle microbolle in relazione alla risposta cellulare. Infine, i vasi CAM hanno dimostrato di essere un sistema adatto per studiare il trapianto di tumore xenograft44. Ciò crea la possibilità di utilizzare il vaso CAM come modello per studiare l'imaging tumorale utilizzando gli ultrasuoni e per studiare il flusso sanguigno all'interno del tumore utilizzando CEUS. I tumori sono tipicamente innestati sui vasi CAM di embrioni di 8 o 9 giorni 1,14,45, per i quali l'embrione viene estratto dal guscio d'uovo al giorno 3 dell'incubazione e ulteriormente sviluppato ex ovo. I metodi descritti in questo protocollo potrebbero essere utilizzati per far crescere embrioni in ovo fino al giorno dell'innesto tumorale.
Gli autori confidano che questo documento sarà utile per i ricercatori che vogliono utilizzare embrioni di pollo e la loro membrana corioallantoica (CAM) come modello in vivo per applicazioni di agenti di contrasto e studi di flusso.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dall'Applied and Engineering Sciences (TTW) (Vidi-project 17543), parte del NWO. Gli autori desiderano ringraziare Robert Beurskens, Luxi Wei e Reza Pakdaman Zangabad del Dipartimento di Ingegneria Biomedica e Michiel Manten e Geert Springeling del Dipartimento di Strumentazione Medica Sperimentale per l'assistenza tecnica, tutti del Centro medico universitario Erasmus MC di Rotterdam, Paesi Bassi.
Materiali
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Clamp (Kocher clamp) | |||
| Cling film | |||
| Holder with acoustic membrane (CLINIcell 25 cm2) | MABIO, Tourcoing, France | CLINIcell25-50-T FER 00106 | |
| Demi water | |||
| Disposable plastic Pasteur pipets | VWR | 612-1747 | |
| Eggs | Drost Pluimveebedrijf Loenen BV, the Netherlands | Freshly fertilized | |
| Fridge 15 °C | |||
| Glass capillary needles | Drummond | 1-000-1000 | Inside diameter: 0.0413 inch |
| Heating plate 37 °C | |||
| Humidified incubator 37 °C | |||
| Insect specimen pins | |||
| Metal egg holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 A,B | ||
| Metal weighing boat holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 C,D | ||
| Microinjection system | FUJIFILM VisualSonics | ||
| Mineral oil | Sigma-Aldrich | M8410-100ML | |
| Needle, 19 G | VWR (TERUMO) | 613-5392 | |
| Phosphate-bufferes saline (PBS), 1x | ThermoFisher | 10010023 | |
| Petri dish, 1 L | Glass | ||
| Petri dish, 90 mm diameter | VWR | 391-0559 | |
| Preclinical animal ultrasound machine (Vevo 2100) | FUJIFILM VisualSonics | ||
| Probe (MS250) | FUJIFILM VisualSonics | 30 MHz transmit and 15 MHz receive frequency | |
| Probe (MS550s) | FUJIFILM VisualSonics | transmission frequency of 40 MHz | |
| Scalpel | VWR (SWANN-MORTON) | 233-5363 | |
| Scissors, small | Fine Science Tools (FST) | 14558-09 | |
| Syringe, 5 mL | VWR (TERUMO) | 613-0973 | |
| Table spoon | |||
| Tape (Scotch Magic tape) | Scotch | ||
| Tissue paper | Tork | ||
| Tweezers large | VWR (USBECK Laborgeräte) | 232-0107 | See figure 1E |
| Tweezers small | DUMONT Medical, Switzerland | 0103-5/45 | See figure 1F |
| Ultrasound contrast agent (custum made F-type) | Produced as described by: Daeichin, V. et al. Microbubble Composition and Preparation for Imaging : In Vitro and In Vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555–567 (2017). | ||
| Ultrasound contrast agent (MicroMarker) | FUJIFILM VisualSonics, Inc. | ||
| Ultrasound contrast agent (Definity) | Lantheus medical imaging, United States | ||
| Ultrasound gel | Aquasonic | ||
| Waxi film (Parafilm) | Parafilm | ||
| Weighing boats (85 × 85 × 24 mm) | VWR | 611-0094 |
Riferimenti
- Martowicz, A., Kern, J., Gunsilius, E., Untergasser, G. Establishment of a Human Multiple Myeloma Xenograft Model in the Chicken to Study Tumor Growth, Invasion and Angiogenesis. Journal of Visualized Experiments. (99), e1 (2015).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A Submerged Filter Paper Sandwich for Long-term Ex ovo Time-lapse Imaging of Early Chick Embryos. Journal of Visualized Experiments. (118), e1 (2016).
- Brauer, R., Chen, P. Influenza Virus Propagation in Embryonated Chicken Eggs. Journal of Visualized Experiments. (97), e1 (2015).
- Oosterbaan, A. M., Ursem, N. T. C., Struijk, P. C., Bosch, J. G., van der Steen, A. F. W., Steegers, E. A. P. Doppler flow velocity waveforms in the embryonic chicken heart at developmental stages corresponding to 5-8 weeks of human gestation. Ultrasound in Obstetrics and Gynecology. 33 (6), 638-644 (2009).
- McQuinn, T. C., Bratoeva, M., DeAlmeida, A., Remond, M., Thompson, R. P., Sedmera, D. High-Frequency Ultrasonographic Imaging of Avian Cardiovascular Development. Developmental Dynamics. 236 (12), 3503-3513 (2007).
- Stieger, S. M., Caskey, C. F., Adamson, R. H., Curry, F. E., Wisner, E. R., Ferrara, K. W. Enhancement of Vascular Permeability with Low-Frequency Contrast-enhanced Ultrasound in the Chorioallantoic Membrane Model. Radiology. 243 (1), 112-121 (2007).
- Skachkov, I., Luan, Y., van der Steen, A. F. W., De Jong, N., Kooiman, K. Targeted microbubble mediated sonoporation of endothelial cells in vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (10), 1661-1667 (2014).
- Vargas, A., Zeisser-Labouèbe, M., Lange, N., Gurny, R., Delie, F. The chick embryo and its chorioallantoic membrane (CAM) for the in vivo evaluation of drug delivery systems. Advanced Drug Delivery Reviews. 59 (11), 1162-1176 (2007).
- Rytelewski, M., Buensuceso, A., Leong, H. S., Deroo, B. J., Chambers, A. F., Koropatnick, J. Evaluating the Effectiveness of Cancer Drug Sensitization In Vitro and In vivo. Journal of Visualized Experiments. (96), e1 (2015).
- Schmitd, L. B., Liu, M., Scanlon, C. S., Banerjee, R., Silva, N. J. D. The Chick Chorioallantoic Membrane In vivo Model to Assess Perineural Invasion in Head and Neck Cancer. Journal of Visualized Experiments. (148), e1 (2019).
- Daeichin, V., Bosch, J. G., Needles, A., Foster, F. S., van der Steen, A., de Jong, N. Subharmonic, non-linear fundamental and ultraharmonic imaging of microbubble contrast at high frequencies. Ultrasound in Medicine and Biology. 41 (2), 486-497 (2015).
- Maresca, D., et al. Imaging microvasculature with contrast-enhanced ultraharmonic ultrasound. Ultrasound in Medicine and Biology. 40 (6), 1318-1328 (2014).
- Lindsey, B. D., et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography. Annals of Biomedical Engineering. 45 (4), 939-948 (2017).
- Paproski, R. J., Jovel, J., Wong, G. K. S., Lewis, J. D., Zemp, R. J. Enhanced detection of cancer biomarkers in blood-borne extracellular vesicles using nanodroplets and focused ultrasound. Cancer Research. 77 (1), 3-13 (2017).
- Huang, C., et al. Short Acquisition Time Super-Resolution Ultrasound Microvessel Imaging via Microbubble Separation. Scientific Reports. 10, 1-13 (2020).
- Lowerison, M. R., Huang, C., Kim, Y., Lucien, F., Chen, S., Song, P. In vivo Confocal Imaging of Fluorescently Labeled Microbubbles: Implications for Ultrasound Localization Microscopy. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 67 (9), 1811-1819 (2020).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo Characterization of Ultrasound Contrast Agents: Microbubble Spectroscopy in a Chicken Embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yalcin, H. C., Shekhar, A., Rane, A. A., Butcher, J. T. An ex-ovo Chicken Embryo Culture System Suitable for Imaging and Microsurgery Applications. Journal of Visualized Experiments. (44), e4 (2010).
- Kokhuis, T. J. A., et al. Intravital microscopy of localized stem cell delivery using microbubbles and acoustic radiation force. Biotechnology and Bioengineering. 112 (1), 220-227 (2015).
- Cloney, K., Franz-Odendaal, T. A. Optimized Ex-ovo Culturing of Chick Embryos to Advanced Stages of Development. Journal of Visualized Experiments. (95), e6 (2015).
- Dohle, D. S., et al. Chick ex ovo Culture and ex ovo CAM Assay: How it Really Works. Journal of Visualized Experiments. (33), e2 (2010).
- Hamburger, V., Hamilton, H. A Series Of Normal Stages In The Developent Of The Chick Embryo. Journal of Morphology. 88 (1), 231-272 (1951).
- Ribatti, D. A morphometric study of the expansion of the chick vasculosa in shell-less culture. Journal of Anatomy. 186, 639-644 (1995).
- Ribatti, D., Nico, B., Vacca, A., Roncali, L., Burri, P. H., Djonov, V. Chorioallantoic Membrane Capillary Bed: A Useful Target for Studying Angiogenesis and Anti-Angiogenesis In vivo. Anatomical Record. 324, 317-324 (2001).
- DeFouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the Microcirculation in the Chick Chorioallantoic Membrane during Normal Angiogenesis. Microvascular research. 38, 136-147 (1989).
- Beekers, I., van Rooij, T., van der Steen, A. F. W., de Jong, N., Verweij, M. D., Kooiman, K. Acoustic characterization of the CLINIcell for ultrasound contrast agent studies. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (1), 244-246 (2019).
- Lang, E. R., Rha, C. Apparent shear viscosity of native egg white. Journal of Food Science and Technology. 17, 595-606 (1982).
- Daeichin, V., et al. Microbubble Composition and Preparation for Imaging: In Vitro and In vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555-567 (2017).
- Mcferrin, H. E., Olson, S. D., Gutschow, M. V., Semon, J. A., Sullivan, D. E., Prockop, D. J. Rapidly Self-Renewing Human Multipotent Marrow Stromal Cells (hMSC) Express Sialyl Lewis X and Actively Adhere to Arterial Endothelium in a Chick Embryo Model System. PLoS ONE. 9 (8), 1-11 (2014).
- Akiyama, R., Mitsubayashi, H., Tazawa, H., Burggren, W. W. Heart rate responses to altered ambient oxygen in early (days 3-9) chick embryos in the intact egg. Journal of Comparative Physiology - B Biochemical, Systemic, and Environmental Physiology. 169 (2), 85-92 (1999).
- Foster, F. S., Hossack, J., Adamson, S. L. Micro-ultrasound for preclinical imaging. Interface Focus. 1, 576-601 (2011).
- Gabrielli, M. G., Accili, D. The Chick Chorioallantoic Membrane: A Model of Molecular, Structural, and Functional Adaptation to Transepithelial Ion Transport and Barrier Function during Embryonic Development. Journal of Biomedicine and Biotechnology. , 1-12 (2010).
- van der Wagt, I., de Jong, I. C., Mitchell, M. A., Molenaar, R., van den Brand, H. A review on yolk sac utilization in poultry. Poultry Science. 99, 2162-2175 (2020).
- Kind, C. The development of the circulating blood volume of the chick embryo. Anatomy and Embryology. 147, 127-132 (1975).
- Ribatti, D. Chick Embryo Chorioallantoic Membrane as a Useful Tool to Study Angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Schneider, M. Characteristics of SonoVue(TM). Echocardiography. 16 (7), 743-746 (1999).
- Kitzman, D. W., Goldman, M. E., Gillam, L. D., Cohen, J. L., Aurigemma, G. P., Gottdiener, J. S. Efficacy and Safety of the Novel Ultrasound Contrast Agent Perflutren (Definity) in Patients With Suboptimal Baseline Left Ventricular Echocardiographic Images. American Journal of Cardiology. 86, 669-674 (2000).
- Kosareva, A., Abou-Elkacem, L., Chowdhury, S., Lindner, J. R., Kaufmann, B. A. Seeing the Invisible-Ultrasound Molecular Imaging. Ultrasound in Medicine and Biology. 46 (3), 479-497 (2020).
- Al-Roubaie, S., Jahnsen, E. D., Mohammed, M., Henderson-Toth, C., Jones, E. A. V. Rheology of embryonic avian blood. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2473-2481 (2011).
- Helfield, B., Chen, X., Qin, B., Villanueva, F. S. Individual lipid encapsulated microbubble radial oscillations: Effects of fluid viscosity. The Journal of the Acoustical Society of America. 139 (1), 204-214 (2016).
- Metcalfe, J., Stock, M. K. Oxygen exchange in the chorioallantoic membrane, avian homologue of the mammalian placenta. Placenta. 14, 605-613 (1993).
- Tazawa, H. Oxygen and CO2 exchange and acid-base regulation in the avian embryo. American Journal of Zoology. 20, 395-404 (1980).
- Kooiman, K., et al. Ultrasound-Responsive Cavitation Nuclei for Therapy and Drug Delivery. Ultrasound in Medicine and Biology. 46 (6), 1296-1325 (2020).
- Li, M., Pathak, R. R., Lopez-rivera, E., Friedman, S. L., Aguirre-ghiso, J. A., Sikora, A. G. The In ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of Visualized Experiments. (104), e1 (2015).
- Sys, G. M. L., et al. The In ovo CAM-assay as a Xenograft Model for Sarcoma. Journal of Visualized Experiments. (77), e1 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon