Method Article
Die Herstellung von Hühner-Ex-Ovo-Embryonen und chorioallantoischen Membrangefäßen als In-vivo-Modell für kontrastmittelverstärkte Ultraschallbildgebung und Mikroblasen-vermittelte Arzneimittelabgabestudien
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt drei Methoden zur Gewinnung und Verwendung von 5 bis 8 Tage alten Hühnerembryonen und ihrer Chorioallanto-Membran (CAM) als In-vivo-Modell zur Untersuchung der kontrastverstärkten Ultraschallbildgebung und der Mikroblasen-vermittelten Wirkstoffabgabe.
Zusammenfassung
Der Hühnerembryo und die blutgefäßreiche Chorioallantoinmembran (CAM) sind ein wertvolles In-vivo-Modell zur Untersuchung biomedizinischer Prozesse, neuer Ultraschallpulsierungsschemata oder neuartiger Schallköpfe für kontrastverstärkte Ultraschallbildgebung und Mikroblasen-vermittelte Medikamentenabgabe. Gründe dafür sind die Zugänglichkeit des Embryo- und Gefäßnetzwerks des CAM sowie die geringen Kosten des Modells. Ein wichtiger Schritt, um Zugang zu den Embryo- und CAM-Gefäßen zu erhalten, besteht darin, den Eiinhalt aus der Eierschale zu entnehmen. In diesem Protokoll werden drei Methoden beschrieben, um den Inhalt zwischen Tag 5 und 8 der Inkubation aus der Eierschale zu entnehmen, so dass sich die Embryonen bis heute in der Eierschale entwickeln können. Die beschriebenen Methoden erfordern nur einfache Werkzeuge und Geräte und liefern eine höhere Überlebenserfolgsrate von 90% für 5-Tage, 75% für 6-Tage, 50% für 7-Tage und 60% für 8-Tage alte inkubierte Eizellen im Vergleich zu ex ovo kultivierten Embryonen (~ 50%). Das Protokoll beschreibt auch, wie Kavitationskerne wie Mikrobläschen in das CAM-Gefäßsystem injiziert werden, wie die Membran mit Embryo und CAM vom Rest des Eiinhalts für optisch transparente Studien getrennt wird und wie der Hühnerembryo und CAM in einer Vielzahl von kurzfristigen Ultraschallexperimenten verwendet werden. Das In-vivo-Hühnerembryo- und CAM-Modell ist äußerst relevant, um neuartige Bildgebungsprotokolle, Ultraschallkontrastmittel und Ultraschallpulsierungsschemata für kontrastverstärkte Ultraschallbildgebung zu untersuchen und die Mechanismen der ultraschallvermittelten Medikamentenabgabe zu entschlüsseln.
Einleitung
Ex-Ovo-Hühnerembryonen und die blutgefäßreiche Chorioallantousmembran (CAM) haben sich als geeignetes Modell erwiesen, um verschiedene biologische und biomedizinische Prozesse wie Embryogenese, Onkologie und Medikamentenabgabe zu untersuchen 1,2,3,4. Ultraschall wurde zur Bildgebung der embryonalen Herzentwicklung 4,5 und zur Aktivierung von Kavitationskernen bei Injektion, wie Mikrobläschen, für die vaskuläre Arzneimittelabgabe 6,7 verwendet. Hühnerembryonen sind kostengünstig, benötigen weniger Infrastruktur und Ausrüstung und haben im Vergleich zu anderen Tiermodellen weniger strenge Rechtsvorschriften8. Der Hühnerembryo und die CAM-Gefäße sind nach dem Öffnen des Eies leicht zugänglich, während sich dies bei Säugetierembryonen und -gefäßen als viel schwieriger erweist. Außerdem sorgen der Hühnerembryo und die CAM-Gefäße für einen Herzschlag und einen pulsierenden Blutfluss. Das CAM zeigt Ähnlichkeiten in der Gefäßanatomie mit Säugetieren und kann für das Drogenscreening 8,9,10 verwendet werden. Aufgrund dieser Eigenschaften haben sich die CAM-Gefäße auch als geeignetes Modell zur Untersuchung der kontrastverstärkten Ultraschallbildgebung (CEUS) erwiesen11,12,13,14,15,16. Darüber hinaus kann das Modell verwendet werden, um das Verhalten von Ultraschallkontrastmitteln in einem Ultraschallfeld mit einer Ultrahochgeschwindigkeitskamera und die Wirkung der akustischen Strahlungskraft auf das Treiben, Binden und die Extravasation von Arzneimitteln 7,17,18,19 optisch zu untersuchen. Obwohl der Hühnerembryo und die CAM für Langzeitexperimente weniger geeignet sind, können sie für kurzfristige In-vivo-Experimente von Vorteil sein.
Um die Sichtbarkeit und Kontrollierbarkeit über den Hühnerembryo und die CAM während der Experimente zu erhöhen, ist es wichtig, den Eiinhalt, der den Embryo und die CAM enthält, aus der Eierschalezu entnehmen 18. Frühere Hühnerembryostudien mit Ultraschallkontrastmitteln verwendeten 5 bis 6 Tage alte Embryonen 7,11,12,17,19 und 14 bis 18 Tage alte Embryonen13,14,15,16. Mehrere Ansätze wurden detailliert beschrieben, um den Eiinhalt aus der Schale zu nehmen 18,20,21. Nach unserem besten Wissen konzentrieren sich die zuvor veröffentlichten Ansätze jedoch darauf, den Eigehalt nach 3 Tagen Inkubation aus der Eierschale zu nehmen (d.h. Hamburger & Hamilton (HH) Stadium 19-2022) und die Kultur ex ovo fortzusetzen. Dieser Ex-Ovo-Kulturansatz hat mehrere Nachteile, darunter ein erhöhtes Risiko für Todesfälle während der Kultur (~ 50%)1,18, die Verwendung von Antibiotika18,20 und eine verringerte Gesamtgefäßlänge im Vergleich zum In-Ovo-Wachstum 23. Da die Kultivierung des Embryos in der Eierschale die natürlichste Umgebung bietet, ist es am einfachsten, den Embryo bis zum Tag des Experiments in der Eierschale zu inkubieren. Aus diesem Grund wäre ein Ansatz, bei dem der Eiinhalt nach 5 bis 8 Tagen Inkubation aus der Eierschale entnommen wird, insbesondere für Experimente an 5 bis 8 Tage alten Embryonen von Vorteil.
In diesem Protokoll beschreiben wir drei Methoden, um den Eiinhalt aus der Eierschale zu entnehmen, wenn sich der Embryo am Tag 5 bis 8 der Entwicklung befindet (HH 26-3522), so dass sich der Embryo bis zum Tag des Experiments innerhalb der Eierschale entwickeln kann. Die CAM-Gefäßgröße reicht von 10-15 μm Durchmesser in den kleineren Kapillaren eines 8 Tage alten Embryos 24 bis 115-136 μm im Durchmesser im größeren Gefäß von 6 und 8 Tage alten Embryonen24,25. Die drei beschriebenen Methoden erfordern nur grundlegende Laborwerkzeuge und reduzieren das Risiko von Komplikationen vor Beginn des Experiments, wodurch unnötige Kosten und Arbeitsaufwand reduziert werden. Wir beschreiben auch eine Methode, um die Membran mit dem Embryo und der CAM vom Dottersack zu trennen, wodurch das CAM für Mikroskopiestudien optisch transparent wird. Da die Membran, die den Embryo und die CAM enthält, beispielsweise auf einen Halter mit einer akustischen Membran fixiert werden kann, kann der Aufbau auch akustisch transparent gemacht werden26, was die Kombination von Mikroskopie und Ultraschalluntersuchungen ermöglicht, wenn der Lichtweg durch das Eigelb beeinflusst wird. Schließlich beschreiben wir einige andere Ultraschall-Setups, die für Ultraschall oder CEUS-Bildgebung verwendet werden können.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit dem niederländischen Tierversuchsgesetz und in Übereinstimmung mit dem Europäischen Rat (2010/63/EU) zum Schutz der Verwendung von Tieren für wissenschaftliche Zwecke durchgeführt.
1 . Protokoll zur Vorbereitung des Embryos
- Inkubation der befruchteten Hühnereier
- Frisch befruchtete Hühnereier bis zu einer Woche bei 15 °C lagern.
- Um die befruchteten Eier zu befruchten, legen Sie sie senkrecht mit der spitzen Seite nach unten in einen 37 °C befeuchteten Inkubator. Das Drehen der Eier während der Inkubation ist nicht notwendig.
HINWEIS: Schreiben Sie das Startdatum der Inkubation der Oberseite des Eies mit einem Permanentmarker.
- Vorbereitung von bis zu 5 Tagen (120 h) alten Embryonen (HH-Stadium 26-28)22
- Vorbereitung des Arbeitsbereichs
- Eine Heizplatte auf 37 °C erwärmen.
- Legen Sie einen Eierhalter aus Metall (Abbildung 1A,B), einen Metallwaagenhalter (Abbildung 1C,D) und einen mit PBS gefüllten 10-ml-Erlenmeyer auf die Heizplatte.
- Füllen Sie ein Wiegeboot (85 mm × 85 mm × 25 mm) mit einer 10 mm Schicht Ultraschallgel und legen Sie das gefüllte Wiegeboot in den vorgewärmten Metallwaagenhalter.
HINWEIS: Wenn Sie das Wiegeboot mit Ultraschallgel füllen, werden der Embryo und die CAM angehoben. Dies kann für die Injektion oder Bildgebung des Embryos und der CAM von Vorteil sein, ist jedoch nicht notwendig, um den Embryo und die CAM aus der Eierschale zu entnehmen. - Bereiten Sie ein paar Stücke Klebeband (ca. 3 cm lang) vor, wobei ein Teil eines Endes wieder auf sich selbst gefaltet ist, damit es nicht mehr klebt.
- Den Eiinhalt aus der Eierschale nehmen
- Nehmen Sie ein 5 Tage altes, befruchtetes Ei und geben Sie es in den vorgewärmten Metalleihalter (Abbildung 1A, B). Stellen Sie sicher, dass Sie das Ei in der gleichen Ausrichtung halten (d. H. Datum oben).
HINWEIS: Es ist wichtig, das Ei in der gleichen Ausrichtung zu halten, um den Luftsack und den Embryo und CAM an der gleichen Position in der Oberseite des Eies zu halten. - Verwenden Sie die spitze Rückseite einer Pinzette (oder ähnlich; Abbildung 1E) eine kleine Einkerbung ganz oben auf dem Ei (wo das Datum geschrieben ist) zu machen (Abbildung 2A).
- Verwenden Sie die spitze Rückseite der Pinzette, um eine zweite Vertiefung an der Seite des Eies etwa 2/3 nach unten zu machen (Abbildung 2B).
HINWEIS: Achten Sie darauf, den Einzug nicht zu groß zu machen und ein Loch zu erzeugen. Wenn versehentlich ein Loch entsteht, verschließen Sie das Loch mit Klebeband und machen Sie keine weitere Vertiefung. - Nehmen Sie mit der größeren Pinzette (Abbildung 1E) ein kleines Stück Eierschale aus dem eingerückten Bereich auf dem Ei heraus (mit schriftlichem Datum). Stellen Sie sicher, dass der Luftsack in der Oberseite der Eierschale Kontakt mit der Luft außerhalb des Eies hat, aber dringen Sie nicht zu tief in die Schale ein.
HINWEIS: Wenn die Schale beim Herstellen der oberen Vertiefung zu tief durchdrungen wird, können der Embryo und die CAM beschädigt werden und der Embryo wird die Entfernung aus der Schale nicht überleben. Es ist wichtig, dass das kleine Loch auf der Oberseite Luftkontakt zwischen der Innen- und Außenseite des Eies herstellt. Wenn dies nicht geschieht, wird in den nächsten Schritten des Verfahrens ein Vakuum erzeugt, das dazu führt, dass große Luftblasen unter dem CAM eingeschlossen werden, was den Embryo und die CAM unbrauchbar macht. Um die Position des Luftsacks im Inneren des Eies zu überprüfen, kann eine Lichtquelle verwendet werden, da seine Position nicht immer genau oben ist und auch mehr zur Seite sein kann. - Verwenden Sie eine 5-ml-Spritze und eine 19-G-Nadel, um durch die zweite Vertiefung auf der Seite 2/3 des Eies in die Schale einzudringen, und ziehen Sie ~ 2 ml Eiweiß ab (Abbildung 2C).
HINWEIS: Stellen Sie sicher, dass die Nadel nach unten zum Boden des Eies zeigt, um die Gefahr einer Beschädigung des Embryos und der CAM zu vermeiden. Dieser Schritt erzeugt eine größere Lufttasche in der Oberseite des Eies, die zum Entfernen des Eiinhalts benötigt wird. Wenn in Schritt 1.2.2.3 versehentlich ein Loch anstelle einer Einrückung erzeugt wird, stechen Sie das Klebeband mit der Nadel durch, um das Eiweiß herauszuziehen. Verschließen Sie den Einstich mit einem anderen Stück Klebeband wieder. - Nehmen Sie die Nadel heraus, und verschließen Sie den seitlichen Spalt mit Klebeband (Abbildung 2D).
HINWEIS: Um zu verhindern, dass Eiweiß aus dem Ei austritt, kann das obere Loch mit einem Finger geschlossen werden, bevor die Nadel herausgenommen wird. Wenn Eiweiß mit dem bereits vorhandenen Klebeband austritt, entfernen Sie zuerst das Eiweiß mit einem Stück Gewebe, um sicherzustellen, dass das Klebeband richtig haftet. - Entleeren Sie die Spritze, indem Sie das Eiweiß in das Wiegeboot geben.
- Verwenden Sie die große Pinzette (Abbildung 1E), um die kleine Öffnung auf der Oberseite des Eies zu vergrößern (Abbildung 2E). Wenn man durch die Öffnung oben in die Eizelle schaut, sind der Embryo und die CAM sichtbar. Lokalisieren Sie den Embryo und die CAM, während Sie so viel Eierschale wie möglich entfernen (Abbildung 2F).
HINWEIS: Bewegen Sie das Ei weiter, um die Position des Embryos und der CAM in der Schale maximal sichtbar zu halten. Stellen Sie sicher, dass der Rand der Öffnung in der Schale nicht tiefer als das CAM geht. Eindringen Sie außerdem nicht in die innere Membran und verhindern Sie scharfe Kanten. - Nachdem Sie die Öffnung erstellt haben, drehen Sie das Ei um 180° und legen Sie das Ei wieder so in den Eierhalter, dass die erzeugte Öffnung an der Oberseite des Eies nun nach unten zeigt. Der Embryo schwimmt nach oben und wird von unten unsichtbar (Abbildung 2G), was 1-2 Minuten dauert. Stellen Sie sicher, dass der gesamte Embryo und die CAM (einschließlich aller Gefäße) verschwunden sind und nur Eigelb sichtbar ist, bevor Sie mit dem nächsten Schritt fortfahren (Abbildung 2H).
HINWEIS: Wenn der Embryo nach 2 min immer noch von unten sichtbar ist, drehen Sie das Ei für 1-2 min im Uhrzeigersinn. Dies wird dem Embryo und dem CAM helfen, nach oben zu schwimmen. - Entfernen Sie das Klebeband von der seitlichen Öffnung. Schauen Sie, ob sich das Innere des Eies nun aus der unteren Öffnung wölbt. Wenn dies der Fall ist, fahren Sie mit dem nächsten Schritt fort. Wenn nicht, verwenden Sie die Nadel an der Spritze, um die Öffnung an der Seite noch einmal zu punktieren, um das Vakuum im Ei freizugeben. Stellen Sie sicher, dass Sie mit der Nadel nach oben zeigen, um die Gefahr zu vermeiden, dass der Dottersack durchsticht. Fahren Sie fort, bis sich das Ei aus der unteren Öffnung wölbt.
- Während Sie den Boden des Eies in der Nähe des Wiegeboots in der Metallwaage halten (Abbildung 1C, D), machen Sie vorsichtig, aber schnell einen horizontalen Kratzer in der Membran über die gesamte Breite der Öffnung mit einer der scharfen Spitzen der kleinen Pinzette (Abbildung 1F) und lassen Sie den Eiinhalt vorsichtig in das Wiegeboot fallen (Abbildung 2I).
HINWEIS: Wenn der Eiinhalt nicht herauskommt, verwenden Sie die Nadel an der Spritze, um die Seitenöffnung wieder mit der Nadel nach oben zu punktieren. - Wenn sich der Embryo seitlich im Wiegeboot befindet, geht er normalerweise von selbst nach oben. Wenn dies nicht geschieht, verwenden Sie ein Stück Seidenpapier, um den Embryo neu zu positionieren. Legen Sie eine Seite des Seidenpapiers auf den Embryo, ziehen Sie das Seidenpapier an das andere Ende und lösen Sie das Seidenpapier mit einigen Tropfen ~ 30 μL PBS (37 ° C) mit einer Pasteur-Pipette aus Kunststoff.
- Überprüfen Sie visuell, ob der Embryo am Leben ist, indem Sie sicherstellen, dass der Herzschlag noch vorhanden ist, die CAM-Gefäße intakt sind und keine Blutungen auftreten und kein Eigelb austritt. Wenn eines dieser Dinge nicht korrekt ist, verwerfen Sie den Embryo und die CAM, da sie nicht lebensfähig ist.
- Stellen Sie sicher, dass der Embryo und die CAM bei 37 ° C gehalten werden und nicht austrocknen, da sich die CAM-Gefäße dadurch verschlechtern und der Embryo schließlich absterben wird. Um dies zu verhindern, geben Sie regelmäßig kleine Tropfen von ~ 30 μL von 37 ° C PBS auf den Embryo und CAM.
- Nehmen Sie ein 5 Tage altes, befruchtetes Ei und geben Sie es in den vorgewärmten Metalleihalter (Abbildung 1A, B). Stellen Sie sicher, dass Sie das Ei in der gleichen Ausrichtung halten (d. H. Datum oben).
- Vorbereitung des Arbeitsbereichs
- Vorbereitung des 6 bis 7 Tage (144-168 h) alten Embryos (HH-Stadium 28-32)22
- Vorbereitung des Arbeitsbereichs
- Bereiten Sie die Phase wie in Abschnitt 1.2.1 beschrieben vor.
- Den Eiinhalt aus der Eierschale nehmen
- Zwei Stunden vor dem Experiment nehmen Sie ein 6 bis 7 Tage altes inkubiertes Ei und drehen Sie das Ei im Inkubator um 180 °, so dass die Oberseite des Eies nach unten zeigt. Drehen Sie das Ei nach 1 h zurück in seine ursprüngliche Position und lassen Sie es für weitere 1 h stehen.
HINWEIS: Wenn Sie das Ei 2 Stunden vor dem Experiment drehen, können Sie den Eiinhalt leichter aus der Schale entnehmen. - Nehmen Sie nach dem Drehen das Ei aus dem Inkubator.
- Führen Sie Schritt 1.2.2.2 bis Schritt 1.2.2.4 aus.
- Verwenden Sie eine 5-ml-Spritze und eine 19-G-Nadel, um durch den zweiten Einzug auf der Seite 2/3 des Eies in die Schale einzudringen und zwischen 5-6 ml Eiweiß abzuheben. Stellen Sie sicher, dass die Nadel nach unten zum Boden des Eies zeigt.
HINWEIS: Mit der von uns verwendeten 5-ml-Spritze ist es möglich, bis zu 6 ml zu entnehmen, so dass nur eine Penetration erforderlich ist. - Nehmen Sie die Nadel heraus, und versiegeln Sie den seitlichen Spalt mit einem Stück Klebeband (Abbildung 2D).
- Entleeren Sie die Spritze, indem Sie das Eiweiß zum Ultraschallgel im Wiegeboot geben.
- Verwenden Sie die große Pinzette (Abbildung 1E), um die kleine Öffnung auf der Oberseite des Eies zu vergrößern (Abbildung 2E). Versuchen Sie, die Öffnung so groß wie möglich zu machen, aber stellen Sie sicher, dass der Rand der Öffnung in der Schale nicht tiefer als die CAM geht. Eindringen Sie außerdem nicht in die innere Membran und versuchen Sie, scharfe Kanten zu verhindern.
- Füllen Sie eine Spritze mit ~1 ml mehr PBS von 37 °C als das entnommene Volumen während Schritt 1.3.2.4.
- Nehmen Sie das Klebeband aus dem Seitenspalt, durchdringen Sie den Spalt mit der gefüllten Spritze und entleeren Sie es in die Schale. Stellen Sie sicher, dass die Nadel nach unten zum Boden des Eies zeigt.
HINWEIS: Da Eiweiß eine höhere Viskosität (~160 cP)27 als PBS (~1 cP) hat, reduziert das Ersetzen des Eiweißes durch PBS sowohl die Spannung als auch die Belastung des Embryos und der CAM, während der Eiinhalt aus der Schale entnommen wird. - Nehmen Sie die Nadel heraus, und verschließen Sie den Spalt schnell wieder mit einem Stück Klebeband (Abbildung 2D).
- Drehen Sie das Ei um 180° und legen Sie das Ei wieder so in den Eierhalter, dass die entstandene Öffnung an der Oberseite des Eies nun nach unten zeigt. Drehen Sie das Ei im Uhrzeigersinn, bis der gesamte Embryo und die CAM (einschließlich aller Gefäße) verschwunden sind und nur noch Eigelb sichtbar ist.
- Führen Sie Schritt 1.2.2.10 bis Schritt 1.2.2.14 aus.
- Zwei Stunden vor dem Experiment nehmen Sie ein 6 bis 7 Tage altes inkubiertes Ei und drehen Sie das Ei im Inkubator um 180 °, so dass die Oberseite des Eies nach unten zeigt. Drehen Sie das Ei nach 1 h zurück in seine ursprüngliche Position und lassen Sie es für weitere 1 h stehen.
- Vorbereitung des Arbeitsbereichs
- Vorbereitung des 8 Tage (192 h) alten Embryos (HH-Stadium 32-35)22
- Vorbereitung des Arbeitsbereichs
- Eine Heizplatte auf 37 °C erwärmen.
- Legen Sie einen Metallwaagen-Bootshalter (Abbildung 1C, D) und einen mit PBS gefüllten 10-ml-Erlenmeyer auf die Heizplatte.
- Nehmen Sie einen flachen Behälter von 170 x 110 x 70 mm oder ähnlichem und füllen Sie den Behälter mit 1 L 37 °C PBS.
- Stellen Sie ein Wiegeboot (85 × 85 × 25 mm) in eine Petrischale mit einem Durchmesser von 90 mm. Stellen Sie die Petrischale und das Wiegeboot auf den Boden des Behälters und stellen Sie sicher, dass sie vollständig untergetaucht sind.
- Den Eiinhalt aus der Eierschale nehmen
- Zwei Stunden vor dem Experiment nehmen Sie ein 8 Tage altes inkubiertes Ei und drehen Sie das Ei um 180 ° im Inkubator, so dass die Oberseite des Eies nach unten zeigt. Drehen Sie das Ei nach 1 h zurück in seine ursprüngliche Position und lassen Sie es für weitere 1 h stehen.
HINWEIS: Wenn Sie das Ei 2 Stunden vor dem Experiment drehen, können Sie den Eiinhalt leichter aus der Schale entnehmen. - Nehmen Sie ein 8 Tage altes inkubiertes Ei aus dem Inkubator.
- Halten Sie das Ei horizontal und verwenden Sie die spitze Rückseite der großen Pinzette (Abbildung 1E), um einen kleinen Einzug 1/2 nach unten am Ei zu machen. Machen Sie weiterhin kleine Vertiefungen in einem Ringmuster 360° um die Eierschale. Verwenden Sie einen Abstand von ~10 mm zwischen den Einzügen.
HINWEIS: Während dieses Vorgangs können sich kleine Risse zwischen den Einzügen bilden. - Nachdem Sie die kleinen Vertiefungen rund um die Schale erstellt haben, machen Sie ein größeres Loch, indem Sie die Schale zwischen zwei kleinen Vertiefungen mit der spitzen Rückseite der großen Pinzette knacken.
- Das Ei vollständig in die 37 °C PBS tauchen und 5 min unter Wasser lassen. Nach 5 Minuten halten Sie das Ei in der Nähe des Wiegeboots im Behälter. Legen Sie die Oberseite beider Daumen in das große Loch und öffnen Sie das Ei vorsichtig. Das Ei wird entlang der kleinen Vertiefungen knacken.
- Wenn sich der Riss um die Eierschale gebildet hat, versuchen Sie vorsichtig, die beiden Eierschalenstücke auseinander zu ziehen und bewegen Sie die beiden Teile vorsichtig hin und her, bis der Eiinhalt von der Schale getrennt ist. Lassen Sie dann den Eiinhalt vorsichtig in das Wiegeboot fallen.
HINWEIS: Durch das Hin- und Herbewegen der beiden Eierschalenstücke fließt mehr PBS in die Eierschale, was dazu beiträgt, den Eiinhalt von der Schale zu trennen. Manchmal klebt ein bisschen Eiweiß an der Innenseite der Eierschale. Wenn dies geschieht, verwenden Sie die Pinzette, um das Eiweiß von der Schale zu trennen. - Heben Sie langsam die Petrischale mit dem Wiegeboot und dem Eiinhalt aus dem PBS an. Wenn Sie das PBS verlassen, neigen Sie das Wiegeboot leicht, um das überschüssige PBS zu entfernen.
- Legen Sie das Wiegeboot mit dem Eiinhalt in die Metallwaagenhalterung und bewegen Sie sich zum gewünschten Versuchsaufbau.
- Zwei Stunden vor dem Experiment nehmen Sie ein 8 Tage altes inkubiertes Ei und drehen Sie das Ei um 180 ° im Inkubator, so dass die Oberseite des Eies nach unten zeigt. Drehen Sie das Ei nach 1 h zurück in seine ursprüngliche Position und lassen Sie es für weitere 1 h stehen.
- Vorbereitung des Arbeitsbereichs
2. Ausgewählte Anwendungen
- Injektion von Mikrobläschen und/oder anderen Lösungen in die CAM-Gefäße
- Vorbereitung des Injektionsaufbaus
- Ziehen Sie Glasnadeln aus Glaskapillarrohren mit einer Mikroschmiede (Abbildung 3A) oder kaufen Sie gezogene Glaskapillarnadeln.
- Falls die Spitze der Glaskapillarnadel nicht abgeschrägt ist, brechen Sie einen kleinen Teil der Nadelspitze ab. Füllen Sie die Glasnadel mit Mineralöl und legen Sie sie in ein Mikroinjektionssystem. Stellen Sie sicher, dass sich keine Luftblasen im Mineralöl in der Glasnadel befinden.
HINWEIS: Das Mineralöl wird gemäß den Anweisungen des Herstellers des von uns verwendeten Einspritzsystems hinzugefügt. - Entleeren Sie die gezogene Glaskapillarnadel so weit, wie es das Mikroinjektionssystem zulässt, und füllen Sie die Glasnadel teilweise mit Luft nach.
HINWEIS: Das kleine bisschen Luft verhindert die Mischung des Mineralöls und der zu injizierenden Lösung. - 10 μL der gewünschten Lösung, in diesem Protokoll Mikrobläschen, auf ein Stück Wachsfolie geben (Abbildung 3B). Wenn mehr als eine Lösung benötigt wird, können Lösungen vor dem Pipettieren gemischt werden7.
HINWEIS: Bevor Sie die Nadel mit Mikrobläschen füllen, lassen Sie den Mikroblasentropfen für ~ 1 min auf dem wachsartigen Film, damit die Mikrobläschen an die Spitze des Tropfens schwimmen und konzentriert werden. Für das speziell angefertigte Ultraschallkontrastmittel28 vom Typ F erhöht dieser Konzentrationsschritt die zu injizierende Mikroblasenkonzentration um ~ 30%. Die Konzentration nach der Injektion im Blut des Hühnerembryos liegt zwischen 32 x 10 3 Mikrobläschen/μL für 5 Tage alte Embryonen und 19 x 103 Mikrobläschen/μL für 6 Tage alte Embryonen. - Füllen Sie die Glasnadel mit der Mikroblase und/oder einer anderen Lösung, indem Sie die Glasnadelspitze in den Tropfen auf dem Wachsfilm positionieren. Stellen Sie beim Ansaugen von Mikrobläschen sicher, dass Sie die Nadelspitze oben im Flüssigkeitstropfen positionieren, um die mit Mikrobläschen angereicherte Lösung abzusaugen.
HINWEIS: Bevor Sie Mikrobläschen injizieren, heben Sie die Spitze der Glasnadel auf ihren höchsten Punkt an und warten Sie ~ 2 Minuten. Dadurch wird sichergestellt, dass sich die Mikrobläschen in der Spitze der Glasnadel konzentrieren.
- Vorbereitung des Injektionsaufbaus
- Injektion in die CAM-Gefäße
- Betrachten Sie vor der Injektion das CAM unter einem Stereomikroskop und wählen Sie das beste Gefäß für die Injektion aus. Injizieren Sie immer in eine der Venen des Embryos. Dies sind die Gefäße, in denen sich der Blutfluss in Richtung des Embryos bewegt. Venen sind aufgrund des sauerstoffreichen Blutes heller als dieArterien 29. Darüber hinaus befinden sich Venen immer oben auf der Arterie, mit zwei Ausnahmen, nämlich den vorderen und hinteren Vitellinvenen (d. h. den weniger verzweigten Venen, die in Abbildung 6A,B mit Sternchen gekennzeichnet sind), die keine Arterie in ihrer Umgebung haben.
HINWEIS: Die Injektion in einen der Zweige begrenzt die Behinderung des Blutflusses während der Injektion. Gute Injektionsstellen wurden mit Pfeilspitzen in Abbildung 6A,B angezeigt. Es ist wichtig, in die Vene zu injizieren, da dadurch die injizierte Substanz in Richtung des Embryos fließt. Außerdem führt die Injektion in die Arterie zu einer massiven Blutung beim Entfernen der Glasnadel, die den Embryo tötet. - Positionieren Sie die Glasnadel und den Embryo so, dass sich die Glasnadelspitze und die ausgewählte Vene in der gleichen Fokusebene und in der gleichen Richtung befinden. Versuchen Sie, die Nadel so horizontal wie möglich parallel zur ausgewählten Vene zu positionieren. Die Nadelspitze sollte die Gefäßwand berühren.
HINWEIS: Wenn Sie die Glasnadel so horizontal wie möglich positionieren, ist die Wahrscheinlichkeit, dass das gesamte Gefäß durchbohrt wird, geringer. - Nach der Positionierung langsam vorrücken und mit der Glasnadel in die Gefäßwand eindringen. Während des Eindringens wird das CAM zunächst durch die Bewegung der Glasnadel weggedrückt. Schieben Sie die Glasnadel weiter, bis die Gefäßwand durchdrungen ist.
HINWEIS: Wenn das Gefäß versehentlich durchbohrt wird, ziehen Sie die Nadel langsam zurück, um wieder in das Lumen zu gelangen. Wenn Sie sich wieder im Lumen befinden, heben Sie die Nadel leicht an und bewegen Sie sich entlang des Gefäßes nach vorne, um die Nadel neu zu positionieren. - Ziehen Sie die Glasnadel nach dem Eindringen leicht zurück, um die Spitze im Gefäßlumen besser zu positionieren, und bewegen Sie die Glasnadel zur Seite, um zu überprüfen, ob sie nicht an der Gefäßwand befestigt ist. Injizieren Sie langsam eine kleine Menge der Lösung, um zu bestätigen, dass sich die Spitze im Gefäßlumen befindet (Abbildung 3C).
- Stellen Sie sicher, dass die injizierte Lösung dem Blutfluss folgt. Wenn dies nicht der Fall ist, bewegen Sie die Glasnadel leicht und injizieren Sie kleine Mengen, bis die Glasnadel richtig positioniert ist17.
- Wenn die gewünschte Menge injiziert wird, lassen Sie die Glasnadel für ~ 15 s im Gefäß, um eine massive Blutung zu verhindern. Bewegen Sie dann die Glasnadel ein wenig seitwärts, auf und ab und ein paar Mal hin und her, um ein sanftes Zurückziehen der Glasnadel zu ermöglichen.
HINWEIS: Einige Blutungen sind normal. Verwenden Sie für jede Injektion eine neue Glasnadel, da die Glasnadel leicht verstopft und vom Eiweiß abgestumpft wird.
- Betrachten Sie vor der Injektion das CAM unter einem Stereomikroskop und wählen Sie das beste Gefäß für die Injektion aus. Injizieren Sie immer in eine der Venen des Embryos. Dies sind die Gefäße, in denen sich der Blutfluss in Richtung des Embryos bewegt. Venen sind aufgrund des sauerstoffreichen Blutes heller als dieArterien 29. Darüber hinaus befinden sich Venen immer oben auf der Arterie, mit zwei Ausnahmen, nämlich den vorderen und hinteren Vitellinvenen (d. h. den weniger verzweigten Venen, die in Abbildung 6A,B mit Sternchen gekennzeichnet sind), die keine Arterie in ihrer Umgebung haben.
- Mikroskopische Bildgebung des Embryos und/oder der CAM-Gefäße
- Vorbereitungshalter mit akustischer Membran
- Nehmen wir eine Zellkulturkammer, bestehend aus einem quadratischen Kunststoffhalter mit zwei parallelen 50 μm dicken akustisch transparenten Polycarbonatmembranen26, im Folgenden als Halter mit akustischer Membran bezeichnet. Schließen Sie beide Anschlüsse mit einem Deckel.
- Verwenden Sie ein Skalpell, um eine der beiden Membranen aus dem Halter mit akustischer Membran zu entfernen.
HINWEIS: Um die Membran zu entfernen, schneiden Sie die Membran direkt neben der Klebelinie auf dem Kunststoff ab. Achten Sie darauf, nicht vom Rand abzurutschen, um Schäden an der anderen Membran zu vermeiden. - Bereiten Sie ~15 mL 2% Agarose in Demi-Wasserlösung durch Erhitzen auf 80-95 °C in einem kleinen Glasbecher vor. Kühlen Sie das Glasbecherglas mit der gelösten Agaroselösung unter einem fließenden Kaltwasserhahn.
HINWEIS: Wenn die Agarose zu heiß ist, schmilzt die akustische Membran, wodurch eine unebene Oberfläche entsteht. - Wenn die Lösung auf etwa 37 °C abgekühlt ist, gießen Sie die Lösung langsam mit einer akustischen Membran in den Halter, bis sie den gesamten Halter füllt. Neigen Sie den Halter leicht mit der akustischen Membran, damit sich die Agaroseschicht gleichmäßig im Kunststoffrahmen verteilt (Abbildung 4A). Stellen Sie sicher, dass die Agaroseschicht flach ist und lassen Sie die Agarose bei Raumtemperatur aushärten.
- Entfernen von Embryo und CAM aus dem Dottersack und Auflegen auf Halter mit akustischer Membran
- Nehmen Sie den Eiinhalt wie in Abschnitt 1.2, 1.3 oder 1.4 beschrieben aus dem Ei.
- Falls erforderlich, injizieren Sie dem CAM Mikrobläschen und/oder andere Lösungen, wie in Abschnitt 2.1.2 beschrieben.
- Füllen Sie eine 1 L Petrischale mit ~500 mL 37 °C PBS und legen Sie den Halter mit akustischer Membran mit Agarose auf den Boden der Schale. Stellen Sie sicher, dass die Agaroseschicht nach oben zeigt.
- Mit einer kleinen Schere schnell in die Membran des Dottersacks, auch Vitellus-Membran genannt, um das gesamte CAM herum zu schneiden, während sich der Eiinhalt im Wiegeboot befindet (Abbildung 4B). Halten Sie die Schere in der gleichen Position und drehen Sie das Wiegeboot, während Sie schneiden, um eine bessere Präzision und mehr Geschwindigkeit zu erzielen.
HINWEIS: Ab dem Moment, in dem der erste Schnitt gemacht wird, beginnt das Eigelb zu lecken. Dies verringert die Sichtbarkeit des Embryos und der CAM. Versuchen Sie, innerhalb von 6-7 Schnitten den ganzen Weg um das CAM herum zu schneiden. Dies sollte nicht viel länger als 20 s dauern. Die kleine Pinzette (Abbildung 1F) kann verwendet werden, um den Rand der Vitellinmembran zu halten und ein Schneiden in das CAM zu verhindern. - Verwenden Sie einen Esslöffel, um die ausgeschnittene Membran mit dem Embryo und CAM aus dem Wiegeboot zu schöpfen. Heben Sie den Löffel langsam vom Wiegeboot und prüfen Sie visuell, ob die ausgeschnittene Membran mit dem Embryo und der CAM noch an der restlichen Dottersackmembran befestigt ist. Wenn dies der Fall ist, verwenden Sie die Schere, um einen zusätzlichen Schnitt zu machen. Kippen Sie den Löffel während des Schöpfens leicht, um so viel Eigelb wie möglich loszuwerden, aber lassen Sie ihn nicht austrocknen. Die ausgeschnittene Membran mit Embryo und CAM in die 1-Liter-Petrischale geben, in die 37 °C PBS eintauchen und den Löffel entfernen.
- Wenn die Membran mit dem Embryo und der CAM in die 37 °C PBS eingetaucht ist, greifen Sie mit der kleinen Pinzette (Abbildung 1F) eine Kante der Membran und schwenken Sie vorsichtig um die Membran herum, um das noch anhaftende Eigelb loszuwerden.
- Wenn das gesamte Eigelb entfernt ist, bewegen Sie mit der kleinen Pinzette die Membran mit dem Embryo und der CAM und positionieren Sie sie über dem Halter mit akustischer Membran.
- Verwenden Sie einen Insektenprobenstift, um die Membran mit dem Embryo und der CAM in einer Ecke zu fixieren. Vermeiden Sie es, die Gefäße im CAM zu durchstechen und fixieren Sie nur die Membran.
- Verwenden Sie einen zweiten Insektenprobenstift, um die Membran mit dem Embryo und der CAM an der diagonal gegenüberliegenden Ecke zu befestigen.
- Heben Sie den Halter mit der akustischen Membran, die den Embryo und das CAM enthält, langsam von der 37 °C PBS an. Neigen Sie den Halter leicht, um den größten Teil des PBS loszuwerden.
- Verwenden Sie die kleine Pinzette (Abbildung 1F), um die Membran mit Embryo und CAM gleichmäßig über den Halter mit akustischer Membran zu dehnen und gleichmäßig zu verteilen und den Rest der Membran festzuhalten. Stellen Sie sicher, dass die Membran, die den Embryo und die CAM enthält, leicht gedehnt ist, um sicherzustellen, dass sie flach ist (Abbildung 4C).
- Legen Sie den Halter mit akustischer Membran mit der festgenagelten Membran, die den Embryo und das CAM enthält, in einen Mikroskopieaufbau, der bei 37 °C gehalten wird.
- Legen Sie ein Deckglas oder eine akustisch und optisch transparente Membran (abhängig vom gewünschten Objektiv und der Verwendung von Ultraschall oder nicht) auf die Region von Interesse auf dem Embryo oder CAM (Abbildung 4D), um eine optische Visualisierung zu ermöglichen.
- Vorbereitungshalter mit akustischer Membran
- Ultraschallbildgebung des Hühnerembryos und/oder der CAM-Gefäße
- Ultraschallbildgebung von der Seite des Hühnerembryos und der CAM-Gefäße
- Nehmen Sie den Eiinhalt wie in Abschnitt 1.2, 1.3 oder 1.4 beschrieben heraus. Verwenden Sie jedoch kein Standard-Wiegeboot. Verwenden Sie stattdessen ein maßgeschneidertes Wiegeboot mit einer akustisch transparenten Wand.
HINWEIS: Das Standard-Wiegeboot wurde eingestellt, indem eine Seite des Wiegebootes abgeschnitten und durch ein Fenster aus Polyesterfolie ersetzt wurde, das mit Epoxidkleber zusammengeklebt wurde. - Tauchen Sie den bevorzugten Ultraschallwandler in ein 37 °C warmes Wasserbad und positionieren Sie ihn an der gewünschten Stelle mit dem erforderlichen Abstandsabstand.
- Stellen Sie das Wiegeboot so in das Wasserbad, dass die transparente Wand dem Schallkopf zugewandt ist. Stellen Sie sicher, dass das Wägeboot tief genug ist, um sich auf Höhe des Messwandlers zu befinden, und vermeiden Sie jedoch, dass Wasser in das Wägeboot gelangt (Abbildung 5A).
- Falls gewünscht, fügen Sie eine weitere Anordnung an der Oberseite des Embryos oder der CAM-Gefäße hinzu, z. B. ein Mikroskop oder einen Laser (Abbildung 5A).
- Nehmen Sie den Eiinhalt wie in Abschnitt 1.2, 1.3 oder 1.4 beschrieben heraus. Verwenden Sie jedoch kein Standard-Wiegeboot. Verwenden Sie stattdessen ein maßgeschneidertes Wiegeboot mit einer akustisch transparenten Wand.
- Ultraschallbildgebung von der Oberseite des Embryos und der CAM-Gefäße ohne akustische Störungen
- Füllen Sie ein 2 L Becherglas mit 37 °C PBS. Stellen Sie ein 500-ml-Becherglas kopfüber auf den Boden des 2-Liter-Becherglases. Vermeiden Sie Luft im 500-ml-Becherglas.
HINWEIS: Das 500-ml-Becherglas soll das Wiegeboot mit dem Eiinhalt näher an die PBS-Oberfläche bringen. Durch das Ersetzen des Becherglases durch Objekte mit anderen Größen kann der Abstand zwischen dem Schallkopf und dem Eiinhalt variiert werden. - Stellen Sie das gefüllte 2 L Becherglas mit dem 500 mL Becherglas innen in ein 37 °C warmes Wasserbad.
- Nehmen Sie den Eiinhalt wie in Abschnitt 1.2, 1.3 oder 1.4 beschrieben heraus.
- Befeuchten Sie den Eiinhalt mit 37 °C PBS und bedecken Sie den Embryo mit klarem Frischhaltefilm. Dies kann getan werden, um den Embryo in der gleichen Position zu halten und zu verhindern, dass er sich dreht oder wegschwimmt.
HINWEIS: Durch das Benetzen des Eiinhalts mit PBS wird es weniger klebrig, was es einfacher macht, den Eiinhalt mit klarer Frischhaltefolie abzudecken. - Legen Sie das Wiegeboot mit dem Eiinhalt in eine Petrischale mit einem Durchmesser von 90 mm und tauchen Sie die Petrischale langsam in die PBS (Abbildung 5B).
HINWEIS: Die Verwendung von zwei Klemmen an den gegenüberliegenden Seiten der Petrischale erleichtert das Eintauchen der Petrischale. - Positionieren Sie den Ultraschallwandler mit dem gewünschten Abstandsabstand.
- Füllen Sie ein 2 L Becherglas mit 37 °C PBS. Stellen Sie ein 500-ml-Becherglas kopfüber auf den Boden des 2-Liter-Becherglases. Vermeiden Sie Luft im 500-ml-Becherglas.
- Ultraschallbildgebung des Hühnerembryos und der CAM-Gefäße mit einem beweglichen Schallkopf
- Nehmen Sie den Eiinhalt wie in Abschnitt 1.2, 1.3 oder 1.4 beschrieben heraus.
- Bereiten Sie eine 2%ige Agaroselösung in Demi-Wasser vor, indem die Lösung in einem kleinen Glasbecher auf 80-95 °C erhitzt wird. Kühlen Sie das Glasbecherglas mit der gelösten Agaroselösung unter einem fließenden Kaltwassertab.
- Gießen Sie die Agaroselösung in einen flachen Behälter, um ein etwa 1 mm dickes Agarosettenkissen zu erhalten. Wenn es vollständig abgekühlt und fest abgekühlt ist, schneiden Sie das Agarosenkissen mit einem Skalpell auf die gewünschte Größe.
HINWEIS: Die Dicke des Agarosepads kann geändert werden, um die gewünschte Brennweite zu erhalten, die für die korrekte Funktion des Ultraschallwandlers erforderlich ist. - Legen Sie das Agarosepolster auf den Embryo und die CAM (Abbildung 5C). Fügen Sie ein paar Tropfen ~ 30 μL 37 ° C PBS auf die Oberseite des Agarosageads hinzu, um eine dünne PBS-Schicht zwischen dem Agarosepad und dem Wandler zu erzeugen.
HINWEIS: Die Verwendung von PBS verhindert, dass der Schallkopf am Agarosepad klebt. Dies ist beispielsweise von Vorteil, wenn ein Motor verwendet wird, um einen zweidimensionalen Wandler mechanisch zu bewegen, um einen dreidimensionalen Scan durchzuführen (Abbildung 9B)11. Wenn der Schallkopf nicht bewegt werden muss, kann das PBS auch durch Ultraschallgel ersetzt werden. - Positionieren Sie den gewünschten Ultraschallwandler.
- Ultraschallbildgebung von der Seite des Hühnerembryos und der CAM-Gefäße
Ergebnisse
In diesem Protokoll beschreiben wir drei Methoden, um den Eiinhalt am Tag 5-8 der Inkubation aus der Schale zu entnehmen (HH 26-3522). Abbildung 6 zeigt den Eigehalt in Wiegebooten nach der Entnahme aus der Schale. Der 5 Tage alte Embryo und die CAM (Abbildung 6A) wurden mit der in Abschnitt 1.2 beschriebenen Methode entnommen. Die 6 und 7 Tage alten Embryonen und CAM (Abbildung 6B,C) wurden mit der in Abschnitt 1.3 beschriebenen Methode entnommen. Der 8 Tage alte Embryo und die CAM (Abbildung 6D) wurden mit der in Abschnitt 1.4 beschriebenen Methode entnommen. Es können keine Blutungen oder Schäden am Embryo oder CAM beobachtet werden, was darauf hindeutet, dass diese Methoden verwendet werden können, um den Eiinhalt sicher aus der Schale zu bekommen, ohne den Embryo oder die CAM-Gefäße zu schädigen. Bei korrekter Ausführung liefert die Methode für die 5 Tage alten Embryonen in 90% aller Verfahren einen lebensfähigen Embryo und intakte CAM. Die Lebensfähigkeitsrate basiert auf der Gesamtzahl der befruchteten Eier, die erfolgreich aus der Eierschale extrahiert wurden. Mit der zweiten Methode, für 6 und 7 Tage inkubierte Eizellen, liegt die Chance auf einen lebensfähigen Embryo und intakte CAM bei etwa 75% für 6 Tage alte und etwa 50% für 7 Tage alte. Mit der dritten beschriebenen Methode für 8 Tage alte Embryonen liegt die Chance auf einen lebensfähigen Embryo und eine intakte CAM bei etwa 60%. Unterschiede in den Entwicklungsstadien zwischen den 5 und 8 Tage alten Embryonen können beobachtet werden, was mit Hamburger und Hamilton22 übereinstimmt. Sowohl die Größe des Embryos als auch die Komplexität der CAM-Gefäße nehmen während der Entwicklung zu (Abbildung 6A-D). Abbildung 6C zeigt einen dünnen Agarosefleck auf dem Eiinhalt, der es ermöglicht, den Embryo und die CAM mit dem in Abbildung 5C gezeigten Ultraschallaufbau abzubilden. Nachdem der Eiinhalt aus der Schale entnommen wurde, ist der Herzschlag des Embryos mit bloßem Auge sichtbar. Die Herzfrequenz dieser Ex-Ovo-Embryonen ist ähnlich wie bei Ovo-Embryonen bei 183 Schlägen pro Minute (bpm) am Tag 5 bis zu ~208 bpm am Tag 830. Bei Befeuchtung und bei 37 °C hält der Embryo diese Herzfrequenz für ~5 h in den experimentellen Ultraschallaufbauten aufrecht.
Mehrere Komplikationen können während der zuvor beschriebenen drei Methoden auftreten. Abbildung 7A zeigt eingeschlossene Luft unter dem CAM, die den Embryo für die Ultraschallbildgebung ungeeignet macht und der Druck der Luftblase(n) auch den Embryo und/oder die CAM schädigen kann. Dieses Problem tritt auf, wenn der Luftsack in der Schale beim Herausnehmen des Eiinhalts aus der Schale keinen Kontakt mit der Luft außerhalb der Schale hat. Abbildung 7B zeigt eine kleine Austrittsrate von Eigelb aus dem Dottersack oben rechts im Bild. Dies kann beim Herausnehmen des Eiinhalts aus der Schale auftreten, wenn der Dottersack durch scharfe Kanten der Schale beschädigt wird oder wenn der Dottersack von der Pinzette durchdrungen wird. Ein Auslaufen des Eigelbs kann die Sichtbarkeit des Embryos und der CAM-Gefäße beeinträchtigen. Abbildung 7C zeigt einen Embryo, in dem eine Luftblase unter dem CAM eingeschlossen ist. Dies geschieht manchmal in der Embryonalentwicklung. Eine weitere Komplikation, die auftreten kann, ist eine Schädigung der Gefäße. Dieser Schaden kann entstehen, wenn der Eiinhalt aus der Schale entnommen oder eine Injektion durchgeführt wird (Abbildung 7D). Außerdem können der Embryo und die Gefäße mit der Zeit austrocknen (Abbildung 7E). Dies tritt auf, wenn der Eiinhalt nicht mit PBS bestreut wird. Das Austrocknen des Embryos kann zu massiven Kapillarobstruktionen führen (Abbildung 7F), die die Lebensfähigkeit des Embryos beeinträchtigen. Die massiven Kapillarobstruktionen können auch während der Entwicklung auftreten oder wenn der Herzschlag des Embryos nicht stabil ist.
Nachdem der Eiinhalt komplikationslos aus der Schale entnommen wurde, kann dem Embryo beispielsweise Ultraschallkontrastmittel wie Mikrobläschen injiziert werden (Abbildung 3C). Abbildung 8 zeigt zirkulierende Mikrobläschen im Lumen des Blutgefäßes bei der Injektion. Diese Mikrobläschen werden mit dem Blutfluss mitgeführt und bleiben mehrere Stunden im Blutkreislauf vorhanden (Supplemental Video 1). Das Vorhandensein dieser Mikrobläschen im Kreislauf schafft die Möglichkeit, verschiedene Arten von CEUS- und Arzneimittelabgabeexperimentendurchzuführen 7,11,12. Das CAM ist ideal, um neuartige Ultraschallkontrastdetektionsmethoden zu untersuchen, für die wir drei Beispiele zeigen. Abbildung 9A zeigt die subharmonische Hochfrequenz-Ultraschallbildgebung eines 6 Tage alten Hühnerembryos im B-Mode und CEUS vor und nach der Mikroblaseninjektion. Hier wurden den CAM-Gefäßen 5 μL Ultraschallkontrastmittel injiziert und die Bildgebung mit einem präklinischen Tierultraschallgerät mit einer MS250-Sonde (30 MHz Sende- und 15 MHz Empfangsfrequenz, 10% Leistung) durchgeführt. Vor der Mikroblaseninjektion ist der Kontrast bereits im Inneren des embryonalen Herzens in den B-Mode-Bildern zu sehen (Abbildung 9A-I). Dieses Phänomen ist auf das Vorhandensein eines Kerns in den roten Blutkörperchen der Vögel zurückzuführen, der den Kontrast des Blutes in der Ultraschallbildgebungerhöht 5,31. Die Zugabe der Mikrobläschen erhöhte den Kontrast und die Sichtbarkeit des Embryos, sowohl im B-Mode als auch in der CEUS-Bildgebung. Abbildung 9B zeigt ein optisches und ein hochfrequentes subharmonisches 3D-Bild eines 6 Tage alten Embryos und der umliegenden Gefäße. Das CAM wurde mit 5 μL Ultraschallkontrastmittel injiziert und die Bildgebung wurde mit einem präklinischen Tierultraschallgerät mit MS550s-Sonde (Sendefrequenz von 40 MHz, Spitzenunterdruck ~300 kPa) durchgeführt. Diese Ergebnisse zeigen, dass die CEUS-Bildgebung in Kombination mit einem Kontrastmittel auch verwendet werden kann, um hochfrequente subharmonische 3D-Bilder zu erstellen und die Blutgefäße außerhalb des Embryos abzubilden. Abbildung 9C zeigt ein optisches Bild und ein ultraharmonisches intravaskuläres Ultraschallbild (IVUS), das mit einer benutzerdefinierten Sonde von CAM-Mikrogefäßen eines 6 Tage alten Embryos (26 MHz Sende- und 39 und 65 MHz Empfangsfrequenz) erstellt wurde. CAM-Gefäße wurden mit 4 ± 1 μL Ultraschallkontrastmittel injiziert. Das optische Bild und das IVUS-Bild stammen aus demselben Embryo und derselben Region von Interesse und zeigen entsprechende Gefäßnetzwerke.
Der Hühnerembryo und die CAM-Gefäße können auch verwendet werden, um die ultraschallvermittelte Medikamentenabgabe zu untersuchen, für die wir ein Beispiel zeigen. Da das Eigelb während der Bildgebung den Lichtweg behindert, ist die Entfernung des Dottersacks notwendig, um die Wirkstoffabgabe in den Embryo- und CAM-Gefäßen optisch zu untersuchen. Für diese Studie wurden der Embryo und die CAM für die mikroskopische Bildgebung vorbereitet, wie in Abschnitt 2.2 erläutert, indem die Membran mit dem Embryo und der CAM vom Dottersack getrennt wurden (Abbildung 4C). In diesen Embryonen ist die Herzfrequenz stabil bei etwa 80 bpm und die Embryonen bleiben bis zu 2 h am Leben, wenn sie bei 37 °C7 gehalten werden. Abbildung 10 zeigt eine Ultraschall- und Mikroblasen-vermittelte Wirkstoffabgabestudie in Endothelzellen der CAM-Gefäße. Lipidbeschichtete Mikrobläschen, die mit αvβ 3-Antikörpern auf die Gefäßwand gerichtet und mit dem Fluoreszenzfarbstoff DiI7 angefärbt wurden, wurden in die CAM-Gefäße injiziert (Abbildung 10A,C). CAM-Gefäß-Endothelzellkerne wurden mit Hoechst 33342 angefärbt (Abbildung 10B) und das Modellmedikament Propidium Iodid (PI) wurde verwendet, um die Sonoporation7 sichtbar zu machen. Beide Farbstoffe wurden gleichzeitig mit den Mikrobläschen injiziert. Nach Ultraschallbehandlung (1 MHz, 200 kPa Spitzenunterdruck, Single Burst von 1000 Zyklen) wurde eine PI-Aufnahme in den Kernen beobachtet, die den Zielmikrobläschen am nächsten waren (Abbildung 10D). Dies zeigt, dass die ultraschallinduzierten Schwingungen der anvisierten Mikrobläschen in der Lage waren, eine Pore in der Endothelzellmembran zu erzeugen.
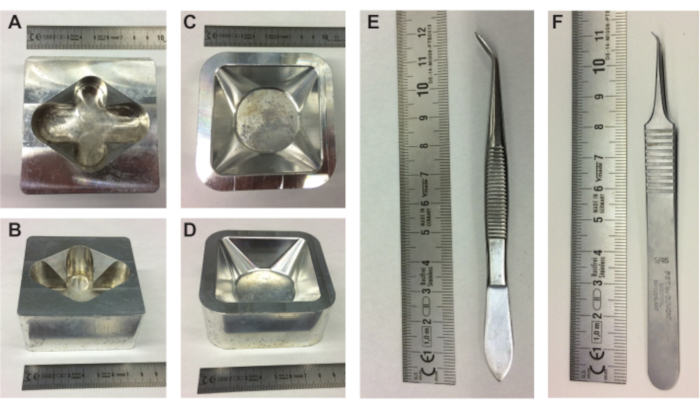
Abbildung 1. Ausrüstung zur Vorbereitung von Embryonen. (A-B) Ober- und Seitenansicht des Eierhalters aus Metall und (C-D) Drauf- und Seitenansicht des Metallwaagenboothalters. (E-F) Pinzette benötigt, um den Eiinhalt aus der Schale zu entnehmen. Skala in cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
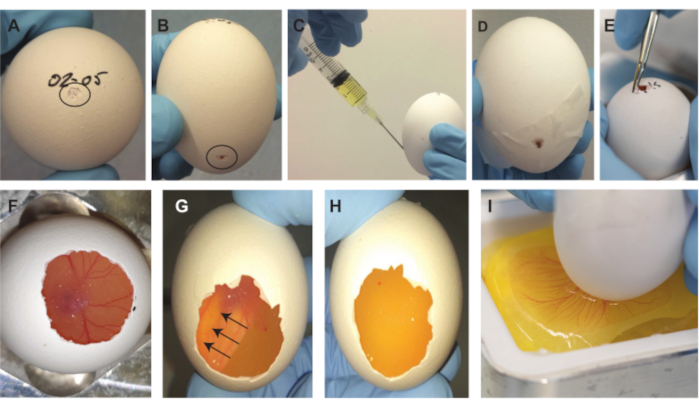
Abbildung 2. Verfahren zur Entfernung von Embryonen. (A) Kleine Vertiefung auf der Oberseite des Eies, gekennzeichnet durch den schwarzen Kreis. (B) Kleiner Spiegelstrich 2/3 unten am Ei, gekennzeichnet durch den schwarzen Kreis. (C) Entnahme von ~ 2 ml Eiweiß. (D) Geschlossener Spalt an der Seite mit Klebeband. (E) Vergrößern der kleinen Öffnung auf der Oberseite des Eies. (F) Der Embryo wird sichtbar, nachdem ein Teil der Schale entfernt wurde. (G-H) Nach dem Drehen der Eizelle um 180° schwimmt der Embryo nach oben und wird unsichtbar (Pfeile zeigen die Bewegungsrichtung des Embryos an). Nach 1-2 min ist der Embryo von unten unsichtbar. (I) Nach dem Zerkratzen der Membran fällt der Eiinhalt in das Wiegeboot. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
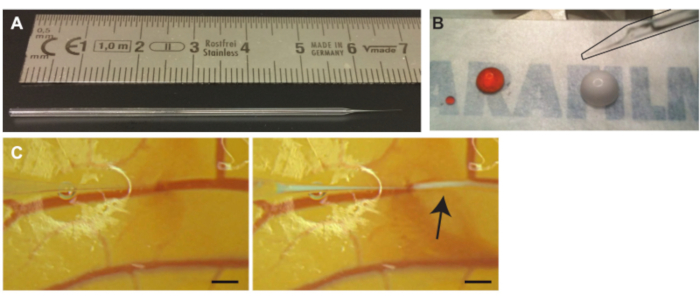
Abbildung 3. Injektion von Mikrobläschen in die CAM-Gefäße. (A) Kapillarnadel aus Glas. Skala in cm. (B) Propidiumiodid (PI) Lösung (linker Tropfen) und Mikrobläschen (rechter Tropfen ) vor der Aspiration vor der Injektion. Nadel (schwarz umrandet) ist in der oberen rechten Ecke zu sehen (C) Microbubble Injektion. Die Kapillarnadelspitze befindet sich im Lumen einer der Venen (links). Mikrobläschen, die weiße Wolke, die mit einem Pfeil gekennzeichnet ist, werden injiziert und verteilen sich entlang des Blutkreislaufs (rechts). Der Maßstabsbalken stellt 1 mm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
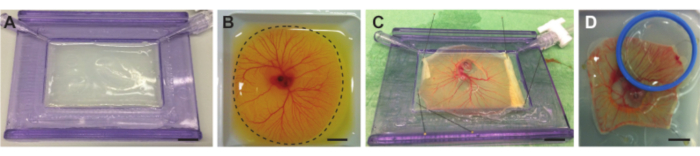
Abbildung 4. Embryo und CAM aus dem Dottersack entnehmen und auf Halter mit akustischer Membran legen. (A) Halter mit akustischer Membran, gefüllt mit Agaroseschicht. (B) Hühnerembryo und CAM-Gefäß vor dem Schneiden im Wiegeboot. Die gepunktete Linie zeigt die Schnittlinie um das CAM an. (C) Hühnerembryo und CAM vom Eigelb getrennt und auf die akustische Membran fixiert. (D) Festgesteckter Hühnerembryo mit einer akustisch und optisch transparenten Membran in einem Halter (blau), der auf dem CAM angebracht ist. Der Halter kann mit Demi-Wasser gefüllt werden, so dass ein Wassertauchobjektiv verwendet werden kann. Alle Maßstabsbalken stellen 1 cm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5. Verschiedene Setups für Hühnerembryonen und CAM-Ultraschallbildgebung. (A) Einrichtung für die Ultraschallbildgebung von der Seite. Der Hühnerembryo wurde in ein speziell angepasstes Wiegeboot mit einer akustisch transparenten Wand gelegt und in ein 37 °C warmes Wasserbad gelegt. Der Ultraschallwandler wurde auf der linken (a) Seite neben der akustisch transparenten Wand und der Laser (b) für die photoakustische Bildgebung oben positioniert. (B) Einrichtung für Ultraschallbildgebung von oben. Embryo und CAM wurden in ein Becherglas aus PBS getaucht, das in ein 37 °C warmes Wasserbad gegeben wurde. Der gestrichelte Umriss zeigt den 2-L-Glasbecher (a) mit dem 500-ml-Glasbecher (b) im Inneren. (C) Einrichtung für Ultraschallbildgebung von oben mit einem beweglichen Schallkopf. Ein dünnes Agarosepolster (gepunktete Linie) wurde auf den Embryo mit einer dünnen PBS-Schicht als Kopplung zwischen dem Schallkopf und der Agaroseoberfläche gelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
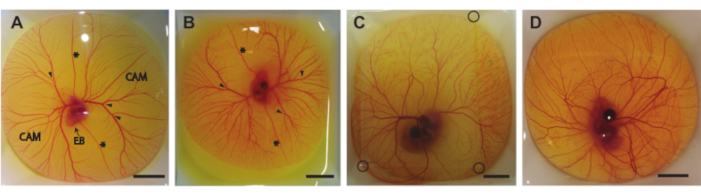
Abbildung 6. Eiinhalt außerhalb der Schale. (A) Eigehalt, der nach 5 Tagen Inkubation aus der Schale entnommen wird. Die Chorioallantousmembran (CAM), der Embryonenkörper (EB), die vorderen und hinteren Vitellinvene (*) und geeignete Injektionsstellen (Pfeilspitzen) sind indiziert. (B) Eigehalt, der nach 6 Tagen Inkubation aus der Schale entnommen wird. Die vorderen und hinteren Vitellinvenen (*) und geeignete Injektionsstellen (Pfeilspitzen) sind angegeben. (C) Eigehalt, der nach 7 Tagen Inkubation aus der Schale entnommen wird. Ein Pflaster Agarose wird darauf gelegt, um Ultraschallbilder zu ermöglichen. Die Ecken des Agarosenflecks sind mit schwarzen Kreisen gekennzeichnet. (D) Eigehalt, der nach 8 Tagen Inkubation aus der Schale entnommen wird. Alle Maßstabsbalken stellen 1 cm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
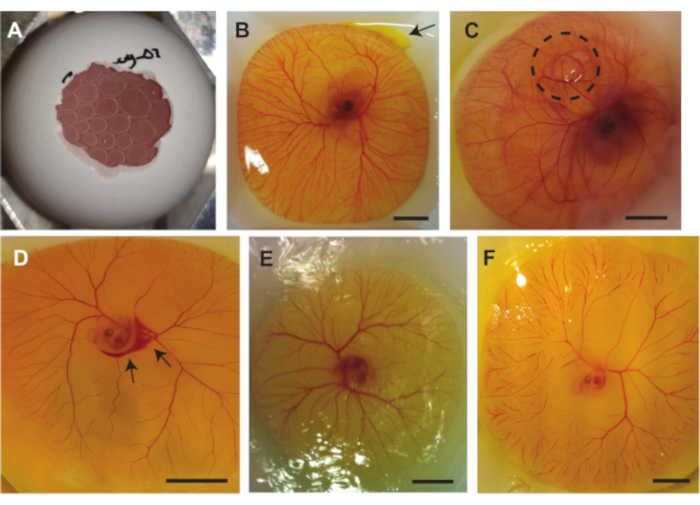
Abbildung 7. Komplikationen, die während der Eingriffe mit dem Hühnerembryo und dem CAM-Modell auftreten können. (A ) Luftblasen, die unter dem CAM eingeschlossen werden, wenn der Eiinhalt nach Methode 1.2 (5 Tage alter Embryo) oder 1.3 (6 bis 7 Tage alter Embryo) aus der Schale entnommen wird. (B) Kleines Austreten von Eigelb, angezeigt mit einem Pfeil oben rechts (6 Tage alter Embryo). (C) Luft, die unter dem CAM eingeschlossen ist, angezeigt durch den schwarz gepunkteten Kreis (7 Tage alter Embryo). (D) Blutung, angezeigt mit den schwarzen Pfeilen (5 Tage alter Embryo. (E) Ausgetrockneter Embryo und CAM (5 Tage alter Embryo). (F) Massive Kapillarobstruktionen (5 Tage alter Embryo). Alle Maßstabsbalken stellen 1 cm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
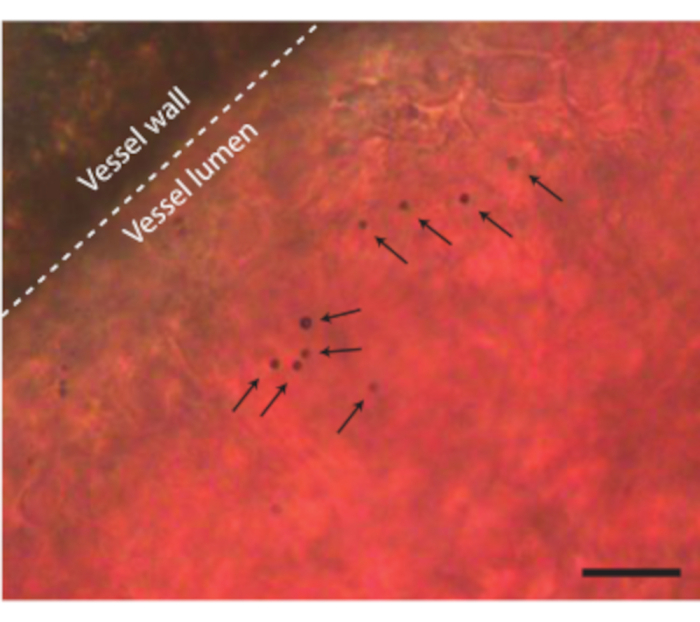
Abbildung 8. Mikrobläschen in CAM-Blutgefäßen. Die Gefäßwand ist mit einer gestrichelten Linie und einzelne Mikrobläschen mit Pfeilen gekennzeichnet. Der Maßstabsbalken stellt 20 μm dar. Die entsprechende Mikroskopieaufzeichnung finden Sie in Supplemental Video 1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 9. Kontrastverstärkte Ultraschallbildgebung in Hühnerembryonen und CAM-Gefäßen. (A) Projektion maximaler Intensität von B-Mode (I, III) und subharmonischen (II, IV) Echtzeitbildern (präklinisches Tierultraschallgerät mit MS250-Sonde, 30 MHz Sende- und 15 MHz Empfangsfrequenz, 10% Leistung) eines 6 Tage alten Embryos mit einem Agarosefleck obendrauf. Die oberen Bilder (I, II) zeigen die Ergebnisse vor und unten (III, IV) nach der Injektion von 5 μL Ultraschallkontrastmittel. Der Maßstabsbalken stellt 1 mm dar. Dieses Bild wurde mit Genehmigung von Daeichin et al.2015 modifiziert 11(B) Optische (links) und subharmonische 3D-Bildgebung (rechts) eines 6 Tage alten Hühnerembryos mit einem Agarosefleck obendrauf. CAM-Gefäße wurden mit 5 μL Ultraschallkontrastmittel injiziert und die Bildgebung wurde mit einer Hochfrequenzsonde durchgeführt (präklinisches Tierultraschallgerät mit MS550s-Sonde, Übertragungsfrequenz von 40 MHz, Spitzenunterdruck ~300 kPa, gerendert im präklinischen Tierultraschallgerät 3-D-Modus). Der Maßstabsbalken stellt 5 mm dar. Dieses Bild wurde mit freundlicher Genehmigung von Daeichin et al. 201511 verändert. (C) Optisches Bild (links) und mittlere Intensitätsprojektion des ultraharmonischen intravaskulären Ultraschalls (IVUS) (rechts) der CAM-Mikrovaskulatur eines 6 Tage alten Embryos. CAM-Gefäße wurden mit 4 ± 1 μL Kontrastmittel injiziert. Die ultraharmonische IVUS-Bildgebung wurde mit einer kundenspezifischen IVUS-Sonde (Sendefrequenz 35 MHz, Spitzenunterdruck 600 kPa) durchgeführt. Beide Bilder stammen aus demselben Embryo und derselben Region von Interesse. Pfeile zeigen entsprechende Gefäße in den beiden Bildern an. Der Maßstabsbalken stellt 1 mm dar. Dieses Bild wurde mit freundlicher Genehmigung von Maresca et al. 201412 verändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
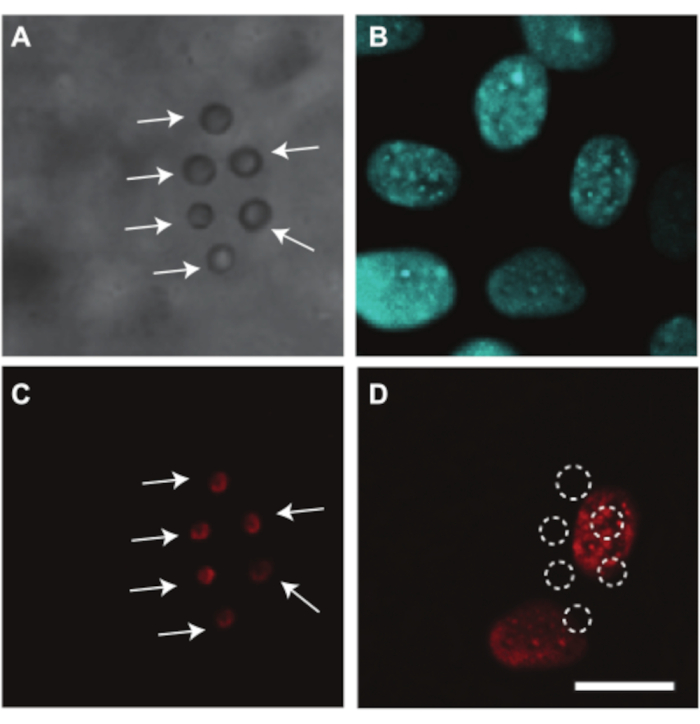
Abbildung 10. Medikamentenabgabe an CAM-Gefäßendothelzellen in 6 Tage alten Embryonen. (A) Hellfeldbild von sechs αvβ3-gezielten Mikrobläschen, gekennzeichnet mit weißen Pfeilen, die vor der Ultraschallbehandlung an der Gefäßwand haften. (B) Endothelzellkerne, die vor der Ultraschallbehandlung fluoreszierend gefärbt wurden. (C) Fluoreszierendes Bild der gefärbten Zielmikrobläschen, gekennzeichnet mit weißen Pfeilen, vor der Ultraschallbehandlung. (D) Aufnahme des Modellmedikaments Propidiumiodid (PI) in die Zellkerne unter den Zielmikrobläschen nach Ultraschallbehandlung (1 MHz, 200 kPa Spitzenunterdruck, Single Burst von 1000 Zyklen). Der Maßstabsbalken stellt 10 μm dar und gilt für alle Bilder. Dieses Bild wurde mit Genehmigung von Skachkov et al. 20147 verändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
ERGÄNZENDE DOSSIERS
Ergänzendes Video 1. Mikrobläschen in CAM-Blutgefäßen. Der Maßstabsbalken stellt 20 μm dar. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Dieses Protokoll beschreibt drei Methoden zur Gewinnung und Verwendung von 5 bis 8 Tage alten Hühnerembryonen und deren CAM als In-vivo-Modell, um kontrastverstärkte Ultraschallbildgebung und Mikroblasen-vermittelte Arzneimittelabgabe zu untersuchen. Die kritischsten Schritte für die Entnahme von 5 Tage alten (Abschnitt 1.2) und 6 bis 7 Tage alten (Abschnitt 1.3) Embryonen aus der Schale sind: 1) Machen Sie das kleine Loch in der Oberseite des Eies, um durch die gesamte Eierschale in den Luftsack zu gelangen, bevor Sie Eiweiß entnehmen; 2) Schaffen Sie glatte Kanten für die große Öffnung in der Schale. Für die Methode zur Entnahme von 8 Tage alten Embryonen aus der Schale (Abschnitt 1.4) sind die kritischsten Schritte: 1) Machen Sie eine ausreichende Anzahl von Vertiefungen, um einen schönen Riss entlang des Eies zu erzeugen; 2) Halten Sie das Ei in PBS eingetaucht. Um die Lebensfähigkeit des Embryos bei allen Methoden zu gewährleisten, ist es wichtig, die Eizelle und ihren Inhalt bei 37 °C zu halten. Vermeiden Sie außerdem die Injektion in eine CAM-Arterie. Es wird empfohlen, die Herzfrequenz des Embryos während der Studien visuell zu überwachen, um die Vitalität des Embryos zu gewährleisten. Um das genaue Entwicklungsstadium des Embryos zu bestätigen, kann die Indikation Hamburger & Hamilton22 verwendet werden.
Es ist wichtig, Schäden am Embryo, CAM und Dottersack zu vermeiden. Dieser Schaden kann die Lebensfähigkeit, den Blutfluss und die Sichtbarkeit des Embryos und der CAM beeinträchtigen. Zudem macht eine Beschädigung des Dottersacks und damit eine geringe Steifigkeit der Membran eine Injektion in die CAM-Gefäße unmöglich. Ein 5 Tage alter Embryo hat einen relativ kleinen Luftsack, so dass 2 ml Eiweiß entnommen werden müssen, um ein ausreichend großes Loch in die Schale machen zu können, durch das der Eiinhalt entfernt werden kann. Dadurch wird mehr Platz zwischen Eierschale und Embryo geschaffen. Nach der Entnahme des Eiweißes muss ein Stück Klebeband das Loch verschließen, in das die Nadel eingedrungen ist. Wenn immer noch Eiweiß ausläuft, tragen Sie ein weiteres Stück Klebeband an. Außerdem erzeugt das Aufbringen von Klebeband auf das seitliche Loch ein Vakuum im Inneren des Eies, das verhindert, dass der Eiinhalt aufgrund seines Eigengewichts herausfällt, wenn das große Loch in Schritt 1.2.2.8 erzeugt wird. Schäden am Embryo oder CAM können auch auftreten, wenn der Rand der Eierschale zu scharf war oder wenn der Eiinhalt zu streng in das Wiegeboot fallen gelassen wird, so dass die Eierschale sehr nahe am Wiegeboot gehalten werden sollte. Zwischen Tag 5 und 6 der Entwicklung beginnt das CAM mit der Befestigung an der Schalenmembran32. Diese Befestigung erhöht das Risiko, den Embryo und die CAM zu schädigen, wenn der Eiinhalt aus der Eierschale entnommen wird. Durch Öffnen des Eies nach der Injektion von PBS für ein 6 bis 7 Tage bebrütetes Ei oder in einem PBS-gefüllten Behälter, wie für ein 8-tägiges bebrütetes Ei beschrieben, wird das Risiko einer Beschädigung reduziert. In Bezug auf eine Injektion in eine CAM-Vene: Wenn die erste Injektion fehlschlägt, kann eine zweite Injektion weiter stromaufwärts in derselben Vene durchgeführt werden, wenn der Schaden geringfügig war, oder in einer anderen CAM-Vene. Die Trennung von Embryo und CAM vom Eigelb macht den Embryo und die CAM-Gefäße optisch transparent. Infolgedessen verliert der Embryo seine primäre Nährstoffquelle33. Dieser Verlust an Nährstoffen könnte eine Erklärung für die beobachtete niedrigere Herzfrequenz von 80 bpm im Vergleich zu ~190 für einen 6 Tage alten Embryo sein, der noch in Kontakt mit dem Dotter30 ist, und die reduzierte Überlebenszeit von 2 h nach diesem Trennungsvorgang. Ein weiterer Faktor, der eine Rolle bei der reduzierten Herzfrequenz und Überlebenszeit spielen kann, ist die Herausforderung, die eigelbgetrennten Embryo- und CAM-Gefäße bei 37 °C zu halten. Ein Mikroskoptischinkubator kann hilfreich sein. Darüber hinaus führt die Ablösung des CAM vom Eigelb wahrscheinlich zu mechanischen Veränderungen im Gewebe, da die Membranspannung geringer wird. Die niedrigere Membranspannung kann eine erhöhte innere Scherrate verursachen, was zu einer niedrigeren Herzfrequenz führt.
Der Ex-Ovo-Hühnerembryo und die CAM-Gefäße haben einige Einschränkungen als In-vivo-Modell, einschließlich nur Kurzzeitbeobachtungen, für kontrastverstärkte Ultraschallbildgebung und Mikroblasen-vermittelte Arzneimittelabgabestudien. Aufgrund des geringen Blutvolumens von 100±23 μL an Tag 5 und 171±23 μL an Tag 634 kann ein maximales Volumen von ~5 μL injiziert werden. In den späteren Entwicklungsstadien (Tag 7 und älter) nimmt die Gefäßsteifigkeit zu und die Dotterelastizität ab. Dies kann eine erfolgreiche Injektion in ältere Embryonen erschweren. Sobald die Mikrobläschen injiziert sind, zirkulieren sie stundenlang, da der Hühnerembryo in diesem Stadium kein voll entwickeltes Immunsystem hat35. Daher werden Mikrobläschen nicht innerhalb von ~6 min wie beim Menschen 36,37 beseitigt, was typische Ultraschall-molekulare Bildgebungsstudien mit einer Wartezeit von 5-10 Minuten für nicht gebundene gezielte Mikrobläschen38 nicht durchführbar macht. Um Mikrobläschen gezielt anzugreifen, müssen geeignete Liganden verwendet werden, die an aviäre Endothelzellen binden können, wie zuvor für den Angiogenesemarker αvβ3 7 beschrieben. Andere Aspekte, die für dieses Modell zu berücksichtigen sind, sind die erhöhte Schwierigkeit, die Embryo- und CAM-Gefäße vom Eigelb bei älteren Embryonen zu trennen (> 8 Tage) und der niedrigere Hämatokrit von ~ 20%39 im Vergleich zum Menschen. Letzteres kann Mikroblasenschwingungen beeinflussen, da bekannt ist, dass Mikroblasenschwingungen in einer viskoseren Umgebung gedämpft werden40. CAM-Arterien sind weniger sauerstoffreich als CAM-Venen41,42. Dieser Unterschied sollte berücksichtigt werden, wenn beispielsweise die photoakustische Bildgebung der Blutoxygenierung untersucht wird.
Die hier beschriebenen Methoden ermöglichen es, den Eiinhalt am Tag der Ultraschallbildgebung oder Arzneimittelabgabestudie, typischerweise am Tag 5 bis 8 der Inkubation, aus der Eierschale zu entnehmen. Dies unterscheidet sich von bestehenden Methoden, bei denen der Eiinhalt nach einer 3-tägigen Inkubation aus der Schale entnommen und als Ex-Ovo-Kultur 18,20,21 weiterentwickelt wird. Die Vorteile sind eine höhere Überlebensrate von 90% für 5-Tage, 75% für 6-Tage, 50% für 7-Tage und 60% für 8-Tage alte bebrütete Eizellen im Vergleich zu ~50% für 3 Tage alte Embryonen, die aus der Eierschale entnommen und weiter inkubiert werden ex ovo 1,18 die Vermeidung von Antibiotika während der Kultur 18, 20 und großer steriler Inkubator für die EX Ovo Kultur. Das Überleben der 6 bis 8 Tage alten Embryonen ist geringer, da sich das CAM an die Schale21 anheftet, wodurch die CAM-Membran bei der Extraktion anfälliger für Brüche ist. Die Trennung des Embryos mit dem CAM aus dem Eigelb wird ebenfalls beschrieben, wodurch der Embryo und CAM optisch transparent werden.
Durch die Platzierung des Eiinhalts in verschiedenen Setups können der Hühnerembryo und das CAM für eine Vielzahl von Ultraschallbildgebungsstudien wie IVUS, photoakustisch, ohne oder mit Ultraschallkontrastmitteln in 2D und 3D verwendet werden. Der Schwerpunkt kann auf der Entwicklung neuer Ultraschallpulsierungsverfahren oder der Erprobung neuartiger Schallköpfe liegen. Darüber hinaus kann das Modell auch verwendet werden, um neuartige Ultraschallkontrastmittel und ihr Verhalten in Blutgefäßen unter Strömung zu untersuchen. Da der Mechanismus der Mikroblasen-vermittelten Wirkstoffabgabe noch unbekannt ist43, kann die Verwendung des In-vivo-CAM-Modells bei der Aufklärung des Mechanismus helfen, indem das Mikroblasenverhalten in Bezug auf die zelluläre Antwort untersucht wird. Schließlich haben sich die CAM-Gefäße als geeignetes System zur Untersuchung der Xenograft-Tumortransplantation erwiesen44. Dies schafft die Möglichkeit, das CAM-Gefäß als Modell zu nutzen, um die Tumorbildgebung mittels Ultraschall zu untersuchen und den Blutfluss im Tumorinneren mittels CEUS zu untersuchen. Die Tumoren werden typischerweise auf die CAM-Gefäße von 8 oder 9 Tage alten Embryonen 1,14,45 gepfropft, für die der Embryo am Tag 3 der Inkubation aus der Eierschale entnommen und ex ovo weiterentwickelt wird. Die in diesem Protokoll beschriebenen Methoden könnten verwendet werden, um Embryonen in Ovo bis zum Tag der Tumortransplantation zu züchten.
Die Autoren vertrauen darauf, dass diese Arbeit für Forscher hilfreich sein wird, die Hühnerembryonen und ihre Chorioallantoinmembran (CAM) als In-vivo-Modell für Anwendungen von Kontrastmitteln und Flussstudien verwenden möchten.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde von der Angewandten und Ingenieurwissenschaften (TTW) (Vidi-Projekt 17543), Teil der NWO, unterstützt. Die Autoren danken Robert Beurskens, Luxi Wei und Reza Pakdaman Zangabad vom Department of Biomedical Engineering sowie Michiel Manten und Geert Springeling vom Department of Experimental Medical Instrumentation für die technische Unterstützung, alle vom Erasmus MC University Medical Center Rotterdam, Niederlande.
Materialien
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Clamp (Kocher clamp) | |||
| Cling film | |||
| Holder with acoustic membrane (CLINIcell 25 cm2) | MABIO, Tourcoing, France | CLINIcell25-50-T FER 00106 | |
| Demi water | |||
| Disposable plastic Pasteur pipets | VWR | 612-1747 | |
| Eggs | Drost Pluimveebedrijf Loenen BV, the Netherlands | Freshly fertilized | |
| Fridge 15 °C | |||
| Glass capillary needles | Drummond | 1-000-1000 | Inside diameter: 0.0413 inch |
| Heating plate 37 °C | |||
| Humidified incubator 37 °C | |||
| Insect specimen pins | |||
| Metal egg holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 A,B | ||
| Metal weighing boat holder | Custom made by Experimental Medical Instrumentation at Erasmus MC. See figure 1 C,D | ||
| Microinjection system | FUJIFILM VisualSonics | ||
| Mineral oil | Sigma-Aldrich | M8410-100ML | |
| Needle, 19 G | VWR (TERUMO) | 613-5392 | |
| Phosphate-bufferes saline (PBS), 1x | ThermoFisher | 10010023 | |
| Petri dish, 1 L | Glass | ||
| Petri dish, 90 mm diameter | VWR | 391-0559 | |
| Preclinical animal ultrasound machine (Vevo 2100) | FUJIFILM VisualSonics | ||
| Probe (MS250) | FUJIFILM VisualSonics | 30 MHz transmit and 15 MHz receive frequency | |
| Probe (MS550s) | FUJIFILM VisualSonics | transmission frequency of 40 MHz | |
| Scalpel | VWR (SWANN-MORTON) | 233-5363 | |
| Scissors, small | Fine Science Tools (FST) | 14558-09 | |
| Syringe, 5 mL | VWR (TERUMO) | 613-0973 | |
| Table spoon | |||
| Tape (Scotch Magic tape) | Scotch | ||
| Tissue paper | Tork | ||
| Tweezers large | VWR (USBECK Laborgeräte) | 232-0107 | See figure 1E |
| Tweezers small | DUMONT Medical, Switzerland | 0103-5/45 | See figure 1F |
| Ultrasound contrast agent (custum made F-type) | Produced as described by: Daeichin, V. et al. Microbubble Composition and Preparation for Imaging : In Vitro and In Vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555–567 (2017). | ||
| Ultrasound contrast agent (MicroMarker) | FUJIFILM VisualSonics, Inc. | ||
| Ultrasound contrast agent (Definity) | Lantheus medical imaging, United States | ||
| Ultrasound gel | Aquasonic | ||
| Waxi film (Parafilm) | Parafilm | ||
| Weighing boats (85 × 85 × 24 mm) | VWR | 611-0094 |
Referenzen
- Martowicz, A., Kern, J., Gunsilius, E., Untergasser, G. Establishment of a Human Multiple Myeloma Xenograft Model in the Chicken to Study Tumor Growth, Invasion and Angiogenesis. Journal of Visualized Experiments. (99), e1 (2015).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A Submerged Filter Paper Sandwich for Long-term Ex ovo Time-lapse Imaging of Early Chick Embryos. Journal of Visualized Experiments. (118), e1 (2016).
- Brauer, R., Chen, P. Influenza Virus Propagation in Embryonated Chicken Eggs. Journal of Visualized Experiments. (97), e1 (2015).
- Oosterbaan, A. M., Ursem, N. T. C., Struijk, P. C., Bosch, J. G., van der Steen, A. F. W., Steegers, E. A. P. Doppler flow velocity waveforms in the embryonic chicken heart at developmental stages corresponding to 5-8 weeks of human gestation. Ultrasound in Obstetrics and Gynecology. 33 (6), 638-644 (2009).
- McQuinn, T. C., Bratoeva, M., DeAlmeida, A., Remond, M., Thompson, R. P., Sedmera, D. High-Frequency Ultrasonographic Imaging of Avian Cardiovascular Development. Developmental Dynamics. 236 (12), 3503-3513 (2007).
- Stieger, S. M., Caskey, C. F., Adamson, R. H., Curry, F. E., Wisner, E. R., Ferrara, K. W. Enhancement of Vascular Permeability with Low-Frequency Contrast-enhanced Ultrasound in the Chorioallantoic Membrane Model. Radiology. 243 (1), 112-121 (2007).
- Skachkov, I., Luan, Y., van der Steen, A. F. W., De Jong, N., Kooiman, K. Targeted microbubble mediated sonoporation of endothelial cells in vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (10), 1661-1667 (2014).
- Vargas, A., Zeisser-Labouèbe, M., Lange, N., Gurny, R., Delie, F. The chick embryo and its chorioallantoic membrane (CAM) for the in vivo evaluation of drug delivery systems. Advanced Drug Delivery Reviews. 59 (11), 1162-1176 (2007).
- Rytelewski, M., Buensuceso, A., Leong, H. S., Deroo, B. J., Chambers, A. F., Koropatnick, J. Evaluating the Effectiveness of Cancer Drug Sensitization In Vitro and In vivo. Journal of Visualized Experiments. (96), e1 (2015).
- Schmitd, L. B., Liu, M., Scanlon, C. S., Banerjee, R., Silva, N. J. D. The Chick Chorioallantoic Membrane In vivo Model to Assess Perineural Invasion in Head and Neck Cancer. Journal of Visualized Experiments. (148), e1 (2019).
- Daeichin, V., Bosch, J. G., Needles, A., Foster, F. S., van der Steen, A., de Jong, N. Subharmonic, non-linear fundamental and ultraharmonic imaging of microbubble contrast at high frequencies. Ultrasound in Medicine and Biology. 41 (2), 486-497 (2015).
- Maresca, D., et al. Imaging microvasculature with contrast-enhanced ultraharmonic ultrasound. Ultrasound in Medicine and Biology. 40 (6), 1318-1328 (2014).
- Lindsey, B. D., et al. High Resolution Ultrasound Superharmonic Perfusion Imaging: In vivo Feasibility and Quantification of Dynamic Contrast-Enhanced Acoustic Angiography. Annals of Biomedical Engineering. 45 (4), 939-948 (2017).
- Paproski, R. J., Jovel, J., Wong, G. K. S., Lewis, J. D., Zemp, R. J. Enhanced detection of cancer biomarkers in blood-borne extracellular vesicles using nanodroplets and focused ultrasound. Cancer Research. 77 (1), 3-13 (2017).
- Huang, C., et al. Short Acquisition Time Super-Resolution Ultrasound Microvessel Imaging via Microbubble Separation. Scientific Reports. 10, 1-13 (2020).
- Lowerison, M. R., Huang, C., Kim, Y., Lucien, F., Chen, S., Song, P. In vivo Confocal Imaging of Fluorescently Labeled Microbubbles: Implications for Ultrasound Localization Microscopy. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 67 (9), 1811-1819 (2020).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo Characterization of Ultrasound Contrast Agents: Microbubble Spectroscopy in a Chicken Embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yalcin, H. C., Shekhar, A., Rane, A. A., Butcher, J. T. An ex-ovo Chicken Embryo Culture System Suitable for Imaging and Microsurgery Applications. Journal of Visualized Experiments. (44), e4 (2010).
- Kokhuis, T. J. A., et al. Intravital microscopy of localized stem cell delivery using microbubbles and acoustic radiation force. Biotechnology and Bioengineering. 112 (1), 220-227 (2015).
- Cloney, K., Franz-Odendaal, T. A. Optimized Ex-ovo Culturing of Chick Embryos to Advanced Stages of Development. Journal of Visualized Experiments. (95), e6 (2015).
- Dohle, D. S., et al. Chick ex ovo Culture and ex ovo CAM Assay: How it Really Works. Journal of Visualized Experiments. (33), e2 (2010).
- Hamburger, V., Hamilton, H. A Series Of Normal Stages In The Developent Of The Chick Embryo. Journal of Morphology. 88 (1), 231-272 (1951).
- Ribatti, D. A morphometric study of the expansion of the chick vasculosa in shell-less culture. Journal of Anatomy. 186, 639-644 (1995).
- Ribatti, D., Nico, B., Vacca, A., Roncali, L., Burri, P. H., Djonov, V. Chorioallantoic Membrane Capillary Bed: A Useful Target for Studying Angiogenesis and Anti-Angiogenesis In vivo. Anatomical Record. 324, 317-324 (2001).
- DeFouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the Microcirculation in the Chick Chorioallantoic Membrane during Normal Angiogenesis. Microvascular research. 38, 136-147 (1989).
- Beekers, I., van Rooij, T., van der Steen, A. F. W., de Jong, N., Verweij, M. D., Kooiman, K. Acoustic characterization of the CLINIcell for ultrasound contrast agent studies. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 66 (1), 244-246 (2019).
- Lang, E. R., Rha, C. Apparent shear viscosity of native egg white. Journal of Food Science and Technology. 17, 595-606 (1982).
- Daeichin, V., et al. Microbubble Composition and Preparation for Imaging: In Vitro and In vivo Evaluation. IEEE TRANSACTIONS ON ULTRASONICS. 64 (3), 555-567 (2017).
- Mcferrin, H. E., Olson, S. D., Gutschow, M. V., Semon, J. A., Sullivan, D. E., Prockop, D. J. Rapidly Self-Renewing Human Multipotent Marrow Stromal Cells (hMSC) Express Sialyl Lewis X and Actively Adhere to Arterial Endothelium in a Chick Embryo Model System. PLoS ONE. 9 (8), 1-11 (2014).
- Akiyama, R., Mitsubayashi, H., Tazawa, H., Burggren, W. W. Heart rate responses to altered ambient oxygen in early (days 3-9) chick embryos in the intact egg. Journal of Comparative Physiology - B Biochemical, Systemic, and Environmental Physiology. 169 (2), 85-92 (1999).
- Foster, F. S., Hossack, J., Adamson, S. L. Micro-ultrasound for preclinical imaging. Interface Focus. 1, 576-601 (2011).
- Gabrielli, M. G., Accili, D. The Chick Chorioallantoic Membrane: A Model of Molecular, Structural, and Functional Adaptation to Transepithelial Ion Transport and Barrier Function during Embryonic Development. Journal of Biomedicine and Biotechnology. , 1-12 (2010).
- van der Wagt, I., de Jong, I. C., Mitchell, M. A., Molenaar, R., van den Brand, H. A review on yolk sac utilization in poultry. Poultry Science. 99, 2162-2175 (2020).
- Kind, C. The development of the circulating blood volume of the chick embryo. Anatomy and Embryology. 147, 127-132 (1975).
- Ribatti, D. Chick Embryo Chorioallantoic Membrane as a Useful Tool to Study Angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Schneider, M. Characteristics of SonoVue(TM). Echocardiography. 16 (7), 743-746 (1999).
- Kitzman, D. W., Goldman, M. E., Gillam, L. D., Cohen, J. L., Aurigemma, G. P., Gottdiener, J. S. Efficacy and Safety of the Novel Ultrasound Contrast Agent Perflutren (Definity) in Patients With Suboptimal Baseline Left Ventricular Echocardiographic Images. American Journal of Cardiology. 86, 669-674 (2000).
- Kosareva, A., Abou-Elkacem, L., Chowdhury, S., Lindner, J. R., Kaufmann, B. A. Seeing the Invisible-Ultrasound Molecular Imaging. Ultrasound in Medicine and Biology. 46 (3), 479-497 (2020).
- Al-Roubaie, S., Jahnsen, E. D., Mohammed, M., Henderson-Toth, C., Jones, E. A. V. Rheology of embryonic avian blood. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2473-2481 (2011).
- Helfield, B., Chen, X., Qin, B., Villanueva, F. S. Individual lipid encapsulated microbubble radial oscillations: Effects of fluid viscosity. The Journal of the Acoustical Society of America. 139 (1), 204-214 (2016).
- Metcalfe, J., Stock, M. K. Oxygen exchange in the chorioallantoic membrane, avian homologue of the mammalian placenta. Placenta. 14, 605-613 (1993).
- Tazawa, H. Oxygen and CO2 exchange and acid-base regulation in the avian embryo. American Journal of Zoology. 20, 395-404 (1980).
- Kooiman, K., et al. Ultrasound-Responsive Cavitation Nuclei for Therapy and Drug Delivery. Ultrasound in Medicine and Biology. 46 (6), 1296-1325 (2020).
- Li, M., Pathak, R. R., Lopez-rivera, E., Friedman, S. L., Aguirre-ghiso, J. A., Sikora, A. G. The In ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of Visualized Experiments. (104), e1 (2015).
- Sys, G. M. L., et al. The In ovo CAM-assay as a Xenograft Model for Sarcoma. Journal of Visualized Experiments. (77), e1 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten