Method Article
סינון מקטעים מבוסס NMR במדגם מינימלי אך במצב אוטומציה מקסימלי
In This Article
Summary
סינון מבוסס מקטעים על ידי NMR הוא שיטה חזקה לזיהוי מהיר של קושרי מולקולות קטנות לביומקרומולקולות (DNA, RNA או חלבונים). מוצגים פרוטוקולים המתארים הכנת דגימות מבוססת אוטומציה, ניסויי NMR ותנאי רכישה ותהליכי עבודה של ניתוח. הטכניקה מאפשרת ניצול אופטימלי של גרעינים פעילים של 1H ו-19F NMR לצורך גילוי.
Abstract
סינון מבוסס פרגמנטים (FBS) הוא מושג מאומת ומקובל בתהליך גילוי התרופות הן באקדמיה והן בתעשייה. היתרון הגדול ביותר של סינון מקטעים מבוסס NMR הוא היכולת שלו לא רק לזהות קלסרים מעל 7-8 סדרי גודל של אהדה, אלא גם לפקח על טוהר ואיכות כימית של השברים ובכך לייצר להיטים באיכות גבוהה ומינימום תוצאות חיוביות שגויות או שליליות כוזבות. תנאי מוקדם בתוך FBS הוא לבצע בקרת איכות ראשונית ותקופתית של ספריית המקטעים, קביעת מסיסות ושלמות כימית של המקטעים במאגרים רלוונטיים, והקמת ספריות מרובות כדי לכסות פיגומים מגוונים כדי להתאים למחלקות מטרה מקרומולקולות שונות (חלבונים/RNA/DNA). יתר על כן, נדרשת אופטימיזציה נרחבת של פרוטוקול סינון מבוסס NMR ביחס לכמויות הדגימה, מהירות הרכישה והניתוח ברמת המבנה הביולוגי / מרחב מקטעים, במרחב התנאים (חיץ, תוספים, יונים, pH וטמפרטורה) ובמרחב ליגנד (אנלוגים של ליגנדים, ריכוז ליגנד). לפחות באקדמיה, מאמצי סינון אלה נעשו עד כה באופן ידני באופן מוגבל מאוד, מה שהוביל לזמינות מוגבלת של תשתיות סינון לא רק בתהליך פיתוח התרופות אלא גם בהקשר של פיתוח בדיקות כימיות. על מנת לעמוד בדרישות מבחינה כלכלית, מוצגים תהליכי עבודה מתקדמים. הם מנצלים את החומרה המתקדמת העדכנית ביותר, שבעזרתה ניתן למלא את אוסף הדגימות הנוזליות בצורה מבוקרת טמפרטורה לתוך צינורות NMR באופן אוטומטי. 1ספקטרום מבוסס ליגנד H/19F NMR נאסף לאחר מכן בטמפרטורה נתונה. מחליף דגימות בתפוקה גבוהה (מחליף דגימות HT) יכול לטפל ביותר מ-500 דגימות בבלוקים מבוקרי טמפרטורה. זה יחד עם כלי תוכנה מתקדמים מאיץ את איסוף הנתונים וניתוחם. יתר על כן, יישום של שגרות סינון על דגימות חלבון ורנ"א מתוארים כדי להיות מודעים לפרוטוקולים שנקבעו עבור בסיס משתמשים רחב במחקר ביומקרומולקולרי.
Introduction
סינון מבוסס מקטעים הוא כיום שיטה נפוצה לזיהוי מולקולות פשוטות למדי ובעלות משקל מולקולרי נמוך (MW <250 Da) המראות קשירה חלשה למטרות מקרומולקולריות כולל חלבונים, DNA ו- RNA. פגיעות ראשוניות ממסכים ראשוניים משמשות כבסיס לביצוע מסך משני של אנלוגים גדולים יותר הזמינים מסחרית של הלהיטים, ולאחר מכן לשימוש באסטרטגיות גידול או קישור מקטעים מבוססות כימיה. עבור פלטפורמה מוצלחת לגילוי תרופות מבוססות פרגמנטים (FBDD), באופן כללי, נדרשת שיטה ביופיזיקלית חזקה לאיתור ואפיון פגיעות חלשות, ספריית מקטעים, מטרה ביומולקולרית ואסטרטגיה לכימיית המשך. ארבע שיטות ביופיזיקליות נפוצות המיושמות בקמפיינים לגילוי תרופות הן בדיקות שינוי תרמי, תהודה פלסמונית פני השטח (SPR), קריסטלוגרפיה וספקטרוסקופיית תהודה מגנטית גרעינית (NMR).
ספקטרוסקופיית NMR הציגה תפקידים מגוונים בשלבים השונים של FBDD. מלבד הבטחת הטוהר הכימי והמסיסות של המקטעים בספריית מקטעים המומסת במערכת חיץ אופטימלית, ניסויי NMR שנצפו על ידי ליגנד יכולים לזהות קשירת מקטעים למטרה עם זיקה נמוכה וניסויי NMR שנצפו במטרה יכולים לשרטט את אפיטופ הקישור של המקטע, ובכך לאפשר מחקרי יחסי מבנה-פעילות מפורטים. במסגרת מיפוי אפיטופים, שינויי הזזה כימיים מבוססי NMR אינם יכולים לזהות רק את אתרי הקישור האורתוסטריים, אלא גם אתרים אלוסטריים שעשויים להיות מוצפנים ונגישים רק במה שמכונה מצבי קונפורמציה מעוררים של המטרה הביומולקולרית. אם המטרה הביומולקולרית כבר קושרת ליגנד אנדוגני, ניתן לסווג בקלות את פגיעות המקטע שזוהו כאלוסטריות או אורתוסטריות על ידי ביצוע ניסויי תחרות מבוססי NMR. קביעת קבוע הדיסוציאציה (KD) של אינטראקציית ליגנד-מטרה היא היבט חשוב בתהליך FBDD. ניתן לבצע בקלות טיטרציות הזזה כימיות מבוססות NMR, ליגנד או מטרה שנצפו כדי לקבוע את KD. יתרון מרכזי של NMR הוא שמחקרי האינטראקציה מבוצעים בתמיסה ובסמוך לתנאים פיזיולוגיים. לפיכך, ניתן לבחון את כל מצבי הקונפורמציה לניתוח אינטראקציית ליגנד/פרגמנט עם מטרתו. יתר על כן, גישות מבוססות NMR אינן מוגבלות רק לסינון של חלבונים מסיסים מקופלים היטב, אלא גם מיושמות כדי להתאים למרחב מטרה גדול יותר, כולל DNA, RNA, חלבונים הקשורים לממברנה וחלבונים בעלי הפרעה פנימית1.
ספריות פרגמנטים הן חלק חיוני בתהליך FBDD. באופן כללי, מקטעים פועלים כמבשרים ראשוניים אשר בסופו של דבר הופכים לחלק (תת-מבנה) של המעכב החדש שפותח עבור מטרה ביולוגית. מספר תרופות (Venetoclax2, Vemurafenib3, Erdafitinib4, Pexidartnib5) דווחו כי החלו כשברים וכעת משתמשים בהן בהצלחה במרפאות. בדרך כלל, מקטעים הם מולקולות אורגניות בעלות משקל מולקולרי נמוך (<250 Da) עם מסיסות מימית גבוהה ויציבות. ספריית פרגמנטים מתוכננת בקפידה המכילה בדרך כלל כמה מאות פרגמנטים, יכולה כבר להבטיח חקירה יעילה של החלל הכימי. ההרכב הכללי של ספריות מקטעים התפתח במשך שעות ארוכות ולרוב נגזר על ידי ניתוח תרופות ידועות למקטעים קטנים יותר או שתוכננו באופן חישובי. ספריות פרגמנטים מגוונות אלה מכילות בעיקר ארומטים שטוחים או הטרואטומים ונצמדות לחוק ליפינסקי של 5 6, או למגמה המסחרית הנוכחית כלל 3 7, אך הימנעו מקבוצות תגובתיות. חלק מספריות המקטעים נגזרו או הורכבו גם ממטבוליטים מסיסים מאוד, מוצרים טבעיים או נגזרותיהם8. אתגר כללי שמציבות רוב ספריות המקטעים הוא קלות הכימיה במורד הזרם.
המרכז לתהודה מגנטית ביומולקולרית (BMRZ) באוניברסיטת גתה בפרנקפורט, שותף של iNEXT-Discovery (תשתית ל-NMR, EM וקרני רנטגן למחקר תרגומי-גילוי), קונסורציום לתשתיות מחקר מבניות לכל החוקרים האירופאים מכל תחומי המחקר הביוכימי והביו-רפואי. במסגרת היוזמה הקודמת של iNEXT שהסתיימה בשנת 2019, נוצרה ספריית מקטעים הכוללת 768 מקטעים במטרה "מינימום מקטעים וגיוון מקסימלי" המכסה חלל כימי גדול. יתר על כן, בניגוד לכל ספריית פרגמנטים אחרת, ספריית הפרגמנטים iNEXT תוכננה גם היא על בסיס הרעיון של "פרגמנטים מפויחים" במטרה להקל על סינתזה במורד הזרם של ליגנדות מורכבות בעלות זיקה גבוהה ומעתה ואילך תיקרא ספרייה פנימית (Diamond, Structural Genomic Consortium ו-iNEXT).
הקמת FBDD על ידי תמ"ג דורשת כוח אדם, ידע ומכשור . ב- BMRZ פותחו זרימות עבודה ממוטבות לתמיכה בסיוע טכני לסינון מקטעים על ידי NMR. אלה כוללים בקרת איכות והערכת מסיסות של ספריית המקטעים 9, אופטימיזציה של חיץ עבור המטרות שנבחרו, 1 H או 19F- נצפה 1D ליגנד מבוסס הקרנה, ניסויי תחרות כדי להבדיל בין קשירה אורתוסטרית ו allosteric, מטרות מבוססות 2D נצפו ניסויי NMR עבור מיפוי אפיטופים,ולאפיון האינטראקציה עם קבוצה משנית של נגזרות של פגיעות השבר הראשוני. BMRZ קבעה שגרות אוטומטיות לניתוח, כפי שנדון בעבר גם בספרות 10,11, של אינטראקציות מולקולות קטנות וחלבונים ויש לה את כל התשתית האוטומטית הדרושה לסינון מקטעים מבוסס NMR. היא יישמה הפרשי העברת רוויה NMR (STD-NMR), ליגנד מים שנצפה באמצעות ספקטרוסקופיית שיפוע (waterLOGSY), וניסויי הרפיה מבוססי Carr-Purcell-Meiboom-Gill (מבוססי CPMG) כדי לזהות מקטעים בתוך מגוון רחב של משטרי זיקה, כמו גם מכשור NMR אוטומטי מתקדם ותוכנה לגילוי תרופות. בעוד שסינון מקטעים מבוסס NMR מבוסס היטב עבור חלבונים, גישה זו פחות נפוצה למציאת ליגנדות חדשות המקיימות אינטראקציה עם RNA ו- DNA. BMRZ ביססה הוכחת היתכנות לפרוטוקולים חדשים המאפשרים זיהוי אינטראקציות מולקולה-רנ"א/דנ"א קטנות. בסעיפים הבאים של תרומה זו, יישום של שגרות סינון על דגימות חלבון ורנ"א מדווח כדי ליידע את הפרוטוקולים שנקבעו עבור בסיס משתמשים רחב במחקר ביומקרומולקולרי.
Protocol
1. ספריית פרגמנטים
- ספריית פרגמנטים פנימית
הערה: במסגרת אחת מפעילויות המחקר המשותפות של iNEXT, פותחה ספריית פרגמנטים חזקה וידידותית לכימיה מהדור הראשון12 ולאחר מכן דור שני של הספרייה הורכב בשיתוף פעולה עם Enamine וידוע בשם ספריית הפרגמנטים DSI (Diamond-SGC-iNEXT) (מעתה ואילך תיקרא "ספרייה פנימית"). ספרייה זו יכולה להיות זמינה ב- BMRZ למטרות הקרנה.- הערך את ספריית המקטעים לגבי שלמותה ומסיסותה באמצעות פרוטוקול מבוסס NMR9 שדווח בעבר.
הערה: הספרייה הפנימית כוללת 768 קטעים עם מגוון כימי גבוה מאוד (>200 סינגלטונים). ביצוע ההקרנה בתערובות פרגמנטים יכול לזרז משמעותית את מסע הסינון; עם זאת, מספר המקטעים בתערובת מוגבל עקב חפיפת אותות בספקטרום H-NMR 1. המגוון הכימי הגבוה יותר המוצע על ידי הספרייה הפנימית מאפשר הכנת תערובות המכילות 12 מקטעים שונים ללא כל חפיפה משמעותית של שינוי כימי בספקטרום NMR שנצפה ב-1H. - 103 שברים בתוך 768 השברים מכילים אטום פלואור. למטרות סינון של 19 F, חלקו את כל 103המקטעים בעלי קבוצת פלואור ל-5 תערובות המבוססות על חפיפה מינימלית של 19F בהזזה כימית. כדי למזער את חפיפת האותות בסינון של 19F, השתמש במידע ההסטה הכימית ממדידות של תרכובת בודדת כדי לתכנן תערובות עם מספר מרבי של מקטעים וחפיפת אות מינימלית. בכל תערובת יש 20-21 מקטעים עם הזזות כימיות נפרדות של 19F המאפשרות הקצאה חד משמעית של שברים.
- הערך את ספריית המקטעים לגבי שלמותה ומסיסותה באמצעות פרוטוקול מבוסס NMR9 שדווח בעבר.
- ספריית פרגמנטים מוגדרת/מסופקת על-ידי המשתמש
- לבצע מסעות סינון עם ספריית הפרגמנטים המוגדרת או מסופקת על ידי המשתמש; עם זאת, השלבים הבאים צריכים להקדים את קמפיין הסינון.
- אם לא צוין על ידי המשתמש מראש, לבצע בקרת איכות מבוססת NMR של השברים (ב BMRZ, כלי תוכנה מתקדמים משמשים לכך; 9, פרק 6.1.1).
- בדוק את מסיסות המקטעים במאגר הבחירה עבור המטרה הביומולקולרית, שלמות המבנה וריכוז המקטעים לפני השימוש.
- תכננו את התערובת כך שתפחית הן את חפיפת האותות בספקטרום ה-NMR והן את זמן המדידה.
- עיצוב תערובות לפי שלב 4.2.
- מסך מקטעים בודדים או קבוצת משנה של תערובות במקום את הספרייה כולה.
2. הכנת מדגם
הערה: סינון בתפוקה גבוהה על ידי NMR משתמש ברובוט צנרת להכנת דגימה. ספקטרום NMR, אך גם יציבויות לאורך מספר ימים של קליטת אותות של חלבונים, רנ"א ודנ"א רגישים מאוד לתנודות טמפרטורה ולכן מערכות אוטומטיות מבוקרות טמפרטורה יקלו מאוד על יציבות הדגימות הנלקחות. לשם כך, מכשיר הרחבה נוסף, הפועל בין 4 ל -40 מעלות צלזיוס, מוצמד לרובוט הפיפטינג לטיפול נוזלי בדגימות NMR בסביבה מבוקרת טמפרטורה.
- הכנת תערובת ליגנד
- הכינו דגימות סינון למדידות NMR באמצעות רובוט להכנת דגימות. התצורה הגמישה של הרובוט מאפשרת מגוון רחב של יישומים (למשל, שחזור הדגימות מצינורות NMR בחזרה למיכלי אחסון או משימות כלליות לטיפול בנוזלים). ניתן להשתמש בצינורות NMR בקטרים שונים (1.7, 2.0, 2.5, 3.0 ו- 5.0 מ"מ). מערכת הרובוט לדוגמה יחד עם תוכנת הבקרה המתקדמת קוראת את הברקוד המוקצה לכל סוג מיכל ומבצעת את פרוטוקול מילוי הנוזלים בצורה אופטימלית.
- להכנת תערובות ליגנד הספרייה הביתיות, השתמשו בבקבוקונים עם ברקוד. בקבוקוני הברקוד מבטיחים את רמת האמינות הגבוהה ביותר ועקיבות אופטימלית של הדגימות.
- מפזרים 768 תרכובות ל-8 צלחות בפורמט 96 בארות. ריכוז המניה של כל מקטע בודד הוא 50 מילימטרב-d 6-DMSO/D2O (9:1). בסך הכל, להכין 64 תערובות כל אחד מכיל 12 שברים. הריכוז הסופי של כל קטע בתערובת הוא 4.2 מילימול.
הערה: רובוט הצנרת יכול להכיל מגוון סוגי מיכלים עם גיאומטריות מגוונות (בקבוקוני דוגם קריו-או אוטומטי, לוחות 96 בארות עגולים או מרובעים עמוקים, בקבוקונים סטנדרטיים ברקוד, צינורות מיקרוצנטריפוגה) ומסייע בביצוע יעיל של העברת הנוזלים למגוון צינורות ומדפי NMR.

איור 1: (A) הכנת דגימת NMR בתפוקה גבוהה ורובוט מילוי צינור NMR המותקן ב-BMRZ. (B) מחליף דגימות בתפוקה גבוהה עם ארונות תקשורת נפרדים מבוקרי טמפרטורה המותקנים על ספקטרומטר של 600 MHz במתקן BMRZ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- סינון הכנת דגימה ריקה (ספקטרום ליגנד ייחוס) ועם מטרה (ליגנד בנוכחות מטרה)
- להכנת דגימות בדיקת NMR, בנוכחות ביומולקולת המטרה (חלבון/רנ"א/דנ"א) ותערובת הליגנד, יש להשתמש בצינורות מחליפי דגימות NMR HT בקוטר 3 מ"מ שנבחרו מתוך פורטפוליו צינורות ה-NMR הסטנדרטיים של Bruker NMR.
- העבר את המטרה הביומולקולרית (למשל, 1H Screening: 10 μM RNA או Protein) במאגר סינון מוגדר לתוך צינור NMR 3 מ"מ (נפח סופי של 200 μL) באופן ידני או באמצעות רובוט הפיפטציה.
- העבירו 10 μL ( למשל, 1H Screening) של תערובת הליגנד בשלב הבא באמצעות המערכת הרובוטית לתוך צינורות NMR 3 מ"מ ברקודים המכילים את ביומולקולת המטרה וערבבו באמצעות הפרוטוקול המובנה של תוכנת הבקרה.
הערה: מספר הברקוד של צינור ה- NMR משולב בנוחות ובאופן אוטומטי בערכת נתוני ה- NMR שנרכשה, ובכך מבטיח זרימת עבודה מוכוונת מזהה ללא כל ערבוב. אביזר בקרת הטמפרטורה של רובוט הצנרת מאפשר לשמור על הדגימות המוכנות בצינורות NMR בטמפרטורה קבועה.
- תנאים ופרמטרים שהוגדרו בתוך החברה
- קבע תנאי חיץ אופטימליים לביצוע סינון של RNA וחלבון כנגד ספריית המקטעים הפנימית. הדגימה הבאה המותנית משמשת לרנ"א ב-BMRZ: 25 mM KPi, 50 mM KCl, pH 6.2. Mg2+ הוא אופציונלי.
- חלבונים רגישים מאוד לתנאי תמיסה; השתמש במאגרים אופטימליים עבור היעד הנבחר. עבור כל אחד ממאגרים אלה, רכוש ספקטרום ייחוס נוסף של הליגנדות כדי לשמש ריק לניתוח.
- תנאים שצוינו על-ידי המשתמש
הערה: במקרים שבהם התנאים שנקבעו בתוך הארגון אינם מתאימים לסינון המטרות ממשתמש פוטנציאלי, יש ליישם את השלבים הבאים.- בצע 1H-NMR של המאגר בלבד כדי להבטיח הפרעה מינימלית מרכיבי המאגר בביצוע וניתוח ניסויי הסינון שנצפו בליגנד. רכיבים מפריעים יכולים להיות מוחלפים כראוי עם מקבילות deuteated.
- מגבלות בייצור מדגם (כמויות יעד)/תנאים וזמינות
הערה: בידוד או ייצור רקומביננטי של ביומקרומולקולות מסוימות יכול במקרים מסוימים להיות מאתגר ולגרום לזמינות מוגבלת של היעד כדי להמשיך בקמפיין סינון תרופות מוצלח. במקרים של זמינות מוגבלת או בלתי מוגבלת של המטרות, ניתן להשתמש בחלופות הבאות לביצוע סריקה מוצלחת של מקטעים מבוססי תמ"ג.- אם הדבר מוגבל, יש להשתמש ב-19בדיקות סקר מבוססות F-NMR. לליגנדות מופלרות טיפוסיות יש אות יחיד של 19F; לכן, להשתמש קוקטיילים עם 25-30 שברים ללא כל חפיפה אותות. יש פחות אותות לנתח, אין הפרעות אות מרכיבי חיץ, ופחות אותות להסתמך עליהם לזיהוי פגיעות.
- אם האפשרות אינה מוגבלת, השתמש במסכים גדולים יותר כגון H-NMR אחד. ניתן להקרין את ספריית הפרגמנטים הגדולה יותר. בדרך כלל, מקטעים מורכבים מיותר מפרוטון אחד, מה שאומר יותר אותות להסתמך עליהם לצורך הניתוח.
3. תנאי רכישת תמ"א
- תנאים פנימיים מוגדרים בדרך כלל
- ספקטרומטר מצויד במחליף דגימות HT (אוטומציה)
- לסינון בתפוקה גבוהה, השתמשו בצלחות של 96 בארות שניתן למדוד רק באמצעות מחליף דגימות HT. מחליף הדגימות HT מציע גם את האפשרות למתן כל ארון תקשורת בנפרד.
- לקבלת אות לרעש אופטימלי, השתמש בספקטרומטר עם בדיקה קריוגנית מקוררת הליום או חנקן. מודול כוונון והתאמה אוטומטי (ATM) נחוצים לאוטומציה.
- ערכות פרמטרים ורצפי פולסים
הערה: ניסויי NMR רבים יכולים לאפיין אירועים מחייבים. זיהוי הפגיעה משתנה בהתאם למערך הניסוי. הניסויים הבאים משמשים באופן שגרתי במסעות סינון BMRZ. עם זאת, ניתן לבצע שינויים בקמפיינים לסינון המוגדרים על ידי המשתמש ובהתאם למפרט המשתמש.- אם אתה משתמש בתוכנת TopSpin, כלול את ערכת הפרמטרים לניסויים מבוססי ליגנד: SCREEN_STD, SCREEN_T1R, SCREEN_T2 SCREEN_WLOGSY. ערכת הפרמטרים כוללת את כל הפרמטרים הדרושים ואת רצפי הדופק: STD: stddiffesgp.3; ט1ρ: t1rho_esgp2d; ט2: cpmg_esgp2d; ו waterLOGSY: ephogsygpno.2.
- עבור כל הניסויים המפורטים, השתמש בפיסול עירור13 כדיכוי מים. לעיון, השתמש בפיסול עירור 1D (zgesgp). מספר הסריקות תלוי ברגישות המערכת (עוצמת השדה המגנטי וראש הבדיקה), ריכוז הדגימה ובחירת הניסוי. המלצה היא: 1D עם NS=64, T1ρ &; T2 עם NS=128, STD עם NS=256 ו-waterLOGSY עם NS=384 או 512.
- עבור סינון 19 F, השתמש הן בניסויי 1D והן בניסויי T2: 1D: F19CPD (pp=zgig) עבור 19 F{1 H}-ראש בדיקה ו- F19(pp=zg) עבור 19F/1H-probe head; SCREEN_19F_T2 (pp = cpmgigsp).
- השתמש ברוחב ספקטרלי של 220 עמודים לדקה ובתדר עירור של -140 עמודים לדקה. זמן הניסוי הוא בין 1 ל 5 שעות (להבטיח את היציבות לטווח ארוך של biomacromolecule) בהתאם לחומרה ואת ריכוז הדגימה. עבור T2, זמן CPMG צריך לסירוגין בין 0 ms ו 200 ms.
- עיבוד
- הקלט את ניסויי STD, T1ρ ו- T2 כפסאודו דו-ממדי. כדי לעבד את שני ספקטרום 1D יחיד, IconNMR משתמש בתוכנית au proc_std עם או בלי האפשרות להירגע. האפשרות הראשונה מספקת את הייחוס 1D ואת ההבדל של שני ספקטרה. האפשרות השנייה מניבה שני ספקטרום נפרדים עם זמן הרפיה קצר וארוך. waterLOGSY הוא 1D יחיד אשר צריך להיות בשלבים עם שלילי עבור אות ממס.
- ספקטרומטר מצויד במחליף דגימות HT (אוטומציה)
- תנאים ספציפיים למשתמש
- התאם כל אחד מהפרמטרים שהוזכרו לעיל לתנאים המוגדרים על-ידי המשתמש. לדוגמה, אם חלבון שסופק על ידי המשתמש אינו יציב בטמפרטורה המקובלת, ניתן לבצע ניסויי אופטימיזציה בטמפרטורה משתנה, ריכוז, תנאי חיץ וכו '.
4. ניתוח נתונים
- ספריית פרגמנטים QC (d6-DMSO/מאגר ספציפי) וכימות
- CMC-q
הערה: בקרת איכות של ספריות מקטעים חיונית לפני תחילת מסעות סינון. יתר על כן, יש להבטיח יציבות ארוכת טווח של ספריית פרגמנטים לצורך יישום מספר מבצעי סינון, ולכן יש לבצע הערכה תקופתית של איכות הספרייה. לשם כך, התוכנה המשולבת CMC-q ו- CMC-a מ- TopSpin משמשת להערכת איכות וכמות. CMC-q ו- CMC-a הם מודולי תוכנה בתוך Topspin המאפשרים רכישה חלקה, ניתוח כולל אימות מבנה באמצעות ספקטרום H-NMR 1המתקבל ממולקולות אורגניות קטנות 9.- לשלמות, הכינו דגימות הערכה עם ריכוז מקטע של 1 mM ב-d6-DMSO. הכינו דגימות באופן אוטומטי עם רובוט צנרת על ידי מילוי איסוף דגימות נוזליות לתוך צינור NMR 3 מ"מ.
- להערכת מסיסות, יש להשתמש בדגימה המורכבת מתרכובת של 1 mM במאגר נתרן פוספט של 50 mM ב- pH 7.4, 150 mM נתרן כלורי, 90% H 2 O / 10% D 2 O ו- 1mM של 3-(trimethylsilyl) propionic-2,2,3,3-d4 מלח נתרן חומצה (TMSP-Na).
- אסוף ספקטרום NMR במהירות של 298 K או 293 K באמצעות ספקטרומטר NMR של 600 MHz המצויד בבדיקה קריוגנית TCI 5 מ"מ בתהודה משולשת ובמחליף דגימות HT, שיכול לטפל ב- 579 דגימות בבת אחת.
- להגדרת תוכנת CMC-q, בצע את ההוראות של המדריך למשתמש, המיישם את יצירת משתמש IconNMR, הפעלת FastLaneNMR ושינוי מחליף הדגימות של HT.
- כייל את הדופק של 90° ושמור אותו בטבלת הפרזול TopSpin.
- הניחו את צלחת באר הדגימה 96 באחד מ-5 מיקומי ארון התקשורת במחליף הדגימות HT.
- כדי לטעון קובץ SDF (קובץ נתוני מבנה) שאמור להכיל את המבנה הכימי המוצע שלו, מזהה ייחודי ואת המיקום במחליף דגימות HT של כל דגימה באצווה, עבור אל עיון בחלון הגדרת CMC-q ולחץ על פתח לאחר בחירת קובץ המסתיים ב- .sdf.
- בהגדרות CMC.q Batch Automation, הגדר את סוג האימות המגדיר את הניסוי שיימדד, משתמש IconNMR והגדר את הממס.
- הגדר קובצי SDF לקובץ Path for SDF, למזהה המולקולה ולמיקום הדגימה.
- התחל את הרכישה על ידי לחיצה על התחל. לחץ שוב על התחל רכישה . ניתן לשמור את הגדרת CMC-q גם על ידי לחיצה על שמור.
- לקבלת תיאור מפורט של שלבי ההתקנה של CMC-q, בצע את ההוראות למשתמש של Bruker.
- CMC-a
- עבור CMC-a, השתמש במודול התוכנה בתוך Topspin המאפשר ניתוח כולל אימות מבנה באמצעות ספקטרום 1H-NMR המתקבל ממולקולות אורגניות קטנות9.
- CMC-q
- עיצוב תערובת
הערה: עיצוב תערובת נכון ממלא תפקיד חשוב בסינון באמצעות NMR כפלטפורמה. מספר גבוה של שברים לכל תערובות מאפשר סינון מהיר יותר אך מגדיל את הסיכון לתוצאות חיוביות ושליליות כוזבות. מספר נמוך יותר מקטין את הסיכון אך מגדיל את הזמן שלוקח לבצע את הבדיקה. באופן כללי, יש להימנע מחפיפת אותות בעת יצירת תערובות. באמצעות הספרייה הפנימית, ניתן להזניח זאת להקרנה של 1H מכיוון שהספרייה תוכננה במיוחד להיות מגוונת ולהראות חפיפת אותות מועטה תוך שמירה על מגוון כימי גבוה. משמעות הדבר היא שאין צורך לעבור הליך עיצוב מיוחד ליצירת 64 התערובות.- מכיוון שהקרנת 19F מסתמכת על שברי הספרייה הפנימית המכילים פלואור והספרייה לא נוצרה כדי להפחית את חפיפת האות עבור מקטעים ספציפיים אלה, תכנן תערובת מתאימה.
- מדוד ספקטרום מורכב יחיד עבור כל המקטעים המכילים 19F.
- שים לב למידע על ההסטה הכימית של כל אות.
- על פי מידע זה, לבחור 20-21 שברים לתערובת. זה בתורו נותן 5 תערובות שכל אחת מהן מכילה 20-21 שברים ללא חפיפת אות ומאפשר ניתוח חצי אוטומטי של הנתונים.
- ביצוע זיהוי פגיעות בתוך ליגנד שנצפה באינטראקציה ביומקרומולקולרית-ליגנד
הערה: ישנן הגדרות שונות של להיט בין הליך הסינון של 19F ו- 1H. זיהויי הפגיעות הבאים נקבעו על ידינו ופועלים לפי כללים ספציפיים. הנושא של קביעת פגיעה הוא מאוד סובייקטיבי ויכול להיות שונה ממשתמש למשתמש. עם זאת, ישנה חשיבות עליונה לכך שהכללים לזיהוי פגיעות לא ישתנו לאחר שהוסכם עליהם כדי לשמור על תיקוף ואמינות.- 1מסך H
- כדי לקבוע בביטחון פגיעות, רכשו ניסויי הרפיה 1D 1H, waterLOGSY ו- T2 הן בנוכחות והן בהיעדר מטרה לזיהוי קלסרים. לכל שלושת הניסויים יש פוטנציאל להראות אירוע מחייב. אם CSP של יותר מ-6 הרץ נראה בספקטרום הדגימה בהשוואה לספקטרום הריק, הדבר נחשב כאינדיקציה לפגיעה. כנ"ל אם אות חיובי חזק ב- waterLOGSY כמו גם הפחתה של יותר מ -30% T2 בספקטרום הדגימה גלוי. ניתן להציג אירועי קשירה בכל שלושת הניסויים, כאשר משווים את הדגימה המכילה ספקטרום עם הספקטרום הריק המתאים להם. עם זאת, אירועים מחייבים עשויים שלא להיראות בכל שלושת הניסויים. בשל כך הוסכם כי לפחות שניים מהאירועים המתוארים לעיל חייבים להתרחש על מנת לסווג שבר כפגיעה מחייבת.
- השתמש בכלי FBS ב- TopSpin כדי להגדיר את מצב השברים לכריכה, דו-משמעית, לא ידועה, אגרגטים ולא מחייבים.
- לאחר סיום עם ערבוב, לאשר אותו בתוך הכלי FBS.
- בכרטיסייה סיכום בתוך פרויקט FBS, לחץ על צור דוח סינון. פעולה זו תפתח חלון שיוצר קובץ .xlsx. לאחר מכן המשתמש יכול לבחור בין כל הליגנדות, ליגנד מחייב בלבד, ליגנד לא מחייב בלבד וליגנדות דו-משמעיות שידווחו בגיליון האלקטרוני.
- 19מסך F
- כדי להבדיל בין קלסר שאינו קלסר, קלסר שבועי וקלסר חזק, חלק את מנת השילוב בין מדידת היעד של 200 אלפיות השנייה לבין מדידת הריקים של 200 אלפיות השנייה במנה של מדידת היעד של 0 אלפיות השנייה, ונעשה שימוש במדידה ריקה של 0 אלפיות השנייה:
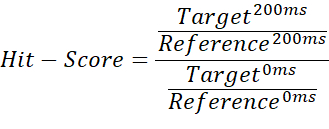
הערה: פעולה זו מספקת ערכים בטווח שבין 0 ל~1 (ניקוד הפגיעה), מה שמאפשר להקצות ערכי סף לכל מצב איגוד. - השתמש בממוצע של מדידת 200 אלפיות השנייה ההפניה כסף בסיסי, כדי לסמן מקרים שבהם תוצאת הפגיעה עולה על 1. מצב זה עשוי להתרחש אם האינטגרלים המיובאים מכילים ערכים שליליים או שמדידת הייחוס גבוהה ממדידת היעד. ציון חבטה של 0.67 ≤ נחשב לחבטה, < 0.33 לחבטה חזקה, וכל דבר > 0.67 כלא להיט. דוגמה לכך מוצגת באיור 2.
- כדי להבדיל בין קלסר שאינו קלסר, קלסר שבועי וקלסר חזק, חלק את מנת השילוב בין מדידת היעד של 200 אלפיות השנייה לבין מדידת הריקים של 200 אלפיות השנייה במנה של מדידת היעד של 0 אלפיות השנייה, ונעשה שימוש במדידה ריקה של 0 אלפיות השנייה:
- 1מסך H
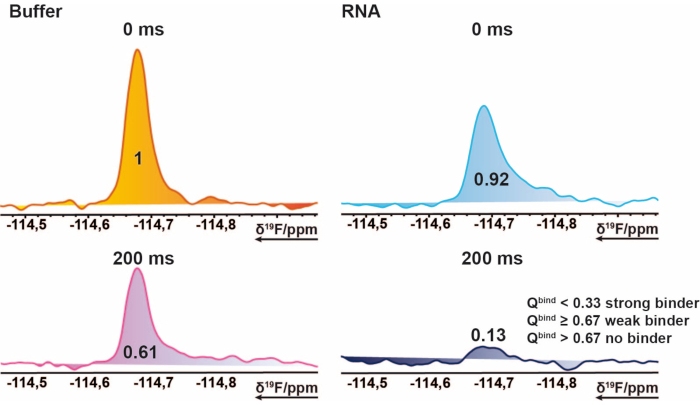
איור 2: זיהוי פגיעות עבור הקרנת 19F. חתך של ספקטרום 19F CPMG NMR של תרכובת מופתית. ייצוג ציורי זה מסביר את תכונותיו של קלסר. 19ספקטרום F-CPMG של תרכובת הנרכשת מדגימות תערובת בנוכחות והיעדר RNA. הערכים מייצגים את הערכים האינטגרליים הנורמטיביים של הפסגה המתאימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- ניתוח נתונים
- הכנת נתונים לניתוח
הערה: חשוב שלנתונים שנרכשו לא יהיו פגמים נראים לעין. משמעות הדבר היא כי נתונים שבהם השימינג היה בעייתי, או דיכוי המים לא היה מספיק לא צריך להיחשב לניתוח. במקום זאת, מומלץ להקליט נתונים שוב ולוודא שהכל בסדר עם הדגימה (למשל, ללא בועות אוויר), עם הטמפרטורה, השימינג ודיכוי המים. תמיד ניתן להעריך את נכונות הנתונים בעת השוואת אותות DMSO. - 1הקרנת H
- כדי לנתח נתוני סינון של 1H, השתמש בכלי FBS (זקוק לרישיון נוסף) ב- TopSpin 4.0.9.
- בצע את ההוראות במדריך הכלי של FBS כדי להתחיל בניתוח הנתונים. השלבים הבאים מסכמים את ההליך המדווח במדריך.
- אחסן את נתוני BMRZ NMR ממסעות סינון כך שלכל תערובת סינון שונה תהיה ספרייה משלה שבה תת-ספרייה מכילה את הניסויים השונים שנמדדו על המדגם.
- לשימוש בכלי FBS, אחסן את ספקטרום הייחוס הכולל את כל הנתונים שנשמרו מדגימות ללא המטרה הביומולקולרית אלא עם התערובות וכן עם התרכובת היחידה הנמדדת בספריות /nmr שונות. זה חשוב מכיוון שכלי FBS יבקש את נתיב הספרייה של כל אחד בנפרד.
הערה: הכלי FBS יזהה ספרייה כפרויקט סינון אם ערכות הנתונים הבאות אוחסנו באותה ספרייה שבה מאוחסנות התערובות של דגימת סינון (csv, מסמכי XML של FragmentScreen וקובץ BAK). - בעת שימוש TopSpin 4.0.9, ליצור נתיב ישיר לספרייה המכילה את הנתונים שנרכשו, מה שנקרא DIR. בחר את הספרייה /nmr שבה כל תערובות צריך להיות ספרייה נפרדת.
- כדי להפעיל את הכלי FBS של דוגמה מוקרנת, גרור את פרויקט FBS הסמל לאמצע חלון TopSpin. בספרייה שנבחרה, סמל הפרויקט FBS אמור להופיע אם ערכות הנתונים האמורות הועתקו לתוכו.
- החלון אפשרויות סינון מבוססות פרגמנט אמורות להיפתח באופן אוטומטי בעת טעינה ראשונה של פרויקט FBS חדש. בחלון זה בחר קובץ קוקטייל. קובץ הקוקטייל הוא קובץ csv המכיל את הקצאת שם התערובות, שם כל קטע וחלוקתן לתערובות. כמו כן, הגדר תיקיית ספקטרום ליגנד ייחוס הכוללת את כל הספקטרום הנמדד של המקטעים הבודדים. לבסוף, הגדר תיקיית ניסוי ריקה להפניה, שהיא בדרך כלל התיקייה המכילה את ערכות הנתונים של התערובות ללא היעד הנחקר.
- אפשרויות הסינון המבוססות על מקטע כוללות כרטיסייה בשם סוגי ספקטרום המאפשרת להגדיר את הספקטרום הנחקר וכן את הצבע להצגת הספקטרה. הגדר את Spectype בהתאם לנתונים שעובדו מראש. בכרטיסיה פריסת תצוגה , הגדר את הספקטרום שיושווה זה לזה בהתאם לסוגי המפרט שלהם.
- לחץ על אישור כדי להתחיל את פרויקט FBS.
- תוך כדי התבוננות בנתונים, ייפתח חלון נפרד, המסכם את כל תערובות הקוקטיילים ואת כל הליגנדות של כל תערובת בטבלה. על ידי לחיצה כפולה על תא, ערכות הנתונים המתאימות ייפתחו, תוך השוואה לדוגמה 1H 1D Blank spectra עם ערכת הנתונים המכילה את היעד.
- לפני הקצאת קלסרים, ודא ששיאי הייחוס (DMSO של כל המדידות וכן של התרכובות הבודדות) תואמים זה לזה ובעלי אותו שינוי כימי. אם נצפים הבדלים, תקן אותם באמצעות אפשרות העיבוד הטורי מ- TopSpin.
- אפשרות העיבוד הטורי נמצאת תחת הכרטיסיה תהליך תחת מתקדם. הוא מחיל שינויים על כל הספקטרום שנבחר מתוך ערכת נתונים. בדרך זו, ניתן בקלות להקצות מפרטים למספרי ניסוי וניתן להזיז את כל הספקטרום בבת אחת כדי ליישר קו עם הייחוס.
- 19הקרנת F
- לניתוח ראשון של תערובות 19F, צור קובץ אינטגרציה עבור כל מיקס. כדי להגדיר את אזור האינטגרציה, לחץ על פונקציית האינטגרציה בכרטיסייה ניתוח . ודא שעבור כל קטע בתערובת מוגדר אזור אינטגרציה ברור עבור 19F-singal המתאים.
- השתמש בלחצן שמור/יצא אזורי אינטגרציה כדי לייצא את קובץ השילוב לשימוש עתידי. שמור את כל קבצי האינטגרציה המשומשים ב- C:\Bruker\TopSpin4.0.9\exp\stan\nmr\lists\intrng, או את הנתיב המתאים של ספריית ההתקנה TopSpin.
- עבור נתוני 19F, פתח ערכת נתונים עם או בלי היעד הנחקר.
- כדי לטעון את קובץ השילוב לספקטרום הנוכחי, פתח שוב את הכרטיסיה ניתוח , עבור אל שילוב ובאמצעות לחצן אזורי שילוב קריאה/ייבוא , טען את קובץ השילוב המתאים. פעולה זו תטען את כל האזורים המוגדרים של קובץ זה לתוך הספקטרום הנוכחי.
- שמור וחזור כדי למצוא רשימה של כל האזורים המשולבים בכרטיסיה אינטגרלים . העתק זאת לגיליון אלקטרוני או לכל כלי אחר המשמש לניתוח נוסף של הנתונים.
- חזור על הליך זה עבור כל ערבוב, עם ובלי מטרה.
- ניהול נתונים
- למען קלות השימוש והפרודוקטיביות, הגדר זרימת עבודה אחידה להמשך ניתוח ואחסון הנתונים שנרכשו. הן עבור הקרנת H 1והן עבור הקרנת 19F, השתמש בגיליון אלקטרוני שעוצב במיוחד עבור כל אחת מהן.
הערה: עבור סינון 1H זה שימש אך ורק לניהול נתונים ולסיכום כל מטרה, ואילו עבור סינון 19F הוא השתמש במנה המוסברת בפרק 4.3 כדי לתייג אוטומטית כל קטע כפגע / לא פגע לאחר שהנתונים האינטגרליים הועתקו לתוכו. זה מקטין את הסיכון לטעויות אנוש במהלך הניתוח, בהנחה שהקובץ הוגדר כראוי, ומקל על שיתוף המידע, שכן כל המידע החשוב נאסף במקום אחד בקובץ שניתן לפתוח כמעט על ידי כל אחד ללא צורך בתוכניות נוספות להסתכלות ראשונית על הנתונים.
- למען קלות השימוש והפרודוקטיביות, הגדר זרימת עבודה אחידה להמשך ניתוח ואחסון הנתונים שנרכשו. הן עבור הקרנת H 1והן עבור הקרנת 19F, השתמש בגיליון אלקטרוני שעוצב במיוחד עבור כל אחת מהן.
- הכנת נתונים לניתוח
תוצאות
בקרת איכות של ספריית פרגמנטים
השברים מהספרייה הפנימית נמסרו כתמיסות מלאי של 50 מילימטר ב-90% d6-DMSO ו-10%D 2 O (10% מ-D2O מבטיח מזעור של התפרקות תרכובת עקב מחזורי הקפאה-הפשרה חוזרים ונשנים14). דגימות תרכובת בודדות כללו ליגנד 1 mM במאגר פוספט של 50 mM (25 mM KPi pH 6.2 + 50 mM KCl + 5 mM MgCl 2), pH 6.0 ב-90% H 2 O/9% D2O/1% d6-DMSO. 1ניסויי H-NMR של מקטעים מספריית iNEXT נמדדו על ספקטרומטר NMR של 500/600 MHz. נתונים אלה שימשו גם לזיהוי התרכובות הבודדות במסעות סינון של 1 H באמצעות תוכנת CMC-q המאפשרת למשתמש לרכוש ספקטרום באופן אוטומטי באופן אוטומטי, ותוסף הניתוח CMC-a הוערך האיכות (מסיסות ושלמות) שלהמקטעים. התוצאות מהניתוח האוטומטי של CMC-a מוצגות כפלט גרפי דומה למה שמיוצג באיור 3. הפלט הגרפי מציג ייצוג של לוח 96 בארות. עיגול בצבע אדום פירושו שקטע זה מראה חוסר עקביות במבנה או בריכוז. בארות בצבע ירוק מעידות על עקביות השבר.
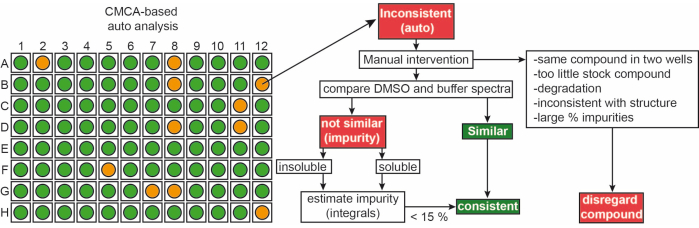
איור 3: בקרת איכות של ספריית פרגמנטים. ייצוג סכמטי של פלט אוטומטי מבוסס CMC-a. תכונות פרגמנט כגון ריכוז ושלמות מבנית מוערכות. ירוק מייצג עקבי, כתום במקרה זה מייצג לא עקבי. מקטעים לא עקביים משתנים באופן ידני בהתאם לזרימת העבודה המוצגת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כ-65% ו-35% מהשברים סווגו כעקביים ולא עקביים, בהתאמה, הן ב-DMSO והן בחיץ. יתר על כן, 30% מהליגנדות המסווגות הלא עקביות הפכו עקביות לאחר בדיקה ידנית קפדנית של ספקטרום9.
עיצוב תערובת 19 F
103 קטעים שהכילו קבוצת פלואור אחת או יותר מספריית הבית חולקו ל-5 תערובות (A, B, C, D, E). בכל תערובת יש 20 עד 21 שברים. במקרה זה, התערובות היו צריכות להיות מתוכננות בקפידה כדי למנוע חפיפת אותות. 19F ניסויי הרפיה רוחביים נמדדו עבור כל תערובת המפעילה רכבות דופק CPMG. ניסויים אלה יכולים להשתנות על ידי שינוי עיכובי הרפיה. ניתן לראות את השינוי הכימי 19F של תערובות A-E באיור 4.
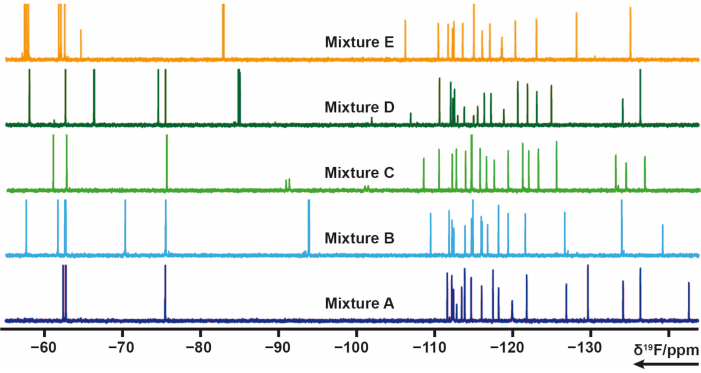
איור 4: ספקטרום 19F 1D-NMR של דגימות תערובת מהספרייה הביתית. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הכנת דוגמאות
הכנת הדגימה בהליך סינון 19F נעשתה באופן ידני או באמצעות פיפטינג אוטומטי באמצעות רובוט פיפטינג. השברים בכל תערובת היו בעלי ריכוז של 2.5 מילימטר ב-90% d6-DMSO ו-10% D2O. הנפח הסופי של דגימת הסינון היה 170 μL עם 5% D2O כסוכן נעילה. כל תערובת הותקפה פעמיים, אחת בחיץ המכיל תמיסה (ללא מטרה) ואחת למטרה המכילה תמיסת חיץ. היחס בין המטרה לשבר נקבע ל-1:1, והתוצאה הייתה ריכוז מטרה/ליגנד סופי של 50 מיקרומטר. בנוסף, דגימות בקרה הן ביומולקולת המטרה במאגר סינון ללא תערובת כדי להבטיח את שלמות המטרה, כמו גם דגימת בקרה עם חיץ בלבד ו-D2O כדי להבטיח את איכות החיץ.
נתוני סינון NMR של 19 F-1D ו-19F-CPMG-T2 היו מדידות כמתואר בסעיף 3.1. לדוגמה, במקרה של RNA נרכש רצף הד קפיצה-חזרה (pp = zggpjrse,15) עבור דגימת המטרה היחידה בחיץ.
ניתוח נתונים
הליך הסינון של 19F הוחל על TPP riboswitch thiM מ E. coli וחלבון טירוזין קינאז (PtkA) מ M. tuberculosis בין מספר מטרות אחרות16. בספריית הסינון 19F יש 103 קטעים המחולקים ל-5 מיקסים המסומנים ממיקס A עד E. הכנת דגימות הסינון יכולה להתבצע באופן ידני ללא שימוש ברובוט צנרת דגימה. 40 μM thiM RNA המכיל תמיסה (תנאי חיץ) עורבב עם 3.2 μL מהתערובות. הוכנו דגימות בקרה נוספות המורכבות מחיץ בלבד, חיץ עם 5% של DMSO (בעבר להבטיח את יציבות הביומקרומולקולה בנוכחות ריכוז DMSO הרצוי) וחיץ עם RNA. 13 דגימות הסינון הללו הוכנו והועברו לצינורות NMR בקוטר 3 מ"מ. ברקודים של צינורות NMR נסרקים וכל תערובת בנוכחות והיעדר RNA, כמו גם דגימות בקרה נמדדו על פי 19ניסויי F NMR שהוזכרו לעיל שבוצעו ב 298 K. סינון של thiM RNA מול הספרייה הפנימית בוצע על ידי ביצוע מדידות T2 עם CPMG של 0 ms ו 200 ms עבור כל דגימה שונה. שימינג תקין ודיכוי מים נוטרו לאחר סיום המדידות על ידי השוואת כל שיאי DMSO במונחים של הרחבת קווים ואובדן עוצמה של ניסויי 1 H1D שנמדדו בנוסף עבור כל הדגימות. עיבוד ספקטרום הרפיה CPMGT 2 19F המתקבל בוצע באמצעות מאקרו שהוכן בעבר ואוטומטי ב- TopSpin, בהתאמה. ניתוח הנתונים בוצע בהתאם להוראות בסעיף הפרוטוקול. הנתונים האינטגרליים המתקבלים מ- TopSpin (בהתאם להוראות בפרוטוקול) ניתנים להערכה במהירות ובקלות באמצעות גיליון אלקטרוני מוכן מראש או כל תוכנית דומה, על ידי הגדרת התנאים והספים הנכונים. כפי שתואר קודם לכן, ערכי סף שימושיים בהגדרת קלסר, קלסר חלש או לא קלסר. איור 5 מראה תוצאות אופייניות של ספקטרום CPMG של thiM RNA ו-PtkA, בהתאמה. במקרים מסוימים, היה צורך בתיקון מומחה נוסף.
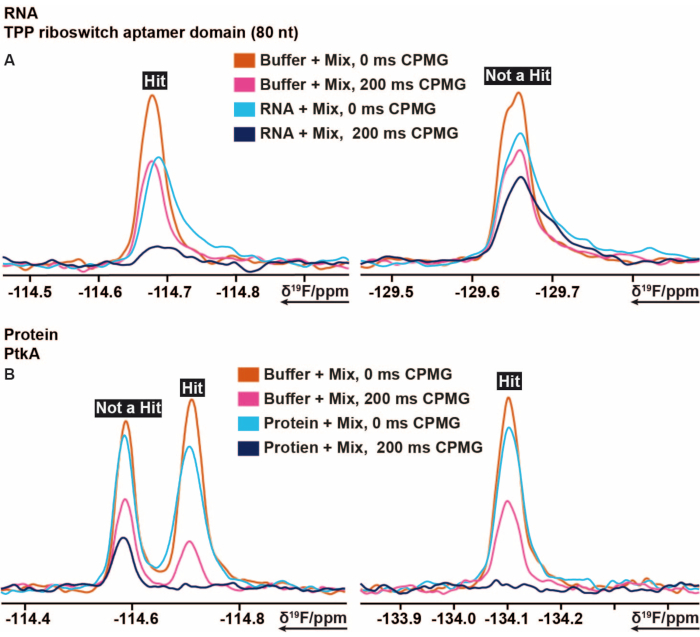
איור 5: חתך מתוך 19F CPMG NMR SPECTRA המראה את שינויי העוצמה המתקבלים מזמני עיכוב שונים של ניסויים מבוססי CPMG . (A) ייצוג של קלסר (מכה) ואי-קלסר בסינון מבוסס מקטע 19F המבוצע על RNA TPP riboswitch thiM מ-E. coli. (B) ייצוג של קלסר ואי-קלסר בהקרנה מבוססת שבר 19F שבוצעה ב-PtkA מ-M. tuberculosis. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הקרנה של 1שעות
עיצוב תערובת
הספרייה המשומשת בתוך הבית כל כך מגוונת שלמטרות הקרנה של 1H לא בוצע עיצוב תערובת. משמעות הדבר היא כי 64 תערובות הוכנו על ידי בחירה אקראית 12 להיות ערבוב בתערובת אחת.
הכנת דוגמאות
עבור הקרנה של 1 H שלRNA מופתי של SARS-CoV-2, בוצעה פיפטינג אוטומטי באמצעות רובוט פיפטינג להכנת הדגימות. השברים בכל תערובת היו בעלי ריכוז של 4.2 mM ב-90% d6-DMSO ו-10% D2O. הנפח הסופי של דגימת הסינון היה 200 μL עם 5% D2O כסוכן נעילה. 64 דגימות שכל אחת מהן הכילה תערובת שונה ב-25 mM KPi, 50 mM KCl ב-pH 6.2 נלקחו ללא RNA מטרה. בהתאמה, 64 דגימות היו pipeted עם RNA מטרה, כל אחד הכיל תערובת שונה. יחס RNA:Ligand נקבע ל-1:20, וכתוצאה מכך ריכוז RNA של 10 מיקרומטר וריכוז ליגנד של 200 מיקרומטר.
ניתוח נתונים
עבור ניתוח 1H, הכלי FBS ב TopSpin שימש. כדי לקבוע אם שבר הוא פגיעה, נערכו ניסויי הרפיה 1D Chemical Shift, waterLOGSY ו-T2 . עבור הרפיה T2 , ירידה בעוצמה גדולה מ -30% נחשבה להיט, בעוד עבור השינוי הכימי שינוי של יותר מ 6 הרץ היה החתך. waterLOGSY היה צריך להראות שינוי אות משמעותי (מ שלילי חיובי במקרה זה). אם אחד משלושת הקריטריונים הללו היה חיובי, רסיס נחשב למכה. שתי דוגמאות לכך ניתן לראות באיור 6.
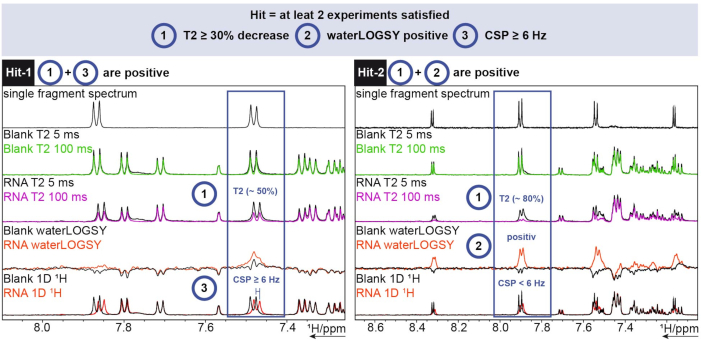
איור 6: בדיקת סקר של 1H שבוצעה על RNA לדוגמה של SARS-CoV-2 המראה קריטריונים לקביעת פגיעה. רכישת שלושה ניסויים שונים (1 H T2 CPMG (5/100 ms), waterLOGSY, ו- 1D 1H). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Hit-1 מראה ירידה של T2 של ~50% ו- CSP ≥ 6 הרץ. waterLOGSY אינו מראה שינוי משמעותי מספיק באות כדי להיחשב גם חיובי. מכיוון ששניים מתוך שלושה ניסויים הם חיוביים, קטע זה נחשב להיט. עבור Hit-2, T2 מראה ירידה של ~ 80% עוצמת האות וניתן לראות שינוי אות ברור עבור waterLOGSY. CSP אינו מספיק במקרה זה, אבל כמו שני הקריטריונים הקודמים הם חיוביים זה עדיין נחשב להיט.
Discussion
רב-תכליתיות של מקטע מבוסס NMR / בדיקת תרופות. BMRZ יישמה בהצלחה מכשור NMR אוטומטי חדיש, כמו גם ניסויי STD-NMR, waterLOGSY והרפיה כדי לזהות מקטעים בתוך מגוון רחב של משטר זיקה לגילוי תרופות. החומרה המותקנת כוללת רובוט להכנת דגימות בתפוקה גבוהה ויחידת אחסון, מחליף ורכישת נתונים בתפוקה גבוהה המשויכת לספקטרומטר של 600 מגה-הרץ. בדיקה קריוגנית שנרכשה לאחרונה עבור 1 H, 19 F, 13C ו- 15N מבטיחה את הרגישות הנדרשת למדידות המוצעות ומאפשרת ניתוק של1 H (1) במהלך זיהוי 19F. בדיקה זו מחוברת לדור האחרון של קונסולת NMR המציעה את האפשרות להשתמש בכלי התוכנה המתקדמים של Bruker, כולל CMC-q, CMC-assist, CMC-se ו- FBS (כלולים ב- TopSpin). כלי הסינון מבוסס הפרגמנטים (FBS) כלול בגרסה האחרונה של TopSpin ומסייע לנתח את הנתונים בעלי התפוקה הגבוהה הכוללים ניסויי הרפיה STD, waterLOGSY, T2/T1r. ניתן למלא את אוסף הדגימות הנוזלי 1D 1H לתוך צינורות NMR באופן אוטומטי באמצעות רובוט מילוי הדגימה. בדרך כלל, בלוק של 96 צינורות (3 מ"מ) מלאים כשעתיים. מתלי 96 הלוחות ממוקמים ישירות במחליף הדגימות HT, אשר קורא את הברקוד של הבלוק ומקצה את צינורות ה- NMR לניסויים הנשלטים על ידי תוכנת האוטומציה (IconNMR). ניתן לאחסן ולתכנת חמישה ארונות תקשורת בעלי 96 בארות במחליף הדגימות HT בו זמנית. הטמפרטורה של כל אחד מהארונות הנפרדים ניתנת לשליטה ולוויסות בנפרד. בנוסף, ניתן להתנות מראש כל דגימה בודדת (חימום מקדים וייבוש צינורית להסרת לחות מעובה) לטמפרטורה הרצויה לפני המדידה.
התאמה למגוון רחב של יישומים. אחד היישומים הרחבים של סינון אוטומטי מבוסס NMR זה הוא לזהות ולפתח ליגנדות חדשות הנקשרות למטרה ביו-מקרומולקולרית (DNA/RNA/חלבונים). ליגנדות אלה יכולות לכלול מעכבים אורתוסטריים ואלוסטאריים שבדרך כלל נקשרים באופן לא קוולנטי. יתר על כן, FBDD על ידי NMR משמש בדרך כלל כצעד ראשון לבחירת תרכובות מבטיחות, הדרישות שיש לעמוד בהן הן זמינות המטרה הביומולקולרית בכמויות מספיקות. מטרה זו מחולקת לשתי משימות עיקריות.
המשימה הראשונה היא לפתח ולאפיין ספריית מקטעים פנימית מהסיבות הבאות: בקרת איכות ראשונית ותקופתית, אפיון וכימות של יותר מ-1000 מקטעים; קביעת מסיסות המקטעים במאגרים המותאמים לכל מטרה, במיוחד למטרות חלבון; והקמתן של מספר ספריות כדי להכיל פיגומים מגוונים ולהתרחב למחלקות מקרומולקולות אחרות. המשימה השנייה היא לשלב זרימות עבודה עבור תכנון תרופות מבוססות מקטעים (FBDD) על ידי NMR באמצעות: סריקה אוטומטית של ליגנד 1D שנצפה (1H ו-19F שנצפו); בדיקות החלפה אוטומטיות (ניסויי תחרות עם ליגנד (טבעי) כדי להבדיל בין קשירה אורתוסטרית לקשירה אלוסטרית; הקרנות משניות אוטומטיות עם קטעים מרובים; סינון אוטומטי של חלבון דו-ממדי, וסינון משני של קבוצה של נגזרות סביב להיט ראשוני תוך שימוש בספריית EU-OPENSCREEN או בכל ספרייה אחרת; ויצירת פרופיל מחדש של סינון ספריית ה-FDA כנגד המטרות שנבחרו.
בנוסף, ניתן לבצע מטבוליטיפ של קווי תאים שונים (רלוונטיים למחלות) על מנת לפענח את מנגנוני הבקרה המקשרים בין בקרת מחזור התא לבין חילוף החומרים. כמו כן, קיים אפיון פונקציונלי של רכיבי ויסות RNA/DNA/חלבונים in vivo ו-in vitro לאופטימיזציה של מבנה/תחום (אופטימיזציה של יציבות לחקירות מבניות (Buffer, pH, טמפרטורה וסינון מלחים), והרחבה של סינון מקטעים מבוסס NMR לחלבוני ממברנה וחלבונים בעלי אי-סדר פנימי, אשר בדרך כלל אינם נגישים לטכניקות אחרות.
מגבלות. לשימוש בספריות שברי 19F ו- 1H יש יתרונות וחסרונות, שרק מעטים מהם יוזכרו להלן. היתרון הגדול ביותר של מדידות של 19F לעומת 1H הוא המהירות הן של זמן המדידה בפועל והן של הניתוח שלאחר מכן, מכיוון שהתערובות מכילות מספר כמעט כפול של מקטעים ויש לבצע פחות ניסויים. ניתוח המעקב הוא גם קל יותר עבור סינון 19F, מכיוון שאין הפרעה של מאגרים ובנוסף מציע טווח שינוי כימי רחב יותר כמעט ללא חפיפת אות עבור תערובת מקטעים שתוכננה בצורה אופטימלית. הספקטרום עצמו מפושט מאוד, בדרך כלל יש רק אות אחד או שניים לכל מקטע, בהתאם למספר אטומי פלואור. לפיכך, ניתוח הספקטרום הזה יכול להיות אוטומטי, ושוב לקצר את הזמן. זה בא על חשבון המגוון הכימי, לפחות עבור הספרייה ששימשה במחקר זה. מכיוון שרק ~13% מהספרייה מכילה 19 F, אך באופן טבעי כולם ניתנים לשימוש בהקרנה של 1 H, המגוון של קטעי ההקרנה של 19F יהיה נמוך יותר. ניתן לעקוף זאת באמצעות ספריות 19F שתוכננו במיוחד עם יותר מקטעים ומגוון כימי גדול יותר. חסרון נוסף להקרנת 19F הוא מספר האותות הנמוך לכל מקטע. מקטעים מורכבים בדרך כלל מיותר מאטום מימן אחד. לכן, ניסויי סינון שנצפו ב-1H יכולים להסתמך על אותות שונים עבור אותו מקטע לצורך זיהוי קשירה. זה נותן רמה גבוהה יותר של ביטחון בעת זיהוי פגיעות עבור הקרנת 1H, בעוד שהקרנת 19F חייבת להסתמך על אות אחד או שניים שניתנו לכל מקטע.
הוצג תיאור מפורט של המכשור המודרני האוטומטי לסינון מקטעים מבוסס NMR, תוכנות ושיטות ניתוח ופרוטוקולים שלהם. החומרה המותקנת כוללת רובוט להכנת דגימות בתפוקה גבוהה ויחידת אחסון, מחליף ורכישת נתונים בתפוקה גבוהה המשויכת לספקטרומטר של 600 מגה-הרץ. ראש בדיקה קריוגני שהותקן לאחרונה עבור 1 H, 19 F, 13 C ו- 15N מבטיח את הרגישות הנדרשת למדידות המוצעות ומאפשר ניתוק של 1H במהלך זיהוי 19F. יתר על כן, הדור האחרון של קונסולת NMR מציע את האפשרות להשתמש בתוכנה אנליטית מתקדמת לסיוע ברכישה וניתוח תוך כדי תנועה. הטכנולוגיה, זרימות העבודה והפרוטוקולים המתוארים לעיל צריכים לטפח הצלחה יוצאת דופן למשתמשים הרודפים אחר FBS על ידי NMR.
Disclosures
ללא.
Acknowledgements
עבודה זו נתמכה על ידי iNEXT-Discovery, פרויקט מספר 871037, שמומן על ידי תוכנית Horizon 2020 של הנציבות האירופית.
Materials
| Name | Company | Catalog Number | Comments |
| Bruker Avance III HD | Bruker | 600 MHz NMR Spectrometer | |
| Matrix Clear Polypropylene 2D Barcoded Open-Top Storage Tubes | 3731-11 0.75ML V-BOTTOM TUBE/LATCH RACK | ThermoFisher Scientific | Barcoded Tubes |
| Matrix SepraSeal und DuraSeal& | 4463 Cap Mat, SeptraSeal 10/CS | ThermoFisher Scientific | |
| SampleJet | Bruker | HT Sample Changer | |
| SamplePro Tube | Bruker | Pipetting Robot |
References
- Yanamala, N., et al. NMR-Based Screening of Membrane Protein Ligands. Chemical Biology & Drug Design. 75, 237-256 (2010).
- Souers, A. J., et al. ABT-199, a potent and selective BCL-2 inhibitor, achieves antitumor activity while sparing platelets. Nature Medicine. 19, 202-208 (2013).
- Su, M. C., Te Chang, C., Chu, C. H., Tsai, C. H., Chang, K. Y. An atypical RNA pseudoknot stimulator and an upstream attenuation signal for -1 ribosomal frameshifting of SARS coronavirus. Nucleic Acids Research. 33, 4265-4275 (2005).
- Perera, T. P. S., et al. Discovery & pharmacological characterization of JNJ-42756493 (Erdafitinib), a functionally selective small-molecule FGFR family inhibitor. Molecular Cancer Therapeutics. 16, 1010-1020 (2017).
- Zhang, C., et al. Design and pharmacology of a highly specific dual FMS and KIT kinase inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 110, 5689-5694 (2013).
- Lipinski, C. A., Lombardo, F., Dominy, B. W., Feeney, P. J. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Advanced Drug Delivery Reviews. 23, 3-25 (1997).
- Congreve, M., Carr, R., Murray, C., Jhoti, H. A 'Rule of Three' for fragment-based lead discovery. Drug Discovery Today. 8, 876-877 (2003).
- Chávez-Hernández, A. L., Sánchez-Cruz, N., Medina-Franco, J. L. A Fragment Library of Natural Products and its Comparative Chemoinformatic Characterization. Molecular Informatics. 39, 2000050(2020).
- Sreeramulu, S., et al. NMR quality control of fragment libraries for screening. Journal of Biomolecular NMR. , 00327-00329 (2020).
- Gao, J., et al. Automated NMR Fragment Based Screening Identified a Novel Interface Blocker to the LARG/RhoA Complex. PLoS One. 9, 88098(2014).
- Peng, C., et al. Fast and Efficient Fragment-Based Lead Generation by Fully Automated Processing and Analysis of Ligand-Observed NMR Binding Data. Journal of Medicinal Chemistry. 59, 3303-3310 (2016).
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7, 2322-2330 (2016).
- Hwang, T. L., Shaka, A. J. Water Suppression That Works. Excitation Sculpting Using Arbitrary Wave-Forms and Pulsed-Field Gradients. Journal of Magnetic Resonance, Series A. 112, 275-279 (1995).
- Gossert, A. D., Jahnke, W. NMR in drug discovery: A practical guide to identification and validation of ligands interacting with biological macromolecules. Progress in Nuclear Magnetic Resonance Spectroscopy. 97, 82-125 (2016).
- Sklenar, V., Bax, A. A new water suppression technique for generating pure-phase spectra with equal excitation over a wide bandwidth. Journal of Magnetic Resonance. 75, 378-383 (1987).
- Binas, O., et al. 19F NMR-Based Fragment Screening for 14 Different Biologically Active RNAs and 10 DNA and Protein Counter-Screens. ChemBioChem. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved