Method Article
최소 샘플이지만 최대 자동화 모드에서 NMR 기반 단편 스크리닝
요약
NMR에 의한 단편 기반 스크리닝은 생체고분자(DNA, RNA 또는 단백질)에 대한 소분자 결합제를 신속하게 식별하는 강력한 방법입니다. 자동화 기반 시료 전처리, NMR 실험 및 획득 조건, 분석 워크플로우를 설명하는 프로토콜이 제시됩니다. 이 기술은 검출을 위해 1H 및 19FNMR 활성 핵 모두를 최적으로 이용할 수 있습니다.
초록
단편 기반 스크리닝(FBS)은 학계와 산업계 모두에서 신약 개발 프로세스 내에서 잘 검증되고 인정되는 개념입니다. NMR 기반 단편 스크리닝의 가장 큰 장점은 7-8배 이상의 친화도 이상의 결합제를 검출할 수 있을 뿐만 아니라 단편의 순도와 화학적 품질을 모니터링하여 고품질 히트와 최소한의 위양성 또는 위음성을 생성할 수 있다는 것입니다. FBS의 전제 조건은 단편 라이브러리의 초기 및 주기적 품질 관리를 수행하고, 관련 완충액에서 단편의 용해도 및 화학적 무결성을 결정하고, 다양한 거대분자 표적 클래스(단백질/RNA/DNA)를 수용하기 위해 다양한 스캐폴드를 포괄하는 여러 라이브러리를 구축하는 것입니다. 또한, 생물학적 구성물/단편 공간, 조건-공간(완충액, 첨가제, 이온, pH 및 온도) 및 리간드-공간(리간드 유사체, 리간드 농도) 수준에서 샘플 양, 획득 및 분석 속도에 대한 광범위한 NMR 기반 스크리닝 프로토콜 최적화가 필요합니다. 적어도 학계에서는 이러한 스크리닝 노력이 지금까지 매우 제한된 방식으로 수동으로 수행되어 약물 개발 프로세스뿐만 아니라 화학 프로브 개발의 맥락에서도 스크리닝 인프라의 가용성이 제한되었습니다. 경제적으로 요구 사항을 충족하기 위해 고급 워크 플로우가 제공됩니다. 그들은 액체 샘플 수집을 온도 제어 방식으로 NMR-튜브에 자동화된 방식으로 채울 수 있는 최신 최첨단 고급 하드웨어를 활용합니다. 1이어서, H/19FNMR 리간드-기반 스펙트럼을 주어진 온도에서 수집한다. 고처리량 시료 주입기(HT 시료 주입기)는 온도 제어 블록에서 500개 이상의 시료를 처리할 수 있습니다. 이는 고급 소프트웨어 도구와 함께 데이터 수집 및 분석 속도를 높입니다. 또한, 단백질 및 RNA 샘플에 대한 스크리닝 루틴의 적용은 생체 고분자 연구에서 광범위한 사용자 기반을 위해 확립된 프로토콜을 인식하기 위해 설명됩니다.
서문
단편 기반 스크리닝은 이제 단백질, DNA 및 RNA를 포함한 거대분자 표적에 약한 결합을 보이는 다소 간단하고 저분자량 분자(MW <250Da)를 식별하는 데 일반적으로 사용되는 방법입니다. 1차 스크린으로부터의 초기 히트는 상업적으로 이용가능한 히트의 더 큰 유사체의 2차 스크린을 수행한 다음 화학 기반 단편 성장 또는 연결 전략을 활용하기 위한 기초 역할을 합니다. 성공적인 단편 기반 약물 발견(FBDD) 플랫폼을 위해서는 일반적으로 약한 적중, 단편 라이브러리, 생체 분자 표적 및 후속 화학 전략을 검출하고 특성화하기 위한 강력한 생물물리학적 방법이 필요합니다. 약물 발견 캠페인에서 일반적으로 적용되는 네 가지 생물물리학적 방법은 열 이동 분석, 표면 플라즈몬 공명(SPR), 결정학 및 핵자기 공명 분광법(NMR)입니다.
NMR 분광법은 FBDD의 여러 단계에서 다양한 역할을 나타냈습니다. 최적화된 완충액 시스템에 용해된 단편 라이브러리에서 단편의 화학적 순도 및 용해도를 보장하는 것 외에도, 리간드 관찰 NMR 실험은 낮은 친화력으로 표적에 대한 단편 결합을 검출할 수 있고, 표적 관찰 NMR 실험은 단편의 결합 에피토프를 묘사할 수 있으므로 상세한 구조-활성 관계 연구가 가능합니다. 에피토프 매핑 내에서 NMR 기반 화학적 이동 변화는 오르토스테릭 결합 부위뿐만 아니라 생체 분자 표적의 소위 흥분된 형태 상태에서만 접근할 수 있고 비밀스러울 수 있는 알로스테릭 부위도 식별할 수 있습니다. 생체 분자 표적이 이미 내인성 리간드에 결합하는 경우, 확인된 단편 히트는 NMR 기반 경쟁 실험을 수행하여 알로스테릭 또는 오르토스테릭으로 쉽게 분류할 수 있습니다. 리간드-표적 상호작용의 해리 상수(KD)를 결정하는 것은 FBDD 공정에서 중요한 측면이다. NMR 기반 화학적 이동 적정은, 관찰된 리간드 또는 표적 중 어느 것이든, KD를 결정하기 위해 용이하게 수행될 수 있다. NMR의 주요 장점은 상호 작용 연구가 용액에서 생리적 조건에 가깝게 수행된다는 것입니다. 따라서 표적과의 리간드/단편 상호작용 분석을 위한 모든 구조적 상태를 조사할 수 있습니다. 또한, NMR 기반 접근법은 잘 접힌 가용성 단백질의 스크리닝으로 제한될 뿐만 아니라 DNA, RNA, 막 결합 및 본질적으로 무질서한 단백질을 포함한 더 큰 표적 공간을 수용하기 위해 적용되고 있습니다1.
프래그먼트 라이브러리는 FBDD 프로세스에서 없어서는 안될 부분입니다. 일반적으로, 단편은 초기 전구체로서 작용하며, 이는 결국 생물학적 표적을 위해 개발된 새로운 억제제의 일부(하부구조)가 된다. 여러 약물(베네토클락스2, 베무라페닙3, 에르다피티닙4, 펙시다르닙5)이 단편으로 시작하여 현재 클리닉에서 성공적으로 사용되는 것으로 보고되었습니다. 전형적으로, 단편은 높은 수성 용해도 및 안정성을 갖는 저분자량 (<250 Da) 유기 분자이다. 일반적으로 수백 개의 조각이 포함된 세심하게 제작된 조각 라이브러리는 이미 화학 공간의 효율적인 탐사를 약속할 수 있습니다. 단편 라이브러리의 일반적인 구성은 시간이 지남에 따라 발전해 왔으며 대부분 알려진 약물을 더 작은 조각으로 해부하거나 계산적으로 설계하여 파생되었습니다. 이러한 다양한 단편 라이브러리는 주로 편평한 방향족 또는 헤테로 원자를 포함하며 5 6의 리핀스키 규칙 또는 3 7의 현재 상업적 추세 규칙을 준수하지만 반응성 그룹은 피합니다. 일부 단편 라이브러리는 또한 고용해성 대사산물, 천연물 및/또는 이들의 유도체로 유도되거나 구성되었다8. 대부분의 단편 라이브러리가 제기하는 일반적인 과제는 다운스트림 화학의 용이성입니다.
프랑크푸르트 괴테대학교의 생체분자 자기공명 센터(BMRZ)는 생화학 및 생물의학 연구 분야의 모든 유럽 연구자들을 위한 구조 연구 인프라 컨소시엄인 iNEXT-Discovery(중개 연구-발견을 위한 NMR, EM 및 X-ray를 위한 인프라)의 파트너입니다. 2019년에 종료된 iNEXT의 이전 이니셔티브 내에서 768개의 조각으로 구성된 조각 라이브러리는 넓은 화학 공간을 포괄하는 "최소 조각과 최대 다양성"을 목표로 제작되었습니다. 또한, 다른 단편 라이브러리와 달리 iNEXT 단편 라이브러리는 복잡하고 친화성이 높은 리간드의 다운스트림 합성을 용이하게 하기 위해 "포이즈드 단편"이라는 개념을 기반으로 설계되었으며, 이후 사내 라이브러리(Diamond, Structural Genomic Consortium 및 iNEXT)로 알려져 있습니다.
NMR로 FBDD를 설정하려면 인력, 지식 및 계측이 필요합니다. BMRZ에서는 NMR에 의한 단편 스크리닝에 대한 기술 지원을 지원하기 위해 최적화된 워크플로우가 개발되었습니다. 여기에는 단편 라이브러리(9)의 품질 관리 및 용해도 평가, 선택된 표적에 대한 완충액 최적화, 1H 또는 19F-관찰된 1D-리간드 기반 스크리닝, 오르토스테릭 결합과 알로스테릭 결합을 구별하기 위한 경쟁 실험, 에피토프 맵핑을 위한 2D 기반 표적 관찰 NMR 실험 및 초기 단편 적중의 유도체의 2차 세트와의 상호작용을 특성화하기 위한 것이 포함된다. BMRZ는 이전에 문헌 10,11에서 논의된 바와 같이 소분자-단백질 상호작용의 분석을 위한 자동화된 루틴을 확립했으며 NMR 기반 단편 스크리닝에 필요한 모든 자동화된 인프라를 갖추고 있습니다. 포화 전달 차이 NMR(STD-NMR), 그래디언트 분광법(waterLOGSY)을 통해 관찰된 물-리간드, 광범위한 친화성 영역 내의 단편을 식별하기 위한 Carr-Purcell-Meiboom-Gill 기반(CPMG 기반) 이완 실험을 구현했을 뿐만 아니라 약물 발견을 위한 최첨단 자동 NMR 기기 및 소프트웨어. NMR 기반 단편 스크리닝은 단백질에 대해 잘 확립되어 있지만, 이 접근법은 RNA 및 DNA와 상호 작용하는 새로운 리간드를 찾는 데 덜 일반적으로 사용됩니다. BMRZ는 소분자-RNA/DNA 상호작용을 식별할 수 있는 새로운 프로토콜에 대한 개념 증명을 확립했습니다. 이 기여의 다음 섹션에서는 단백질 및 RNA 샘플에 대한 스크리닝 루틴의 적용이 생체 고분자 연구의 광범위한 사용자 기반에 대해 확립된 프로토콜을 인식하는 것으로 보고되었습니다.
프로토콜
1. 조각 라이브러리
- 사내 조각 라이브러리
참고 : iNEXT의 공동 연구 활동 중 하나의 틀 내에서 견고하고 다운 스트림 화학 친화적 인 1 세대 단편 라이브러리가 개발되었으며12 이후 Enamine과 공동으로 2 세대 라이브러리가 구성되었으며 DSI (Diamond-SGC-iNEXT)-poised fragment library (이하 "사내 도서관"이라고 함)로 알려져 있습니다. 이 라이브러리는 스크리닝 목적으로 BMRZ에서 사용할 수 있습니다.- 이전에 보고된 NMR 기반 프로토콜9을 사용하여 단편 라이브러리의 무결성 및 용해도를 평가합니다.
참고: 사내 라이브러리는 화학적 다양성이 매우 높은 768개의 단편(>200 싱글톤)으로 구성되어 있습니다. 단편 혼합물에서 스크리닝을 수행하면 스크리닝 캠페인 속도를 크게 높일 수 있습니다. 그러나 믹스의 단편 수는 1H-NMR 스펙트럼의 신호 중첩으로 인해 제한됩니다. 사내 라이브러리가 제공하는 더 높은 화학적 다양성은 1H관찰 NMR 스펙트럼에서 상당한 화학적 이동 중첩 없이 12개의 서로 다른 단편을 포함하는 혼합물의 제조를 가능하게 합니다. - 768 개의 단편 중 103 개의 단편은 불소 원자를 가지고 있습니다. 19F스크리닝 목적을 위해 불소기를 가진 103개의 단편을 모두 최소 19F화학적 이동 중첩을 기준으로 5개의 혼합물로 나눕니다. 19F스크리닝에서 신호 중복을 최소화하려면 단일 화합물 측정의 화학적 이동 정보를 사용하여 최대 조각 수와 최소 신호 중첩으로 혼합물을 설계합니다. 각 혼합물에는 뚜렷한 19F화학적 이동이 있는 20-21개의 단편이 있어 단편을 명확하게 할당할 수 있습니다.
- 이전에 보고된 NMR 기반 프로토콜9을 사용하여 단편 라이브러리의 무결성 및 용해도를 평가합니다.
- 사용자 정의/제공 조각 라이브러리
- 사용자가 정의하거나 제공한 조각 라이브러리로 스크리닝 캠페인을 수행합니다. 그러나 심사 캠페인에 앞서 다음 단계를 거쳐야 합니다.
- 사용자가 사전에 지정하지 않은 경우 단편의 NMR 기반 품질 관리를 수행합니다(BMRZ에서는 이를 위해 고급 소프트웨어 도구가 사용됩니다. 9, 6.1.1장).
- 사용하기 전에 생체 분자 표적, 구조 무결성 및 단편 농도에 대해 선택한 완충액에서 단편의 용해도를 확인하십시오.
- NMR 스펙트럼과 측정 시간에서 신호 중첩을 모두 줄이도록 혼합물을 설계합니다.
- 4.2 단계에 따라 혼합물을 설계합니다.
- 전체 라이브러리 대신 단일 조각 또는 혼합물의 하위 집합을 스크리닝합니다.
2. 시료 전처리
참고: NMR에 의한 고처리량 스크리닝은 샘플 준비를 위해 피펫팅 로봇을 활용합니다. NMR 스펙트럼뿐만 아니라 단백질, RNA 및 DNA의 신호 획득 수일에 걸친 안정성은 온도 변동에 매우 민감하므로 온도 제어 자동화 시스템은 피펫팅되는 샘플의 안정성을 크게 촉진합니다. 이를 위해 4 내지 40 °C 사이에서 작동하는 추가 애드온 장치가 온도 제어 환경에서 NMR 샘플의 액체 처리를 위해 피펫팅 로봇에 결합됩니다.
- 리간드 혼합물 제조
- 샘플 준비 로봇을 사용하여 NMR 측정을 위한 스크리닝 샘플을 준비합니다. 로봇의 유연한 구성으로 다양한 응용 분야(예: NMR 튜브에서 저장 용기로 샘플 회수 또는 일반적인 액체 처리 작업)가 가능합니다. 직경이 다른 NMR 튜브 (1.7, 2.0, 2.5, 3.0 및 5.0 mm)를 사용할 수 있습니다. 샘플 로봇 시스템은 고급 제어 소프트웨어와 함께 각 용기 유형에 할당된 바코드를 판독하고 액체 충전 프로토콜을 최적으로 실행합니다.
- 사내 라이브러리 리간드 혼합물을 준비하려면 바코드 바이알을 사용하십시오. 바코드 처리된 바이알은 최고 수준의 신뢰성과 시료의 최적 추적성을 보장합니다.
- 768개의 화합물을 96웰 형식의 플레이트 8개에 분배합니다. 각 개별 단편의 스톡 농도는 d6-DMSO/D2O(9:1)에서 50mM입니다. 총 12 개의 단편을 포함하는 64 개의 혼합물을 준비하십시오. 혼합물에서 각 단편의 최종 농도는 4.2mM입니다.
참고: 피펫팅 로봇은 다양한 형상(극저온 또는 자동 샘플러 바이알, 원형 또는 정사각형 깊이의 96웰 플레이트, 바코드 표준 바이알, 미세 원심분리기 튜브)을 가진 다양한 용기 유형을 수용할 수 있으며 다양한 NMR 튜브 및 랙으로 액체를 효율적으로 이송하는 데 도움이 됩니다.

그림 1: (A) BMRZ에 설치된 고처리량 NMR 샘플 준비 및 NMR 튜브 충전 로봇. (B) BMRZ 시설의 600MHz 분광계에 개별 온도 제어 랙이 설치된 고처리량 샘플 교환기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 스크리닝 샘플 준비 블랭크(reference ligand spectrum) 및 표적(표적 존재 시 리간드)
- NMR 스크리닝 샘플의 준비를 위해 표적 생체 분자(단백질/RNA/DNA)와 리간드 혼합물이 있는 상태에서 표준 NMR 튜브의 Bruker NMR 포트폴리오에서 선택한 3mm NMR HT 샘플 체인저 튜브를 사용합니다.
- 정의된 스크리닝 버퍼의 생체 분자 표적(예: 1시간 스크리닝: 10μM RNA 또는 단백질)을 수동으로 또는 피펫팅 로봇을 사용하여 3mm NMR 튜브(최종 부피 200μL)로 옮깁니다.
- 로봇 시스템을 사용하여 다음 단계에서 리간드 혼합물 10μL(예: 1H스크리닝)를 표적 생체분자가 포함된 바코드화된 3mm NMR 튜브로 옮기고 제어 소프트웨어의 내장 프로토콜을 사용하여 혼합합니다.
참고: NMR 튜브의 바코드 번호는 획득한 NMR 데이터 세트에 편리하고 자동으로 통합되므로 혼동 없이 ID 지향 워크플로를 보장합니다. 피펫팅 로봇 온도 제어 액세서리를 사용하면 NMR 튜브에 준비된 샘플을 일정한 온도로 보관할 수 있습니다.
- 사내에서 정의한 조건 및 매개변수
- 사내 단편 라이브러리에 대해 RNA 및 단백질의 스크리닝을 수행하기 위한 최적의 완충 조건을 설정합니다. BMRZ에서 RNA에 대해 컨디셔닝된 다음 샘플이 사용됩니다: 25mM KPi, 50mM KCl, pH 6.2. Mg2+ 는 선택 사항입니다.
- 단백질은 용액 조건에 매우 민감합니다. 선택한 대상에 가장 적합한 버퍼를 사용합니다. 이러한 버퍼 각각에 대해 분석을 위한 블랭크 역할을 할 리간드의 추가 참조 스펙트럼을 획득합니다.
- 사용자 지정 조건
참고: 사내에서 설정한 조건이 잠재적 사용자로부터 대상을 선별하는 데 적합하지 않은 경우 다음 단계를 구현해야 합니다.- 리간드 관찰 스크리닝 실험을 수행 및 분석함에 있어서 완충액의 성분으로부터의 간섭을 최소화하기 위해 완충액 단독의 1H-NMR을 수행한다. 간섭 성분은 중수소화 등가물로 적절하게 대체될 수 있다.
- 시료 생산(목표량)/조건 및 가용성의 한계
참고: 특정 생체고분자의 분리 또는 재조합 생산은 경우에 따라 어려울 수 있으며 성공적인 약물 스크리닝 캠페인을 추구하기 위한 표적의 가용성이 제한될 수 있습니다. 표적의 가용성이 제한적이거나 무제한인 경우 성공적인 NMR 기반 단편 스크리닝을 수행하기 위해 다음 대안을 사용할 수 있습니다.- 제한되는 경우 19F-NMR 기반 스크리닝을 사용하십시오. 전형적인 플루오르화 리간드는 단일 19F신호를 가지며; 따라서 신호 겹침없이 25-30 개의 조각이있는 칵테일을 사용하십시오. 분석할 신호가 적고, 버퍼 구성 요소의 신호 간섭이 없으며, 히트 식별에 의존해야 하는 신호가 더 적습니다.
- 무제한인 경우 1H-NMR과 같은 더 큰 화면을 사용하십시오. 더 큰 조각 라이브러리를 스크리닝할 수 있습니다. 일반적으로 단편은 둘 이상의 양성자로 구성되며, 이는 분석에 의존해야 하는 신호가 더 많다는 것을 의미합니다.
3. NMR 획득 조건
- 사내 일반적으로 정의된 조건
- HT 자동 시료 주입기가 장착된 분광계(자동화)
- 고처리량 스크리닝의 경우, HT 샘플 교환기를 사용해서만 측정할 수 있는 96웰 플레이트를 사용하십시오. HT 자동 시료 주입기는 각 랙을 개별적으로 템퍼링할 수도 있습니다.
- 최적의 신호 대 잡음비를 위해 헬륨 또는 질소 냉각된 극저온 프로브가 있는 분광계를 사용하십시오. 자동화를 위해서는 자동 튜닝 및 매칭 모듈(ATM)이 필요합니다.
- 파라미터 세트 & 펄스 시퀀스
참고: 많은 NMR 실험에서 결합 이벤트를 특성화할 수 있습니다. 적중 식별은 실험 설정에 따라 다릅니다. 다음 실험은 BMRZ 스크리닝 캠페인에서 일상적으로 사용됩니다. 그럼에도 불구하고 사용자 정의 스크리닝 캠페인에 대해 사용자 사양에 따라 변경할 수 있습니다.- TopSpin 소프트웨어를 사용하는 경우 리간드 기반 실험을 위한 파라미터 세트(SCREEN_STD, SCREEN_T1R, SCREEN_T2 SCREEN_WLOGSY)를 포함합니다. 매개변수 세트에는 필요한 모든 매개변수와 펄스 시퀀스가 포함됩니다: STD: stddiffesgp.3; T1ρ: t1rho_esgp2d; T2: cpmg_esgp2d; 및 waterLOGSY: ephogsygpno.2.
- 나열된 모든 실험에 대해 여기 조각13 을 물 억제로 사용합니다. 참고로 1D 여기 조각(zgesgp)을 사용합니다. 스캔 횟수는 시스템의 감도(자기장 강도 및 프로브 헤드), 샘플 농도 및 실험 선택에 따라 다릅니다. 권장 사항은 NS = 64 인 1D, NS = 128 인 T1ρ & T2 , NS = 256 인 STD 및 NS = 384 또는 512 인 waterLOGSY입니다.
- 19F스크리닝의 경우 1D 및 T2 실험을 모두 사용합니다: 1D: 19F{1H}-프로브 헤드의 경우 F19CPD(pp=zgig) 및 19F/1H-프로브 헤드의 경우 F19(pp=zg); SCREEN_19F_T2 (pp = cpmgigsp)입니다.
- 스펙트럼 폭은 220ppm이고 여기 주파수는 -140ppm입니다. 실험 시간은 하드웨어 및 샘플 농도에 따라 1시간에서 5시간 사이입니다(생체 거대분자의 장기 안정성 보장). T2의 경우 CPMG 시간은 0ms와 200ms 사이에서 번갈아 가며 사용해야 합니다.
- 가공
- STD,T1ρ 및T2 실험을 의사 2D로 기록한다. 두 개의 단일 1D 스펙트럼을 처리하기 위해 IconNMR은 옵션 relax가 있거나 없는 au 프로그램 proc_std 사용합니다. 첫 번째 옵션은 기준 1D와 두 스펙트럼의 차이를 제공합니다. 두 번째 옵션은 이완 시간이 짧고 긴 두 개의 개별 스펙트럼을 생성합니다. waterLOGSY는 용매 신호에 대해 음수로 단계적으로 처리되어야 하는 단일 1D입니다.
- HT 자동 시료 주입기가 장착된 분광계(자동화)
- 사용자별 조건
- 앞서 언급한 매개 변수를 사용자 정의 조건에 맞게 조정합니다. 예를 들어, 시설 사용자가 제공한 단백질이 일반적으로 사용되는 온도에서 안정적이지 않은 경우 최적화 실험을 다양한 온도, 농도, 완충액 조건 등으로 수행할 수 있습니다.
4. 데이터 분석
- 절편 라이브러리 QC(d6-DMSO/특이적 완충액) 및 정량
- CMC-q
참고: 스크리닝 캠페인을 시작하기 전에 조각 라이브러리의 품질 관리가 필수적입니다. 또한, 여러 심사 캠페인의 적용을 위해 단편 도서관의 장기적인 안정성이 보장되어야 하며, 이것이 도서관의 품질에 대한 주기적인 평가가 수행되어야 하는 이유입니다. 이를 위해 TopSpin의 통합 소프트웨어 CMC-q 및 CMC-a가 품질 및 수량 평가에 사용됩니다. CMC-q 및 CMC-a는 작은 유기 분자 9에서 얻은 1H-NMR 스펙트럼을 사용하여 구조 검증을 포함한 원활한 획득, 분석을 가능하게 하는 Topspin 내의 소프트웨어 모듈입니다.- 무결성을 위해 d6-DMSO에서 1mM의 단편 농도로 평가 샘플을 준비합니다. 액체 샘플 수집을 3mm NMR-튜브에 채워 피펫팅 로봇으로 자동화된 방식으로 샘플을 준비합니다.
- 용해도 평가를 위해 pH 7.4의 50mM 인산나트륨 완충액에 1mM 화합물, 150mM 염화나트륨, 90% H2O/10%D2O및 1mM의 3-(트리메틸실릴)프로피온-2,2,3,3-d4 산성 나트륨 염(TMSP-Na)으로 구성된 샘플을 사용합니다.
- 삼중 공명 5mm TCI 극저온 프로브와 HT 샘플 체인저가 장착된 600MHz NMR 분광계를 사용하여 298K 또는 293K에서 NMR 스펙트럼을 수집하며, 한 번에 579개의 샘플을 처리할 수 있습니다.
- CMC-q 소프트웨어를 설정하려면 IconNMR 사용자 생성, FastLaneNMR 활성화 및 HT 샘플 교환기 변경을 구현하는 사용자 매뉴얼의 지침을 따르십시오.
- 90° 펄스를 보정하고 TopSpin prosol 테이블에 저장합니다.
- 96 샘플 웰 플레이트를 HT 샘플 체인저의 5개 랙 위치 중 하나에 놓습니다.
- 제안된 화학 구조, 고유 식별자 및 배치에서 각 샘플의 HT 샘플 교환기 위치를 포함해야 하는 SDF 파일(구조 데이터 파일)을 로드하려면 CMC-q 설정 창에서 찾아보기 로 이동하고 .sdf로 끝나는 파일을 선택한 후 열기 를 클릭합니다.
- CMC.q 배치 자동화 설정에서 측정할 실험을 정의하는 검증 유형인 IconNMR 사용자를 설정하고 용매를 정의합니다.
- SDF 파일의 경로, 분자 ID 및 샘플 위치에 대한 SDF 파일을 정의합니다.
- 시작을 클릭하여 획득을 시작합니다. 획득 시작을 다시 클릭합니다. CMC-q 설정은 저장을 클릭하여 저장할 수도 있습니다.
- CMC-q 설정 단계에 대한 자세한 설명은 Bruker의 사용 설명서 지침을 따르십시오.
- CMC-a
- CMC-a의 경우, 작은 유기 분자9에서 얻은 1H-NMR 스펙트럼을 사용하여 구조 검증을 포함한 분석을 가능하게 하는 Topspin 내의 소프트웨어 모듈을 사용하십시오.
- CMC-q
- 혼합물 설계
참고: 적절한 혼합물 설계는 NMR을 플랫폼으로 사용하여 스크리닝하는 데 중요한 역할을 합니다. 혼합물당 많은 수의 절편을 사용하면 더 빠른 스크리닝이 가능하지만 위양성 및 음성의 위험이 증가합니다. 숫자가 낮을수록 위험은 감소하지만 스크리닝을 수행하는 데 걸리는 시간이 늘어납니다. 일반적으로 혼합물을 만들 때 신호 겹침을 피해야 합니다. 사내 라이브러리를 사용하면 라이브러리가 다양하고 높은 화학적 다양성을 유지하면서 신호 중복이 거의 없도록 특별히 설계되었기 때문에 1시간 스크리닝에서 이를 무시할 수 있습니다. 이는 64개의 믹스를 만들기 위해 특별한 설계 절차를 거칠 필요가 없음을 의미합니다.- 19F스크리닝은 불소를 함유한 사내 라이브러리의 단편에 의존하고 라이브러리는 이러한 특정 단편에 대한 신호 중첩을 줄이기 위해 생성되지 않았으므로 적절한 혼합물을 설계합니다.
- 19F를 함유하는 모든 단편에 대한 단일 화합물 스펙트럼을 측정합니다.
- 각 신호의 화학적 이동 정보를 확인합니다.
- 이 정보에 따르면 혼합물 당 20-21 개의 단편을 선택하십시오. 이것은 차례로 신호 겹침이 없는 20-21개의 단편을 포함하는 5개의 혼합물을 제공하고 데이터의 반자동 분석을 가능하게 합니다.
- 관찰된 생체거대분자-리간드 상호작용 내에서 적중 식별 수행
참고: 19F와 1H스크리닝 절차 사이에는 히트에 대한 정의가 다릅니다. 다음 히트 식별은 당사에서 설정했으며 특정 규칙을 따릅니다. 적중 판정의 주제는 매우 주관적인 방식이며 사용자마다 다를 수 있습니다. 그럼에도 불구하고 적중 식별에 대한 규칙은 검증과 신뢰성을 유지하기 위해 합의된 후에는 변경되지 않는 것이 가장 중요합니다.- 1H 스크린
- 적중을 자신 있게 결정하기 위해 바인더를 식별하기 위해 표적의 존재 및 부재 모두에서 1D 1H스펙트럼, waterLOGSY 및T2 이완 실험을 획득합니다. 세 가지 실험 모두 결합 이벤트를 보여줄 가능성이 있습니다. 블랭크 스펙트럼과 비교하여 샘플 스펙트럼에서 6Hz 이상의 CSP를 볼 수 있는 경우 이는 히트에 대한 표시로 간주됩니다. waterLOGSY에서 강한 양의 신호뿐만 아니라 샘플 스펙트럼의 30% 이상의T2 감소가 보이는 경우에도 마찬가지이다. 결합 이벤트는 스펙트럼을 포함하는 샘플을 각각의 블랭크 스펙트럼과 비교할 때 세 가지 실험 모두에서 나타날 수 있습니다. 그러나 결합 이벤트는 세 가지 실험 모두에서 보이지 않을 수 있습니다. 이 때문에 조각을 바인딩 히트로 분류하기 위해 앞서 설명한 이벤트 중 적어도 두 가지가 발생해야한다는 데 동의했습니다.
- TopSpin의 FBS 도구를 사용하여 조각의 상태를 바인딩, 모호함, 알 수 없음, 집계 및 바인딩되지 않음으로 정의합니다.
- 믹스가 끝나면 FBS 도구 내에서 승인합니다.
- FBS 프로젝트 내의 요약 탭에서 스크리닝 보고서 만들기를 클릭합니다. 그러면 .xlsx 파일을 만드는 창이 열립니다. 그런 다음 사용자는 모든 리간드, 결합 리간드 전용, 결합 리간드 만 아님 및 스프레드시트에 보고될 모호한 리간드 중에서 선택할 수 있습니다.
- 19F 스크린
- 비바인더, 주 바인더 및 스트롱 바인더를 구별하기 위해 200ms 목표 측정과 200ms 공백 측정 간의 적분 몫을 0ms 목표 측정의 몫으로 나누고 0ms 공백 측정이 사용됩니다.
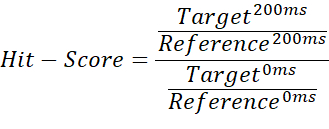
참고: 이렇게 하면 0에서 ~1(적중 점수) 범위의 값이 제공되어 각 바인딩 상태에 대한 임계값을 할당할 수 있습니다. - 참조 200ms 측정의 평균을 기준 임계값으로 사용하여 적중 점수가 1을 초과하는 사례를 표시합니다. 이는 가져온 적분에 음수 값이 포함되어 있거나 기준 측정값이 목표 측정값보다 높은 경우에 발생할 수 있습니다. ≤ 0.67의 적중 점수는 약한 안타로 간주< 0.33은 강한 안타로 간주되며 0.67> 것은 노히트로 간주됩니다. 그림 2에 예가 나와 있습니다.
- 비바인더, 주 바인더 및 스트롱 바인더를 구별하기 위해 200ms 목표 측정과 200ms 공백 측정 간의 적분 몫을 0ms 목표 측정의 몫으로 나누고 0ms 공백 측정이 사용됩니다.
- 1H 스크린
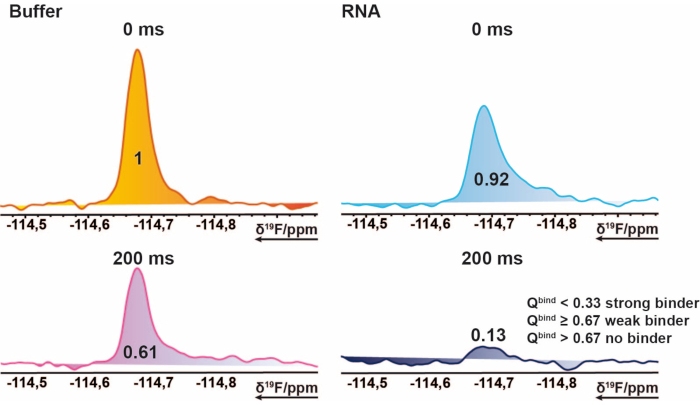
그림 2: 19F스크리닝을 위한 히트 식별. 예시적인 화합물의 19FCPMG NMR 스펙트럼의 절편. 이 그림 표현은 바인더의 특성을 설명합니다. 19RNA의 존재 및 부재 하에서 혼합물 샘플에서 획득된 화합물의 F-CPMG 스펙트럼. 이 값들은 대응하는 피크의 정규화된 적분 값을 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 데이터 분석
- 분석용 데이터 준비
참고: 획득한 데이터에 눈에 띄는 결함이 없는 것이 중요합니다. 즉, shimming에 문제가 있거나 물 억제가 불충분한 데이터는 분석을 위해 고려해서는 안 됩니다. 오히려 데이터를 다시 기록하고 샘플(예: 기포 없음), 온도, 시밍 및 수분 억제와 함께 모든 것이 정상인지 확인하는 것이 좋습니다. 데이터 정확성은 DMSO 신호를 비교할 때 항상 평가할 수 있습니다. - 1H 스크리닝
- 1시간 스크리닝 데이터를 분석하려면 TopSpin 4.0.9에서 FBS 도구(추가 라이선스 필요)를 사용하십시오.
- FBS 도구 설명서의 지침에 따라 데이터 분석을 시작합니다. 다음 단계는 설명서에 보고된 절차를 요약한 것입니다.
- 스크리닝 캠페인의 BMRZ NMR 데이터를 저장하여 각 스크리닝 혼합물이 샘플에서 측정된 다양한 실험을 보유하는 하위 디렉토리를 갖도록 합니다.
- FBS 도구를 사용하려면 생체 분자 표적이 없는 샘플에서 저장된 모든 데이터가 있는 참조 스펙트럼을 저장하지만 혼합물과 함께 다른 /nmr 디렉토리에서 측정된 단일 화합물을 저장합니다. 이것은 FBS 도구가 각각의 디렉토리 경로를 개별적으로 요청하기 때문에 중요합니다.
참고: FBS 도구는 다음 데이터 세트가 스크리닝 샘플의 혼합물이 저장된 동일한 디렉토리에 저장된 경우 디렉토리를 스크리닝 프로젝트로 인식합니다(csv, FragmentScreen XML 문서 및 BAK 파일). - TopSpin 4.0.9를 사용할 때 수집 된 데이터가 포함 된 디렉토리에 대한 직접 경로 (소위 DIR)를 만듭니다. 모든 혼합물에 고유 한 디렉토리가 있어야하는 / nmr 디렉토리를 선택하십시오.
- 스크리닝된 샘플의 FBS 도구를 시작하려면 FBS 프로젝트 기호를 TopSpin 창의 가운데로 끕니다. 선택한 디렉토리에서 FBS 프로젝트 심볼은 이전에 말한 데이터 세트가 복사된 경우 나타나야 합니다.
- Fragment Based Screening Options 창은 새 FBS 프로젝트를 처음 로드할 때 자동으로 열립니다. 이 창에서 칵테일 파일을 선택합니다. 칵테일 파일은 믹스 이름, 각 조각의 이름 및 믹스로의 분할을 포함하는 csv 파일입니다. 또한 단일 단편의 모든 측정된 스펙트럼을 갖는 참조 리간드 스펙트럼 폴더를 정의한다. 마지막으로, 참조 빈 실험 폴더를 정의합니다.이 폴더는 일반적으로 조사 된 목표가없는 믹스의 데이터 세트를 포함하는 폴더입니다.
- Fragment Based Screening Options에는 조사된 스펙트럼과 스펙트럼을 표시하기 위한 색상을 정의할 수 있는 스펙트럼 유형 이라는 탭이 있습니다. 미리 처리된 데이터에 따라 Spectype을 설정합니다. Display layout 탭에서 spectypes에 따라 서로 비교할 스펙트럼을 정의합니다.
- 확인을 눌러 FBS 프로젝트를 시작합니다.
- 데이터를 보는 동안 별도의 창이 열리고 모든 칵테일 믹스와 각 믹스의 모든 리간드가 테이블에 요약됩니다. 셀을 두 번 클릭하면 각 데이터 세트가 열리고 예를 들어 1H 1D 빈 스펙트럼을 타겟이 포함된 데이터 세트와 비교합니다.
- 바인더를 할당하기 전에 기준 피크(단일 화합물뿐만 아니라 모든 측정의 DMSO)가 서로 일치하고 화학적 이동이 동일한지 확인하십시오. 차이점이 관찰되면 TopSpin의 직렬 처리 옵션을 사용하여 수정하십시오.
- Serial Processing 옵션은 Advanced(고급)의 Process(프로세스) 탭 아래에 있습니다. 데이터 세트에서 선택한 모든 스펙트럼에 변경 사항을 적용합니다. 이러한 방식으로 Spectype을 실험 번호에 쉽게 할당할 수 있으며 모든 스펙트럼을 한 번에 이동하여 참조에 맞출 수 있습니다.
- 19F 스크리닝
- 19F혼합물에 대한 첫 번째 분석의 경우 각 혼합물에 대한 통합 파일을 만듭니다. 통합 영역을 정의하려면 Analyse(분석) 탭에서 Integrate(통합) 기능을 클릭합니다. 혼합물의 모든 단편에 대해 해당 19F-singal에 대한 명확한 통합 영역이 정의되어 있는지 확인하십시오.
- 통합 영역 저장/내보내기 버튼을 사용하여 나중에 사용할 수 있도록 통합 파일을 내보냅니다. 사용된 통합 파일을 C:\Bruker\TopSpin4.0.9\exp\stan\nmr\lists\intrng 또는 TopSpin 설치 디렉토리의 해당 경로에 저장합니다.
- 19F데이터의 경우 조사된 대상과 함께 또는 조사된 대상 없이 데이터 세트를 엽니다.
- 통합 파일을 현재 스펙트럼에 로드하려면 분석 탭을 다시 열고 통합으로 이동한 다음 통합 영역 읽기/가져오기 버튼을 사용하여 해당 통합 파일을 로드합니다. 이렇게 하면 해당 파일의 정의된 영역이 현재 스펙트럼에 로드됩니다.
- 저장하고 돌아와서 적분 탭에서 모든 통합 영역 목록을 찾습니다. 이것을 스프레드시트나 데이터의 추가 분석에 사용되는 다른 도구에 복사합니다.
- 타겟이 있거나 없는 모든 믹스에 대해 이 절차를 반복합니다.
- 데이터 관리
- 사용 편의성과 생산성을 위해 수집된 데이터의 추가 분석 및 저장을 위해 균일한 작업 흐름을 설정합니다. 1H및 19F스크리닝 모두에 대해 각각에 대해 특별히 설계된 스프레드시트를 사용하십시오.
참고: 1시간 스크리닝의 경우 이것은 순전히 데이터 관리 및 각 대상을 요약하는 데 사용되었으며 19F스크리닝의 경우 4.3장에서 설명한 몫을 사용하여 적분 데이터가 복사된 후 각 단편을 적중/적중 없음으로 자동 레이블을 지정했습니다. 이렇게 하면 파일이 올바르게 설정되었다고 가정할 때 분석 중에 인적 오류의 위험이 줄어들고, 데이터를 처음 보기 위한 추가 프로그램 없이 거의 모든 사람이 열 수 있는 파일의 모든 중요한 정보가 한 곳에 수집되므로 정보 공유가 더 쉬워집니다.
- 사용 편의성과 생산성을 위해 수집된 데이터의 추가 분석 및 저장을 위해 균일한 작업 흐름을 설정합니다. 1H및 19F스크리닝 모두에 대해 각각에 대해 특별히 설계된 스프레드시트를 사용하십시오.
- 분석용 데이터 준비
결과
조각 라이브러리의 품질 관리
사내 라이브러리로부터의 단편은 90% d6-DMSO 및 10% D2O 중 50 mM 원액으로서 전달되었다 (10%D2O는 반복적인 동결-해동 사이클로 인한 화합물 분해의 최소화를 보장한다14). 단일 화합물 샘플은 50 mM 포스페이트 완충제 (25 mM KPi pH 6.2 + 50 mM KCl + 5 mMMgCl2), 90% H2O/9% D2O/1% d6-DMSO 중 pH 6.0 중 1 mM 리간드로 구성되었다. 1iNEXT 라이브러리로부터의 단편의 H-NMR 실험은 500/600 MHz NMR 분광계에서 측정하였다. 이 데이터는 사용자가 자동화된 방식으로 스펙트럼을 완전히 획득할 수 있도록 하는 CMC-q 소프트웨어를 사용하여 1시간 스크리닝 캠페인에서 단일 화합물을 식별하는 데 추가로 사용되었으며 분석 애드온 CMC-a단편의 품질(용해도 및 무결성)을 평가했습니다. CMC-a의 자동 분석 결과는 그림 3에 표시된 것과 유사한 그래픽 출력으로 표시됩니다. 그래픽 출력은 96웰 플레이트의 표현을 보여줍니다. 빨간색 원은 이 조각이 구조나 농도에 불일치를 나타낸다는 것을 의미합니다. 녹색 우물은 조각이 일관성이 있음을 나타냅니다.
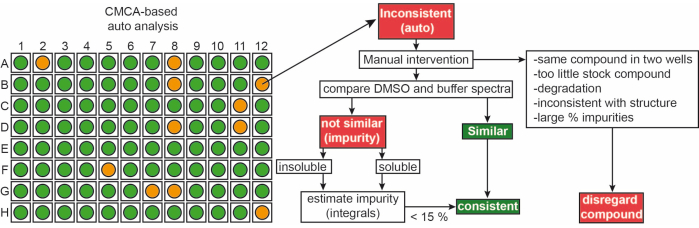
그림 3: 조각 라이브러리의 품질 관리. CMC-a 기반 자동 출력의 개략도. 농도 및 구조적 무결성과 같은 단편 특성이 평가됩니다. 녹색은 일관성을 나타내고 주황색은 일관성이 없음을 나타냅니다. 일관되지 않은 조각은 표시된 워크플로우에 따라 수동으로 수정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
대략적으로, 단편의 65% 및 35%는 DMSO 및 완충액 둘 다에서 각각 일관성 및 비일관성으로 분류되었다. 또한, 일관되지 않은 분류된 리간드의 30%는 스펙트럼9의 신중한 수동 검사 후에 일관되게 변했습니다.
19F혼합물 디자인
사내 라이브러리에서 하나 또는 여러 개의 불소기를 포함하는 103개의 단편을 5개의 혼합물(A, B, C, D, E)로 분할했습니다. 각 믹스에는 20-21 개의 단편이 있습니다. 이 경우 혼합물은 신호 겹침을 피하기 위해 신중하게 설계되어야 했습니다. 19F 횡방향 이완 실험은 CPMG 펄스 트레인을 적용하는 각 혼합물에 대해 측정되었다. 이러한 실험은 완화 지연을 변화시킴으로써 수정될 수 있다. 혼합물 AE의 19F화학적 이동은 그림 4에서 볼 수 있습니다.
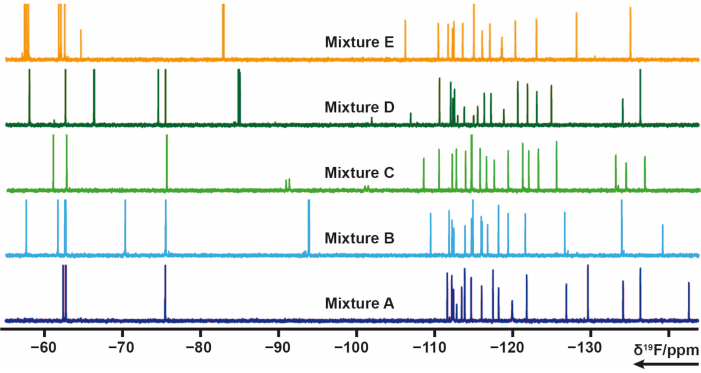
그림 4 : 사내 라이브러리의 혼합물 샘플의 19F 1D-NMR 스펙트럼. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
시료 전처리
19F스크리닝 절차의 샘플 준비는 수동으로 수행되거나 피펫팅 로봇을 사용한 자동 피펫팅으로 수행되었습니다. 각각의 혼합물 중의 단편은 90% d6-DMSO 및 10%D2O중 2.5 mM의 농도를 가졌다. 스크리닝 샘플의 최종 부피는 170 μL였으며 5%D2O를 잠금제로서 사용하였다. 각 혼합물을 두 번 피펫팅했는데, 하나는 완충액 함유 용액(표적 없음)에, 다른 하나는 완충액 함유 표적에 넣었다. 표적과 절편의 비율을 1:1로 설정하여 최종 표적/리간드 농도가 50μM이 되었습니다. 또한 대조군 시료는 표적 무결성을 보장하기 위해 혼합물 없이 선별 완충액에서 표적 생체분자를 스크리닝하고, 완충액 품질을 보장하기 위해 완충액과D2O만 있는 대조군 시료입니다.
19F-1D및 19F-CPMG-T2의 NMR 스크리닝 데이터는 섹션 3.1에 기재된 바와 같이 측정하였다. 예를 들어, RNA의 경우 완충액의 단일 표적 샘플에 대해 점프-리턴 에코 서열(pp = zggpjrse,15)을 획득했습니다.
데이터 분석
19F스크리닝 절차는 몇몇 다른 표적 중에서 대장균의 TPP 리보스위치 thiM 및 M. tuberculosis의 단백질 티로신 키나아제(PtkA)에 적용되었습니다(16). 19F 스크리닝 라이브러리에는 Mix A에서 E까지 라벨링된 5개의 Mix로 분할된 103개의 단편이 있습니다. 스크리닝 샘플의 준비는 샘플 피펫팅 로봇을 사용하지 않고 수동으로 수행할 수 있습니다. 40 μM thiM RNA 함유 용액 (완충액 조건)을 혼합물로부터의 3.2 μL와 혼합하였다. 추가의 대조군 샘플은 완충액만, 5%의 DMSO를 갖는 완충액(이전에는 원하는 DMSO 농도의 존재 하에서 생체거대분자의 안정성을 보장함) 및 RNA를 갖는 완충액으로 구성되었다. 이 13개의 스크리닝 샘플을 준비하여 3mm NMR-튜브로 옮겼습니다. NMR 튜브의 바코드는 RNA의 존재 및 부재 하에서 각각의 혼합물을 주사하고, 대조군 샘플뿐만 아니라 298 K에서 수행된 전술한 19FNMR 실험에 따라 측정하였다. 사내 라이브러리에 대한 thiM RNA의 스크리닝은 각각의 상이한 샘플에 대해 0 ms 및 200 ms의 CPMG로T2 측정을 수행함으로써 수행하였다. 모든 샘플에 대해 추가로 측정된 1H 1D실험의 라인 넓힘 및 강도 손실 측면에서 모든 DMSO 피크를 비교하여 측정을 마친 후 적절한 shimming 및 수분 억제를 모니터링했습니다. 수득된 CPMGT219F이완 스펙트럼의 처리는 각각 TopSpin에서 미리 제조되고 자동화된 매크로를 사용하여 수행되었다. 데이터 분석은 프로토콜 섹션의 지침에 따라 수행되었습니다. TopSpin에서 얻은 적분 데이터(프로토콜의 지침에 따름)는 올바른 조건과 임계값을 설정하여 미리 만들어진 스프레드시트 또는 유사한 프로그램을 사용하여 빠르고 쉽게 평가할 수 있습니다. 앞에서 설명한 대로 임계값은 바인더, 약한 바인더 또는 비바인더를 정의하는 데 유용합니다. 도 5는 각각 thiM RNA 및 PtkA의 CPMG 스펙트럼의 전형적인 결과를 보여준다. 어떤 경우에는 추가 전문가 수정이 필요했습니다.
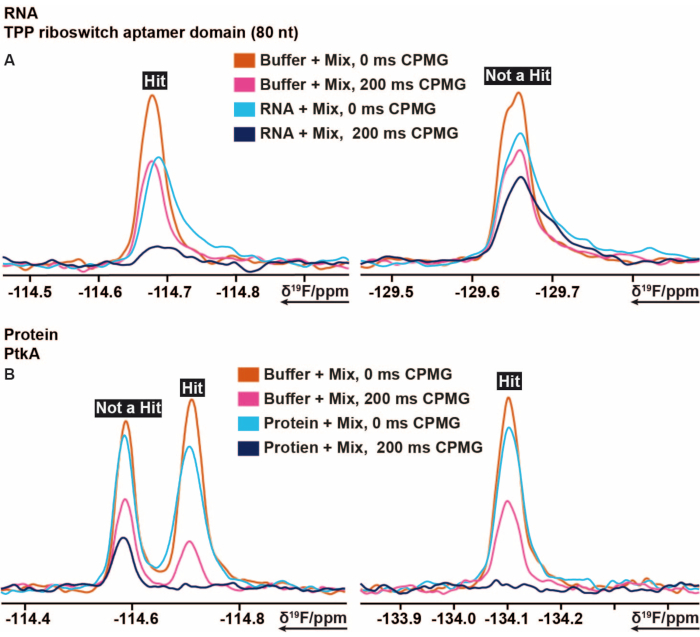
도 5: CPMG 기반 실험의 상이한 지연 시간으로부터 얻어진 강도 변화를 보여주는 19F CPMG NMR 스펙트럼 중 컷아웃. (A) E. coli로부터의 TPP riboswitch thiM RNA에 대해 수행된 19F단편 기반 스크리닝에서의 결합제(hit) 및 비결합제의 표현. (B) M. tuberculosis의 PtkA에 대해 수행된 19F단편 기반 스크리닝에서 결합제 및 비결합제의 표현. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1시간 스크리닝
혼합물 설계
사용된 사내 라이브러리는 매우 다양하여 1시간 스크리닝 목적으로 혼합물 설계가 수행되지 않았습니다. 이는 하나의 혼합물에서 혼합할 12개를 무작위로 선택하여 64개의 혼합물을 준비했음을 의미합니다.
시료 전처리
예시적인 SARS-CoV-2 RNA의 1시간 스크리닝을 위해, 샘플을 준비하기 위해 피펫팅 로봇을 사용한 자동 피펫팅을 수행하였다. 각각의 혼합물 중의 단편은 90% d6-DMSO 및 10%D2O중 4.2 mM의 농도를 가졌다. 스크리닝 샘플의 최종 부피는 200 μL였으며, 5%D2O를 잠금제로서 사용하였다. pH 6.2에서 25 mM KPi, 50 mM KCl의 상이한 혼합물을 각각 함유하는 64개의 샘플을 표적 RNA 없이 피펫팅하였다. 각각, 64개의 샘플을 각각 다른 혼합물을 함유하는 표적 RNA로 피펫팅하였다. RNA:리간드 비율을 1:20으로 설정하여 RNA 농도는 10μM, 리간드 농도는 200μM가 되었습니다.
데이터 분석
1시간 분석을 위해 TopSpin의 FBS 도구가 사용되었습니다. 단편이 적중인지를 결정하기 위해, 1D 화학적 이동, waterLOGSY, 및T2 완화 실험을 수행하였다. T2 완화의 경우, 30 % 초과의 강도 감소가 히트로 계산되었고, 화학적 이동의 경우 6Hz 초과의 이동이 컷오프 (cut-off)였다. waterLOGSY는 상당한 신호 변화(이 경우 음수에서 양수로)를 보여야 했습니다. 이 세 가지 기준 중 두 가지가 양수이면 조각이 적중으로 계산되었습니다. 이에 대한 두 가지 예는 그림 6에서 볼 수 있습니다.
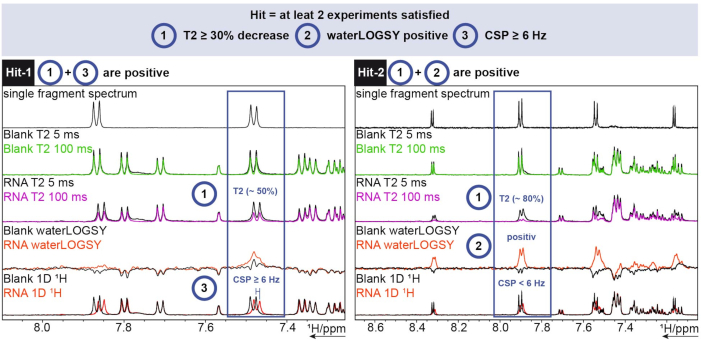
그림 6: 적중 결정 기준을 보여주는 예시적인 SARS-CoV-2 RNA에 대해 수행된 1시간 스크리닝. 3개의 상이한 실험 (1H T2 CPMG (5/100 ms), waterLOGSY, 및 1D 1H)의 획득. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Hit-1은 ~50%의T2 감소 및 6Hz≥ CSP를 나타낸다. waterLOGSY는 신호의 유의미한 변화를 나타내지 않아 양수로 간주됩니다. 3개의 실험 중 2개가 양성이므로 이 조각은 적중으로 계산됩니다. Hit-2의 경우 T2 는 ~80% 신호 강도의 감소를 나타내며 waterLOGSY에 대해 명확한 신호 변화를 볼 수 있습니다. 이 경우 CSP로는 충분하지 않지만 앞의 두 기준이 양수이므로 여전히 적중으로 계산됩니다.
토론
NMR 기반 단편/약물 스크리닝의 다양성. BMRZ는 약물 발견을 위한 광범위한 친화성 영역 내에서 단편을 식별하기 위해 STD-NMR, waterLOGSY 및 이완 실험뿐만 아니라 최첨단 자동 NMR 기기를 성공적으로 구현했습니다. 설치된 하드웨어에는 고처리량 시료 전처리 로봇과 600MHz 분광계와 관련된 고처리량 시료 저장, 교환기 및 데이터 수집 장치가 포함됩니다. 최근에 구입한 1H, 19F, 13C및 15N용 극저온 프로브는 제안된 측정에 필요한 감도를 보장하고 19F검출 중에 1H(1)디커플링을 허용합니다. 이 프로브는 CMC-q, CMC-assist, CMC-se 및 FBS(TopSpin에 포함됨)를 포함한 Bruker의 고급 소프트웨어 도구를 사용할 수 있는 최신 세대의 NMR 콘솔에 연결됩니다. 절편 기반 스크리닝(FBS) 도구는 최신 버전의 TopSpin에 포함되어 있으며 STD, waterLOGSY,T2/T1r-relaxation 실험으로 구성된 고처리량 데이터를 분석하는 데 도움이 됩니다. 액체 1D 1H 샘플 수집은 샘플 충전 로봇을 사용하여 자동화된 방식으로 NMR 튜브에 충전할 수 있습니다. 일반적으로 96개의 튜브(3mm) 블록이 약 2시간 내에 채워집니다. 96웰 플레이트 랙은 HT 샘플 체인저에 직접 배치되어 블록의 바코드를 판독하고 자동화 소프트웨어(IconNMR)에 의해 제어되는 실험에 NMR 튜브를 할당합니다. 5개의 96웰 플레이트 랙을 HT 자동 시료 주입기에 동시에 보관하고 프로그래밍할 수 있습니다. 각 개별 랙의 온도는 개별적으로 제어하고 조절할 수 있습니다. 또한 각 개별 시료는 측정 전에 원하는 온도로 사전 컨디셔닝(응축 습도 제거를 위한 예열 및 튜브 건조)할 수 있습니다.
광범위한 응용 분야에 적합합니다. 이 자동화된 NMR 기반 스크리닝의 광범위한 응용 분야 중 하나는 생체고분자 표적(DNA/RNA/단백질)에 결합하는 새로운 리간드를 식별하고 개발하는 것입니다. 이들 리간드는 전형적으로 비공유적으로 결합하는 오르토스테릭 및 알로스테릭 억제제를 포함할 수 있다. 또한, NMR에 의한 FBDD는 전형적으로 유망한 화합물을 선택하기 위한 제1 단계로서 사용되며, 충족되어야 하는 요건은 충분한 양의 생체분자 표적의 가용성이다. 이 목표는 두 가지 주요 작업으로 나뉩니다.
첫 번째 과제는 다음과 같은 이유로 사내 단편 라이브러리를 개발하고 특성화하는 것입니다 : 1000 개 이상의 단편의 초기 및 주기적 품질 관리, 특성화 및 정량화; 각 표적, 특히 단백질 표적에 대해 최적화된 완충액에서 단편의 용해도 측정; 다양한 스캐폴드를 수용하고 다른 거대분자 부류로 확장하기 위해 여러 라이브러리를 설립합니다. 작업 2는 다음을 사용하여 NMR에 의한 단편 기반 약물 설계(FBDD)를 위한 워크플로우를 통합하는 것입니다: 자동화된 1D-리간드 관찰 스크리닝(1H 및 19F관찰); orthosteric 및 allosteric 결합을 구별하기 위한 자동 교체 분석((천연) 리간드를 사용한 경쟁 실험); 여러 단편을 사용한 자동화된 2차 스크리닝; 자동화된 2D-단백질 스크리닝 및 EU-OPENSCREEN 라이브러리 또는 기타 라이브러리를 사용하는 초기 히트 주변의 유도체 세트의 2차 스크리닝; 선택한 대상에 대한 FDA 라이브러리의 재프로파일링 스크리닝.
또한, 세포주기 조절과 대사를 연결하는 조절 메커니즘을 밝히기 위해 다양한 세포주(질병 관련)의 대사형 분석이 수행될 수 있습니다. 또한, 구축물/도메인 최적화(구조 조사(완충액, pH, 온도 및 염 스크리닝)를 위한 안정성 최적화)의 최적화를 위한 생체 내 및 시험관 내에서 RNA/DNA/단백질 조절 요소의 기능적 특성화와 일반적으로 다른 기술로는 접근할 수 없는 막 단백질 및 본질적으로 무질서한 단백질에 대한 NMR 기반 단편 스크리닝의 확장이 있습니다.
제한. 19F 및 1H 단편 라이브러리의 사용에는 장단점이 있으며, 그 중 일부는 다음에서 언급 할 것입니다. 19F대 1H측정의 가장 큰 이점은 혼합물에 거의 두 배의 단편이 포함되어 있고 더 적은 수의 실험을 수행해야 하기 때문에 실제 측정 시간과 후속 분석의 속도입니다. 또한 버퍼의 간섭이 없고 최적으로 설계된 단편 혼합물에 대해 신호 겹침이 거의 없는 더 넓은 화학적 이동 범위를 추가로 제공하기 때문에 19F스크리닝의 경우 후속 분석이 더 쉽습니다. 스펙트럼 자체는 크게 단순화되어 일반적으로 불소 원자의 수에 따라 단편당 하나 또는 두 개의 신호만 갖습니다. 따라서 이러한 스펙트럼의 분석을 자동화하여 시간을 단축할 수 있습니다. 이것은 적어도이 연구에 사용 된 도서관에 대한 화학적 다양성을 희생시켜줍니다. 라이브러리의 ~13%만이 19F를 포함하고 있지만 당연히 모두 1H 스크리닝에 사용할 수 있으므로 19F스크리닝 조각의 다양성은 더 낮아집니다. 이것은 더 많은 조각과 더 큰 화학적 다양성을 가진 특별히 설계된 19F라이브러리를 사용하여 우회할 수 있습니다. 19F스크리닝의 또 다른 단점은 단편당 신호 수가 적다는 것입니다. 단편은 일반적으로 하나 이상의 수소 원자로 구성된다. 따라서 1H관찰 스크리닝 실험은 결합을 검출하기 위해 동일한 단편에 대해 서로 다른 신호에 의존할 수 있습니다. 이는 1H 스크리닝에 대한 히트를 식별할 때 더 높은 신뢰도를 제공하는 반면, 19F스크리닝은 단편당 주어진 하나 또는 두 개의 신호에 의존해야 합니다.
현대의 자동화된 NMR 기반 단편 스크리닝 기기, 소프트웨어 및 분석 방법 및 프로토콜에 대한 자세한 설명이 제시되었습니다. 설치된 하드웨어에는 고처리량 시료 전처리 로봇과 600MHz 분광계와 관련된 고처리량 시료 저장, 교환기 및 데이터 수집 장치가 포함됩니다. 최근에 설치된 1 H, 19 F, 13 C 및 15N용 극저온 프로브 헤드는 제안된 측정에 필요한 감도를 보장하고 19F 검출 중에 1H 디커플링을 허용합니다. 또한 최신 세대의 NMR 콘솔은 획득 및 즉석 분석을 지원하기 위해 고급 분석 소프트웨어를 사용할 수 있는 가능성을 제공합니다. 위에서 논의한 기술, 워크플로 및 설명된 프로토콜은 NMR에 의해 FBS를 추구하는 사용자에게 놀라운 성공을 촉진할 것입니다.
공개
없음.
감사의 말
이 작업은 유럽연합 집행위원회(European Commission)의 Horizon 2020 프로그램에서 자금을 지원하는 프로젝트 번호 871037인 iNEXT-Discovery의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Bruker Avance III HD | Bruker | 600 MHz NMR Spectrometer | |
| Matrix Clear Polypropylene 2D Barcoded Open-Top Storage Tubes | 3731-11 0.75ML V-BOTTOM TUBE/LATCH RACK | ThermoFisher Scientific | Barcoded Tubes |
| Matrix SepraSeal und DuraSeal& | 4463 Cap Mat, SeptraSeal 10/CS | ThermoFisher Scientific | |
| SampleJet | Bruker | HT Sample Changer | |
| SamplePro Tube | Bruker | Pipetting Robot |
참고문헌
- Yanamala, N., et al. NMR-Based Screening of Membrane Protein Ligands. Chemical Biology & Drug Design. 75, 237-256 (2010).
- Souers, A. J., et al. ABT-199, a potent and selective BCL-2 inhibitor, achieves antitumor activity while sparing platelets. Nature Medicine. 19, 202-208 (2013).
- Su, M. C., Te Chang, C., Chu, C. H., Tsai, C. H., Chang, K. Y. An atypical RNA pseudoknot stimulator and an upstream attenuation signal for -1 ribosomal frameshifting of SARS coronavirus. Nucleic Acids Research. 33, 4265-4275 (2005).
- Perera, T. P. S., et al. Discovery & pharmacological characterization of JNJ-42756493 (Erdafitinib), a functionally selective small-molecule FGFR family inhibitor. Molecular Cancer Therapeutics. 16, 1010-1020 (2017).
- Zhang, C., et al. Design and pharmacology of a highly specific dual FMS and KIT kinase inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 110, 5689-5694 (2013).
- Lipinski, C. A., Lombardo, F., Dominy, B. W., Feeney, P. J. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Advanced Drug Delivery Reviews. 23, 3-25 (1997).
- Congreve, M., Carr, R., Murray, C., Jhoti, H. A 'Rule of Three' for fragment-based lead discovery. Drug Discovery Today. 8, 876-877 (2003).
- Chávez-Hernández, A. L., Sánchez-Cruz, N., Medina-Franco, J. L. A Fragment Library of Natural Products and its Comparative Chemoinformatic Characterization. Molecular Informatics. 39, 2000050(2020).
- Sreeramulu, S., et al. NMR quality control of fragment libraries for screening. Journal of Biomolecular NMR. , 00327-00329 (2020).
- Gao, J., et al. Automated NMR Fragment Based Screening Identified a Novel Interface Blocker to the LARG/RhoA Complex. PLoS One. 9, 88098(2014).
- Peng, C., et al. Fast and Efficient Fragment-Based Lead Generation by Fully Automated Processing and Analysis of Ligand-Observed NMR Binding Data. Journal of Medicinal Chemistry. 59, 3303-3310 (2016).
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7, 2322-2330 (2016).
- Hwang, T. L., Shaka, A. J. Water Suppression That Works. Excitation Sculpting Using Arbitrary Wave-Forms and Pulsed-Field Gradients. Journal of Magnetic Resonance, Series A. 112, 275-279 (1995).
- Gossert, A. D., Jahnke, W. NMR in drug discovery: A practical guide to identification and validation of ligands interacting with biological macromolecules. Progress in Nuclear Magnetic Resonance Spectroscopy. 97, 82-125 (2016).
- Sklenar, V., Bax, A. A new water suppression technique for generating pure-phase spectra with equal excitation over a wide bandwidth. Journal of Magnetic Resonance. 75, 378-383 (1987).
- Binas, O., et al. 19F NMR-Based Fragment Screening for 14 Different Biologically Active RNAs and 10 DNA and Protein Counter-Screens. ChemBioChem. , (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유