A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
רב-תכליתיות של פרוטוקולים לאימון והערכת התנגדות באמצעות סולמות סטטיים ודינמיים במודלים של בעלי חיים
In This Article
Summary
הפרוטוקול הנוכחי מתאר אימוני התנגדות ובדיקות באמצעות סולמות סטטיים ודינמיים במודלים של בעלי חיים.
Abstract
אימוני התנגדות הם מודל של פעילות גופנית עם יתרונות משמעותיים לבריאות לאורך כל החיים. השימוש במודלים של תרגילי התנגדות לבעלי חיים הוא דרך לקבל תובנה לגבי המנגנונים המולקולריים הבסיסיים המתזמרים את ההתאמות הללו. מטרת מאמר זה היא לתאר מודלים של תרגילים ופרוטוקולי אימונים המיועדים לאימוני כוח והערכת התנגדות במודלים של בעלי חיים ולספק דוגמאות. במאמר זה, אימוני כוח והערכת התנגדות מבוססים על פעילות טיפוס בסולמות, תוך שימוש בסולמות סטטיים ודינמיים. מכשירים אלה מאפשרים מגוון מודלים של אימונים וכן מספקים שליטה מדויקת במשתנים העיקריים הקובעים את תרגיל ההתנגדות: נפח, עומס, מהירות ותדירות. יתר על כן, בניגוד לתרגילי התנגדות בבני אדם, זהו תרגיל מאולץ. לפיכך, יש להימנע מגירויים מרתיעים בהתערבות זו כדי לשמור על רווחת בעלי החיים. לפני היישום, יש צורך בתכנון מפורט, יחד עם תקופת התאקלמות ולמידה. התאקלמות למכשירי אימון, כגון סולמות, משקולות וסרט קליני, כמו גם למניפולציות הנדרשות, נחוצה כדי למנוע דחיית פעילות גופנית ולמזער מתח. במקביל, מלמדים את בעלי החיים לטפס במעלה הסולם, לא למטה, לאזור המנוחה בראש הסולם. הערכת התנגדות יכולה לאפיין כוח פיזי ולאפשר התאמה וכימות של עומס האימון והתגובה לאימון. יתר על כן, סוגים שונים של כוח ניתן להעריך. לגבי תוכניות אימון, עם עיצוב מתאים ושימוש במכשיר, הם יכולים להיות תכליתיים מספיק כדי לווסת סוגים שונים של כוח. יתר על כן, הם צריכים להיות גמישים מספיק כדי להיות שונה בהתאם לתגובה הסתגלותית והתנהגותית של בעלי החיים או נוכחות של פציעות. לסיכום, אימוני התנגדות והערכה באמצעות סולמות ומשקולות הם שיטות מגוונות במחקרים בבעלי חיים.
Introduction
פעילות גופנית היא גורם אורח חיים מכריע לקידום הבריאות ולהפחתת השכיחות של המחלות הכרוניות הנפוצות ביותר, כמו גם סוגים מסוימים של סרטן בבני אדם1.
תרגיל התנגדות העלה עניין בגלל הרלוונטיות המוחצת שלו לבריאות לאורך החיים2, במיוחד בשל היתרונות שלה בנטרול מחלות הקשורות לגיל המשפיעות על מערכת לוקומוטור, כגון סרקופניה, אוסטאופורוזיס וכו'3. יתר על כן, תרגיל התנגדות משפיע גם על רקמות ואיברים שאינם מעורבים ישירות בביצוע התנועה, כגון המוח4. רלוונטיות זו בשנים האחרונות עודדה פיתוח מודלים של תרגילי התנגדות בבעלי חיים כדי לחקור את המנגנונים הטיסלולריים והמולקולריים הבסיסיים, כאשר הדבר אינו אפשרי בבני אדם או כאשר בעלי החיים מספקים תובנה טובה יותר ומהווים מודל מבוקר יותר.
בניגוד לתרגילי התנגדות בבני אדם, עבור מודלים של בעלי חיים חוקרים מסתמכים בדרך כלל על נהלים מאולצים. עם זאת, יש להימנע מגירויים מרתיעים בהקשר זה, בעיקר כדי לשמור על רווחת בעלי החיים, להפחית את הלחץ ולהפחית את חומרת הליכי הניסוי5. יש לציין כי בעלי חיים נהנים מפעילות גופנית גם בטבע6. מסיבות אלה, יש צורך לשפר את ההסתגלות לניסוי באמצעות התאקלמות הדרגתית ממושכת.
המכשירים, החומרים והפרוטוקולים המשמשים לאימון התנגדות ולהערכה בחיות ניסוי חייבים לאפשר בקרה ואפנון מדויקים של משתנים רבים: עומס, נפח, מהירות ותדר7. הם צריכים גם לאפשר סוגים שונים של התכווצויות שרירים להתבצע: קונצנטרי, אקסצנטרי, או איזומטרי. בהתחשב באמור לעיל, הפרוטוקולים המשמשים צריכים להיות מסוגלים להעריך באופן ספציפי או להתאמן עבור יישומים שונים של כוח: כוח מקסימלי, היפרטרופיה, מהירות, וסיבולת.
ישנן מספר שיטות של אימוני כוח, כגון קפיצה במים8,9, שחייה במשקלבמים 10, או גירוי חשמלי של שרירים11. עם זאת, סולמות סטטיים ודינמיים הם התקנים רב-תכליתיים הנמצאים בשימוש נרחב12,13,14.
הערכת עמידות במודלים של בעלי חיים ניסיוניים מספקת מידע רב ערך עבור מסגרות מחקר רבות, כגון תיאור המאפיינים הפנוטיפיים של בעלי חיים מהונדסים גנטית, הערכת ההשפעה של פרוטוקולי התערבות שונים (תוספי רכיבים תזונתיים, טיפולים תרופתיים, השתלת מיקרוביוטה וכו '), או הערכת ההשפעה של פרוטוקולי אימון. מודלים של אימונים מספקים תובנות לגבי הפיזיולוגיה של הסתגלות לאימוני כוח, מה שעוזר להבין טוב יותר את ההשפעה של פעילות גופנית על מצב הבריאות והפתופיזיולוגיה.
כתוצאה מכך, אין פרוטוקול אוניברסלי לאימוני התנגדות או להערכה תפקודית של כוח במודלים של בעלי חיים, ולכן יש צורך בפרוטוקולים רב-תכליתיים.
מטרת מחקר זה היא לזהות את הגורמים הרלוונטיים ביותר שיש לקחת בחשבון בעת תכנון ויישום פרוטוקול לאימון והערכה של התנגדות באמצעות סולמות סטטיים ודינמיים במודלים של בעלי חיים, כמו גם לספק דוגמאות ספציפיות.
Protocol
השיטות המוצגות בפרוטוקול זה הוערכו ואושרו על ידי הוועדה הטכנית למחקר בבעלי חיים (הפניה PROAE 04/2018, Principado de Asturias, ספרד).
1. תכנון
- בחר בקפידה בעלי חיים למחקר על סמך מאפייני העניין (מהונדסים גנטית, מודלים פתולוגיים, גיל וכו ') ויישם התאמות ספציפיות לפרוטוקול (טיפוס ללא משקולות, הפחתת מספר הרצים לטיפוס ונטייה).
- זהה את אופני הכוח שיש להעריך או לאמן: כוח מרבי, סיבולת-התנגדות, מהירות וכו 'בהתאם למטרות המחקר.
- התאם את הפרמטרים בקפידה כאשר הערכה תפקודית או אימון ממוסגרים, בהתחשב אם הם מתמקדים בתוצאות של בדיקות אלה או אם הם משלימים סוגים אחרים של קביעות קליניות, תפקודיות, היסטולוגיות או מולקולריות.
- תכננו את כל הנושאים הקשורים לאימון, במיוחד לוח הזמנים, משך תקופת האימון ותדירות המפגשים, ושרטטו טבלת אימונים.
- ציין את מדרגות החימום ואת הנטייה של הסולם, אשר יהיה זהה לאורך כל האימון. ציין סטים, חזרות, עומס (בהתבסס על תוצאות מבחני ההתנגדות שנעשו לפני תקופת האימון), ומנוחה בין לבין, תוך שימת לב לעליית העומס בהתבסס על האימון הקודם.
- לשנות את התוכנית, כמו עם אימון אנושי, בהתאם לרווחת החיה. השינויים כוללים הפחתת חזרות, הגדלת זמן המנוחה בין סטים או חזרות, והפחתת עומס כדי למנוע אימון יתר ופציעות.
- בסיום, יש להגיש את התכנון להערכה ולאישור של ועדת המחקר לאתיקה בבעלי חיים.
2. מכשירים וחומרים לתרגול התנגדות
- התקנים: סולמות סטטיים ודינמיים
הערה: שני סוגים של סולמות, מה שנקרא סולמות סטטיים ודינמיים (ראו איור 1), יכולים לשמש לאימון והערכה של התנגדות (ראו טבלת חומרים).- השתמש בסולם אנכי עם לפחות 30 מדרגות חוט פלדה בקוטר 1.5 מ"מ, מופרדות על ידי 15 מ"מ, ואזור מנוחה של לפחות 20 x 20 ס"מ בחלק העליון של הסולם. שיפוע הסולם חייב להיות ניתן לכוונון מ-80° ל-110° עם המישור האופקי (איור 1C). תיחום שני נתיבים כדי למנוע טיפוס לא ליניארי.
- השתמש בסולם דינמי הדומה לסולם הסטטי, עם מחסום נימה מפלסטיק בחלקו העליון, שניתן לפתוח כדי לשלוט בגישה לאזור המנוחה, ומחסום נימה מפלסטיק בתחתית, כדי למנוע מבעלי החיים לטפס למטה. זווית הנטייה של הסולם חייבת להיות מתכווננת בין 80° ל-100°, כאשר הנפוצה ביותר היא 85°.
הערה: הסולם יכול להסתובב באמצעות פיר עליון ותחתון בקוטר של 8 ס"מ. הפיר התחתון מונע על ידי מנוע חשמלי שגורם למדרגות לרדת מלפנים ולעלות מאחור, מה שיוצר סולם אינסופי. הוא מצויד בהילוך הפחתה ובווסת מהירות להורדת המהירות מ-11.6 ס"מ לשנייה ל-3.3 ס"מ לשנייה, והמהירות הנפוצה ביותר היא 5.6 ס"מ לשנייה.
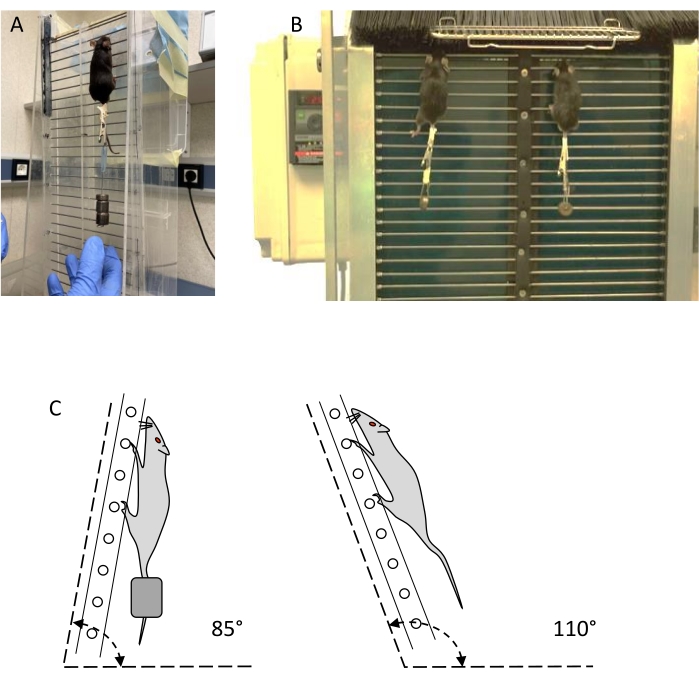
איור 1: מכשירי אימון התנגדות: סולמות סטטיים ודינמיים. (A) אימון עכבר עם משקל חיצוני בסולם סטטי. (B) שני עכברים מתאמנים עם משקל על סולם דינמי. (C) ייצוג סכמטי של זוויות סולם לצורך אימון והערכה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- חומרים
- הכינו את החומרים הבאים: משקולות, חוט להחזקת משקולות, תפס גטור פלדה וסרט דבק קליני.
הערה: המשקולות הן גלילי פלדה בעלי מסה שונה (5, 10, 15, 20, 25 ו -50 גרם), עם חור בקוטר 5 מ"מ במרכז כדי לחבר אותם על חוט (טבלת חומרים). החוט להחזקת המשקולות עשוי פלדה בקוטר של 1-1.5 מ"מ ובאורך של 5-10 ס"מ, תלוי במספר המשקולות שיש לטעון. - חותכים חתיכת תחבושת דבק אלסטית (Table of Materials) בגודל של כ-3.0-3.5 ס"מ על גודל 1.0-1.5 ס"מ ומחברים אותה סביב זנב החיה כדי להחזיק את המשקולות. הקפידו לא להדק יתר על המידה מכיוון שזה עלול להוביל להגבלת זרימת הדם.
הערה: בהתחלה, ההתנהגות של בעלי החיים תהיה להילחם נגד הקלטת ולנשוך אותו, אבל אחרי כמה ימים, הם יסבלו את זה, טיפוח כרגיל ולא מראה סימנים של מתח. - הכנס את המשקולות הרצויות לחוט וחבר את תפס הגאטור (טבלת חומרים: תפס גאטור פלדה וחוט להחזקת משקולות).
- מהדקים את הגאטור לסרט הקליני המחובר לזנב החיה.
- מיד לאחר הטיפוס על הרצים הנדרשים, הסירו את המהדק ואפשרו לחיה לנוח עם הסרט הקליני על הזנב, אך ללא המשקל (איור 1).
- הכינו את החומרים הבאים: משקולות, חוט להחזקת משקולות, תפס גטור פלדה וסרט דבק קליני.
3. התאקלמות
הערה: התאקלמות נכונה חיונית כדי למנוע דחייה של פעילות גופנית וכדי למזער את הלחץ. התאקלמות היא שלב מכריע לפני ביצוע מבחני הערכת התנגדות או פרוטוקולי אימון. יש להשקיע זמן מספיק כדי להשיג סימנים התנהגותיים של נוחות אצל בעלי החיים. פרטים על התאקלמות יומית עם הסולמות הסטטיים והדינמיים מוצגים בטבלה 1 ובטבלה 2, בהתאמה.
- הרגילו את בעלי החיים להישאר באזור המנוחה בראש הסולם (סטטי או דינמי). השאירו את החיות במקום הזה בקבוצות של ארבעה, עם מצעים מהכלוב שלהם, למשך 15 דקות בכל יום. בדרך כלל, לאחר 3-5 ימים, בעלי החיים לא יראו סימנים של מתח.
- למדו בעלי חיים לטפס למעלה, לא למטה, בסולם. באמצעות הסולם הסטטי, הניחו את העכברים על רצועה קרובה לפסגה, משם הם יכולים לראות את אזור המנוחה. הם ילכו אליו באופן אינסטינקטיבי. לאחר מכן, למדו אותם בהדרגה לטפס מחמישה רצים (3x) ביום הראשון, ל-10 rungs (3x) למחרת, עד 15 rungs (3x) (טבלה 1).
השתמש באותו הליך עם הסולם הדינמי, תחילה ללא תנועה, ולאחר מכן עם הסולם נע במהירות של 5.4 ס"מ לשנייה ו -6.6 ס"מ לשנייה והחיות מטפסות למעלה במשך 2 דקות, ומשלימות חמש סדרות (טבלה 2). - התאימו את בעלי החיים לשאת משקולות, החל מהיום השלישי להתאקלמות. הדביקו חתיכת סרט קליני לבסיס הזנב אשר ישמש להחזקת משקולות.
- מהיום השביעי של התאקלמות, לצרף משקולות קטנות (5-10 גרם) לקלטת הקלינית עם קליפ גאטור. הימנעו מביצוע סדרות רבות מדי, כך שההסתגלות לא תהפוך לאימון.
הערה: ההסתגלות של קבוצת הביקורת היא חובה במקרה שקבוצה זו מבצעת את בדיקת ההתנגדות. לאחר תקופה זו, בצעו תזכורת טיפוס על סולם פעם בשבוע, עם סרט הדבקה אך ללא משקולות.
4. הערכת התנגדות
- בדיקות מצטברות להערכת חוזק מרבי
הערה: בדיקה זו מתכוונת לקבוע את ההתנגדות המרבית שנמדדה כמשקל המרבי שבו בעלי החיים יכולים לטפס 10 רצים בסולם הסטטי, המגדיר את המקסימום של 10 חזרות (10 RM)4. פרוטוקול זה הותאם ממחקרים קודמים (שנסקרו ב- Kregel et al.15).- לחימום יש לבצע שלוש סדרות של 10 חזרות, 10 צעדים/חזרות, ללא עומס חיצוני. עבור הסדרה הראשונה נקבע השיפוע על 90°, ולאחר מכן על 85°. אפשר תקופת מנוחה של 60 שניות בין סדרות.
- קבעו את השיפוע על 85° (כדי למנוע מהמשקולות לרעות או להתחבר לסוללות הסולם).
- חברו את הסרט סביב זנב החיה כדי להחזיק את המשקולות והכינו את המשקולות כפי שהוסבר קודם לכן.
- התחל את הבדיקה עם עומס חיצוני של 10 גרם ובצע סדרה אחת של 10 שלבים.
- הסר את המשקל ואפשר תקופת מנוחה של 120 שניות באזור המנוחה.
- בצע סדרה רצופה של 10 שלבים המגדילים את העומס החיצוני ב-5 גרם עד לתשישות. אפשר את תקופת המנוחה (120 שניות) בין הסדרות.
- אם בעל חיים אחד לא מצליח לטפס 10 מדרגות עם עומס משקל מסוים, אפשר ניסיון נוסף עם אותו עומס לאחר 120 שניות של מנוחה. אם הוא מצליח לטפס עם העומס, הוא ממשיך את המבחן עם העומס הבא. אם הוא נכשל שוב, רשום את עומס המשקל של הסדרה האחרונה שהושלמה כעומס המשקל המרבי שלה.
- תוצאת הבדיקה יכולה להתבטא כמשקל חיצוני מוחלט (g), כעומס מרבי ביחס למשקל הגוף (%), או כמסה המורמת לגרם של משקל גוף, לפי שיקול דעתו של החוקר.
הערה: הפרוטוקול הקודם מייצג מודל שבו שינויים רבים אפשריים, למשל, כדי להעריך את העמידות המרבית של עכברים מהונדסים גנטית עם מוגבלות עצבית-שרירית. בעלי חיים אלה אינם מסוגלים לטפס עם עומסים חיצוניים ומתקשים לטפס על 10 רצים כאשר הסולם מוגדר בשיפוע של 90 מעלות (נתונים שלא פורסמו). הפרוטוקול כלל טיפוס של חמש מדרגות ללא עומס חיצוני, החל בשיפוע של 110 מעלות. השיפוע ירד ב-5° בכל סדרה עד 85° עם מנוחה של 120 שניות אחרי כל סדרה. במקרה זה, ההתנגדות המקסימלית באה לידי ביטוי כאשר מספר הצעדים המצטבר טיפס (מבלי לקחת בחשבון חזרות לאחר כישלונות). קבוצת הביקורת מסוג פראי, לאחר שהגיעה לשיפוע של 85°, תמשיך בבדיקה על ידי הוספת משקל חיצוני לזנב, בהתאם לפרוטוקול הקודם, עד לתשישות.
- מבחן סיבולת-התנגדות מרבי עם הסולם הסטטי
- לחימום יש לבצע שלוש סדרות של 10 חזרות, 10 צעדים/חזרות, ללא עומס חיצוני. עבור הסדרה הראשונה, קבעו את השיפוע על 90°, ולאחר מכן על 85°. אפשר תקופת מנוחה של 60 שניות בין סדרות.
- קבעו את השיפוע על 85°.
- גזור את המשקל על הסרט הקליני המונח סביב זנב העכבר.
הערה: בהתאם לגיל ולמאפייני בעלי החיים, העומס החיצוני יכול להיות המשקל המרבי המתקבל במבחן מצטבר קודם, אחוז ממנו (למשל, 50%), או אחוז ממשקל הגוף (למשל, 100%-200%). אם בדיקה זו מבוצעת לאחר תקופת אימון, מומלץ להשתמש באותו עומס כמו במבחן הראשוני כדי להעריך את השינויים. - יש לבצע סדרה רצופה של 10 שלבים עד לתשישות. לא ניתן לנוח לאחר כל סדרה.
- תוצאת הבדיקה היא מספר הרצים שטיפסו.
- מבחן סיבולת-התנגדות מרבי עם הסולם הדינמי
הערה: השימוש בסולם הדינמי מאפשר לחוקר לשלוט במהירות הטיפוס.- קבעו את השיפוע על 85°.
- הגדר את המהירות ל-4.2 ס"מ לשנייה.
- לחימום בצע שלוש סדרות של 100 צעדים, ללא עומס חיצוני. אפשר תקופת מנוחה של 60 שניות בין סדרות.
- גזור את המשקל על הסרט הקליני המונח סביב זנב העכבר.
הערה: בהתאם לגיל ולמאפייני בעלי החיים, העומס החיצוני יכול להיות המשקל המרבי המתקבל במבחן מצטבר קודם, אחוז ממנו (למשל, 50%), או אחוז ממשקל הגוף (למשל, 100%-200%). אם בדיקה זו מבוצעת לאחר תקופת אימון, מומלץ להשתמש באותו עומס כמו במבחן הראשוני כדי להעריך את השינויים. - יש להתחיל במהירות של 4.2 ס"מ לשנייה ולהגביר את המהירות ב-1.2 ס"מ לשנייה כל 60 שניות עד לתשישות.
הערה: תוצאת הבדיקה היא זמן האימון, מספר הריצות שטיפסו או המהירות המרבית.
5. אימון התנגדות עם סולם סטטי
הערה: לפני תחילת תקופת ההכשרה, יש צורך בהתאקלמות (טבלה 1) ובתכנון האימון. כדי להפחית חרדה, התאימו ואמנו את העכברים בקבוצות של ארבעה בעלי חיים החולקים את אותו הכלוב.
- לחימום יומיומי יש לבצע שלוש סדרות של 10 חזרות, 10 צעדים/חזרות, ללא עומס חיצוני. עבור הסדרה הראשונה נקבע השיפוע על 90°, ולאחר מכן על 85°. אפשר תקופת מנוחה של 60 שניות בין סדרות.
- האימון מתחיל באזור המנוחה. גזור את הגאטור עם המשקל על הסרט הקליני.
- הניחו בעדינות את העכבר 10-20 רצים מתחת למקום המנוחה. אפשרו לעכבר לאחוז בריצה ולטפס לאזור המנוחה.
חזור על תהליך זה עד להשלמת מספר הריצות בסדרה זו (לדוגמה, 10 rungs x 10 series). - הסר את המשקל מזנב העכבר והמתן 120 שניות עד לסדרה הבאה.
- הגדילו את מספר הצעדים ואת עומסי המשקל המרביים של הסדרה לאורך תקופת האימון, תוך שמירה על לוח הזמנים השבועי.
הערה: דוגמה לשונות של עומסים במהלך תכנון שבוע מוצגת בטבלה 3. בקרוב, שלישי ושישי עם עומס משקל גבוה (40-50 גרם) ומספר נמוך של צעדים (500-400); שני וחמישי עם עומס משקל ביניים (25-35 גרם) ומספר ביניים של צעדים (800-600); ויום רביעי ללא עומס משקל אך מספר גבוה של צעדים (2,000). עיצוב זה מקל על התאוששות מאימונים קודמים ומונע פציעות ואימון יתר. דוגמאות ל-3 שבועות של אימונים עם עיצובים מרובים באמצעות הסולם הסטטי מוצגות בטבלה 4 (בהתחלה, באמצע ובסוף תקופת האימון, בהתאמה)4.
6. אימון התנגדות עם סולם דינמי
הערה: לאחר התאקלמות, האימון בסולם הדינמי דומה למדי לזה הסטטי (טבלה 2). האימון מתבצע על 2-4 עכברים בכל פעם.
- הגדר את השיפוע ל-85°, סגור את הדלת לאזור המנוחה והפעל את הסולם במהירות הרצויה (למשל, 5.4 ס"מ לשנייה).
- לחימום בצע שלוש סדרות של 100 צעדים, ללא עומס חיצוני. אפשר תקופת מנוחה של 60 שניות בין סדרות.
- לפני תחילת האימונים, כאשר העכבר נמצא באזור המנוחה, גזור את הגאטור עם המשקולת על הסרט הקליני. לחלופין, ניתן לחבר את המשקולת כאשר העכבר כבר נמצא על הסולם.
- הניחו בעדינות את העכבר בראש גרם המדרגות הנע עם המשקל על הזנב. אפשרו לעכברים לאחוז בריצה ולטפס.
- כאשר מגיעים למספר הריצות בסדרה זו (למשל, 100), הסר את המשקולות. לאחר מכן הדלת נפתחת כך שהחיה יכולה ללכת לאזור המנוחה. זמן המנוחה הוא 120 שניות לפני הסדרה הבאה.
הערה: מספר המדרגות שמטפסים נספר כפונקציה של זמן הטיפוס במהירות שנקבעה. - חזור על הליך זה עד לסיום האימון. תוכנית האימונים היומית המפורטת מוצגת בטבלה 5.
7. הערכת השפעת ההצלבה של אימוני התנגדות על ביצועי הסיבולת
הערה: לשם כך, בדיקת הליכון מצטברת מבוצעת4, לאחר 24 שעות של מנוחה.
- לאחר חימום של 3 דקות במהירות של 10 ס"מ לשנייה, התחל את הבדיקה המצטברת במהירות של 10 ס"מ לשנייה וזווית נטייה של 10°.
- הגבירו את המהירות ב-3.33 ס"מ לשנייה כל 3 דקות עד לתשישות.
הערה: לא נעשה שימוש בשוקרים חשמליים, ולכן מברשת של צייר ממוקמת בחלק האחורי של ההליכון כדי למנוע מהעכברים לברוח ממנו.
8. התנהגות בעלי חיים במהלך ההליכים
הערה: יש לבצע ניטור רציף של הסתגלות העכברים לאימונים כדי לזהות עייפות קיצונית, אימון יתר או פציעה.
- שימו לב לסימנים של רווחת בעלי חיים, במיוחד טיפוח וסירוב לאימונים. ההתנהגות הרגילה של העכבר, לאחר סדרה של אימונים אינטנסיביים, היא להישאר לא פעיל במשך כדקה אחת עקב עייפות. לאחר מכן, הם מתחילים לטפח, לחקור או לנסות להסיר את הקלטת על הזנב.
- במקרה של עכבר שמסרב לאמן סדרה, נסו לתת מנוחה ארוכה יותר או אפילו לא לבצע את הסדרה כדי למנוע עכבות.
- מדי פעם, בעת ביצוע תרגילים קלים, דחפו בעדינות את זנב החיה, כדי לעודד אותה לסיים את הסדרה. החיות מפסיקות לטפס כי זו לא משימה תובענית. לעומת זאת, כאשר בעלי חיים נושאים מטען כבד, העבירו בעדינות את משקל החיה כדי להקל על העומס ולעודד אותה לסיים את הסדרה, ואז אפשרו לבעל החיים לנוח עד לאימון הבא. בעלי החיים עלולים לעצור או אפילו לנסות לרדת בגלל העומס הכבד.
9. נהלי בטיחות
- נהלי אבטחה לחוקרים: ערכו מחקר במעבדה של מתקן בעלי החיים והשתמשו בכיסויי נעליים, כיסויים, כפפות, כובעים ומסכות. אין דרישות נוספות מלבד אלה הספציפיות למחקר בבעלי חיים.
- ביטחון לבעלי חיים: במהלך האימונים יש להקדיש תשומת לב מתמשכת לבעלי החיים, בשל סיכונים פוטנציאליים, כגון נפילות או קפיצות. הניחו יד מתחת למשקולות כדי לתפוס ולהחזיק את העכברים במקרה של נפילה עקב תשישות, שכן יכולתה להחזיק את הרצים כראוי תהיה מוגבלת.
תוצאות
תוצאות עם סולם סטטי
פרוטוקול אימוני ההתנגדות המתקדמת המשמש ומתואר על ידי Codina-Martinez et al.4 (טבלה 4) נבדק במחקר ראשוני המורכב מ-7 שבועות של אימון על סולם סטטי עם עכברי C57BL6J מסוג פראי בני 6 חודשים (n = 4). במחקר ראשוני זה בוצעו בדיקות מצטברות להערכת הכוח המרבי לפני ואחר...
Discussion
אימון הוא התערבות עם יישומים מרובים במחקר, מלבד המחקר של התרגיל עצמו. לפיכך, ניתוח השפעתו על הזדקנות20 או תנאים פתולוגיים מסוימים פיזיותרפיה21 קיבל תשומת לב רבה בשנים האחרונות. בנוסף, מחברים רבים ניתחו את ההשפעה של התערבויותפרמקולוגיות 22 אות...
Disclosures
המחבר המתאים מבטיח שלכל המחברים אין ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי ה- Ministerio de Economía y Competitividad, ספרד (DEP2012-39262 ל- EI-G ו- DEP2015-69980-P ל- BF-G). תודה לפרנק מקלאוד הנדרסון היגינס מהמרכז האנגלי של מקלאוד באסטוריאס, ספרד, על הסיוע בשפה.
Materials
| Name | Company | Catalog Number | Comments |
| Dynamic ladder | in-house production | ||
| Elastic adhesive bandage 6 cm x 2.5 m | BSN medical | 4005556 | |
| Gator Clip Steel NON-INSUL 10A | Digikey electronics | BC60ANP | |
| Static ladder | in-house production | ||
| Weights | in-house production | ||
| Wire for holding weigths | in-house production |
References
- Pedersen, B. K., Saltin, B. Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases. Scandinavian Journal of Medicine & Science in Sports. 25, 1-72 (2015).
- Westcott, W. L. Resistance training is medicine: effects of strength training on health. Current Sports Medicine Reports. 11 (4), 209-216 (2012).
- Garatachea, N., et al. Exercise attenuates the major hallmarks of aging. Rejuvenation Research. 18 (1), 57-89 (2015).
- Codina-Martinez, H., et al. Autophagy is required for performance adaptive response to resistance training and exercise-induced adult neurogenesis. Scandinavian Journal of Medicine & Science in Sports. 30 (2), 238-253 (2020).
- Conner, J. D., Wolden-Hanson, T., Quinn, L. S. Assessment of murine exercise endurance without the use of a shock grid: an alternative to forced exercise. Journal of Visualized Experiments: JoVE. (90), e51846 (2014).
- Meijer, J. H., Robbers, Y. Wheel running in the wild. Proceedings of the Royal Society B: Biological Sciences. 281 (1786), 20140210 (2014).
- Suchomel, T. J., Nimphius, S., Bellon, C. R., Hornsby, W. G., Stone, M. H. Training for muscular strength: Methods for monitoring and adjusting training intensity. Sports Medicine. 51 (10), 2051-2066 (2021).
- Pousson, M., Perot, C., Goubel, F. Stiffness changes and fibre type transitions in rat soleus muscle produced by jumping training. Pflügers Archive. 419 (2), 127-130 (1991).
- Marqueti, R. C., et al. Biomechanical responses of different rat tendons to nandrolone decanoate and load exercise. Scandinavian Journal of Medicine & Science in Sports. 21 (6), 91-99 (2011).
- Cunha, T. S., Tanno, A. P., Costa Sampaio Moura, M. J., Marcondes, F. K. Influence of high-intensity exercise training and anabolic androgenic steroid treatment on rat tissue glycogen content. Life Sciences. 77 (9), 1030-1043 (2005).
- Heinemeier, K. M., et al. Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. The Journal of Physiology. 582, 1303-1316 (2007).
- Hornberger, T. A., Farrar, R. P. Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat. Canadian Journal of Applied Physiology. 29 (1), 16-31 (2004).
- Yarasheski, K. E., Lemon, P. W., Gilloteaux, J. Effect of heavy-resistance exercise training on muscle fiber composition in young rats. Journal of Applied Physiology. 69 (2), 434-437 (1990).
- Khamoui, A. V., et al. Aerobic and resistance training dependent skeletal muscle plasticity in the colon-26 murine model of cancer cachexia. Metabolism. 65 (5), 685-698 (2016).
- Kregel, K. C., et al. Resource book for the design of animal exercise protocols. American Physiological Society. 152, (2006).
- Marino, G., et al. Autophagy is essential for mouse sense of balance. The Journal of Clinical Investigation. 120 (7), 2331-2344 (2010).
- Figueiredo, V. C., de Salles, B. F., Trajano, G. S. Volume for muscle hypertrophy and health outcomes: The most effective variable in resistance training. Sports Medicine. 48 (3), 499-505 (2018).
- Gentil, P., et al. Using velocity loss for monitoring resistance training effort in a real-world setting. Applied Physiology, Nutrition, and Metabolism. 43 (8), 833-837 (2018).
- Fernández-Sanjurjo, M., et al. Is physical performance (in mice) increased by Veillonella atypica or decreased by Lactobacillus bulgaricus. Journal of Sport and Health Science. 9 (3), 197-200 (2020).
- Shiguemoto, G. E., et al. Effects of resistance training on matrix metalloproteinase-2 activity and biomechanics and physical properties of bone in ovariectomized and intact rats. Scandivavian Journal of Medicine & Science in Sports. 22 (5), 607-617 (2012).
- de Sousa Neto, I. V., et al. Effects of resistance training on matrix metalloproteinase activity in skeletal muscles and blood circulation during aging. Frontiers in Physiology. 9, 190 (2018).
- Ghosh, S., Golbidi, S., Werner, I., Verchere, B. C., Laher, I. Selecting exercise regimens and strains to modify obesity and diabetes in rodents: an overview. Clinical Science. 119 (2), 57-74 (2010).
- Mônico-Neto, M., et al. Resistance training minimizes catabolic effects induced by sleep deprivation in rats. Applied Physiology, Nutrition, and Metabolism. 40 (11), 1143-1150 (2015).
- Hawley, J. A., Hargreaves, M., Joyner, M. J., Zierath, J. R. Integrative biology of exercise. Cell. 159 (4), 738-749 (2014).
- Booth, F. W., Laye, M. J., Spangenburg, E. E. Gold standards for scientists who are conducting animal-based exercise studies. Journal of Applied Physiology. 108 (1), 219-221 (1985).
- Kruger, K., et al. Functional and muscular adaptations in an experimental model for isometric strength training in mice. PLoS One. 8 (11), 79069 (2013).
- Hendrickse, P. W., Krusnauskas, R., Hodson-Tole, E., Venckunas, T., Degens, H. Endurance exercise plus overload induces fatigue resistance and similar hypertrophy in mice irrespective of muscle mass. Experimental Physiology. 105 (12), 2110-2122 (2020).
- Knab, A. M., et al. Repeatability of exercise behaviors in mice. Physiology & Behavior. 98 (4), 433-440 (2009).
- Konhilas, J. P., et al. Loaded wheel running and muscle adaptation in the mouse. American Journal of Physiology-Heart and Circulatory Physiology. 289 (1), 455-465 (2005).
- Reiter, A., et al. Functional measures of grip strength and gait remain altered long-term in a rat model of post-traumatic elbow contracture. The Journal of Biomechanical Engineering. , (2019).
- Stieglitz, T., Schuettler, M., Schneider, A., Valderrama, E., Navarro, X. Noninvasive measurement of torque development in the rat foot: measurement setup and results from stimulation of the sciatic nerve with polyimide-based cuff electrodes. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 11 (4), 427-437 (2003).
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflügers Archiv. 466 (9), 1673-1687 (2014).
- Tanaka, H., Swensen, T. Impact of resistance training on endurance performance. A new form of cross-training. Sports Medicine. 25 (3), 191-200 (1998).
- Hakkinen, K., Mero, A., Kauhanen, H. Specificity of endurance, sprint and strength training on physical performance capacity in young athletes. The Journal of Sports Medicine and Physical Fitness. 29 (1), 27-35 (1989).
- Vellers, H. L., Kleeberger, S. R., Lightfoot, J. T. Inter-individual variation in adaptations to endurance and resistance exercise training: genetic approaches towards understanding a complex phenotype. Mammalian Genome. 29 (1), 48-62 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved