È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Versatilità dei protocolli per l'allenamento e la valutazione della resistenza utilizzando scale statiche e dinamiche in modelli animali
In questo articolo
Riepilogo
Il presente protocollo descrive l'allenamento e i test di resistenza utilizzando scale statiche e dinamiche in modelli animali.
Abstract
L'allenamento di resistenza è un modello di esercizio fisico con profondi benefici per la salute per tutta la vita. L'uso di modelli animali di esercizi di resistenza è un modo per ottenere informazioni sui meccanismi molecolari sottostanti che orchestrano questi adattamenti. Lo scopo di questo articolo è descrivere modelli di esercizi e protocolli di allenamento progettati per l'allenamento della forza e la valutazione della resistenza in modelli animali e fornire esempi. In questo articolo, l'allenamento della forza e la valutazione della resistenza si basano sull'attività di arrampicata su scale, utilizzando scale statiche e dinamiche. Questi dispositivi consentono una varietà di modelli di allenamento e forniscono un controllo preciso delle principali variabili che determinano l'esercizio di resistenza: volume, carico, velocità e frequenza. Inoltre, a differenza dell'esercizio di resistenza negli esseri umani, questo è un esercizio forzato. Pertanto, gli stimoli avversivi devono essere evitati in questo intervento per preservare il benessere degli animali. Prima dell'implementazione, è necessaria una progettazione dettagliata, insieme a un periodo di acclimatazione e apprendimento. L'acclimatazione ai dispositivi di allenamento, come scale, pesi e nastro clinico, nonché alle manipolazioni richieste, è necessaria per evitare il rifiuto dell'esercizio e ridurre al minimo lo stress. Allo stesso tempo, agli animali viene insegnato a salire la scala, non giù, fino all'area di riposo in cima alla scala. La valutazione della resistenza può caratterizzare la forza fisica e consentire di regolare e quantificare il carico di allenamento e la risposta all'allenamento. Inoltre, possono essere valutati diversi tipi di forza. Per quanto riguarda i programmi di allenamento, con un design e un uso del dispositivo appropriati, possono essere sufficientemente versatili da modulare diversi tipi di forza. Inoltre, dovrebbero essere abbastanza flessibili da essere modificati a seconda della risposta adattiva e comportamentale degli animali o della presenza di lesioni. In conclusione, l'allenamento di resistenza e la valutazione con scale e pesi sono metodi versatili nella ricerca sugli animali.
Introduzione
L'esercizio fisico è un fattore determinante dello stile di vita per promuovere la salute e ridurre l'incidenza delle malattie croniche più diffuse e di alcuni tipi di cancro nell'uomo1.
L'esercizio di resistenza ha suscitato interesse a causa della sua schiacciante rilevanza per la salute per tutta la vita2, soprattutto a causa dei suoi benefici nel contrastare le malattie legate all'età che colpiscono il sistema locomotore, come la sarcopenia, l'osteoporosi, ecc3. Inoltre, l'esercizio di resistenza colpisce anche tessuti e organi non direttamente coinvolti nell'esecuzione del movimento, come il cervello4. Questa rilevanza negli ultimi anni ha incoraggiato lo sviluppo di modelli di esercizi di resistenza negli animali per studiare i meccanismi tissutali e molecolari sottostanti, quando non è possibile nell'uomo o quando gli animali forniscono una migliore comprensione e sono un modello più controllato.
A differenza dell'esercizio di resistenza negli esseri umani, per i modelli animali i ricercatori di solito si affidano a procedure forzate. Tuttavia, gli stimoli avversivi devono essere evitati in questo contesto, principalmente per preservare il benessere degli animali, ridurre lo stress e diminuire la gravità delle procedure sperimentali5. Va notato che gli animali godono di esercizio fisico anche in natura6. Per questi motivi, è necessario migliorare l'adattamento all'esperimento attraverso un acclimatamento graduale prolungato.
I dispositivi, i materiali e i protocolli utilizzati per l'allenamento e la valutazione della resistenza negli animali da esperimento devono consentire il controllo preciso e la modulazione di numerose variabili: carico, volume, velocità e frequenza7. Dovrebbero anche consentire di eseguire diversi tipi di contrazioni muscolari: concentriche, eccentriche o isometriche. Considerando quanto sopra, i protocolli utilizzati dovrebbero essere in grado di valutare o allenare specificamente per diverse applicazioni di forza: forza massima, ipertrofia, velocità e resistenza.
Esistono diversi metodi di allenamento della forza, come il salto in acqua8,9, il nuoto ponderato in acqua 10 o l'elettrostimolazione muscolare11. Tuttavia, le scale statiche e dinamiche sono dispositivi versatili ampiamente utilizzati12,13,14.
La valutazione della resistenza in modelli animali sperimentali fornisce informazioni preziose per molti contesti di ricerca, come la descrizione delle caratteristiche fenotipiche degli animali geneticamente modificati, la valutazione dell'effetto di diversi protocolli di intervento (integrazione di componenti dietetici, trattamenti farmacologici, trapianto di microbiota, ecc.) o la valutazione dell'effetto dei protocolli di allenamento. I modelli di allenamento forniscono informazioni sulla fisiologia dell'adattamento all'esercizio di forza, che aiuta a comprendere meglio l'effetto dell'esercizio sullo stato di salute e sulla fisiopatologia.
Di conseguenza, non esiste un protocollo universale per l'allenamento di resistenza o la valutazione funzionale della forza nei modelli animali, quindi sono necessari protocolli versatili.
Lo scopo di questo studio è identificare i fattori più rilevanti da considerare quando si progetta e si applica un protocollo per l'allenamento e la valutazione della resistenza utilizzando scale statiche e dinamiche in modelli animali, nonché fornire esempi specifici.
Protocollo
I metodi presentati in questo protocollo sono stati valutati e approvati dal comitato tecnico per la ricerca animale (riferimento PROAE 04/2018, Principado de Asturias, Spagna).
1. Pianificazione
- Selezionare accuratamente gli animali per lo studio in base alle caratteristiche di interesse (geneticamente modificati, modelli patologici, età, ecc.) e applicare adattamenti specifici al protocollo (arrampicata senza pesi, riduzione del numero di pioli da salire e inclinazione).
- Identificare la modalità di forza da valutare o allenare: forza massima, resistenza-resistenza, velocità, ecc. a seconda degli obiettivi dello studio.
- Regolare attentamente i parametri quando viene inquadrata la valutazione funzionale o l'allenamento, considerando se si concentra sui risultati di questi test o se sono complementari ad altri tipi di determinazioni cliniche, funzionali, istologiche o molecolari.
- Pianificare tutte le questioni relative alla formazione, in particolare l'orario, la durata del periodo di formazione e la frequenza delle sessioni e disegnare una tabella di allenamento.
- Specificare i passaggi di riscaldamento e l'inclinazione della scala, che sarà la stessa durante l'allenamento. Specificare le serie, le ripetizioni, il carico (in base ai risultati dei test di resistenza eseguiti prima del periodo di allenamento) e riposare nel mezzo, prestando attenzione agli aumenti di carico in base alla sessione precedente.
- Modificare il piano, come con l'addestramento umano, a seconda del benessere dell'animale. Le modifiche includono la diminuzione delle ripetizioni, l'aumento del tempo di riposo tra le serie o le ripetizioni e la diminuzione del carico per evitare sovrallenamento e lesioni.
- Al termine, presentare il progetto per la valutazione e l'approvazione da parte del comitato di ricerca sull'etica animale.
2. Dispositivi e materiali per l'esercizio di resistenza
- Dispositivi: scale statiche e dinamiche
NOTA: Due tipi di scale, le cosiddette scale statiche e dinamiche (vedi Figura 1), possono essere utilizzate per l'allenamento e la valutazione della resistenza (vedi Tabella dei materiali).- Utilizzare una scala verticale con almeno 30 gradini di filo d'acciaio di 1,5 mm di diametro, separati da 15 mm, e un'area di appoggio di almeno 20 x 20 cm sulla parte superiore della scala. La pendenza della scala deve essere regolabile da 80° a 110° con il piano orizzontale (Figura 1C). Delimitare due corsie per impedire l'arrampicata non lineare.
- Utilizzare una scala dinamica simile alla scala statica, con una barriera di filamenti di plastica nella parte superiore, che può essere aperta per controllare l'accesso all'area di riposo, e una barriera di filamenti di plastica nella parte inferiore, per impedire agli animali di scendere. L'angolo di inclinazione della scala deve essere regolabile tra 80° e 100°, il più comune è 85°.
NOTA: La scala può circolare per mezzo di un albero superiore e uno inferiore con un diametro di 8 cm. L'albero inferiore è azionato da un motore elettrico che fa scendere i gradini nella parte anteriore e salire nella parte posteriore, creando una scala senza fine. È dotato di un riduttore e di un regolatore di velocità per abbassare la velocità da 11,6 cm/s a 3,3 cm/s, e la velocità più comune è di 5,6 cm/s.
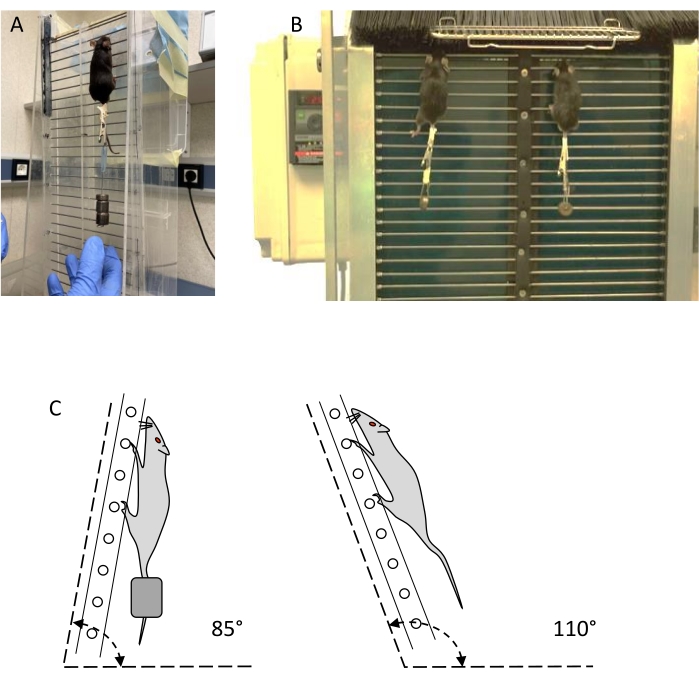
Figura 1: Dispositivi di allenamento della resistenza: scale statiche e dinamiche. (A) Allenamento del mouse con peso esterno su una scala statica. (B) Due topi che si allenano con il peso su una scala dinamica. (C) Rappresentazione schematica degli angoli delle scale per la formazione e la valutazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Materiali
- Preparare i seguenti materiali: pesi, filo per tenere pesi, clip per alligatori in acciaio e nastro adesivo clinico.
NOTA: I pesi sono cilindri di acciaio di massa diversa (5, 10, 15, 20, 25 e 50 g), con un foro di 5 mm di diametro al centro per infilarli su un filo (Tabella dei materiali). Il filo per contenere i pesi è realizzato in acciaio con un diametro di 1-1,5 mm e una lunghezza di 5-10 cm, a seconda del numero di pesi da caricare. - Tagliare un pezzo di benda adesiva elastica (Table of Materials) di circa 3,0-3,5 cm x 1,0-1,5 cm e attaccarlo intorno alla coda dell'animale per sostenere i pesi. Assicurati di non stringere eccessivamente in quanto potrebbe portare a una restrizione del flusso sanguigno.
NOTA: All'inizio, il comportamento degli animali combatterà contro il nastro e lo morderà, ma dopo un paio di giorni, lo tollereranno, toelettando come al solito e non mostrando segni di stress. - Inserire i pesi desiderati nel filo e agganciare la clip gator (Tabella dei materiali: clip gator in acciaio e filo per tenere i pesi).
- Blocca l'alligatore al nastro clinico attaccato alla coda dell'animale.
- Immediatamente dopo aver scalato i pioli richiesti, rimuovere il morsetto e lasciare riposare l'animale con il nastro clinico sulla coda, ma senza il peso (Figura 1).
- Preparare i seguenti materiali: pesi, filo per tenere pesi, clip per alligatori in acciaio e nastro adesivo clinico.
3. Acclimatazione
NOTA: Una corretta acclimatazione è essenziale per evitare il rifiuto dell'esercizio e ridurre al minimo lo stress. L'acclimatazione è una fase cruciale prima che vengano eseguiti test di valutazione della resistenza o protocolli di allenamento. Dovrebbe essere speso un tempo adeguato per ottenere segni comportamentali di comfort negli animali. I dettagli dell'acclimatazione giornaliera con le scale statiche e dinamiche sono mostrati rispettivamente nella Tabella 1 e nella Tabella 2.
- Abituare gli animali a stare nell'area di riposo in cima alla scala (statica o dinamica). Lascia gli animali in questo posto in gruppi di quattro, con lettiere dalla loro gabbia, per 15 minuti ogni giorno. Di solito, dopo 3-5 giorni, gli animali non mostreranno segni di stress.
- Insegna agli animali a salire, non a scendere, la scala. Usando la scala statica, posiziona i topi su un gradino vicino alla cima, da dove possono vedere l'area di riposo. Istintivamente ci andranno. Quindi, insegna loro a salire progressivamente da cinque gradini (3x) il primo giorno, a 10 gradini (3x) il giorno seguente, fino a 15 gradini (3x) (Tabella 1).
Utilizzare la stessa procedura con la scala dinamica, prima senza movimento, poi con la scala che si muove a 5,4 cm/s e 6,6 cm/s e gli animali che salgono per 2 minuti, completando cinque serie (Tabella 2). - Adattare gli animali a trasportare pesi, a partire dal terzo giorno di acclimatazione. Attaccare un pezzo di nastro clinico alla base della coda che verrà utilizzato per contenere i pesi.
- Dal settimo giorno di acclimatazione, attaccare piccoli pesi (5-10 g) al nastro clinico con una clip di gator . Evita di eseguire troppe serie, in modo che l'adattamento non si trasformi in allenamento.
NOTA: L'acclimatazione del gruppo di controllo è obbligatoria nel caso in cui questo gruppo esegua il test di resistenza. Dopo questo periodo, eseguire un promemoria di arrampicata una volta alla settimana, con nastro adesivo ma senza pesi.
4. Valutazione della resistenza
- Test incrementali per valutare la resistenza massima
NOTA: Questo test intende determinare la resistenza massima misurata come il peso massimo al quale gli animali possono salire 10 pioli sulla scala statica, che definisce il massimo di 10 ripetizioni (10 RM)4. Questo protocollo è stato adattato da studi precedenti (rivisti in Kregel et al.15).- Per il riscaldamento eseguire tre serie di 10 ripetizioni, 10 passi/ripetizione, senza carico esterno. Per la prima serie impostare la pendenza a 90°, e successivamente a 85°. Lasciare un periodo di riposo di 60 s tra una serie e l'altra.
- Impostare la pendenza a 85° (per evitare che i pesi sfiorano o si aggancino ai pioli della scala).
- Attacca il nastro intorno alla coda dell'animale per contenere i pesi e prepara i pesi come spiegato in precedenza.
- Inizia il test con un carico esterno di 10 g ed esegui una serie di 10 passaggi.
- Rimuovere il peso e consentire un periodo di riposo di 120 s nell'area di riposo.
- Eseguire serie successive di 10 passaggi aumentando il carico esterno di 5 g fino all'esaurimento. Lasciare il periodo di riposo (120 s) tra una serie e l'altra.
- Se un animale non riesce a salire 10 gradini con un particolare carico di peso, consentire un altro tentativo con lo stesso carico dopo 120 s di riposo. Se riesce a salire con il carico, continua il test con il carico successivo. Se si guasta di nuovo, registrare il carico di peso dell'ultima serie completata come carico di peso massimo.
- Il risultato del test può essere espresso come peso esterno assoluto (g), come carico massimo in relazione al peso corporeo (%), o come massa sollevata per grammo di peso corporeo, a discrezione del ricercatore.
NOTA: Il protocollo precedente rappresenta un modello su cui sono possibili numerose modifiche, ad esempio, per valutare la massima resistenza di topi geneticamente modificati con disabilità neuromuscolari. Questi animali non sono in grado di arrampicarsi con carichi esterni e hanno difficoltà a salire 10 pioli con la scala impostata a 90° di pendenza (dati non pubblicati). Il protocollo consisteva nel salire cinque gradini senza carico esterno, partendo da una pendenza di 110°. La pendenza è diminuita di 5° in ogni serie fino a 85° con 120 s di riposo dopo ogni serie. In questo caso, la resistenza massima è stata espressa come il numero accumulato di passi saliti (senza considerare le ripetizioni dopo i fallimenti). Il gruppo di controllo wild-type, dopo aver raggiunto la pendenza di 85°, proseguirà con la prova aggiungendo peso esterno alla coda, seguendo il protocollo precedente, fino ad esaurimento.
- Test di massima resistenza-resistenza con la scala statica
- Per il riscaldamento eseguire tre serie di 10 ripetizioni, 10 passi/ripetizione, senza carico esterno. Per la prima serie, impostare la pendenza a 90° e successivamente a 85°. Lasciare un periodo di riposo di 60 s tra una serie e l'altra.
- Impostare la pendenza a 85°.
- Agganciare il peso sul nastro clinico posto intorno alla coda del mouse.
NOTA: A seconda dell'età e delle caratteristiche degli animali, il carico esterno può essere il peso massimo ottenuto in un precedente test incrementale, una percentuale di esso (ad esempio, 50%) o una percentuale del peso corporeo (ad esempio, 100% -200%). Se questo test viene eseguito dopo un periodo di allenamento, si consiglia di utilizzare lo stesso carico del test iniziale per valutare le modifiche. - Eseguire serie consecutive di 10 passaggi fino all'esaurimento. Non è consentito alcun tempo di riposo dopo ogni serie.
- Il risultato del test è il numero di pioli saliti.
- Test di massima resistenza-resistenza con la scala dinamica
NOTA: L'uso della scala dinamica consente al ricercatore di controllare la velocità di salita.- Impostare la pendenza a 85°.
- Impostare la velocità a 4,2 cm/s.
- Per il riscaldamento eseguire tre serie di 100 passi, senza carico esterno. Lasciare un periodo di riposo di 60 s tra una serie e l'altra.
- Agganciare il peso sul nastro clinico posto intorno alla coda del mouse.
NOTA: A seconda dell'età e delle caratteristiche degli animali, il carico esterno può essere il peso massimo ottenuto in un precedente test incrementale, una percentuale di esso (ad esempio, 50%) o una percentuale del peso corporeo (ad esempio, 100% -200%). Se questo test viene eseguito dopo un periodo di allenamento, si consiglia di utilizzare lo stesso carico del test iniziale per valutare le modifiche. - Iniziare a 4,2 cm/s e aumentare la velocità di 1,2 cm/s ogni 60 s fino ad esaurimento.
NOTA: Il risultato del test è il tempo di esercizio, il numero di pioli saliti o la velocità massima.
5. Allenamento di resistenza con scala statica
NOTA: Prima di iniziare il periodo di formazione, sono necessari l'acclimatazione (Tabella 1) e la pianificazione dell'allenamento. Per ridurre l'ansia, adattare e addestrare i topi in gruppi di quattro animali che condividono la stessa gabbia.
- Per il riscaldamento quotidiano eseguire tre serie di 10 ripetizioni, 10 passi/ripetizione, senza carico esterno. Per la prima serie impostare la pendenza a 90°, e successivamente a 85°. Lasciare un periodo di riposo di 60 s tra una serie e l'altra.
- La sessione di allenamento inizia nell'area di riposo. Aggancia l'alligatore con il peso sul nastro clinico.
- Posizionare delicatamente il mouse 10-20 pioli sotto il luogo di riposo. Consentire al mouse di afferrare il gradino e salire sull'area di riposo.
Ripetere questo processo fino al completamento del numero di pioli in questa serie (ad esempio, 10 pioli x 10 serie). - Rimuovere il peso dalla coda del mouse e attendere 120 secondi fino alla serie successiva.
- Aumentare il numero di passi e i carichi di peso massimi della serie durante tutto il periodo di allenamento, mantenendo il programma settimanale.
NOTA: un esempio della variazione dei carichi durante la pianificazione settimanale è mostrato nella tabella 3. A breve, martedì e venerdì con carico di peso elevato (40-50 g) e un basso numero di passi (500-400); lunedì e giovedì con carico di peso intermedio (25-35 g) e un numero intermedio di passi (800-600); e mercoledì senza carico di peso ma un numero elevato di passi (2.000). Questo design facilita il recupero dalle precedenti sessioni di allenamento ed evita infortuni e sovrallenamento. Esempi di 3 settimane di allenamento con più progetti utilizzando la scala statica sono mostrati nella Tabella 4 (rispettivamente all'inizio, al centro e alla fine del periodo di formazione)4.
6. Allenamento di resistenza con scala dinamica
NOTA: Dopo l'acclimatazione, l'allenamento sulla scala dinamica è abbastanza simile a quello statico (Tabella 2). L'allenamento viene eseguito su 2-4 topi alla volta.
- Impostare la pendenza a 85°, chiudere la porta dell'area di riposo e avviare la scala alla velocità desiderata (ad esempio, 5,4 cm/s).
- Per il riscaldamento eseguire tre serie di 100 passi, senza carico esterno. Lasciare un periodo di riposo di 60 s tra una serie e l'altra.
- Prima dell'inizio delle sessioni di allenamento, quando il topo si trova nell'area di riposo, agganciare l'alligatore con il peso sul nastro clinico. In alternativa, il peso può essere fissato quando il mouse è già sulla scala.
- Posiziona delicatamente il mouse in cima alla scala mobile con il peso sulla coda. Lascia che i topi afferrino il gradino e salire.
- Quando viene raggiunto il numero di pioli in questa serie (ad esempio, 100), rimuovere i pesi. Quindi la porta viene aperta in modo che l'animale possa andare nell'area di riposo. Il tempo di riposo è di 120 s prima della serie successiva.
NOTA: Il numero di gradini saliti viene conteggiato in funzione del tempo di salita alla velocità impostata. - Ripetere questa procedura fino al completamento della sessione di allenamento. Il programma di allenamento giornaliero dettagliato è mostrato nella Tabella 5.
7. Valutazione dell'effetto crossover dell'allenamento di resistenza sulle prestazioni di resistenza
NOTA: Per questo, viene eseguito un test incrementale sul tapis roulant4, dopo 24 ore di riposo.
- Dopo un riscaldamento di 3 minuti a 10 cm/s, iniziare la prova incrementale a 10 cm/s e angolo di inclinazione di 10°.
- Aumentare la velocità di 3,33 cm/s ogni 3 minuti fino ad esaurimento.
NOTA: non vengono utilizzate scosse elettriche, quindi un pennello da pittore viene posizionato sul retro del tapis roulant per evitare che i topi scappino via.
8. Comportamento animale durante le procedure
NOTA: Il monitoraggio continuo dell'adattamento dei topi all'allenamento deve essere eseguito per rilevare affaticamento estremo, sovrallenamento o lesioni.
- Osservare i segni del benessere degli animali, in particolare la toelettatura e il rifiuto dell'addestramento. Il comportamento normale del topo, dopo una serie di allenamenti intensi, è quello di rimanere inattivo per circa un minuto a causa della stanchezza. Dopo di ciò, iniziano a pulire, esplorare o cercare di rimuovere il nastro sulla coda.
- Nel caso in cui un topo si rifiuti di allenare una serie, prova a dare pause più lunghe o addirittura a non eseguire quella serie per prevenire l'inibizione.
- Occasionalmente, quando si eseguono esercizi leggeri, spingere delicatamente la coda dell'animale, per incoraggiarlo a finire la serie. Gli animali smettono di arrampicarsi perché non è un compito impegnativo. Al contrario, quando gli animali trasportano un carico pesante, sposta delicatamente il peso dell'animale per alleggerire il carico e incoraggiarlo a finire la serie, quindi consentire all'animale di riposare fino alla prossima sessione di allenamento. Gli animali possono fermarsi o addirittura tentare di scendere a causa del carico pesante.
9. Procedure di sicurezza
- Procedure di sicurezza per i ricercatori: condurre ricerche nel laboratorio della struttura per animali e utilizzare copriscarpe, tute, guanti, berretti e maschere. Non ci sono requisiti aggiuntivi oltre a quelli specifici per la ricerca sugli animali.
- Sicurezza per gli animali: Durante le sessioni di allenamento è necessario prestare un'attenzione continua agli animali, a causa di potenziali rischi, come cadute o salti. Metti una mano sotto i pesi per catturare e tenere i topi in caso di caduta a causa dell'esaurimento, poiché la sua capacità di trattenere correttamente i pioli sarà limitata.
Risultati
Risultati con scala statica
Il protocollo di allenamento progressivo di resistenza utilizzato e descritto da Codina-Martinez et al.4 (Tabella 4) è stato testato in uno studio preliminare consistente in 7 settimane di allenamento su una scala statica con topi C57BL6J wild-type di 6 mesi (n = 4). In questo studio preliminare, sono stati eseguiti test incrementali per valutare la forza massima prima e dopo il periodo di allenamento. Abbiamo osservato un aumento d...
Discussione
La formazione è un intervento con molteplici applicazioni nella ricerca, oltre allo studio dell'esercizio stesso. Pertanto, l'analisi del suo effetto sull'invecchiamento20 o su determinate condizioni patologiche e sulla terapia fisica21 ha ricevuto molta attenzione negli ultimi anni. Inoltre, numerosi autori hanno analizzato l'effetto degli interventi farmacologici22 o dietetici21 sulla forma fisica. In questo contesto, è so...
Divulgazioni
L'autore corrispondente garantisce che tutti gli autori non abbiano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato in parte sostenuto dal Ministerio de Economía y Competitividad, Spagna (DEP2012-39262 a EI-G e DEP2015-69980-P a BF-G). Grazie a Frank Mcleod Henderson Higgins del McLeod's English Centre nelle Asturie, Spagna, per l'assistenza linguistica.
Materiali
| Name | Company | Catalog Number | Comments |
| Dynamic ladder | in-house production | ||
| Elastic adhesive bandage 6 cm x 2.5 m | BSN medical | 4005556 | |
| Gator Clip Steel NON-INSUL 10A | Digikey electronics | BC60ANP | |
| Static ladder | in-house production | ||
| Weights | in-house production | ||
| Wire for holding weigths | in-house production |
Riferimenti
- Pedersen, B. K., Saltin, B. Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases. Scandinavian Journal of Medicine & Science in Sports. 25, 1-72 (2015).
- Westcott, W. L. Resistance training is medicine: effects of strength training on health. Current Sports Medicine Reports. 11 (4), 209-216 (2012).
- Garatachea, N., et al. Exercise attenuates the major hallmarks of aging. Rejuvenation Research. 18 (1), 57-89 (2015).
- Codina-Martinez, H., et al. Autophagy is required for performance adaptive response to resistance training and exercise-induced adult neurogenesis. Scandinavian Journal of Medicine & Science in Sports. 30 (2), 238-253 (2020).
- Conner, J. D., Wolden-Hanson, T., Quinn, L. S. Assessment of murine exercise endurance without the use of a shock grid: an alternative to forced exercise. Journal of Visualized Experiments: JoVE. (90), e51846 (2014).
- Meijer, J. H., Robbers, Y. Wheel running in the wild. Proceedings of the Royal Society B: Biological Sciences. 281 (1786), 20140210 (2014).
- Suchomel, T. J., Nimphius, S., Bellon, C. R., Hornsby, W. G., Stone, M. H. Training for muscular strength: Methods for monitoring and adjusting training intensity. Sports Medicine. 51 (10), 2051-2066 (2021).
- Pousson, M., Perot, C., Goubel, F. Stiffness changes and fibre type transitions in rat soleus muscle produced by jumping training. Pflügers Archive. 419 (2), 127-130 (1991).
- Marqueti, R. C., et al. Biomechanical responses of different rat tendons to nandrolone decanoate and load exercise. Scandinavian Journal of Medicine & Science in Sports. 21 (6), 91-99 (2011).
- Cunha, T. S., Tanno, A. P., Costa Sampaio Moura, M. J., Marcondes, F. K. Influence of high-intensity exercise training and anabolic androgenic steroid treatment on rat tissue glycogen content. Life Sciences. 77 (9), 1030-1043 (2005).
- Heinemeier, K. M., et al. Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. The Journal of Physiology. 582, 1303-1316 (2007).
- Hornberger, T. A., Farrar, R. P. Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat. Canadian Journal of Applied Physiology. 29 (1), 16-31 (2004).
- Yarasheski, K. E., Lemon, P. W., Gilloteaux, J. Effect of heavy-resistance exercise training on muscle fiber composition in young rats. Journal of Applied Physiology. 69 (2), 434-437 (1990).
- Khamoui, A. V., et al. Aerobic and resistance training dependent skeletal muscle plasticity in the colon-26 murine model of cancer cachexia. Metabolism. 65 (5), 685-698 (2016).
- Kregel, K. C., et al. Resource book for the design of animal exercise protocols. American Physiological Society. 152, (2006).
- Marino, G., et al. Autophagy is essential for mouse sense of balance. The Journal of Clinical Investigation. 120 (7), 2331-2344 (2010).
- Figueiredo, V. C., de Salles, B. F., Trajano, G. S. Volume for muscle hypertrophy and health outcomes: The most effective variable in resistance training. Sports Medicine. 48 (3), 499-505 (2018).
- Gentil, P., et al. Using velocity loss for monitoring resistance training effort in a real-world setting. Applied Physiology, Nutrition, and Metabolism. 43 (8), 833-837 (2018).
- Fernández-Sanjurjo, M., et al. Is physical performance (in mice) increased by Veillonella atypica or decreased by Lactobacillus bulgaricus. Journal of Sport and Health Science. 9 (3), 197-200 (2020).
- Shiguemoto, G. E., et al. Effects of resistance training on matrix metalloproteinase-2 activity and biomechanics and physical properties of bone in ovariectomized and intact rats. Scandivavian Journal of Medicine & Science in Sports. 22 (5), 607-617 (2012).
- de Sousa Neto, I. V., et al. Effects of resistance training on matrix metalloproteinase activity in skeletal muscles and blood circulation during aging. Frontiers in Physiology. 9, 190 (2018).
- Ghosh, S., Golbidi, S., Werner, I., Verchere, B. C., Laher, I. Selecting exercise regimens and strains to modify obesity and diabetes in rodents: an overview. Clinical Science. 119 (2), 57-74 (2010).
- Mônico-Neto, M., et al. Resistance training minimizes catabolic effects induced by sleep deprivation in rats. Applied Physiology, Nutrition, and Metabolism. 40 (11), 1143-1150 (2015).
- Hawley, J. A., Hargreaves, M., Joyner, M. J., Zierath, J. R. Integrative biology of exercise. Cell. 159 (4), 738-749 (2014).
- Booth, F. W., Laye, M. J., Spangenburg, E. E. Gold standards for scientists who are conducting animal-based exercise studies. Journal of Applied Physiology. 108 (1), 219-221 (1985).
- Kruger, K., et al. Functional and muscular adaptations in an experimental model for isometric strength training in mice. PLoS One. 8 (11), 79069 (2013).
- Hendrickse, P. W., Krusnauskas, R., Hodson-Tole, E., Venckunas, T., Degens, H. Endurance exercise plus overload induces fatigue resistance and similar hypertrophy in mice irrespective of muscle mass. Experimental Physiology. 105 (12), 2110-2122 (2020).
- Knab, A. M., et al. Repeatability of exercise behaviors in mice. Physiology & Behavior. 98 (4), 433-440 (2009).
- Konhilas, J. P., et al. Loaded wheel running and muscle adaptation in the mouse. American Journal of Physiology-Heart and Circulatory Physiology. 289 (1), 455-465 (2005).
- Reiter, A., et al. Functional measures of grip strength and gait remain altered long-term in a rat model of post-traumatic elbow contracture. The Journal of Biomechanical Engineering. , (2019).
- Stieglitz, T., Schuettler, M., Schneider, A., Valderrama, E., Navarro, X. Noninvasive measurement of torque development in the rat foot: measurement setup and results from stimulation of the sciatic nerve with polyimide-based cuff electrodes. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 11 (4), 427-437 (2003).
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflügers Archiv. 466 (9), 1673-1687 (2014).
- Tanaka, H., Swensen, T. Impact of resistance training on endurance performance. A new form of cross-training. Sports Medicine. 25 (3), 191-200 (1998).
- Hakkinen, K., Mero, A., Kauhanen, H. Specificity of endurance, sprint and strength training on physical performance capacity in young athletes. The Journal of Sports Medicine and Physical Fitness. 29 (1), 27-35 (1989).
- Vellers, H. L., Kleeberger, S. R., Lightfoot, J. T. Inter-individual variation in adaptations to endurance and resistance exercise training: genetic approaches towards understanding a complex phenotype. Mammalian Genome. 29 (1), 48-62 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon