このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
動物モデルにおける静的および動的はしごを使用したレジスタンストレーニングと評価のためのプロトコルの多様性
要約
本プロトコルは、動物モデルにおける静的および動的はしごを使用したレジスタンストレーニングおよびテストについて説明しています。
要約
レジスタンストレーニングは、生涯を通じて健康に大きな利益をもたらす身体運動モデルです。抵抗運動動物モデルの使用は、これらの適応を調整する根底にある分子メカニズムへの洞察を得る方法です。この記事の目的は、動物モデルにおける筋力トレーニングと抵抗の評価のために設計された運動モデルとトレーニングプロトコルについて説明し、例を提供することです。この記事では、筋力トレーニングと抵抗評価は、静的および動的なはしごを使用して、はしご登り活動に基づいています。これらのデバイスは、さまざまなトレーニングモデルを可能にするだけでなく、抵抗運動を決定する主要な変数(ボリューム、負荷、速度、および周波数)の正確な制御を提供します。さらに、人間の抵抗運動とは異なり、これは強制的な運動です。したがって、動物福祉を維持するために、この介入では嫌悪刺激を避ける必要があります。実装前に、順応と学習期間とともに、詳細な設計が必要です。はしご、ウェイト、臨床テープなどのトレーニングデバイス、および必要な操作への順応は、運動拒否を回避し、ストレスを最小限に抑えるために必要です。同時に、動物ははしごの上の休憩所まで、はしごを下ろすのではなく、はしごを登るように教えられます。抵抗評価は、体力を特徴付け、トレーニング負荷とトレーニングへの反応を調整および定量化することができます。さらに、異なるタイプの強度を評価することができます。トレーニングプログラムに関しては、適切な設計とデバイスの使用により、さまざまなタイプの強度を調整するのに十分な汎用性があります。さらに、それらは、動物の適応的および行動的反応または傷害の存在に応じて修正されるのに十分な柔軟性を有するべきである。結論として、はしごとウェイトを使用したレジスタンストレーニングと評価は、動物研究における用途の広い方法です。
概要
身体運動は、健康を促進し、ヒトで最も一般的な慢性疾患およびある種の癌の発生率を低下させるための決定的なライフスタイル要因です1。
レジスタンス運動は、生涯にわたる健康への圧倒的な関連性2、特にサルコペニア、骨粗鬆症などの自発運動系に影響を与える加齢性疾患に対抗する利点があるため、関心を高めています3。また、抵抗運動は、脳4などの運動の実行に直接関与しない組織や臓器にも影響を及ぼす。近年のこの関連性は、ヒトでは不可能な場合、または動物がより良い洞察を提供し、より制御されたモデルである場合に、根底にあるチスラーおよび分子メカニズムを研究するための動物における抵抗運動モデルの開発を奨励している。
人間の抵抗運動とは異なり、動物モデルの場合、研究者は通常、強制的な手順に依存しています。ただし、この文脈では、主に動物福祉を維持し、ストレスを軽減し、実験手順の重症度を下げるために、嫌悪刺激を避ける必要があります5。動物は野生でも運動を楽しむことに注意する必要があります6。これらの理由から、長期の段階的順応を通じて実験への適応を改善する必要がある。
実験動物のレジスタンストレーニングと評価に使用されるデバイス、材料、およびプロトコルは、負荷、体積、速度、および周波数などの多数の変数の正確な制御と変調を可能にする必要があります7。また、同心円、偏心、等尺性など、さまざまな種類の筋肉収縮を実行できるようにする必要があります。上記を考慮すると、使用されるプロトコルは、強度のさまざまなアプリケーション(最大強度、肥大、速度、および持久力)について具体的に評価またはトレーニングできる必要があります。
筋力トレーニングには、水中でのジャンプ8,9、水中での加重水泳10、筋肉電気刺激11など、いくつかの方法があります。ただし、静的および動的はしごは、広く使用されている用途の広いデバイスです12、13、14。
実験動物モデルにおける耐性評価は、遺伝子組み換え動物の表現型特性の説明、さまざまな介入プロトコル(食事成分の補給、薬物治療、微生物叢移植など)の効果の評価、トレーニングプロトコルの効果の評価など、多くの研究環境に貴重な情報を提供します。トレーニングモデルは、筋力トレーニングへの適応の生理学に関する洞察を提供し、健康状態と病態生理学に対する運動の効果をよりよく理解するのに役立ちます。
したがって、動物モデルにおける筋力トレーニングや筋力の機能評価のための普遍的なプロトコルは存在しないため、汎用性の高いプロトコルが必要です。
この研究の目的は、動物モデルで静的および動的はしごを使用したレジスタンストレーニングと評価のプロトコルを設計および適用する際に考慮すべき最も関連性の高い要因を特定し、具体的な例を提供することです。
プロトコル
このプロトコルで提示された方法は、動物研究技術委員会によって評価および承認されています(参照PROAE 04/2018、プリンシパドデアストゥリアス、スペイン)。
1.計画
- 関心のある特性(遺伝子組み換え、病理モデル、年齢など)に基づいて研究する動物を慎重に選択し、プロトコルに特定の適応を適用します(ウェイトなしで登る、登るラングの数を減らす、傾斜)。
- 研究の目的に応じて、評価または訓練する強度モダリティ(最大強度、耐久力、速度など)を特定します。
- 機能評価またはトレーニングを組み立てるときは、これらのテストの結果に焦点を当てているかどうか、または他のタイプの臨床的、機能的、組織学的、または分子的決定を補完するかどうかを考慮して、パラメーターを慎重に調整してください。
- トレーニングに関連するすべての問題、特にタイムテーブル、トレーニング期間の期間、およびセッションの頻度を計画し、トレーニングテーブルを作成します。
- ウォームアップステップとはしごの傾斜を指定しますが、これはトレーニング全体で同じになります。セット、繰り返し、負荷(トレーニング期間の前に行われた抵抗テストの結果に基づく)を指定し、前のセッションに基づく負荷の増加に注意しながら、その間の休憩を指定します。
- 動物の福祉に応じて、人間の訓練と同様に計画を変更します。変更には、繰り返しの減少、セットまたは繰り返し間の休憩時間の増加、およびオーバートレーニングや怪我を避けるための負荷の減少が含まれます。
- 完成したら、動物倫理研究委員会による評価と承認のためにデザインを提出します。
2.抵抗運動のためのデバイスと材料
- デバイス:静的および動的はしご
注意: 2種類のはしご、いわゆる静的はしごと動的はしご( 図1を参照)は、レジスタンスのトレーニングと評価に使用できます( 資料表を参照)。- 直径1.5 mmの鋼線ステップが30 mm以上、15 mm離された垂直はしごを使用し、はしごの上部に少なくとも20 x 20 cmの静止領域があります。はしごの勾配は、水平面で80°から110°まで調整可能である必要があります(図1C)。非線形の上昇を防ぐために2車線を区切ります。
- 静的はしごに似た動的はしごを使用し、上部にプラスチックフィラメントバリアがあり、休憩エリアへのアクセスを制御するために開くことができ、下部にプラスチックフィラメントバリアを使用して、動物が降りるのを防ぎます。はしごの傾斜角度は80°から100°の間で調整可能でなければならず、最も一般的なのは85°です。
注:はしごは、直径8cmの上部シャフトと下部シャフトによって循環できます。下部シャフトは電気モーターによって駆動され、ステップが前部で下降し、後部で上昇し、無限のはしごを作成します。減速機と速度を11.6cm/sから3.3cm/sに下げるための速度レギュレーターが装備されており、最も一般的な速度は5.6cm/sです。
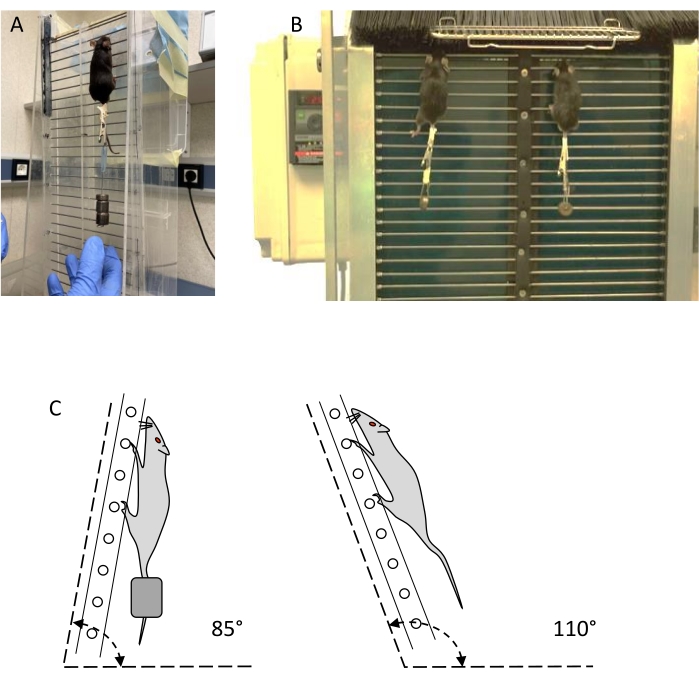
図1:レジスタンストレーニングデバイス:静的および動的はしご。 (A)静的はしごに外部重を乗せたマウストレーニング。(B)動的はしごで体重をかけてトレーニングする2匹のマウス。(C)トレーニングと評価のためのはしご角度の概略図。この図の拡大版を表示するには、ここをクリックしてください。
- 料
- 次の材料を準備します:おもり、おもりを保持するためのワイヤー、スチール製ゲイタークリップ、および臨床用粘着テープ。
注:重りは、質量の異なる鋼製シリンダー(5、10、15、20、25、および50 g)で、中央に直径5 mmの穴があり、ワイヤーにひもで固定されています(材料表)。おもりを保持するワイヤーは、装填する重りの数に応じて、直径1〜1.5 mm、長さ5〜10 cmの鋼でできています。 - 約3.0〜3.5 cm x 1.0〜1.5 cmのサイズの弾性絆創膏(材料表)を切り取り、動物の尾の周りに取り付けて重りを保持します。締めすぎは血流制限につながる恐れがありますので、ご注意ください。
注:最初は、動物の行動はテープと戦って噛むことですが、数日後、彼らはそれを容認し、いつものように手入れをし、ストレスの兆候を示しません。 - 目的のウェイトをワイヤーに挿入し、ワニクリップを引っ掛けます(材料表:スチール製ワニクリップとウェイトを保持するためのワイヤー)。
- 動物の尾に取り付けられた臨床テープにワニを固定します。
- 必要な横木を登った直後にクランプを外し、動物を尾に臨床テープを付けて休ませますが、体重はありません(図1)。
- 次の材料を準備します:おもり、おもりを保持するためのワイヤー、スチール製ゲイタークリップ、および臨床用粘着テープ。
3.順応
注:運動の拒絶反応を回避し、ストレスを最小限に抑えるには、適切な順応が不可欠です。順応は、抵抗評価テストまたはトレーニングプロトコルが実行される前の重要な段階です。動物の快適さの行動徴候を達成するために十分な時間を費やすべきです。静的および動的はしごによる毎日の順応の詳細を それぞれ表1 および表2に示す。
- はしごの一番上の休憩所にとどまるように動物を慣れさせます(静的または動的)。毎日15分間、ケージから寝具を使って、4人のグループで動物をこの場所に置いておきます。通常、3〜5日後、動物はストレスの兆候を示しません。
- はしごを下りるのではなく、登るように動物に教えます。静的はしごを使用して、マウスを上部近くの横木に置き、そこから休憩エリアが見えます。彼らは本能的にそれに行きます。次に、初日の5段(3倍)から翌日の10段(3倍)、最大15段(3倍)まで登るように徐々に教えます(表1)。
ダイナミックラダーでも同じ手順を使用し、最初は動かずに、次にはしごを5.4 cm / sと6.6 cm / sで移動し、動物を2分間登り、5つのシリーズを完了します(表2)。 - 順応の3日目から始めて、体重を運ぶように動物を適応させます。ウェイトを保持するために使用される尾の付け根に臨床テープを貼り付けます。
- 順応の7日目から、ワニ口クリップで臨床テープに小さなウェイト(5〜10 g)を取り付けます。あまりにも多くのシリーズを実行することを避けて、適応がトレーニングに変換されないようにします。
注:このグループが抵抗テストを実行する場合、コントロールグループの順応は必須です。この期間の後、週に一度、テープはあるがウェイトなしで、はしご登りのリマインダーを実行します。
4. 抵抗評価
- 最大強度を評価するための増分テスト
注:このテストは、動物が静的はしごで10段登ることができる最大重量として測定された最大抵抗を決定することを目的としています。このプロトコルは、以前の研究から適応されました(Kregelら15でレビュー)。- ウォームアップでは、外部負荷なしで、10回の繰り返し、10ステップ/回の繰り返しを3回実行します。最初のシリーズでは、勾配を90°に設定し、その後は85°に設定します。シリーズ間に60秒の休憩時間を許可します。
- 勾配を85°に設定します(ウェイトがはしごの横木にかすんだり引っ掛かったりするのを防ぐため)。
- 動物の尻尾の周りにテープを貼り付けて重りを保持し、前述のように重りを準備します。
- 10 gの外部負荷でテストを開始し、一連の10ステップを実行します。
- 重量を取り除き、休憩エリアで120秒の休憩時間を確保します。
- 消耗するまで外部負荷を5g増加させ、連続した10ステップを実行します。シリーズ間の休止期間(120秒)を許可します。
- 1匹の動物が特定の体重負荷で10段の階段を登れなかった場合は、120秒の休息後に同じ負荷で別の試みを許可します。負荷で上昇に成功すると、次の負荷でテストを続行します。再び失敗する場合は、最後に完了したシリーズの重量負荷を最大重量荷重として記録します。
- 試験結果は、研究者の裁量に従って、絶対外部重量(g)、体重に対する最大荷重(%)、または体重1グラムあたり持ち上げられた質量として表すことができます。
注:前のプロトコルは、たとえば、神経筋障害のある遺伝子組み換えマウスの最大耐性を評価するために、多数の変更が可能なモデルを表しています。これらの動物は、外部荷重で登ることができず、はしごを90°の傾斜に設定した状態で10段を登るのが困難です(未発表データ)。プロトコルは、110°の傾斜から始めて、外部負荷なしで5つのステップを登ることで構成されていました。勾配は各シリーズで5°減少し、各シリーズの後に120秒の休憩で85°になりました。この場合、最大抵抗は累積登歩数(故障後の繰り返しを考慮せずに)で表した。野生型の対照群は、85°の傾斜に達した後、以前のプロトコルに従って、枯渇するまで尾に外部重りを追加してテストを続けます。
- 静的はしごによる最大耐久試験
- ウォームアップでは、外部負荷なしで、10回の繰り返し、10ステップ/回の繰り返しを3回実行します。最初のシリーズでは、勾配を90°に設定し、その後85°に設定します。シリーズ間に60秒の休憩時間を許可します。
- 勾配を85°に設定します。
- マウスの尾の周りに置かれた臨床テープに体重をクリップします。
注:動物の年齢と特性に応じて、外部負荷は、以前の増分テストで得られた最大体重、そのパーセンテージ(たとえば、50%)、または体重のパーセンテージ(たとえば、100%-200%)になります。このテストを一定期間のトレーニング後に実行する場合は、最初のテストと同じ負荷を使用して変更を評価することをお勧めします。 - 使い果たされるまで連続した10ステップを実行します。各シリーズの後に休憩時間は許可されていません。
- テスト結果は、登ったラングの数です。
- 動的はしごによる最大耐久試験
注:ダイナミックラダーを使用すると、研究者は上昇速度を制御できます。- 勾配を85°に設定します。
- 速度を4.2 cm / sに設定します。
- ウォームアップのために、外部負荷なしで、100ステップの3つのシリーズを実行します。シリーズ間に60秒の休憩時間を許可します。
- マウスの尾の周りに置かれた臨床テープに重りをクリップします。
注:動物の年齢と特性に応じて、外部負荷は、以前の増分テストで得られた最大体重、そのパーセンテージ(たとえば、50%)、または体重のパーセンテージ(たとえば、100%-200%)になります。このテストを一定期間のトレーニング後に実行する場合は、最初のテストと同じ負荷を使用して変更を評価することをお勧めします。 - 4.2 cm / sから始めて、消耗するまで1.2秒ごとに60 cm / sずつ速度を上げます。
注意: テスト結果は、運動時間、登ったラングの数、または最高速度です。
5.静的はしごによるレジスタンストレーニング
注意: トレーニング期間を開始する前に、順応(表1)とトレーニング計画が必要です。不安を軽減するために、同じケージを共有する4匹の動物のグループでマウスを適応させ、訓練します。
- 毎日のウォーミングアップでは、外部負荷なしで、10回の繰り返し、10ステップ/繰り返しの3つのシリーズを実行します。最初のシリーズでは、勾配を90°に設定し、その後は85°に設定します。シリーズ間に60秒の休憩時間を許可します。
- トレーニングセッションは休憩所から始まります。臨床テープの重さでワニをクリップします。
- マウスを休憩場所の10〜20段下にそっと置きます。マウスが横木をつかみ、休憩エリアに登るのを待ちます。
このシリーズのラング数(たとえば、10ラングx10シリーズ)が完了するまで、このプロセスを繰り返します。 - マウスの尾からウェイトを取り除き、次のシリーズまで120秒待ちます。
- 毎週のスケジュールを維持しながら、トレーニング期間中のシリーズのステップ数と最大重量負荷を増やします。
注: 週計画中の負荷の変動の例を 表 3 に示します。まもなく、火曜日と金曜日に高い重量負荷(40-50 g)と低いステップ数(500-400)があります。月曜日と木曜日、中間の重量負荷(25〜35 g)と中間のステップ数(800〜600)。水曜日は体重負荷はありませんが、歩数が多い(2,000)。この設計により、以前のトレーニングセッションからの回復が容易になり、怪我やオーバートレーニングを回避できます。静的ラダーを使用した複数の設計による3週間のトレーニングの例を 表 4に示します(トレーニング期間の開始時、途中、終了時にそれぞれ)4。
6.ダイナミックラダーによるレジスタンストレーニング
注意: 順応後、動的はしごでのトレーニングは静的なトレーニングと非常によく似ています(表2)。トレーニングは一度に2〜4匹のマウスで行われます。
- 傾斜を85°に設定し、休憩エリアのドアを閉じて、希望の速度(たとえば、5.4 cm / s)ではしごを開始します。
- ウォームアップのために、外部負荷なしで、100ステップの3つのシリーズを実行します。シリーズ間に60秒の休憩時間を許可します。
- トレーニングセッションが始まる前に、マウスが休憩エリアにいるときに、臨床テープの重さでワニをクリップします。あるいは、マウスがすでにはしご上にあるときにウェイトを取り付けることもできます。
- 尾に重りを乗せて、動く階段の上にマウスをそっと置きます。マウスが横木をつかんで登るのを待ちます。
- このシリーズのラングの数(たとえば、100)に達したら、ウェイトを削除します。それから動物が休憩所に行くことができるようにドアが開かれます。残り時間は次のシリーズの120秒前です。
注意: 登った歩数は、設定速度での上昇時間の関数としてカウントされます。 - トレーニングセッションが完了するまで、この手順を繰り返します。詳細な毎日のトレーニングプログラムを 表5に示します。
7. レジスタンストレーニングが持久力性能に及ぼすクロスオーバー効果の評価
注意: このために、インクリメンタルトレッドミルテストが実行されます 4、24時間の休息後。
- 10 cm / sで3分間のウォームアップ後、10 cm / sおよび10°の傾斜角でインクリメンタルテストを開始します。
- 消耗するまで3.33分ごとに3cm / sの速度を上げます。
注意: 電気ショックは使用されていないため、マウスがトレッドミルから逃げるのを防ぐために、画家のブラシがトレッドミルの後ろに配置されます。
8.処置中の動物の行動
注:極度の倦怠感、オーバートレーニング、または怪我を検出するために、マウスのトレーニングへの適応を継続的に監視する必要があります。
- 動物福祉の兆候、特に身だしなみと訓練の拒否を観察してください。マウスの正常な行動は、一連の激しいトレーニングの後、疲労のために約1分間非活動のままである。その後、彼らはグルーミング、探索、または尾のテープを取り除こうとします。
- マウスがシリーズのトレーニングを拒否した場合は、抑制を防ぐために、より長い休息を与えるか、そのシリーズを実行しないようにしてください。
- 時折、軽量の運動を行うときは、動物の尾をそっと押して、シリーズを終了するように促します。それは厳しい仕事ではないので、動物は登るのをやめます。逆に、動物が重い荷物を運んでいるときは、動物の体重をそっと移動して負荷を軽減し、シリーズを終了するように促してから、次のトレーニングセッションまで動物を休ませます。動物は重い負荷のために停止したり、降下しようとすることさえあります。
9. 安全手順
- 研究者のセキュリティ手順:動物施設の実験室で調査を実施し、靴カバー、つなぎ服、手袋、キャップ、マスクを使用します。動物研究に固有の要件以外の追加要件はありません。
- 動物の安全:運動セッション中は、転倒やジャンプなどの潜在的なリスクがあるため、動物に継続的な注意を払う必要があります。倦怠感のために転倒した場合にマウスを捕まえて保持するために、おもりの下に手を置きます、横木を適切に保持する能力が制限されるため。
結果
静的ラダーを使用した結果
Codina-Martinezらによって使用および記載された漸進的レジスタンストレーニングプロトコル4(表4)は、生後6ヶ月の野生型C57BL6Jマウス(n = 4)を用いた静的はしご上での7週間のトレーニングからなる予備研究で試験された。この予備研究では、最大強度を評価するための増分テストがトレーニング期間の前後に実行されました...
ディスカッション
トレーニングは、運動自体の研究とは別に、研究における複数のアプリケーションを持つ介入です。このように、老化20または特定の病的状態および理学療法21に対するその効果の分析は、近年多くの注目を集めている。さらに、多くの著者が体力に対する薬理学的22または食事21介入の効果を分析している。これに関連?...
開示事項
対応する著者は、すべての著者に利益相反がないことを保証します。
謝辞
この作業は、スペイン経済・競争大臣(DEP2012-39262からEI-GおよびDEP2015-69980-PからBF-G)によって部分的に支援されました。言語支援を提供してくれたスペインのアストゥリアスにあるMcLeod's English CentreのFrank McLeod Henderson Higginsに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Dynamic ladder | in-house production | ||
| Elastic adhesive bandage 6 cm x 2.5 m | BSN medical | 4005556 | |
| Gator Clip Steel NON-INSUL 10A | Digikey electronics | BC60ANP | |
| Static ladder | in-house production | ||
| Weights | in-house production | ||
| Wire for holding weigths | in-house production |
参考文献
- Pedersen, B. K., Saltin, B. Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases. Scandinavian Journal of Medicine & Science in Sports. 25, 1-72 (2015).
- Westcott, W. L. Resistance training is medicine: effects of strength training on health. Current Sports Medicine Reports. 11 (4), 209-216 (2012).
- Garatachea, N., et al. Exercise attenuates the major hallmarks of aging. Rejuvenation Research. 18 (1), 57-89 (2015).
- Codina-Martinez, H., et al. Autophagy is required for performance adaptive response to resistance training and exercise-induced adult neurogenesis. Scandinavian Journal of Medicine & Science in Sports. 30 (2), 238-253 (2020).
- Conner, J. D., Wolden-Hanson, T., Quinn, L. S. Assessment of murine exercise endurance without the use of a shock grid: an alternative to forced exercise. Journal of Visualized Experiments: JoVE. (90), e51846 (2014).
- Meijer, J. H., Robbers, Y. Wheel running in the wild. Proceedings of the Royal Society B: Biological Sciences. 281 (1786), 20140210 (2014).
- Suchomel, T. J., Nimphius, S., Bellon, C. R., Hornsby, W. G., Stone, M. H. Training for muscular strength: Methods for monitoring and adjusting training intensity. Sports Medicine. 51 (10), 2051-2066 (2021).
- Pousson, M., Perot, C., Goubel, F. Stiffness changes and fibre type transitions in rat soleus muscle produced by jumping training. Pflügers Archive. 419 (2), 127-130 (1991).
- Marqueti, R. C., et al. Biomechanical responses of different rat tendons to nandrolone decanoate and load exercise. Scandinavian Journal of Medicine & Science in Sports. 21 (6), 91-99 (2011).
- Cunha, T. S., Tanno, A. P., Costa Sampaio Moura, M. J., Marcondes, F. K. Influence of high-intensity exercise training and anabolic androgenic steroid treatment on rat tissue glycogen content. Life Sciences. 77 (9), 1030-1043 (2005).
- Heinemeier, K. M., et al. Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. The Journal of Physiology. 582, 1303-1316 (2007).
- Hornberger, T. A., Farrar, R. P. Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat. Canadian Journal of Applied Physiology. 29 (1), 16-31 (2004).
- Yarasheski, K. E., Lemon, P. W., Gilloteaux, J. Effect of heavy-resistance exercise training on muscle fiber composition in young rats. Journal of Applied Physiology. 69 (2), 434-437 (1990).
- Khamoui, A. V., et al. Aerobic and resistance training dependent skeletal muscle plasticity in the colon-26 murine model of cancer cachexia. Metabolism. 65 (5), 685-698 (2016).
- Kregel, K. C., et al. Resource book for the design of animal exercise protocols. American Physiological Society. 152, (2006).
- Marino, G., et al. Autophagy is essential for mouse sense of balance. The Journal of Clinical Investigation. 120 (7), 2331-2344 (2010).
- Figueiredo, V. C., de Salles, B. F., Trajano, G. S. Volume for muscle hypertrophy and health outcomes: The most effective variable in resistance training. Sports Medicine. 48 (3), 499-505 (2018).
- Gentil, P., et al. Using velocity loss for monitoring resistance training effort in a real-world setting. Applied Physiology, Nutrition, and Metabolism. 43 (8), 833-837 (2018).
- Fernández-Sanjurjo, M., et al. Is physical performance (in mice) increased by Veillonella atypica or decreased by Lactobacillus bulgaricus. Journal of Sport and Health Science. 9 (3), 197-200 (2020).
- Shiguemoto, G. E., et al. Effects of resistance training on matrix metalloproteinase-2 activity and biomechanics and physical properties of bone in ovariectomized and intact rats. Scandivavian Journal of Medicine & Science in Sports. 22 (5), 607-617 (2012).
- de Sousa Neto, I. V., et al. Effects of resistance training on matrix metalloproteinase activity in skeletal muscles and blood circulation during aging. Frontiers in Physiology. 9, 190 (2018).
- Ghosh, S., Golbidi, S., Werner, I., Verchere, B. C., Laher, I. Selecting exercise regimens and strains to modify obesity and diabetes in rodents: an overview. Clinical Science. 119 (2), 57-74 (2010).
- Mônico-Neto, M., et al. Resistance training minimizes catabolic effects induced by sleep deprivation in rats. Applied Physiology, Nutrition, and Metabolism. 40 (11), 1143-1150 (2015).
- Hawley, J. A., Hargreaves, M., Joyner, M. J., Zierath, J. R. Integrative biology of exercise. Cell. 159 (4), 738-749 (2014).
- Booth, F. W., Laye, M. J., Spangenburg, E. E. Gold standards for scientists who are conducting animal-based exercise studies. Journal of Applied Physiology. 108 (1), 219-221 (1985).
- Kruger, K., et al. Functional and muscular adaptations in an experimental model for isometric strength training in mice. PLoS One. 8 (11), 79069 (2013).
- Hendrickse, P. W., Krusnauskas, R., Hodson-Tole, E., Venckunas, T., Degens, H. Endurance exercise plus overload induces fatigue resistance and similar hypertrophy in mice irrespective of muscle mass. Experimental Physiology. 105 (12), 2110-2122 (2020).
- Knab, A. M., et al. Repeatability of exercise behaviors in mice. Physiology & Behavior. 98 (4), 433-440 (2009).
- Konhilas, J. P., et al. Loaded wheel running and muscle adaptation in the mouse. American Journal of Physiology-Heart and Circulatory Physiology. 289 (1), 455-465 (2005).
- Reiter, A., et al. Functional measures of grip strength and gait remain altered long-term in a rat model of post-traumatic elbow contracture. The Journal of Biomechanical Engineering. , (2019).
- Stieglitz, T., Schuettler, M., Schneider, A., Valderrama, E., Navarro, X. Noninvasive measurement of torque development in the rat foot: measurement setup and results from stimulation of the sciatic nerve with polyimide-based cuff electrodes. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 11 (4), 427-437 (2003).
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflügers Archiv. 466 (9), 1673-1687 (2014).
- Tanaka, H., Swensen, T. Impact of resistance training on endurance performance. A new form of cross-training. Sports Medicine. 25 (3), 191-200 (1998).
- Hakkinen, K., Mero, A., Kauhanen, H. Specificity of endurance, sprint and strength training on physical performance capacity in young athletes. The Journal of Sports Medicine and Physical Fitness. 29 (1), 27-35 (1989).
- Vellers, H. L., Kleeberger, S. R., Lightfoot, J. T. Inter-individual variation in adaptations to endurance and resistance exercise training: genetic approaches towards understanding a complex phenotype. Mammalian Genome. 29 (1), 48-62 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved