A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ביטוי חיידקי וטיהור של מטריקס אנושי Metalloproteinase-3 באמצעות כרומטוגרפיה זיקה
* These authors contributed equally
In This Article
Summary
טיהור התג שלו, דיאליזה, והפעלה מועסקים כדי להגדיל את התשואות של מסיס, מטריצה פעילה metalloproteinase-3 ביטוי חלבון תחום קטליטי בחיידקים. שברי חלבון מנותחים באמצעות ג'ל SDS-PAGE.
Abstract
מטריצה metalloproteinases (MMPs) שייכים למשפחה של פרוטאזים מצינזין עם תפקידים מרכזיים מטריצה חוץ תאית (ECM) השפלה ושיפוץ, כמו גם אינטראקציות עם מספר גורמי גדילה וציטוקינים. ביטוי יתר של MMPs ספציפיים אחראי במספר מחלות כגון סרטן, מחלות ניווניות ומחלות לב וכלי דם. MMPs היו מרכז תשומת הלב לאחרונה כמטרות לפתח טיפולית שיכולה לטפל במחלות בקורלציה MMP overexpression.
כדי ללמוד את מנגנון ה- MMP בפתרון, נדרשות שיטות ביטוי וטיהור חלבונים רקומביננטיות מקלות וחזקות יותר לייצור MMPs פעילים ומסיסים יותר. עם זאת, התחום הקטליטי של רוב MMPs לא יכול לבוא לידי ביטוי Escherichia coli (E. coli) בצורה מסיסת בשל חוסר מכונות פוסט-טרנסלטיות, בעוד מערכות ביטוי יונקים הם בדרך כלל יקרים ויש להם תשואות נמוכות יותר. גופי הכללת MMP חייבים לעבור את התהליך המייגע והמייגע של טיהור נרחב ושיפוץ מחדש, מה שמפחית באופן משמעותי את התשואה של MMPs בקונפורמציה מקומית. מאמר זה מציג פרוטוקול באמצעות Rosetta2(DE3)pLysS (להלן R2DP) תאים כדי לייצר מטריצה metalloproteinase-3 תחום קטליטי (MMP-3cd), המכיל N-מסוף His-tag ואחריו pro-domain (Hisx6-pro-MMP-3cd) לשימוש בטיהור זיקה. תאי R2DP משפרים את הביטוי של חלבונים אאוקריוטים באמצעות פלסמיד עמיד בפני כלורמפניקול המכיל קודונים נדירים בדרך כלל במערכות ביטוי חיידקיות. בהשוואה לקו התא המסורתי המועדף על ביטוי חלבון רקומביננטי, BL21(DE3), טיהור באמצעות זן חדש זה שיפר את התשואה של Hisx6-pro-MMP-3cd מטוהר. לאחר ההפעלה וההתפלה, התחום המקצועי נבקע יחד עם ה- N-terminal His-tag, ומספק MMP-3cd פעיל לשימוש מיידי באינספור יישומי הפריה חוץ גופית . שיטה זו אינה דורשת ציוד יקר או חלבוני היתוך מורכבים ומתארת ייצור מהיר של MMPs אנושיים רקומביננטיים בחיידקים.
Introduction
רוב החלבונים האוקריוטים המורכבים עוברים שינויים פוסט-טרנסליים מורכבים לאחר ההבעה, הדורשים קיפול חלבונים בסיוע גבוה וגורמים משותפים כדי להיות פונקציונליים1. ייצור כמויות גדולות של חלבון אנושי מסיס בפונדקאי חיידקי נותר אתגר משמעותי בשל עלויות גבוהות והיעדר שיטות ביטוי וטיהור חזקות, אפילו לניסויי מעבדה בקנה מידה קטן יותר2,3. MMPs, אנדופטידסים אנושיים עם משקל מולקולרי גדול, מתבטאים בדרך כלל כגופי הכללה בלתי מסיסים כאשר הם באים לידי ביטוי ב- E. coli. הפקת MMPs אנושיים מסיסים מובילה לעתים קרובות לתהליך solubilization מייגע וגוזל זמן רב4.
ל- MMPs יש תפקידים קריטיים הן בתהליכים פיזיולוגיים והן בתהליכים פתוגניים. MMPs אנושיים הם משפחה של 23 אנדופטידסים אבץ, מסווגים לפי מבנה ומצע ספציפיים, ובאים לידי ביטוי דיפרנציאלי למרות תחום קטליטי שמור מאוד 5,6. MMPs מופרשים כמו זימוגנים לא פעילים, מוסדר באמצעות הפעלה פוסט-טרנסלטית ומעכבים אנדוגני שלהם, מעכבי רקמות של metalloproteinases (TIMPs)7,8,9,10. למרות שהוכרו בתחילה על תפקידם במחזור ECM, MMPs היו מעורבים גם בפיתוח, מורפוגנזה, תיקון רקמות, ושיפוץ8. Dysregulation של MMPs נקשרה באופן בולט לסרטן יחד עם מחלות ניווניות, לב וכלי דם, פיברוטיות, בין מחלות אחרות5,7.
הפיתוח של שיטות ייצור MMP חזקות בקנה מידה גדול הוא קריטי כדי להבטיח את הצלחתם של מחקרים עתידיים של מנגנוני MMP באמצעות בדיקות ביוכימיות ומבוססות תאים. MMPs שונים התבטאו בעבר בחיידקים11, כולל MMPs מתויגים Hisx6, מבלי לשנות את פעילות ה- MMP12,13,14,15. עם זאת, שיטות אלה כוללות צעדים מייגעים וארוכים שעשויים להיות קשים לשכפול.
תאי יונקים יכולים לשמש גם כדי לבטא חלבונים אנושיים רבים ושונים תוך הבטחת השינויים הפוסט-טרנסליים הנכונים16. למרות שמערכת הביטוי של היונקים היא בחירה אידיאלית לייצר חלבונים אנושיים רקומביננטיים עם שינויים נכונים לאחר התרגום, החסרונות העיקריים של שיטה זו הם תשואות נמוכות ראשוניות, מדיה צמיחה יקרה ורגנטים, צירי זמן ארוכים כדי להגיע לקווי ביטוי יציבים, וסיכון לזיהום עם מינים אחרים כגון פטריות או חיידקים2,11 . יתר על כן, ייצור MMP בשורות תאי יונקים מניב זיהומים מחלבונים תאיים הקשורים כגון TIMPs או פיברונקטין11. שלא כמו צמיחת התאים האיטית שנצפתה בתאי יונקים, מערכת הביטוי החיידקית מציעה ייצור חלבון בקנה מידה גדול בפרק זמן קצר יחד עם מדיה פשוטה יותר ודרישות צמיחה. עם זאת, בשל היעדר חלבונים תאיים אחרים הקשורים (כלומר, TIMPs) במערכות ביטוי חיידקי, MMPs פעיל בריכוזים גבוהים יותר כפופים השפלה באמצעות autoproteolysis, וכתוצאה מכך תשואה MMP ירודה17.
מאמר זה מתאר שיטה מפורטת לביטוי חיידקי, טיהור והפעלה של Hisx6-pro-MMP-3cd רקומביננטי באמצעות E. coli כפונדקאי ביטוי בשל סבירותו, פשטותו, והצלחה בהפקת תשואות גבוהות יותר של MMPs2,3,18. מאז E. coli חסר את מכונות קיפול חלבון ועיבוד פוסט-טרנסלנטי הנדרש עבור MMPs רקומביננטי וחלבונים מורכבים אחרים, זנים רבים E. coli תוכננו כדי להתגבר על מגבלות אלה, מה שהופך את E. coli פונדקאי מתאים יותר לביטוי של MMP-3cd אנושי רקומביננטי, 19,20 . לדוגמה, זן R2DP המשמש במחקר זה משפר את הביטוי האוקריוטי על ידי אספקת פלסמיד עמיד בפני כלורמפניקול המכיל קודונים המשמשים לעתים רחוקות E. coli.
כפי שמתואר בפרוטוקול זה, לאחר הבעת יתר של גופי הכללה טהורים יחסית מווקטור pET-3a (איור 1) בתאי R2DP, חלבוני Hisx6-pro-MMP-3 קטליטי (MMP-3cd) מופקים ומנוטרלים4. Hisx6-pro-MMP-3cd3,19 היה מטוהר באמצעות כרומטוגרפיה תג זיקה. לאחר refolding ודיאליזה, pro-MMP-3cd (זימוגן) הופעל על ידי אצטט 4-aminophenylmercuric (APMA), וניתוח SDS-PAGE משמש להערכת התשואות ואת הצורך בטיהור נוסף5,21. פרוטוקול זה מתאר ביטוי, טיהור והפעלה של MMP-3cd מסיס כדוגמה. עם זאת, הוא עשוי לשמש גם כמדריך לביטוי של MMPs ופרוטאזים אנושיים אחרים עם ביטוי דומה, ומנגנוני הפעלה (איור 2). עבור חלבונים אחרים שאינם MMP-3cd, הקורא מומלץ לקבוע קומפוזיציות חיץ אופטימליות ושיטות עבור חלבון היעד שלהם לפני ניסיון פרוטוקול זה.
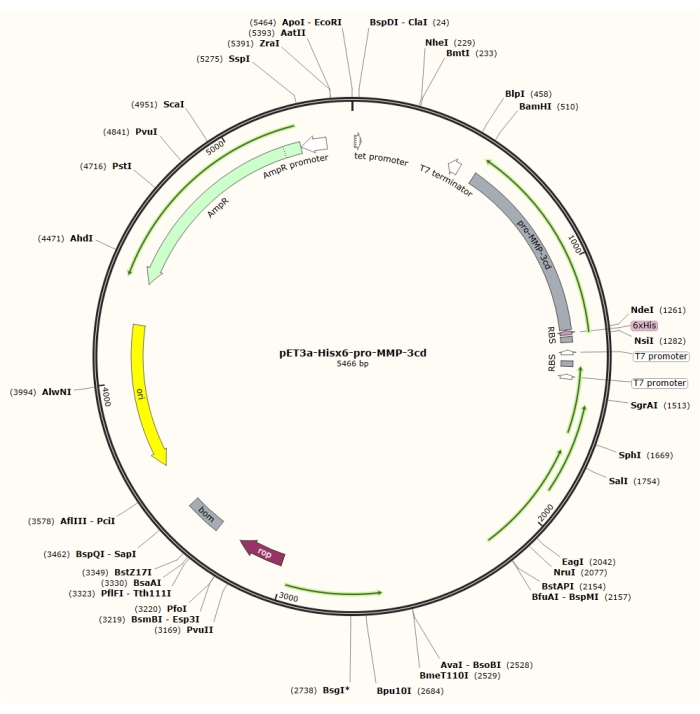
איור 1: מפת פלסמיד של הפלסמיד pET-3a-Hisx6-pro-MMP-3cd plasmid. וקטור pET-3a כולל גן עמידות אמפיצילין. רצף תגים מסוג N-terminal Hisx6 משוכפל לתוך וקטור מבוסס pET-3a, כולל פרו-MMP-3cd, כדי להניב את המבנה pET-3a-Hisx6-pro-MMP-3cd תחת שליטה של מקדם T7 בין אתרי ההגבלה BamHI ו- NdeI. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: ביטוי חיידקי של פלסמיד פרו-MMP-3cd, טיהור, שכפול מחדש והפעלה. 1.1: pET-3a-Hisx6-pro-MMP-3cd פלסמיד הפך לתאי BL21(DE3) או R2DP. 1.2: ביטוי חלבון פרו-MMP-3cd הושרה באמצעות IPTG. 1.3: תמוגה כימית ו sonication משמשים כדי לחלץ Hisx6-pro-MMP-3cd חלבונים כי הם בעיקר מסיסים ונמצאים בגופי ההכללה. אוריאה שימשה כדי denature ו solubilize חלבון מגופי הכללה. 2.1. חלבון Hisx6-pro-MMP-3cd מטוהר באמצעות טיהור כרומטוגרפיה של זיקה. 3. Hisx6-pro-MMP-3cd המנוטרל נפרש לאט במהלך דיאליזה באמצעות הסרה הדרגתית של אוריאה מהחוצץ. 4. לבסוף, חלבון MMP-3cd משוחזר הופעל באמצעות APMA על ידי הסרת תחום N-מסוף פרו פפטיד. APMA מוסר מאוחר יותר מהפתרון באמצעות התפלה. המספרים תואמים למקטעי פרוטוקול המתארים שלבים אלה. קיצורים: MMP-3cd = מטריקס metalloproteinase-3 תחום קטליטי; APMA = אצטט 4-אמינופניל-מרקורי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
1. ביטוי MMP
- שיבוט וטרנספורמציה של pET-3a-Hisx6-pro-MMP-3cd לתאי R2DP
- לעכל את pET-3a plasmid (ראה את טבלת החומרים) עם אנזימי הגבלה NdeI ו BamHI ב Digest Buffer (ראה טבלת החומרים). בנפח תגובה כולל של 40 μL, להוסיף 4 μL של מאגר תקציר, 33 μL של 100 ng / μL plasmid, ו 1.5 μL של כל אנזים הגבלה ולאפשר את התגובה להמשיך ~ 2 שעות עד להשלמת ב 37 °C (37 °F).
- בצע תגובת PCR ברצף MMP-3cd כדי להוסיף תג שלו N-מסוף. השתמש ב-25 μL של תערובת PCR (ראו טבלת החומרים), 2.5 מיקרו-ל' של 10 מיקרומטר פריימרים (איור S1 משלים) ו-1.25 μL של רצף ההוספה של 100 ננוגרם/μL. הוסף מים סטריליים לנפח תגובה סופי של 50 μL.
- הפעל את מוצר ה- PCR ואת הווקטור המעוכל על ג'ל אגרוז 1%. טהרו את רצועות הג'ל באמצעות ערכת התאוששות ג'ל (ראו טבלת החומרים) לפי פרוטוקול היצרן.
- שכפלו את מוצר ה-PCR המוגבר לווקטור המעוכל בין אתרי ההגבלה של NdeI ו-BamHI באמצעות תערובת הרכבות DNA (ראו טבלת החומרים). השתמש בכלים מקוונים כדי לקבוע את הנפח הנדרש של וקטור ההוספה והחיתוך עבור נפח תגובה כולל של 15 μL.
- להפשיר aliquot 50 μL של תאים בעלי יעילות טרנספורמציה גבוהה (ראה טבלת החומרים) על קרח עד להפשרה. לפני המלחמה SOC צמיחה בינוני (ראה את טבלת החומרים) עד 37 °C (LB-אמפיצילין) לוחות (LB-amp) (ראה את טבלת החומרים).
- הוסף 1-2 μL של pET-3a-Hisx6-פרו-MMP-3cd תגובת הרכבה כדי aliquot 50 μL. דגירה על קרח במשך 30 דקות.
- הלם חום התאים על ידי דגירה ב 42 °C (50 °F) עבור 30 s. דגירה על קרח במשך 2 דקות.
- הוסף 950 μL של מדיום צמיחה SOC לכל תערובת שנאי. יש לנער למשך שעה אחת ב-250 סל"ד וב-37°C (37°F).
- צלחת 100 μL של שנאים על לוחות מגבר LB ודגרה לילה ב 37 °C (60 °F).
- לחסן כל מושבה מבודדת ב 10 מ"ל של LB Amp בינוני. יש לנער למשך הלילה ב-250 סל"ד וב-37 מעלות צלזיוס.
- חלץ דנ"א פלסמיד לפי פרוטוקול היצרן עבור ערכת ההכנה הזעירה (ראה טבלת החומרים). אשרו את רצף המבנה באמצעות פריימרים T7 קדימה והפוך (איור S1 משלים).
הערה: ניתן לאחסן את ה- DNA של מבנה PET-3a-Hisx6-Pro-MMP-3cd ב-20 °C (60 °F). כאשר אתה מוכן, המשך בהפיכה לתאי R2DP. - להפשיר אחד 20 μL aliquot של תאי R2DP (ראה את טבלת החומרים) על קרח במשך 2-5 דקות. צמיחת SOC לפני המלחמה בינונית לטמפרטורת החדר ולוחות LB Amp CamR עד 37 °C (ראה טבלת החומרים).
- הוסף 1 μL של 100 ng/ μL רצף מאושר pET-3a-Hisx6-pro-MMP-3cd כדי aliquot 50 μL. מערבבים בעדינות לערבב ולהחזיר את הצינור לקרח.
- לדגור על הצינור על קרח במשך 5 דקות.
- הלם חום התאים על ידי דגירה ב 42 °C (50 °F) בדיוק 30 s. אל תרעד.
- מניחים את התאים על קרח במשך 2 דקות.
- הוסיפו 80 μL של מדיום SOC בטמפרטורת החדר לתערובת השנאים. יש לנער למשך שעה אחת ב-250 סל"ד וב-37°C (37°F).
- צלחת את השנאים על צלחות LB Amp CamR ודגור לילה ב 37 °C (50 °F).
- צמיחה ואינדוקציה
- לחסן מושבה אחת, מבודדת של R2DP pET-3a-Hisx6-pro-MMP-3cd טרנספורמט מצלחת LB Amp CamR ב 10 מ"ל של מדיה LB Amp CamR ב 37 °C (57 °F). יש לנער ב-250 סל"ד למשך הלילה (כ-16 שעות). שמור aliquots מכל תרבות ולהכין 40% (v /v) גליצרול (ראה טבלת החומרים) מניות אם תרצה.
- לכל תרבות לילה, לחסן בקבוקון 1 L המכיל 500 מ"ל של LB Amp CamR בינוני לצפיפות אופטית ב 600 ננומטר (OD600) של 0.05-0.1.
הערה: זה אמור להחזיר את התאים לצמיחה לוגריתמית. - מדוד את OD600 במספר נקודות זמן, בדרך כלל עבור 3-4 שעות, עד שהוא נופל בין 0.4 ל 0.6.
- לפני האינדוקציה, aliquot שבר של תרבות לתוך צינור microfuge 1.5 מ"ל (ראה את טבלת החומרים) ולתייג אותו שבר לא מושרה. לאחסן אותו ב -80 °C (80 °F) לניתוח ג'ל. אם אינך מפעיל ג'ל SDS-PAGE, דלג על שלב זה והמשיך לשלב 1.2.5.
- לגרום את התרבויות לריכוז סופי של 1 mM באמצעות 1 M איזופרופיל-ß-D-thiogalactopyranoside (IPTG) מלאי (IPTG) (ראה את טבלת החומרים). ממשיכים לדגור בשייקר של 37 °C (37 °F) למשך 3-4 שעות נוספות.
הערה: במהלך הביטוי, הקורא צריך לקבוע את OD600 האופטימלי בזמן האינדוקציה ואת ריכוז IPTG. אם התשואה יורדת באופן משמעותי לאחר הטיהור, ריכוז imidazole במאגרי טיהור עשוי לדרוש התאמה, או גלולה התא ייתכן שיהיה צורך sonicated עוד יותר. - לפני צנטריפוגת התרבויות, aliquot שבריר של תרבות לתוך צינור מיקרופוגה 1.5 מ"ל שני ולתייג אותו שבר המושרה. לאחסן אותו ב -80 °C (80 °F) לניתוח ג'ל. אם אינך מפעיל ג'ל SDS-PAGE, דלג על שלב זה והמשיך לשלב 1.2.7.
- צנטריפוגה תרבית התא בבקבוקים חרוטיים 250 מ"ל (ראה טבלת החומרים) במהירות המרבית ו 4 °C (60 °F) במשך 10 דקות.
- חזור על שלב 1.2.7 עד שהתרביות יתגלו לחלוטין.
הערה: השהה: כדורי תא ניתן להקפיא ב -80 °C (80 °F) ולהפשיר מאוחר יותר לעיבוד נוסף. אחרת, דלג על שלב זה והמשך לשלב 1.3.1.
- מיצוי גוף הכללה ו solubilization
הערה: הכינו אוריאה טרייה של 10 מ' אוריאה, רצוי לא לפני יום אחד מראש, תוך ערבוב יסודי עד להמסה מלאה. אין לחמם או אוריאה אוטומטית; לאחסן אותו בטמפרטורת החדר.- Resuspend את הכדור (משלב 1.2.8) במאגר תמוגה (ראה את טבלת החומרים). לכל גרם של גלולה, להוסיף 3 מ"ל של מאגר תמוגה resuspend על ידי מערבולת או pipetting. לנער לילה ב 4 °C (7 °F).
- הוסף 1.25 מ"ל של 10% (w/v) נתרן deoxycholate (ראה טבלת החומרים) לכל 1 L של תרבות. יש לנער בטמפרטורת החדר למשך 30 דקות ב-150 סל"ד.
- הוסף 10 μL של DNase I (ראה את טבלת החומרים) לכל 1 L של תרבות. יש לנער בטמפרטורת החדר למשך 30 דקות ב-150 סל"ד.
- צנטריפוגה במשך 10 דקות ב 13,000 × גרם ו 4 °C (60 °F).
- מניחים בצד שבריר של MMP Lysed לניתוח ג'ל. לאחסן אותו ב -80 °C (80 °F). אם לא מבצע ניתוח ג'ל, המשך לשלב 1.3.6.
הערה: לאחר צנטריפוגה, הכדור עשוי להיות מחרוזת ולא ארוז בצורה קומפקטית, מה שהופך אותו מסוכן להשליך את supernatant. אם זהו המקרה, דלג על שלב 1.3.6 והמשך לשלב 1.3.7. - זרוק את הסופר-נרטיב מהדגימות הצנטריפוגליות.
הערה: ניתן להשהות את הפרוטוקול בשלב זה ואת כדורי התא קפוא ב -80 °C (80 °F) ולהפשיר מאוחר יותר. אחרת, דלג על שלב זה והמשך לשלב 1.3.7. - Resuspend את הכדור בתרבית 100 מ"ל / L של חוצץ גוף הכללה (ראה את טבלת החומרים) על ידי צנרת למעלה ולמטה.
- במהלך sonication, לשמור את הדגימות על קרח כדי למנוע התחממות יתר. Sonicate כל מדגם עבור 6 מחזורים של 15 s, פלט 5, ו 50% דופק. אפשר תקופות מנוחה של 15 שניות לקירור בין מחזורים.
הערה: במידת הצורך, להעביר את הדגימות לתוך צינורות חרוטיים 50 מ"ל עבור צנטריפוגה נוספת (ראה את טבלת החומרים). צנטריפוגה ל-10 דקות ב-13,000 × גרם ו-4 מעלות צלזיוס. - מניחים בצד שבריר של MMP Sonicated לניתוח ג'ל. לאחסן אותו ב -80 °C (80 °F). אם לא מבצע ניתוח ג'ל, המשך לשלב 1.3.11.
- תבדוק את הכדור. אם stringy, חזור על שלבים 1.3.8-1.3.10. אם הכדור הוא קומפקטי, להשליך את supernatant ולהמשיך לשלב 1.3.12.
הערה: Sonication במאגר גוף הכללה ניתן לחזור על עצמו כדי לשחזר יותר חלבון מפסולת התא lysed. עם זאת, יותר מדי sonication יכול לגרום גזירה, אשר פוגע בתשואה MMP. ניתן להשהות את הפרוטוקול בשלב זה, ואת כדורי התא ניתן להקפיא ב -80 °C (80 °F) ולהפשיר מאוחר יותר. - Resuspend כל גלולה מתרבית 1 L ב 5 מ"ל של מאגר Solubilization (ראה את טבלת החומרים) על ידי צינורות. דגירה במשך 30 דקות לפחות על קרח כדי לאפשר לחלבונים להתפחות.
- מניחים בצד שבריר של MMP Solubilized לניתוח ג'ל. לאחסן אותו ב -80 °C (80 °F). אם לא מבצע ניתוח ג'ל, המשך לשלב 1.3.14.
- צנטריפוגה התאים במשך 10 דקות ב 13,000 × גרם ו 4 °C (60 °F) לא להשליך את SUPERNATANT.
- אם גלולה נוצרת/ נשארת לאחר צנטריפוגה, יוצקים את supernatant לתוך צינור חרוט נפרד 50 מ"ל. Resuspend את הכדור עוד 5 מ"ל של מאגר Solubilization (לכל 1 L של תרבות) על ידי צנרת למעלה ולמטה.
- צנטריפוגה במשך 10 דקות ב 13,000 × גרם ו 4 °C (50 °F) לא להשליך את SUPERNATANT.
- חזור על שלבים 1.3.13 ו 1.3.14 עד קצת ללא צורות גלולה לאחר צנטריפוגה או רק משקעים אפורים נשאר. תאחדו את הסופר-נאטנטים. להשליך או לאחסן את הכדור ב -80 °C (80 °F) עבור sonication נוסף.
2. טיהור MMP וכיסוי מחדש
- טיהור זיקה לתגית שלו (HT)
- לפי פרוטוקול היצרן, מלאו עמודת זרימת כבידה (ראו טבלת החומרים) בשרף Ni-NTA מעורבב היטב (ראו טבלת החומרים). אפשרו לשרף להתיישב ולהיפרד ממאגר האחסון כך שקו נפרד ייווצר בין שתי השכבות.
הערה: לעולם אל תאפשר לשרף להתייבש, מכיוון שהאוויר יחדור לשרף ויפגע בתפוקת החלבון. בין שימושים, בצע את הליך התחדשות השרף המתואר בסעיף 2.2. - אפשר למאגר האחסון להתנקז. מלא את העמודה בשני כרכים של מיטת שרף של מאגר שיווי משקל HT.
- רוקנו את מאגר שיווי המשקל של HT והשליכו אותו. כאשר העמוד מתרוקן, צנטריפוגות תמצית החלבון ב 13,000 × גרם במשך 1 דקה לסנן לסנן באמצעות מסנן 0.22 מיקרומטר (ראה את טבלת החומרים).
- החלף את מיכל הפסולת עבור צינור חרוטי 50 מ"ל שכותרתו HT Flowthrough. מוסיפים את תמצית החלבון המוכנה לעמודה.
- החל מחדש את הזרימה כדי למקסם את האיגוד.
- מניחים בצד שבר של Flowthrough לניתוח ג'ל. לאחסן אותו ב -80 °C (80 °F). אם לא מבצע ניתוח ג'ל, המשך לשלב 2.1.7.
- מיד לשטוף את השרף עם 15 מ"ל של HT לשטוף חוצץ (ראה את טבלת החומרים). לאסוף את הזרימה בצינורות חרוטיים 15 מ"ל (ראה את טבלת החומרים) שכותרתו HT לשטוף.
הערה: ערכי ספיגה ב- 280 ננומטר (A280) התקבלו באמצעות ספקטרופוטומטריה ושימשו יחד עם מקדם משקל מולקולרי ומקדם הכחדה, ε, להערכת ריכוזי חלבון. עבור Hisx6-pro-MMP-3cd, המשקל המולקולרי הוא 29.86 kDa, ε הוא 34.38 M-1 ס"מ-1 ס"מ.1. - ריקון נגד מאגר כביסה HT, למדוד ולהקליט את A280. חזור על שלבים 2.1.7 ו- 2.1.8 עם שברי כביסה נוספים. לאחר A280 מתקרב בסיסי זיהומים כבר ממוזער, להמשיך לשלב 2.1.9.
- מניחים בצד חלק קטן מ-Wash Fraction לניתוח ג'ל. חזור על הפעולה עבור שברי כביסה מרובים. אחסן את השברים בטמפרטורה של -80 °C (60 °F). אם לא מבצע ניתוח ג'ל, המשך לשלב 2.1.10.
- מיד לברוח חלבונים מתויגים שלו על ידי הוספת 5 מ"ל של HT Elution Buffer (ראה את טבלת החומרים). לאסוף את הזרימה כמו שברי 0.5-1 מ"ל בצינורות microfuge שכותרתו HT Elution.
- מניחים בצד שבר של Elution לניתוח ג'ל. חזור על הפעולה עבור שברי הארכה מרובים. אחסן את השברים בטמפרטורה של -80 °C (60 °F). אם לא מבצע ניתוח ג'ל, המשך לשלב 2.1.12.
- אם A280 הוא >0.3 מ"ג / מ"ל, לדלל את השבר באמצעות מאגר שיווי משקל HT (ראה את טבלת החומרים).
הערה: יש לדלל את השבר המנוטרל ל- A280 של 0.3 מ"ג / מ"ל או פחות כדי למנוע משקעים במהלך דיאליזה. ניתן להשהות את הפרוטוקול כאן ואת השברים במאגר קפוא ב -80 °C (80 °F) ולהפשיר מאוחר יותר. אחרת, דלג על שלב זה והמשך לשלב 2.2.1.
- לפי פרוטוקול היצרן, מלאו עמודת זרימת כבידה (ראו טבלת החומרים) בשרף Ni-NTA מעורבב היטב (ראו טבלת החומרים). אפשרו לשרף להתיישב ולהיפרד ממאגר האחסון כך שקו נפרד ייווצר בין שתי השכבות.
- התחדשות שרף
- לשטוף את השרף עם עשרה כרכים במיטת שרף של מאגר התחדשות HT (ראה טבלת החומרים) ועשרה נפחי מיטת שרף של מים סטריליים.
- יש לאחסן את השרף כתסיסה של 50% ב-20% (v/v) אתנול במים.
3. קיפוח מחדש של חלבונים
הערה: עבור אמצעי אחסון קטנים יותר, ניתן להשתמש בקלטות דיאליזה בסיכון נמוך יותר לאובדן דגימה. צינורות דיאליזה נדרשים אם נעשה שימוש בנפחים גדולים יותר (עיין בטבלת החומרים).
- דיאליזה
הערה: ריכוז החלבון האופטימלי לדיאליזה הוא ~ 0.3 מ"ג / מ"ל. אם משקעים משמעותיים מתרחשים במהלך דיאליזה, להפחית את שיפוע ריכוז אוריאה בין כל דיאליזה באמצעות שיטת דיאליזה צעדים ולהוסיף צעדי ביניים נוספים (למשל, מ 6 M ל 5 M, ולאחר מכן 5 M עד 4 M, במקום לדלג על שלב 5 M). כמו מחזורי הפשרה להקפאה לפגוע במבנה הסלולר והחלבון, זה חיוני כדי למזער את ההפסקות בפרוטוקול.- לפי פרוטוקול היצרן, השתמש בכמות המתאימה של צינורות דיאליזה בהתאם לנפח של דגימות שבר Elution .
- הטביעו את שברי ה- MMP המנוטרלים בצינורות דיאליזה ב- 1 L של מאגר דיאליזה 1 (עיין בטבלת החומרים). מערבבים את הצינורות ותכולתם על מערבל מגנטי לא פחות מ 8 שעות ב 4 °C (60 °F).
- העבר ל- 1 L של מאגר דיאליזה 2 (עיין בטבלת החומרים). מערבבים את הצינורות ותכולתם על מערבל מגנטי לא פחות מ 8 שעות ב 4 °C (60 °F).
- העבר ל- 1 L של מאגר דיאליזה 3 (עיין בטבלת החומרים). מערבבים את הצינורות ותכולתם על מערבל מגנטי לא פחות מ 8 שעות ב 4 °C (60 °F).
- העבר את הדגימה לצינורות חרוטיים חדשים של 50 מ"ל וסמן אותם כ - MMP דיאליזד.
- תבדוק את הצינור כדי למצוא משקעים. אם נוצר משקעים, צנטריפוגה המדגם במשך 1 דקה ב 13,000 × גרם ו 4 °C (65 °F).
- העבר את supernatant לתוך צינורות חרוטיים חדשים 15 מ"ל ולתייג אותם כמו MMP Refolded.
- מניחים בצד שבר לניתוח ג'ל ומתייגים אותו כ-MMP מקופל מחדש. לאחסן אותו ב -80 °C (80 °F). אם לא מבצע ניתוח ג'ל, המשך לשלב 3.1.9.
הערה: אם התשואות נמוכות, ניתן להמיס את המשקעים במאגר שיווי המשקל של HT ולשלבים בסעיף 3.1 החוזרים על עצמם עם צינורות דיאליזה. אם אין לבצע ניתוח ג'ל או אם יש להשהות את הפרוטוקול כאן, להקפיא את הדגימות ב -80 °C (80 °F) ולהפשיר אותם מאוחר יותר. אם התשואות נמצאות בטווח הרצוי, המשך לשלב 3.2.1.
- שיתוף פעולה מחדש
הערה: מקדמי ההכחדה עבור Hisx6-pro-MMP-3cd מקופלים ומנוטרלים צפויים להיות זהים; לפיכך, חישובי A280 אינם מושפעים.- לרכז מחדש את המדגם עד 0.5 מ"ג / מ"ל. השתמש בתא מעורבב 400 מ"ל (ראה את טבלת החומרים) כדי לרכז את המדגם ל 15 מ"ל. כדי למנוע הקצפה, יש להשתמש בצינור קירור של 50 מ"ל כדי להתרכז עוד יותר במידת הצורך.
הערה: אם נוצר משקעים, ניתן להטיל אותו ולהמיס אותו במאגר שיווי המשקל של HT. לאחר מכן, חזור על סעיפים 3.1 ושלב 3.2.1. אחרת, המשך לשלב 3.2.2. - מניחים בצד שבר לניתוח ג'ל ומתייגים אותו כ-MMP מרוכז.
הערה: ניתן להשהות את הפרוטוקול כאן ואת הדגימות קפואות ב -80 °C (80 °F) ולהפשיר מאוחר יותר.
- לרכז מחדש את המדגם עד 0.5 מ"ג / מ"ל. השתמש בתא מעורבב 400 מ"ל (ראה את טבלת החומרים) כדי לרכז את המדגם ל 15 מ"ל. כדי למנוע הקצפה, יש להשתמש בצינור קירור של 50 מ"ל כדי להתרכז עוד יותר במידת הצורך.
4. הפעלה
- 4-אמינופנילמריק אצטט (APMA) הפעלה
הערה: APMA הוא רעיל מאוד. הפוך פתרון מלאי טרי של 20 מ"מ APMA לפני ההפעלה, ותמיד לעבוד תחת מכסה המנוע אדים בעת שימוש APMA. להשליך את פסולת APMA לתוך המיכל שלה.- לכל 1 מ"ל aliquot של MMP (1 מ"ג / מ"ל), להוסיף 50 μL של 20 mM APMA (ראה את טבלת החומרים) כדי להגיע לריכוז APMA הסופי של 1 מ"מM. דגירה לילה בטמפרטורה של 37 מעלות צלזיוס.
- אם נוצר משקע, צנטריפוגה זה במהירות המרבית במשך 10 דקות ב 4 °C (4 °F). אחסן את supernatant בצינור microfuge 1.5 מ"ל שכותרתו MMP פעיל. השלך את המשקעים לתוך מיכל מסומן עבור פסולת APMA.
- מניחים בצד שבר לניתוח ג'ל ומתייגים אותו כ-MMP פעיל.
הערה: ניתן להשהות את הפרוטוקול כאן ואת הדגימות קפואות ב -80 °C (80 °F) ולהפשיר מאוחר יותר. אם לא מבצע ניתוח ג'ל, המשך לשלב 4.2.1. לאחר ההפעלה, מקדם המשקל וההכחדה המולקולרי של MMP-3cd הם 19.40 kDa ו- 28.42 M-1 cm-1, בהתאמה.
- התפלה
- הסר APMA מדגם MMP-3cd המופעל עם עמודת התפלה של 2 מ"ל (עיין בטבלת החומרים), בהתאם לפרוטוקול היצרן.
- מניחים בצד שבר לניתוח ג'ל ומתייגים אותו מותפל MMP. לאחסן אותו ב -80 °C (80 °F). אם לא מבצע ניתוח ג'ל, המשך לסעיף 4.3 עם הדגימות הנותרות.
הערה: ניתן להשהות את הפרוטוקול כאן ואת הדגימות קפואות ב -80 °C (80 °F) ולהפשיר מאוחר יותר.
- הפעלת ג'לים SDS-PAGE
- הפעל את כל שברי החלבון על ג'לים SDS-PAGE: שבר לא מושרה, שבר מושרה, MMP Lysed, MMP Sonicated, MMP Solubilized, שבר Flowthrough, שבר לשטוף, שבר Elution, MMP מעובד מחדש, MMP מרוכז, MMP מופעל, ו- MMP מותפל.
- אחסון ארוך טווח של MMP-3
- הוסף 0.05% (v/v) פעילי שטח לא יוניים (עיין בטבלת החומרים) לדגימות MMP-3cd המותפלות ואחסן אותן בטמפרטורה של -80 °C (80 °F).
תוצאות
בעת הפעלת דגימות על SDS-PAGE, כי החלבון מתבטא בצורה של גופי הכללה מסיסים, שברי lysed ו sonicated צריך להכיל מעט מאוד תמצית Hisx6-pro-MMP-3cd, כמו החלבון עדיין לא היה resolubilized ב אוריאה. איור 3 משווה את שברי הארכת הטיהור של His-tag של Hisx6-pro-MMP-3cd מתאי BL21(DE3) ותאי R2DP. שברי Elution אוגדו בנפרד עבור תאי BL21(DE3) ו- R2DP...
Discussion
הייצור בקנה מידה גדול של MMPs מסיסים, אנושיים, רקומביננטיים נשאר משימה מאתגרת. תאי יונקים יכולים לבטא MMPs פונקציונליים בעלויות גבוהות וזמני המתנה ארוכים, ואילו E. coli מייצר במהירות כמויות גבוהות של גופי הכללת MMP שיש לטהר ולטפח מחדש 11,16. תאי R2DP מגדילים באופן מ...
Disclosures
המחברים מצהירים כי אין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
המחברים רוצים להודות לד"ר אווט רדיסקי ואלכסנדרה הוקלה במרפאת מאיו בג'קסונוויל, פלורידה, על כך שסיפקו את הפלסמיד pET-3a-pro-MMP-3cd כתבנית לשיבוט הגן Hisx6pro-MMP-3cd, ואת הערותיהם, יחד עם ד"ר פול הארטלי ממרכז הגנומיקה של נבאדה באוניברסיטת נבאדה, רינו, לרצף DNA. המחברים רוצים גם להודות לקסנדרה הרגנרדר על שעזרה עם חלק מביטוי החלבון. מ.ר.ס. רוצה להודות למענק NIH-P20 GM103650-COBRE אינטגרטיבי למדעי המוח ולפרס מענק הזרעים MICRO MICRO של UNR R&D.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| Nonionic surfactant | Thermo Fisher Scientific | PI28316 | Storage detergent for preventing MMP aggregation. Minimizes interactions between hydrophobic residues on the MMP surface and water molecules, without disrupting catalytic activity. |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved