É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Expressão bacteriana e purificação da matriz humana Metaloproteinase-3 usando cromatografia de afinidade
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Sua marca purificação, diálise e ativação são empregadas para aumentar os rendimentos da expressão proteica de domínio catalítico de matriz solúvel-3 em bactérias. As frações proteicas são analisadas através de géis SDS-PAGE.
Resumo
As metaloproteínas matricial (MMPs) pertencem à família de proteases metzincinas com papéis centrais na degradação e remodelagem da matriz extracelular (ECM), bem como interações com diversos fatores de crescimento e citocinas. A superexpressão de MMPs específicos é responsável por diversas doenças, como câncer, doenças neurodegenerativas e doenças cardiovasculares. Os MMPs têm sido o centro das atenções recentemente como metas para desenvolver terapêuticas que possam tratar doenças correlacionadas à superexpressão de MMP.
Para estudar o mecanismo MMP em solução, são necessários métodos de expressão e purificação de proteínas recombinantes mais fáceis e robustas para a produção de MMPs ativos e solúveis. No entanto, o domínio catallítico da maioria dos MMPs não pode ser expresso em Escherichia coli (E. coli) em forma solúvel devido à falta de máquinas pós-transicionais, enquanto os sistemas de expressão dos mamíferos são geralmente caros e têm rendimentos mais baixos. Os órgãos de inclusão de MMP devem passar pelo processo tedioso e trabalhoso de purificação extensiva e re dobra, reduzindo significativamente o rendimento de MMPs na conformação nativa. Este artigo apresenta um protocolo usando células Rosetta2(DE3)pLysS (doravante referida como R2DP) para produzir domínio catalítico matrix metalloproteinase-3 (MMP-3cd), que contém uma tag N-terminal Sua seguida por pró-domínio (Hisx6-pro-MMP-3cd) para uso na purificação de afinidade. As células R2DP aumentam a expressão de proteínas eucarióticas através de um plasmídeo resistente a clororamfenícol contendo códons normalmente raros em sistemas de expressão bacteriana. Em comparação com a linha celular tradicional de escolha para expressão de proteína recombinante, BL21(DE3), a purificação usando esta nova cepa melhorou o rendimento do Hisx6-pro-MMP-3cd purificado. Após a ativação e desalagem, o domínio pro é cortado juntamente com o N-terminal His-tag, fornecendo MMP-3cd ativo para uso imediato em inúmeras aplicações in vitro . Este método não requer equipamentos caros ou proteínas de fusão complexas e descreve a rápida produção de MMPs humanos recombinantes em bactérias.
Introdução
A maioria das proteínas eucarióticas complexas sofrem modificações pós-transicionais elaboradas após a expressão, exigindo dobramento de proteína altamente assistida e cofatores para serem funcionais1. Produzir grandes quantidades de proteína humana solúvel em um hospedeiro bacteriano continua sendo um desafio significativo devido aos altos custos e à falta de métodos robustos de expressão e purificação, mesmo para experimentos laboratoriais de menor escala2,3. OS MMPs, endopeptidases humanas com grande peso molecular, são geralmente expressos como corpos de inclusão insolúveis quando expressos em E. coli. A extração de MMPs humanos solúveis muitas vezes leva a um processo de solubilização e reabascamento laborioso e demorado4.
Os MMPs têm papéis críticos em processos fisiológicos e patogênicos. Os MMPs humanos são uma família de 23 endopeptidases de zinco, categorizadas pela especificidade de estrutura e substrato, e expressas diferencialmente apesar de um domínio catalítico altamente conservado5,6. Os MMPs são secretados como zymogens inativos, regulados via ativação pós-translacional e seus inibidores endógenos, inibidores de tecidos de metaloproteinas (TIMPs)7,8,9,10. Embora inicialmente reconhecidos por seu papel na rotatividade do ECM, os MMPs também foram implicados no desenvolvimento, morfogênese, reparação de tecidos e remodelação8. A desregulação dos MMPs tem sido notavelmente ligada ao câncer, juntamente com doenças neurodegenerativas, cardiovasculares e fibrosas, entre outras doenças5,7.
O desenvolvimento de métodos robustos de produção de MMP em larga escala é fundamental para garantir o sucesso de estudos futuros de mecanismos MMP por meio de ensaios bioquímicos e baseados em células. Vários MMPs foram previamente expressos em bactérias11, incluindo MMPs com marca Hisx6, sem alterar a atividade MMP12,13,14,15. No entanto, esses métodos incluem passos longos e tediosos que podem ser difíceis de replicar.
As células mamíferas também podem ser usadas para expressar muitas proteínas humanas diferentes, garantindo as modificações pós-transacionais adequadas16. Embora o sistema de expressão de mamíferos seja a escolha ideal para produzir proteínas humanas recombinantes com modificações pós-translacionais adequadas, as principais desvantagens deste método são os baixos rendimentos iniciais, meios de crescimento caros e reagentes, longas linhas temporais para alcançar linhas de expressão estáveis e risco de contaminação com outras espécies, como fungos ou bactérias2,11 . Além disso, a produção de MMP em linhas de células de mamíferos produz impurezas de proteínas celulares associadas, como TIMPs ou fibronectinas11. Ao contrário do lento crescimento celular observado em células mamíferas, o sistema de expressão bacteriana oferece produção de proteínas em larga escala em um curto período, juntamente com requisitos mais simples de mídia e crescimento. No entanto, devido à falta de outras proteínas celulares associadas (ou seja, TIMPs) em sistemas de expressão bacteriana, os MMPs ativos em concentrações mais elevadas estão sujeitos à degradação por meio da autoproteólise, resultando em baixo rendimento de MMP17.
Este artigo descreve um método detalhado para expressão bacteriana, purificação e ativação do recombinante Hisx6-pro-MMP-3cd usando E. coli como hospedeiro de expressão devido à sua acessibilidade, simplicidade e sucesso na produção de maiores rendimentos de MMPs2,3,18. Uma vez que a E. coli não tem o maquinário dobrável de proteínas e o processamento pós-transicional necessário para MMPs recombinantes e outras proteínas complexas, muitas cepas de E. coli foram projetadas para superar essas limitações, tornando a E. coli um hospedeiro mais adequado para a expressão de MMP-3cd humano recombinante,19,20 . Por exemplo, a cepa R2DP usada neste estudo aumenta a expressão eucariótica fornecendo um plasmídeo resistente a clororamfenícol contendo códons raramente usados em E. coli.
Como descrito neste protocolo, após a superexpressão de corpos de inclusão relativamente puros do vetor pET-3a (Figura 1) em células R2DP, proteínas do domínio catalítico Hisx6-pro-MMP-3 (MMP-3cd) são extraídas e desnaturadas4. Hisx6-pro-MMP-3cd3,19 foi purificado usando cromatografia de tag de afinidade. Após a redobramento e diálise, o pro-MMP-3cd (zymogen) foi ativado por acetato 4-aminofenilmerárico (APMA), e a análise SDS-PAGE é usada para avaliar os rendimentos e a necessidade de mais purificação5,21. Este protocolo descreve a expressão, purificação e ativação do MMP-3cd solúvel como exemplo. No entanto, também pode ser usado como guia para a expressão de outros MMPs e proteases humanas com expressão semelhante, e mecanismos de ativação (Figura 2). Para outras proteínas além do MMP-3cd, o leitor é aconselhado a determinar as composições e métodos de buffer ideais para sua proteína alvo antes de tentar este protocolo.
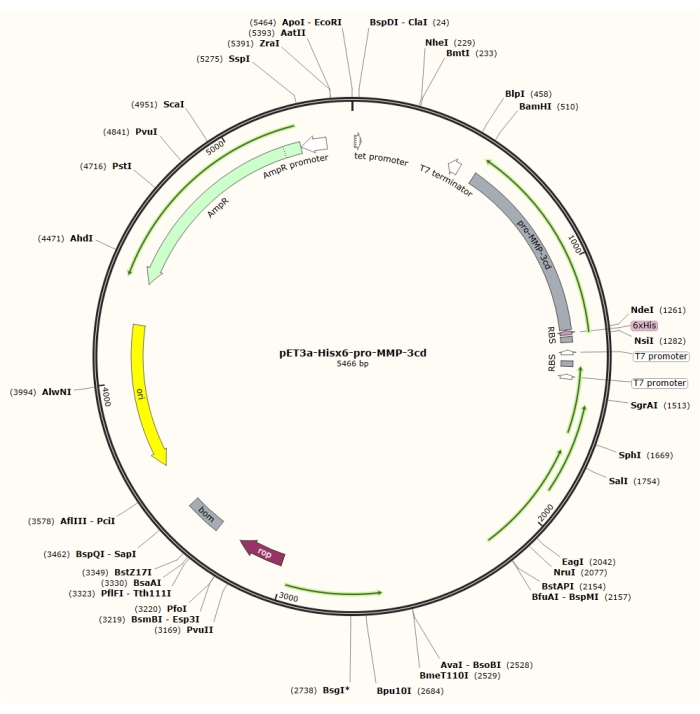
Figura 1: Mapa plasmídeo do pET-3a-Hisx6-pro-MMP-3cd plasmid. O vetor pET-3a inclui um gene de resistência à ampicilina. Uma sequência de tags Hisx6-terminal N é clonada no vetor baseado em pET-3a, incluindo pró-MMP-3cd, para produzir a construção pET-3a-Hisx6-pro-MMP-3cd sob controle do promotor T7 entre os locais de restrição BamHI e NdeI. Clique aqui para ver uma versão maior desta figura.

Figura 2: Expressão bacteriana de pro-MMP-3cd, purificação, repato e ativação. 1.1: pET-3a-Hisx6-pro-MMP-3cd plasmid foi transformado em células BL21(DE3) ou R2DP. 1.2: A expressão proteica Pró-MMP-3cd foi induzida por IPTG. 1.3: A lise química e a sônica são utilizadas para extrair proteínas Hisx6-pro-MMP-3cd que são principalmente insolúveis e encontradas nos corpos de inclusão. A ureia foi usada para desnaturar e solubilizar proteínas de corpos de inclusão. 2.1. A proteína Hisx6-pro-MMP-3cd foi purificada por meio da purificação da cromatografia de afinidade. 3. O Hisx6-pro-MMP-3cd elucido foi lentamente redobrado durante a diálise através da remoção gradual da ureia do buffer. 4. Finalmente, a proteína MMP-3cd repato foi ativada usando APMA removendo o domínio pró-peptídeo n-terminal. A APMA é posteriormente removida da solução através da desalting. Os números correspondem a seções de protocolo descrevendo essas etapas. Abreviaturas: MMP-3cd = Domínio catalítico matrix metaloproteinase-3; APMA = acetato aminofenilmerálico. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Expressão MMP
- Clonagem e transformação de células pET-3a-Hisx6-pro-MMP-3cd em células R2DP
- Digerir o plasmídeo pET-3a (ver a Tabela de Materiais) com enzimas de restrição NdeI e BamHI em Buffer digest (ver a Tabela de Materiais). Em um volume total de reação de 40 μL, adicione 4 μL de Buffer digest, 33 μL de 100 ng/μL plasmid e 1,5 μL de cada enzima de restrição e permita que a reação prossiga por ~2 h até a conclusão a 37 °C.
- Execute uma reação pcr na sequência MMP-3cd para inserir uma tag N-terminal His.. Use 25 μL de PCR Mix (ver a Tabela de Materiais), 2,5 μL de primers de 10 μM (Figura Suplementar S1) e 1,25 μL da sequência de inserção de 100 ng/μL. Adicione água estéril a um volume final de reação de 50 μL.
- Execute o produto PCR e o vetor digerido em um gel de 1% de agarose. Purifique as bandas de gel usando um Kit de Recuperação de Gel (veja a Tabela de Materiais) de acordo com o protocolo do fabricante.
- Clone o produto PCR amplificado no vetor digerido entre os locais de restrição NdeI e BamHI usando o DNA Assembly Mix (veja a Tabela de Materiais). Use ferramentas on-line para determinar o volume necessário do vetor de inserção e corte para um volume total de reação de 15 μL.
- Descongele uma alíquota de 50 μL de células de eficiência de alta transformação (ver a Tabela de Materiais) no gelo até descongelar. Meio de Crescimento SOC pré-aque (ver a Tabela de Materiais) a 37 °C e placas LB-ampicillin (LB Amp) (ver a Tabela de Materiais).
- Adicione 1-2 μL da reação de montagem pET-3a-Hisx6-pro-MMP-3cd à alíquota de 50 μL. Incubar no gelo por 30 minutos.
- Choque térmico das células incubando a 42 °C por 30 s. Incubar no gelo por 2 minutos.
- Adicione 950 μL de soc médio de crescimento a cada mistura transformadora. Agite por 1h a 250 rpm e 37 °C.
- Placa 100 μL dos transformadores em placas LB Amp e incubar durante a noite a 37 °C.
- Inocular cada colônia isolada em 10 mL de meio LB Amp. Agite durante a noite a 250 rpm e 37 °C.
- Extrair DNA plasmídeo por protocolo do fabricante para o kit miniprep (ver a Tabela de Materiais). Confirme a sequência da construção usando primers T7 para frente e para trás (Figura Suplementar S1).
NOTA: O DNA de construção pET-3a-Hisx6-pro-MMP-3cd pode ser armazenado a -20 °C. Quando estiver pronto, proceda com a transformação em células R2DP. - Descongele uma alíquota de 20 μL de células R2DP (ver a Tabela de Materiais) no gelo por 2-5 min. Crescimento soc pré-aquecimento de temperatura média a ambiente e placas LB Amp CamR a 37 °C (veja a Tabela de Materiais).
- Adicione 1 μL de 100 ng/μL seqüência-confirmada pET-3a-Hisx6-pro-MMP-3cd à alíquota de 50 μL. Mexa delicadamente para misturar e devolva o tubo ao gelo.
- Incubar o tubo no gelo por 5 minutos.
- Choque térmico das células incubando a 42 °C exatamente 30 s. Não se agite.
- Coloque as células no gelo por 2 minutos.
- Adicione 80 μL de soc de temperatura ambiente ao meio transformador. Agite por 1h a 250 rpm e 37 °C.
- Emplaque os transformadores em placas LB Amp CamR e incubar durante a noite a 37 °C.
- Crescimento e indução
- Inocular uma única colônia isolada de R2DP pET-3a-Hisx6-pro-MMP-3cd transformador de uma placa LB Amp CamR em 10 mL de mídia LB Amp CamR a 37 °C. Agite a 250 rpm durante a noite (~16 h). Salve alíquotas de cada cultura e prepare 40% (v/v) glicerol (veja a Tabela de Materiais) se desejar.
- Por cultura durante a noite, inocular um frasco de 1 L contendo 500 mL de meio LB Amp CamR a uma densidade óptica a 600 nm (OD600) de 0,05-0,1.
NOTA: Isso deve retornar as células ao crescimento logarítmico. - Meça o OD600 em vários pontos de tempo, normalmente para 3-4 h, até que caia entre 0,4 e 0,6.
- Antes da indução, alíquotar uma fração de cultura em um tubo de microfuça de 1,5 mL (ver a Tabela de Materiais) e rotulá-la de Fração Não Induzida. Armazene-o a -80 °C para análise de gel. Se não estiver executando um gel SDS-PAGE, pule esta etapa e prossiga para a etapa 1.2.5.
- Induzir as culturas a uma concentração final de 1 mM usando 1 M isopropílico-ß-D-thiogalactopyranoside (IPTG) (ver a Tabela de Materiais). Continue incubando no agitador de 37 °C por mais 3-4 h.
NOTA: Durante a expressão, o leitor deve determinar o OD600 ideal no momento da indução e da concentração de IPTG. Se o rendimento cair substancialmente após a purificação, a concentração de imidazol em tampões de purificação pode exigir ajuste, ou a pelota celular pode precisar ser sisônica ainda mais. - Antes de centrifugar as culturas, aliquotar uma fração de cultura em um segundo tubo de microfuça de 1,5 mL e rotulá-lo fração induzida. Armazene-o a -80 °C para análise de gel. Se não estiver executando um gel SDS-PAGE, pule esta etapa e prossiga para a etapa 1.2.7.
- Centrifugar a cultura celular em garrafas cônicas de 250 mL (ver a Tabela de Materiais) em velocidade máxima e 4 °C por 10 min.
- Repita o passo 1.2.7 até que as culturas estejam completamente pelotas.
NOTA: PAUSA: As pelotas celulares podem ser congeladas a -80 °C e descongeladas posteriormente para posterior processamento. Caso contrário, pule esta etapa e prossiga para a etapa 1.3.1.
- Inclusão extração corporal e solubilização corporal
NOTA: Prepare a ureia fresca de 10 M, de preferência não antes de um dia de antecedência, mexendo bem até dissolver completamente. Não aqueça ou autoclave ureia; armazená-lo à temperatura ambiente.- Resuspenda a pelota (a partir da etapa 1.2.8) no tampão de lise (ver a Tabela de Materiais). Por grama de pelota, adicione 3 mL de tampão de lise e resuspend por vórtice ou pipetação. Agite durante a noite a 4 °C.
- Adicione 1,25 mL de 10% (w/v) desoxicolato de sódio (ver a Tabela de Materiais) por 1 L de cultura. Agite à temperatura ambiente por 30 min a 150 rpm.
- Adicione 10 μL de DNase I (ver a Tabela de Materiais) por 1 L de cultura. Agite à temperatura ambiente por 30 min a 150 rpm.
- Centrifugar por 10 min a 13.000 × g e 4 °C.
- Reserve uma fração de MMP lysed para análise de gel. Armazene-o a -80 °C. Caso não realize a análise do gel, proceda à etapa 1.3.6.
NOTA: Após a centrifugação, a pelota pode ser pega e não compactamente embalada, tornando arriscado descartar o supernatante. Se esse for o caso, então pule a etapa 1.3.6 e prossiga para a etapa 1.3.7. - Descarte o sobrenatante das amostras centrífugas.
NOTA: O protocolo pode ser pausado neste momento e as pelotas de célula congeladas a -80 °C e descongeladas mais tarde. Caso contrário, pule esta etapa e prossiga para a etapa 1.3.7. - Resuspense a pelota na cultura de 100 mL/L de Inclusão Body Buffer (ver a Tabela de Materiais) por tubulação para cima e para baixo.
- Durante a sonicação, mantenha as amostras no gelo para evitar superaquecimento. Sonicate cada amostra para 6 ciclos de 15 s, saída 5, e 50% de pulso. Permita períodos de descanso de 15 s para resfriamento entre os ciclos.
NOTA: Se necessário, transfira as amostras para tubos cônicos de 50 mL para posterior centrifugação (consulte a Tabela de Materiais). Centrifugar por 10 min a 13.000 × g e 4 °C. - Reserve uma fração de MMP Sonicated para análise de gel. Armazene-o a -80 °C. Caso não realize a análise do gel, prossiga para a etapa 1.3.11.
- Verifique a pelota. Se stringy, repita as etapas 1.3.8-1.3.10. Se a pelota for compacta, descarte o supernasce e prossiga para a etapa 1.3.12.
NOTA: A sônica na inclusão do tampão corporal pode ser repetida para recuperar mais proteína dos detritos celulares lysed. No entanto, muita sônica pode causar cisalhamento, o que prejudica o rendimento do MMP. O protocolo pode ser pausado nesta fase, e as pelotas celulares podem ser congeladas a -80 °C e descongeladas mais tarde. - Resuspend cada pelota de uma cultura 1 L em 5 mL de Tampão de Solubilização (ver a Tabela de Materiais) por pipetação. Incubar por pelo menos 30 minutos no gelo para permitir que as proteínas solubilizem.
- Reserve uma fração de MMP solubilizado para análise de gel. Armazene-o a -80 °C. Caso não faça a análise do gel, prossiga para a etapa 1.3.14.
- Centrifugar as células por 10 min a 13.000 × g e 4 °C. NÃO DESCARTE O SUPERNATANTE.
- Se uma pelota se formar/permanecer após a centrifugação, despeje o sobrenatante em um tubo cônico separado de 50 mL. Resuspense a pelota em outros 5 mL de Tampão de Solubilização (por 1 L de cultura) por pipetar para cima e para baixo.
- Centrifugar por 10 min a 13.000 × g e 4 °C. NÃO DESCARTE O SUPERNATANTE.
- Repita as etapas 1.3.13 e 1.3.14 até que um pouco ou nenhuma pelota se forme após centrifugação ou apenas restos de precipitado cinza. Juntar os supernantes. Descarte ou armazene a pelota a -80 °C para sônicação adicional.
2. Purificação e recobramento de MMP
- Purificação de afinidade de sua tag (HT)
- De acordo com o protocolo do fabricante, preencha uma coluna de fluxo de gravidade (veja a Tabela de Materiais) com resina Ni-NTA bem misturada (veja a Tabela de Materiais). Permita que a resina se resolva e separe do buffer de armazenamento de tal forma que uma linha distinta se forme entre as duas camadas.
NOTA: Nunca permita que a resina seque, pois o ar penetrará na resina e prejudicará o rendimento da proteína. Entre os usos, realize o procedimento de regeneração da resina descrito na seção 2.2. - Deixe o buffer de armazenamento drenar. Encha a coluna com dois volumes de cama de resina de tampão de equilíbrio HT.
- Escorra o tampão de equilíbrio HT e descarte. Como a coluna está drenando, centrifugar o extrato de proteína a 13.000 × g por 1 min e esterilizar o filtro usando um filtro de 0,22 μm (ver a Tabela de Materiais).
- Troque o recipiente de resíduos por um tubo cônico de 50 mL rotulado HT Flowthrough. Adicione o extrato de proteína preparado à coluna.
- Reaplique o fluxo para maximizar a vinculação.
- Reserve uma fração de Flowthrough Fraction para análise de gel. Armazene-o a -80 °C. Caso não realize a análise do gel, proceda à etapa 2.1.7.
- Lave imediatamente a resina com 15 mL de tampão de lavagem HT (veja a tabela de materiais). Colete o fluxo através de tubos cônicos de 15 mL (ver a tabela de materiais) rotulados HT Wash.
NOTA: Os valores de absorvência a 280 nm (A280) foram obtidos via espectrofotometria e utilizados juntamente com o coeficiente de peso molecular e extinção, ε, para estimar concentrações proteicas. Para Hisx6-pro-MMP-3cd desnaturado, o peso molecular é de 29,86 kDa, e ε é de 34,38 M-1 cm-1. - Em branco contra ht Wash Buffer, meça e grave o A280. Repetir as etapas 2.1.7 e 2.1.8 com frações adicionais de lavagem. Uma vez que o A280 se aproxime da linha de base e as impurezas tenham sido minimizadas, proceda à etapa 2.1.9.
- Reserve uma fração de Fração de Lavagem para análise de gel. Repita por várias frações de lavagem. Armazene as frações a -80 °C. Caso não faça a análise do gel, prossiga para a etapa 2.1.10.
- Imediatamente elute Suas proteínas marcadas adicionando 5 mL de HT Elution Buffer (ver a Tabela de Materiais). Colete o fluxo através de frações de 0,5-1 mL em tubos de microfuça rotulados de Elução HT.
- Reserve uma fração de Fração de Eluição para análise de gel. Repita para várias frações de eluição. Armazene as frações a -80 °C. Caso não realize a análise do gel, proceda à etapa 2.1.12.
- Se o A280 estiver >0,3 mg/mL, diluir a fração com o Tampão de Equilíbrio HT (consulte a Tabela de Materiais).
NOTA: A fração elucida deve ser diluída a um A280 de 0,3 mg/mL ou menos para evitar precipitação durante a diálise. O protocolo pode ser pausado aqui e as frações agrupadas congeladas a -80 °C e descongeladas mais tarde. Caso contrário, pule esta etapa e prossiga para a etapa 2.2.1.
- De acordo com o protocolo do fabricante, preencha uma coluna de fluxo de gravidade (veja a Tabela de Materiais) com resina Ni-NTA bem misturada (veja a Tabela de Materiais). Permita que a resina se resolva e separe do buffer de armazenamento de tal forma que uma linha distinta se forme entre as duas camadas.
- Regeneração de resina
- Lave a resina com dez volumes de resina de tampão de regeneração HT (ver a tabela de materiais) e dez volumes de resina de água estéril.
- Guarde a resina como um chorume de 50% em 20% (v/v) etanol na água.
3. Repato de proteína
NOTA: Para volumes menores, os de diálise podem ser usados com menor risco de perda amostral. A tubulação de diálise é necessária se forem utilizados volumes maiores (veja a tabela de materiais).
- Diálise
NOTA: A concentração proteica ideal para diálise é de ~0,3 mg/mL. Se ocorrer precipitação significativa durante a diálise, reduza o gradiente de concentração de ureia entre cada diálise usando um método de diálise stepwise e adicione etapas mais intermediárias (por exemplo, de 6 M para 5 M, e depois 5 M a 4 M, em vez de pular o estágio de 5 M). Como os ciclos de congelamento danificam a estrutura celular e proteica, é vital minimizar pausas no protocolo.- De acordo com o protocolo do fabricante, use a quantidade apropriada de tubos de diálise de acordo com o volume de amostras de Fração de Eluição .
- Submergir as frações de MMP elucidas na tubulação de diálise em 1 L de Tampão de Diálise 1 (ver a Tabela de Materiais). Mexa a tubulação e seu conteúdo em um agitador magnético por nada menos que 8h a 4 °C.
- Transfira para 1 L de Tampão de Diálise 2 (consulte a Tabela de Materiais). Mexa a tubulação e seu conteúdo em um agitador magnético por nada menos que 8h a 4 °C.
- Transfira para 1 L de Tampão de Diálise 3 (consulte a Tabela de Materiais). Mexa a tubulação e seu conteúdo em um agitador magnético por nada menos que 8h a 4 °C.
- Transfira a amostra para novos tubos cônicos de 50 mL e rotule-os como MMP dialisados.
- Examine o tubo para precipitar. Se o precipitado tiver se formado, centrifugar a amostra por 1 min a 13.000 × g e 4 °C.
- Transfira o supernatante para novos tubos cônicos de 15 mL e rotule-os como MMP repostados.
- Reserve uma fração para análise de gel e rotule-a como MMP redobrada. Armazene-o a -80 °C. Caso não realize a análise do gel, proceda à etapa 3.1.9.
NOTA: Se os rendimentos forem baixos, o precipitado pode ser dissolvido no Tampão de Equilíbrio HT e passos na seção 3.1 repetidos com tubos de diálise. Se a análise do gel não for realizada ou se o protocolo deve ser pausado aqui, congele as amostras a -80 °C e descongele-as mais tarde. Se os rendimentos estiverem na faixa desejada, proceda à etapa 3.2.1.
- Reconcentração
NOTA: Espera-se que os coeficientes de extinção para Hisx6-pro-MMP-3cd redobrados sejam os mesmos; portanto, os cálculos A280 não são afetados.- Reconcentrar a amostra até 0,5 mg/mL. Use uma célula mesxida de 400 mL (ver a Tabela de Materiais) para concentrar a amostra a 15 mL. Para evitar espuma, use um tubo de reconcentrização de 50 mL para se concentrar ainda mais, se necessário.
NOTA: Se uma forma precipitada, pode ser pelotada e dissolvida no Tampão de Equilíbrio HT. Em seguida, repita as seções 3.1 e a etapa 3.2.1. Caso contrário, continue a etapa 3.2.2. - Reserve uma fração para análise de gel e rotule-a como MMP concentrada.
NOTA: O protocolo pode ser pausado aqui e as amostras congeladas a -80 °C e descongeladas mais tarde.
- Reconcentrar a amostra até 0,5 mg/mL. Use uma célula mesxida de 400 mL (ver a Tabela de Materiais) para concentrar a amostra a 15 mL. Para evitar espuma, use um tubo de reconcentrização de 50 mL para se concentrar ainda mais, se necessário.
4. Ativação
- Ativação do acetato aminofenilmerálico (APMA)
NOTA: A APMA é altamente tóxica. Faça uma solução de estoque fresco de 20 mM APMA antes da ativação, e sempre trabalhe sob um capô de fumaça ao usar APMA. Descarte os resíduos da APMA em seu contêiner.- Por 1 mL aliquot de MMP (1 mg/mL), adicione 50 μL de 20 mM APMA (ver a Tabela de Materiais) para alcançar uma concentração final de APMA de 1 mM. Incubar durante a noite a 37 °C.
- Se um precipitado se formar, centrifuse-o em velocidade máxima por 10 min a 4 °C. Armazene o supernatante em um tubo de microfuça de 1,5 mL rotulado MMP ativado. Descarte o precipitado em um recipiente marcado para resíduos de APMA.
- Reserve uma fração para análise de gel e rotule-o de MMP ativado.
NOTA: O protocolo pode ser pausado aqui e as amostras congeladas a -80 °C e descongeladas mais tarde. Caso não realize a análise do gel, prossiga para a etapa 4.2.1. Após a ativação, o coeficiente de peso molecular e extinção de MMP-3cd são de 19,40 kDa e 28,42 M-1 cm-1, respectivamente.
- Desalting
- Remova o APMA da amostra MMP-3cd ativada com uma coluna de dessecação de 2 mL (veja a Tabela de Materiais), seguindo o protocolo do fabricante.
- Reserve uma fração para análise de gel e rotule-a desalada MMP. Armazene-o a -80 °C. Se não realizar a análise do gel, proceda para a seção 4.3 com as demais amostras.
NOTA: O protocolo pode ser pausado aqui e as amostras congeladas a -80 °C e descongeladas mais tarde.
- Executando os géis SDS-PAGE
- Execute todas as frações proteicas em géis SDS-PAGE: Fração não induzida, Fração Induzida, MMP Lysed, MMP Sonicated, MMP Solubilizado, Flowthrough Fraction, Wash Fraction, Elution Fraction, Refolded MMP, Concentrated MMP, Activated MMP e Desalted MMP.
- Armazenamento a longo prazo de MMP-3
- Adicione 0,05% (v/v) surfactante noniônico (veja a tabela de materiais) às amostras de MMP-3cd desseladas e armazene-as a -80 °C.
Access restricted. Please log in or start a trial to view this content.
Resultados
Ao executar amostras em SDS-PAGE, porque a proteína é expressa na forma de corpos de inclusão insolúveis, as frações límpidas e sônicas devem conter pouco ou nenhum extrato Hisx6-pro-MMP-3cd, uma vez que a proteína ainda não foi resolutizada em ureia. A Figura 3 compara as frações de elução de purificação his-tag de Células Hisx6-pro-MMP-3cd de células BL21(DE3) e células R2DP. As frações de elução foram agrupadas separadamente para as células BL21(DE3) e R2DP antes d...
Access restricted. Please log in or start a trial to view this content.
Discussão
A produção em larga escala de MMPs solúveis, humanos e recombinantes continua sendo uma tarefa desafiadora. As células mamíferas podem expressar MMPs funcionais a altos custos e longos tempos de espera, enquanto a E. coli produz rapidamente altas quantidades de corpos de inclusão de MMP que devem ser purificados e reobsecados11,16. As células R2DP aumentam significativamente o rendimento dos organismos de inclusão de MMP, permitindo um processo d...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Os autores gostariam de reconhecer a Dra. Evette Radisky e Alexandra Hockla na Clínica Mayo em Jacksonville, Flórida, por fornecer o pET-3a-pro-MMP-3cd plasmid como o modelo para clonagem do gene Hisx6pro-MMP-3cd, e seus comentários, juntamente com o Dr. Paul Hartley do Centro de Genômica de Nevada da Universidade de Nevada, Reno, para sequenciamento de DNA. Os autores também gostariam de agradecer Cassandra Hergenrader por ajudar com parte da expressão proteica. M.R.-S. gostaria de agradecer ao NIH-P20 GM103650-COBRE Integrative Neuroscience grant e ao Prêmio UNR P&D mICRO SEED Grant.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| Nonionic surfactant | Thermo Fisher Scientific | PI28316 | Storage detergent for preventing MMP aggregation. Minimizes interactions between hydrophobic residues on the MMP surface and water molecules, without disrupting catalytic activity. |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
Referências
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897(2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568(2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370(2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981(2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445(2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313(2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. Galea, C. A. , Humana Press. New York, NY. 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041(2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320(2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431(2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772(2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844(2010).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados