Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Afinite Kromatografisi Kullanılarak İnsan Matriksi Metalloproteinaz-3'ün Bakteriyel İfadesi ve Saflaştırılması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Onun etiketi saflaştırma, diyaliz ve aktivasyon, bakterilerde çözünür, aktif matriks metalloproteinaz-3 katalitik alan protein ekspresyonunun verimini arttırmak için kullanılır. Protein fraksiyonları SDS-PAGE jelleri ile analiz edilir.
Özet
Matriks metalloproteinazlar (MMP'ler), hücre dışı matriks (ECM) bozunması ve yeniden şekillenmesinde merkezi rolleri olan metzinsin proteazlar ailesine ve ayrıca çeşitli büyüme faktörleri ve sitokinlerle etkileşimlere aittir. Spesifik MMP'lerin aşırı ekspresyonu, kanser, nörodejeneratif hastalıklar ve kardiyovasküler hastalık gibi çeşitli hastalıklardan sorumludur. MMP'ler, MMP aşırı ekspresyonu ile ilişkili hastalıkları tedavi edebilen terapötikler geliştirmeyi hedef alan hedefler olarak son zamanlarda ilgi odağı olmuştur.
Çözeltideki MMP mekanizmasını incelemek için, aktif, çözünür MMP'lerin üretimi için daha kolay ve sağlam rekombinant protein ekspresyonu ve saflaştırma yöntemlerine ihtiyaç vardır. Bununla birlikte, çoğu MMP'nin katalitik alanı, posttranslasyonel makine eksikliği nedeniyle Escherichia coli'de (E. coli) çözünür formda ifade edilemezken, memeli ekspresyon sistemleri genellikle maliyetlidir ve daha düşük verime sahiptir. MMP inklüzyon organları, doğal konformasyondaki MMP'lerin verimini önemli ölçüde azaltan sıkıcı ve zahmetli kapsamlı saflaştırma ve yeniden katlama sürecinden geçmelidir. Bu yazıda, matris metalloproteinaz-3 katalitik etki alanı (MMP-3cd) üretmek için Rosetta2 (DE3) pLysS (bundan böyle R2DP olarak anılacaktır) hücrelerini kullanan ve afinite saflaştırmasında kullanılmak üzere bir N-terminal His-etiketi ve ardından pro-domain (Hisx6-pro-MMP-3cd) içeren bir protokol sunulmaktadır. R2DP hücreleri, bakteriyel ekspresyon sistemlerinde normalde nadir görülen kodonları içeren kloramfenikol dirençli bir plazmid yoluyla ökaryotik proteinlerin ekspresyonunu arttırır. Rekombinant protein ekspresyonu için tercih edilen geleneksel hücre hattı BL21 (DE3) ile karşılaştırıldığında, bu yeni suşu kullanarak saflaştırma, saflaştırılmış Hisx6-pro-MMP-3cd'nin verimini artırdı. Aktivasyon ve tuzdan arındırma üzerine, pro etki alanı N-terminal His-tag ile birlikte bölünür ve sayısız in vitro uygulamada anında kullanım için aktif MMP-3cd sağlar. Bu yöntem pahalı ekipman veya karmaşık füzyon proteinleri gerektirmez ve bakterilerde rekombinant insan MMP'lerinin hızlı üretimini tanımlar.
Giriş
Çoğu kompleks ökaryotik protein, ekspresyondan sonra ayrıntılı posttranslasyonel modifikasyonlara uğrar ve yüksek oranda yardımcı protein katlanmasını ve ko-faktörlerin işlevsel olmasını gerektirir1. Bir bakteri konağında büyük miktarlarda çözünür insan proteini üretmek, yüksek maliyetler ve daha küçük ölçekli laboratuvar deneyleri için bile sağlam ekspresyon ve saflaştırma yöntemlerinin bulunmaması nedeniyle önemli bir zorluk olmaya devam etmektedir2,3. MMP'ler, büyük moleküler ağırlığa sahip insan endopeptidazları, genellikle E. coli'de ifade edildiğinde çözünmez inklüzyon cisimleri olarak ifade edilir. Çözünür insan MMP'lerinin ekstraksiyonu genellikle zahmetli, zaman alıcı bir çözünürlük ve yeniden katlama işlemine yol açar4.
MMP'ler hem fizyolojik hem de patojenik süreçlerde kritik rollere sahiptir. İnsan MMP'leri, yapı ve substrat özgüllüğüne göre kategorize edilen ve yüksek oranda korunmuş bir katalitik alana rağmen farklı şekilde eksprese edilen 23 çinko endopeptidaz ailesidir5,6. MMP'ler inaktif zimojenler olarak salgılanır, posttranslasyonel aktivasyon ve endojen inhibitörleri, metalloproteinazların doku inhibitörleri (TIMP'ler) 7,8,9,10 ile düzenlenir. Başlangıçta ECM cirosundaki rolleriyle tanınmasına rağmen, MMP'ler gelişim, morfogenez, doku onarımı ve yeniden şekillendirmede de rol oynamıştır8. MMP'lerin düzensizliği, diğer hastalıkların yanı sıra nörodejeneratif, kardiyovasküler ve fibrotik hastalıklarla birlikte kanserle de özellikle ilişkilendirilmiştir5,7.
Sağlam büyük ölçekli MMP üretim yöntemlerinin geliştirilmesi, biyokimyasal ve hücre bazlı testler yoluyla MMP mekanizmalarının gelecekteki çalışmalarının başarısını sağlamak için kritik öneme sahiptir. Çeşitli MMP'ler daha önce MMP aktivitesini değiştirmeden Hisx6 etiketli MMP'ler de dahil olmak üzere bakterilerde11 ifade edilmiştir12,13,14,15. Ancak, bu yöntemler çoğaltılması zor olabilecek sıkıcı, uzun adımlar içerir.
Memeli hücreleri, uygun posttranslasyonel modifikasyonları sağlarken birçok farklı insan proteinini eksprese etmek için de kullanılabilir16. Memeli ekspresyon sistemi, uygun post-translasyonel modifikasyonlarla rekombinant insan proteinleri üretmek için ideal bir seçim olmasına rağmen, bu yöntemin başlıca dezavantajları başlangıçtaki düşük verimler, maliyetli büyüme ortamı ve reaktifleri, kararlı ekspresyon hatlarına ulaşmak için uzun zaman çizelgeleri ve mantar veya bakteri gibi diğer türlerle kontaminasyon riskidir2,11 . Ayrıca, memeli hücre hatlarındaki MMP üretimi, TIMP veya fibronektinler gibi ilişkili hücresel proteinlerden safsızlıklar verir11. Memeli hücrelerinde gözlenen yavaş hücre büyümesinin aksine, bakteri ekspresyon sistemi, daha basit ortam ve büyüme gereksinimleri ile birlikte kısa sürede büyük ölçekli protein üretimi sunar. Bununla birlikte, bakteriyel ekspresyon sistemlerinde diğer ilişkili hücresel proteinlerin (yani TIMP'lerin) eksikliği nedeniyle, daha yüksek konsantrasyonlardaki aktif MMP'ler otoproteoliz yoluyla bozunmaya maruz kalır ve bu da zayıf MMP verimine neden olur17.
Bu yazıda, uygun fiyatlılığı, basitliği ve daha yüksek MMP verimi üretmedeki başarısı nedeniyle E. coli'yi ekspresyon konakçısı olarak kullanan rekombinant Hisx6-pro-MMP-3cd'nin bakteriyel ekspresyonu, saflaştırılması ve aktivasyonu için ayrıntılı bir yöntem açıklanmaktadır2,3,18. E. coli, rekombinant MMP'ler ve diğer karmaşık proteinler için gerekli protein katlama makinesinden ve posttranslasyonel işlemden yoksun olduğundan, birçok E. coli suşu bu sınırlamaların üstesinden gelmek için tasarlanmıştır ve E. coli'yi rekombinant insan MMP-3cd'nin ekspresyonu için daha uygun bir konakçı haline getirmiştir,19,20 . Örneğin, bu çalışmada kullanılan R2DP suşu, E. coli'de nadiren kullanılan kodonları içeren kloramfenikol dirençli bir plazmid sağlayarak ökaryotik ekspresyonu arttırır.
Bu protokolde açıklandığı gibi, R2DP hücrelerinde pET-3a vektöründen (Şekil 1) nispeten saf inklüzyon cisimlerinin aşırı ekspresyonundan sonra, Hisx6-pro-MMP-3 katalitik alan (MMP-3cd) proteinleri ekstrakte edilir ve denatüre edilir4. Hisx6-pro-MMP-3cd3,19, afinite etiketi kromatografisi kullanılarak saflaştırıldı. Yeniden katlanma ve diyaliz üzerine, pro-MMP-3cd (zymogen) 4-aminofenilmerkürik asetat (APMA) ile aktive edildi ve verimi ve daha fazla saflaştırma ihtiyacını değerlendirmek için SDS-PAGE analizi kullanıldı5,21. Bu protokol, örnek olarak çözünür MMP-3cd'nin ekspresyonunu, saflaştırılmasını ve aktivasyonunu açıklar. Bununla birlikte, diğer MMP'lerin ve insan proteazlarının benzer ekspresyonla ekspresyonu ve aktivasyon mekanizmaları için bir rehber olarak da kullanılabilir (Şekil 2). MMP-3cd dışındaki diğer proteinler için, okuyucunun bu protokolü denemeden önce hedef proteinleri için en uygun tampon bileşimlerini ve yöntemlerini belirlemesi önerilir.
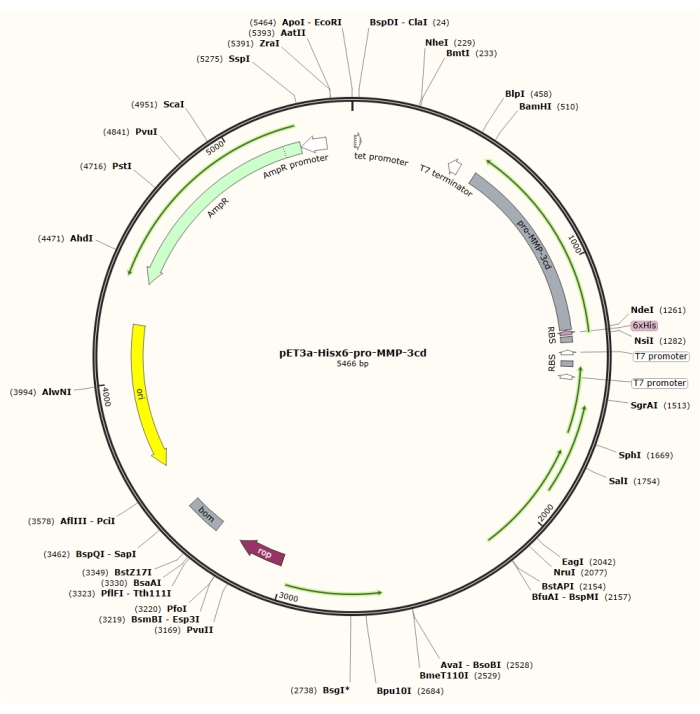
Resim 1: pET-3a-Hisx6-pro-MMP-3cd plazmidinin plazmid haritası. pET-3a vektörü bir ampisilin direnç geni içerir. Bir N-terminal Hisx6-etiket dizisi, BamHI ve NdeI kısıtlama bölgeleri arasında T7 promotörünün kontrolü altında pET-3a-Hisx6-pro-MMP-3cd yapısını üretmek için pro-MMP-3cd dahil olmak üzere pET-3a tabanlı vektöre klonlanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Pro-MMP-3cd'nin bakteriyel ekspresyonu, saflaştırılması, yeniden katlanması ve aktivasyonu. 1.1: pET-3a-Hisx6-pro-MMP-3cd plazmidi BL21 (DE3) veya R2DP Hücrelerine dönüştürüldü. 1.2: Pro-MMP-3cd protein ekspresyonu IPTG kullanılarak indüklendi. 1.3: Kimyasal lizis ve sonikasyon, esas olarak çözünmeyen ve inklüzyon cisimlerinde bulunan Hisx6-pro-MMP-3cd proteinlerini çıkarmak için kullanılır. Üre, proteini inklüzyon cisimciklerinden denatüre etmek ve çözündürmek için kullanıldı. 2.1. Denatüre Hisx6-pro-MMP-3cd proteini, afinite kromatografisi saflaştırması ile saflaştırıldı. 3. Salınan Hisx6-pro-MMP-3cd, ürenin tampondan kademeli olarak çıkarılmasıyla diyaliz sırasında yavaşça yeniden katlandı. 4. Son olarak, yeniden katlanmış MMP-3cd proteini, N-terminal pro-peptid alanı çıkarılarak APMA kullanılarak aktive edildi. APMA daha sonra tuzdan arındırma yoluyla çözeltiden çıkarılır. Sayılar, bu adımları açıklayan protokol bölümlerine karşılık gelir. Kısaltmalar: MMP-3cd = Matriks metalloproteinaz-3 katalitik alan; APMA = 4-aminofenilmerkürik asetat. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
1. MMP ifadesi
- pET-3a-Hisx6-pro-MMP-3cd'nin klonlanması ve R2DP hücrelerine dönüştürülmesi
- pET-3a plazmidini (Malzeme Tablosuna bakınız) Digest Buffer'daki NdeI ve BamHI kısıtlama enzimleri ile sindirin ( Malzeme Tablosuna bakınız). Toplam 40 μL'lik bir reaksiyon hacminde, 4 μL Sindirim Tamponu, 33 μL 100 ng / μL plazmid ve her bir kısıtlama enziminin 1.5 μL'sini ekleyin ve reaksiyonun 37 ° C'de tamamlanana kadar ~ 2 saat ilerlemesine izin verin.
- Bir N-terminal His-etiketi eklemek için MMP-3cd dizisinde bir PCR reaksiyonu gerçekleştirin. 25 μL PCR Karışımı ( Malzeme Tablosuna bakınız), 2,5 μL 10 μM astarlar (Ek Şekil S1) ve 100 ng/μL kesici uç dizisinin 1,25 μL'sini kullanın. 50 μL'lik bir son reaksiyon hacmine steril su ekleyin.
- PCR ürününü ve sindirilmiş vektörü% 1'lik bir agaroz jeli üzerinde çalıştırın. Jel bantlarını, üreticinin protokolüne göre bir Jel Kurtarma Kiti ( Malzeme Tablosuna bakınız) kullanarak saflaştırın.
- DNA Assembly Mix'i kullanarak güçlendirilmiş PCR ürününü NdeI ve BamHI kısıtlama bölgeleri arasındaki sindirilmiş vektöre klonlayın ( bkz. Toplam 15 μL'lik reaksiyon hacmi için kesici uç ve kesme vektörünün gerekli hacmini belirlemek için çevrimiçi araçları kullanın.
- Çözülene kadar buz üzerinde 50 μL'lik bir yüksek dönüşüm verimli hücre alikotunu (Malzeme Tablosuna bakınız) çözün. SOC Büyüme Ortamını (Malzeme Tablosuna bakınız) 37 °C'ye ve LB-ampisilin (LB Amper) plakalarına ( Malzeme Tablosuna bakınız) ısıtın.
- 50 μL aliquot'a pET-3a-Hisx6-pro-MMP-3cd montaj reaksiyonunun 1-2 μL'sini ekleyin. 30 dakika boyunca buz üzerinde kuluçkaya yatırın.
- 30 s boyunca 42 ° C'de inkübe ederek hücreleri ısıl şoka sokun. 2 dakika boyunca buz üzerinde kuluçkaya yatırın.
- Her dönüştürücü karışıma 950 μL SOC büyüme ortamı ekleyin. 250 rpm ve 37 °C'de 1 saat çalkalayın.
- LB Amp plakalar üzerindeki transformantların 100 μL'lik plakası ve 37 °C'de gece boyunca inkübe edilir.
- İzole edilen her koloniye 10 mL LB Amp ortamında aşılayın. Gece boyunca 250 rpm ve 37 °C'de çalkalayın.
- Miniprep kiti için üreticinin protokolüne göre plazmid DNA'sını çıkarın ( Malzeme Tablosuna bakınız). T7 ileri ve geri astarları kullanarak yapının sırasını onaylayın (Ek Şekil S1).
NOT: pET-3a-Hisx6-pro-MMP-3cd yapı DNA'sı -20 °C'de saklanabilir. Hazır olduğunda, R2DP hücrelerine dönüştürmeye devam edin. - R2DP hücrelerinin bir adet 20 μL alikotunu ( Malzeme Tablosuna bakınız) 2-5 dakika boyunca buz üzerinde çözün. SOC büyüme ortamından oda sıcaklığına kadar ısıtın ve LB Amp CamR plakaları 37 °C'ye kadar ( Malzeme Tablosuna bakınız).
- 50 μL aliquot'a 1 μL 100 ng/μL dizi onaylı pET-3a-Hisx6-pro-MMP-3cd ekleyin. Tüpü karıştırmak ve buza döndürmek için hafifçe karıştırın.
- Tüpü 5 dakika boyunca buz üzerinde kuluçkaya yatırın.
- Tam olarak 30 s için 42 ° C'de inkübe ederek hücreleri ısıl şoka sokun. Sallamayın.
- Hücreleri 2 dakika boyunca buzun üzerine yerleştirin.
- Transforman karışıma 80 μL oda sıcaklığında SOC ortamı ekleyin. 250 rpm ve 37 °C'de 1 saat çalkalayın.
- Transformantları LB Amp CamR plakalarına yerleştirin ve gece boyunca 37 °C'de inkübe edin.
- Büyüme ve indüksiyon
- Bir LB Amp CamR plakasından R2DP pET-3a-Hisx6-pro-MMP-3cd dönüştürücüsünün tek, izole bir kolonisini, 37 ° C'de 10 mL LB Amp CamR ortamında aşılayın. Gece boyunca 250 rpm'de sallayın (~ 16 saat). Her kültürden alikotları saklayın ve istenirse% 40 (v / v) gliserol ( Malzeme Tablosuna bakınız) stokları hazırlayın.
- Gece kültürü başına, 500 mL LB Amp CamR ortamı içeren 1 L'lik bir şişeyi, 600 nm'de (OD600) 0.05-0.1'lik bir optik yoğunluğa aşılayın.
NOT: Bu, hücreleri logaritmik büyümeye döndürmelidir. - OD600'ü birkaç zaman noktasında, tipik olarak 3-4 saat boyunca, 0,4 ila 0,6 arasına düşene kadar ölçün.
- İndüksiyondan önce, kültürün bir kısmını 1.5 mL'lik bir mikrofüj tüpüne alikote edin ( Malzeme Tablosuna bakınız) ve İndüklenmemiş Fraksiyon olarak etiketleyin. Jel analizi için -80 °C'de saklayın. SDS-PAGE jeli çalıştırmıyorsanız, bu adımı atlayın ve adım 1.2.5'e geçin.
- 1 M izopropil-ß-D-tiyogalaktopiranosid (IPTG) stoğu kullanarak kültürleri 1 mM'lik bir nihai konsantrasyona indükleyin (bakınız Malzeme Tablosu). 37 °C çalkalayıcıda 3-4 saat daha inkübe etmeye devam edin.
NOT: İfade sırasında, okuyucu indüksiyon sırasında en uygun OD600'ü ve IPTG konsantrasyonunu belirlemelidir. Saflaştırmadan sonra verim önemli ölçüde düşerse, saflaştırma tamponlarındaki imidazol konsantrasyonunun ayarlanması gerekebilir veya hücre peletinin daha fazla sonikleştirilmesi gerekebilir. - Kültürleri santrifüjlemeden önce, kültürün bir kısmını ikinci bir 1.5 mL mikrofüj tüpüne alın ve İndüklenmiş Fraksiyon olarak etiketleyin. Jel analizi için -80 °C'de saklayın. SDS-PAGE jeli çalıştırmıyorsanız, bu adımı atlayın ve adım 1.2.7'ye geçin.
- Hücre kültürünü 250 mL konik şişelerde ( Malzeme Tablosuna bakınız) maksimum hızda ve 4 °C'de 10 dakika boyunca santrifüj yapın.
- Kültürler tamamen peletlenene kadar adım 1.2.7'yi tekrarlayın.
NOT: DURAKLAT: Hücre peletleri -80 °C'de dondurulabilir ve daha sonra işlenmek üzere çözülebilir. Aksi takdirde, bu adımı atlayın ve adım 1.3.1'e geçin.
- Inklüzyon cisimciklerinin ekstraksiyonu ve çözündürülmesi
NOT: Taze 10 M üre, tercihen bir günden daha erken olmamak üzere, tamamen eriyene kadar iyice karıştırarak hazırlayın. Üreyi ısıtmayın veya otoklav yapmayın; oda sıcaklığında saklayın.- Peletin (adım 1.2.8'den itibaren) lizis tamponunda yeniden askıya alınması (Malzeme Tablosuna bakınız). Pelet gramı başına 3 mL lizis tamponu ekleyin ve vorteks veya pipetleme ile yeniden askıya alın. Gece boyunca 4 °C'de çalkalayın.
- 1 L kültür başına 1.25 mL% 10 (w / v) sodyum deoksikolat ekleyin ( Malzeme Tablosuna bakınız). Oda sıcaklığında 150 rpm'de 30 dakika çalkalayın.
- 1 L kültür başına 10 μL DNaz I ekleyin ( Malzeme Tablosuna bakın). Oda sıcaklığında 150 rpm'de 30 dakika çalkalayın.
- 13.000 × g ve 4 °C'de 10 dakika santrifüj.
- Jel analizi için Lysed MMP'nin bir kısmını bir kenara koyun. -80 °C'de saklayın. Jel analizi yapılmıyorsa, adım 1.3.6'ya geçin.
NOT: Santrifüjlemeden sonra, pelet telli olabilir ve kompakt bir şekilde paketlenmemiş olabilir, bu da süpernatanın atılmasını riskli hale getirir. Bu durumda, adım 1.3.6'yı atlayın ve adım 1.3.7'ye geçin. - Süpernatantı santrifüjlü numunelerden atın.
NOT: Protokol bu noktada duraklatılabilir ve hücre peletleri -80 ° C'de dondurulabilir ve daha sonra çözülebilir. Aksi takdirde, bu adımı atlayın ve adım 1.3.7'ye geçin. - Pelet, yukarı ve aşağı pipetleyerek, 100 mL/L Inklüzyon Gövde Tamponu kültüründe ( Malzeme Tablosuna bakınız) yeniden askıya alın.
- Sonikasyon sırasında, aşırı ısınmayı önlemek için örnekleri buz üzerinde tutun. Her numuneyi 15 s'lik 6 döngü, çıkış 5 ve% 50 darbe için sonikleştirin. Çevrimler arasında soğutma için 15 s dinlenme süresi bekleyin.
NOT: Gerekirse, daha fazla santrifüjleme için numuneleri 50 mL konik tüplere aktarın ( Malzeme Tablosuna bakınız). 13.000 × g ve 4 °C'de 10 dakika santrifüj. - Jel analizi için Sonicated MMP'nin bir kısmını bir kenara koyun. -80 °C'de saklayın. Jel analizi yapılmıyorsa, adım 1.3.11'e geçin.
- Pelet'i kontrol edin. Dizeliyse, 1.3.8-1.3.10 arasındaki adımları yineleyin. Pelet kompaktsa, süpernatantı atın ve adım 1.3.12'ye geçin.
NOT: Inklüzyon Vücut Tamponunda Sonikasyon, lize hücre kalıntılarından daha fazla protein geri kazanmak için tekrarlanabilir. Bununla birlikte, çok fazla sonikasyon, MMP verimine zarar veren kesmeye neden olabilir. Protokol bu aşamada duraklatılabilir ve hücre peletleri -80 ° C'de dondurulabilir ve daha sonra çözülebilir. - Pipetleme yoluyla her bir peleti 1 L'lik bir kültürden 5 mL Çözünürlük Tamponunda ( Malzeme Tablosuna bakınız) yeniden askıya alın. Proteinlerin çözünmesini sağlamak için buz üzerinde en az 30 dakika inkübe edin.
- Jel analizi için Çözünür MMP'nin bir kısmını bir kenara koyun. -80 °C'de saklayın. Jel analizi yapılmıyorsa, adım 1.3.14'e geçin.
- Hücreleri 13.000 × g ve 4 ° C'DE 10 dakika boyunca santrifüj edin.
- Santrifüjlemeden sonra bir pelet oluşursa/kalırsa, süpernatantı ayrı bir 50 mL konik tüpe dökün. Pelet, yukarı ve aşağı pipetleyerek, başka bir 5 mL Çözünürlük Tamponunda (1 L kültür başına) yeniden askıya alın.
- 13.000 × g ve 4 ° C'DE 10 dakika boyunca santrifüj. süpernatanı atmayın.
- Santrifüjlemeden sonra pelet oluşana veya sadece gri çökelti kalana kadar 1.3.13 ve 1.3.14 adımlarını tekrarlayın. Süpernatantları bir araya getirin. Ek sonikasyon için peleti -80 ° C'de atın veya saklayın.
2. MMP saflaştırma ve yeniden katlama
- Onun etiketi (HT) afinite saflaştırma
- Üreticinin protokolüne göre, bir yerçekimi akışı sütununu (Malzeme Tablosuna bakınız) iyi karıştırılmış Ni-NTA reçinesi ile doldurun ( Malzeme Tablosuna bakınız). Reçinenin yerleşmesine ve depolama tamponundan ayrılmasına izin verin, böylece iki katman arasında ayrı bir çizgi oluşur.
NOT: Hava reçineye nüfuz edeceğinden ve protein verimine zarar vereceğinden reçinenin kurumasına asla izin vermeyin. Kullanımlar arasında, bölüm 2.2'de açıklanan reçine rejenerasyon prosedürünü uygulayın. - Depolama arabelleğinin boşalmasına izin verin. Sütunu iki reçine yataklı HT Denge Arabelleği hacmiyle doldurun.
- HT Dengeleme Arabelleğini boşaltın ve atın. Kolon boşalırken, protein ekstraktını 1 dakika boyunca 13.000 × g'de santrifüj edin ve 0.22 μm'lik bir filtre kullanarak filtreyle sterilize edin ( Malzeme Tablosuna bakınız).
- Atık konteynerini HT Flowthrough etiketli 50 mL'lik konik bir tüp ile değiştirin. Hazırlanan protein ekstraktını kolona ekleyin.
- Bağlamayı en üst düzeye çıkarmak için akışı yeniden uygulayın.
- Jel analizi için Flowthrough Fraksiyonunun bir kısmını bir kenara koyun. -80 °C'de saklayın. Jel analizi yapılmıyorsa, adım 2.1.7'ye geçin.
- Reçineyi derhal 15 mL HT Yıkama Tamponu ile yıkayın (Malzeme Tablosuna bakınız). Akışı HT Yıkama etiketli 15 mL konik tüplerde toplayın (Malzeme Tablosuna bakınız).
NOT: 280 nm'deki (A280) absorbans değerleri spektrofotometri ile elde edilmiş ve protein konsantrasyonlarını tahmin etmek için moleküler ağırlık ve yok olma katsayısı olan ε ile birlikte kullanılmıştır. Denatüre Hisx6-pro-MMP-3cd için moleküler ağırlık 29.86 kDa'dır ve ε 34.38 M-1 cm-1'dir. - HT Yıkama Arabelleğine karşı boşluk bırakarak A280'i ölçün ve kaydedin. 2.1.7 ve 2.1.8 adımlarını ek yıkama fraksiyonlarıyla tekrarlayın. A280 taban çizgisine yaklaştığında ve safsızlıklar en aza indirildiğinde, adım 2.1.9'a geçin.
- Jel analizi için Yıkama Fraksiyonunun bir kısmını bir kenara koyun. Birden fazla yıkama fraksiyonu için tekrarlayın. Fraksiyonları -80 °C'de saklayın. Jel analizi yapılmıyorsa, adım 2.1.10'a geçin.
- 5 mL HT Elüsyon Tamponu ekleyerek His etiketli proteinleri derhal etkisiz hale getirin (Malzeme Tablosuna bakınız). HT Elüsyon etiketli mikrofüj tüplerinde 0.5-1 mL fraksiyonları olarak akışı toplayın.
- Jel analizi için Elüsyon Fraksiyonunun bir kısmını bir kenara koyun. Birden fazla elüsyon fraksiyonu için tekrarlayın. Fraksiyonları -80 °C'de saklayın. Jel analizi yapılmıyorsa, adım 2.1.12'ye geçin.
- A280 >0.3 mg/mL ise, fraksiyonu HT Denge Tamponu ile seyreltin (bkz.
NOT: Salınan fraksiyon, diyaliz sırasında çökelmeyi önlemek için 0.3 mg / mL veya daha az bir A280'e seyreltilmelidir. Protokol burada duraklatılabilir ve havuzlanmış fraksiyonlar -80 ° C'de dondurulabilir ve daha sonra çözülebilir. Aksi takdirde, bu adımı atlayın ve adım 2.2.1'e geçin.
- Üreticinin protokolüne göre, bir yerçekimi akışı sütununu (Malzeme Tablosuna bakınız) iyi karıştırılmış Ni-NTA reçinesi ile doldurun ( Malzeme Tablosuna bakınız). Reçinenin yerleşmesine ve depolama tamponundan ayrılmasına izin verin, böylece iki katman arasında ayrı bir çizgi oluşur.
- Reçine rejenerasyonu
- Reçineyi on reçine yatağı hacmi HT Rejenerasyon Tamponu ( Malzeme Tablosuna bakınız) ve on reçine yatağı hacmi steril su ile yıkayın.
- Reçineyi% 50 bulamaç olarak% 20 (v / v) etanol içinde suda saklayın.
3. Protein yeniden katlanması
NOT: Daha küçük hacimler için, diyaliz kasetleri daha düşük numune kaybı riski altında kullanılabilir. Daha büyük hacimler kullanılıyorsa diyaliz borusu gereklidir ( Malzeme Tablosuna bakınız).
- Diyaliz
NOT: Diyaliz için optimum protein konsantrasyonu ~ 0.3 mg / mL'dir. Diyaliz sırasında önemli yağış meydana gelirse, kademeli diyaliz yöntemi kullanarak her diyaliz arasındaki üre konsantrasyon gradyanını azaltın ve daha fazla ara adım ekleyin (örneğin, 5 M aşamasını atlamak yerine 6 M'den 5 M'ye ve ardından 5 M'den 4 M'ye). Donma-çözülme döngüleri hücresel ve protein yapısına zarar verdiğinden, protokoldeki duraklamaları en aza indirmek hayati önem taşır.- Üreticinin protokolüne göre, Elüsyon Fraksiyonu örneklerinin hacmine göre uygun miktarda diyaliz tüpü kullanın.
- Salınımlı MMP fraksiyonlarını diyaliz borusuna 1 L Diyaliz Tamponu 1'e batırın (Malzeme Tablosuna bakınız). Boruyu ve içeriğini manyetik bir karıştırıcı üzerinde 4 ° C'de en az 8 saat boyunca karıştırın.
- 1 l diyaliz tamponu 2'ye aktarın ( malzeme tablosuna bakınız). Boruyu ve içeriğini manyetik bir karıştırıcı üzerinde 4 ° C'de en az 8 saat boyunca karıştırın.
- 1 l diyaliz tamponu 3'e aktarın ( malzeme tablosuna bakınız). Boruyu ve içeriğini manyetik bir karıştırıcı üzerinde 4 ° C'de en az 8 saat boyunca karıştırın.
- Numuneyi yeni 50 mL konik tüplere aktarın ve bunları Diyalize MMP olarak etiketleyin.
- Tüpü herhangi bir çökelti için inceleyin. Çökelti oluşmuşsa, numuneyi 13.000 × g ve 4 ° C'de 1 dakika boyunca santrifüj edin.
- Süpernatantı yeni 15 mL konik tüplere aktarın ve bunları Yeniden Katlanmış MMP olarak etiketleyin.
- Jel analizi için bir kesir ayırın ve Yeniden Katlanmış MMP olarak etiketleyin. -80 °C'de saklayın. Jel analizi yapılmıyorsa, adım 3.1.9'a geçin.
NOT: Verim düşükse, çökelti HT Denge Tamponunda çözülebilir ve bölüm 3.1'deki adımlar diyaliz borusu ile tekrarlanabilir. Jel analizi yapılmayacaksa veya protokol burada duraklatılacaksa, numuneleri -80 ° C'de dondurun ve daha sonra çözün. Verim istenen aralıktaysa, adım 3.2.1'e geçin.
- Yeniden konsantrasyon
NOT: Yeniden katlanmış ve denatüre edilmiş Hisx6-pro-MMP-3cd için yok olma katsayılarının aynı olması beklenmektedir; Bu nedenle, A280 hesaplamaları etkilenmez.- Numuneyi 0,5 mg/mL'ye kadar yeniden konsantre edin. Numuneyi 15 mL'ye konsantre etmek için 400 mL'lik bir karıştırılmış hücre kullanın (Malzeme Tablosuna bakın). Köpüklenmeyi önlemek için, gerekirse daha fazla konsantre olmak için 50 mL'lik bir yeniden konsantrasyon tüpü kullanın.
NOT: Bir çökelti oluşursa, HT Denge Tamponunda peletlenebilir ve çözülebilir. Ardından, bölüm 3.1 ve adım 3.2.1'i yineleyin. Aksi takdirde, adım 3.2.2'ye geçin. - Jel analizi için bir kesir ayırın ve Konsantre MMP olarak etiketleyin.
NOT: Protokol burada duraklatılabilir ve numuneler -80 °C'de dondurulabilir ve daha sonra çözülebilir.
- Numuneyi 0,5 mg/mL'ye kadar yeniden konsantre edin. Numuneyi 15 mL'ye konsantre etmek için 400 mL'lik bir karıştırılmış hücre kullanın (Malzeme Tablosuna bakın). Köpüklenmeyi önlemek için, gerekirse daha fazla konsantre olmak için 50 mL'lik bir yeniden konsantrasyon tüpü kullanın.
4. Etkinleştirme
- 4-Aminofenilmerkürik asetat (APMA) aktivasyonu
NOT: APMA oldukça toksiktir. Etkinleştirmeden önce 20 mM APMA'lık yeni bir stok çözümü yapın ve APMA kullanırken daima bir duman başlığı altında çalışın. APMA atıklarını kabına atın.- 1 mL MMP aliquot (1 mg / mL) başına, 1 mM'lik son APMA konsantrasyonuna ulaşmak için 50 μL 20 mM APMA ekleyin ( Malzeme Tablosuna bakınız). Gece boyunca 37 ° C'de inkübe edin.
- Bir çökelti oluşursa, 4 ° C'de 10 dakika boyunca maksimum hızda santrifüj yapın. Süpernatantı Aktif MMP etiketli 1,5 mL'lik bir mikrofüj tüpünde saklayın. Çökeltiyi APMA atıkları için işaretlenmiş bir kaba atın.
- Jel analizi için bir kesir ayırın ve Aktif MMP olarak etiketleyin.
NOT: Protokol burada duraklatılabilir ve numuneler -80 °C'de dondurulabilir ve daha sonra çözülebilir. Jel analizi yapılmıyorsa, adım 4.2.1'e geçin. Aktivasyondan sonra, MMP-3cd'nin moleküler ağırlığı ve yok olma katsayısı sırasıyla 19.40 kDa ve 28.42 M-1 cm-1'dir.
- Tuzdan arındırma
- APMA'yı etkinleştirilen MMP-3cd numunesinden, üreticinin protokolünü izleyerek 2 mL'lik bir tuz giderme sütunuyla çıkarın (Malzeme Tablosuna bakın).
- Jel analizi için bir kesir ayırın ve Tuzdan Arındırılmış MMP olarak etiketleyin. -80 °C'de saklayın. Jel analizi yapılmıyorsa, kalan numunelerle birlikte bölüm 4.3'e geçin.
NOT: Protokol burada duraklatılabilir ve numuneler -80 °C'de dondurulabilir ve daha sonra çözülebilir.
- SDS-PAGE jellerinin çalıştırılması
- Tüm protein fraksiyonlarını SDS-PAGE jellerinde çalıştırın: İndüklenmemiş Fraksiyon, İndüklenmiş Fraksiyon, Lizlenmiş MMP, Sonicated MMP, Çözünürleştirilmiş MMP, Akış Fraksiyonu, Yıkama Fraksiyonu, Elüsyon Fraksiyonu, Yeniden Katlanmış MMP, Konsantre MMP, Aktif MMP ve Tuzdan Arındırılmış MMP.
- MMP-3'ün uzun süreli depolanması
- Tuzdan arındırılmış MMP-3cd numunelerine %0,05 (v/v) iyonik olmayan yüzey aktif madde ekleyin ( Malzeme Tablosuna bakınız) ve bunları -80 °C'de saklayın.
Sonuçlar
SDS-PAGE'de numuneler çalıştırılırken, protein çözünmez inklüzyon cisimleri şeklinde ifade edildiğinden, lize ve sonikasyonlu fraksiyonlar, protein henüz üre içinde çözünmediğinden, Hisx6-pro-MMP-3cd ekstraktını çok az içermeli veya hiç içermemelidir. Şekil 3 , BL21 (DE3) hücrelerinden ve R2DP hücrelerinden Hisx6-pro-MMP-3cd'nin His-tag saflaştırma elüsyon fraksiyonlarını karşılaştırmaktadır. Elüsyon fraksiyonları, diyalizden önce hem BL21 (DE3) hem d...
Tartışmalar
Çözünür, insan, rekombinant MMP'lerin büyük ölçekli üretimi zorlu bir görev olmaya devam etmektedir. Memeli hücreleri, fonksiyonel MMP'leri yüksek maliyetlerle ve uzun bekleme süreleriyle ifade edebilirken, E. coli hızla saflaştırılması ve yeniden katlanması gereken yüksek miktarda MMP inklüzyon cismi üretir11,16. R2DP hücreleri, MMP inklüzyon gövdelerinin verimini önemli ölçüde artırarak daha uygun maliyetli ve üretken bir...
Açıklamalar
Yazarlar, rekabet eden finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Yazarlar, Jacksonville, Florida'daki Mayo Clinic'teki Dr. Evette Radisky ve Alexandra Hockla'ya, Hisx6pro-MMP-3cd genini klonlamak için şablon olarak pET-3a-pro-MMP-3cd plazmidini sağladıkları için ve yorumlarına ve DNA dizilimi için Nevada Üniversitesi, Reno'daki Nevada Genomik Merkezi'nden Dr. Paul Hartley ile birlikte teşekkür etmek istiyorlar. Yazarlar ayrıca Cassandra Hergenrader'e protein ekspresyonunun bir kısmına yardımcı olduğu için teşekkür etmek istiyorlar. M.R.-S. NIH-P20 GM103650-COBRE Bütünleştirici Sinirbilim hibesine ve UNR Ar-Ge mICRO SEED Hibe Ödülü'ne teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| Nonionic surfactant | Thermo Fisher Scientific | PI28316 | Storage detergent for preventing MMP aggregation. Minimizes interactions between hydrophobic residues on the MMP surface and water molecules, without disrupting catalytic activity. |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
Referanslar
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır