このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アフィニティークロマトグラフィーを用いたヒトマトリックスメタロプロテイナーゼ-3の細菌発現と精製
要約
hisタグの精製、透析、および活性化は、細菌における可溶性で活性なマトリックスメタロプロテイナーゼ-3触媒ドメインタンパク質発現の収率を増加させるために用いられる。タンパク質画分は、SDS-PAGEゲルを介して分析される。
要約
マトリックスメタロプロテイナーゼ(MMP)は、細胞外マトリックス(ECM)の分解およびリモデリング、ならびにいくつかの成長因子およびサイトカインとの相互作用において中心的な役割を果たすメチンチンプロテアーゼのファミリーに属する。特定のMMPの過剰発現は、癌、神経変性疾患、および心血管疾患などのいくつかの疾患において責任がある。MMPは、MMPの過剰発現と相関する疾患を治療できる治療法を開発する標的として、近年注目されている。
溶液中のMMPメカニズムを研究するためには、活性で可溶性MMPの生産のために、より容易で堅牢な組換えタンパク質の発現および精製方法が必要である。しかし、ほとんどのMMPの触媒ドメインは、翻訳後機構の欠如のために可溶性形態で 大腸菌 (E. coli)で発現することができないが、哺乳類の発現系は通常高価であり、収率が低い。MMP封入体は、広範な精製およびリフォールディングの退屈で面倒なプロセスを経なければならず、天然の立体構造におけるMMPの収率を著しく低下させる。本稿では、Rosetta2(DE3)pLysS(以下、R2DPという)細胞を用いて、N末端Hisタグとそれに続くプロドメイン(Hisx6-pro-MMP-3cd)を含むマトリックスメタロプロテイナーゼ-3触媒ドメイン(MMP-3cd)を作製するためのプロトコールを提示する。R2DP細胞は、細菌発現系において通常稀なコドンを含むクロラムフェニコール耐性プラスミドを介して真核生物タンパク質の発現を増強する。組換えタンパク質発現に最適な従来の細胞株BL21(DE3)と比較して、この新しい株を用いた精製により、精製Hisx6-pro-MMP-3cdの収率が向上しました。活性化および脱塩時に、プロドメインはN末端Hisタグとともに切断され、無数の インビトロ用途で 即時使用するための活性MMP-3cdを提供する。この方法は、高価な装置または複雑な融合タンパク質を必要とせず、細菌における組換えヒトMMPの迅速な生産を記載する。
概要
ほとんどの複雑な真核生物タンパク質は、発現後に精巧な翻訳後修飾を受け、高度に支援されたタンパク質の折り畳みと補因子が機能的であることを必要とする1。細菌宿主中で大量の可溶性ヒトタンパク質を生産することは、小規模の実験室実験であっても、高いコストと堅牢な発現および精製方法の欠如のために、依然として大きな課題です2,3。MMPsは、分子量の大きいヒトエンドペプチダーゼであり、大腸菌で発現すると通常不溶性封入体として発現される。可溶性ヒトMMPの抽出は、しばしば面倒で時間のかかる可溶化およびリフォールディングプロセスにつながる4。
MMPは、生理学的および病原性プロセスの両方において重要な役割を果たしている。ヒトMMPは、23個の亜鉛エンドペプチダーゼのファミリーであり、構造および基質特異性によって分類され、高度に保存された触媒ドメインにもかかわらず差動的に発現される5,6。MMPsは、不活性なザイモゲンとして分泌され、翻訳後活性化およびそれらの内因性阻害剤を介して調節される、メタロプロテイナーゼ(TIMP)の組織阻害剤7、8、9、10。MMPは当初、ECMの代謝回転における役割が認識されていましたが、発生、形態形成、組織修復、およびリモデリングにも関与しています8。MMPの調節不全は、神経変性疾患、心臓血管疾患、線維性疾患などとともにがんと顕著に関連しています5,7。
堅牢な大規模MMP生産法の開発は、生化学的および細胞ベースのアッセイによるMMPメカニズムの将来の研究の成功を確実にするために不可欠です。Hisx6タグ付きMMPを含む様々なMMPが、MMP活性を変化させることなく、細菌11において以前に発現されてきた12、13、14、15。ただし、これらの方法には、複製が困難な退屈で長い手順が含まれます。
哺乳類細胞は、適切な翻訳後修飾を確保しながら、多くの異なるヒトタンパク質を発現させるためにも使用できます16。哺乳類の発現系は、適切な翻訳後修飾を有する組換えヒトタンパク質を産生するのに理想的な選択であるが、この方法の主な欠点は、初期の低収量、高価な増殖培地および試薬、安定した発現ラインに到達するまでの長いタイムライン、および真菌または細菌などの他の種による汚染のリスクである2,11。.さらに、哺乳動物細胞株におけるMMP産生は、TIMPまたはフィブロネクチン11などの関連する細胞タンパク質から不純物を生じる。哺乳類細胞で観察される遅い細胞増殖とは異なり、細菌発現系は、より単純な培地および増殖要件とともに、短期間で大規模なタンパク質生産を提供する。しかし、細菌発現系には他の関連する細胞タンパク質(すなわちTIMP)がないため、高濃度の活性MMPは自己タンパク質分解による分解を受け、MMP収率が低下する17。
本稿では、MMPs2,3,18の手頃な価格、単純さ、およびより高い収率の生産に成功しているため、大腸菌を発現宿主として用いた組換えHisx6-pro-MMP-3cdの細菌発現、精製、および活性化の詳細な方法を説明する。大腸菌は組換えMMPやその他の複雑なタンパク質に必要なタンパク質折り畳み機構と翻訳後プロセシングを欠いているため、多くの大腸菌株がこれらの制限を克服するように設計されており、大腸菌は組換えヒトMMP-3cdの発現に適した宿主となっています,19,20。.例えば、本研究で用いたR2DP株は、大腸菌でめったに使用されないコドンを含むクロラムフェニコール耐性プラスミドを供給することにより、真核生物の発現を増強する。
このプロトコールに記載されているように、R2DP細胞においてpET-3aベクター(図1)から比較的純粋な封入体を過剰発現させた後、Hisx6-pro-MMP-3触媒ドメイン(MMP-3cd)タンパク質を抽出し、変性させる4。Hisx6-プロ-MMP-3cd3,19をアフィニティータグクロマトグラフィーを用いて精製した。リフォールディングおよび透析時に、プロMMP-3cd(ザイモゲン)を4-アミノフェニル水銀アセテート(APMA)によって活性化し、SDS-PAGE分析を使用して収率およびさらなる精製の必要性を評価する5,21。このプロトコルは、可溶性MMP-3cdの発現、精製、および活性化を例として記載する。しかしながら、同様の発現、および活性化機構を有する他のMMPsおよびヒトプロテアーゼの発現のためのガイドとしても使用され得る(図2)。MMP-3cd以外の他のタンパク質については、このプロトコールを試みる前に、標的タンパク質に最適なバッファー組成と方法を決定することをお勧めします。
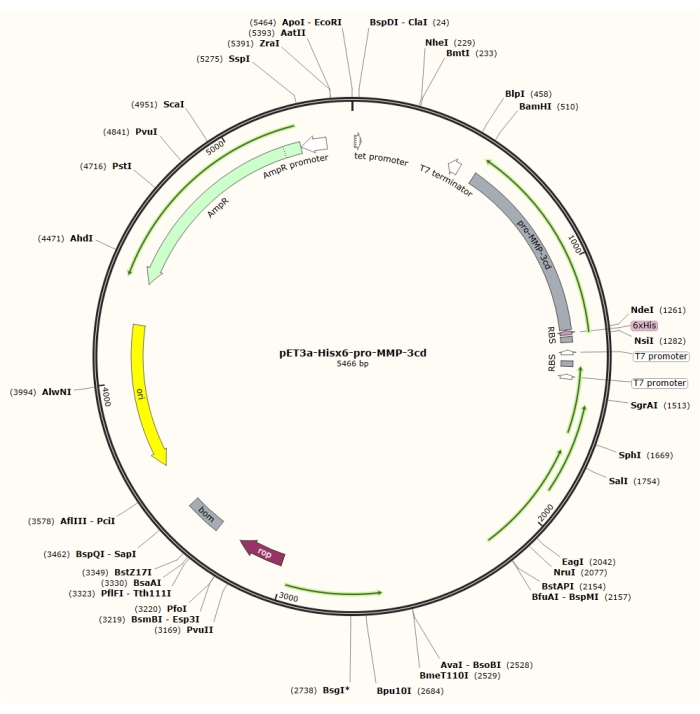
図1:pET-3a-Hisx6-pro-MMP-3cdプラスミドのプラスミドマップ。 このpET-3aベクターは、アンピシリン耐性遺伝子を含む。N末端Hisx6タグ配列をプロMMP-3cdを含むpET-3aベースのベクターにクローニングし、BamHIとNdeI制限部位との間のT7プロモーターの制御下でpET-3a-Hisx6-プロMMP-3cd構築物を作製する。 この図の拡大版を表示するには、ここをクリックしてください。

図2:プロMMP-3cdの細菌発現、精製、リフォールディング、および活性化 。 1.1:pET-3a-Hisx6-pro-MMP-3cdプラスミドをBL21(DE3)またはR2DP細胞に形質転換した。2:IPTGを用いてPro-MMP-3cdタンパク質発現を誘導した。1.3:化学溶解および超音波処理は、主に不溶性であり、封入体に見られるHisx6-pro-MMP-3cdタンパク質を抽出するために使用されます。尿素は、封入体からタンパク質を変性および可溶化するために使用された。変性Hisx6-pro-MMP-3cdタンパク質をアフィニティークロマトグラフィー精製により精製した。3. 溶出したHisx6-pro-MMP-3cdは、透析中に緩衝液から尿素を徐々に除去することにより、ゆっくりとリフォールディングした。最後に、リフォールディングされたMMP-3cdタンパク質を、N末端プロペプチドドメインを除去することによってAPMAを用いて活性化した。APMAは、後に脱塩によって溶液から除去される。番号は、これらの手順を説明するプロトコルのセクションに対応しています。略語: MMP-3cd = マトリックスメタロプロテイナーゼ-3触媒ドメイン;APMA=4-アミノフェニル水銀アセテート。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1. MMP式
- pET-3a-Hisx6-pro-MMP-3cdのR2DP細胞へのクローニングと形質転換
- pET-3aプラスミド(材料表を参照)をNdeIおよびBamHI制限酵素で消化バッファー(材料表を参照)で消化します。40 μLの総反応容量に、4 μLの消化バッファー、33 μLの100 ng/μLプラスミド、および1.5 μLの各制限酵素を加え、37°Cで反応が終了するまで約2時間反応を進行させる。
- MMP-3cd配列に対してPCR反応を行い、N末端Hisタグを挿入した。25 μL の PCR ミックス ( 材料表を参照)、2.5 μL の 10 μM プライマー (補足図 S1)、および 1.25 μL の 100 ng/μL インサート配列を使用します。滅菌水を加え、最終反応容量50 μLにする。
- PCR産物および消化ベクターを1%アガロースゲル上で実行します。ゲル回収キット( 材料表を参照)を使用して、製造元のプロトコルに従ってゲルバンドを精製します。
- 増幅されたPCR産物を、DNAアセンブリミックスを使用してNdeIとBamHIの制限部位の間の消化ベクターにクローンします( 材料表を参照)。オンラインツールを使用して、15 μLの総反応容量に対するインサートおよびカットベクターの必要な容量を決定します。
- 50 μL の高形質転換効率細胞 (材料表を参照) を氷上で解凍し、解凍します。SOC増殖培地(材料表参照)を37°Cに予温し、LB−アンピシリン(LBアンペア)プレート(材料表参照)とする。
- 1~2 μLのpET-3a-Hisx6-プロMMP-3cdアセンブリ反応を50 μLアリコートに加える。氷上で30分間インキュベートする。
- 細胞を42°Cで30秒間インキュベートすることにより熱衝撃を与える。氷上で2分間インキュベートする。
- 950 μLのSOC増殖培地を各形質転換体混合物に加える。250rpmおよび37°Cで1時間振る。
- 形質転換体のプレート100 μLをLB Ampプレート上に、37°Cで一晩インキュベートした。
- 単離された各コロニーを10mLのLBアンペア培地に接種する。250rpmおよび37°Cで一晩振る。
- ミニプレップキットの製造元のプロトコールに従ってプラスミド DNA を抽出します ( 材料表を参照)。T7フォワードプライマーおよびリバースプライマーを用いて構築物の配列を確認する(補足図S1)。
注:pET-3a-Hisx6-pro-MMP-3cdコンストラクトDNAは、-20°Cで保存することができます。 準備ができたら、R2DP細胞への形質転換を進めます。 - 20 μLアリコートのR2DP細胞( 材料表を参照)を氷上で2〜5分間解凍する。SOC増殖培地を室温に予温し、LB Amp CamR プレートを37°Cに予温する( 材料表を参照)。
- 1 μL の 100 ng/μL 配列確認済み pET-3a-Hisx6-pro-MMP-3cd を 50 μL アリコートに加えます。軽くかき混ぜて混合し、チューブを氷に戻します。
- チューブを氷上で5分間インキュベートする。
- 42°Cで正確に30秒間インキュベートすることにより細胞をヒートショックする。振らないでください。
- 細胞を氷の上に2分間置く。
- 形質転換体混合物に80 μLの室温SOC培地を加える。250rpmおよび37°Cで1時間振る。
- 形質転換体をLB Amp CamR プレートにプレートし、37°Cで一晩インキュベートした。
- 成長と誘導
- LB Amp CamR プレートから単離された単一のコロニーの R2DP pET-3a-Hisx6-pro-MMP-3cd 形質転換体を、10 mL の LB Amp CamR 培地に 37 °C で接種します。 一晩(〜16時間)250rpmで振ってください。各培養物からアリコートを保存し、必要に応じて40%(v/v)グリセロール( 材料表を参照)ストックを調製する。
- 一晩培養につき、500mLのLB Amp CamR 培地を含む1Lフラスコに、600nmにおける光学密度(OD600)が0.05〜0.1になるように接種する。
注:これにより、細胞は対数成長に戻るはずです。 - OD600 をいくつかの時点で、通常は 3 ~ 4 時間、0.4 ~ 0.6 時間下がるまで測定します。
- 誘導する前に、培養画分を1.5mLマイクロフュージチューブ( 材料表を参照)にアリコートし、 それを非誘導画分とラベル付けする。ゲル分析のために-80°Cで保存してください。SDS-PAGE ゲルを実行していない場合は、このステップをスキップしてステップ 1.2.5 に進みます。
- 1 Mイソプロピル-ß-D-チオガラクトピラノシド(IPTG)ストックを用いて培養物を終濃度1 mMに誘導する( 材料表を参照のこと)。37°Cのシェーカー内でさらに3〜4時間インキュベートし続ける。
注:式中、リーダーは誘導時の最適なOD600 とIPTG濃度を決定する必要があります。精製後に収率が実質的に低下する場合、精製緩衝液中のイミダゾール濃度は調整を必要とするか、または細胞ペレットをさらに超音波処理する必要があるかもしれない。 - 培養物を遠心分離する前に、培養画分を第2の1.5mLマイクロフュージチューブにアリコートし、それを 誘導画分と標識する。ゲル分析のために-80°Cで保存してください。SDS-PAGE ゲルを実行していない場合は、このステップをスキップしてステップ 1.2.7 に進みます。
- 細胞培養物を250mL円錐形ボトル( 材料表参照)で最高速度および4°Cで10分間遠心分離する。
- 培養物が完全にペレット化されるまで、ステップ1.2.7を繰り返します。
注:一時停止:セルペレットは-80°Cで凍結し、後で解凍してさらに処理することができます。それ以外の場合は、このステップをスキップしてステップ 1.3.1 に進みます。
- 封入体の抽出と可溶化
注:新鮮な10 M尿素を、好ましくは1日前までに、完全に溶解するまで十分に攪拌して準備してください。尿素を加熱またはオートクレーブしないでください;室温で保管してください。- ペレットを(ステップ1.2.8から)溶解バッファーに再懸濁する( 材料表を参照)。ペレット1グラムあたり、3mLの溶解バッファーを加え、ボルテックスまたはピペッティングによって再懸濁する。4°Cで一晩振る。
- 培養物1Lあたり10%(w/v)デオキシコール酸ナトリウム( 材料表参照)を1.25mL加える。室温で150rpmで30分間振る。
- 培養物1Lあたり10 μLのDNase I( 材料表を参照)を加える。室温で150rpmで30分間振る。
- 13,000 × g および4°Cで10分間遠心分離する。
- ゲル分析のために Lysed MMP のほんの一部を確保してください。-80°Cで保管してください。 ゲル分析を実行しない場合は、ステップ 1.3.6 に進みます。
注:遠心分離後、ペレットは糸状でコンパクトに充填されていない可能性があるため、上清を捨てる危険があります。この場合、ステップ 1.3.6 をスキップしてステップ 1.3.7 に進みます。 - 遠心分離したサンプルから上清を捨てる。
注:プロトコルはこの時点で一時停止することができ、細胞ペレットは-80°Cで凍結し、後で解凍することができる。それ以外の場合は、この手順をスキップして手順 1.3.7 に進みます。 - ペレットを封入体バッファー( 材料表を参照)の100mL/L培養液に再懸濁し、上下にピペッティングします。
- 超音波処理中は、過熱を防ぐためにサンプルを氷の上に保管してください。15秒、出力5、および50%パルスの6サイクルのために各サンプルを超音波処理します。サイクル間の冷却のために15秒の休息期間を許可します。
注:必要に応じて、サンプルを50 mL円錐管に移してさらに遠心分離してください( 材料表を参照)。13,000 × g および4°Cで10分間遠心分離する。 - ゲル分析のために 超音波処理MMP のほんの一部を確保します。-80°Cで保管してください。 ゲル分析を実行しない場合は、ステップ 1.3.11 に進みます。
- ペレットを確認してください。文字列の場合は、手順 1.3.8 ~ 1.3.10 を繰り返します。ペレットがコンパクトな場合は、上清を捨ててステップ1.3.12に進みます。
注:封入体バッファーでの超音波処理は、溶解された細胞破片からより多くのタンパク質を回収するために繰り返すことができます。しかし、あまりにも多くの超音波処理は、MMP収率に害を及ぼす剪断を引き起こす可能性があります。プロトコルはこの段階で一時停止することができ、細胞ペレットを-80°Cで凍結し、後で解凍することができる。 - 1 L培養物からの各ペレットを5 mLの可溶化緩衝液( 材料表を参照)にピペッティングによって再懸濁する。タンパク質が可溶化できるように、氷上で少なくとも30分間インキュベートする。
- 可溶化MMPのほんの一部をゲル分析のために取っておきます。-80°Cで保管してください。 ゲル分析を実行しない場合は、ステップ 1.3.14 に進みます。
- 細胞を13,000 × g および4°Cで10分間遠心分離し、上清を捨てない。
- 遠心分離後にペレットが形成/残留する場合は、上清を別の50mL円錐管に注ぎます。ペレットを別の5 mLの可溶化緩衝液(培養物1 Lあたり)に上下にピペッティングして再懸濁する。
- 上清を捨てずに13,000× g および4°Cで10分間遠心分離する。
- 遠心分離後にペレットが少しまたはまったく形成されなくなるか、灰色の沈殿物のみが残るまで、手順1.3.13および1.3.14を繰り返します。上清をプールする。追加の超音波処理のためにペレットを-80°Cで廃棄または保管する。
2. MMPの精製とリフォールディング
- ヒスタグ(HT)アフィニティー精製
- 製造元のプロトコルに従って、重力フロー列(材料表を参照)によく混合されたNi-NTA樹脂(材料表を参照)を記入します。樹脂を沈降させてストレージバッファから分離し、2つの層の間に異なる線が形成されるようにします。
注:空気が樹脂に浸透し、タンパク質の収量を損なうため、樹脂を乾燥させないでください。使用の合間には、セクション 2.2 で説明されている樹脂再生手順を実行します。 - ストレージ・バッファーのドレインを許可します。カラムを 2 つの樹脂ベッド容量の HT 平衡化バッファーで満たします。
- HT平衡化バッファーを排出して廃棄します。カラムが水切りされたら、タンパク質抽出液を13,000 × gで1分間遠心分離し、0.22 μmフィルターを使用してフィルター滅菌します( 材料表を参照)。
- 廃容器をHT Flowthroughとラベルの付いた50 mLの円錐形チューブに交換します。調製したタンパク質抽出物をカラムに加える。
- フロースルーを再適用して、バインドを最大化します。
- フロースルー画分の一部をゲル分析用に確保します。-80°Cで保管してください。 ゲル分析を実行しない場合は、ステップ 2.1.7 に進みます。
- 直ちに15 mLのHT洗浄バッファーで樹脂を洗浄します(材料表を参照)。フロースルーを HT ウォッシュとラベル付けされた 15 mL の円錐形チューブ (材料表を参照) に集めます。
注:280nmにおける吸光度値(A280)を分光光度法によって取得し、分子量および吸光係数(ε)とともに使用してタンパク質濃度を推定した。変性Hisx6-pro-MMP-3cdの場合、分子量は29.86kDa、εは34.38M-1cm-1である。 - HTウォッシュバッファーに対するブランキング、A280を測定して記録します。追加の洗浄画分を使用して、手順2.1.7と2.1.8を繰り返します。A280がベースラインに近づき、不純物が最小限に抑えられたら、ステップ2.1.9に進みます。
- 洗浄画分の一部をゲル分析用に確保します。複数の洗浄画分について繰り返します。フラクションを-80°Cで保存する。 ゲル分析を実行しない場合は、ステップ 2.1.10 に進みます。
- 5 mL の HT 溶出バッファーを加えて、Hisタグ付きタンパク質を直ちに溶出します ( 材料表を参照)。フロースルーを0.5-1 mL画分として HT溶出標識標識したマイクロフュージチューブに集める。
- 溶出画分の一部をゲル分析用に確保します。複数の溶出画分について繰り返します。フラクションを-80°Cで保存する。 ゲル分析を実行しない場合は、ステップ 2.1.12 に進みます。
- A280が>0.3mg/mLの場合は、HT平衡化バッファーで画分を希釈 します(材料表を参照)。
注:溶出画分は、透析中の沈殿を防ぐために、0.3mg/mL以下のA280に希釈する必要があります。プロトコルはここで一時停止することができ、プールされた画分は-80°Cで凍結し、後で解凍することができる。それ以外の場合は、この手順をスキップして、手順 2.2.1 に進みます。
- 製造元のプロトコルに従って、重力フロー列(材料表を参照)によく混合されたNi-NTA樹脂(材料表を参照)を記入します。樹脂を沈降させてストレージバッファから分離し、2つの層の間に異なる線が形成されるようにします。
- 樹脂再生
- 10 個の樹脂ベッド容量の HT 再生バッファー ( 材料表を参照) と 10 個の樹脂ベッド容量の滅菌水で樹脂を洗浄します。
- 樹脂を50%スラリーとして水中の20%(v/v)エタノールに保存する。
3. タンパク質リフォールディング
注:少量の場合は、透析カセットをサンプル損失のリスクを低くして使用できます。透析チューブは、より大きな容量を使用する場合に必要です( 材料表を参照)。
- 透析
注:透析に最適なタンパク質濃度は〜0.3 mg / mLです。透析中に著しい沈殿が発生した場合は、段階的な透析法を使用して各透析間の尿素濃度勾配を下げ、さらに中間ステップを追加します(たとえば、5 M段階をスキップするのではなく、6 Mから5 M、次に5 Mから4 M)。凍結融解サイクルは細胞およびタンパク質の構造を損傷するため、プロトコルの一時停止を最小限に抑えることが不可欠です。- メーカーのプロトコールに従って、 溶出画分 サンプルの量に応じて適切な量の透析チューブを使用してください。
- 溶出したMMP画分を透析チューブに沈め、1Lの透析バッファー1に浸します( 材料表を参照)。チューブとその内容物をマグネチックスターラーで4°Cで8時間以上攪拌する。
- 透析バッファー2の1Lに移す( 材料表参照)。チューブとその内容物をマグネチックスターラーで4°Cで8時間以上攪拌する。
- 1Lの透析バッファー3に移す( 材料表参照)。チューブとその内容物をマグネチックスターラーで4°Cで8時間以上攪拌する。
- サンプルを新しい50mL円錐管に移し、 透析MMPとしてラベル付けします。
- チューブに沈殿物がないか調べます。沈殿物が形成された場合は、試料を13,000 × g および4°Cで1分間遠心分離する。
- 上清を新しい15mL円錐管に移し、 リフォールドMMPとしてラベル付けする。
- ゲル分析のために画分を脇に置いておき、 それをリフォールディングMMPとしてラベル付けする。-80°Cで保管してください。 ゲル分析を実行しない場合は、ステップ 3.1.9 に進みます。
注:収率が低い場合、沈殿物をHT平衡化バッファーに溶解し、セクション3.1のステップを透析チューブで繰り返すことができます。ゲル分析を実行しない場合、またはここでプロトコルを一時停止する必要がある場合は、サンプルを-80°Cで凍結し、後で解凍します。収率が所望の範囲にある場合は、ステップ3.2.1に進みます。
- 再集中
注: リフォールディングおよび変性した Hisx6-pro-MMP-3cd の消衰係数は同じであると予想されます。したがって、A280 の計算は影響を受けません。- サンプルを 0.5 mg/mL まで再濃縮します。400 mL の攪拌セル ( 材料表を参照) を使用して、サンプルを 15 mL に濃縮します。泡立ちを防ぐために、50 mLの再濃縮チューブを使用して、必要に応じてさらに濃縮します。
注:沈殿物が形成された場合は、ペレット化してHT平衡化バッファーに溶解することができます。次に、セクション 3.1 とステップ 3.2.1 を繰り返します。それ以外の場合は、ステップ 3.2.2 に進みます。 - ゲル分析のために画分を脇に置いておき、濃縮 MMPとしてラベル付けします。
注:プロトコルはここで一時停止し、サンプルを-80°Cで凍結し、後で解凍することができます。
- サンプルを 0.5 mg/mL まで再濃縮します。400 mL の攪拌セル ( 材料表を参照) を使用して、サンプルを 15 mL に濃縮します。泡立ちを防ぐために、50 mLの再濃縮チューブを使用して、必要に応じてさらに濃縮します。
4. アクティベーション
- 4-アミノフェニル水銀アセテート(APMA)活性化
注:APMAは非常に有毒です。活性化前に20mM APMAの新鮮な原液を作り、APMAを使用するときは必ずヒュームフードの下で作業してください。APMA廃棄物を容器に廃棄します。- MMP (1 mg/mL) の 1 mL アリコートあたり、50 μL の 20 mM APMA ( 材料表を参照) を加えて、最終 APMA 濃度 1 mM に到達します。37°Cで一晩インキュベートする。
- 沈殿物ができたら、4°Cで10分間最高速度で遠心分離します。 上清を 活性化MMPとラベル付けした1.5mLマイクロフュージチューブに保存する。沈殿物をAPMA廃棄物のマークの付いた容器に廃棄する。
- ゲル分析のために画分を脇に置いておき、それを 活性化MMPとラベル付けする。
注:プロトコルはここで一時停止し、サンプルを-80°Cで凍結し、後で解凍することができます。ゲル分析を実行しない場合は、ステップ 4.2.1 に進みます。活性化後、MMP-3cdの分子量および吸光係数は、それぞれ19.40kDaおよび28.42m-1cm-1である。
- 脱塩
- 製造元のプロトコルに従って、2mLの脱塩カラム( 材料表を参照)で活性化MMP-3cdサンプルからAPMAを除去します。
- ゲル分析のために画分を脇に置いておき、それを 脱塩MMPとラベル付けする。-80°Cで保管してください。 ゲル分析を実行しない場合は、残りのサンプルでセクション 4.3 に進みます。
注:プロトコルはここで一時停止し、サンプルを-80°Cで凍結し、後で解凍することができます。
- SDS-PAGE ゲルの実行
- SDS-PAGEゲル上のすべてのタンパク質画分を実行します:非誘導画分、誘導画分、溶解MMP、超音波処理MMP、可溶化MMP、フロースルー画分、洗浄画分、溶出画分、リフォールディングMMP、濃縮MMP、活性化MMP、および脱塩MMP。
- MMP-3の長期保存
- 脱塩したMMP-3cdサンプルに0.05%(v/v)ノニオン界面活性剤( 材料表参照)を加え、-80°Cで保存する。
結果
SDS-PAGE上でサンプルを実行する場合、タンパク質は不溶性封入体の形で発現されるため、溶解および超音波処理された画分は、タンパク質がまだ尿素に再可溶化されていないため、Hisx6-pro-MMP-3cd抽出物をほとんどまたはまったく含まないはずです。 図3 は、BL21(DE3)細胞およびR2DP細胞からのHisx6-pro-MMP-3cdのHis-tag精製溶出画分を比較したものである。溶出画分は、透析前にBL...
ディスカッション
可溶性、ヒト、組換えMMPの大規模生産は依然として困難な課題である。哺乳類細胞は高いコストと長い待ち時間で機能的なMMPを発現することができますが、大腸菌は精製とリフォールディングが必要な大量のMMP封入体を急速に産生します11,16。R2DP細胞はMMP封入体の収量を大幅に増加させ、より費用対効果が高く生産的なMMPリフォールディン?...
開示事項
著者らは、競合する金銭的利益はないと宣言している。
謝辞
著者らは、フロリダ州ジャクソンビルのメイヨークリニックのEvette Radisky博士とAlexandra Hockla博士が、Hisx6pro-MMP-3cd遺伝子をクローニングするためのテンプレートとしてpET-3a-pro-MMP-3cdプラスミドを提供したこと、および彼らのコメントを、DNAシーケンシングのためにネバダ大学リノ校のネバダゲノミクスセンターのPaul Hartley博士とともに認めたい。著者らはまた、タンパク質発現の一部を支援してくれたCassandra Hergenrader氏にも感謝したい。M.R.-S.NIH-P20 GM103650-COBRE Integrative Neuroscience GrantとUNR R&D mICRO SEED Grant Awardに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| Nonionic surfactant | Thermo Fisher Scientific | PI28316 | Storage detergent for preventing MMP aggregation. Minimizes interactions between hydrophobic residues on the MMP surface and water molecules, without disrupting catalytic activity. |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
参考文献
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved