A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תכנון והזרקת מיקרו של אוליגונוקלאוטידים ו-mRNA של מורפולינו אנטיסנס לעוברי דג זברה כדי להבהיר תפקוד גנים ספציפיים בהתפתחות הלב
In This Article
Summary
הפרוטוקול הנוכחי מתאר תכנון, הכנה והזרקה של מורפולינו חוסם תרגום כנגד גן לבבי מייצג; נגזרות לב ופסגה עצבית באו לידי ביטוי2 (יד 2) בחלמון של עוברי דג זברה שהופרו לאחרונה כדי להפיל את תפקוד הגנים. הוא גם מראה הצלה חולפת של "מורפנטים" אלה על ידי הזרקה משותפת של mRNA המקודד תוצר גן זה.
Abstract
מערכת הנוקדאון המבוססת על מורפולינו אוליגומר שימשה לזיהוי התפקוד של תוצרי גנים שונים באמצעות אובדן או ביטוי מופחת. למורפולינים (MOs) יש יתרון ביציבות ביולוגית על פני אוליגוס DNA מכיוון שהם אינם רגישים לפירוק אנזימטי. ליעילות מיטבית, MOs מוזרקים לעוברים בשלב 1-4 תאים. היעילות הזמנית של נוקדאון משתנה, אך מאמינים כי MOs מאבדים את השפעותיהם עקב דילול בסופו של דבר. יש לשלוט מקרוב על דילול מורפולינו וכמות ההזרקה כדי למזער את התרחשותן של השפעות מחוץ למטרה תוך שמירה על יעילות על המטרה. יש לבצע כלים משלימים נוספים, כגון CRISPR/Cas9 כנגד גן המטרה המעניין כדי ליצור קווים מוטנטיים ולאשר את הפנוטיפ המורפנט עם קווים אלה. מאמר זה ידגים כיצד לתכנן, להכין ולהזריק מיקרו-הזרקה של מורפולינו חוסם תרגום כנגד יד2 לחלמון של עוברי דג זברה בשלב 1-4 תאים כדי להפיל את תפקוד היד 2 ולהציל את ה"מורפנטים" הללו על ידי הזרקה משותפת של mRNA המקודד את ה-cDNA המתאים. לאחר מכן, היעילות של הזרקות המיקרו של מורפולינו מוערכת על ידי אימות תחילה של נוכחות מורפולינו בחלמון (בהזרקה משותפת עם פנול אדום) ולאחר מכן על ידי ניתוח פנוטיפי. יתר על כן, יידון ניתוח תפקודי לב לבדיקת יעילות נוקדאון. לבסוף, תוסבר הערכת ההשפעה של חסימה הנגרמת על ידי מורפולינו של תרגום גנים באמצעות כתמים מערביים.
Introduction
השימוש בדג הזברה כמודל לחקר התפתחות ומחלות לב וכלי דם מציע מגוון יתרונות, כולל שימור גבוה של תפקוד הגנים, שקיפות אופטית, התפתחות קרדיווסקולרית מהירה ועלות זולה יותר בהשוואה למודלים מסורתיים in vivo 1. מורפולינו אוליגונוקלאוטידים (MOs) הם הכלים הנפוצים ביותר להפלת גנים אנטי-סנס עבור מודל דג הזברה. MOs משמשים לעתים קרובות לקביעת פנוטיפ או לחקירת תפקוד הגנים. ד"ר ג'יימס סאמרטון פיתח בתחילה את מערכת אספקת המורפולינו לעיכוב in vivo של תרגום mRNA כניסיון לפתח טיפולים לפגמים התפתחותיים אנושיים 2,3. MOs שימשו לאורגניזמים מודלים in vitro ו-in vivo כדי להפיל גנים ולחקור את ההשלכות של הפלה זו על הפנוטיפ. זה נעשה על ידי התבוננות בשינויים בהתפתחות של איברים ספציפיים, למשל, הלב. הפלת גנים ספציפיים ללב בעוברי דג זברה WT הובילה לכשל בפעימות לב תקינות, מה שמעיד על התפקוד החיוני של גנים אלה להתפתחות הלב 4,5. פנוטיפים אלה ניצלו על ידי הזרקה משותפת של mRNAs עבור הגנים הספציפיים. מחקר שכלל טרופונין לב T (Tnnt2) הראה כי ביטוי של mRNA tnnt2 באורך מלא יכול להציל פנוטיפים סרקומרי הנגרמים על ידי מורפולינו נוקדאון6. מחקר אחר גילה כי ניתן לשחזר את שלמותם של רצועות A ודיסקי Z על ידי ביטוי יתר של ה-mRNA הרגולטורי של שרשרת השרשרת הקלה של מיוזין (cmlc2) במורפנטים cmcl2 7.
MOs משמשים בדרך כלל כדי להפיל ביטוי גנים על ידי התמקדות בשחבור קדם-mRNA או על ידי חסימת תרגום. MOs חוסמי חיבור נקשרים ומעכבים קדם-mRNA על ידי עיכוב החיבור. חסימה תרגומית מתרחשת כאשר ה-MO נקשר לאזור ה-5' הלא מתורגם של mRNA משלים כדי לעכב את מכלול הריבוזום. MOs הם השיטה הספציפית לגנים הנפוצה ביותר להפיל ביטוי גנים עבור מודלים in vivo ; הם גם חומרי חסימת ה-mRNA היעילים ביותר המשמשים בתרביות תאים. המורפולינו עצמו מורכב בדרך כלל משרשרת קצרה (בסביבות 25) של בסיסי תת-יחידות מורפולינו. כל תת-יחידת MO כוללת בסיס חומצת גרעין, טבעת מורפולין וזרחן לא יוני. מנגנוני הפעולה השונים של שני סוגי ה-MOs מחייבים בדיקות שונות כדי לאמת את יעילות הנוקדאון. עבור MOs חוסמי תרגום, ניתוח כתמים מערביים הוא מבחן היעילות האמין ביותר, מכיוון שאין לייצר את החלבון המעניין עקב חסימה של אתר התחלת התרגום ATG. MOs אינם פוגעים ישירות ב-mRNA המטרה שלהם; במקום זאת, הם נקשרים לאזורים ספציפיים ומעכבים את הביטוי עד שהם מתפרקים באופן טבעי. עם זאת, ה-MOs חוסמי החיבור משנים את ה-pre-mRNA על ידי גרימת שינוי אחוי, אותו ניתן לאמוד על ידי תגובת שרשרת פולימראז הפוכה (RT-PCR) ואלקטרופורזה של ג'ל.
שלושה חלקים מכריעים בתהליך סינון ה-MOs חייבים להיות סטנדרטיים: (i) יש לכוון את עקומת מינון ה-MO לזיהוי פנוטיפי. עקומת המינון מראה גם את המינון הקטלני 50 (LD50: המינון שבו 50% מהעוברים המוזרקים מתים) עבור כל MO שנבדק כדי לשפר את היכולת לייעל 'אות' פנוטיפי לעומת 'רעש' מחוץ למטרה3. (ii) המינוח הפנוטיפי שהותאם צריך להיות מתועד היטב; תיאור פנוטיפי מדויק וקל להבנה הוא קריטי כדי לספק הסברים נרחבים המבוססים על הספרות הקיימת וניסיון החוקרים כדי להקל על שיתוף מידע בין אלה שלא בדקו ישירות את העוברים. (iii) שפה מוגדרת היטב מקלה על איסוף נתונים באופן מרכזי ממסד הנתונים של מורפולינו8.
במחקרי נוקדאון MO עבור גנים לבביים, יש לנטר את פעילות הלב של בעלי חיים ואת דינמיקת זרימת הדם על מנת לקבוע את ההשפעה של ניסויי נוקדאון MO על תפקוד מערכת הלב וכלי הדם. ניתוחים כאלה דורשים הדמיה בזמן אמת של מערכת הלב וכלי הדם ברזולוציה גבוהה. עור דג הזברה שקוף בשבוע הראשון להתפתחות, ומאפשר הדמיה של הלב וזרימת הדם באמצעות מיקרוסקופיה. להערכת תפקוד הלב, הפרמטרים הפיזיולוגיים המחושבים ביותר הם קצב הלב ותפוקת הלב, כמו גם קיצור חלקי, שינוי שטח חלקי ושבר פליטה. ניתן למדוד את מהירויות זרימת הדם על ידי מעקב אחר RBCs נעים, ומדידות אלו משמשות לקביעת רמות מתח גזירה, גורם מכניוביולוגי מכריע על תאי אנדותל. הערכה כזו דורשת הקלטת סרטי זמן-lapse ללב פועם ודם זורם באמצעות מיקרוסקופ הפוך או סטריאומיקרוסקופ המצויד במצלמה מהירה.
מאמר זה מראה כיצד לתכנן, להכין ולהזריק מיקרו מורפולינו חוסם תרגום כנגד גן מעניין לחלמון של עוברי דג זברה שזה עתה הופרו כדי להפיל את תפקוד הגנים. הוא גם יראה הצלת "מורפנטים" אלה על ידי הזרקה משותפת של mRNA המקודד גן זה. לאחר מכן ננתח את היעילות של מיקרו-הזרקות מורפולינו באמצעות אפיונים פנוטיפיים כמו גם ניתוחים מבניים ותפקודיים לבביים. גישה זו תודגם על גן לבבי שנחקר בהרחבה, hand2.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הניסויים בוצעו בהתאם לסטנדרטים המקובלים של טיפול הומני בבעלי חיים תחת רגולציה של IACUC ב-QU; בעלי חיים הוחזקו במתקן דג הזברה תחת המרכז למחקר ביו-רפואי של אוניברסיטת קטאר (QU-BRC). כל החיות ששימשו במחקרים ניסיוניים אלה היו מתחת ל-3 ימים לאחר ההפריה (dpf).
הערה: עבור כל קבוצת ניסוי, רצוי להשתמש לפחות ב-30 עוברים לצורך קפדנות סטטיסטית. קבוצות הניסוי הן כדלקמן:
קבוצת ביקורת: קבוצה זו כוללת עוברים שגודלו במי ביצים ללא זריקות. התוצאות כאן יהוו את תוכנית הבסיס של הבקרה.
קבוצת ביקורת שלילית: קבוצה זו כוללת עוברים שגודלו במי ביצים שהוזרקו עם MOs מקושקשים.
קבוצה מוזרקת: קבוצה זו כוללת עוברים שהוזרקו עם hand2 MO בלבד ו-hand2 MO עם mRNA hand2 כדי להציל את הפנוטיפ. התוצאות כאן יאשרו כי פנוטיפים שנצפו הופיעו עקב הזרקת MOs. השוואה בין קבוצות הניסוי תאפשר להעריך במדויק את ההשפעה של עיכוב והצלה של יד2 על תפקוד הלב.
1. עיצובי מורפולינו לעבודת יד2.
הערה: ניתן להתאים רצפי MO מהספרות 9,10,11. לחלופין, ניתן לעצב אוליגואים אלה באופן מקוון על ידי Gene-tools. Gene-tools מציעים שירות עיצוב מקוון חינמי ומהיר, שניתן לגשת אליו דרך האתר שלהם12. ניתן לעצב MO מותאם אישית בקלות על ידי מתן מידע על הגנים המעניינים, כגון מידע על רצף או מספרי גישה. השלבים הספציפיים הבאים מסכמים כיצד לעצב MOs כנגד יד2 בדג הזברה:
- ראשית, חפש פרטים על הגן המעניין ממסד הנתונים של NCBI. עבור יד2, בדג זברה13.
- קבל מזהה תמלול mRNA של GenBank מ-NCBI14.
- השג את רצף ה-mRNA מ-NCBI15.
הערה: אוליגונוקלאוטידים אנטי-סנס שעברו שינוי במורפולינו (MO) עבור הגן hand2 של דג הזברה זמינים ופורסמו בעבר. יד2 רצף MO 9,10,11: 5'-CCTCCAACTAACTCATGGCGACAG-3', רצפי MO ששימשו במחקר מפורטים בטבלת החומרים. - קבל בקרה שלילית מ-MO לא תואם או מקושקש (רצפים דומים עם שינויים אקראיים בזוגות בסיסים) מכלי גן16 להזרקה. זה יעזור להעיד על הספציפיות של הפנוטיפ (ים) שנצפה בזריקות MO ספציפיות ולמזער את הסיכון שההשפעות הנצפות הן מחפץ של הליך ההזרקה.
2. הכנת הזרקת מורפולינו
- הכנת מלאי
- להמיס מלאי MO עם ddH2O; דיאתיל פירוקרבונט (DEPC) יכול לפגוע ב-MOs ולהיות רעיל לעוברים. לפיכך, השתמש ב-DDH2O ללא DEPC. עם ההזמנה, MOs מועברים בבקבוקון בריכוז של 300 ננומטר.
הערה: בעוד ש-Gene Tools ממליצים על תמיסות מלאי של 1 מילימטר (~8 ננוגרם/ננוטר), זה יכול להיות נמוך מדי, במיוחד אם המורפולינו דורש מינון גבוה או מעורבב עם MOs אחרים. לכן, הוא אידיאלי לייצור ריכוזים שונים של תמיסות מלאי MO (2 או 3 מ"מ). - הכן תמיסת עבודה של 0.2 מ"מ על ידי דילול משנה של תמיסת העבודה (כלומר, למלאי של 2 מ"מ, דילול של 1:10). הכן 10 מיקרוליטר של תמיסת עבודה על ידי הוספת התמיסה של Danieaux (7 μL), מורפולינו מלאי (1 μL) ושל פנול אדום (2 μL ממלאי 10x). אדום פנול מעניק לתמיסה צבע אדום כהה כדי לעזור לעקוב אחר החומר המוזרק בעובר.
- שמור MOs בטמפרטורת החדר (RT) במיכלים אטומים כדי למנוע אידוי. אל תשאיר MOs על קרח על הספסל, מכיוון שהתמיסה עלולה לזרז. הטיפול ב-RT הוא המתאים ביותר.
הערה: Gene Tools ממליצה על אחת משתי שיטות אחסון עבור MOs: ניתן לשמור את תמיסת העבודה בטמפרטורה של -20 מעלות צלזיוס (למשך חודשים רבים עד שנים) או RT בצינור אטום לאחסון לטווח ארוך. אם נשמר בטמפרטורה של -20 מעלות צלזיוס, מחממים את תמיסת האוליגונוקלאוטיד ב-65 מעלות צלזיוס למשך 10 דקות ומערבולת כדי להמיס לחלוטין את המורפולינו לפני השימוש (אין צורך לחמם אותו אם נשמר ב-RT).
- להמיס מלאי MO עם ddH2O; דיאתיל פירוקרבונט (DEPC) יכול לפגוע ב-MOs ולהיות רעיל לעוברים. לפיכך, השתמש ב-DDH2O ללא DEPC. עם ההזמנה, MOs מועברים בבקבוקון בריכוז של 300 ננומטר.
- שעתוק חוץ גופי של mRNA
הערה: השעתוק במבחנה שימש ליצירת mRNA של Hand2 מפלסמיד HAND2 (NM_021973) שיבוט ORF מתויג אנושי להזרקה מיקרו לעוברי דג הזברה להצלת הפנוטיפ עקב הפלת יד דג הזברה2 באמצעות מורפולינו, פרטי הפלסמיד ששימשו במחקר מפורטים בטבלת החומרים.- ליניאריזציה של ה-DNA של הפלסמיד על ידי אנזים הגבלה מתאים וטיהור באמצעות ערכת טיהור DNA (טבלת חומרים). השתמש ב-DNA הליניארי המטוהר כתבנית לשעתוק במבחנה כדי ליצור mRNA להזרקה לפי הוראות היצרן (טבלת חומרים).
- לבסוף, הזרקו 250 pg של mRNA אנושי עבור הגן המעניין לבצע את הצלת הפנוטיפ כדי לבדוק אם היעדר פנוטיפ אכן נובע מאובדן הגן של דג הזברה על ידי MO.
- מתכונן להזרקה
- משוך מחט באמצעות חולץ מיקרו-פיפטה (טבלת חומרים), בצע את השלבים 2.3.2-2.3.6.
- השתמש בצינורות נימיים בגודל 1 מ"מ עם חוטים וחולץ מיקרופיפטה. הפעל את המכונה ופתח את המכסה
- סובב את כפתור בחירת המצב למחמם NO.2 . בעזרת תנור מס' 2 , כוונן את הכפתור כדי להביא את החום ל-68 מעלות צלזיוס
- סובב את כפתור בחירת המצב בחזרה למצב שלב 1 . השתמש בארבע משקולות (2 סוגים קלים / 2 סוגים כבדים)
- הנח את הנימים על המחזיק וסגור את המכסה. לחץ על כפתור התחל כדי לקבל את המחט הנמשכת.
הערה: זה ייצור מחטים נימיות עם התחדדות ארוכה - חותכים את קצה המחטים לזמן קצר בעזרת מלקחיים. חדדו את קצה המחט הנמשכת לחדירה קלה לעוברי דג הזברה באמצעות שפוע נימי למשך כ-30 שניות, וכתוצאה מכך טיפים בקוטר של כ-15-25 מיקרומטר.
- כייל את המחט כדי להעריך את כמות ההזרקה לפי שלבים 2.3.8-2.3.13.
- ערבבו בקצרה את תמיסת ה-mRNA/מורפולינו לפני העמסתה לתוך המחט כדי להמיס את החלקיקים שעלולים לסתום את המחט במלואה.
- הוסף ~3-4 מיקרוליטר של תמיסת MO לחלק האחורי של מחט ההזרקה באמצעות קצה פיפט עם קצה מיקרון. מחטי ההזרקה מצוידות בתעלה קטנה כדי להקל על מילוי חוזר של נימים.
- ודא שאין בועות במחט ההזרקה. התקן את המחט למיקרו-מזרק.
- בדוק שקצה המחט אינו סתום וכי תמיסת MO יכולה לזרום החוצה מהמחט על ידי לחיצה על דוושת ההזרקה.
- כייל את נפח ההזרקה על ידי מדידת גודל הטיפה. שים את קצה המחט בשמן מינרלי על שקופית מיקרומטר. לחץ על דוושת ההזרקה והתאם את לחץ ההזרקה (Eject) (psi) ו/או זמן ההזרקה (ms) עד שקוטר הטיפה הנפלטת הוא 0.1 מ"מ, המתאים ל-0.5 nL.
- ודא שנפח ההזרקה הוא בסביבות 0.5-1 nL. כוונן את עוצמת הקול על ידי שינוי לחץ ההזרקה (פליטה) (psi) או הזמן (ms).
- עבור פרוטוקול הגדרת מזרק פיקוליטר, בצע את השלבים 2.3.15-2.3.16
- השתמש במזרק פיקוליטר להזרקות דג זברה. הפעל את משאבת ההזנה של המזרק.
- הכן את המזרק בהתאם לדרישות המוצגות להלן:
- איזון P: ודא שאיזון ה-P הוא סביב 0. ודא שהוא מעט שלילי כדי למנוע זרימת חלמון בחזרה לתוך המחט, לדלל את תמיסת ה-MO במחט. לעומת זאת, אם הלחץ האחורי גבוה מדי, ה-MO יזרום כל הזמן החוצה מהמחט גם ללא הפעלת לחץ על הדוושה, וכתוצאה מכך שונות וחוסר עקביות במינון המוזרק ובפנוטיפים הנצפים.
- הזרקת P: 20-25 psi הוא אידיאלי; שנה זאת כדי להתאים את נפח ההזרקה. זה יכול לנוע בין 10-30 psi אבל התחל עם ~20 psi כדי לבדוק אם הוא מספק את הנפח הרצוי.
- זמן הזרקה: הקפד להפחית את זמן ההזרקה ל-300 אלפיות השנייה. לפני התאמת נפח ההזרקה, בצע התאמות לזמן ההזרקה.
- להזרקת מורפולינו, בצע את השלבים 2.3.18-2.3.19.
- הכן את תא ההזרקה באופן הבא: הכינו 2% אגרוז מ -0.6 גרם אגרוז ו -30 מ"ל מדיום E3. יוצקים את האגרוז לצלחת פטרי ומניחים תבנית הזרקה על האגרוז באמצעות תבנית הזרקה TU-1. ברגע שהתקררו במקפיא, ייווצרו תלמים למיקום וייצוב של עוברים (איור 1A).
הערה: מתכון תמיסת המלאי 60x E3M מורכב מ-5.0 מ"מ NaCl, 0.17 מ"מ KCl, 0.16 מ"מ MgSO4·7H2O, 0.4 מ"מ CaCl2·2H2O ב-1 ליטר ddH2O עם pH סופי של 7.6. - העבירו את העוברים שנאספו לתלמים באמצעות פיפטת העברה, הסירו את כל תווך ה-E3 העודף סביב העוברים כדי למנוע ציפה של עוברים (איור 1B).
3. הזרקת תמיסת MO ו-mRNA לחלמון
- הכניסו את המחט דרך הכוריון, הזריקו ליד גבול התא/חלמון לצד העובר ולחצו על דוושת ההזרקה (איור 1C).
הערה: תמיסת MO/פנול אדום המוזרקת לא תתפזר מיד בתוך החלמון. כתם אדום ייצפה בחלמון שמתפזר בהדרגה. החומר המוזרק לא יעלה על 10% מגודל העובר. ניתן להזריק מיקרו-MOs לחלמון של ביצי דג זברה שזה עתה הוטלו עד לשלב 8 התאים מכיוון שניתן לקלוט את ה-MOs בקלות בזרם הציטופלזמי של שק החלמון על ידי התאים המתפתחים17,18. בהזרקות mRNA פלסמיד או מכוסה, יש לבצע את ההזרקה לתוך בלסטומר יחיד של עובר בשלב תא אחד. - מעבירים את העוברים לצלחת פטרי עם מדיום E3 ודוגרים אותם בטמפרטורה של 28 מעלות צלזיוס עד 3 dpf, עם חידוש יומי של מדיום E3. בשלב זה, בצע את ההערכה הפנוטיפית באמצעות מיקרוסקופ.
הערה: יש לדלל בזהירות תמיסות MO עבור כל חקירה כדי לקבוע את הריכוז הנמוך ביותר הדרוש כדי לגרום לפנוטיפ ספציפי. יש לקבוע גם קטלניות עוברית עבור כל MOs. בריכוזים גבוהים יותר (מעל 4-10 ננוגרם, תלוי ב-MO), MOs נוטים לעורר השפעות לא ספציפיות, כגון מוות מוחי או מוות כללי של תאים. - הזרקה משותפת של MO עם 250 pg של mRNA של יד אנושית2 באותו אופן כדי לאשר את הצלת הפנוטיפ המושרה על ידי אובדן הגן של יד דג הזברה2 על ידי MO.
4. כתם מערבי כדי לאמת את הצלחת הפלת מורפולינו
- אסוף את העוברים בנקודות זמן ספציפיות (48 hpf, 72 hpf) ודכוריונאט במידת הצורך באמצעות האנזים Pronase.
- חלמון העוברים כדי להסיר ויטלוגנין באמצעות מתודולוגיה ידועה בעבר19.
הערה: ויטלוגנין הוא פוספוליפו-גליקופרוטאין המשמש כמקור לחומרים מזינים לעובר הגדל. אלקטרופורזה של ג'ל דו-ממדי ברזולוציה גבוהה וכתמים מערביים משופרים מאוד מתאפשרים על ידי הסרת החלמון של העוברים והסרת ויטלוגנין. - בצע כתמים מערביים כמתואר קודם20.
5. הערכת מבנה ותפקוד הלב:
- הדמיה חיה של דג הזברה: הדמיית החדר
הערה: ניתן לחשב מספר פרמטרים של תפקוד לב/המודינמיקה על ידי הדמיית הלב הפועם של עובר דג הזברה21,22. פרמטרים אלה כוללים תפוקת לב (CO), מקטע פליטה (EF), נפח שבץ (SV), קיצור חלקי (FS) ושינוי שטח חלקי (FAC) (אנא עיין במאמרים קודמים הכוללים פרוטוקולים מפורטים להערכת תפקוד לב עבור עוברי דג זברה22,23). השלבים הבאים מסבירים בקצרה כיצד לחשב את הפרמטרים הללו עבור עוברי דג הזברה ב-~3 dpf, שלב שבו העור של אורגניזמים אלה שקוף, מה שמאפשר הדמיה במיקרוסקופיה של שדה בהיר.- שים טיפה של 3% תמיסת מתיל צלולוז (RT) בשקופית ההדמיה של הבאר הקעורה.
- מקם את עובר דג הזברה בבאר באמצעות טפטפת פלסטיק מתאימה (איור 2A, B)
הערה: מילוי יתר של הבאר עלול לגרום לעקירת דגים מהבאר. - מערבבים בעדינות את טיפת המתיל צלולוז 3% עם מדיום E3 כדי לייצב את העובר שבקע.
הערה: להכנת תמיסת מתיל צלולוז 3%, ממיסים 3 גרם אבקת מתיל צלולוז ב-100 מ"ל PBS, או אמצעי הרכבה אחר, בבקבוק. מניחים מגנט ערבוב בבקבוק התערובת ומניחים את הבקבוק על צלחת ערבוב מגנטית. הגדר את המהירות ל"נמוכה "ושמור אותה על 4 מעלות צלזיוס למשך ~ יום אחד כדי להמיס את כל הגושים. לאחר שהמתילצלולוז מומס לחלוטין, יש לחלק לצינורות קטנים ולאחסן בטמפרטורה של -20 מעלות צלזיוס. - מקמו את הדג משמאלו, כשהצד הימני שלו פונה כלפי מעלה והנקודה הקדמית שמאלה כדי לאפשר הדמיה חד משמעית של החדר (איור 2C).
- תחת המיקרוסקופ, התקרב ללב העובר בהגדלה של פי 100 והתחל להקליט למשך ~5 שניות. ודא שגבולות החדר נמצאים בתוך חלון ההדמיה (איור 2D).
- הקליטו סרטוני דולג זמן באמצעות מצלמה מהירה וסטריאומיקרוסקופ במהירות של כ-100 פריימים לשנייה (fps) של העובר כולו (איור 2C), חדר פועם (איור 2D) ותאי דם אדומים נעים (RBC) בכלי דם ראשיים, כמו למשל אבי העורקים הגבי או הווריד הקרדינלי האחורי (איור 2E), לניתוח תפקודי לב.
- שמור את הסרט בתבנית סרט AVI או בתבנית רצפי תמונות TIFF (או JPEG).
- חישוב הדופק
- חשב את הזמן הדרוש להקלטת שתי פריימים רצופים. עבור 100 פריימים לשנייה מרווח הזמן שווה ל-0.01 שניות.
- בחר נקודה ידועה מכל מחזור לב מתועד (כלומר, סוף דיאסטולה או סוף סיסטולה). חשב את מספר המסגרות הדרושות כדי לחזור על המחזור.
- הכפל את מרווח הזמן משלב 5.2.1 במספר הפריימים משלב 5.2.2. התוצאה היא משך הזמן (בשניות) לפעימת לב אחת.
- כדי לחשב פעימות לדקה, חלקו 60 במספר שהתקבל בשלב הקודם. עבור עוברים רגילים של 3 dpf, זה צריך להיות בסביבות 150 פעימות לדקה (2.5 הרץ).
הערה: יישומי תוכנה רבים יכולים לחשב דופק באופן אוטומטי מהקלטות לב פועמות, כגון ViewPoint24 ו-DanioVision25. - נתח את מבנה הלב באמצעות סרט הקלטת זמן-lapse בכ-100 פריימים לשנייה כדי לבדוק את כל הלב כדי לזהות נוכחות של בצקת לב או כל פגם מבני אחר.
הערה: איור 3A מראה לב עובר תקין של 3 dpf, ואיור 3B מראה לב של 3 dpf עם בצקת לב ופגם בלולאת לב (חדר מוארך).
- חשב את שינוי השטח השברי (FAC):
הערה: שינוי שטח חלקי (FAC) הוא פרמטר המשמש להשוואת אזורי קצה דיאסטולה וקצה סיסטולה כדי להעריך את התכווצות החדר.- השתמש בסרטון הקלטה של קיטועי זמן במהירות של כ-100 פריימים לשנייה כדי לקבוע פריימים המייצגים מחזור לב אחד. חלץ את המסגרות המציגות את סוף הדיאסטולה הסופית והדיאסטולה הקצה.
- חשב גם את שטח הדיאסטולה הסופית (EDA) וגם את שטח הקצה של הסיסטולה (ESA) באמצעות ImageJ או תוכנת ניתוח תמונה דומה.
- השתמש בנוסחה הבאה כדי לחשב את FAC 22,26,27:
FAC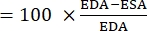
- חשב את הקיצור השברי (FS):
הערה: קיצור חלקי (FS) הוא פרמטר נוסף המשמש להערכת התכווצות החדר; כדי לקבוע FS, יש למדוד את הקוטר הקצה הדיאסטולי והקצה הסיסטולי של החדרים21.- חזור על שלב 5.3.1
- השתמש ב-ImageJ או בכל תוכנית ניתוח תמונה מקבילה אחרת כדי למדוד את קוטר דפנות החדריםבנקודות הקצהשל הדיאסטולה D d ונקודות הקצה של הסיסטולה D. ברוב המקרים, קוטר ציר קצר משמש לקביעת חלקות השבר (FS) (איור 4).
- השתמש בנוסחה הבאה כדי לחשב FS22,27:
FS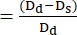
- חישוב עוצמת המשיכה (SV):
הערה: עבור כל פעימת לב, ה-SV הוא כמות הדם הנשאבת מהחדר, אשר מחושבת בקלות מנפחי הדיאסטולה הסופית והסיסטולה הסופית של החדרים28.- חזור על שלבים 5.3.1 ו- 5.3.2
- מדוד את קוטר הדיאסטולה הסופית (DL) וקצה הסיסטולה (DS) כפי שמוצג באיור 4.
הערה: בהנחה שלחדרים של לבבות דג הזברה יש צורה של כדור פרולט21,22, נפח החדר מחושב באמצעות הנוסחה הבאה.
נפח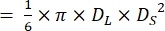
ניתן לחשב SV לפי הנוסחההבאה 27. טווח ה-SV הנורמלי הוא 0.15-0.3 nL עבור 2-6 עוברים dpf29. כאן, EDV הוא נפח סוף דיאסטולה, ו-ESV הוא נפח סוף סיסטולה.
SV = (EDV - ESV)
- חשב את שבר הפליטה (EF):
הערה: EF מוגדר כחלק הדם הנפלט מהחדר עם כל פעימת לב28.- מהנוסחאות לעיל, חלץ EDV ו-ESV לדגים.
- חשב את EF באופן הבא22,27:
EF (%)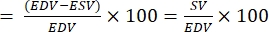
- חשב את תפוקת הלב (CO):
הערה: CO הוא נפח הדם שנשאב על ידי הלב28. ל-CO יש ערך של 10-55 nL/min עבור 2-6 עוברים dpf29.- חשב SV ו-HR כפי שהוזכר בסעיפי המשנה הקודמים 5.5 ו-5.2.
- השתמש בנוסחה הבאה כדי לחשב CO22,27:
CO (nL/min) = SV (nL/פעימה) x HR (פעימות/דקה).
- מדוד את מהירויות ה-RBC:
הערה: קביעת מהירות התאים חיונית להערכת קצב הזרימה, קוטר כלי הדם וחישוב מתח הגזירה המופעל על תאי האנדותל של כלי הדם (כלומר, מתח גזירה, לעומת זאת, הוא כוח החיכוך המופעל על תאי האנדותל על ידי הזזת דם). עבור עוברים של 2-5 dpf, המהירות הממוצעת של תאי הדם האדומים (RBC) היא כ-300-750 מיקרומטר לשנייה29. כדי למדוד את מהירויות ה-RBC:- מתחת למיקרוסקופ, התקרב לזנב החיה בהגדלה של פי 100. תנועת תאי הדם האדומים צריכה להיות גלויה בהגדלה הזו (איור 5A, B).
- התחל להקליט במשך כ-8 שניות. ודא שאבי העורקים הגבי (DA) והווריד הקרדינלי האחורי (PCV), שני העורקים הציריים החשובים ביותר, נמצאים במהירות של 100-120 פריימים לשנייה בתוך חלון ההדמיה. עקוב אחר תאים בודדים ממסגרות עוקבות (איור 5A, B).
- חלץ מספר מסגרות באמצעות ImageJ או תוכנת ניתוח תמונות דומה אחרת.
- חשב את ההבדל במרחק ש-RBC בודד נע (Δx).
- קבע את הפרש הזמן בין המסגרות העוקבות (Δt).
- השתמש בנוסחה הבאה עבור מהירות RBC 22,27:
מהירות RBC (מיקרומטר/שנייה)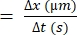
הערה: ניתן לחלץ מהירות מקסימלית וממוצעת מחזרה על מסגרות עוקבות עבור תאים בודדים21. מהירות RBCs מייצגת גם את מהירות זרימת הדם. לחלופין, ניתן להשתמש במגוון יישומי תוכנה זמינים מסחרית כדי למדוד את מהירות ה-RBC באופן אוטומטי. ל-ViewPoint24, כמו גם ל-DanioVision25, יש יישומים כאלה (איור 5C). יתר על כן, ישנם מעט תוספים זמינים עם ImageJ, כגון TrackMate30 ו-MTrackJ31, התואמים לסרטים שהוקלטו מעל 100 פריימים לשנייה.
- חישוב מתח גזירה ממהירויות תאים שנמדדו
מהירויות RBC שנמדדו בכלי הדם מייצגות גם את מהירויות זרימת הדם (איור 5C). ממדידות אלה, חשב את מתח הגזירה τ בכלי מעניין באופן הבא עם הנחת זרימת Poiseuille22,27:
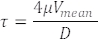
כאשר V היא מהירות הדם הממוצעת (מיקרומטר לשנייה), μ היא צמיגות הדם (דינים/סמ"ק2), ו-D הוא קוטר כלי הדם (מיקרומטר). עבור עוברים של 3 dpf, מתח גזירה ב-DA 22,26,27 הוא כ-4 דינים/ס"מ 2.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הגרף באיור 6 ממחיש את האחוז הממוצע של עוברים ששרדו ב-24, 48 ו-72 hpf הן עבור MO ספציפי ל-HAND2 והן עבור עוברים מקושקשים שהוזרקו ב-MO. העוברים שהוזרקו ב-MO של 1 מ"מ (8 ננוגרם/מיקרוליטר) ו-0.8 מ"מ (6.4 ננוגרם/מיקרוליטר) הראו ירידה משמעותית באחוז ההישרדות בהשוואה לעוברים מקושקש?...
Access restricted. Please log in or start a trial to view this content.
Discussion
טכנולוגיית מורפולינו (MO) נמצאת בשימוש נרחב בדגי זברה, קסנופוס, קיפודי ים, ולאחרונה במערכות מודל תרביות תאים. עם רוב השיטות, יחד עם היתרונות, יש גם מלכודות שהנסיין צריך להיות מודע להן. אחת המלכודות העיקריות בטכנולוגיית MO כוללת את החשש שההשפעות הפנוטיפיות שנצפו על ידי גישת ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים על אינטרסים פיננסיים או ניגודי אינטרסים אחרים.
Acknowledgements
פרסום מאמר זה סוקר בתמיכה נדיבה של BARZAN HOLDINGS. RR נתמך בחלקו על ידי R61HL154254 וכספים מהמחלקה לרפואת ילדים ובית החולים לילדים.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Acrylamide 40% | Sigma | Sigma, cat. no. C977M88 | |
| Agarose | Sigma-Aldrich | Sigma-Aldrich cat. no A9539-250G | |
| All Prep DNA/RNA Mini Kit | Qiagen | Qiagen cat. no. 80204. | |
| alpha Tubulin | Abcam | Abcam- ab4074 | Rabbit polyclonal to alpha Tubulin lot GR3 180877-1 (50 kDa) |
| Ammonium persulfate molecular grade | Sigma | Sigma, cat. no C991U65 | |
| BV10 capillary beveller | Sutter Instruments Product | Sutter Instruments Product Catalog # BV10 | |
| Chemiluminescence Imaging Gene Gnome | SYNGENE | SYNGENE | |
| Cleaver Scientific Blotting | CVS10D_OmniPAGEMini | CVS10D_OmniPAGEMini | |
| Coomassie | Thermo Fisher | Thermo Fisher cat. no C861C44 | |
| Electrochemiluminescence (ECL) kit | Abcam Biochemicals | Abcam Biochemicals cat. no ab65623 | |
| Glycine | Sigma | Sigma, cat. no C988U91 | |
| Goat anti Rabbit | Abcam | Abcam- ab6721 | Goat Anti-Rabbit IgG H&L (HRP) 2nd antibodies lot GR3179871-1 |
| HAND2 | Gene tools | Custom made for HAND2 (NM_021973) | 5'-CCTCCAACTAAACTCATGGCGAC AG-3' |
| Hand2 | Abcam | Abcam- ab10131 | Rabbit polyclonal Anti-HAND2 antibody lot GR143200-9 (24- 26 kDa) |
| HAND2 (NM_021973) Human Tagged ORF Clone | OriGene Technologies, Inc | RC224436L3 | Vector: pLenti-C-Myc-DDK-P2A-Puro (PS100092) |
| IBI DNA/RNA/Protein Extraction Kit | IBI Scientific | IBI Scientific cat. no -r IB47702 | |
| Imaging System | iBright | iBright CL1000 Imaging System | |
| Isopropanol | Sigma-Aldrich | Sigma-Aldrich cat. no 278475-2L | |
| Laemmli sample loading buffer (4x) | Sigma-Aldrich | Sigma-Aldrich cat. no 70607 | |
| Mercaptoethanol | Sigma | Sigma, cat. no M6250-1L | |
| Microplate Spectrophotometer with the Gen5 Data Analysis software interface | Epoch | Epoch | |
| Microscope | Ziess SteREO Lumar V12 Flourescence Microscope | Ziess SteREO Lumar V12 Flourescence Microscope | |
| Mineral oil | Fisher Scientific | Fisher Scientific cat. no 0121-1 | |
| mMESSAGE mMACHINE T7/T3/SP6 Transcription Kit | Thermo Fisher | Thermo Fisher cat. no.AM1340 | for mRNA generation |
| Nuclease-free water | New England Biolabs | New England Biolabs cat. no B1500L | |
| PC-100 Micropipette Puller | NARISHIGE GROUP Product | NARISHIGE GROUP Product Catalog # PC-100 | |
| Phenol red | Sigma | Sigma, cat. no. P-0290 | |
| Picolitre Injector | Harvard Apparatus | Harvard Apparatus cataloge # PLI-90A | |
| Pierce Bicinchoninic acid assay (BCA) Protein Assay kit | Thermo Fisher | Thermo Fisher cat. no 23227 | |
| PMSF, Protease inhibitor as protease inhibitors | Thermo Fisher | Thermo Fisher cat. no 36978 | |
| Ponceau S | Sigma-Aldrich | Sigma-Aldrich cat. no 10165921001 | |
| Protease Inhibitor Cocktail | Thermo Fisher | Thermo Fisher cat. no 88668 | |
| Protein ladder | SMOBiO | SMOBiO cat. no PM2500 | |
| Radioimmunoprecipitation Assay (RIPA) | Thermo Fisher | Thermo Fisher cat. no 89900 | |
| Ringer’s solution | Thermofisher | Catalog No.S25513 | |
| SDS | Sigma | Sigma, cat. no 436143 | |
| Standard Control | Gene tools | SKU: PCO-StandardControl-100 | 5'-CCTCTTACCTCAGTTACAATTTAT A-3'- that targets a human beta-globin intron mutation |
| Stripping buffer | Sigma-Aldrich | Sigma-Aldrich cat. 21059 | |
| Temed | IBI scientific | IBI scientific cat. no C000A52 | |
| Tris Base | Thermo Fisher | Thermo Fisher cat. no BP-152-500 | |
| Tween | sigma life science | sigma life science cat. no P2287 | |
| Zebra Box Revolution-Danio Track system chamber with the EthoVision XT 11.5 software | Noldus Information Technology, NL | Noldus Information Technology, NL | |
| Zeiss Axiocam ERc 5s | Zeiss | Stemi 508 Zeiss | |
| Zeiss Stemi 2000-C | Zeiss | Stemi 2000-C |
References
- Bakkers, J. Zebrafish as a model to study cardiac development and human cardiac disease. Cardiovascular Research. 91 (2), 279-288 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Stainier, D. Y., et al. Guidelines for morpholino use in zebrafish. PLoS Genetics. 13 (10), 1007000(2017).
- Zhou, B., et al. Epicardial progenitors contribute to the cardiomyocyte lineage in the developing heart. Nature. 454 (7200), 109-113 (2008).
- Eve, A. M., Place, E. S., Smith, J. C. Comparison of Zebrafish tmem88a mutant and morpholino knockdown phenotypes. PLoS One. 12 (2), 0172227(2017).
- Huang, W., Zhang, R., Xu, X. Myofibrillogenesis in the developing zebrafish heart: A functional study of tnnt2. Developmental Biology. 331 (2), 237-249 (2009).
- Chen, Z., et al. Depletion of zebrafish essential and regulatory myosin light chains reduces cardiac function through distinct mechanisms. Cardiovascular Research. 79 (1), 97-108 (2008).
- Bedell, V. M., Westcot, S. E., Ekker, S. C. Lessons from morpholino-based screening in zebrafish. Briefings in Functional Genomics. 10 (4), 181-188 (2011).
- Reichenbach, B., et al. Endoderm-derived Sonic hedgehog and mesoderm Hand2 expression are required for enteric nervous system development in zebrafish. Developmental Biology. 318 (1), 52-64 (2008).
- Maves, L., Tyler, A., Moens, C. B., Tapscott, S. J. J. Pbx acts with Hand2 in early myocardial differentiation. Developmental Biology. 333 (2), 409-418 (2009).
- Hinits, Y., et al. Zebrafish Mef2ca and Mef2cb are essential for both first and second heart field cardiomyocyte differentiation. Developmental Biology. 369 (2), 199-210 (2012).
- Gene Tools, custom-sequence Morpholinos. , Available from: https://oligodesign.gene-tools.com/ (2011).
- hand2 heart and neural crest derivatives expressed 2 [ Danio rerio (zebrafish). , Available from: https://www.ncbi.nlm.nih.gov/gene/58150 (2021).
- Danio rerio heart and neural crest derivatives expressed 2 (hand2), mRNA. , Available from: https://www.ncbi.nlm.nih.gov/nuccore/NM_131626.3 (2021).
- NCBI reference sequence -Danio rerio heart and neural crest derivatives expressed 2 (hand2), mRNA FASTA. , hand2), mRNA FASTA at (2021). Prepared control oligos at (2021).
- Prepared control oligos. , Available from: https://store.gene-tools.com/prepared-control-oligos (2021).
- Schubert, S., Keddig, N., Hanel, R., Kammann, U. Microinjection into zebrafish embryos (Danio rerio)-a useful tool in aquatic toxicity testing. Environmental Sciences Europe. 26 (1), 32(2014).
- Moulton, J. D. Guide for morpholino users: toward therapeutics. Journal of Drug Discovery, Development, and Delivery. 3 (2), 1023(2016).
- Link, V., Shevchenko, A., Heisenberg, C. -P. Proteomics of early zebrafish embryos. BMC Developmental Biology. 6 (1), 1(2006).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. Journal of Visualized Experiments: JoVE. (44), e2359(2010).
- Shin, J. T., Pomerantsev, E. V., Mably, J. D., MacRae, C. A. High-resolution cardiovascular function confirms functional orthology of myocardial contractility pathways in zebrafish. Physiological Genomics. 42 (2), 300-309 (2010).
- Yalcin, H. C., Amindari, A., Butcher, J. T., Althani, A., Yacoub, M. Heart function and hemodynamic analysis for zebrafish embryos. Developmental Dynamics: An Officical Publication of the American Association of Anatomists. 246 (11), 868-880 (2017).
- Zakaria, Z. Z., et al. Using zebrafish for investigating the molecular mechanisms of drug-induced cardiotoxicity. Biomed Research International. 2018, 1642684(2018).
- Parker, T., et al. A multi-endpoint in vivo larval zebrafish (Danio rerio) model for the assessment of integrated cardiovascular function. Journal of Pharmacological and Toxicological Methods. 69 (1), 30-38 (2014).
- Grone, B. P., et al. Epilepsy, behavioral abnormalities, and physiological comorbidities in syntaxin-binding protein 1 (STXBP1) mutant zebrafish. PLoS One. 11 (3), 0151148(2016).
- Salman, H. E., Yalcin, H. C. Advanced blood flow assessment in Zebrafish via experimental digital particle image velocimetry and computational fluid dynamics modeling. Micron. 130, 102801(2020).
- Benslimane, F. M., et al. Cardiac function and blood flow hemodynamics assessment of zebrafish (Danio rerio) using high-speed video microscopy. Micron. 136, 102876(2020).
- DeGroff, C. G. Doppler echocardiography. Pediatric Cardiology. 23 (3), 307-333 (2002).
- Bagatto, B., Burggren, W. A three-dimensional functional assessment of heart and vessel development in the larva of the zebrafish (Danio rerio). Physiological and Biochemical Zoology. 79 (1), 194-201 (2005).
- Tinevez, J. -Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods (San Diego, Calif.). 115, 80-90 (2017).
- Meijering, E., Dzyubachyk, O., Smal, I. Methods for cell and particle tracking. Methods in Enzymology. 504, 183-200 (2012).
- Kok, F. O., et al. Reverse genetic screening reveals poor correlation between morpholino-induced and mutant phenotypes in zebrafish. Developmental Cell. 32 (1), 97-108 (2015).
- Sumanas, S. Inducible inhibition of gene function with photomorpholinos. Methods in Molecular Biology. 1565, Clifton, N.J. 51-57 (2017).
- Kyritsi, K., et al. Knockdown of hepatic gonadotropin-releasing hormone by vivo-morpholino decreases liver fibrosis in multidrug resistance gene 2 knockout mice by down-regulation of miR-200b. The American Journal of Pathology. 187 (7), 1551-1565 (2017).
- Flynt, A. S., Rao, M., Patton, J. G. Blocking zebrafish microRNAs with morpholinos. Methods in Molecular Biology. 1565, Clifton, N.J. 59-78 (2017).
- Schoenebeck, J. J., Keegan, B. R., Yelon, D. Vessel and blood specification override cardiac potential in anterior mesoderm. Developmental Cell. 13 (2), 254-267 (2007).
- Lu, F., Langenbacher, A., Chen, J. -N. Transcriptional regulation of heart development in zebrafish. Journal of Cardiovascular Development and Disease. 3 (2), 14(2016).
- Laurent, F., et al. HAND2 target gene regulatory networks control atrioventricular canal and cardiac valve development. Cell Reports. 19 (8), 1602-1613 (2017).
- Miura, G. I., Yelon, D. A guide to analysis of cardiac phenotypes in the zebrafish embryo. Methods in Cell Biology. 101, 161-180 (2011).
- De Luca, E., et al. ZebraBeat: a flexible platform for the analysis of the cardiac rate in zebrafish embryos. Scientific Reports. 4, 4898(2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved