需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
设计吗啉反义寡核苷酸和 mRNA 并将其显微注射到斑马鱼胚胎中,以阐明心脏发育中的特定基因功能
摘要
本方案描述了针对代表性心脏基因的设计、制备和显微注射翻译阻断吗啉;心脏和神经嵴衍生物表达2 (hand2) 到新受精的斑马鱼胚胎的卵黄中,以敲低基因功能。它还显示了通过共注射编码该基因产物的 mRNA 对这些“形态体”的瞬时拯救。
摘要
基于吗啉代寡聚体的敲低系统已用于通过表达缺失或表达减少来识别各种基因产物的功能。 吗啉代 (MOs) 在生物稳定性方面优于 DNA 寡核苷酸,因为它们不易被酶促降解。 为了获得最佳效果,将 MO 注射到 1-4 个细胞期的胚胎中。 敲低的时间功效是可变的,但 MO 被认为最终会因稀释而失去其作用。应严格控制吗啉代稀释和注射量,以尽量减少脱靶效应的发生,同时保持靶向疗效。应针对目标靶基因进行其他补充工具,例如 CRISPR/Cas9,以生成突变系并确认这些系的形态表型。本文将演示如何设计、制备针对 hand2 的翻译阻断吗啉糖,并将其显微注射到 1-4 细胞期斑马鱼胚胎的卵黄中,以敲除 hand2 功能,并通过共注射编码相应 cDNA 的 mRNA 来拯救这些“形态”。随后,通过首先验证蛋黄中吗啉代的存在(与酚红共注射),然后通过表型分析来评估吗啉代显微注射的功效。此外,将讨论用于测试敲除效果的心脏功能分析。最后,将解释通过蛋白质印迹评估吗啉代诱导的基因翻译阻断的影响。
引言
与传统的体内模型相比,利用斑马鱼作为研究心血管发育和疾病的模型具有多种优势,包括基因功能高度保守、光学透明性、心血管发育快速和成本更低1。吗啉代寡核苷酸 (MOs) 是斑马鱼模型中最常用的反义基因敲低工具。MO 经常用于确定表型或探测基因功能。James Summerton 博士最初开发了用于体内抑制 mRNA 翻译的吗啉代递送系统,以尝试开发治疗人类发育缺陷的治疗方法 2,3。MO 已用于体外和体内模式生物,以敲低基因并研究这种敲低对表型的影响。这是通过观察特定器官(例如心脏)发育的变化来完成的。WT 斑马鱼胚胎中心脏特异性基因的敲除导致正常心跳失败,证明了这些基因对心脏发育不可或缺的功能 4,5。这些表型通过共同注射特定基因的 mRNA 来挽救。一项涉及心肌肌钙蛋白 T (Tnnt2) 的研究表明,全长 tnnt2 mRNA 的表达可以挽救吗啉酮敲低引起的肉节表型6。另一项研究表明,在 cmcl2 形态体中过表达调节性肌球蛋白轻链直系同源物 (cmlc2) mRNA 可以恢复 A 带和 Z 盘的完整性7。
MO 通常用于通过靶向前体 mRNA 剪接或阻断翻译来敲低基因表达。剪接阻断 MO 通过抑制剪接体来结合和抑制前体 mRNA。当 MO 与互补 mRNA 的 5'-非翻译区结合以阻碍核糖体组装时,就会发生翻译阻断。MO 是 体内模型中使用 最广泛的基因特异性敲低基因表达方法;它们也是细胞培养中使用的最有效的 mRNA 封闭剂。吗啉亚基本身通常由短链(约 25 个)吗啉亚基碱基组成。每个 MO 亚基包括一个核酸碱基、一个吗啉环和一个非离子型二酰胺磷酸酯。两种 MO 的作用机制不同,需要不同的测试来验证敲低的功效。对于翻译阻断 MO,western blot 分析是最可靠的疗效测试,因为由于 ATG 翻译起始位点受阻,不应产生目标蛋白。MO 不会直接降解其靶标 mRNA;相反,它们与特定区域结合并抑制表达,直到自然降解。然而,剪接阻断 MO 通过诱导剪接修饰来修饰前体 mRNA,这可以通过逆转录酶聚合酶链反应 (RT-PCR) 和凝胶电泳进行检测。
MOs 筛选过程的三个关键部分必须标准化:(i) 必须调整 MO 剂量曲线以进行表型识别。剂量曲线还显示了每个 MO 的致死剂量 50(LD50:50% 的注射胚胎死亡的剂量),以提高优化表型“信号”与脱靶“噪音”的能力3。(ii) 采用的表型命名法应有据可查;精确且易于理解的表型描述对于根据现有文献和研究者经验提供广泛的解释至关重要,以促进未直接检查胚胎的人之间的信息共享。(iii) 拥有定义明确的语言可以很容易地从 Morpholino 数据库8 集中收集数据。
在心脏基因的 MO 敲低研究中,必须监测动物的心脏活动和血流动力学,以确定 MO 敲低实验对心血管系统功能的影响。此类分析需要以高分辨率实时可视化心血管系统。斑马鱼的皮肤在发育的第一周是透明的,可以通过显微镜观察心脏和血液循环。对于心脏功能的评估,计算最多的生理参数是心率和心输出量以及缩短分数、面积变化分数和射血分数。可以通过跟踪移动的红细胞来测量血流速度,这些测量值用于确定剪切应力水平,这是内皮细胞的关键机械生物学因素。这种评估需要通过配备高速摄像机的倒置显微镜或立体显微镜记录跳动的心脏和流动的血液的延时电影。
本文展示了如何设计、制备针对目标基因的翻译阻断吗啉糖并将其显微注射到新鲜受精的斑马鱼胚胎的卵黄中,以敲低基因功能。它还将显示通过共注射编码该基因的 mRNA 来拯救这些 “morphants”。然后,我们将通过表型特征以及心脏结构和功能分析来分析吗啉代显微注射的疗效。这种方法将在广泛研究的心脏基因 hand2 上进行演示。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验均按照 QU 的 IACUC 监管下公认的人道动物护理标准进行;动物被关押在卡塔尔大学生物医学研究中心 (QU-BRC) 下的斑马鱼设施中。这些实验研究中使用的所有动物都在受精后 3 天 (dpf) 内。
注意:对于每个实验组,为了统计的严谨性,建议至少使用 30 个胚胎。实验组如下:
控制组: 该组包括在鸡蛋水中培养且未进行任何注射的胚胎。此处的结果将构成控制基线。
阴性对照组: 该组包括在注射加扰 MO 的鸡蛋水中培养的胚胎。
注射组: 该组包括单独注射 hand2 MO 的胚胎和注射 hand2 mRNA 的 hand2 MO 以挽救表型。此处的结果将证实观察到的表型是由于注射 MO 而出现的。实验组的比较将有助于精确评估 hand2 的抑制和挽救对心脏功能的影响。
1. 手的 Morpholino 设计 2.
注意:MO 序列可以改编自文献 9,10,11。或者,这些寡核苷酸可以通过 Gene-tools 在线设计。Gene-tools 提供免费且快速的在线设计服务,可以通过他们的网站12 访问。通过提供有关目标基因的信息(例如序列信息或登录号),可以很容易地设计自定义 MO。以下具体步骤总结了如何在 zebrafish 中针对 hand2 设计 MO:
- 首先,从 NCBI 数据库中搜索目标基因的详细信息。对于 hand2,在斑马鱼13 中。
- 从 NCBI14 获取 GenBank mRNA 转录本 ID。
- 从 NCBI15 获取 mRNA 序列。
注:斑马鱼 hand2 基因的吗啉代 (MO) 修饰的反义寡核苷酸可用,并且之前已发表。手2MO 序列 9,10,11:5'-CCTCCAACTAAACTCATGGCGACAG-3',研究中使用的 MO 序列列在材料表中。 - 从基因工具16 中从不匹配或加扰的 MO(具有随机碱基对变化的相似序列)中获得阴性对照。这将有助于证明在特定 MO 注射中观察到的表型的特异性,并将观察到的效果来自注射程序伪影的风险降至最低。
2.吗啉代注射液的制备
- 浆料制备
- 用 ddH2O 溶解 MO 股票;焦碳酸二乙酯 (DEPC) 会损害 MO 并对胚胎有毒。因此,使用不含 DEPC 的 ddH2O。订购后,MO 以 300 nM 的浓度装在小瓶中交付。
注:虽然 Gene Tools 推荐 1 mM 储备溶液 (~8 ng/nL),但这可能太低,特别是如果吗啉代需要高剂量或与其他 MO 混合。因此,它是制备各种浓度的 MO 储备液(2 或 3 mM)的理想选择。 - 通过亚稀释工作溶液(即,对于 2 mM 储备液,以 1:10 稀释)制备 0.2 mM 工作溶液。通过添加 Danieaux 溶液 (7 μL)、吗啉代储备液 (1 μL) 和酚红(2 μL 来自 10x 储备液)制备 10 μL 工作溶液。酚红使溶液呈深红色,以帮助追踪胚胎中注射的物质。
- 将 MO 保存在室温 (RT) 下的密封容器中,以防止蒸发。不要将 MO 放在工作台上的冰上,因为溶液可能会沉淀。RT 处理是最合适的。
注:Gene Tools 推荐两种 MO 储存方法之一:工作溶液可在 -20 °C(数月至数年)或 RT 下保存在密封管中长期储存。如果保持在-20°C,则将寡核苷酸溶液在65°C下加热10分钟,并在使用前涡旋以完全溶解吗啉代(如果保持在室温下,则无需预热)。
- 用 ddH2O 溶解 MO 股票;焦碳酸二乙酯 (DEPC) 会损害 MO 并对胚胎有毒。因此,使用不含 DEPC 的 ddH2O。订购后,MO 以 300 nM 的浓度装在小瓶中交付。
- mRNA 的体外转录
注: 体外转录用于 从质粒 HAND2 (NM_021973) 人标记的 ORF 克隆中生成 Hand2 的 mRNA,以显微注射到斑马鱼胚胎中,以挽救由于使用吗啉而敲低斑马鱼 hand2 引起的表型,研究中使用的质粒细节列在 材料表中。- 用适当的限制性内切酶对质粒 DNA 进行线性化,并使用 DNA 纯化试剂盒进行纯化(材料表)。使用纯化的线性化 DNA 作为 体外 转录的模板,以按照制造商的说明生成用于注射的 mRNA(材料表)。
- 最后,为目的基因注射 250 pg 人 mRNA,以执行表型的挽救,以测试表型的缺乏是否确实是由于 MO 导致斑马鱼基因丢失。
- 准备注射
- 按照步骤 2.3.2-2.3.6 使用微量移液器拉拔器(材料表)拉针。
- 使用带有细丝和微量移液器拉拔器的 1 mm 毛细管。启动设备并打开盖子
- 将模式选择旋钮转到 NO.2 加热器。使用 NO.2 加热器,调节旋钮,将热量调至 68 °C
- 将模式选择旋钮拨回 步骤 1 位置。使用四个砝码(2 种轻型 / 2 种重型)
- 将毛细管放在支架上并盖上盖子。按下 Start 按钮以获取拉出的针。
注意:这将生成具有长锥度的毛细管针 - 使用镊子短暂地剪断针尖。使用毛细管斜面器锐化拉出的针尖,以便轻松穿透斑马鱼胚胎约 30 秒,从而产生直径约为 15-25 μm 的尖端。
- 按照步骤 2.3.8-2.3.13 校准针头以估计注射量。
- 在将 mRNA/吗啉代溶液装入针头之前,先短暂混合,以溶解可能完全堵塞针头的颗粒。
- 使用微米尖端的移液管尖端将 ~3-4 μL MO 溶液添加到注射针的后部。注射针配有一个小沟槽,便于毛细管回填。
- 确认注射针中没有气泡。将针头安装到显微注射器上。
- 检查针尖是否堵塞,以及 MO 溶液是否可以通过踩下注射踏板从针中流出。
- 通过测量液滴大小来校准注射体积。将针尖放入千分尺载玻片上的矿物油中。踩下进样踏板并调整进样(弹出)压力 (psi) 和/或进样时间 (ms),直到弹出的液滴直径为 0.1 mm,相当于 0.5 nL。
- 确保注射体积约为 0.5-1 nL。通过更改进样(顶出)压力 (psi) 或时间 (ms) 来调整体积。
- 对于皮升进样器设置方案,请遵循步骤 2.3.15-2.3.16
- 使用皮升注射器注射斑马鱼。打开喷油器的进料泵。
- 根据如下所示的要求准备 Injector:
- P 余额: 确保 P 余额在 0 左右。确保它略微呈阴性,以防止蛋黄流回针中,稀释针中的 MO 溶液。相反,如果背压过高,即使不对踏板施加压力,MO 也会不断从针头中流出,从而导致注射剂量和观察到的表型发生变化和不一致。
- P-inject: 20-25 psi 是理想的;更改此选项可调整注射量。范围为 10-30 psi,但从 ~20 psi 开始,以检查它是否提供所需的体积。
- 注射时间: 确保将注入时间减少到 300 毫秒。在调整进样体积之前,请调整进样时间。
- 对于吗啉醇注射液,请遵循步骤 2.3.18-2.3.19。
- 按如下方式准备注射室:从 0.6 g 琼脂糖和 30 mL E3 培养基中制备 2% 琼脂糖。将琼脂糖倒入培养皿中,并使用 TU-1 注射模具将注射模具放在琼脂糖上。一旦在冰箱中冷却,就会形成沟槽,用于放置和稳定胚胎(图 1A)。
注:60x E3M 储备溶液配方由 5.0 mM NaCl、0.17 mM KCl、0.16 mM MgSO4·7H2O、0.4 mM CaCl2·2H2O 在 1 L ddH2O 中组成,最终 pH 值为 7.6。 - 使用移液管将收集的胚胎转移到沟槽中,去除胚胎周围所有多余的 E3 培养基,以防止胚胎漂浮(图 1B)。
3. 将 MO 和 mRNA 溶液注射到蛋黄中
- 将针头穿过绒毛膜,在细胞/卵黄边界附近注射到胚胎侧,然后按下注射踏板(图 1C)。
注意:注射的 MO 溶液/酚红不会立即在蛋黄内扩散。在蛋黄中会观察到一个红点,并逐渐消散。注射的材料不应超过胚胎大小的 10%。MO 可以在长达 8 细胞阶段显微注射到新产下的斑马鱼卵的蛋黄中,因为 MO 很容易被发育中的细胞吸收到卵黄囊的细胞质流中17,18。在质粒或加帽 mRNA 注射中,应注射到单细胞期胚胎的单个卵裂球中。 - 将胚胎转移到装有 E3 培养基的培养皿中,并在 28 °C 下孵育至 3 dpf,每天补充 E3 培养基。在该阶段,使用显微镜进行表型评估。
注意:每次研究都必须仔细稀释 MO 溶液,以确定诱导特定表型所需的最低浓度。还必须确定每个 MOs 的胚胎致死率。在较高浓度(高于 4-10 ng,取决于 MO)下,MO 往往会引起非特异性效应,例如脑或一般细胞死亡。 - 以相同的方式将 MO 与人 手 2 的 250 pg mRNA 共注射,以确认 MO 挽救了斑马鱼 手 2 基因丢失诱导的表型。
4. Western blot 验证吗啉代敲低成功
- 在特定时间点(48 hpf、72 hpf)收集胚胎,并在需要时使用 Pronase 酶进行去绒毛膜化。
- 使用以前已知的方法对胚胎进行 Deyolk 以去除 Vitellogenin19。
注意:卵黄素原是一种磷酸脂糖蛋白,可作为生长中的胚胎的营养来源。通过去除胚胎和去除 Vitellogenin ,高分辨率 2D 凝胶电泳和大大改进的 western blotting 成为可能。 - 如前所述进行蛋白质印迹20.
5. 心脏结构和功能评估:
- 斑马鱼的实时成像:脑室成像
注意:可以通过可视化斑马鱼胚胎的跳动心脏来计算几个心脏功能/血流动力学参数21,22。这些参数包括心输出量 (CO)、射血分数 (EF)、每搏输出量 (SV)、分数缩短 (FS) 和分数面积变化 (FAC)(请参阅以前的论文,涉及斑马鱼胚胎心脏功能评估的详细方案22,23)。以下步骤简要解释了如何在 ~3 dpf 下计算斑马鱼胚胎的这些参数,这是这些生物体的皮肤是透明的阶段,可以使用明场显微镜进行可视化。- 在凹孔成像载玻片中滴入 3% 甲基纤维素溶液 (RT)。
- 使用合适的塑料滴管将斑马鱼胚胎放置在孔中(图 2A、B)
注意: 井装得太满可能会导致鱼从井中排出。 - 将 3% 甲基纤维素滴与 E3 培养基轻轻混合,以稳定孵化的胚胎。
注:要制备 3% 甲基纤维素溶液,请将 3 g 甲基纤维素粉末溶解在烧瓶中的 100 mL PBS 或其他封片剂中。在混合物的烧瓶中放置一个搅拌磁铁,然后将烧瓶放在磁力搅拌板上。将速度设置为“低”并保持在 4 °C ~1 天以溶解所有团块。一旦甲基纤维素完全溶解,分装到小管中并储存在 -20 °C。 - 将鱼放在左侧,右侧朝上,前部指向左侧,以便于对心室进行明确成像(图 2C)。
- 在显微镜下,以 100 倍放大倍率放大胚胎心脏并开始记录 ~5 秒。确保心室边界位于成像窗口内(图 2D)。
- 使用高速相机和立体显微镜以每秒约 100 帧 (fps) 的速度录制整个胚胎(图 2C)、跳动的心室(图 2D)和主要血管中移动的红细胞 (RBC),例如背主动脉或后红静脉(图 2E),用于心脏功能分析。
- 以 AVI 影片格式或 TIFF(或 JPEG)图像序列格式存储影片。
- 计算心率
- 计算连续录制 2 帧所需的时间。对于 100 fps,时间间隔等于 0.01 秒。
- 从任何记录的心动周期(即舒张末期或收缩末期)中选择一个已知点。计算重复循环所需的帧数。
- 将步骤 5.2.1 中的时间间隔与步骤 5.2.2 中的帧数相乘。结果是一次检测信号的持续时间(以秒为单位)。
- 要计算每分钟的节拍数,请将 60 除以上一步中获得的数字。对于正常的 3 dpf 胚胎,这应该在 150 bpm (2.5 Hz) 左右。
注意:许多软件应用程序可以根据跳动的心脏记录自动计算心率,例如 ViewPoint24 和 DanioVision25。 - 使用约 100 fps 的创纪录延时电影分析心脏结构,以检查整个心脏,以检测是否存在心脏水肿或任何其他结构缺陷。
注意: 图 3A 显示了正常的 3 dpf 胚胎心脏, 图 3B 显示了患有心脏水肿和心脏循环缺陷(细长心室)的 3 dpf 心脏。
- 计算分数面积变化 (FAC):
注意:面积分数变化 (FAC) 是用于比较心室舒张末期和收缩末期区域以评估心室收缩力的参数。- 使用大约 100 fps 的录制延时影片来确定代表一个心动周期的帧。提取显示收缩末期和舒张末期结束的帧。
- 使用 ImageJ 或类似的图像分析软件计算舒张末期面积 (EDA) 和收缩末期面积 (ESA)。
- 使用以下公式计算 FAC 22,26,27:
外交 事务 委员会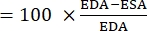
- 计算分数起酥油 (FS):
注意:分数缩短 (FS) 是另一个用于评估心室收缩力的参数;要确定 FS,必须测量心室的舒张末期和收缩末期直径21。- 重复步骤 5.3.1
- 使用 ImageJ 或任何其他等效的图像分析程序测量舒张末期 Dd 和收缩末期 Ds 点的心室壁直径。在大多数情况下,短轴直径用于确定分数平滑度 (FS)(图 4)。
- 使用以下公式计算 FS22,27:
司 司长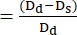
- 每搏输出量 (SV) 的计算:
注意:对于每次心跳,SV 是从心室泵出的血量,很容易从心室的舒张末期和收缩末期体积计算28。- 重复步骤 5.3.1 和 5.3.2
- 测量舒张末期 (DL) 和收缩末期 (DS) 直径,如图 4 所示。
注意:假设斑马鱼心脏的心室具有长球体21,22 的形状,则使用以下公式计算心室容积。
卷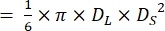
SV 可以按照以下公式27 计算。对于 2-6 个 dpf 胚胎,正常的 SV 范围为 0.15-0.3 nL29。这里,EDV 是舒张末期体积,ESV 是收缩末期体积。
SV = (EDV - ESV)
- 计算射血分数 (EF):
注:EF 定义为每次心跳28 时从心室射出的血液分数。- 从上述公式中,提取鱼的 EDV 和 ESV。
- EF 的计算公式如下:22,27:
EF (%)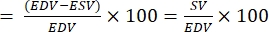
- 计算心输出量 (CO):
注意:CO 是心脏泵出的血液量28。对于 10-55 dpf 胚胎的 CO 值为 2-6 nL/min29。- 按照前面的 5.5 和 5.2 小节中提到的计算 SV 和 HR。
- 使用以下公式计算 CO22,27:
CO (nL/min) = SV (nL/beat) x HR (beats/min)。
- 测量红细胞速度:
注:细胞速度测定对于评估流速、血管直径和计算施加在血管内皮细胞上的剪切应力至关重要(即,另一方面,剪切应力是通过移动血液施加在内皮细胞上的摩擦力)。对于 2-5 dpf 胚胎,平均红细胞 (RBC) 速度约为 300-750 μm/s29。要测量 RBC 速度:- 在显微镜下,以 100 倍的放大倍率放大动物尾巴。在此放大倍率下,红细胞的运动应该是可见的(图 5A、B)。
- 开始录制约 8 秒。确保背主动脉 (DA) 和后主静脉 (PCV) 是两条最重要的轴动脉,在成像窗口内为 100-120 fps。从连续帧中跟踪单个细胞(图 5A、B)。
- 使用 ImageJ 或其他类似的图像分析软件提取多个帧。
- 计算单个 RBC 移动的距离差 (Δx)。
- 确定连续帧之间的时间差 (Δt)。
- 使用以下公式计算 RBC 速度22,27:
红细胞速度 (μm/s)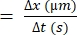
注意:最大和平均速度可以从单个单元格21 的连续帧的重复中提取。红细胞速度也代表血流速度。或者,可以使用各种市售软件应用程序来自动测量 RBC 的速度。ViewPoint24 和 DanioVision25 都有这样的应用(图 5C)。此外,ImageJ 的可用插件很少,例如 TrackMate30 和 MTrackJ31,与录制在 100 fps 以上的电影兼容。
- 根据测得的泡胞速度计算剪切应力
在血管中测得的 RBC 速度也代表血流速度(图 5C)。根据这些测量值,计算相关容器中的剪切应力 τ,假设泊肃叶流为22,27:
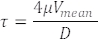
其中 V 是平均血流速 (μm/s),μ 是血液粘度 (dynes/cm2),D 是血管直径 (μm)。对于 3 dpf 胚胎,DA 22,26,27 中的剪切应力约为 4 达因/厘米 2。
Access restricted. Please log in or start a trial to view this content.
结果
图 6 中的图表说明了 HAND2 特异性 MO 和对照加扰 MO 注射胚胎在 24、48 和 72 hpf 下存活的胚胎的平均百分比。与对照加扰 MO 注射胚胎相比,1 mM (8 ng/μL) 和 0.8 mM (6.4 ng/μL) MO 注射的胚胎的存活率显著降低。在观察到致死性或畸形的每个测量时间点中都观察到了这一点。结果表明,由于 MO 的脱靶效应和毒性,高浓度 HAND2MO 的存活率显着降低。而 0.4 ...
Access restricted. Please log in or start a trial to view this content.
讨论
吗啉代 (MO) 技术已广泛用于斑马鱼、非洲爪蟾、海胆,最近还用于细胞培养模型系统。对于大多数方法,除了好处外,实验者也应该注意一些陷阱。MO 技术的主要缺陷之一包括担心 MO 介导的基因敲低方法观察到的表型效应不是由于与原代基因产物相关的功能丧失,而是由于一些其他基因与原代基因一起或独立于已靶向的原代基因,因此这种所谓的“脱靶”效应是“观?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明经济利益或其他利益冲突。
致谢
本文的发布得到了 BARZAN HOLDINGS 的慷慨支持。RR 部分由儿科和儿童医院的 R61HL154254 和资金支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Acrylamide 40% | Sigma | Sigma, cat. no. C977M88 | |
| Agarose | Sigma-Aldrich | Sigma-Aldrich cat. no A9539-250G | |
| All Prep DNA/RNA Mini Kit | Qiagen | Qiagen cat. no. 80204. | |
| alpha Tubulin | Abcam | Abcam- ab4074 | Rabbit polyclonal to alpha Tubulin lot GR3 180877-1 (50 kDa) |
| Ammonium persulfate molecular grade | Sigma | Sigma, cat. no C991U65 | |
| BV10 capillary beveller | Sutter Instruments Product | Sutter Instruments Product Catalog # BV10 | |
| Chemiluminescence Imaging Gene Gnome | SYNGENE | SYNGENE | |
| Cleaver Scientific Blotting | CVS10D_OmniPAGEMini | CVS10D_OmniPAGEMini | |
| Coomassie | Thermo Fisher | Thermo Fisher cat. no C861C44 | |
| Electrochemiluminescence (ECL) kit | Abcam Biochemicals | Abcam Biochemicals cat. no ab65623 | |
| Glycine | Sigma | Sigma, cat. no C988U91 | |
| Goat anti Rabbit | Abcam | Abcam- ab6721 | Goat Anti-Rabbit IgG H&L (HRP) 2nd antibodies lot GR3179871-1 |
| HAND2 | Gene tools | Custom made for HAND2 (NM_021973) | 5'-CCTCCAACTAAACTCATGGCGAC AG-3' |
| Hand2 | Abcam | Abcam- ab10131 | Rabbit polyclonal Anti-HAND2 antibody lot GR143200-9 (24- 26 kDa) |
| HAND2 (NM_021973) Human Tagged ORF Clone | OriGene Technologies, Inc | RC224436L3 | Vector: pLenti-C-Myc-DDK-P2A-Puro (PS100092) |
| IBI DNA/RNA/Protein Extraction Kit | IBI Scientific | IBI Scientific cat. no -r IB47702 | |
| Imaging System | iBright | iBright CL1000 Imaging System | |
| Isopropanol | Sigma-Aldrich | Sigma-Aldrich cat. no 278475-2L | |
| Laemmli sample loading buffer (4x) | Sigma-Aldrich | Sigma-Aldrich cat. no 70607 | |
| Mercaptoethanol | Sigma | Sigma, cat. no M6250-1L | |
| Microplate Spectrophotometer with the Gen5 Data Analysis software interface | Epoch | Epoch | |
| Microscope | Ziess SteREO Lumar V12 Flourescence Microscope | Ziess SteREO Lumar V12 Flourescence Microscope | |
| Mineral oil | Fisher Scientific | Fisher Scientific cat. no 0121-1 | |
| mMESSAGE mMACHINE T7/T3/SP6 Transcription Kit | Thermo Fisher | Thermo Fisher cat. no.AM1340 | for mRNA generation |
| Nuclease-free water | New England Biolabs | New England Biolabs cat. no B1500L | |
| PC-100 Micropipette Puller | NARISHIGE GROUP Product | NARISHIGE GROUP Product Catalog # PC-100 | |
| Phenol red | Sigma | Sigma, cat. no. P-0290 | |
| Picolitre Injector | Harvard Apparatus | Harvard Apparatus cataloge # PLI-90A | |
| Pierce Bicinchoninic acid assay (BCA) Protein Assay kit | Thermo Fisher | Thermo Fisher cat. no 23227 | |
| PMSF, Protease inhibitor as protease inhibitors | Thermo Fisher | Thermo Fisher cat. no 36978 | |
| Ponceau S | Sigma-Aldrich | Sigma-Aldrich cat. no 10165921001 | |
| Protease Inhibitor Cocktail | Thermo Fisher | Thermo Fisher cat. no 88668 | |
| Protein ladder | SMOBiO | SMOBiO cat. no PM2500 | |
| Radioimmunoprecipitation Assay (RIPA) | Thermo Fisher | Thermo Fisher cat. no 89900 | |
| Ringer’s solution | Thermofisher | Catalog No.S25513 | |
| SDS | Sigma | Sigma, cat. no 436143 | |
| Standard Control | Gene tools | SKU: PCO-StandardControl-100 | 5'-CCTCTTACCTCAGTTACAATTTAT A-3'- that targets a human beta-globin intron mutation |
| Stripping buffer | Sigma-Aldrich | Sigma-Aldrich cat. 21059 | |
| Temed | IBI scientific | IBI scientific cat. no C000A52 | |
| Tris Base | Thermo Fisher | Thermo Fisher cat. no BP-152-500 | |
| Tween | sigma life science | sigma life science cat. no P2287 | |
| Zebra Box Revolution-Danio Track system chamber with the EthoVision XT 11.5 software | Noldus Information Technology, NL | Noldus Information Technology, NL | |
| Zeiss Axiocam ERc 5s | Zeiss | Stemi 508 Zeiss | |
| Zeiss Stemi 2000-C | Zeiss | Stemi 2000-C |
参考文献
- Bakkers, J. Zebrafish as a model to study cardiac development and human cardiac disease. Cardiovascular Research. 91 (2), 279-288 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Stainier, D. Y., et al. Guidelines for morpholino use in zebrafish. PLoS Genetics. 13 (10), 1007000(2017).
- Zhou, B., et al. Epicardial progenitors contribute to the cardiomyocyte lineage in the developing heart. Nature. 454 (7200), 109-113 (2008).
- Eve, A. M., Place, E. S., Smith, J. C. Comparison of Zebrafish tmem88a mutant and morpholino knockdown phenotypes. PLoS One. 12 (2), 0172227(2017).
- Huang, W., Zhang, R., Xu, X. Myofibrillogenesis in the developing zebrafish heart: A functional study of tnnt2. Developmental Biology. 331 (2), 237-249 (2009).
- Chen, Z., et al. Depletion of zebrafish essential and regulatory myosin light chains reduces cardiac function through distinct mechanisms. Cardiovascular Research. 79 (1), 97-108 (2008).
- Bedell, V. M., Westcot, S. E., Ekker, S. C. Lessons from morpholino-based screening in zebrafish. Briefings in Functional Genomics. 10 (4), 181-188 (2011).
- Reichenbach, B., et al. Endoderm-derived Sonic hedgehog and mesoderm Hand2 expression are required for enteric nervous system development in zebrafish. Developmental Biology. 318 (1), 52-64 (2008).
- Maves, L., Tyler, A., Moens, C. B., Tapscott, S. J. J. Pbx acts with Hand2 in early myocardial differentiation. Developmental Biology. 333 (2), 409-418 (2009).
- Hinits, Y., et al. Zebrafish Mef2ca and Mef2cb are essential for both first and second heart field cardiomyocyte differentiation. Developmental Biology. 369 (2), 199-210 (2012).
- Gene Tools, custom-sequence Morpholinos. , Available from: https://oligodesign.gene-tools.com/ (2011).
- hand2 heart and neural crest derivatives expressed 2 [ Danio rerio (zebrafish). , Available from: https://www.ncbi.nlm.nih.gov/gene/58150 (2021).
- Danio rerio heart and neural crest derivatives expressed 2 (hand2), mRNA. , Available from: https://www.ncbi.nlm.nih.gov/nuccore/NM_131626.3 (2021).
- NCBI reference sequence -Danio rerio heart and neural crest derivatives expressed 2 (hand2), mRNA FASTA. , hand2), mRNA FASTA at (2021). Prepared control oligos at (2021).
- Prepared control oligos. , Available from: https://store.gene-tools.com/prepared-control-oligos (2021).
- Schubert, S., Keddig, N., Hanel, R., Kammann, U. Microinjection into zebrafish embryos (Danio rerio)-a useful tool in aquatic toxicity testing. Environmental Sciences Europe. 26 (1), 32(2014).
- Moulton, J. D. Guide for morpholino users: toward therapeutics. Journal of Drug Discovery, Development, and Delivery. 3 (2), 1023(2016).
- Link, V., Shevchenko, A., Heisenberg, C. -P. Proteomics of early zebrafish embryos. BMC Developmental Biology. 6 (1), 1(2006).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. Journal of Visualized Experiments: JoVE. (44), e2359(2010).
- Shin, J. T., Pomerantsev, E. V., Mably, J. D., MacRae, C. A. High-resolution cardiovascular function confirms functional orthology of myocardial contractility pathways in zebrafish. Physiological Genomics. 42 (2), 300-309 (2010).
- Yalcin, H. C., Amindari, A., Butcher, J. T., Althani, A., Yacoub, M. Heart function and hemodynamic analysis for zebrafish embryos. Developmental Dynamics: An Officical Publication of the American Association of Anatomists. 246 (11), 868-880 (2017).
- Zakaria, Z. Z., et al. Using zebrafish for investigating the molecular mechanisms of drug-induced cardiotoxicity. Biomed Research International. 2018, 1642684(2018).
- Parker, T., et al. A multi-endpoint in vivo larval zebrafish (Danio rerio) model for the assessment of integrated cardiovascular function. Journal of Pharmacological and Toxicological Methods. 69 (1), 30-38 (2014).
- Grone, B. P., et al. Epilepsy, behavioral abnormalities, and physiological comorbidities in syntaxin-binding protein 1 (STXBP1) mutant zebrafish. PLoS One. 11 (3), 0151148(2016).
- Salman, H. E., Yalcin, H. C. Advanced blood flow assessment in Zebrafish via experimental digital particle image velocimetry and computational fluid dynamics modeling. Micron. 130, 102801(2020).
- Benslimane, F. M., et al. Cardiac function and blood flow hemodynamics assessment of zebrafish (Danio rerio) using high-speed video microscopy. Micron. 136, 102876(2020).
- DeGroff, C. G. Doppler echocardiography. Pediatric Cardiology. 23 (3), 307-333 (2002).
- Bagatto, B., Burggren, W. A three-dimensional functional assessment of heart and vessel development in the larva of the zebrafish (Danio rerio). Physiological and Biochemical Zoology. 79 (1), 194-201 (2005).
- Tinevez, J. -Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods (San Diego, Calif.). 115, 80-90 (2017).
- Meijering, E., Dzyubachyk, O., Smal, I. Methods for cell and particle tracking. Methods in Enzymology. 504, 183-200 (2012).
- Kok, F. O., et al. Reverse genetic screening reveals poor correlation between morpholino-induced and mutant phenotypes in zebrafish. Developmental Cell. 32 (1), 97-108 (2015).
- Sumanas, S. Inducible inhibition of gene function with photomorpholinos. Methods in Molecular Biology. 1565, Clifton, N.J. 51-57 (2017).
- Kyritsi, K., et al. Knockdown of hepatic gonadotropin-releasing hormone by vivo-morpholino decreases liver fibrosis in multidrug resistance gene 2 knockout mice by down-regulation of miR-200b. The American Journal of Pathology. 187 (7), 1551-1565 (2017).
- Flynt, A. S., Rao, M., Patton, J. G. Blocking zebrafish microRNAs with morpholinos. Methods in Molecular Biology. 1565, Clifton, N.J. 59-78 (2017).
- Schoenebeck, J. J., Keegan, B. R., Yelon, D. Vessel and blood specification override cardiac potential in anterior mesoderm. Developmental Cell. 13 (2), 254-267 (2007).
- Lu, F., Langenbacher, A., Chen, J. -N. Transcriptional regulation of heart development in zebrafish. Journal of Cardiovascular Development and Disease. 3 (2), 14(2016).
- Laurent, F., et al. HAND2 target gene regulatory networks control atrioventricular canal and cardiac valve development. Cell Reports. 19 (8), 1602-1613 (2017).
- Miura, G. I., Yelon, D. A guide to analysis of cardiac phenotypes in the zebrafish embryo. Methods in Cell Biology. 101, 161-180 (2011).
- De Luca, E., et al. ZebraBeat: a flexible platform for the analysis of the cardiac rate in zebrafish embryos. Scientific Reports. 4, 4898(2014).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。