Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Дизайн и микроинъекция морфолиноантисмысловых олигонуклеотидов и мРНК в эмбрионы рыбок данио-рерио для выяснения специфической функции генов в развитии сердца
В этой статье
Резюме
Настоящий протокол описывает разработку, приготовление и микроинъекцию трансляционно-блокирующего морфолино против репрезентативного сердечного гена; Производные сердца и нервного гребня экспрессируются2 (рука2) в желток недавно оплодотворенных эмбрионов данио-рерио, чтобы подавить функцию генов. Он также показывает временное спасение этих «морфантов» путем совместной инъекции мРНК, кодирующей этот продукт гена.
Аннотация
Нокдаун-система на основе морфолигонолигомеров была использована для идентификации функции различных продуктов генов через потерю или снижение экспрессии. Морфолино (МО) имеют преимущество в биологической стабильности перед олигонами ДНК, поскольку они не подвержены ферментативной деградации. Для достижения оптимальной эффективности МО вводят эмбрионам 1-4 клеточной стадии. Временная эффективность нокдауна варьируется, но считается, что МО в конечном итоге теряют свои эффекты из-за разведения. Разведение морфолино и количество инъекции должны тщательно контролироваться, чтобы свести к минимуму возникновение побочных эффектов при сохранении целевой эффективности. Дополнительные комплементарные инструменты, такие как CRISPR/Cas9, должны быть применены к интересующему гену-мишени для генерации мутантных линий и подтверждения фенотипа морфанта с помощью этих линий. В этой статье мы продемонстрируем, как спроектировать, приготовить и микроввести блокирующий трансляцию морфолино против HAND2 в желток эмбрионов рыбок данио рерио на 1-4 клеточной стадии, чтобы подавить функцию HAND2 и спасти эти «морфанты» путем совместной инъекции мРНК, кодирующей соответствующую кДНК. Впоследствии эффективность микроинъекций морфолино оценивают путем предварительной проверки наличия морфолино в желтке (вводимом совместно с феноловым красным), а затем с помощью фенотипического анализа. Кроме того, будет обсуждаться кардиологический функциональный анализ для проверки эффективности нокдауна. Наконец, будет объяснена оценка эффекта морфолин-индуцированной блокировки трансляции гена с помощью вестерн-блоттинга.
Введение
Использование рыбок данио в качестве модели для изучения сердечно-сосудистого развития и заболеваний дает ряд преимуществ, включая высокую степень сохранения функции генов, оптическую прозрачность, быстрое развитие сердечно-сосудистой системы и меньшую стоимость по сравнению страдиционными моделями in vivo. Морфолигонуклеотиды (МО) являются наиболее часто используемыми инструментами нокдауна антисмысловых генов для модели рыбок данио. МО часто используются для определения фенотипа или для исследования функции генов. Доктор Джеймс Саммертон первоначально разработал систему доставки морфолино для ингибирования трансляции мРНК in vivo в попытке разработать терапевтические средства для дефектов развития человека 2,3. МО использовались для модельных организмов in vitro и in vivo для нокдауна генов и исследования последствий этого нокдауна для фенотипа. Это делается путем наблюдения за изменениями в развитии конкретных органов, например, сердца. Нокдаун специфичных для сердца генов у эмбрионов рыбок данио WT приводил к нарушению надлежащего сердцебиения, что свидетельствует о незаменимой функции этих генов для развития сердца 4,5. Эти фенотипы были спасены путем совместной инъекции мРНК для конкретных генов. Исследование с участием сердечного тропонина T (Tnnt2) показало, что экспрессия полноразмерной мРНК tnnt2 может спасти саркомерные фенотипы, вызванные нокдауном морфолино6. Другое исследование показало, что целостность A-полос и Z-дисков может быть восстановлена за счет сверхэкспрессии мРНК регуляторного ортолога легкой цепи миозина (cmlc2) в морфантах cmcl2 7.
МО обычно используются для подавления экспрессии генов путем нацеливания на сплайсинг пре-мРНК или блокирования трансляции. MOs, блокирующие сплайс, связывают и ингибируют пре-мРНК путем ингибирования сплайсомы. Трансляционная блокировка происходит, когда MO связывается с 5'-нетранслируемой областью комплементарной мРНК, препятствуя сборке рибосом. МО являются наиболее широко используемым геноспецифическим методом подавления экспрессии генов для моделей in vivo ; они также являются наиболее эффективными блокаторами мРНК, используемыми в клеточных культурах. Сам морфолино обычно состоит из короткоцепочечной (около 25) субъединицных оснований морфолино. Каждая субъединица MO включает основание нуклеиновой кислоты, морфолиновое кольцо и неионогенный фосфориамидат. Различные механизмы действия двух типов МО требуют проведения различных тестов для проверки эффективности нокдауна. Для блокирования трансляции МО вестерн-блоттинг является наиболее надежным тестом эффективности, так как интересующий белок не должен вырабатываться из-за блокировки сайта начала трансляции ATG. МО не разрушают непосредственно свою мишенную мРНК; Вместо этого они связываются с определенными областями и подавляют экспрессию до тех пор, пока не разрушатся естественным образом. Тем не менее, МО, блокирующие сплайс, модифицируют пре-мРНК, индуцируя модификацию сплайсинга, которая может быть проанализирована с помощью полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР) и гель-электрофореза.
Три важнейшие части процесса скрининга МО должны быть стандартизированы: (i) Кривая дозы МО должна быть настроена на фенотипическое распознавание. Кривая дозы также показывает летальную дозу 50 (ЛД50: доза, при которой погибает 50% введенных эмбрионов) для каждого тестируемого МО для улучшения способности оптимизировать фенотипический «сигнал» по сравнению с нецелевым «шумом»3. (ii) адаптированная номенклатура фенотипирования должна быть хорошо задокументирована; Точное и легко понятное фенотипическое описание имеет решающее значение для предоставления обширных объяснений, основанных на существующей литературе и опыте исследователей, чтобы облегчить обмен информацией между теми, кто непосредственно не исследовал эмбрионы. (iii) Наличие четко определенного языка облегчает централизованный сбор данных из базы данных Morpholino8.
В исследованиях нокдауна МО для сердечных генов необходимо контролировать сердечную деятельность животных и динамику кровотока, чтобы определить влияние экспериментов с нокдауном МО на функцию сердечно-сосудистой системы. Такие анализы требуют визуализации сердечно-сосудистой системы в режиме реального времени с высоким разрешением. Кожа рыбок данио прозрачна в течение первой недели развития, что позволяет визуализировать сердце и кровообращение с помощью микроскопии. Для оценки функции сердца наиболее рассчитываемыми физиологическими параметрами являются частота сердечных сокращений и сердечный выброс, а также фракционное укорочение, изменение фракционной площади и фракция выброса. Скорость кровотока может быть измерена путем отслеживания движущихся эритроцитов, и эти измерения используются для определения уровней напряжения сдвига, важного механобиологического фактора на эндотелиальных клетках. Для такой оценки необходимо записывать покадровые видеоролики о бьющемся сердце и протекающей крови с помощью перевернутого или стереомикроскопа, оснащенного высокоскоростной камерой.
В этой статье показано, как спроектировать, приготовить и микроинъекцию морфолино, блокирующего трансляцию, против интересующего гена в желток только что оплодотворенных эмбрионов рыбок данио, чтобы подавить функцию гена. Он также покажет спасение этих «морфантов» путем совместной инъекции мРНК, кодирующей этот ген. Затем мы проанализируем эффективность микроинъекций морфолино с помощью фенотипических характеристик, а также структурного и функционального анализа сердца. Этот подход будет продемонстрирован на широко изученном сердечном гене HAND2.
Access restricted. Please log in or start a trial to view this content.
протокол
Все эксперименты проводились в соответствии с принятыми стандартами гуманного ухода за животными в соответствии с регламентом IACUC при QU; животные содержались в центре данио-рерио при Центре биомедицинских исследований Катарского университета (QU-BRC). Все животные, использованные в этих экспериментальных исследованиях, находились в течение 3 дней после оплодотворения (dpf).
Примечание: Для каждой экспериментальной группы рекомендуется использовать не менее 30 эмбрионов для статистической строгости. Экспериментальными группами являются:
Контрольная группа: К этой группе относятся эмбрионы, культивируемые в яичной воде без каких-либо инъекций. Результаты здесь сформируют контрольную базу.
Группа негативного контроля: В эту группу входят эмбрионы, культивируемые в яичной воде с введением омлета MOs.
Группа вводимых: В эту группу входят эмбрионы, которым вводили только hand2 MO и hand2 MO с мРНК hand2 для спасения фенотипа. Полученные результаты подтвердят, что наблюдаемые фенотипы появились в результате введения МО. Сравнение экспериментальных групп позволит точно оценить влияние ингибирования и спасения кисти2 на функцию сердца.
1. Морфолино конструкции для рук2.
ПРИМЕЧАНИЕ: Последовательности MO могут быть адаптированы из литературы 9,10,11. В качестве альтернативы, эти олигопласты могут быть сконструированы онлайн с помощью Gene-tools. Gene-tools предлагает бесплатный и быстрый онлайн-сервис дизайна, доступ к которому можно получить через их веб-сайт12. Пользовательский МО может быть легко спроектирован путем предоставления информации об интересующих генах, такой как информация о последовательности или номера доступа. Следующие конкретные шаги обобщают то, как спроектировать MO против hand2 в данио-рерио:
- Во-первых, найдите подробную информацию об интересующем гене в базе данных NCBI. Для руки2, у рыбок данио13.
- Получите идентификатор транскрипта мРНК GenBank в NCBI14.
- Получите последовательность мРНК из NCBI15.
ПРИМЕЧАНИЕ: Модифицированные морфолино (MO)-модифицированные антисмысловые олигонуклеотиды для гена hand2 данио-рерио доступны и были ранее опубликованы. рука2 Последовательность MO 9,10,11: 5'-CCTCCAACTAAACTGGCGACAG-3', последовательности MO, использованные в исследовании, перечислены в Таблице материалов. - Получите отрицательный контроль либо от несовпадающего, либо от скремблированного МО (похожие последовательности со случайными изменениями пар оснований) от вводимого генного инструмента16. Это помогло бы подтвердить специфичность фенотипа (фенотипов), наблюдаемых при конкретных инъекциях МО, и свести к минимуму риск того, что наблюдаемые эффекты являются результатом артефакта процедуры инъекции.
2. Приготовление морфолино для инъекций
- Подготовка поголовья
- Растворить запасы MO с помощью ddH2O; Диэтилпирокарбонат (DEPC) может повреждать MO и быть токсичным для эмбрионов. Следовательно, используйте ddH2O, не содержащий DEPC. При заказе МО поставляются во флаконе в концентрации 300 нМ.
ПРИМЕЧАНИЕ: Несмотря на то, что Gene Tools рекомендует 1 мМ стоковые растворы (~8 нг/нл), это может быть слишком мало, особенно если морфолино требует высокой дозы или смешивается с другими MO. Поэтому он идеально подходит для изготовления исходных растворов МО различной концентрации (2 или 3 мМ). - Приготовьте рабочий раствор в концентрации 0,2 мМ путем субразбавления рабочего раствора (т.е. для запаса в 2 мМ разведение 1:10). Приготовьте 10 μL рабочего раствора, добавив раствор Данье (7 μL), бульонный морфолино (1 μл) и феноловый красный (2 мкл из 10 мкл). Феноловый красный придает раствору темно-красный цвет, чтобы помочь проследить введенный материал в эмбрионе.
- Храните МО при комнатной температуре (RT) в герметичных контейнерах, чтобы предотвратить испарение. Не держите МО на льду на столе, так как раствор может выпасть в осадок. Наиболее подходящим является обращение с RT.
ПРИМЕЧАНИЕ: Gene Tools рекомендует один из двух методов хранения MO: рабочий раствор можно хранить при температуре -20 °C (в течение многих месяцев или лет) или RT в герметичной пробирке для длительного хранения. При хранении при температуре -20 °C нагрейте раствор олигонуклеотида до 65 °C в течение 10 минут и сделайте вихрем для полного растворения морфолино перед использованием (не нужно нагревать его при температуре RT).
- Растворить запасы MO с помощью ddH2O; Диэтилпирокарбонат (DEPC) может повреждать MO и быть токсичным для эмбрионов. Следовательно, используйте ddH2O, не содержащий DEPC. При заказе МО поставляются во флаконе в концентрации 300 нМ.
- Транскрипция мРНК in vitro
ПРИМЕЧАНИЕ: Транскрипция in vitro была использована для получения мРНК Hand2 из клона ORF плазмиды HAND2 (NM_021973) для микроинъекции эмбрионам данио-рерио для спасения фенотипа, вызванного сбиванием руки данио-рерио2 с помощью морфолиноса, детали плазмиды, использованные в исследовании, перечислены в таблице материалов.- Линеаризируйте плазмидную ДНК с помощью соответствующего фермента рестрикции и очистите с помощью набора для очистки ДНК (Таблица материалов). Используйте очищенную линеаризованную ДНК в качестве матрицы для транскрипции in vitro для получения мРНК для инъекций в соответствии с инструкциями производителя (Таблица материалов).
- Наконец, введите 250 пг мРНК человека в интересующий ген, чтобы выполнить спасение фенотипа, чтобы проверить, действительно ли отсутствие фенотипа связано с потерей гена данио-рерио из-за МО.
- Подготовка к инъекции
- Потяните иглу с помощью микропипетки (Таблица материалов), следуя шагам 2.3.2-2.3.6.
- Используйте капиллярные трубки диаметром 1 мм с нитями накаливания и микропипетку Puller. Включите машину и откройте крышку
- Поверните ручку выбора режима в положение NO.2 Нагреватель. Используя нагреватель No 2 , отрегулируйте ручку, чтобы довести температуру до 68 °C
- Поверните ручку выбора режима обратно в положение шага 1 . Используйте четыре груза (2 типа легких / 2 типа тяжелых)
- Поместите капилляр на держатель и закройте крышку. Нажмите кнопку «Пуск », чтобы достать вытянутую иглу.
ПРИМЕЧАНИЕ: При этом образуются капиллярные иглы с длинным конусом - Коротко обрежьте кончик игл, используя щипцы. Заточите кончик вытянутой иглы для легкого проникновения в эмбрионы данио-рерио с помощью капиллярного скоса в течение примерно 30 с, в результате чего получаются кончики диаметром около 15-25 мкм.
- Откалибруйте иглу для оценки объема инъекции в соответствии с шагами 2.3.8-2.3.13.
- Перед загрузкой в иглу быстро перемешайте раствор мРНК/морфолино, чтобы растворить частицы, которые могут полностью закупорить иглу.
- Добавьте ~3-4 мкл раствора MO в заднюю часть инъекционной иглы с помощью наконечника пипетки с микронным наконечником. Инъекционные иглы оснащены небольшой траншеей для облегчения капиллярного засыпания.
- Убедитесь, что в игле для инъекций нет пузырьков. Установите иглу на микроинъектор.
- Убедитесь, что кончик иглы не забит и что раствор MO может вытекать из иглы, нажав на педаль инъекции.
- Откалибруйте объем инъекции, измерив размер капли. Положите кончик иглы в минеральное масло на предметное стекло микрометра. Нажмите на педаль впрыска и отрегулируйте давление впрыска (фунт/кв. дюйм) и/или время впрыска (мс) до тех пор, пока диаметр выбрасываемой капли не составит 0,1 мм, что соответствует 0,5 нл.
- Следите за тем, чтобы объем инъекции составлял около 0,5-1 нл. Отрегулируйте объем, изменив давление впрыска (фунт/кв. дюйм) или время (мс).
- Для протокола настройки пиколитрового инжектора выполните шаги 2.3.15-2.3.16
- Используйте инъектор пиколитера для инъекций рыбок данио. Включите питательный насос инжектора.
- Подготовьте инжектор в соответствии с требованиями, указанными ниже:
- P-баланс: Убедитесь, что P-balance находится в районе 0. Следите за тем, чтобы он был немного отрицательным, чтобы желток не затекал обратно в иглу, разводя раствор МО в игле. И наоборот, если противодавление слишком высокое, МО будет постоянно вытекать из иглы даже без приложения давления на педаль, что приводит к вариабельности и несоответствиям вводимой дозы и наблюдаемых фенотипов.
- P-впрыск: 20-25 фунтов на квадратный дюйм идеально; Измените это, чтобы отрегулировать объем впрыска. Это может быть от 10 до 30 фунтов на квадратный дюйм, но начните с ~20 фунтов на квадратный дюйм, чтобы проверить, обеспечивает ли он желаемый объем.
- Время впрыска :Убедитесь, что время инъекции сокращено до 300 мс. Перед регулировкой объема инъекции внесите коррективы во время инъекции.
- Для инъекции морфолина выполните шаги 2.3.18-2.3.19.
- Подготовьте инъекционную камеру следующим образом: Внесите 2% агарозы из 0,6 г агарозы и 30 мл среды Е3. Вылейте агарозу в чашку Петри и установите на нее форму для литья под давлением с помощью формы для литья под давлением TU-1. После охлаждения в морозильной камере образуются борозды для размещения и стабилизации эмбрионов (Рисунок 1A).
ПРИМЕЧАНИЕ: Рецептура стокового раствора E3M 60x состоит из 5,0 мМ NaCl, 0,17 мМ KCl, 0,16 мМ MgSO4·7H2O, 0,4 мМ CaCl2·2H2O в 1 л ddH2O с конечным pH 7,6. - Перенесите собранные эмбрионы в борозды с помощью трансферной пипетки, удалите все излишки среды E3 вокруг эмбрионов, чтобы предотвратить всплытие эмбрионов (рис. 1B).
3. Введение раствора МО и мРНК в желток
- Введите иглу через хорион, введите рядом с границей клетки/желтка со стороны эмбриона и нажмите на педаль инъекции (рисунок 1C).
ПРИМЕЧАНИЕ: Введенный раствор MO/феноловый красный не будет немедленно диффундировать внутри желтка. В желтке будет наблюдаться красное пятно, которое постепенно рассеивается. Вводимый материал не должен превышать более 10% от размера эмбриона. МО могут быть микроинъецированы в желток вновь отложенных яиц рыбок данио на стадии до 8 клеток, поскольку МО могут легко поглощаться развивающимися клетками в цитоплазматическом потоке желточного мешка17,18. При инъекциях плазмиды или кэпированной мРНК инъекция должна быть выполнена в один бластомер эмбриона одноклеточной стадии. - Перенесите эмбрионы в чашку Петри со средой Е3 и инкубируйте их при 28 °С до 3 дпф, с ежедневным пополнением среды Е3. На этом этапе проведите фенотипическую оценку с помощью микроскопа.
Примечание: Растворы MO должны быть тщательно разбавлены для каждого исследования, чтобы установить самую низкую концентрацию, необходимую для индуцирования конкретного фенотипа. Также должна быть определена эмбриональная летальность для каждого МО. При более высоких концентрациях (выше 4-10 нг, в зависимости от МО) МО имеют тенденцию вызывать неспецифические эффекты, такие как гибель мозга или общей гибели клеток. - Таким же образом введите MO с 250 пг мРНК человеческой руки2, чтобы подтвердить спасение фенотипа, вызванное потерей гена руки данио-рерио2 методом MO.
4. Вестерн-блот для проверки успешности нокдауна морфолино
- Соберите эмбрионы в определенные моменты времени (48 hpf, 72 hpf) и при необходимости дехорионат, используя фермент проназу.
- Дежелтирование эмбрионов для удаления вителлогенина с использованием ранее известной методики19.
ПРИМЕЧАНИЕ: Вителлогенин – это фосфолипогликопротеин, который служит источником питательных веществ для растущего эмбриона. Электрофорез в 2D геле с высоким разрешением и значительно улучшенный вестерн-блоттинг стали возможными благодаря дейолкингу эмбрионов и удалению вителлогенина. - Выполните вестерн-блоттинг, как описано ранее20.
5. Оценка структуры и функции сердца:
- Живая визуализация рыбок данио-рерио: визуализация желудочка
ПРИМЕЧАНИЕ: Некоторые параметры функции сердца/гемодинамики могут быть рассчитаны путем визуализации бьющегося сердца эмбриона данио-рерио 21,22. Эти параметры включают сердечный выброс (CO), фракцию выброса (EF), ударный объем (SV), фракционное укорочение (FS) и изменение фракционной площади (FAC) (см. предыдущие статьи, включающие подробные протоколы оценки сердечной функции эмбрионов данио-рерио22,23). Следующие шаги кратко объясняют, как рассчитать эти параметры для эмбрионов рыбок данио при ~3 dpf, стадии, когда кожа этих организмов прозрачна, что позволяет визуализировать их с помощью светлопольной микроскопии.- Капните каплю 3% раствора метилцеллюлозы (РТ) в предметное стекло вогнутой лунки.
- Поместите эмбрион данио-рерио в лунку с помощью подходящей пластиковой пипетки (рис. 2A, B)
ПРИМЕЧАНИЕ: Переполнение колодца может привести к вытеснению рыбы из скважины. - Аккуратно смешайте 3% каплю метилцеллюлозы со средой E3 для стабилизации вылупившегося эмбриона.
ПРИМЕЧАНИЕ: Для приготовления 3% раствора метилцеллюлозы растворите 3 г порошка метилцеллюлозы в 100 мл PBS или другой монтажной среды в колбе. Поместите магнит для перемешивания в колбу со смесью и поместите колбу на магнитную пластину для перемешивания. Установите скорость на «низкую» и держите ее на уровне 4 °C в течение ~1 дня, чтобы растворить все комки. Как только метилцеллюлоза полностью растворится, разложите по небольшим пробиркам и храните при температуре -20 °C. - Расположите рыбу слева от нее правой стороной вверх и передней точкой влево, чтобы облегчить однозначную визуализацию желудочка (рисунок 2C).
- Под микроскопом увеличьте сердце эмбриона со 100-кратным увеличением и начните запись в течение ~5 секунд. Убедитесь, что границы желудочков находятся внутри окна визуализации (рисунок 2D).
- Записывайте цейтраферные видеоролики с помощью высокоскоростной камеры и стереомикроскопа со скоростью около 100 кадров в секунду (кадр в секунду) всего эмбриона (рисунок 2C), бьющегося желудочка (рисунок 2D) и движущихся эритроцитов (эритроцитов) в крупных сосудах, таких как дорсальная аорта или задняя кардинальная вена (рисунок 2E), для анализа функции сердца.
- Сохраните фильм в формате видео AVI или в формате последовательности изображений TIFF (или JPEG).
- Рассчитать частоту сердечных сокращений
- Рассчитайте время, необходимое для записи двух последовательных кадров. Для 100 кадров в секунду интервал времени равен 0,01 с.
- Выберите известную точку из любого зарегистрированного сердечного цикла (например, конец диастолы или конец систолы). Рассчитайте количество кадров, необходимое для повторения цикла.
- Умножьте временной интервал с шага 5.2.1 на количество кадров из шага 5.2.2. Результатом является продолжительность времени (в секундах) для одного удара сердца.
- Чтобы рассчитать удары в минуту, разделим 60 на число, полученное на предыдущем шаге. Для нормальных эмбрионов с 3 dpf это должно быть около 150 уд/мин (2,5 Гц).
ПРИМЕЧАНИЕ: Многие программные приложения могут автоматически рассчитывать частоту сердечных сокращений по записям бьющегося сердца, такие как ViewPoint24 и DanioVision25. - Проанализируйте структуру сердца с помощью рекордного покадрового фильма со скоростью около 100 кадров в секунду, чтобы проверить все сердце, чтобы обнаружить наличие сердечного отека или любого другого структурного дефекта.
ПРИМЕЧАНИЕ: На рисунке 3А показано нормальное сердце эмбриона с концентрацией 3 dpf, а на рисунке 3B показано сердце с 3 dpf с отеком сердца и пороком петли сердца (удлиненный желудочек).
- Рассчитайте изменение дробной площади (FAC):
ПРИМЕЧАНИЕ: Изменение фракционной площади (FAC) является параметром, используемым для сравнения областей конечной диастолы и конечной систолы желудочков для оценки сократимости желудочка.- Используйте запись цейтраферного фильма со скоростью около 100 кадров в секунду, чтобы определить кадры, представляющие один сердечный цикл. Извлеките кадры, которые показывают конец как конечной систолы, так и конечной диастолы.
- Рассчитайте как конечную диастолу (EDA), так и конечную систолу (ESA) с помощью ImageJ или аналогичного программного обеспечения для анализа изображений.
- Используйте следующую формулу для расчета FAC 22,26,27:
КВС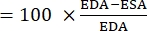
- Рассчитайте дробное укорачивание (ФС):
ПРИМЕЧАНИЕ: Фракционное укорочение (ФС) является еще одним параметром, используемым для оценки сократительной способности желудочка; Для определения ФС необходимо измерить конечный диастолический и конечный систолический диаметры желудочков21.- Повторите шаг 5.3.1
- Используйте ImageJ или любую другую эквивалентную программу анализа изображений для измерения диаметров стенок желудочков в точках конечной диастолы Dd и конечной систолы Ds . В большинстве случаев для определения дробной гладкости (ФС) используются диаметры коротких осей (Рисунок 4).
- Используйте следующую формулу для расчета FS22,27:
ФС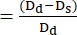
- Расчет объема хода (SV):
ПРИМЕЧАНИЕ: Для каждого удара сердца SV – это количество крови, перекачиваемой из желудочка, которое легко вычислить по объемам конца диастолы и конца систолы желудочков28.- Повторите шаги 5.3.1 и 5.3.2
- Измерьте диаметр конечной диастолы (DL) и конечной систолы (DS), как показано на рисунке 4.
ПРИМЕЧАНИЕ: Предполагая, что желудочки сердец рыбок данио имеют форму вытянутой сфероидальнойформы 21,22, объем желудочка рассчитывается по следующей формуле.
Том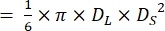
SV можно рассчитать по приведенной ниже формуле27. Нормальный диапазон СО составляет 0,15-0,3 нл для 2-6 эмбрионов с дозой29. Здесь EDV — это объем в конце диастолы, а ESV — объем в конце систолы.
SV = (EDV - ESV)
- Рассчитайте фракцию выброса (EF):
ПРИМЕЧАНИЕ: ФВ определяется как фракция крови, выбрасываемой из желудочка с каждым ударом сердца28.- Из приведенных выше формул извлеките КДВ и ЭСВ для рыб.
- Рассчитаем EF следующим образом: 22,27:
EF (%)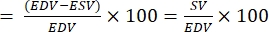
- Рассчитайте сердечный выброс (CO):
ПРИМЕЧАНИЕ: CO – это объем крови, перекачиваемой сердцем28. CO имеет значение 10-55 нл/мин для 2-6 эмбрионов dpf29.- Рассчитайте SV и HR, как упоминалось в предыдущих подразделах 5.5 и 5.2.
- Используйте следующую формулу для расчета CO22,27:
CO (нл/мин) = SV (нл/дол.) x HR (уд/мин).
- Измерьте скорости эритроцитов:
ПРИМЕЧАНИЕ: Определение скорости клеток имеет жизненно важное значение для оценки скорости потока, диаметра сосуда и расчета напряжения сдвига, оказываемого на эндотелиальные клетки сосуда (т.е. напряжение сдвига, с другой стороны, представляет собой силу трения, действующую на эндотелиальные клетки при движении крови). Для 2-5 эмбрионов dpf средняя скорость эритроцитов (эритроцитов) составляет около 300-750 мкм/с29. Чтобы измерить скорости эритроцитов:- Под микроскопом увеличьте хвост животного с увеличением 100x. Движение эритроцитов должно быть видно при этом увеличении (рис. 5A, B).
- Начните запись примерно на 8 секунд. Убедитесь, что дорсальная аорта (ДА) и задняя кардинальная вена (ПКВ), две наиболее важные аксиальные артерии, находятся на расстоянии 100-120 кадров в секунду внутри окна визуализации. Отслеживание отдельных ячеек по последовательным кадрам (рис. 5A, B).
- Извлеките несколько кадров с помощью ImageJ или другого аналогичного программного обеспечения для анализа изображений.
- Вычислите разницу в расстоянии, на которое перемещается отдельный эритроцит (Δx).
- Определите разницу во времени между последовательными кадрами (Δt).
- Используйте следующую формулу для скорости эритроцитов 22,27:
Скорость эритроцитов (мкм/с)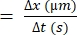
ПРИМЕЧАНИЕ: Максимальная и средняя скорость могут быть получены из повторения последовательных кадров для отдельных ячеек21. Скорость эритроцитов также представляет собой скорость кровотока. В качестве альтернативы можно использовать различные коммерчески доступные программные приложения для автоматического измерения скорости эритроцитов. ViewPoint24, а также DanioVision25 имеют такие приложения (рисунок 5C). Кроме того, существует несколько доступных плагинов с ImageJ, таких как TrackMate30 и MTrackJ31, совместимых с фильмами, записанными со скоростью более 100 кадров в секунду.
- Расчет напряжения сдвига на основе измеренных скоростей ячеек
Измеренные скорости эритроцитов в кровеносных сосудах также представляют собой скорости кровотока (Рисунок 5C). На основе этих измерений рассчитать напряжение сдвига τ в интересующем сосуде следующим образом, исходя из предположения о потоке Пуазейля22,27:
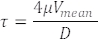
Где V — средняя скорость крови (мкм/с), μ — вязкость крови (дин/см2), а D — диаметр сосуда (мкм). Для эмбрионов с 3 dpf напряжение сдвига в DA 22,26,27 составляет около 4 дин/см 2 .
Access restricted. Please log in or start a trial to view this content.
Результаты
График на рисунке 6 иллюстрирует средний процент эмбрионов, выживающих при 24, 48 и 72 hpf как для HAND2-специфичного MO, так и для контрольных скремблированных MO-инъекционных эмбрионов. Эмбрионы, введенные MO в объеме 1 мМ (8 нг/мкл) и 0,8 мМ (6,4 нг/мкл), показали значи...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Технология морфолино (MO) широко используется в рыбках данио, ксенопусах, морских ежах, а в последнее время и в модельных системах клеточных культур. В большинстве методов, наряду с преимуществами, есть и подводные камни, о которых экспериментатор должен знать. Одним из ...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют о финансовых интересах или ином конфликте интересов.
Благодарности
Публикация этой статьи была освещена при щедрой поддержке со стороны BARZAN HOLDINGS. РР частично поддерживается R61HL154254 и средствами отделения педиатрии и детской больницы.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Acrylamide 40% | Sigma | Sigma, cat. no. C977M88 | |
| Agarose | Sigma-Aldrich | Sigma-Aldrich cat. no A9539-250G | |
| All Prep DNA/RNA Mini Kit | Qiagen | Qiagen cat. no. 80204. | |
| alpha Tubulin | Abcam | Abcam- ab4074 | Rabbit polyclonal to alpha Tubulin lot GR3 180877-1 (50 kDa) |
| Ammonium persulfate molecular grade | Sigma | Sigma, cat. no C991U65 | |
| BV10 capillary beveller | Sutter Instruments Product | Sutter Instruments Product Catalog # BV10 | |
| Chemiluminescence Imaging Gene Gnome | SYNGENE | SYNGENE | |
| Cleaver Scientific Blotting | CVS10D_OmniPAGEMini | CVS10D_OmniPAGEMini | |
| Coomassie | Thermo Fisher | Thermo Fisher cat. no C861C44 | |
| Electrochemiluminescence (ECL) kit | Abcam Biochemicals | Abcam Biochemicals cat. no ab65623 | |
| Glycine | Sigma | Sigma, cat. no C988U91 | |
| Goat anti Rabbit | Abcam | Abcam- ab6721 | Goat Anti-Rabbit IgG H&L (HRP) 2nd antibodies lot GR3179871-1 |
| HAND2 | Gene tools | Custom made for HAND2 (NM_021973) | 5'-CCTCCAACTAAACTCATGGCGAC AG-3' |
| Hand2 | Abcam | Abcam- ab10131 | Rabbit polyclonal Anti-HAND2 antibody lot GR143200-9 (24- 26 kDa) |
| HAND2 (NM_021973) Human Tagged ORF Clone | OriGene Technologies, Inc | RC224436L3 | Vector: pLenti-C-Myc-DDK-P2A-Puro (PS100092) |
| IBI DNA/RNA/Protein Extraction Kit | IBI Scientific | IBI Scientific cat. no -r IB47702 | |
| Imaging System | iBright | iBright CL1000 Imaging System | |
| Isopropanol | Sigma-Aldrich | Sigma-Aldrich cat. no 278475-2L | |
| Laemmli sample loading buffer (4x) | Sigma-Aldrich | Sigma-Aldrich cat. no 70607 | |
| Mercaptoethanol | Sigma | Sigma, cat. no M6250-1L | |
| Microplate Spectrophotometer with the Gen5 Data Analysis software interface | Epoch | Epoch | |
| Microscope | Ziess SteREO Lumar V12 Flourescence Microscope | Ziess SteREO Lumar V12 Flourescence Microscope | |
| Mineral oil | Fisher Scientific | Fisher Scientific cat. no 0121-1 | |
| mMESSAGE mMACHINE T7/T3/SP6 Transcription Kit | Thermo Fisher | Thermo Fisher cat. no.AM1340 | for mRNA generation |
| Nuclease-free water | New England Biolabs | New England Biolabs cat. no B1500L | |
| PC-100 Micropipette Puller | NARISHIGE GROUP Product | NARISHIGE GROUP Product Catalog # PC-100 | |
| Phenol red | Sigma | Sigma, cat. no. P-0290 | |
| Picolitre Injector | Harvard Apparatus | Harvard Apparatus cataloge # PLI-90A | |
| Pierce Bicinchoninic acid assay (BCA) Protein Assay kit | Thermo Fisher | Thermo Fisher cat. no 23227 | |
| PMSF, Protease inhibitor as protease inhibitors | Thermo Fisher | Thermo Fisher cat. no 36978 | |
| Ponceau S | Sigma-Aldrich | Sigma-Aldrich cat. no 10165921001 | |
| Protease Inhibitor Cocktail | Thermo Fisher | Thermo Fisher cat. no 88668 | |
| Protein ladder | SMOBiO | SMOBiO cat. no PM2500 | |
| Radioimmunoprecipitation Assay (RIPA) | Thermo Fisher | Thermo Fisher cat. no 89900 | |
| Ringer’s solution | Thermofisher | Catalog No.S25513 | |
| SDS | Sigma | Sigma, cat. no 436143 | |
| Standard Control | Gene tools | SKU: PCO-StandardControl-100 | 5'-CCTCTTACCTCAGTTACAATTTAT A-3'- that targets a human beta-globin intron mutation |
| Stripping buffer | Sigma-Aldrich | Sigma-Aldrich cat. 21059 | |
| Temed | IBI scientific | IBI scientific cat. no C000A52 | |
| Tris Base | Thermo Fisher | Thermo Fisher cat. no BP-152-500 | |
| Tween | sigma life science | sigma life science cat. no P2287 | |
| Zebra Box Revolution-Danio Track system chamber with the EthoVision XT 11.5 software | Noldus Information Technology, NL | Noldus Information Technology, NL | |
| Zeiss Axiocam ERc 5s | Zeiss | Stemi 508 Zeiss | |
| Zeiss Stemi 2000-C | Zeiss | Stemi 2000-C |
Ссылки
- Bakkers, J. Zebrafish as a model to study cardiac development and human cardiac disease. Cardiovascular Research. 91 (2), 279-288 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Stainier, D. Y., et al. Guidelines for morpholino use in zebrafish. PLoS Genetics. 13 (10), 1007000(2017).
- Zhou, B., et al. Epicardial progenitors contribute to the cardiomyocyte lineage in the developing heart. Nature. 454 (7200), 109-113 (2008).
- Eve, A. M., Place, E. S., Smith, J. C. Comparison of Zebrafish tmem88a mutant and morpholino knockdown phenotypes. PLoS One. 12 (2), 0172227(2017).
- Huang, W., Zhang, R., Xu, X. Myofibrillogenesis in the developing zebrafish heart: A functional study of tnnt2. Developmental Biology. 331 (2), 237-249 (2009).
- Chen, Z., et al. Depletion of zebrafish essential and regulatory myosin light chains reduces cardiac function through distinct mechanisms. Cardiovascular Research. 79 (1), 97-108 (2008).
- Bedell, V. M., Westcot, S. E., Ekker, S. C. Lessons from morpholino-based screening in zebrafish. Briefings in Functional Genomics. 10 (4), 181-188 (2011).
- Reichenbach, B., et al. Endoderm-derived Sonic hedgehog and mesoderm Hand2 expression are required for enteric nervous system development in zebrafish. Developmental Biology. 318 (1), 52-64 (2008).
- Maves, L., Tyler, A., Moens, C. B., Tapscott, S. J. J. Pbx acts with Hand2 in early myocardial differentiation. Developmental Biology. 333 (2), 409-418 (2009).
- Hinits, Y., et al. Zebrafish Mef2ca and Mef2cb are essential for both first and second heart field cardiomyocyte differentiation. Developmental Biology. 369 (2), 199-210 (2012).
- Gene Tools, custom-sequence Morpholinos. , Available from: https://oligodesign.gene-tools.com/ (2011).
- hand2 heart and neural crest derivatives expressed 2 [ Danio rerio (zebrafish). , Available from: https://www.ncbi.nlm.nih.gov/gene/58150 (2021).
- Danio rerio heart and neural crest derivatives expressed 2 (hand2), mRNA. , Available from: https://www.ncbi.nlm.nih.gov/nuccore/NM_131626.3 (2021).
- NCBI reference sequence -Danio rerio heart and neural crest derivatives expressed 2 (hand2), mRNA FASTA. , hand2), mRNA FASTA at (2021). Prepared control oligos at (2021).
- Prepared control oligos. , Available from: https://store.gene-tools.com/prepared-control-oligos (2021).
- Schubert, S., Keddig, N., Hanel, R., Kammann, U. Microinjection into zebrafish embryos (Danio rerio)-a useful tool in aquatic toxicity testing. Environmental Sciences Europe. 26 (1), 32(2014).
- Moulton, J. D. Guide for morpholino users: toward therapeutics. Journal of Drug Discovery, Development, and Delivery. 3 (2), 1023(2016).
- Link, V., Shevchenko, A., Heisenberg, C. -P. Proteomics of early zebrafish embryos. BMC Developmental Biology. 6 (1), 1(2006).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. Journal of Visualized Experiments: JoVE. (44), e2359(2010).
- Shin, J. T., Pomerantsev, E. V., Mably, J. D., MacRae, C. A. High-resolution cardiovascular function confirms functional orthology of myocardial contractility pathways in zebrafish. Physiological Genomics. 42 (2), 300-309 (2010).
- Yalcin, H. C., Amindari, A., Butcher, J. T., Althani, A., Yacoub, M. Heart function and hemodynamic analysis for zebrafish embryos. Developmental Dynamics: An Officical Publication of the American Association of Anatomists. 246 (11), 868-880 (2017).
- Zakaria, Z. Z., et al. Using zebrafish for investigating the molecular mechanisms of drug-induced cardiotoxicity. Biomed Research International. 2018, 1642684(2018).
- Parker, T., et al. A multi-endpoint in vivo larval zebrafish (Danio rerio) model for the assessment of integrated cardiovascular function. Journal of Pharmacological and Toxicological Methods. 69 (1), 30-38 (2014).
- Grone, B. P., et al. Epilepsy, behavioral abnormalities, and physiological comorbidities in syntaxin-binding protein 1 (STXBP1) mutant zebrafish. PLoS One. 11 (3), 0151148(2016).
- Salman, H. E., Yalcin, H. C. Advanced blood flow assessment in Zebrafish via experimental digital particle image velocimetry and computational fluid dynamics modeling. Micron. 130, 102801(2020).
- Benslimane, F. M., et al. Cardiac function and blood flow hemodynamics assessment of zebrafish (Danio rerio) using high-speed video microscopy. Micron. 136, 102876(2020).
- DeGroff, C. G. Doppler echocardiography. Pediatric Cardiology. 23 (3), 307-333 (2002).
- Bagatto, B., Burggren, W. A three-dimensional functional assessment of heart and vessel development in the larva of the zebrafish (Danio rerio). Physiological and Biochemical Zoology. 79 (1), 194-201 (2005).
- Tinevez, J. -Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods (San Diego, Calif.). 115, 80-90 (2017).
- Meijering, E., Dzyubachyk, O., Smal, I. Methods for cell and particle tracking. Methods in Enzymology. 504, 183-200 (2012).
- Kok, F. O., et al. Reverse genetic screening reveals poor correlation between morpholino-induced and mutant phenotypes in zebrafish. Developmental Cell. 32 (1), 97-108 (2015).
- Sumanas, S. Inducible inhibition of gene function with photomorpholinos. Methods in Molecular Biology. 1565, Clifton, N.J. 51-57 (2017).
- Kyritsi, K., et al. Knockdown of hepatic gonadotropin-releasing hormone by vivo-morpholino decreases liver fibrosis in multidrug resistance gene 2 knockout mice by down-regulation of miR-200b. The American Journal of Pathology. 187 (7), 1551-1565 (2017).
- Flynt, A. S., Rao, M., Patton, J. G. Blocking zebrafish microRNAs with morpholinos. Methods in Molecular Biology. 1565, Clifton, N.J. 59-78 (2017).
- Schoenebeck, J. J., Keegan, B. R., Yelon, D. Vessel and blood specification override cardiac potential in anterior mesoderm. Developmental Cell. 13 (2), 254-267 (2007).
- Lu, F., Langenbacher, A., Chen, J. -N. Transcriptional regulation of heart development in zebrafish. Journal of Cardiovascular Development and Disease. 3 (2), 14(2016).
- Laurent, F., et al. HAND2 target gene regulatory networks control atrioventricular canal and cardiac valve development. Cell Reports. 19 (8), 1602-1613 (2017).
- Miura, G. I., Yelon, D. A guide to analysis of cardiac phenotypes in the zebrafish embryo. Methods in Cell Biology. 101, 161-180 (2011).
- De Luca, E., et al. ZebraBeat: a flexible platform for the analysis of the cardiac rate in zebrafish embryos. Scientific Reports. 4, 4898(2014).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены