JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
심장 발달의 특정 유전자 기능을 규명하기 위해 제브라피시 배아에 Morpholino Antisense 올리고뉴클레오티드 및 mRNA의 설계 및 미세주입
요약
본 프로토콜은 대표적인 심장 유전자에 대해 번역 차단 모르폴리노를 설계, 준비 및 미세 주입하는 것을 설명합니다. Heart And Neural Crest Derivatives는 유전자 기능을 무너뜨리기 위해 새로 수정된 제브라피시 배아의 난황에 2(손2) 을 표현했습니다. 또한 이 유전자 산물을 암호화하는 mRNA의 동시 주입에 의한 이러한 "morphants"의 일시적인 구조를 보여줍니다.
초록
morpholino oligomer 기반 knockdown system은 손실 또는 발현 감소를 통해 다양한 유전자 산물의 기능을 확인하는 데 사용되었습니다. 모르폴리노(MO)는 효소 분해에 취약하지 않기 때문에 DNA 올리고에 비해 생물학적 안정성에서 이점이 있습니다. 최적의 효과를 위해 MO를 1-4개의 세포기 배아에 주입합니다. 넉다운의 시간적 효능은 가변적이지만, MO는 결국 희석으로 인해 효과를 잃는 것으로 여겨집니다. Morpholino 희석 및 주입량을 면밀히 조절하여 on-target 효능을 유지하면서 off-target 효과의 발생을 최소화해야 합니다. CRISPR/Cas9와 같은 추가 보완 도구를 관심 대상 유전자에 대해 수행하여 돌연변이 세포주를 생성하고 이러한 세포주를 가진 morphant 표현형을 확인해야 합니다. 이 논문은 hand2에 대한 번역 차단 모르폴리노를 설계, 준비 및 1-4 세포 단계 제브라피시 배아의 난황에 미세주입하여 hand2 기능을 녹다운하고 해당 cDNA를 인코딩하는 mRNA의 동시 주입을 통해 이러한 "모르펀트"를 구출하는 방법을 보여줍니다. 그 후, 모르폴리노 미세주입제의 효능은 먼저 노른자(페놀 레드와 함께 주입)에 모르폴리노의 존재를 확인한 다음 표현형 분석을 통해 평가합니다. 또한 녹다운 효능을 테스트하기 위한 심장 기능 분석에 대해 논의합니다. 마지막으로, 웨스턴 블로팅(western blotting)을 통한 모르폴리노(morpholino)에 의한 유전자 번역 차단의 효과를 평가하는 것이 설명될 것입니다.
서문
심혈관 발달 및 질병 연구를 위한 모델로 제브라피시를 활용하면 유전자 기능의 높은 보존, 광학 투명도, 빠른 심혈관 발달, 기존 생체 내 모델과 비교할 때 저렴한 비용 등 다양한 이점을 제공합니다1. 모르폴리노 올리고뉴클레오티드(MO)는 제브라피시 모델에 가장 일반적으로 사용되는 안티센스 유전자 녹다운 도구입니다. MO는 표현형을 결정하거나 유전자 기능을 조사하는 데 자주 사용됩니다. 제임스 서머턴(James Summerton) 박사는 인간 발달 결함에 대한 치료제를 개발하기 위한 시도로 mRNA 번역의 생체 내 억제를 위한 모르폴리노 전달 시스템을 처음 개발했습니다 2,3. MO는 유전자를 knockdown하고 표현형에 대한 이러한 knockdown의 결과를 조사하기 위해 in vitro 및 in vivo 모델 유기체에 사용되었습니다. 이것은 예를 들어 심장과 같은 특정 기관의 발달 변화를 관찰함으로써 이루어집니다. WT 제브라피시 배아에서 심장 특이적 유전자의 녹다운은 적절한 심장 박동의 실패로 이어졌으며, 이는 심장 발달에 대한 이러한 유전자의 필수 기능을 입증합니다 4,5. 이러한 표현형은 특정 유전자에 대한 mRNA의 동시 주입에 의해 구출되었습니다. 심장 트로포닌 T(Tnnt2)와 관련된 연구는 전장 tnnt2 mRNA의 발현이 모르폴리노 녹다운(morpholino knockdown)으로 인한 육종 표현형을 구제할 수 있음을 보여주었다6. 또 다른 연구에서는 cmcl2 morphants에서 조절 미오신 경쇄 ortholog(cmlc2) mRNA의 과발현에 의해 A-밴드 및 Z-디스크의 무결성이 복원될 수 있음을 밝혔습니다7.
MO는 일반적으로 pre-mRNA 스플라이싱을 표적으로 하거나 번역을 차단하여 유전자 발현을 억제하는 데 사용됩니다. 스플라이스 차단 MO는 스플라이솜을 억제하여 pre-mRNA와 결합하고 억제합니다. 번역 차단은 MO가 상보적 mRNA의 5'-번역되지 않은 영역에 결합하여 리보솜 조립을 방해할 때 발생합니다. MO는 in vivo 모델의 유전자 발현을 knockdown하는 데 가장 널리 사용되는 유전자 특이적 방법입니다. 또한 세포 배양에 사용되는 가장 효율적인 mRNA 차단제입니다. morpholino 자체는 일반적으로 morpholino subunit bases의 짧은 사슬 (약 25)로 구성됩니다. 각 MO 소단위체는 핵산 염기, 모르폴린 고리 및 비이온성 포스포로디아미데이트를 포함합니다. 두 가지 유형의 MO에 대한 작용 메커니즘이 다르기 때문에 녹다운의 효능을 검증하기 위해 서로 다른 테스트가 필요합니다. translation blocking MO의 경우, 웨스턴 블롯 분석은 ATG translation start site의 막힘으로 인해 관심 단백질이 생성되어서는 안 되기 때문에 가장 신뢰할 수 있는 효능 테스트입니다. MO는 타겟 mRNA를 직접 분해하지 않습니다. 대신, 그들은 특정 영역에 결합하고 자연적으로 분해될 때까지 발현을 억제합니다. 그러나 스플라이스 차단 MO는 스플라이스 변형을 유도하여 pre-mRNA를 변형시키며, 이는 역전사효소 중합효소연쇄반응(RT-PCR) 및 겔 전기영동에 의해 분석될 수 있습니다.
MO 스크리닝 프로세스의 세 가지 중요한 부분을 표준화해야 합니다: (i) MO 선량 곡선은 표현형 인식을 위해 조정되어야 합니다. 선량 곡선은 또한 표현형 '신호'와 비표적 '노이즈'를 최적화하는 능력을 향상시키기 위해 테스트된 각 MO에 대한 치사량 50(LD50: 주입된 배아의 50%가 죽는 선량)을 보여줍니다3. (ii) 조정된 표현형 명명법은 잘 문서화되어야 합니다. 정확하고 쉽게 이해할 수 있는 표현형 설명은 배아를 직접 검사하지 않은 사람들 간의 정보 공유를 용이하게 하기 위해 기존 문헌 및 연구자 경험을 기반으로 광범위한 설명을 제공하는 데 중요합니다. (iii) 잘 정의된 언어가 있으면 Morpholino Database8에서 중앙에서 데이터를 쉽게 수집할 수 있습니다.
심장 유전자에 대한 MO 녹다운 연구에서는 MO 녹다운 실험이 심혈관계 기능에 미치는 영향을 결정하기 위해 동물의 심장 활동과 혈류 역학을 모니터링해야 합니다. 이러한 분석에는 고해상도로 심혈관 시스템을 실시간으로 시각화해야 합니다. 제브라피시 피부는 개발 첫 주 동안 투명하여 현미경을 통해 심장과 혈액 순환을 시각화할 수 있습니다. 심장 기능 평가를 위해 가장 많이 계산된 생리학적 매개변수는 심박수 및 심박출량뿐만 아니라 분수 단축, 분수 면적 변화 및 박출률입니다. 혈류 속도는 움직이는 적혈구를 추적하여 측정할 수 있으며, 이러한 측정은 내피 세포의 중요한 기계생물학적 요인인 전단 응력 수준을 결정하는 데 사용됩니다. 이러한 평가를 위해서는 고속 카메라가 장착된 도립 현미경 또는 실체 현미경을 통해 심장 박동과 혈류의 혈액 박동을 보여주는 타임랩스 동영상을 녹화해야 합니다.
이 논문은 유전자 기능을 무너뜨리기 위해 갓 수정된 제브라피시 배아의 노른자에 관심 유전자에 대해 번역 차단 모르폴리노를 설계, 준비 및 미세 주입하는 방법을 보여줍니다. 또한 이 유전자를 암호화하는 mRNA를 동시 주입하여 이러한 "morphants"를 구하는 것을 보여줄 것입니다. 그런 다음 표현형 특성화와 심장 구조 및 기능 분석을 통해 morpholino 미세주입제의 효능을 분석할 것입니다. 이 접근법은 널리 연구된 심장 유전자인 hand2에서 입증될 것입니다.
프로토콜
모든 실험은 QU의 IACUC 규정에 따라 허용되는 인도적 동물 관리 표준에 따라 수행되었습니다. 동물들은 카타르 대학 생물 의학 연구 센터(QU-BRC) 산하 제브라피시 시설에 보관되었습니다. 이 실험 연구에 사용된 모든 동물은 수정 후 3일(dpf) 미만이었습니다.
참고: 각 실험 그룹에 대해 통계적 엄격성을 위해 최소 30개의 배아를 사용하는 것이 좋습니다. 실험 그룹은 다음과 같습니다.
대조군: 이 그룹에는 주사 없이 난수에서 배양된 배아가 포함됩니다. 여기의 결과는 제어 기준선을 형성합니다.
부정적 대조군 : 이 그룹에는 스크램블된 MO가 주입된 난수에서 배양된 배아가 포함됩니다.
주입된 그룹: 이 그룹에는 표현형을 구하기 위해 hand2 MO만 주입된 배아와 hand2 mRNA가 포함된 hand2 MO가 포함됩니다. 여기서의 결과는 주입된 MO로 인해 관찰된 표현형이 나타났음을 확인할 것입니다. 실험군을 비교하면 hand2 가 심장 기능에 미치는 억제 및 구제의 영향을 정확하게 평가할 수 있습니다.
1. Morpholino는 hand2를 위해 디자인합니다.
참고: MO 서열은 문헌 9,10,11에서 적용할 수 있습니다. 또는 이러한 올리고는 유전자 도구에 의해 온라인으로 설계될 수 있습니다. Gene-tools는 웹사이트를 통해 액세스할 수 있는 빠른 무료 온라인 디자인 서비스를 제공합니다12. 맞춤형 MO는 서열 정보 또는 식별 번호와 같은 관심 유전자에 대한 정보를 제공함으로써 쉽게 설계할 수 있습니다. 다음 특정 단계는 제브라피시에서 hand2에 대해 MO를 설계하는 방법을 요약합니다.
- 먼저 NCBI 데이터베이스에서 관심 유전자의 세부 정보를 검색합니다. 핸드2의 경우 제브라피시13.
- NCBI14에서 GenBank mRNA 전사체 ID를 가져옵니다.
- NCBI15에서 mRNA 염기서열을 얻습니다.
참고: 제브라피시 hand2 유전자에 대한 Morpholino (MO) 변형 안티센스 올리고뉴클레오티드를 사용할 수 있으며 이전에 발표되었습니다. 핸드2 MO 서열 9,10,11: 5'-CCTCCAACTAAACTCATGGCGACAG-3', 연구에 사용된 MO 서열은 재료 표에 나열되어 있습니다. - 주입할 유전자 도구16에서 일치하지 않거나 스크램블된 MO(무작위 염기쌍 변화가 있는 유사한 서열)에서 음성 대조군을 얻습니다. 이는 특정 MO 주입에서 관찰된 표현형의 특이성을 입증하고 관찰된 효과가 주입 절차의 인공물에서 비롯된 위험을 최소화하는 데 도움이 됩니다.
2. morpholino 주입의 준비
- 재고 준비
- ddH2O로 MO 주식을 용해합니다. 디에틸 피로탄산염(DEPC)은 MO를 손상시키고 배아에 독성을 유발할 수 있습니다. 따라서 DEPC가 없는 ddH2O를 사용하십시오. 주문 시 MO는 300nM 농도의 바이알에 담겨 전달됩니다.
참고: Gene Tools는 1mM 원액(~8ng/nL)을 권장하지만, 특히 모르폴리노가 고용량이 필요하거나 다른 MO와 혼합된 경우 이 수치가 너무 낮을 수 있습니다. 따라서 다양한 농도의 MO 원액(2 또는 3mM)을 만드는 데 이상적입니다. - 작업 용액을 sub-diluting하여 0.2mM 작업 용액을 준비합니다(즉, 2mM stock의 경우 1:10 희석). Danieaux 용액(7μL), 스톡 모르폴리노(1μL) 및 페놀 레드(10x 스톡에서 2μL)를 추가하여 10μL의 작업 용액을 준비합니다. 페놀 레드는 용액에 짙은 빨간색을 띠어 배아에 주입된 물질을 추적하는 데 도움이 됩니다.
- 증발을 방지하기 위해 밀폐 용기에 MO를 실온(RT)으로 보관하십시오. 용액이 침전될 수 있으므로 MO를 벤치탑의 얼음 위에 두지 마십시오. RT 처리가 가장 적합합니다.
참고 : Gene Tools는 MO에 대해 두 가지 보관 방법 중 하나를 권장합니다. 작업 용액은 -20 ° C (수개월에서 수년)로 보관하거나 장기 보관을 위해 밀봉 된 튜브에 RT로 보관할 수 있습니다. -20 °C에서 유지하는 경우 올리고뉴클레오티드 용액을 65 °C에서 10 분 동안 가열하고 사용하기 전에 모르 폴리노를 완전히 용해시키기 위해 와류를 일으킵니다 (RT에서 유지 할 경우 예열 할 필요가 없음).
- ddH2O로 MO 주식을 용해합니다. 디에틸 피로탄산염(DEPC)은 MO를 손상시키고 배아에 독성을 유발할 수 있습니다. 따라서 DEPC가 없는 ddH2O를 사용하십시오. 주문 시 MO는 300nM 농도의 바이알에 담겨 전달됩니다.
- mRNA의 체외 전사
참고: 체외 전사를 사용하여 Plasmid HAND2 (NM_021973) Human Tagged ORF Clone에서 Hand2의 mRNA를 생성하여 제브라피시 배아에 미세주입하여 morpholinos를 사용하여 제브라피시 Hand2 를 녹다운하여 표현형을 구출했으며, 연구에 사용된 플라스미드 세부 정보는 Table of Materials에 나열되어 있습니다.- 적절한 제한 효소에 의해 plasmid DNA를 선형화하고 DNA purification kit(Table of Materials)를 사용하여 정제합니다. 정제된 선형화된 DNA를 in vitro transcription을 위한 템플릿으로 사용하여 제조업체의 지침에 따라 주입용 mRNA를 생성합니다(Table of Materials).
- 마지막으로, 관심 유전자에 대해 250pg의 인간 mRNA를 주입하여 표현형의 구출을 수행하여 표현형의 결핍이 실제로 MO에 의한 제브라피시 유전자 손실로 인한 것인지 여부를 테스트합니다.
- 주입 준비 중
- 마이크로피펫 풀러(재료 표)를 사용하여 2.3.2-2.3.6 단계에 따라 바늘을 당깁니다.
- 필라멘트가 있는 1mm 모세관 튜브와 마이크로피펫 풀러를 사용합니다. 기기를 켜고 뚜껑을 엽니다.
- 모드 선택 노브를 NO.2 히터로 돌립니다. NO.2 히터를 사용하여 손잡이를 조정하여 열을 68°C로 높입니다.
- 모드 선택 노브를 다시 1단계 위치로 돌립니다. 4가지 웨이트 사용(2 타입 라이트 / 2 타입 헤비)
- 모세관을 홀더에 놓고 뚜껑을 닫습니다. 시작 버튼을 눌러 당겨진 바늘을 가져옵니다.
알림: 이렇게 하면 긴 테이퍼가 있는 모세관 바늘이 생성됩니다. - 집게를 사용하여 바늘 끝을 짧게 자릅니다. 모세관 베벨러를 사용하여 제브라피시 배아에 쉽게 침투할 수 있도록 당긴 바늘의 끝을 약 30초 동안 날카롭게 하면 직경이 약 15-25μm인 팁이 생성됩니다.
- 2.3.8-2.3.13 단계에 따라 주입량을 추정하도록 바늘을 보정합니다.
- mRNA/모르폴리노 용액을 바늘에 넣기 전에 간단히 혼합하여 바늘을 완전히 막을 수 있는 입자를 용해합니다.
- 미크론 팁이 있는 피펫 팁을 사용하여 주입 바늘의 뒤쪽 부분에 ~3-4 μL의 MO 용액을 추가합니다. 주사 바늘에는 모세관 되메우기를 용이하게 하기 위해 작은 트렌치가 장착되어 있습니다.
- 주사 바늘에 기포가 없는지 확인합니다. 바늘을 마이크로인젝터에 장착합니다.
- 바늘 끝이 막히지 않았는지, 주입 페달을 밟아 MO 용액이 바늘 밖으로 흘러나올 수 있는지 확인하십시오.
- 액적 크기를 측정하여 주입량을 보정합니다. 바늘 끝을 미네랄 오일에 묻혀 마이크로미터 슬라이드에 놓습니다. 주입 페달을 밟고 배출된 액적 직경이 0.5nL에 해당하는 0.1mm가 될 때까지 주입(배출) 압력(psi) 및/또는 주입 시간(ms)을 조정합니다.
- 주입량이 약 0.5-1nL인지 확인하십시오. 주입(Eject), 압력(psi) 또는 시간(ms)을 변경하여 볼륨을 조정합니다.
- 피코리터 주입기 설정 프로토콜의 경우 2.3.15-2.3.16 단계를 수행합니다.
- 제브라피쉬 주사에는 피코리터 인젝터를 사용하십시오. 인젝터의 공급 펌프를 켭니다.
- 아래 표시된 요구 사항에 따라 인젝터를 준비합니다.
- P-밸런스: P-balance가 약 0인지 확인합니다. 노른자가 바늘로 역류하는 것을 방지하기 위해 약간 음수인지 확인하여 바늘의 MO 용액을 희석합니다. 반대로, 배압이 너무 높으면 페달에 압력을 가하지 않아도 MO가 바늘 밖으로 지속적으로 흘러나와 주입된 용량과 관찰된 표현형의 가변성과 불일치를 초래합니다.
- P 주입: 20-25psi가 이상적입니다. 이를 변경하여 주입량을 조정합니다. 이것은 10-30psi 범위일 수 있지만 ~20psi부터 시작하여 원하는 부피를 제공하는지 확인합니다.
- 주입 시간: 주입 시간을 300ms로 줄여야 합니다. 주입량을 조정하기 전에 주입 시간을 조정하십시오.
- 모르폴리노 주사의 경우 2.3.18-2.3.19 단계를 따르십시오.
- 다음과 같이 주입 챔버를 준비합니다: 0.6g의 아가로스와 30mL의 E3 배지에서 2% 아가로스를 만듭니다. 아가로스를 페트리 접시에 붓고 TU-1 사출 금형을 사용하여 아가로스에 사출 금형을 놓습니다. 냉동고에서 냉각되면 배아를 배치하고 안정화하기 위한 고랑이 형성됩니다(그림 1A).
참고: 60x E3M 원액 레시피는 최종 pH 7.6으로 1L ddH2O에서 5.0mM NaCl, 0.17mM KCl, 0.16mM MgSO4·7H2O, 0.4mM CaCl2·2H2O로 구성됩니다. - 수집된 배아를 이식 피펫을 사용하여 고랑으로 옮기고, 배아 주위의 과도한 E3 배지를 모두 제거하여 배아가 떠다니는 것을 방지합니다(그림 1B).
3. MO 및 mRNA 용액을 노른자에 주입
- 융모막을 통해 바늘을 삽입하고 세포/난황의 경계 근처에서 배아 쪽에 주입한 다음 주입 페달을 밟습니다(그림 1C).
참고: 주입된 MO 용액/페놀 레드는 노른자 내에서 즉시 확산되지 않습니다. 점차 사라지는 노른자에서 붉은 반점이 관찰됩니다. 주입된 물질은 배아 크기의 10%를 초과해서는 안 됩니다. MO는 발달 중인 세포17,18에 의해 난황낭의 세포질 흐름에서 쉽게 흡수될 수 있기 때문에 최대 8세포 단계에서 새로 낳은 제브라피쉬 알의 난황에 미세주입될 수 있습니다. 플라스미드 또는 캡이 있는 mRNA 주입의 경우, 주사는 단세포 단계 배아의 단일 배반구에 수행되어야 합니다. - 배아를 E3 배지가 있는 페트리 접시에 옮기고 28°C에서 3dpf까지 배양하고 매일 E3 배지를 보충합니다. 이 단계에서 현미경을 사용하여 표현형 평가를 수행합니다.
참고: MO 용액은 특정 표현형을 유도하는 데 필요한 최저 농도를 설정하기 위해 각 조사에 대해 신중하게 희석해야 합니다. 각 MO에 대한 배아 치사율도 결정해야 합니다. 더 높은 농도(MO에 따라 4-10ng 이상)에서 MO는 뇌 또는 일반적인 세포 사멸과 같은 비특이적 효과를 유발하는 경향이 있습니다. - MO에 의한 제브라피시 hand2 유전자 손실로 유도된 표현형의 구출을 확인하기 위해 같은 방식으로 human hand2의 mRNA 250pg와 MO를 동시 주입합니다.
4. morpholino 넉다운의 성공을 확인하는 서쪽 오점
- 특정 시점(48 hpf, 72 hpf)에서 배아를 수집하고 필요한 경우 Pronase 효소를 사용하여 탈이온화합니다.
- 이전에 알려진 방법론을 사용하여 Vitellogenin을 제거하기 위해 배아를 Deyolk19.
참고: 비텔로제닌(Vitellogenin)은 성장하는 배아를 위한 영양 공급원 역할을 하는 인산당단백질(phospholipo-glycoprotein)입니다. 고해상도 2D 겔 전기영동과 크게 개선된 웨스턴 블로팅은 배아를 탈노크하고 비텔로제닌을 제거함으로써 가능합니다. - 앞서 설명한 대로 웨스턴 블로팅을 수행합니다20.
5. 심장 구조 및 기능 평가:
- 제브라피쉬의 라이브 이미징: 심실 이미징
참고: 여러 심장 기능/혈류역학 매개변수는 제브라피시 배아21,22의 박동하는 심장을 시각화하여 계산할 수 있습니다. 이러한 매개변수에는 심박출량(CO), 박출률(EF), 뇌졸중 용적(SV), 분획 단축(FS) 및 분획 면적 변화(FAC)가 포함됩니다(제브라피시 배아의 심장 기능 평가를 위한 세부 프로토콜과 관련된 이전 논문참조 22,23). 다음 단계에서는 제브라피시 배아의 피부가 투명하여 명시야 현미경으로 시각화할 수 있는 단계인 ~3dpf에서 이러한 매개변수를 계산하는 방법을 간략하게 설명합니다.- 3% 메틸셀룰로오스 용액(RT)을 오목한 웰 이미징 슬라이드에 한 방울 떨어뜨립니다.
- 적절한 플라스틱 스포이드를 사용하여 제브라피시 배아를 웰에 배치합니다(그림 2A, B).
알림: 우물을 과도하게 채우면 물고기가 우물 밖으로 이동할 수 있습니다. - 3% 메틸셀룰로오스 방울을 E3 배지와 부드럽게 혼합하여 부화한 배아를 안정화합니다.
알림: 3% 메틸셀룰로오스 용액을 준비하려면 메틸셀룰로오스 분말 3g을 PBS 100mL 또는 기타 장착 매체에 플라스크에 용해시킵니다. 혼합물의 플라스크에 교반 자석을 넣고 플라스크를 자기 교반 플레이트에 놓습니다. 속도를 "낮음"으로 설정하고 4 °C에서 ~ 1 일 동안 유지하여 모든 덩어리를 녹입니다. 메틸셀룰로오스가 완전히 용해되면 작은 튜브에 분취하여 -20°C에서 보관합니다. - 심실에 대한 명확한 이미징을 용이하게 하기 위해 물고기의 오른쪽이 위를 향하고 앞쪽이 왼쪽을 향하도록 물고기를 왼쪽에 배치합니다(그림 2C).
- 현미경으로 배아 심장을 100배 확대하여 확대하고 ~5초 동안 기록을 시작합니다. 심실 경계가 이미징 창 내부에 있는지 확인합니다(그림 2D).
- 심장 기능 분석을 위해 고속 카메라와 실체 현미경을 사용하여 전체 배아(그림 2C), 심실박동(그림 2D) 및 배측 대동맥 또는 후방 추기경 정맥(그림 2E)과 같은 주요 혈관에서 적혈구(RBC)를 움직이는 적혈구(RBC)의 약 100fps로 타임랩스 동영상을 녹화합니다.
- AVI 동영상 형식 또는 TIFF(또는 JPEG) 이미지 시퀀스 형식으로 동영상을 저장합니다.
- 심박수 계산
- 두 개의 연속 프레임을 기록하는 데 필요한 시간을 계산합니다. 100fps의 경우 시간 간격은 0.01초와 같습니다.
- 기록된 심장 주기에서 알려진 지점을 선택합니다(즉, 확장기 말기 또는 수축기 말기). 주기를 반복하는 데 필요한 프레임 수를 계산합니다.
- 5.2.1단계의 시간 간격에 5.2.2단계의 프레임 수를 곱합니다. 결과는 한 번의 하트비트에 대한 시간(초)입니다.
- 분당 비트 수를 계산하려면 60을 이전 단계에서 얻은 숫자로 나눕니다. 정상적인 3dpf 배아의 경우 약 150bpm(2.5Hz)이어야 합니다.
알림: 많은 소프트웨어 응용 프로그램은 ViewPoint24 및 DanioVision25와 같은 박동 심장 기록에서 심박수를 자동으로 계산할 수 있습니다. - 약 100fps의 녹화 타임랩스 동영상을 사용하여 심장 구조를 분석하여 심장 부종 또는 기타 구조적 결함의 존재를 감지하기 위해 전체 심장을 확인합니다.
참고: 그림 3A 는 정상적인 3 dpf 배아 심장을 보여주고, 그림 3B 는 심장 부종과 심장 고리 결손(심실이 길쭉함)이 있는 3 dpf 심장을 보여줍니다.
- 분수 영역 변경(FAC)을 계산합니다.
참고: FAC(Fractional Area Change)는 심실의 수축성을 평가하기 위해 심실 확장기 말단과 수축기 말기 영역을 비교하는 데 사용되는 매개변수입니다.- 약 100fps의 녹화 타임랩스 동영상을 사용하여 하나의 심장 주기를 나타내는 프레임을 확인합니다. 수축말기와 이완말기의 끝을 보여주는 프레임을 추출합니다.
- ImageJ 또는 유사한 이미지 분석 소프트웨어를 사용하여 확장말단 면적(EDA)과 수축말 면적(ESA)을 모두 계산할 수 있습니다.
- 다음 공식을 사용하여 FAC 22,26,27을 계산합니다.
증권 시세 표시기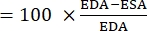
- 분수 단축(FS)을 계산합니다.
참고: 분획 단축(FS)은 심실의 수축성을 평가하는 데 사용되는 또 다른 매개변수입니다. FS를 측정하려면 심실의 확장기 말단 직경과 수축기 말단 직경을 측정해야 합니다21.- 5.3.1단계를 반복합니다.
- ImageJ 또는 기타 동등한 이미지 분석 프로그램을 사용하여 확장기 말단 Dd 및 수축기 말단 Ds 점에서 심실 벽의 직경을 측정합니다. 대부분의 경우 분수 평활도(FS)를 결정하기 위해 짧은 축 직경이 사용됩니다(그림 4).
- 다음 공식을 사용하여 FS22,27을 계산합니다.
일초분의 일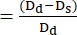
- 스트로크 볼륨(SV) 계산:
참고: 각 심장 박동에 대해 SV는 심실에서 펌핑되는 혈액의 양이며, 이는 심실28의 확장기 말기 및 수축기 말기 부피에서 쉽게 계산됩니다.- 5.3.1 및 5.3.2단계를 반복합니다.
- 그림 4와 같이 확장기 말단(DL) 및 수축기말(DS) 직경을 측정합니다.
참고: 제브라피시 심장의 심실이 프롤레이트 구상체21,22 모양을 가지고 있다고 가정하면 심실 부피는 다음 공식을 사용하여 계산됩니다.
음량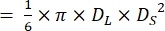
SV는 아래 식27에 따라 계산할 수 있습니다. 정상 SV 범위는 2-6 dpf 배아에 대해 0.15-0.3 nL입니다29. 여기서 EDV는 확장말 용적(end-diastole volume)이고 ESV는 수축기 말 용적(end-systole volume)입니다.
SV = (EDV - ESV)
- 이방출(EF)을 계산합니다.
참고: EF는 심장 박동이28 할 때마다 심실에서 분출되는 혈액의 분획으로 정의됩니다.- 위의 공식에서 물고기의 EDV 및 ESV를 추출합니다.
- 다음과 같이 EF를 계산합니다 22,27:
EF (퍼센트)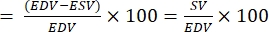
- 심박출량(CO)을 계산합니다.
참고: CO는 심장에서 펌핑되는 혈액의 양입니다28. CO는 2-6 dpf 배아에 대해 10-55 nL/min의 값을 갖는다29.- 이전 하위 섹션 5.5 및 5.2에서 언급한 대로 SV 및 HR을 계산합니다.
- 다음 공식을 사용하여 CO22,27을 계산합니다.
CO(nL/min) = SV(nL/beat) x HR(beats/min).
- 적혈구 속도를 측정합니다.
참고: 세포 속도 결정은 유속, 혈관 직경을 평가하고 혈관의 내피 세포에 가해지는 전단 응력을 계산하는 데 매우 중요합니다(즉, 전단 응력은 혈액 이동에 의해 내피 세포에 가해지는 마찰력입니다). 2-5 dpf 배아의 경우 평균 적혈구(RBC) 속도는 약 300-750 μm/s입니다29. 적혈구 속도를 측정하려면 다음을 수행합니다.- 현미경으로 100배 배율로 동물 꼬리를 확대합니다. 이 배율에서 적혈구의 움직임을 볼 수 있어야 합니다(그림 5A, B).
- 약 8초 동안 녹음을 시작합니다. 가장 중요한 두 개의 축 동맥인 등쪽 대동맥(DA)과 후방 추심 정맥(PCV)이 이미징 창 내에서 100-120fps인지 확인합니다. 순차 프레임에서 개별 셀을 추적합니다(그림 5A, B).
- ImageJ 또는 기타 유사한 이미지 분석 소프트웨어를 사용하여 여러 프레임을 추출합니다.
- 개별 RBC가 이동하는 거리의 차이(Δx)를 계산합니다.
- 연속된 프레임(Δt) 사이의 시간 차이를 확인합니다.
- RBC 속도22,27에 대해 다음 공식을 사용합니다.
RBC 속도(μm/s)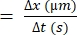
참고: 최대 및 평균 속도는 개별 셀(21)에 대한 연속적인 프레임의 반복에서 추출할 수 있습니다. 적혈구 속도는 혈류 속도도 나타냅니다. 또는 다양한 상용 소프트웨어 응용 프로그램을 사용하여 적혈구의 속도를 자동으로 측정할 수 있습니다. ViewPoint24와 DanioVision25에도 이러한 애플리케이션이 있습니다(그림 5C). 또한 TrackMate30 및 MTrackJ31과 같이 100fps 이상으로 녹화된 동영상과 호환되는 ImageJ와 함께 사용할 수 있는 플러그인은 거의 없습니다.
- 측정된 세포 속도로부터 전단 응력 계산
혈관에서 측정된 적혈구 속도도 혈류 속도를 나타냅니다(그림 5C). 이러한 측정에서 Poiseuille Flow 가정22,27을 사용하여 다음과 같이 관심 용기의 전단 응력 τ를 계산합니다.
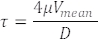
여기서 V는 평균 혈액 속도(μm/s), μ은 혈액 점도(dynes/cm2), D는 혈관 직경(μm)입니다. 3개의 dpf 배아의 경우 DA 22,26,27의 전단 응력은 약 4dynes/cm2입니다.
결과
그림 6의 그래프는 HAND2 특이적 MO 및 대조군 스크램블 MO 주입 배아 모두에서 24, 48 및 72 hphf에서 생존하는 배아의 평균 비율을 보여줍니다. 1 mM(8 ng/μL) 및 0.8 mM(6.4 ng/μL) MO 주입 배아는 대조군 스크램블 MO 주입 배아에 비해 생존율이 현저히 감소한 것으로 나타났습니다. 이것은 치사율 또는 기형이 관찰된 측정된 각 시점에서 관찰되었습니다. 그 결과,...
토론
모르폴리노(MO) 기술은 제브라피시, 제노푸스, 성게, 그리고 최근에는 세포 배양 모델 시스템에 광범위하게 사용되었습니다. 대부분의 방법에는 이점과 함께 실험자가 알고 있어야 하는 함정도 있습니다. MO 기술의 주요 함정 중 하나는 MO 매개 유전자 녹다운 접근법에 의해 관찰된 표현형 효과가 일차 유전자 산물과 관련된 기능의 상실에 기인하는 것이 아니라 일차 유전?...
공개
저자는 재정적 이해관계나 다른 이해관계의 충돌을 선언하지 않는다.
감사의 말
이 기사의 게재는 BARZAN HOLDINGS의 아낌없는 지원으로 다루어졌습니다. RR은 소아과 및 아동 병원의 R61HL154254과 기금으로 부분적으로 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Acrylamide 40% | Sigma | Sigma, cat. no. C977M88 | |
| Agarose | Sigma-Aldrich | Sigma-Aldrich cat. no A9539-250G | |
| All Prep DNA/RNA Mini Kit | Qiagen | Qiagen cat. no. 80204. | |
| alpha Tubulin | Abcam | Abcam- ab4074 | Rabbit polyclonal to alpha Tubulin lot GR3 180877-1 (50 kDa) |
| Ammonium persulfate molecular grade | Sigma | Sigma, cat. no C991U65 | |
| BV10 capillary beveller | Sutter Instruments Product | Sutter Instruments Product Catalog # BV10 | |
| Chemiluminescence Imaging Gene Gnome | SYNGENE | SYNGENE | |
| Cleaver Scientific Blotting | CVS10D_OmniPAGEMini | CVS10D_OmniPAGEMini | |
| Coomassie | Thermo Fisher | Thermo Fisher cat. no C861C44 | |
| Electrochemiluminescence (ECL) kit | Abcam Biochemicals | Abcam Biochemicals cat. no ab65623 | |
| Glycine | Sigma | Sigma, cat. no C988U91 | |
| Goat anti Rabbit | Abcam | Abcam- ab6721 | Goat Anti-Rabbit IgG H&L (HRP) 2nd antibodies lot GR3179871-1 |
| HAND2 | Gene tools | Custom made for HAND2 (NM_021973) | 5'-CCTCCAACTAAACTCATGGCGAC AG-3' |
| Hand2 | Abcam | Abcam- ab10131 | Rabbit polyclonal Anti-HAND2 antibody lot GR143200-9 (24- 26 kDa) |
| HAND2 (NM_021973) Human Tagged ORF Clone | OriGene Technologies, Inc | RC224436L3 | Vector: pLenti-C-Myc-DDK-P2A-Puro (PS100092) |
| IBI DNA/RNA/Protein Extraction Kit | IBI Scientific | IBI Scientific cat. no -r IB47702 | |
| Imaging System | iBright | iBright CL1000 Imaging System | |
| Isopropanol | Sigma-Aldrich | Sigma-Aldrich cat. no 278475-2L | |
| Laemmli sample loading buffer (4x) | Sigma-Aldrich | Sigma-Aldrich cat. no 70607 | |
| Mercaptoethanol | Sigma | Sigma, cat. no M6250-1L | |
| Microplate Spectrophotometer with the Gen5 Data Analysis software interface | Epoch | Epoch | |
| Microscope | Ziess SteREO Lumar V12 Flourescence Microscope | Ziess SteREO Lumar V12 Flourescence Microscope | |
| Mineral oil | Fisher Scientific | Fisher Scientific cat. no 0121-1 | |
| mMESSAGE mMACHINE T7/T3/SP6 Transcription Kit | Thermo Fisher | Thermo Fisher cat. no.AM1340 | for mRNA generation |
| Nuclease-free water | New England Biolabs | New England Biolabs cat. no B1500L | |
| PC-100 Micropipette Puller | NARISHIGE GROUP Product | NARISHIGE GROUP Product Catalog # PC-100 | |
| Phenol red | Sigma | Sigma, cat. no. P-0290 | |
| Picolitre Injector | Harvard Apparatus | Harvard Apparatus cataloge # PLI-90A | |
| Pierce Bicinchoninic acid assay (BCA) Protein Assay kit | Thermo Fisher | Thermo Fisher cat. no 23227 | |
| PMSF, Protease inhibitor as protease inhibitors | Thermo Fisher | Thermo Fisher cat. no 36978 | |
| Ponceau S | Sigma-Aldrich | Sigma-Aldrich cat. no 10165921001 | |
| Protease Inhibitor Cocktail | Thermo Fisher | Thermo Fisher cat. no 88668 | |
| Protein ladder | SMOBiO | SMOBiO cat. no PM2500 | |
| Radioimmunoprecipitation Assay (RIPA) | Thermo Fisher | Thermo Fisher cat. no 89900 | |
| Ringer’s solution | Thermofisher | Catalog No.S25513 | |
| SDS | Sigma | Sigma, cat. no 436143 | |
| Standard Control | Gene tools | SKU: PCO-StandardControl-100 | 5'-CCTCTTACCTCAGTTACAATTTAT A-3'- that targets a human beta-globin intron mutation |
| Stripping buffer | Sigma-Aldrich | Sigma-Aldrich cat. 21059 | |
| Temed | IBI scientific | IBI scientific cat. no C000A52 | |
| Tris Base | Thermo Fisher | Thermo Fisher cat. no BP-152-500 | |
| Tween | sigma life science | sigma life science cat. no P2287 | |
| Zebra Box Revolution-Danio Track system chamber with the EthoVision XT 11.5 software | Noldus Information Technology, NL | Noldus Information Technology, NL | |
| Zeiss Axiocam ERc 5s | Zeiss | Stemi 508 Zeiss | |
| Zeiss Stemi 2000-C | Zeiss | Stemi 2000-C |
참고문헌
- Bakkers, J. Zebrafish as a model to study cardiac development and human cardiac disease. Cardiovascular Research. 91 (2), 279-288 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (1), 69-77 (2009).
- Stainier, D. Y., et al. Guidelines for morpholino use in zebrafish. PLoS Genetics. 13 (10), 1007000 (2017).
- Zhou, B., et al. Epicardial progenitors contribute to the cardiomyocyte lineage in the developing heart. Nature. 454 (7200), 109-113 (2008).
- Eve, A. M., Place, E. S., Smith, J. C. Comparison of Zebrafish tmem88a mutant and morpholino knockdown phenotypes. PLoS One. 12 (2), 0172227 (2017).
- Huang, W., Zhang, R., Xu, X. Myofibrillogenesis in the developing zebrafish heart: A functional study of tnnt2. Developmental Biology. 331 (2), 237-249 (2009).
- Chen, Z., et al. Depletion of zebrafish essential and regulatory myosin light chains reduces cardiac function through distinct mechanisms. Cardiovascular Research. 79 (1), 97-108 (2008).
- Bedell, V. M., Westcot, S. E., Ekker, S. C. Lessons from morpholino-based screening in zebrafish. Briefings in Functional Genomics. 10 (4), 181-188 (2011).
- Reichenbach, B., et al. Endoderm-derived Sonic hedgehog and mesoderm Hand2 expression are required for enteric nervous system development in zebrafish. Developmental Biology. 318 (1), 52-64 (2008).
- Maves, L., Tyler, A., Moens, C. B., Tapscott, S. J. J. Pbx acts with Hand2 in early myocardial differentiation. Developmental Biology. 333 (2), 409-418 (2009).
- Hinits, Y., et al. Zebrafish Mef2ca and Mef2cb are essential for both first and second heart field cardiomyocyte differentiation. Developmental Biology. 369 (2), 199-210 (2012).
- . Gene Tools, custom-sequence Morpholinos Available from: https://oligodesign.gene-tools.com/ (2011)
- . hand2 heart and neural crest derivatives expressed 2 [ Danio rerio (zebrafish) Available from: https://www.ncbi.nlm.nih.gov/gene/58150 (2021)
- . Danio rerio heart and neural crest derivatives expressed 2 (hand2), mRNA Available from: https://www.ncbi.nlm.nih.gov/nuccore/NM_131626.3 (2021)
- . NCBI reference sequence -Danio rerio heart and neural crest derivatives expressed 2 (hand2), mRNA FASTA Available from: https://www.ncbi.nlm.nih.gov/nuccore/NM_131626.3?report=fast (2021)
- . Prepared control oligos Available from: https://store.gene-tools.com/prepared-control-oligos (2021)
- Schubert, S., Keddig, N., Hanel, R., Kammann, U. Microinjection into zebrafish embryos (Danio rerio)-a useful tool in aquatic toxicity testing. Environmental Sciences Europe. 26 (1), 32 (2014).
- Moulton, J. D. Guide for morpholino users: toward therapeutics. Journal of Drug Discovery, Development, and Delivery. 3 (2), 1023 (2016).
- Link, V., Shevchenko, A., Heisenberg, C. -. P. Proteomics of early zebrafish embryos. BMC Developmental Biology. 6 (1), 1 (2006).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. Journal of Visualized Experiments: JoVE. (44), e2359 (2010).
- Shin, J. T., Pomerantsev, E. V., Mably, J. D., MacRae, C. A. High-resolution cardiovascular function confirms functional orthology of myocardial contractility pathways in zebrafish. Physiological Genomics. 42 (2), 300-309 (2010).
- Yalcin, H. C., Amindari, A., Butcher, J. T., Althani, A., Yacoub, M. Heart function and hemodynamic analysis for zebrafish embryos. Developmental Dynamics: An Officical Publication of the American Association of Anatomists. 246 (11), 868-880 (2017).
- Zakaria, Z. Z., et al. Using zebrafish for investigating the molecular mechanisms of drug-induced cardiotoxicity. Biomed Research International. 2018, 1642684 (2018).
- Parker, T., et al. A multi-endpoint in vivo larval zebrafish (Danio rerio) model for the assessment of integrated cardiovascular function. Journal of Pharmacological and Toxicological Methods. 69 (1), 30-38 (2014).
- Grone, B. P., et al. Epilepsy, behavioral abnormalities, and physiological comorbidities in syntaxin-binding protein 1 (STXBP1) mutant zebrafish. PLoS One. 11 (3), 0151148 (2016).
- Salman, H. E., Yalcin, H. C. Advanced blood flow assessment in Zebrafish via experimental digital particle image velocimetry and computational fluid dynamics modeling. Micron. 130, 102801 (2020).
- Benslimane, F. M., et al. Cardiac function and blood flow hemodynamics assessment of zebrafish (Danio rerio) using high-speed video microscopy. Micron. 136, 102876 (2020).
- DeGroff, C. G. Doppler echocardiography. Pediatric Cardiology. 23 (3), 307-333 (2002).
- Bagatto, B., Burggren, W. A three-dimensional functional assessment of heart and vessel development in the larva of the zebrafish (Danio rerio). Physiological and Biochemical Zoology. 79 (1), 194-201 (2005).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods (San Diego, Calif.). 115, 80-90 (2017).
- Meijering, E., Dzyubachyk, O., Smal, I. Methods for cell and particle tracking. Methods in Enzymology. 504, 183-200 (2012).
- Kok, F. O., et al. Reverse genetic screening reveals poor correlation between morpholino-induced and mutant phenotypes in zebrafish. Developmental Cell. 32 (1), 97-108 (2015).
- Sumanas, S. Inducible inhibition of gene function with photomorpholinos. Methods in Molecular Biology. 1565, 51-57 (2017).
- Kyritsi, K., et al. Knockdown of hepatic gonadotropin-releasing hormone by vivo-morpholino decreases liver fibrosis in multidrug resistance gene 2 knockout mice by down-regulation of miR-200b. The American Journal of Pathology. 187 (7), 1551-1565 (2017).
- Flynt, A. S., Rao, M., Patton, J. G. Blocking zebrafish microRNAs with morpholinos. Methods in Molecular Biology. 1565, 59-78 (2017).
- Schoenebeck, J. J., Keegan, B. R., Yelon, D. Vessel and blood specification override cardiac potential in anterior mesoderm. Developmental Cell. 13 (2), 254-267 (2007).
- Lu, F., Langenbacher, A., Chen, J. -. N. Transcriptional regulation of heart development in zebrafish. Journal of Cardiovascular Development and Disease. 3 (2), 14 (2016).
- Laurent, F., et al. HAND2 target gene regulatory networks control atrioventricular canal and cardiac valve development. Cell Reports. 19 (8), 1602-1613 (2017).
- Miura, G. I., Yelon, D. A guide to analysis of cardiac phenotypes in the zebrafish embryo. Methods in Cell Biology. 101, 161-180 (2011).
- De Luca, E., et al. ZebraBeat: a flexible platform for the analysis of the cardiac rate in zebrafish embryos. Scientific Reports. 4, 4898 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유