A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מערכי הידרוג'ל מאפשרים תפוקה מוגברת לסינון השפעות של רכיבי מטריצה וטיפולים במודלים תלת-ממדיים של גידולים
In This Article
Summary
הפרוטוקול הנוכחי מתאר פלטפורמה ניסיונית להערכת ההשפעות של רמזים מכניים וביוכימיים על תגובות כימותרפיות של תאי גליובלסטומה שמקורם בחולה בתרביות מטריצה-מימטיות תלת-ממדיות באמצעות התקן תאורת UV מותאם אישית המאפשר פוטו-קרוסלינקינג בתפוקה גבוהה של הידרוג'לים עם תכונות מכניות הניתנות לכוונון.
Abstract
אינטראקציות בין מטריצת תאים מתווכות תהליכים פיזיולוגיים מורכבים באמצעות רמזים ביוכימיים, מכניים וגיאומטריים, ומשפיעות על שינויים פתולוגיים ותגובות טיפוליות. התחשבות בהשפעות מטריצה מוקדם יותר בצנרת פיתוח התרופות צפויה להגדיל את הסבירות להצלחה קלינית של טיפולים חדשניים. קיימות אסטרטגיות מבוססות-חומר ביולוגי המשחזרות מיקרו-סביבה של רקמות ספציפיות בתרבית תאים תלת-ממדית, אך שילובן עם שיטות התרבית הדו-ממדיות המשמשות בעיקר לבדיקת תרופות היה מאתגר. לפיכך, הפרוטוקול המוצג כאן מפרט את פיתוח השיטות לתרבית תלת-ממדית בתוך מטריצות חומריות ביולוגיות ממוזערות בפורמט של לוחות רב-בארים כדי להקל על אינטגרציה עם צינורות סינון תרופות קיימים ומבחנים קונבנציונליים לכדאיות התא. מכיוון שתכונות המטריצה הקריטיות לשימור פנוטיפים רלוונטיים מבחינה קלינית בתאים בתרבית צפויות להיות ספציפיות מאוד לרקמות ולמחלות, יהיה צורך בסינון קומבינטורי של פרמטרי מטריצה כדי לזהות תנאים מתאימים ליישומים ספציפיים. השיטות המתוארות כאן משתמשות בתבנית תרבית ממוזערת כדי להעריך את תגובות התאים הסרטניים לשונות אורתוגונלית של מכניקת המטריצות והצגת הליגנד. באופן ספציפי, מחקר זה מדגים את השימוש בפלטפורמה זו כדי לחקור את ההשפעות של פרמטרי מטריצה על התגובות של תאי גליובלסטומה (GBM) שמקורם בחולה לכימותרפיה.
Introduction
העלות הצפויה של פיתוח תרופה חדשה עלתה בהתמדה בעשור האחרון, עם יותר ממיליארד דולר בהערכות הנוכחיות1. חלק מהוצאה זו הוא שיעור הכשל הגבוה של תרופות הנכנסות לניסויים קליניים. כ-12% מהמועמדים לתרופות מקבלים בסופו של דבר את אישור מנהל המזון והתרופות האמריקאי (FDA) בשנת 2019. תרופות רבות נכשלות בשלב I עקב רעילות בלתי צפויה2, בעוד שאחרות שעוברות ניסויי בטיחות עלולות להיכשל בשל חוסר יעילות3. התשה זו עקב אי-יעילות יכולה להיות מוסברת בחלקה על ידי העובדה שמודלים סרטניים המשמשים במהלך פיתוח תרופות ידועים לשמצה בכך שאינם מנבאים את היעילות הקלינית4.
ניתן לייחס פערים תפקודיים בין מודלים in vitro ו-in vivo להסרת תאים סרטניים מהמיקרו-סביבה הטבעית שלהם, כולל תאים שאינם סרטניים ו-ECM 5,6 הפיזי. בדרך כלל, קבוצות מחקר משתמשות במטריצות תרבית הזמינות מסחרית, כגון Matrigel (מטריצת קרום מרתף חלבונית שמקורה בסרקומות עכברים) כדי לספק לתאי גידול בתרבית מיקרו-סביבה של מטריצה תלת-ממדית. בהשוואה לתרבית דו-ממדית, תרבית תלת-ממדית במטריצת הממברנה שיפרה את הרלוונטיות הקלינית של תוצאות במבחנה 7,8. עם זאת, ביו-חומרים בתרבית מרקמות שעברו דה-תאיזציה, כולל מטריצת הממברנה, מפגינים בדרך כלל שונות מאצווה לאצווה שעלולה לפגוע בשכפול9. יתר על כן, מטריצות שמקורן בגידולים עם מקורות רקמה שונים מאלה שנחקרו עשויות שלא לספק את הרמזים הפיזיולוגיים המתאימים10. לבסוף, לסרטן עם דרגות גבוהות של הטרוגניות תוך-טוראלית יש תכונות מיקרו-סביבתיות המשתנות בסולם בגודל תת-מיקרון ואשר לא ניתן לכוונן את מטריצת הממברנה כדי לשחזר11.
גליובלסטומה (GBM), גידול מוח קטלני אחיד עם זמן הישרדות חציוני של כ -15 חודשים, הוא סרטן שעבורו התפתחות הטיפול הייתה קשה במיוחד12,13. סטנדרט הטיפול הנוכחי ב- GBM מורכב מכריתת גידול ראשונית, ולאחר מכן הקרנות, ולאחר מכן כימותרפיה באמצעות טמוזולומיד (TMZ)14. עם זאת, יותר ממחצית מגידולי ה-GBM הקליניים מפגינים עמידות לטיפול באמצעות מנגנונים שונים 15,16,17. חיזוי היעילות של משטר טיפול עבור מטופל בודד הוא קשה ביותר. מודלים פרה-קליניים סטנדרטיים המשמשים לחיזוי התוצאות האינדיבידואליות מורכבים מתאי גידול שמקורם בחולה, המושתלים באופן אורתוטופי בעכברים מדוכאי חיסון. בעוד ש-xenografts שמקורם בחולה יכולים לשחזר היבטים רבים של גידולי GBM קליניים והם בעלי ערך עבור מודלים פרה-קליניים18, הם יקרים מטבעם, בעלי תפוקה נמוכה, גוזלים זמן רב, וכרוכים בדאגות אתיות19. תרביות של תאים שמקורם בחולה, על משטחי פלסטיק דו-ממדיים או כספרואידים, נמנעות לרוב מבעיות אלה. בעוד שתאים שמקורם בחולה משמרים סטיות גנטיות, התרביות שלהם בדו-ממד או כספרואידים מרחפים היו במידה רבה ייצוגים גרועים של קסנוגרפטים שמקורם בחולה במכרסמים ובגידולי חולים מקוריים20. בעבר, אנו, ואחרים, הראינו שתאי GBM בתרבית ב-ECM תלת-ממדי המחקה את התכונות המכניות והביוכימיות של רקמת המוח יכולים לשמר פנוטיפים של עמידות לתרופות 10,21,22,23.
אינטראקציות בין חומצה היאלורונית (HA), רב-סוכר הנפוץ ב-ECM במוח וביטוי יתר בגידולי GBM, לבין קולטן ה-CD44 שלה מווסתים את רכישת העמידות לתרופות במבחנה 21,24,25,26,27. לדוגמה, הכללת HA בתוך תרביות תלת-ממדיות רכות הגדילה את היכולת של תאי GBM שמקורם בחולה לרכוש עמידות טיפולית. תגובתיות מכנית זו הייתה תלויה בקשירת HA לקולטני CD44 בתאי GBM21. בנוסף, קשירת אינטגרין לפפטידים נושאי RGD, ששולבו במטריצות תרבית תלת-ממדיות, הגבירה את הכימורסיסטנציה בתיווך CD44 באופן תלוי נוקשות21. מעבר ל-HA, הביטוי של מספר חלבוני ECM, שרבים מהם מכילים אזורי RGD, משתנה בין גידולים רגילים במוח ובגידולי GBM28. לדוגמה, מחקר אחד דיווח כי 28 חלבוני ECM שונים היו מווסתים מוגברת בגידולי GBM29. בתוך מיקרו-סביבה מורכבת זו של מטריצת הגידול, תאים סרטניים משלבים רמזים מכניים וביוכימיים כדי להניב פנוטיפ התנגדות מסוים, התלוי בהבדלים קטנים יחסית (למשל, פחות מסדר גודל) במודולוס של יאנג או בצפיפות של פפטידים קושרי אינטגרין 28,29,30.
הפרוטוקול הנוכחי מאפיין כיצד תאי הגידול מפרשים שילובים ייחודיים של רמזי מטריצה ומזהים מיקרו-סביבה מורכבת וספציפית לחולה, המקדמת עמידות לטיפול (איור 1A). שיטה פוטוכימית ליצירת מטריצות ממוזערות ומכווננות במדויק עבור תרבית תלת-ממדית מספקת מרחב משתנה גדול ואורתוגונלי. מערך שנבנה בהתאמה אישית של נורות LED, המופעל על ידי מיקרו-בקר, שולב בהידרוג'לים של פוטו-קרוסלינק בפורמט לוחית של 384 בארות כדי להגביר את האוטומציה ואת יכולת השכפול. עוצמת החשיפה השתנתה לרוחב היטב כדי לשנות תכונות מיקרו-מכניות של הידרוג'לים שהתקבלו, כפי שהוערך באמצעות מיקרוסקופיית כוח אטומי (AFM). בעוד שכתב יד זה אינו מתמקד בבניית מערך ההארה עצמו, דיאגרמת מעגלים (איור 1B) ורשימת חלקים (טבלת חומרים) מסופקים ככלי עזר לשעתוק המכשיר.
דו"ח זה מדגים את הדור המהיר של מערך של תאי GBM בתרבית במיקרו-סביבה תלת-ממדית ייחודית, שבה המודולוס של יאנג (ארבע רמות בסדר גודל אחד) ותכולת הפפטידים הקושרים אינטגרין (שמקורם בארבעה חלבוני ECM שונים) היו מגוונים באופן אורתוגונלי. הגישה שימשה אז כדי לחקור את התרומות היחסיות של מכניקת ההידרוג'ל ומעורבות האינטגרין הספציפית ל-ECM על הכדאיות וההתפשטות של תאי GBM שמקורם בחולה כשהם רוכשים עמידות לכימותרפיה של טמוזולומיד (TMZ).
Protocol
קווי תאי GBM שמקורם בחולה (GS122 ו- GS304) סופקו על ידי פרופסור דיוויד נתנזון (משתף הפעולה שלנו), שפיתח קווים אלה תחת פרוטוקול שאושר על ידי מועצת הביקורת המוסדית של UCLA (IRB# 10-000655). התאים סופקו ללא זיהוי כך שלא ניתן היה לקשר את קווי התאים בחזרה לחולים הבודדים.
1. הכנת תמיסת הידרוג'ל
- הכינו תמיסה עם חציצה של HEPES על ידי המסת אבקת HEPES ב-20 mM בתמיסת המלח המאוזנת של האנק (HBSS). התאם את ה- pH ל- 7 לאחר פתרון מלא.
- בתמיסה עם חציצה של HEPES, ממיסים HA thiolated (משקל מולקולרי נומינלי של 700 kDa, ראו טבלת חומרים), שהוכנו בעקבות הדו"ח הקודם31, כך ש-6%-8% משאריות החומצה הקרבוקסילית על כל חומצה גלוקורונית משתנות עם תיול, בריכוז של 10 מ"ג/מ"ל בתמיסת חיץ.
הערה: בקבוקון ענבר מומלץ כדי למנוע חמצון תיול על ידי אור הסביבה.- מערבבים באמצעות לוח ערבוב מגנטי (<1,000 סל"ד) בטמפרטורת החדר עד להמסה מלאה, בדרך כלל בסביבות 45 דקות.
- בזמן ש-HA מתמוסס, הכינו תמיסות נפרדות של (1) 100 מ"ג/מ"ל של 8-זרועות-PEG-Norbornene (20 kDa), (2) 100 מ"ג/מ"ל של 4-זרועות-PEG-Thiol (20 kDa), (3) 4 mM של פפטיד המכיל ציסטאין או ציסטאין המכיל ציסטאין (למשל, GCGYGRGDSPG), ו-(4) 4 מ"ג/מ"ל של LAP בצינורות מיקרו-צנטריפוגה (ראו טבלת חומרים).
- הכן כל אחד מארבעת הפתרונות הללו בפתרון בעל מאגר HEPES שהוכן בשלב 1.1. מערבולת את הפתרונות כדי להבטיח פירוק מלא של כל מגיב לפני ביצוע שלב 4.
הערה: אם בודקים מספר פפטידים שונים, כל אחד מהם חייב להכיל ציסטאין או מקור אחר של תיול מואטי עבור כימיה זו של הצמדה. - הכן תמיסות (4 mM זמין thiol) של כל הפפטידים להיות קשור בתוך הידרוג'ל יחיד בשלב זה.
הערה: רצפי פפטידים וחלבוני ECM שמהם הם נגזרו ונעשה בהם שימוש במחקר זה מפורטים בטבלה 1. N-אצטיל ציסטאין (ראו טבלת חומרים), שהתאים אינם נקשרים אליו, יכול להיות מוחלף בפפטיד ביו-אקטיבי המכיל תיול כדי להצביע על ריכוז של פפטיד דבק או לפעול כבקרה שלילית31.
- הכן כל אחד מארבעת הפתרונות הללו בפתרון בעל מאגר HEPES שהוכן בשלב 1.1. מערבולת את הפתרונות כדי להבטיח פירוק מלא של כל מגיב לפני ביצוע שלב 4.
- ערבבו את התמיסות הבודדות של HA, PEG-Norbornene, PEG-thiol ופפטידים המכילים ציסטאין/תיול (ראו טבלת חומרים) כדי להשיג את הריכוזים הסופיים עבור מטריצות ההידרוג'ל הסופיות המפורטות בטבלה 2. מערבבים (<1,000 סל"ד) על צלחת ערבוב מגנטית למשך 30 דקות לפחות כדי לערבב באופן מלא.
הערה: פתרונות HA הם צמיגים מאוד ומטופלים בצורה הטובה ביותר באמצעות פיפטת תזוזה חיובית (ראה טבלת חומרים). אם פיפטה תזוזה חיובית אינה זמינה, ניתן גם לוותר על פתרונות צמיגים עם מיקרופיפטה סטנדרטית על ידי צנרת איטית באמצעות קצוות רחבים.
2. תאורה ופוטו-קרוסלינקינג של הידרוג'לים באמצעות מערך LED
אזהרה: הרכיבו משקפי מגן UV וכסו את שדה התאורה בחומר סופג UV.
הערה: מערך ה-LED המתואר בפרוטוקול זה מורכב משש קבוצות של שמונה נוריות LED הממוקמות בסדרה, כפי שממחישה דיאגרמת המעגל שסופקה (איור 1A). כל קבוצה של נוריות LED יכולה להיות מופעלת באופן עצמאי, מה שמאפשר עד שש הקרנות שונות בכל ריצה. קובץ משלים 1 מכיל צילומי מסך המתאימים להוראות הבאות לקבלת הדרכה נוספת.
- הורד את הקובץ .zip התקן התאורה מקבצי הקידוד המשלימים. ספריה זו מכילה את הקבצים הבאים: Arduino.zip (קובץ קידוד משלים 1), מנהלי התקנים.zip (קובץ קידוד משלים 2), GUI.zip (קובץ קידוד משלים 3) ומחזיק.zip (קובץ קידוד משלים 4).
הערה: הדפס בתלת-ממד את החלקים העליונים והתחתונים להחזקת לוח המעגלים במקומם (ראה קבצי קידוד משלימים לקבלת פרטים). - הורד והתקן את תוכנת המיקרו-בקר (ראה טבלת חומרים).
- הורד והתקן את תוכנת ממשק המשתמש הגרפי (ראה טבלת חומרים). עיין בקובץ משלים 1 לקבלת הוראות הפעלה של תוכנה.
- פתח את 'עיבוד' והתקן את הספריה controlIP5 באמצעות לחיצה על ספריית ייבוא > של Sketch > > Add Library. לאחר מכן, חפש את controlIP5 בספריות ולחץ על התקן. בצע זאת בפעם הראשונה.
- הפעל את התקן התאורה (ראה טבלת חומרים) באמצעות ספק הכוח 36 וולט וחבר אותו למחשב באמצעות כבל micro-USB.
הערה: התקנים מסוימים לא יתקינו מנהלי התקנים באופן אוטומטי עבור ננו-לוחות Arduino שונים. קבוצה אחת של מנהלי התקנים מסופקת בקובץ zip של ההתקן. - פתח את הקובץ Arduino.ino, הממוקם בתיקייה Adruino.zip, באמצעות Arduino IDE.
- הידור הקובץ Arduino.ino על ידי לחיצה על לחצן סימן הביקורת . העלה את הקוד שעבר הידור על-ידי לחיצה על לחצן חץ .
- פתח את קובץ GUI.pde, הממוקם בתיקייה GUI.zip, באמצעות עיבוד.
- לחץ על הפעל בתוכנית העיבוד כדי להפעיל את ממשק המשתמש הגרפי לשליטה בהתקן התאורה.
- בחלון ממשק המשתמש הגרפי, לחץ על עוצמה כדי שהעמודה המכילה את תמיסת מבשר ההידרוג'ל תקושר הצולבת ותזין את העוצמה הרצויה. לחץ על התיבה זמן והזן את הזמן הרצוי. עבור הפתרון המסופק בטבלה 2, זה יהיה 15 שניות.
הערה: משתמשי קצה צריכים לכייל ערכי עוצמה דיגיטלית להקרנה באמצעות רדיומטר. דוגמאות לעוצמות אופייניות מופיעות באיור 2A. - יישרו את הדגימות עם התקן התאורה (איור 2B) עם כל נורית LED אחרת בעמודה אחת של תבניות הסיליקון (ראו טבלת חומרים) או צלחת 384-בארות. לחץ על סיום כדי להתחיל בתאורה. חזור על תהליך זה לפי הצורך להארה של שקופיות מרובות או בארות אחרות של לוחית 384 בארות.
הערה: המחזיק מתוכנן כך שהצלחת בעלת 384 הבאר יושבת צמודה לפינה אחת של החדר הפנימי במהלך התאורה.- לאחר התאורה, כאשר היא ממוקמת בפינה אחת, הזיזו את צלחת הבאר לפינה הבאה וחזרו על הפעולה. כדי להאיר בארות בחצי השני של הצלחת, הרימו את הצלחת מהמחזיק וסובבו 180 מעלות.
- צור הידרוג'לים עם מכניקה משתנה לאפיון מכני בעקבות השלבים הבאים.
- נקו את מגלשות הזכוכית ואת תבניות הסיליקון באמצעות סרט הדבקה להסרת פסולת. הדביקו את תבניות הסיליקון למגלשת הזכוכית, לחצו למטה כדי להבטיח אטימה טובה והזיזו את בועות האוויר.
- פיפטה 80 μL של תמיסת הידרוג'ל מבשר, כפי שהוכנה בשלב 1.4, לתוך כל תבנית סיליקון על מגלשת הזכוכית.
- מקם את שקופית הזכוכית על התקן התאורה מיושר עם כל נורית LED אחרת בעמודה אחת. חשוף את מבשרי ההידרוג'ל לאור UV במשך 15 שניות, כמתואר בשלב 2, לפוטו-קרוסלינק.
- לאחר הפסקת התאורה, שלפו את המגלשות ושחררו את הג'לים מהתבניות על ידי התחקות אחר ההיקף הפנימי של התבנית עם קצה עדין (קצה פיפטה 10 μL, מחט 30 G וכו '). יש להסיר תבניות סיליקון באמצעות פינצטה/מלקחיים.
- הזיזו הידרוג'לים מקושרים לבארות בודדות של צלחת בת 12 בארות על ידי הרטבת מרית ודחיפתם בעדינות ממגלשת הזכוכית. מלא כל באר ב-2 מ"ל של DPBS (ראו טבלת חומרים) לפני הוספת ההידרוג'ל. יש לנפח את הג'לים בתמיסת DPBS למשך 12 שעות לפחות (בדרך כלל במהלך הלילה) בטמפרטורת החדר (לאפיון המכני של יום המחרת).
3. מדידות מיקרוסקופיה של כוח אטומי (AFM)
- הפעל את מיקרוסקופ הכוח האטומי (AFM) בהתאם להוראות היצרן (ראה טבלת חומרים). פרוטוקול זה מספק הוראות קצרות לשימוש במכשיר ובתוכנות הקשורות אליו.
- התקן את בדיקת ה-AFM (ראה טבלת חומרים).
הערה: עבור המחקר הנוכחי, קנטילבר סיליקון ניטריד משולש עם קבוע קפיץ נומינלי של 0.01 N/m שונה עם חלקיק צורן דו-חמצני כדורי של 2.5 מיקרומטר. - לאחר ההתקנה, יישרו את הלייזר לפסגת הגשושית המשולשת, ולאחר מכן התאימו את סטיית המראה והלייזר כדי למקסם את סכום האות (בדרך כלל בין 1.5-2.2 וולט).
- טבלו את הגשושית ב- DPBS והמתינו עד 15 דקות כדי להשיג שיווי משקל תרמי. לחץ על לחצן כיול ובחר כיול תלוי מגע . לחץ על לחצן איסוף כוונון תרמי , ולאחר איסוף הנתונים, בחר את השיא סביב 3 קילוהרץ לכיול.
הערה: ייתכן שיהיה צורך בהתאמה קלה של המראה ומסיטי הלייזר לאחר טבילה בנוזל עקב שינויים במקדם השבירה. - התקרב לפני השטח של צלחת פטרי (פלסטיק) על ידי הגדרת פרמטרי הגישה למהירות קבועה, גובה מטרה של 7.5 מיקרומטר, ומהירות גישה של 15 מיקרומטר לשנייה. אפשר מדידה בסיסית לכל הפעלה עבור גישה כך שהגישה תפעל ברציפות ולא תיעצר מוקדם עקב סחף בסטה.
- עם התקרבות, הגדר פרמטרי רכישה למיפוי כוח ל- 4 תפניות nN, מרחק כניסה של 2 מיקרומטר, מהירות של 1 מיקרומטר לשנייה וזמן מגע של 0 שניות. לחץ על לחצן התחל כדי להתחיל לאסוף עקומת כוח על משטח הפלסטיק (לדוגמה, צלחת באר).
- חזור לחלון הכיול ובחר את החלק של עקומת הכוח המתאים למגע ולהזחה של הפלסטיק. קבל את ערכי הרגישות והנוקשות המחושבים כדי שהגשושית תשלים את הכיול.
- לאחר הכיול, הרימו את בדיקת ה-AFM והניחו את דגימת ההידרוג'ל לחקירה. הגש להידרוג'ל בעקבות ההגדרות שסופקו בשלב 5.
הערה: במהלך הליך ההתקרבות לעבר משטח ההידרוג'ל, היחידה עלולה להפעיל בטעות את המצב המתקרב. כדי לאמת את הגישה בפועל, קבל עקומת כוח כמו בשלב 4.6. חזור על הליך הגישה אם העקומה המתקבלת אינה מציגה מגע וכתוצאה מכך הזחה. - כאשר גישת המשטח מצליחה, עבור למצב מיפוי כוח והגדר פרמטרי רכישה למפה בגודל 8 x 8 עם אורך של 40 מיקרומטר לכל ציר. קבל מפות כוח באזורים שונים כדי להעריך את האחידות של מדידות נוקשות.
- פרש עקומות כוח באמצעות התוכנה JPK SPM עיבוד נתונים באמצעות התאמת מודל הרץ/סנדון (משוואות 1 ו-2, ראו טבלה 3 להגדרת כל המשתנים) כאשר הגיאומטריה הכדורית נבחרה 32,33,3 34.
 משוואה 132
משוואה 132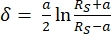 משוואה 232
משוואה 232
- פרש עקומות כוח באמצעות התוכנה JPK SPM עיבוד נתונים באמצעות התאמת מודל הרץ/סנדון (משוואות 1 ו-2, ראו טבלה 3 להגדרת כל המשתנים) כאשר הגיאומטריה הכדורית נבחרה 32,33,3 34.
4. הקמה וטיפול תרופתי בתרבויות תלת-ממדיות משובצות מטריצה
- הכן את התאים הרצויים כתמיסה של תא יחיד.
הערה: סוגי תאים שונים עשויים לדרוש שיטות מעבר שונות. פרוטוקול טיפוסי להעברת תרבית השעיה של כדוריות GBM מבקבוק T-75 מדווח בהתייחסות31. - אספו כדוריות GBM (בקוטר של כ-150 מיקרומטר) מתרבית תרחיף צלוחית T-75 לצינור חרוטי של 15 מ"ל. יש לשטוף את בקבוקון התרבית ב-5 מ"ל של DPBS כדי להסיר את שאריות התאים והמדיה ולהוסיף נפח זה לצינור החרוטי.
- צנטריפוגה הצינור החרוטי המכיל תאים ב 200 x g במשך 5 דקות בטמפרטורת החדר. לאחר צנטריפוגה, הסר את הסופרנטנט עם פיפטה סרולוגית של 5 מ"ל, תוך הקפדה שלא להפריע לכדור התא, ובצע החייאה ב-5 מ"ל של DPBS.
- צנטריפוגה ב 200 x g במשך 5 דקות בטמפרטורת החדר לשטוף תאים. לשאוף את הסופרנטנט עם פיפטה סרולוגית של 5 מ"ל, תוך הקפדה שלא להפריע לכדור התא, ולאחר מכן לבצע החייאה של תאים ב-2 מ"ל של מגיב דיסוציאציה של תאים (ראו טבלת חומרים).
- דגירה בטמפרטורת החדר למשך 10-15 דקות. הוסיפו 3 מ"ל של תווך שלם (ראו טבלת חומרים) ופיפט בעדינות 3-5 פעמים כדי לפרק את הספרואידים לתרחיף של תא בודד31.
- צנטריפוגה של ההשעיה החד-תאית ב-400 x גרם (ניתן לסובב תרחיפים חד-תאיים מהר יותר להיווצרות כדורים) למשך 5 דקות לתאי כדוריות בטמפרטורת החדר. לשאוף את supernatant עם פיפטה סרולוגית 5 מ"ל, תוך הקפדה לא להפריע לכדור התא. תאים Resuspend ב 1 מ"ל של מדיום שלם.
הערה: אם התאים נשארים בגושים, ולא כתאים בודדים בתרחיף, לאחר המעבר, ניתן להעביר תאים דרך מסננת של 40 מיקרומטר כדי להשיג תרחיף של תא בודד. - הסר חלק מהתאים לספירה באמצעות המוציטומטר. מדללים את החלק הזה פי שניים בכחול טריפאן, המחלחל לתאים עם כדאיות ירודה. ספרו רק את התאים החיים וחסרי הצבע. בדרך כלל, T-75 שנזרע ב-800,000 תאים לבקבוק מניב 2-3 מיליון תאים לאחר שבוע בתרבית.
- קבע את מספר התאים הדרושים לאנקפסולציה. העבר נפח של מדיה המכילה את המספר הכולל של התאים הדרושים לתוך צינור מיקרוצנטריפוגה סטרילי של 1.7 מ"ל. סובבו כלפי מטה ב-400 x גרם למשך 5 דקות בטמפרטורת החדר.
הערה: לדוגמה, יש צורך במינימום של 2.5 מיליון תאים שעברו החייאה ב-1 מ"ל של נפח ג'ל כדי לעטוף תאים ב-2.5 מיליון תאים/מ"ל. נפח ג'ל של 1 מ"ל מאפשר למשתמשים לחלק 100 טיפות ג'ל, כאשר כל טיפת ג'ל היא בנפח של 10 μL. מומלץ להכין נפח נוסף של כ-20% מהתאים המושעים בתמיסת הידרוג'ל כדי להסביר את האובדן במהלך העברת הפיפטה. לפיכך, אפשר להכין 3 מיליון תאים ו-1.2 מ"ל של תמיסה מבשרת הידרוג'ל בדוגמה זו. מומלץ לבצע צפיפות מינימלית של 500 אלף תאים/מ"ל. - לשאוף את supernatant עם micropipette, תוך הקפדה לא להפריע לכדור התא. בצעו החייאה של כדור התא בתמיסת מבשר ההידרוג'ל, כפי שהוכנה בשלב 1.4, תוך ערבוב טוב על ידי צנרת למעלה ולמטה עם מיקרופיפטה של 1,000 μL 4-5 פעמים.
- טען את התאים לתוך פיפטטור חוזר (ראה טבלת חומרים) המוגדר לחלוקת 10 μL. כדי למנוע בועות וחלוקה לא אחידה, הכינו את הצינור החוזר על ידי חלוקה של 1-2 פעמים נוספות למיכל פסולת.
- בכל באר של צלחת של 384 בארות, מחלקים 10 μL של תאים התלויים בתמיסת הידרוג'ל מהפיפטטור החוזר. באמצעות מערך ה-LED, הארו כל באר המכילה תאים (שלב 2) במשך 15 שניות בעוצמות (לדוגמה, התוצאה היא באיור 2A שהשתמשו בעוצמות של 1.14, 1.55, 2.15, 2.74 mW/cm2) כדי להשיג את התכונות המכניות הרצויות.
הערה: מומלץ להתחיל עם חמישה שכפולים לכל מצב ניסיוני ולהרחיב או להקטין בהתאם לתפוקה ולשונות הרצויות של מבחן נקודת הקצה. - הוסף 40 μL של מדיה מלאה לכל באר המכילה את התאים. הוסיפו 50 μL של DPBS לבארות לא ניסיוניות ויבשות המקיפות את הג'לים כדי למזער הפסדים עקב אידוי.
- עבור תאי GBM, הוסף 40 μL של התרופה המכילה מדיה (לדוגמה, TMZ, ראה טבלת חומרים) כדי להשיג את הריכוז הרצוי הסופי (10 μM-100 μM ב- dimethylsulfoxide (DMSO) או ברכב (DMSO), בהתאם, החל מ- 3 ימים לאחר האנקפסולציה.
5. בדיקת התפשטות CCK8
- הוסף 10 μL של מגיב CCK8 (ראה טבלת חומרים) לכל באר המכילה את התאים.
הערה: אם מבצעים בדיקה זו בפעם הראשונה, כלול בארות בקרה שליליות כגון מדיה בלבד או הידרוג'ל ללא תאים במדיה. - דגירה למשך 1-4 שעות על פי הוראות היצרן.
הערה: זמן זה עשוי להשתנות כפונקציה של סוג התא וצפיפותו, ולכן יש לבדוק את זמני הדגירה עבור כל יישום כך שערכי הספיגה ייכללו בטווח ליניארי, דרישה ליישום חוק באר35. - קרא את הספיגה ב-450 ננומטר עבור כל הבארות לאחר הדגירה.
- חשב את הספיגה הממוצעת ב- 450 ננומטר המתקבלת בשלב 3 עבור מצב הרכב עבור כל קבוצה. חלקו כל תרופה שטופלה היטב בממוצע של בקרת הרכב לכל קבוצה.
- חשב רווח בר-סמך על-ידי יצירת התפלגויות bootstrap (N = 10,000) באמצעות שיטת האחוזון36.
הערה: באופן כללי, ניתן להשתמש במרווחי סמך של 95% ולפרש תנאים שהרווחים בר-סמך שלהם אינם חוצים את 1 כמשמעותיים ומצדיקים חקירה נוספת. הגדרת רווח בר-סמך ל-95% עולה בקנה אחד עם קביעת ניתוק משמעות של p = 0.05. עבור הנתונים המוצגים בתוצאות, יש תועלת בהבחנה בין מצבים המקדמים או מעכבים עמידות לתרופות בתיווך מטריצה, הדורשים ניתוח דו-צדדי.
תוצאות
מדידות AFM אישרו שליטה מדויקת במכניקת ההידרוג'ל כפונקציה של קרינת UV (mW/cm2) במהלך הצלבת תמונות באמצעות מערך LED שנבנה בהתאמה אישית, הנשלט על ידי Arduino (איור 2A). את נוסחת ההידרוג'ל המשמשת בפרוטוקול זה ניתן למצוא בטבלה 2. הריווח של נוריות ה-LED בתבנית שסופקה תואם את הריוו...
Discussion
העבודה הנוכחית מציגה שיטות ליצירת תרביות תלת-ממדיות ממוזערות בתוך תרבויות מבוססות HA ובמקביל לשנות את נוקשות המטריצה והפפטידים הזמינים למעורבות באינטגרין. טכניקה זו מאפשרת מחקר שיטתי של האופן שבו פרמטרים של מטריצה משפיעים על פנוטיפים תאיים (למשל, הכדאיות של תאים סרטניים שנחשפו לכימותרפי...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להודות באופן ספציפי לקרולין קים, אמליה לאו, ריאן סטוטמור ואיטאי סולומון על תרומתם לאיטרציות מוקדמות יותר של תוכנית הפוטוגלציה. קווי הסלולר GS122 ו-GS304 סופקו בנדיבות על ידי דייוויד נתנזון. כל הדמויות נוצרו עם BioRender.com. מתקני הליבה של UCLA, המשאבים המשותפים לסינון מולקולרי והמעבדה לאפיון ננו ופיקו סייעו לעבודה. צ'ן צ'יה-צ'ון נתמך על ידי מרכז ההכשרה לרפואה רגנרטיבית ותאי גזע באוניברסיטת UCLA. גריגור ורוז'אניאן נתמך על ידי תוכנית הכשרה לביולוגיה של תאי הגידול מענק NIH (T32 CA 009056).
Materials
| Name | Company | Catalog Number | Comments |
| 1.1 kOhm resistors, 6 W | Digikey | 35601k1ft | |
| 1.7 mL microcentrifuge tube | Genesse Scientific | 21-108 | |
| 15 mL conical tube | Fisher Scientific | 14-959-70C | |
| 365 nm LED | Digikey | ltpl-c034uvh365 | |
| 384 well plate | Bio Greiner One | 781090 | |
| 40 µm cell strainer | MTC bio | C4040 | |
| 4-Armed thiol terminated polyethlene glycol (20 kDa) | Laysan Bio | 4arm-PEG-SH-20K-1g | |
| 6 NPN BJTs | Digikey | 2n5550ta | |
| 80 Ohm resistors, 0.125 W | Digikey | erjj-6enf80r6v | |
| 8-Armed norbornene terminated polyethylene glycol (20 kDa) | Jenkem Technology | A7025-1 | |
| Accutase | Innovative Cell Technologies | AT104500 | cell dissociation reagent |
| AFM Probes | Novascan | 0.01 N/m Nominal spring constant, 2.5 µm SiO2 particle | |
| Arduino IDE | Arduino | 1.8.19 | |
| Arduino Nano | Makerfire | Mini Nano V3.0 ATmega328P Microcontroller Board | |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CCK8 | Abcam | ab228554 | |
| Centrifuge | Thermoscientific | sorvall legend xtr | |
| CP100ST | Gilson | F148415 | Pipette tips for positive displacement pipette |
| Cubis Semi-Micro Balance | Sartorius | MSA225S100DI | |
| DMEM - F12 (50-50) | Life Technologies | 11330057 | 1x |
| DMSO | Fisher Scientific | BP231-100 | |
| DPBS Ca (-) Mg (-) | Genesse Scientific | 25-508 | |
| EGF | Peprotech | AF100-15 | 50 ng/mL |
| Ethanol, Anhydrous | Fisher Scientific | A405P | Add DI water to dilute to 70% |
| Fisherbrand Class B Amber Glass threaded vials | Fisher Scientific | 03-339-23C | |
| Fisherbrand Weighing Paper | Fisher Scientific | 09-898-12B | |
| G21 Supplement | Gemini Bio | 400-160 | 50x |
| Hanks Balanced Salt Solution | Thermo Fisher Scientific | 14175095 | |
| HCl, ACS, 12M | Sigma Aldrich | S25838A | Add DI water to dilute to 1 M |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H3149-100Ku | 25 µg/mL |
| HEPES | Sigma Aldrich | H7006-100G | |
| Hot Air Gun | Wagner | HT1000 | |
| Integrin-binding sialoprotein (IBSP) peptide | Genscript | Custom Order | GCGYGGGGNGEPRGDTYRAY |
| Lithium phenyl-2,4,6 trimethylbenzoylphosphinate (LAP) , >95% | Sigma Aldrich | 900889-1G | |
| Magnetic stir plate | Thermo Scientific | SP194715 | |
| Microcentrifuge | Thermo Scientific | Sorvall legend micro 21R | |
| Microman E single Channel Pipettor | Gilson | FD10004 | Positive displacement pipette |
| Micropipette Tips | Various Manufacturs | Various sizes | |
| mLine micropipette | Sartorious | ||
| N-acetyl Cysteine | Sigma Aldrich | A7250-10G | |
| Nanowizard 4 | Bruker | AFM microscope | |
| NaOH | Fisher Scientific | ss255-1 | Add DI water to dilute to 1 M |
| Normoicin | Invivogen | ant-nr-1 | 500x |
| Osteopontin Peptide | Genscript | Custom Order | GCGYGTVDVPDGRGDSLAYG |
| Pipet Aid | Drummond | 4000102 | |
| Plain Microscope Slides | Globe Scientific | 1301 | |
| Press-To-Seal silicone Isolator, 12-4.5mm diam x 2mm deep | Grace Bio Labs | 664201-A | Cut so that 8 individual molds are made from a single sheet |
| Processing | Processing | 3.5.4 | |
| Repeater M4 | Eppendorf | 4982000322 | |
| Repeater Pipette Tips | Sartorious | 30089430 | 1 mL sizes |
| RGD Peptide | Genscript | GCGYGRGDSPG | |
| Scoth Tape | |||
| Serological Pipettes | Genesse Scientific | 12-102,12-104 | 5,10 mL Pipettes |
| Solder Paste | Digikey | 315-NC191LT15T5-ND | |
| Solder Wire | |||
| Straight dissecting forceps | VWR Scientific | 82027-408 | |
| Synergy H1 Plate Reader | Biotek | ||
| T-75 Cell Culture Treated Flask | Genesee Scientific | 25-209 | |
| Temozolomide | Sigma Aldrich | T2577 | Typically used from 10 µM to 100 µM |
| Tenascin-C Peptide | Genscript | GCGYGRSTDLPGLKAATHYTITIR GV | |
| Thiolated Hyaluronic Acid (700 kDa), 6-8% modified | Lifecore Biomedical | HA700K5 | |
| VWR Spinbar, Flea Micro | VWR | 58948-375 |
References
- Scannell, J. W., Blanckley, A., Boldon, H., Warrington, B. Diagnosing the decline in pharmaceutical R&D efficiency. Nature Reviews Drug Discovery. 11 (3), 191-200 (2012).
- Waring, M. J., et al. An analysis of the attrition of drug candidates from four major pharmaceutical companies. Nature Reviews Drug Discovery. 14 (7), 475-486 (2015).
- Khozin, S., Liu, K., Jarow, J. P., Pazdur, R. Why do oncology drugs fail to gain US regulatory approval. Nature Reviews Drug Discovery. 14 (7), 450-451 (2015).
- Booth, B., Ma, P., Glassman, R. Oncology's trials. Market indicators. Nature Reviews Drug Discovery. 2 (8), 609-610 (2003).
- Da Ros, M., et al. Glioblastoma chemoresistance: The double play by microenvironment and blood-brain barrier. International Journal of Molecular Sciences. 19 (10), 2879 (2018).
- Broekman, M. L., et al. Multidimensional communication in the microenvirons of glioblastoma. Nature Reviews Neurology. 14 (8), 482-495 (2018).
- Grundy, T. J., et al. Differential response of patient-derived primary glioblastoma cells to environmental stiffness. Scientific Reports. 6 (1), 1-10 (2016).
- Gomez-Roman, N., Stevenson, K., Gilmour, L., Hamilton, G., Chalmers, A. J. A novel 3D human glioblastoma cell culture system for modeling drug and radiation responses. Neuro-Oncology. 19 (2), 229-241 (2017).
- Simoni, R. D., et al. Basement membrane complexes with biological activity. Biochemistry. 25 (2), 312-318 (2002).
- Xiao, W., et al. Brain-mimetic 3D culture platforms allow investigation of cooperative effects of extracellular matrix features on therapeutic resistance in glioblastoma. Cancer Research. 78 (5), 1358-1370 (2018).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Spinelli, C., et al. Molecular subtypes and differentiation programmes of glioma stem cells as determinants of extracellular vesicle profiles and endothelial cell-stimulating activities. Journal of Extracellular Vesicles. 7 (1), 1490144 (2018).
- Ostrom, Q. T., Cioffi, G., Waite, K., Kruchko, C., Barnholtz-Sloan, J. S. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2014-2018. Neuro-Oncology. 23, (2021).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Tomczak, K., Czerwińska, P., Wiznerowicz, M. The Cancer Genome Atlas (TCGA): An immeasurable source of knowledge. Contemporary oncology. 19, 68-77 (2015).
- Lee, S. Y. Temozolomide resistance in glioblastoma multiforme. Genes and Diseases. 3 (3), 198-210 (2016).
- Joo, K. M., et al. Patient-specific orthotopic glioblastoma xenograft models recapitulate the histopathology and biology of human glioblastomas in situ. Cell Reports. 3 (1), 260-273 (2013).
- Levy, N. The use of animal as models: Ethical considerations. International Journal of Stroke. 7 (5), 440-442 (2012).
- Phon, B. W. S., Kamarudin, M. N. A., Bhuvanendran, S., Radhakrishnan, A. K. Transitioning preclinical glioblastoma models to clinical settings with biomarkers identified in 3D cell-based models: A systematic scoping review. Biomedicine & Pharmacotherapy. 145, 112396 (2022).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85-86, 128-146 (2020).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Xu, X., Farach-Carson, M. C., Jia, X. Three-dimensional in vitro tumor models for cancer research and drug evaluation. Biotechnology Advances. 32 (7), 1256-1268 (2014).
- Xiao, W., Ehsanipour, A., Sohrabi, A., Seidlits, S. K. Hyaluronic-acid based hydrogels for 3-dimensional culture of patient-derived Glioblastoma Cells. Journal of Visualized Experiments: JoVE. (138), e58176 (2018).
- Preston, M. Digestion products of the PH20 hyaluronidase inhibit remyelination. Annals of Neurology. 73 (2), 266-280 (2013).
- Kim, Y., Kumar, S. CD44-mediated adhesion to hyaluronic acid contributes to mechanosensing and invasive motility. Molecular Cancer Research. 12 (10), 1416-1429 (2014).
- Pibuel, M. A., Poodts, D., Díaz, M., Hajos, S. E., Lompardía, S. L. The scrambled story between hyaluronan and glioblastoma. The Journal of Biological Chemistry. 296, 100549 (2021).
- Xiao, W., Sohrabi, A., Seidlits, S. K. Integrating the glioblastoma microenvironment into engineered experimental models. Future Science OA. 3 (3), (2017).
- Trombetta-Lima, M., et al. Extracellular matrix proteome remodeling in human glioblastoma and medulloblastoma. Journal of Proteome Research. 20 (10), 4693-4707 (2021).
- Schregel, K., et al. Characterization of glioblastoma in an orthotopic mouse model with magnetic resonance elastography. NMR in Biomedicine. 31 (10), 3840 (2018).
- Xiao, W., Ehsanipour, A., Sohrabi, A., Seidlits, S. K. Hyaluronic-acid based hydrogels for 3-dimensional culture of patient-derived glioblastoma cells. Journal of Visualized Experiments: JoVE. (138), e58176 (2018).
- Guz, N., Dokukin, M., Kalaparthi, V., Sokolov, I. If cell mechanics can be described by elastic modulus: Study of different models and probes used in indentation experiments. Biophysical Journal. 107 (3), 564-575 (2014).
- Sneddon, I. N. The relation between load and penetration in the axisymmetric boussinesq problem for a punch of arbitrary profile. International Journal of Engineering Science. 3 (1), 47-57 (1965).
- Soofi, S. S., Last, J. A., Liliensiek, S. J., Nealey, P. F., Murphy, C. J. The elastic modulus of MatrigelTM as determined by atomic force microscopy. Journal of Structural Biology. 167 (3), 216-219 (2009).
- Mayerhöfer, T. G., Popp, J. Beer's law - Why absorbance depends (almost) linearly on concentration. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 20 (4), 511-515 (2019).
- Puth, M. T., Neuhäuser, M., Ruxton, G. D. On the variety of methods for calculating confidence intervals by bootstrapping. Journal of Animal Ecology. 84 (4), 892-897 (2015).
- Lavrentieva, A. Gradient hydrogels. Advances in Biochemical Engineering/Biotechnology. 178, 227-251 (2020).
- Zhu, D., Trinh, P., Li, J., Grant, G. A., Yang, F. Gradient hydrogels for screening stiffness effects on patient-derived glioblastoma xenograft cellfates in 3D. Journal of Biomedical Materials Research. Part A. 109 (6), 1027-1035 (2021).
- da Hora, C. C., Schweiger, M. W., Wurdinger, T., Tannous, B. A. Patient-derived glioma models: From patients to dish to animals. Cells. 8 (10), 1177 (2019).
- Li, W., et al. Characterization and transplantation of enteric neural crest cells from human induced pluripotent stem cells. Molecular Psychiatry. 23 (3), 499-508 (2018).
- Scaringi, C., Minniti, G., Caporello, P., Enrici, R. M. Integrin inhibitor cilengitide for the treatment of glioblastoma: A brief overview of current clinical results. Anticancer Research. 32 (10), 4213-4224 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved