A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
העשרת שלפוחיות חוץ-תאיות שמקורן באסטרוציטים מפלזמה אנושית
In This Article
Summary
פרוטוקול זה מתאר העשרה של שלפוחיות חוץ-תאיות שמקורן באסטרוציטים (ADEVs) מפלזמה אנושית. הוא מבוסס על הפרדת EVs על ידי משקעים פולימרים, ואחריו לכידה חיסונית מבוססת ACSA-1 של ADEVs. ניתוח ADEVs עשוי להציע רמזים לחקר שינויים במסלולים דלקתיים של חולים חיים, באופן לא פולשני על ידי ביופסיה נוזלית.
Abstract
שלפוחיות חוץ-תאיות (EVs) הן ננו-חלקיקים ביולוגיים המופרשים על ידי כל התאים לתקשורת תאית וסילוק פסולת. הם משתתפים במגוון רחב של פונקציות על ידי פעולה והעברת המטענים שלהם לתאים אחרים בתנאים פיזיולוגיים ופתולוגיים. בהתחשב בנוכחותם בנוזלים ביולוגיים, EVs מייצגים משאב מצוין לחקר תהליכי מחלה ויכולים להיחשב כביופסיה נוזלית לגילוי סמנים ביולוגיים. היבט אטרקטיבי של ניתוח EV הוא שניתן לבחור אותם על סמך סמנים של תא המוצא שלהם, ובכך לשקף את הסביבה של רקמה ספציפית במטען שלהם. עם זאת, אחת המגבלות העיקריות הקשורות לשיטות בידוד EV היא היעדר קונצנזוס מתודולוגי ופרוטוקולים סטנדרטיים. אסטרוציטים הם תאי גליה עם תפקידים חיוניים במוח. במחלות נוירודגנרטיביות, תגובתיות אסטרוציטים עלולה להוביל לשינוי במטען EV ולתקשורת סלולרית חריגה, מה שמקל / משפר את התקדמות המחלה. לפיכך, ניתוח של אסטרוציטים EVs עשוי להוביל לגילוי סמנים ביולוגיים ומטרות מחלה פוטנציאליות. פרוטוקול זה מתאר שיטה דו-שלבית להעשרה של EVs שמקורם באסטרוציטים (ADEVs) מפלזמה אנושית. ראשית, EVs מועשרים מפלזמה דפיברינה באמצעות משקעים מבוססי פולימרים. לאחר מכן מתבצעת העשרה של ADEVs באמצעות לכידה חיסונית מבוססת ACSA-1 עם מיקרו-חרוזים מגנטיים, כאשר EVs תלויים נטענים על עמודה הממוקמת בשדה מגנטי. רכבי EV בעלי תווית מגנטית ACSA-1+ נשמרים בתוך העמודה, בעוד שרכבי EV אחרים זורמים דרכו. לאחר הסרת העמודה מהמגנט, ADEVs נפלטים ומוכנים לאחסון וניתוח. כדי לאמת את ההעשרה של סמני אסטרוציטים, ניתן למדוד חלבון חומצי סיבי גליה (GFAP), או סמנים אסטרוציטים ספציפיים אחרים ממקור תוך-תאי, ולהשוות אותם לזרימה. פרוטוקול זה מציע שיטה קלה וחסכונית בזמן להעשרת ADEVs מפלזמה שיכולה לשמש כפלטפורמה לבחינת סמנים רלוונטיים לאסטרוציטים.
Introduction
שלפוחיות חוץ-תאיות (EVs) הן קבוצה הטרוגנית של ננו-חלקיקים קרומיים המופרשים על ידי כל סוגי התאים, הנושאים חלבונים, שומנים וחומצות גרעין1. מיקרו-שלפוחיות (100-1000 ננומטר), אקסוזומים (30-100 ננומטר) וגופים אפופטוטיים (1000-5000 ננומטר) מהווים את סוגי ה-EV העיקריים, כפי שנבדלים על ידי אתר מוצאם 2,3. EVs מווסתים תהליכים פיזיולוגיים חשובים, כגון הצגת אנטיגן ותגובות חיסוניות4, מיחזור קולטנים, חיסול מטבוליט5 ותקשורת סלולרית6. ויסות תהליכים אלה עשוי להתרחש על ידי קשירה ישירה בין חלבונים המועשרים בקרום תא EV לבין מטרות בתאים המקבלים, ו/או באמצעות הפנמה ושחרור המטען שלהם בציטופלזמהשל התא המקבל. בעוד שרכבים חשמליים מבצעים פונקציות תאיות חיוניות, הם זכו לעניין גובר מנקודת מבט פתולוגית בתחומי הסרטן והנוירולוגיה. ואכן, מספר מחקרים הראו ש-EVs יכולים לעזור לקדם נדידת תאי גידול 8,9 או אגרגטים של חלבונים רעילים זרעים במחלות ניווניות, כגון מחלת אלצהיימר10,11.
ניתן לבחור ולהעשיר EVs מנוזלים ביולוגיים על סמך סמני פני התא הקשורים לתא המוצא שלהם, ובכך לשקף את הסביבה של רקמה ספציפית במטען שלהם 12,13,14,15,16,17,18,19,20. בנוסף, בהתחשב בנוכחותם בדם, נוזל מוחי (CSF), רוק, שתן וחלב אם, EVs מייצגים כלי מצוין ולא פולשני לאבחון, ויכולים להיחשב כביופסיה נוזלית לגילוי סמנים ביולוגיים. זה מעניין במיוחד בנוירולוגיה, בהתחשב בקשיים בחקר אנליטים של המוח בנוזלים נגישים שאינם CSF.
אסטרוציטים זכו לעניין גובר, מכיוון שהם נמצאים בצומת של תקשורת נוירו-וסקולרית21. בתנאים פיזיולוגיים, הם אחראים על שימור מחסום הדם-מוח, מיחזור נוירוטרנסמיטורים, אספקת חומרים מזינים וגורמי גדילה לנוירונים ותאי גליה אחרים 22,23,24 כמו גם הגנה נוירו-אימונית, בהתחשב בפלסטיות המטבולית שלהם ממצבים פרו-דלקתיים למצבים אנטי דלקתיים ולהיפך 25,26,27 . מנגנון חשוב שבאמצעותו אסטרוציטים מבצעים את תפקידי הוויסות שלהם הוא על ידי תקשורת באמצעות EVs28,29. אסטרוציטוזיס תגובתית היא סימן היכר מרכזי של מספר מחלות נוירודגנרטיביות, כגון מחלת אלצהיימר,30 ניוון רב מערכתי (MSA), שיתוק על-גרעיני מתקדם (PSP)31 וטרשת אמיוטרופית צידית (ALS)32. תגובתיות אסטרוציטים עלולה להוביל לשינוי במטען EV, שחרור מתווכים דלקתיים ותקשורת סלולרית חריגה, ובכך להקל על התפשטות הפתולוגיה ולהוביל לניוון עצבי10,11. לכן, חקר EVs שמקורם באסטרוציטים (ADEVs) ושינויים במטען שלהם הוא משאב אטרקטיבי לבחינת תהליכים ניווניים באופן לא פולשני.
נכון לעכשיו, קיימות מספר מתודולוגיות לבידוד רכבים חשמליים, כל אחת עם היתרונות והחסרונות המתאימים לה33. חיוני לשקול איזו שיטה מתאימה יותר לשימוש ספציפי, בהתאם ליישום הסופי של העניין. בתחום הנוירולוגיה, וליתר דיוק, במחקרי אסטרוציטים, משקעים מבוססי פולימרים ואחריהם לכידה חיסונית הייתה השיטה הנפוצה ביותר 12,18,19,20,34. עם זאת, גם כאשר מיישמים את אותה גישה, נותרה הטרוגניות בין המחקרים בשלבים השונים המיושמים לבידוד EV. לכן, יש צורך במתודולוגיה סטנדרטית ברורה, צעד אחר צעד, כדי להקל על מחקרי EV אסטרוציטים ושחזור מחקר. משקעים מבוססי פולימרים מקלים על סינון סמנים ביולוגיים בהתחשב בכך שמדובר בהליך מהיר ופשוט שאינו דורש ציוד מורכב, מה שמוביל לתפוקה גבוהה של EVs מבלי להשפיע על פעילותם הביולוגית35.
הפרוטוקול הנוכחי מתאר שיטה מפורטת, פשוטה ודו-שלבית להעשרת ADEVs מפלזמה אנושית. הוא מבוסס על משקעים מבוססי פולימר של חלק ה-EV הכולל, ואחריו לכידה חיסונית של EVs אסטרוציטים. בהתחשב בתפקודים החשובים של אסטרוציטים, ניתוח ADEVs עשוי לשפוך אור על גילוי סמנים ביולוגיים ומסלולי דלקת במוח שניתן לחקור בצורה לא פולשנית.
Protocol
המחקר המתואר בפרוטוקול זה נערך עם דגימות פלזמה אנושיות מתורמים בוגרים בריאים משני המינים (טווח גילאים 65.9-81.3 שנים, 45.5% נשים), מקבוצת יוזמת סנט פאו לניוון עצבי (SPIN), ברצלונה, ספרד36. המשתתפים נתנו הסכמה מדעת. המחקר נערך בהתאם להנחיות האתיות הבינלאומיות למחקר רפואי הכלולות בהצהרת הלסינקי ובחוק הספרדי. ועדת האתיקה של המחקר של סנט פאו (CEIC) בחנה ואישרה את הפרוטוקול לאיסוף ואחסון דגימות פלזמה אנושיות מקבוצת SPIN (#16/2013).
1. העשרת EVs אסטרוציטים מפלזמה אנושית
הערה: פרוטוקול זה כולל שימוש בדגימות פלזמה אנושיות. כל הפרטים על ריאגנטים וחומרי מעבדה המשמשים בפרוטוקול זה כלולים בטבלת החומרים. אין צורך בציוד מיוחד להליך זה, עם זאת, אנא עיין בשיקולי הבטיחות של כל מגיב, כפי שצוין בנפרד על ידי כל יצרן.
- איסוף ואחסון דגימות
- אסוף דם בשפופרות ואקוטיין לבנדר EDTA, בהתאם לפרוטוקולים סטנדרטיים לאיסוף פלזמה36,37. צנטריפוגה ב-2000 x גרם למשך 10 דקות ב-4 מעלות צלזיוס תוך 30-120 דקות לאחר האיסוף להפרדת פלזמה. הפרד את הפלזמה, שהיא הנוזל הצלול העליון שמופיע כסופרנטנט, ב -500 מיקרוליטר אליקוטים.
- כדי להסיר פסולת תאים, צנטריפוגה את המינונים ב-3000 x גרם למשך 15 דקות בטמפרטורת החדר. להחזיר את הסופרנטנט. אחסן את הפלזמה בטמפרטורה של -80 מעלות צלזיוס עד לניתוח. כמקובל לאנליזות נוזלים ביולוגיים, יש לצטט את הדגימות לפני האחסון ולהימנע מיותר משלושה מחזורי הקפאה-הפשרה.
- העשרה כוללת לרכב חשמלי
הערה: יש לסנן את כל הריאגנטים המשמשים דרך מסנן של 0.22 מיקרומטר.- להפשיר 500 מיקרוליטר של דגימות פלזמה. הוסף טרומבין ביחס של 1:100 כדי להסיר גורמי קרישה. מערבבים בהיפוך שלוש פעמים ונותנים לו לשבת 5 דקות בטמפרטורת החדר.
- השלם את הנפח כדי להגיע ל-1 מ"ל עם תמיסת המלח המבודדת פוספט (DPBS) של Dulbecco: קוקטייל מעכב פרוטאז מרוכז DPBS + 3x (מדולל ממלאי קוקטייל מעכב פרוטאז פי 10). מיקס על ידי היפוך.
- צנטריפוגה את הדגימות ב-6000 x גרם למשך 20 דקות ב-4 מעלות צלזיוס. להחזיר את הסופרנטנט. השלם את עוצמת הקול עם פתרון עבודה DBPS כדי להגיע ל -1 מ"ל.
- הוסף 252 מיקרוליטר מתמיסת המשקעים EV וערבב בהיפוך שלוש פעמים. דגירה בטמפרטורה של 4 מעלות צלזיוס למשך 60 דקות.
- צנטריפוגה את הדגימות ב-1500 x g למשך 20 דקות ב-4 מעלות צלזיוס כדי לזרז את שבר ה-EV הכולל (גלולה). אוספים 1 מ"ל של הסופרנטנט. סמן את השבר כפלסמה מדולדלת EV לשימוש כבקרה שלילית של סמני העשרת EV (ללא EVs) ואחסן ב-80 מעלות צלזיוס.
- צנטריפוגה את הגלולה הנותרת ב-1500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. השליכו את הסופרנטנט שנותר. השעו מחדש את הגלולה ב-500 מיקרוליטר של מים טהורים במיוחד המכילים מעכבי פרוטאז ופוספטאז מרוכזים (ריכוז סופי פי 3, מדולל ממלאי של פי 100, ראה טבלת חומרים).
- פיפטה למעלה ולמטה במרץ כדי לשחרר את הכדור, הימנעות מקצף; מערבולת ומערבבים על שייקר צינור מסתובב למשך 30 דקות בטמפרטורת החדר עד להשעיה מלאה. הקפידו על השעיית גלולה מלאה, מכיוון שזהו שלב קריטי לשלב הלכידה החיסונית הבא.
- לכידה חיסונית של ADEVs
הערה: ADEVs נושאים סמני אסטרוציטים. הסמן שנבחר להעשרת ADEV באמצעות לכידה חיסונית הוא GLAST. GLAST, ראשי תיבות של טרנספורטר גלוטמט-אספרטט (UniProtKB-P43003), הוא טרנספורטר הגלוטמט הנפוץ ביותר המתבטא בעיקר על ידי אסטרוציטים במוח הקטן ובניאו-קורטקס המוחי38. הנוגדן נגד GLAST (ACSA-1, antigen-1 על פני תא אסטרוציטים) הוא ספציפי לאפיטופ חוץ-תאי של GLAST ופותח לזיהוי אסטרוציטים. זהו היעד הנפוץ ביותר ללכידה חיסונית של ADEVs מפלזמה אנושית 12,20,34.- הוסף 10 מיקרוליטר של נוגדן ביוטיניל אנטי-GLAST (ACSA-1) לכל דגימה המכילה את תכשיר ה-EV הכולל. מערבבים היטב ובעדינות. דגירה למשך שעה בטמפרטורה של 4 מעלות צלזיוס על שייקר צינור מסתובב.
- הוסף 10 מיקרוליטר של מיקרו-חרוזים מגנטיים מצומדים לנוגדנים אנטי-ביוטין חד-שבטיים (IgG1 של עכבר). מערבבים היטב ובעדינות. דגירה למשך שעה בטמפרטורה של 4 מעלות צלזיוס על שייקר צינור מסתובב.
- הנח עמודת מיקרו בשדה המגנטי של מפריד MACS. הכן את העמודה על ידי שטיפתה עם 500 מיקרוליטר של אלבומין סרום בקר PBS-0.5% (BSA). השליכו את הזרימה.
- טען את מתלה ה-EV/ACSA-1/מיקרו-חרוזים על העמוד. אל תדחף עם הבוכנה בשלב זה. אסוף את הזרימה. תייגו את זה כרכבים חשמליים לא אסטרוציטיים (ללא ADEVs) ושמרו כבקרה במידת הצורך.
- שטפו את העמוד פעמיים עם 500 מיקרוליטר PBS-0.5% BSA. השליכו את הזרימה.
- הסר את העמוד מהמפריד המגנטי והנח אותו בצינור איסוף בעל הידבקות נמוכה של 1.5 מ"ל. פיפטה 500 מיקרוליטר של PBS-0.5% BSA על העמודה. דחף בחוזקה עם בוכנה לתוך העמוד ואסוף את הנוזל.
- תווית כ-ACSA-1+ EVs (ADEVs). אחסן רכבים חשמליים ללא ליז ב-20 מעלות צלזיוס לתקופות קצרות או ב-80 מעלות צלזיוס לתקופות ארוכות יותר (>6 חודשים).
הערה: נוגדנים נגד ACSA-1 ייקשרו לאפיטופ GLAST-1/EAAT-1. מיקרו-חרוזים מגנטיים ייקשרו בזיקה לקומפלקס האנטי-ACSA-1-EV. עמודות מיקרו MACS מכילות מטריצה אופטימלית ליצירת שדה מגנטי חזק כאשר היא מונחת במגנט, הנדרש כדי לשמור על ה-ADEVs המסומנים בתווית.
לייצוג סכמטי של הליך ההעשרה של ADEV, ראה איור 1.
- ליזה של רכבים חשמליים
הערה: רכבים חשמליים חייבים להיות ליזים לחלוטין לזיהוי סמנים תוך-שלפוחיתיים. מומלץ להשתמש בשתי שיטות עוקבות, כגון כימית ואחריה ליזה מכנית.- בצע ליזה כימית של EVs על ידי הוספת מגיב מיצוי חלבון (ראה טבלת חומרים) בפרופורציה של דגימה של 100 מיקרוליטר לכל מגיב מיצוי של 150 מיקרוליטר. הוסף פי 100 מעכבי פרוטאז ופוספטאז כדי להגיע לריכוז סופי פי 1. מערבולת נמרצת ומניחים לשבת בטמפרטורת החדר למשך 15 דקות.
- בצע ליזה מכנית בהליך דו-שלבי: העבירו את תמיסת ה-EV הליזה הכימית דרך מזרק פעמיים (מחט G29). לאחר מכן, סוניקציה של הדגימות למשך 45 שניות באמבט מים קרים קולי. הקפיאו את הרכבים החשמליים הליזיים בטמפרטורה של -80 מעלות צלזיוס.
- מפשירים את הדגימות ב-37 מעלות צלזיוס למשך 5 דקות. הקפיאו שוב בטמפרטורה של -80 מעלות צלזיוס לאחסון רכבים חשמליים שעברו ליזה. יש להפשיר שוב למשך 5 דקות בטמפרטורה של 37 מעלות צלזיוס לפני הניתוח.
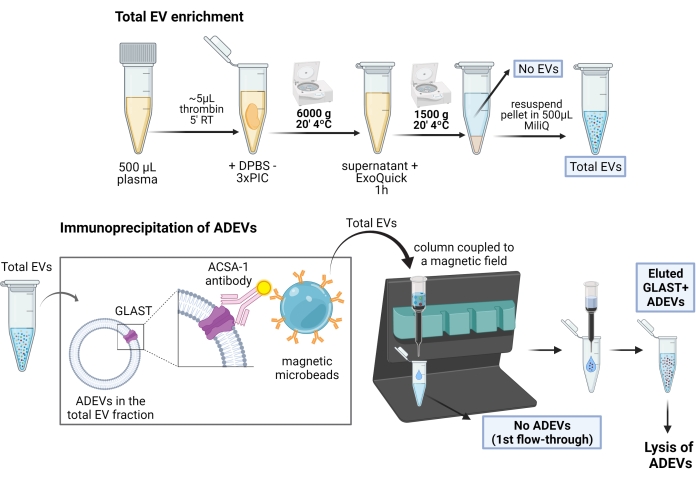
איור 1: ייצוג סכמטי של ההליך הדו-שלבי להעשרת EVs שמקורם באסטרוציטים. בשלב הראשון, EVs מועשרים מפלזמה אנושית דפיברינה על ידי משקעים מבוססי פולימרים ושלבי צנטריפוגה. לאחר השעיית EV מלאה, EVs אסטרוציטים נבחרים על ידי לכידה חיסונית עם נוגדנים אנטי-GLAST ביוטיניליים (ACSA-1) ומיקרו-חרוזים מגנטיים אנטי-ביוטין. קיצורים: ACSA-1 = אנטיגן 1 על פני תא אסטרוציטים; ADEVs = שלפוחיות חוץ-תאיות שמקורן באסטרוציטים; DPBS = מי מלח חוצץ פוספט של Dulbecco; EVs = שלפוחיות חוץ-תאיות; GLAST = טרנספורטר גלוטמט-אספרטט; ללא ADEVs = שלפוחיות חוץ-תאיות לא אסטרוציטיות; ללא EVs = ללא שלפוחיות חוץ-תאיות (פלזמה מדולדלת EV); PIC = קוקטייל מעכב פרוטאז; RT = טמפרטורת החדר. הדמות נוצרה באמצעות BioRender. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. אימות פרוטוקול
- אפיון מקטע EV הכולל לפני לכידה חיסונית
- השתמש ב-EVs כוללים ליזים (גלולה מושעה לאחר משקעים פולימריים) ודגימות פלזמה מדוללות לניתוח כתמים מערביים. השלימו את הדגימות עם מאגר דגימה 4x Laemmli (5 מיקרוליטר עבור 15 מיקרוליטר דגימה), הרתיחו במשך 10 דקות ב-90 מעלות צלזיוס והעמיסו על ג'ל אקרילאמיד 10% ללא כתמים.
- בצע אלקטרופורזה של ג'ל SDS-polyacrylamide (SDS-PAGE) במאגר Tris/Glycine/SDS ב-80 וולט למשך 30 דקות, ואחריו 200 וולט למשך 40 דקות. לאחר ה-SDS-PAGE, הסר את הג'ל מלוחות הזכוכית ודמיין את תכולת החלבון הכוללת לאחר עירור UV של דקה אחת.
- העבירו את החלבונים מהג'ל לקרום PVDF 0.2 מיקרומטר המופעל על ידי מתנול דרך מערכת חצי יבשה ב-25 וולט, 2.5 A למשך 10 דקות (ראה טבלת חומרים לפרטים על ציוד). לאחר ההעברה, יש לחסום את הממברנה במאגר חוסם למשך 5 דקות בטמפרטורת החדר ולאחר מכן לדגור למשך הלילה ב-4 מעלות צלזיוס עם הנוגדנים העיקריים לאליקס (1:1000), CD9 (1:1000) או קלנקסין (1:1000); ראה טבלת חומרים לפרטים.
- שטפו את הממברנה במי מלח עם 0.1% Tween 20 (TBST) שלוש פעמים למשך 10 דקות ודגרו למשך שעה בטמפרטורת החדר עם נוגדן משני HRP נגד ארנב מדולל ב-1:7500 במאגר חוסם. שוטפים את הממברנה ב- TBST ארבע פעמים למשך 10 דקות. בצע את כל שלבי הכביסה והדגירה עם תסיסה עדינה של הממברנה על נדנדת ספסל.
- מערבבים ביחס של 1:1 את התמיסה הכימילומינסנט עם מאגר החמצן ודוגרים על הממברנות למשך 5 דקות בטמפרטורת החדר. חשוף ורכוש רצועות באמצעות מערכת הדמיה כימילומינסנציה (ראה טבלת חומרים לפרטים).
- אימות ההעשרה של סמנים ספציפיים לאסטרוציטים בשבר ADEV
הערה: חלבון חומצי סיבי גליה (GFAP) הוא חלבון חוט הביניים העיקרי בתאים אסטרוציטים ומרכיב חיוני בשלד הציטו שלהם במהלך ההתפתחות. ניתן לזהות GFAP ברקמת המוח ובנוזלים ביולוגיים בהיותו סמן אסטרוציטים ידוע39. לכן, סמן זה כומת באמצעות טכנולוגיה מסחרית לזיהוי סמנים ביולוגיים כדי להדגים את ההעשרה של סמנים שמקורם באסטרוציטים במקטע ADEV. טכנולוגיית סמנים ביולוגיים זו היא טכניקה רגישה במיוחד המאפשרת מדידה של מולקולות חלבון בודדות ברגישות של עד פי 1,000 מבדיקות אימונולוגיות קונבנציונליות. טכניקה זו מבוססת על שימוש במיקרו-חלקיקים פרמגנטיים יחד עם נוגדנים שנועדו להיקשר למטרות ספציפיות40,41 (ראה טבלת חומרים).- השתמש בדגימות EV ליז לניתוח סמנים ביולוגיים. כדי לבדוק את ההעשרה של סמני אסטרוציטים, השווה את רמות ה-GFAP ב-eluate (ADEVs) לעומת הזרימה (ללא ADEVs) באמצעות בדיקה חיסונית מסחרית אולטרה-רגישה.
- לדלל את הדגימות ביחס של 1:4 (25 מיקרוליטר של EVs + 75 מיקרוליטר של מאגר בדיקה), להכין את הכיולים ולבצע את הבדיקה בציוד זיהוי הסמנים הביולוגיים, כמפורט בהוראות היצרן (ראה טבלת חומרים). ניתן לדלל את הדגימות ישירות על הצלחת.
- בדוק את הדגימות והכיולים בשכפול. טווח הכימות של בדיקת GFAP היה 1.37-1000 pg/mL. השתמש בפלטפורמת ניתוח התוכנה של היצרן כדי לחשב את ריכוזי ה-GFAP מעקומת הכיול.
- כדי להעריך את מקדם השונות (CV) של הפרוטוקול להעשרת סמני אסטרוציטים, יש למדוד את רמות ה-GFAP בתכשירי ADEV המתקבלים משכפולים זהים של דגימות פלזמה אנושיות מאוגדות ולחשב את ה-CV כסטיית תקן/ממוצע x 100. בפרוטוקול זה, ה-CV חושב באמצעות N = 10 דגימות פלזמה זהות.
- אימות העשרת סמני EV בשבר ADEV
- כדי לאמת את ההעשרה של סמני EV, מדוד את רמות Alix ו-CD81 על ידי ELISA (ראה טבלת חומרים) בדגימות EV לא מדוללות, בהתאם להמלצות היצרן. בדוק דגימות וכיולים בשכפול.
- קרא את הלוחות ב-450 ננומטר ו-570 ננומטר באמצעות קורא מיקרו-פלטות. השתמש בעקומת כיול ליניארית כדי לחשב את ריכוזי Alix ו-CD81. טווח הכימות עבור בדיקת Alix היה 47-3000 pg/mL ועבור CD81 הוא היה 0.156-10 ננוגרם/מ"ל.
- אפיון הגודל והמורפולוגיה של ADEVs
- ניתוח מעקב אחר ננו-חלקיקים
- השתמש בניתוח מעקב אחר ננו-חלקיקים (NTA) כדי למדוד את ריכוז החלקיקים והתפלגות הגודל של תכשירי EV טריים שאינם ליזים.
- לדלל מתלי ADEV טריים ולא ליזים (10 מיקרוליטר) עם PBS מסונן בהתאם לטווח הזיהוי של המכשיר (20-100 חלקיקים/מסגרת), באמצעות התוכנה המצורפת, הקלט שלושה סרטוני 60 שניות עם הגדרות כדלקמן: קצב זרימת מזרק ב-30 a.u., רמת מצלמה ב-13 וסף הזיהוי ב-5. תקן את ריכוזי החלקיקים עבור נפח דגימת הקלט, נפח השעיית EV והדילול הדרושים לקריאת NTA.
הערה: מומלץ לדמיין מראש דגימה המכילה את פתרון הרכב החשמלי כדי לאמת את אפקט המטריצה ואת טוהר המדיום שבו מושעים רכבים חשמליים.
- מיקרוסקופ אלקטרונים קריו
- השתמש במיקרוסקופ אלקטרונים קריו (Cryo-EM) כדי לאשר את הנוכחות והמורפולוגיה של Evs בתרחיפים טריים של ADEV (4 מיקרוליטר). זגוגי את הדגימות באמצעות מקפיא צלילה מסחרי על רשתות פחמן Holey עם ההגדרות הבאות: 3.9 מיקרוליטר של דגימה, זמן המתנה 10 שניות, זמן כתמים 2 שניות.
- צללו לתוך אתאן-חנקן נוזלי בתחנת עבודה קריו. העבר את הרשתות למחזיק קריו הנשמר בטמפרטורה של -179 מעלות צלזיוס לניתוח מיקרוסקופ אלקטרונים שידור. בדוק את הרכבים החשמליים עם מיקרוסקופ אלקטרונים שידור הפועל במתח מאיץ של 200 קילו וולט ומצויד במצלמת CCD. רכוש מיקרוגרפים באמצעות תוכנה.
- ניתוח מעקב אחר ננו-חלקיקים
- ניתוח משקעים משותפים של ליפופרוטאין
- קבע רמות ApoB אנושיות בפלזמה לא מדוללת, דגימות EV כוללות ודגימות ADEV ליז עם בדיקה אימונוטורבידימטרית באמצעות ערכה מסחרית המותאמת לאוטו-אנלייזר מסחרי (ראה טבלת חומרים לפרטים נוספים).
- ניתוח סמנים דלקתיים ב-ADEVs
- השתמש בבדיקה מבוססת חרוזים (ראה טבלת חומרים) כדי לכמת את הריכוז של 25 סמנים דלקתיים: אאוטקסין, IFN Alpha2, IFN Gamma, IL-1 Alpha, IL-1 Beta, IL-3, IL-6, IL-8, IL-10, IL-12 (p40), IL-12 (p70), IL-15, IL-17A, IL-17E/IL-25, IL-17F, IL-18, IP-10, MCP-1, MCP-3, MDC, MIP-1 Alpha, MIP-1 Beta, TGF Alpha, TNF Alpha, TNF Beta.
- השתמש בתכשירי EV לא מדוללים (25 מיקרוליטר) ודגר את הדגימות עם החרוזים למשך הלילה בטמפרטורה של 4 מעלות צלזיוס, בהתאם להוראות היצרן. שוטפים את הצלחת, דוגרים עם 25 מיקרוליטר של נוגדנים לזיהוי, ודוגרים למשך שעה עם תסיסה בטמפרטורת החדר.
- מוסיפים 25 מיקרוליטר של Streptavidin-PE לכל באר ודוגרים למשך 30 דקות בטמפרטורת החדר. מוסיפים 150 מיקרוליטר נוזל נדן ודוגרים למשך 5 דקות תחת תסיסה. קרא את הלוחית על קורא הלוחות המחובר למערכת.
הערה: טכניקה זו מבוססת על בדיקות אימונולוגיות באמצעות נוגדנים הנקשרים לפני השטח של מיקרו-חרוזים מגנטיים מצופים פלואורסצנט. טכנולוגיה זו מקודדת באופן פנימי מיקרוספירות לפי צבען בצבעים שונים. כל סוג של מיקרוספירה מצופה בנוגדני לכידה ספציפיים, כך שחרוזים מצומדים מרובים לוכדים את האנליטים המוטמעים בדגימות, ומאפשרים זיהוי כמותי של עשרות אנליטים בו זמנית. המערכת משתמשת בפלטפורמת הבדיקה החיסונית המרובה מבוססת החרוזים לזיהוי אותות43.
3. ניתוח נתונים
- ביצוע ניתוחים סטטיסטיים באמצעות תוכנה מסחרית. העריכו את נורמליות הנתונים באמצעות מבחן שפירו-וילק. בדוק השוואות של שתי קבוצות עם מבחן Mann-Whitney U והשוואות של שלוש קבוצות עם מבחן Kruskal-Wallis ותיקון פוסט-הוק של דאן. הגדר את המשמעות ב- p < 0.05.
תוצאות
הבידוד של ADEVs מפלזמה שנאספה מתורמים בריאים הושג בהצלחה. נעשה שימוש בשיטת משקעים מבוססת פולימרים כדי להשיג את חלק ה-EV הכולל, ואחריו לכידה חיסונית עם מיקרו-חרוזים מגנטיים להשגת ADEVs.
ניתוח הכתם המערבי של מקטע ה-EV הכולל לפני שלב הלכידה החיסונית הצביע על היעדר ק?...
Discussion
רכבים חשמליים זכו לעניין רב במחקר ביו-רפואי בשל הפוטנציאל האבחוני והטיפולי שלהם. נכון לעכשיו, אחת המגבלות העיקריות הקשורות לשיטות בידוד EV היא היעדר קונצנזוס מתודולוגי ופרוטוקולים סטנדרטיים. מחקר זה מספק פרוטוקול מפורט להעשרת EVs אסטרוציטים מפלזמה אנושית באמצעות מש...
Disclosures
ד"ר בלבין דיווח על קבלת עמלות אישיות מ-ADx NeuroSciences מחוץ לעבודה שהוגשה. ד"ר אלקולאה דיווח על קבלת עמלות אישיות עבור שירותי הוועדה המייעצת ו/או כבוד של דוברים מ-Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. ו-Esteve מחוץ לעבודה שהוגשה. ד"ר לאו שימש כיועץ או בוועדות מייעצות עבור Fujirebio-Europe, Roche, Biogen, Grifols ו-Nutricia מחוץ לעבודה שהוגשה. ד"ר פורטיאה דיווח על קבלת שכר אישי עבור שירות בוועדות המייעצות, ועדות השיפוט או כבוד של דוברים מ-AC Immune, Novartis, Lundbeck, Roche, Fujirebio ו-Biogen מחוץ לעבודה שהוגשה. ד"ר אלקולאה, בלבין, לאו ופורטיאה מדווחים על פטנט על סמנים של סינפטופתיה במחלות ניווניות (ברישיון ADx, EPI8382175.0). לא דווח על גילויים נוספים. לכל הסופרים האחרים אין שום דבר אחר לחשוף.
Acknowledgements
המחברים מבקשים להודות לעזרתם של סוראיה טורס, שיימה אל בונאסרי אל בנאדי ואוריול סאנצ'ז לופז לטיפול והכנת דגימות. ברצוננו גם להודות לשיתוף הפעולה של חוסה אמבל ברנבה, מ-ICTS "NANBIOSIS", יחידה 6 (היחידה של CIBER בביו-אינינגיינרינג, ביו-חומרים וננו-רפואה) של המכון למדעי החומרים בברצלונה, מרטי דה קאבו ג'אומה מהיחידה למיקרוסקופיה אלקטרונית באוניברסיטה האוטונומית של ברצלונה, ד"ר מרתה סולר קסטני וליה רוס בלנקו מפלטפורמת ציטומטריית הזרימה במכון המחקר הביו-רפואי סנט פאו (IIB-Sant Pau), כמו גם ד"ר ג'ואן קרלס אסקולה-גיל מקבוצת הפתופיזיולוגיה של מחלות הקשורות לליפידים ב-IIB-Sant Pau לעזרה בקביעות NTA, cryo-EM, Luminex ו-ApoB, בהתאמה.
המחברים מודים לתמיכה כספית מקרן Jérôme Lejeune (פרויקט #1941 ו-#1913 ל-MFI ו-MCI), Instituto de Salud Carlos III (PI20/01473 ל-JF, PI20/01330 ל-AL, PI18/00435 ל-DA, ו-INT19/00016 ל-DA), המכון הלאומי לבריאות (1R01AG056850-01A1, R21AG056974 ו-R01AG061566 ל-JF), איגוד האלצהיימר והמכון העולמי לבריאות המוח (GBHI_ALZ-18-543740 ל-MCI), האגודה לניוון פרונטו-טמפורלי (מלגת פוסט-דוקטורט למחקר קליני, AFTD 2019–2021) ל-ODI, ו-Societat Catalana de Neurologia (Premi Beca Fundació SCN 2020 ל-MCI). עבודה זו נתמכה גם על ידי תוכנית CIBERNED (תוכנית 1, מחלת אלצהיימר ל-AL ומחקר SIGNAL. SS הוא זוכה במענק פוסט-דוקטורט "Juan de la Cierva-Incorporación" (IJC2019-038962-I) על ידי Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España).
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
References
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved