JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 혈장에서 성상세포 유래 세포외 소포체의 농축(Enrichment of Astrocyte-derived Extracellular Vesicles from Human Plasma
요약
이 프로토콜은 인간 혈장에서 성상세포 유래 세포외 소포체(ADEV)의 농축을 설명합니다. 이는 폴리머 침전에 의한 EV의 분리를 기반으로 하며, ADEV의 ACSA-1 기반 면역 캡처를 기반으로 합니다. ADEV의 분석은 액체 생검에 의해 비침습적으로 살아있는 환자의 염증 경로 변화를 연구할 수 있는 단서를 제공할 수 있습니다.
초록
세포외 소포체(EV)는 세포 통신 및 폐기물 제거를 위해 모든 세포에서 분비되는 생물학적 나노 입자입니다. 그들은 생리학적, 병리학적 조건에서 다른 세포에 작용하고 화물을 다른 세포로 이동시킴으로써 광범위한 기능에 참여합니다. EV는 생체 유체에 존재한다는 점을 감안할 때 질병 과정을 연구하기 위한 훌륭한 자원이며 바이오마커 발견을 위한 액체 생검으로 간주될 수 있습니다. EV 분석의 매력적인 측면은 기원 세포의 마커를 기반으로 선택할 수 있으므로 화물에 있는 특정 조직의 환경을 반영할 수 있다는 것입니다. 그러나 EV 절연 방법과 관련된 주요 단점 중 하나는 방법론적 합의와 표준화된 프로토콜이 부족하다는 것입니다. 성상세포(astrocyte)는 뇌에서 필수적인 역할을 하는 신경교세포(glial cell)입니다. 신경퇴행성 질환에서 성상세포 반응은 EV 화물 및 비정상적인 세포 통신을 변경하여 질병 진행을 촉진/향상시킬 수 있습니다. 따라서 성상교세포 EV의 분석은 바이오마커 및 잠재적인 질병 표적의 발견으로 이어질 수 있습니다. 이 프로토콜은 인간 혈장에서 성상세포 유래 EV(ADEV)를 농축하는 2단계 방법을 설명합니다. 첫째, EV는 폴리머 기반 침전을 통해 제세된 플라즈마에서 농축됩니다. 그 다음에는 자기 마이크로 비드를 사용한 ACSA-1 기반 면역 캡처를 통해 ADEV를 농축하며, 여기서 재현탁된 EV는 자기장에 배치된 기둥에 적재됩니다. 자기 라벨링된 ACSA-1+ EV는 컬럼 내에 유지되고 다른 EV는 통과합니다. 자석에서 컬럼이 제거되면 ADEV가 용리되어 저장 및 분석할 준비가 됩니다. 성상세포 마커의 농축을 검증하기 위해 신경교세포섬유산단백질(GFAP) 또는 세포 내 기원의 기타 특정 성상세포 마커를 용리액에서 측정하고 플로우 스루(flow-through)와 비교할 수 있습니다. 이 프로토콜은 성상세포 관련 마커를 검사하기 위한 플랫폼으로 사용할 수 있는 혈장에서 ADEV를 농축하는 쉽고 시간 효율적인 방법을 제안합니다.
서문
세포외 소포체(EV)는 모든 유형의 세포에서 분비되는 막질 나노입자의 이질적인 그룹으로, 단백질, 지질 및 핵산을 운반합니다1. 미세소포체(100-1000 nm), 엑소좀(30-100 nm) 및 자가사멸체(1000-5000 nm)가 주요 EV 유형을 구성하며, 원산지 2,3에 따라 구별됩니다. EV는 항원 제시 및 면역 반응4, 수용체 재생, 대사 산물 제거5,세포 소통6과 같은 중요한 생리적 과정을 조절합니다. 이러한 과정의 조절은 EV 세포막에 풍부한 단백질과 수용 세포의 표적 사이의 직접 결합 및/또는 수용 세포의 세포질에서 화물의 내재화 및 방출을 통해 발생할 수 있습니다7. EV는 필수적인 세포 기능을 수행하지만 암 및 신경학 분야에서 병리학적 관점에서 점점 더 많은 관심을 받고 있습니다. 실제로, 여러 연구에 따르면 EV는 종양 세포 이동을 촉진하는 데 도움이 될 수 있습니다 8,9 또는 알츠하이머병과 같은 신경퇴행성 질환에서 종자 독성 단백질 응집체10,11.
EV는 기원 세포와 관련된 세포 표면 마커를 기반으로 생체 유체에서 선택하고 농축할 수 있으므로 화물에 있는 특정 조직의 환경을 반영합니다 12,13,14,15,16,17,18,19,20. 또한 혈액, 뇌척수액(CSF), 타액, 소변 및 모유에 존재한다는 점을 감안할 때 EV는 진단을 위한 탁월한 비침습적 도구이며 바이오마커 발견을 위한 액체 생검으로 간주될 수 있습니다. 이것은 CSF 이외의 접근 가능한 유체에서 뇌 분석물을 연구하는 어려움이 있다는 점을 감안할 때 신경학에서 특별한 관심을 끌고 있습니다.
성상세포(astrocyte)는 신경-혈관 소통(neuro-vascular communication)의 교차점에 있기 때문에 점점 더 많은 관심을 받고 있다21. 생리학적 조건 하에서, 그들은 혈액-뇌 장벽의 보존, 신경 전달 물질의 재활용, 뉴런 및 기타 신경교세포에 대한 영양분 및 성장 인자의 공급을 담당합니다 22,23,24 뿐만 아니라 전염증 상태에서 항염증 상태로 또는 그 반대로 신진대사 가소성을 감안할 때 신경 면역 방어 25,26,27. 성상세포가 조절 기능을 수행하는 중요한 메커니즘은 EV를 통한 의사소통입니다28,29. 반응성 성상세포작용은 알츠하이머병,30 다계통 위축증(MSA), 진행성 핵상마비(PSP)31 및 근위축성 측삭 경화증(ALS)32과 같은 여러 신경퇴행성 질환의 주요 특징입니다. 성상세포 반응성은 전기차 화물의 변화, 염증 매개체의 방출 및 비정상적인 세포 통신을 유발할 수 있으며, 따라서 병리학의 확산을 촉진하고 신경 퇴행을 유발할 수 있습니다10,11. 따라서 성상세포 유래 EV(ADEV)와 그 화물의 변화를 연구하는 것은 비침습적 방식으로 신경퇴행성 과정을 조사할 수 있는 매력적인 자원입니다.
현재 EV의 격리를 위한 여러 방법론이 존재하며, 각 방법론에는 해당 장점과 단점이 있습니다33. 관심의 최종 응용 프로그램에 따라 특정 용도에 더 적합한 방법을 고려하는 것이 중요합니다. 신경학 분야에서, 더 구체적으로 말하자면, 성상세포 연구에서는 고분자 기반 침전 후 면역 캡처가 주로 사용되는 방법이었습니다 12,18,19,20,34. 그러나 동일한 접근 방식을 적용하더라도 EV 분리에 적용된 여러 단계의 연구 간에 이질성이 남아 있습니다. 따라서 성상교세포 EV 연구를 촉진하고 재현성을 연구하기 위해 명확하고 단계적으로 표준화된 방법론이 필요합니다. 폴리머 기반 침전은 복잡한 장비가 필요하지 않은 빠르고 간단한 절차라는 점을 감안할 때 바이오마커 스크리닝을 용이하게 하여 생물학적 활성에 영향을 주지 않고 EV의 높은 수율로 이어집니다35.
본 프로토콜은 인간 혈장에서 ADEV를 농축하기 위한 상세하고 간단한 2단계 방법을 설명합니다. 이는 총 EV 분획의 폴리머 기반 침전을 기반으로 한 후 성상교세포 EV의 면역 캡처를 기반으로 합니다. 성상세포의 중요한 기능을 감안할 때, ADEV 분석은 비침습적 방식으로 연구할 수 있는 바이오마커 및 뇌 염증 경로의 발견에 빛을 비출 수 있습니다.
프로토콜
이 프로토콜에 설명된 연구는 스페인 바르셀로나에 있는 Sant Pau Initiative on Neurodegeneration(SPIN) 코호트의 남녀 건강한 성인 기증자(연령 범위 65.9-81.3세, 여성 45.5%)의 인간 혈장 샘플로 수행되었습니다. 참가자들은 정보에 입각한 동의를 했습니다. 이 연구는 헬싱키 선언과 스페인 법에 포함된 의학 연구에 대한 국제 윤리 지침에 따라 수행되었습니다. 산트 파우 연구 윤리 위원회(Sant Pau Research Ethics Committee, CEIC)는 SPIN 코호트(#16/2013)에서 인간 혈장 샘플의 수집 및 보관을 위한 프로토콜을 검토하고 승인했습니다.
1. 인간 플라즈마에서 성상세포 EV의 농축
참고: 이 프로토콜에는 인간 혈장 샘플의 사용이 포함됩니다. 이 프로토콜에 사용된 시약 및 실험실 재료에 대한 모든 세부 정보는 재료 표에 포함되어 있습니다. 이 절차에는 특별한 장비가 필요하지 않지만, 각 제조업체에서 개별적으로 지정한 대로 각 시약의 안전성 고려 사항을 검토하십시오.
- 시료 채취 및 보관
- 혈장 수집을 위한 표준화된 프로토콜에 따라 라벤더 EDTA 액포 튜브에 혈액을 수집합니다36,37. 2000 x g에서 10분 동안 4°C에서 원심분리기, 혈장 분리를 위해 채취한 후 30-120분 이내. 상층액으로 나타나는 상층부의 투명한 액체인 혈장을 500μL 분취액에서 분리합니다.
- 세포 파편을 제거하려면 실온에서 15분 동안 3000 x g 의 부분 표본을 원심분리합니다. 상등액을 회수합니다. 분석할 때까지 플라즈마를 -80°C에서 보관하십시오. 생체 유체 분석의 일반적인 관행과 같이, 보관 전에 샘플을 분취하고 3회 이상의 동결-해동 주기를 피하십시오.
- 종합 EV 농축
참고: 사용되는 모든 시약은 0.22μm 필터를 통해 여과해야 합니다.- 500μL의 혈장 샘플을 해동합니다. 트롬빈을 1:100 비율로 첨가하여 응고 인자를 제거합니다. 반전으로 세 번 혼합하고 실온에서 5분 동안 그대로 두십시오.
- Dulbecco의 인산염 완충 식염수(DPBS) 작업 용액인 DPBS + 3x 농축 단백질 분해 효소 억제제 칵테일(10x 단백질 분해 효소 억제제 칵테일 스톡에서 희석)으로 1mL에 도달하도록 부피를 완성합니다. 반전으로 혼합합니다.
- 6000 x g 에서 4°C에서 20분 동안 시료를 원심분리합니다. 상등액을 회수합니다. DBPS 작업 솔루션으로 1mL에 도달하도록 부피를 완성합니다.
- 252μL의 EV 침전 용액을 추가하고 반전으로 3회 혼합합니다. 4 °C에서 60 분 동안 배양합니다.
- 1500 x g 에서 4°C에서 20분 동안 샘플을 원심분리하여 총 EV 분획(펠렛)을 침전시킵니다. 상층액 1mL를 수집합니다. 분획을 EV 고갈 플라즈마로 표시하여 EV 농축 마커(EV 없음)의 음성 대조군으로 사용하고 -80°C에서 보관합니다.
- 남은 펠릿을 1500 x g 에서 4°C에서 5분 동안 원심분리합니다. 남은 상층액은 버립니다. 농축된 프로테아제 및 인산가수분해효소 억제제(최종 농도 3x, 100x 저장에서 희석, 재료 표 참조)를 포함하는 500μL의 초순수에 펠릿을 재현탁합니다.
- 거품을 피하기 위해 펠릿을 느슨하게하기 위해 위아래로 피펫을 세게 움직입니다. 회전식 튜브 셰이커에서 완전히 재현탁될 때까지 실온에서 30분 동안 소용돌이치고 교반합니다. 완전한 펠릿 재현탁은 후속 면역포획 단계에서 중요한 단계이므로 반드시 보장해야 합니다.
- ADEV의 면역 캡처
참고: ADEV에는 성상세포 마커가 있습니다. immunocapture를 통한 ADEV 농축을 위해 선택된 마커는 GLAST입니다. GLAST는 glutamate-aspartate transporter (UniProtKB-P43003)의 약자로, 소뇌와 대뇌 신피질에서 성상세포에 의해 주로 발현되는 가장 풍부한 글루타메이트 수송체입니다38. anti-GLAST(ACSA-1, astrocyte cell surface antigen-1) 항체는 GLAST의 세포외 항원결정기에 특이적이며 성상세포 식별을 위해 개발되었습니다. 인간 혈장 12,20,34에서 ADEV의 면역 캡처에 가장 널리 사용되는 표적입니다.- 총 EV 제제를 포함하는 각 샘플에 10μL의 anti-GLAST(ACSA-1) 비오틴화 항체를 추가합니다. 잘 부드럽게 섞습니다. 회전식 튜브 셰이커에서 4 °C에서 1 시간 동안 배양합니다.
- 단클론 항비오틴 항체(마우스 IgG1)에 접합된 10μL의 마그네틱 마이크로비드를 추가합니다. 잘 부드럽게 섞습니다. 회전식 튜브 셰이커에서 4 °C에서 1 시간 동안 배양합니다.
- MACS 분리기의 자기장에 마이크로 컬럼을 배치합니다. 500μL의 PBS-0.5% 소 혈청 알부민(BSA)으로 헹궈 컬럼을 준비합니다. 플로우 스루를 폐기합니다.
- EV/ACSA-1/마이크로비드 현탁액을 컬럼에 로드합니다. 이 단계에서 플런저로 누르지 마십시오. 플로우 스루를 수집합니다. 이를 비성상세포 EV(ADEV 없음)로 레이블을 지정하고 필요한 경우 대조군으로 유지합니다.
- 500μL의 PBS-0.5% BSA로 컬럼을 두 번 세척합니다. 플로우 스루를 폐기합니다.
- 자기 분리기에서 컬럼을 제거하고 점착력이 낮은 1.5mL 수집 튜브에 넣습니다. 컬럼에 500μL의 PBS-0.5% BSA를 피펫으로 분사합니다. 플런저로 컬럼에 단단히 밀어 넣고 용리액을 수집합니다.
- 레이블을 ACSA-1+ EV(ADEV)로 지정합니다. 용해되지 않은 EV는 단기간(-20°C) 또는 -80°C(>6개월)에서 단기간 동안 보관하십시오.
참고: Anti-ACSA-1 항체는 GLAST-1/EAAT-1 에피토프에 결합합니다. 마그네틱 마이크로비즈는 anti-ACSA-1-EV 복합체에 친화력으로 결합합니다. MACS 마이크로 컬럼에는 라벨링된 ADEV를 유지하는 데 필요한 자석에 배치할 때 강력한 자기장을 생성하도록 최적화된 매트릭스가 포함되어 있습니다.
ADEV 농축 절차의 개략도는 그림 1을 참조하십시오.
- EV의 용해
참고: EV는 방포내 마커를 감지하기 위해 완전히 용해되어야 합니다. 화학적 용해 후 기계적 용해와 같은 두 가지 순차적 방법을 사용하는 것이 좋습니다.- 150μL 추출 시약당 100μL 샘플의 비율로 단백질 추출 시약( 재료 표 참조)을 추가하여 EV의 화학적 용해를 수행합니다. 100x 프로테아제 및 포스파타제 억제제를 첨가하여 1x 최종 농도에 도달합니다. 격렬하게 소용돌이를 일으키고 실온에서 15분 동안 그대로 두십시오.
- 2단계 절차로 기계적 용해를 수행합니다: 화학적으로 용해된 EV 용액을 주사기에 두 번(G29 바늘) 통과시킵니다. 그런 다음 초음파 냉수 수조에서 45초 동안 샘플을 초음파 처리합니다. 용해된 EV를 -80°C에서 동결합니다.
- 샘플을 37°C에서 5분 동안 해동합니다. 용해된 EV의 보관을 위해 -80 °C에서 다시 동결하십시오. 분석하기 전에 37°C에서 5분 동안 다시 해동합니다.
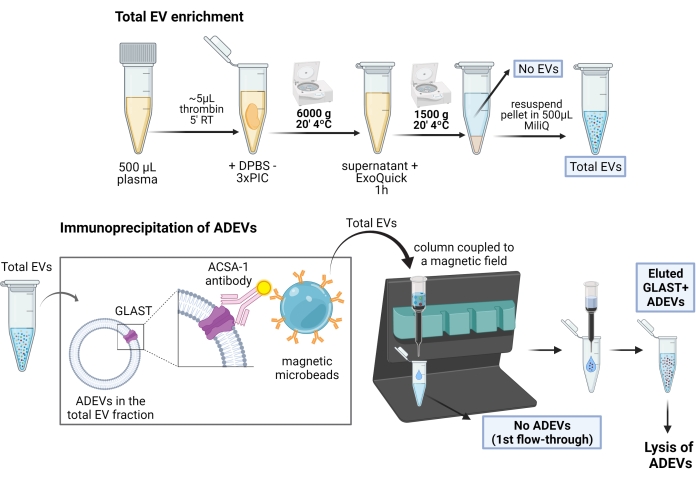
그림 1: 성상교세포 유래 EV의 농축을 위한 2단계 절차의 개략도 . 첫 번째 단계에서 EV는 폴리머 기반 침전 및 원심분리 단계를 통해 제세된 인간 플라즈마에서 농축됩니다. 전체 EV 재현탁 후, 비오틴화 항 GLAST(ACSA-1) 항체 및 항비오틴 자성 마이크로비드를 사용한 면역 캡처로 성상세포 EV를 선택합니다. 약어: ACSA-1 = 성상세포 세포 표면 항원-1; ADEVs = 성상세포 유래 세포외 소포체; DPBS = Dulbecco의 인산염 완충 식염수; EVs = 세포외 소포체; GLAST = 글루타메이트-아스파르테이트 수송체; ADEV 없음 = 비성상세포 세포외 소포체; EVs 없음 = 세포외 소포체 없음(EV-고갈 혈장); PIC = 프로테아제 억제제 칵테일; RT = 실온. BioRender로 만든 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 프로토콜 검증
- 면역포획 전 총 EV 비율의 특성화
- 웨스턴 블롯 분석을 위해 용해된 총 EV(폴리머 침전 후 재현탁 펠릿) 및 희석된 혈장 샘플을 사용합니다. 샘플에 4x Laemmli 샘플 버퍼(15μL 샘플의 경우 5μL)를 보충하고 90°C에서 10분 동안 끓인 다음 10% 무염색 아크릴아마이드 겔에 로드합니다.
- Tris/Glycine/SDS 버퍼에서 80V에서 30분 동안 SDS-폴리아크릴아미드 겔 전기영동(SDS-PAGE)을 수행한 다음 40분 동안 200V를 수행합니다. SDS-PAGE에 따라 유리판에서 젤을 제거하고 1분 UV 여기 후 총 단백질 함량을 시각화합니다.
- 10분 동안 25V, 2.5A의 반건조 시스템을 통해 겔의 단백질을 메탄올 활성화 0.2μm PVDF 멤브레인으로 이동합니다(장비에 대한 자세한 내용은 재료 표 참조). 이식 후 실온에서 5분 동안 차단 버퍼에서 멤브레인을 차단한 후 Alix(1:1000), CD9(1:1000) 또는 Calnexin(1:1000)에 대한 1차 항체로 4°C에서 밤새 배양합니다. 자세한 내용은 재료 표를 참조하십시오.
- 0.1% Tween 20(TBST)을 첨가한 Tris-buffered saline에서 멤브레인을 10분 동안 3회 세척하고 차단 버퍼에서 1:7500으로 희석된 anti-rabbit HRP 2차 항체로 실온에서 1시간 동안 배양합니다. TBST에서 멤브레인을 10분 동안 4회 세척합니다. 모든 세척 및 배양 단계를 벤치 로커에서 멤브레인을 부드럽게 교반하여 수행합니다.
- 화학발광 용액과 과산화물 완충액을 1:1 비율로 혼합하고 실온에서 5분 동안 멤브레인을 배양합니다. 화학발광 이미징 시스템을 사용하여 밴드를 노출시키고 획득합니다(자세한 내용은 재료 표 참조).
- ADEV 분획에서 성상세포 특이적 마커의 농축 검증
참고: 신경교섬유산성 단백질(GFAP)은 성상세포의 주요 중간 필라멘트 단백질이며 발달 중 세포골격의 필수 요소입니다. GFAP는 뇌 조직 및 생체액에서 검출될 수 있으며, 이는 잘 알려진 성상세포 마커39입니다. 따라서 이 마커는 ADEV 분획에서 성상세포 유래 마커의 풍부함을 입증하기 위해 상용 바이오마커 검출 기술을 사용하여 정량화되었습니다. 이 바이오마커 기술은 기존 면역액보다 최대 1,000배 더 높은 감도로 단일 단백질 분자를 측정할 수 있는 초고감도 기술입니다. 이 기술은 특정 표적40,41에 결합하도록 설계된 항체와 결합된 상자성 미세입자의 사용을 기반으로 합니다(재료표 참조).- 바이오마커 분석을 위해 용해된 EV 샘플을 사용합니다. 성상세포 마커의 농축을 테스트하려면 상용 초고감도 면역분석법을 사용하여 용리액(ADEV)의 GFAP 수치와 관류(ADEV 없음)를 비교하십시오.
- 샘플을 1:4 비율(EV 25μL + 분석 버퍼 75μL)로 희석하고, 보정기를 준비하고, 제조업체의 지침에 따라 바이오마커 검출 장비에서 분석을 수행합니다( 재료 표 참조). 샘플은 플레이트에서 직접 희석할 수 있습니다.
- 샘플과 캘리브레이터를 복제하여 테스트합니다. GFAP 분석의 정량 범위는 1.37-1000pg/mL였습니다. 제조업체의 소프트웨어 분석 플랫폼을 사용하여 검량선에서 GFAP 농도를 계산하십시오.
- 성상교세포 마커 농축을 위한 프로토콜의 변동 계수(CV)를 추정하려면 풀링된 인간 혈장 샘플의 동일한 복제에서 얻은 ADEV 제제의 GFAP 수준을 측정하고 CV를 표준 편차/평균 x 100으로 계산합니다. 이 프로토콜에서 CV는 N = 10개의 동일한 혈장 샘플을 사용하여 계산되었습니다.
- ADEV 분율에서 EV 마커의 농축 검증
- EV 마커의 농축을 검증하려면 제조업체의 권장 사항에 따라 용해된 희석되지 않은 EV 샘플에서 ELISA( 재료 표 참조)로 Alix 및 CD81 수준을 측정합니다. 테스트 샘플과 교정기를 중복하여 사용하십시오.
- 마이크로플레이트 리더를 사용하여 450nm 및 570nm에서 플레이트를 판독합니다. 선형 검량선을 사용하여 Alix 및 CD81 농도를 계산합니다. Alix 분석의 정량 범위는 47-3000pg/mL이고 CD81의 경우 0.156-10ng/mL였습니다.
- ADEV의 크기와 형태에 대한 특성화
- 나노 입자 추적 분석
- 나노입자 추적 분석(NTA)을 사용하여 용해되지 않은 새로운 EV 제제의 입자 농도 및 크기 분포를 측정합니다.
- 제공된 소프트웨어를 사용하여 기기의 감지 범위(20-100 입자/프레임)에 따라 여과된 PBS로 신선한 비용해 ADEV 현탁액(10μL)을 희석하고 주사기 유량 30a.u., 카메라 레벨 13, 검출 임계값 5와 같은 설정으로 3개의 60초 비디오를 녹화합니다. 입력 시료 부피, EV 재현탁액 부피 및 NTA 판독에 필요한 희석량에 대한 입자 농도를 수정합니다.
참고: EV가 다시 부유하는 매트릭스 효과와 매체의 순도를 확인하기 위해 EV 차량 솔루션이 포함된 샘플을 사전 시각화하는 것이 좋습니다.
- 초저온 전자 현미경
- 초저온 전자 현미경(Cryo-EM)을 사용하여 용해되지 않은 신선한 ADEV 현탁액(4μL)에서 Ev의 존재 및 형태를 확인합니다. Holey 탄소 그리드의 상업용 플런지 냉동고를 사용하여 시료 3.9μL, 대기 시간 10초, 블롯 시간 2초 설정으로 시료를 유리화합니다.
- 극저온 워크스테이션에서 액체 에탄 질소에 뛰어듭니다. 투과 전자 현미경 분석을 위해 -179 °C로 유지되는 극저온 홀더로 그리드를 옮깁니다. 200kV의 가속 전압에서 작동하고 CCD 카메라가 장착된 투과 전자 현미경으로 EV를 검사합니다. 소프트웨어를 사용하여 현미경 사진을 획득합니다.
- 나노 입자 추적 분석
- 지단백질 동시침전(co-precipation) 분석
- 상용 자기분석기에 적합한 상용 키트를 사용하여 면역탁도계 분석을 통해 희석되지 않은 혈장, 용해된 총 EV 시료 및 용해된 ADEV 시료에서 인간 ApoB 수준을 측정합니다(자세한 내용은 재료 표 참조).
- ADEV의 염증 마커 분석
- 비드 기반 분석법( 재료 표 참조)을 사용하여 25가지 염증 마커의 농도를 정량화합니다: eotaxin, IFN Alpha2, IFN Gamma, IL-1 Alpha, IL-1 Beta, IL-3, IL-6, IL-8, IL-10, IL-12 (p40), IL-12 (p70), IL-15, IL-17A, IL-17E/IL-25, IL-17F, IL-18, IP-10, MCP-1, MCP-3, MDC, MIP-1 Alpha, MIP-1 Beta, TGF Alpha, TNF Alpha, TNF Beta.
- 용해된 희석되지 않은 EV 제제(25μL)를 사용하고 제조업체의 지침에 따라 4°C에서 밤새 비드와 함께 샘플을 배양합니다. 플레이트를 세척하고 25μL의 검출 항체로 배양한 다음 실온에서 교반으로 1시간 동안 배양합니다.
- 각 웰에 25μL의 Streptavidin-PE를 추가하고 실온에서 30분 동안 배양합니다. 150μL의 피복 유체를 추가하고 교반하면서 5분 동안 배양합니다. 시스템에 연결된 플레이트 리더에서 플레이트를 읽습니다.
참고: 이 기술은 형광 코팅된 마그네틱 마이크로비드의 표면에 결합하는 항체를 사용하는 면역 분석을 기반으로 합니다. 이 기술은 내부적으로 다양한 염료를 사용하여 색상별로 마이크로스피어를 코딩합니다. 각 유형의 마이크로스피어는 특정 포획 항체로 코팅되어 있어 여러 개의 공액 비드가 샘플에 포함된 분석물을 캡처하여 수십 개의 분석물을 동시에 정량적으로 다중 검출할 수 있습니다. 이 시스템은 신호 검출을 위해 비드 기반 다중 면역분석 플랫폼을 사용합니다43.
3. 데이터 분석
- 상용 소프트웨어로 통계 분석을 수행합니다. Shapiro-Wilk 검정을 사용하여 데이터 정규성을 평가합니다. Mann-Whitney U 검정을 사용한 두 그룹 비교와 Kruskal-Wallis 검정 및 Dunn의 사후 보정을 사용한 세 그룹 비교. p< 0.05에서 유의성을 설정합니다.
결과
건강한 기증자로부터 채취한 혈장에서 ADEV를 분리하는 작업이 성공적으로 이루어졌습니다. 총 EV 분획을 얻기 위해 폴리머 기반 침전 방법을 사용한 다음 자기 마이크로비드를 사용한 면역 캡처를 수행하여 ADEV를 얻었습니다.
면역 포획 단계 전 총 EV 분획에 대한 웨스턴 블롯 분석은 EV 제제에 칼넥신(calnexin, 세포 오염 마커)이 부족하고 알릭스(Alix)와 ...
토론
EV는 진단 및 치료 가능성으로 인해 생물 의학 연구에 대한 큰 관심을 얻고 있습니다. 현재 EV 격리 방법과 관련된 주요 단점 중 하나는 방법론적 합의와 표준화된 프로토콜이 부족하다는 것입니다. 이 연구는 폴리머 기반 침전 및 GLAST 면역 캡처 를 통해 인간 혈장에서 성상 세포 EV를 농축하기 위한 자세한 프로토콜을 제공합니다.
EV를 체액에서 ...
공개
Belbin 박사는 제출된 연구 외에 ADx NeuroSciences로부터 개인 수수료를 받았다고 보고했습니다. Alcolea 박사는 제출된 논문 외에 Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. 및 Esteve로부터 자문 위원회 서비스에 대한 개인 회비를 받았다고 보고했습니다. Lleó 박사는 제출된 연구 외에도 Fujirebio-Europe, Roche, Biogen, Grifols 및 Nutricia의 컨설턴트 또는 자문 위원회에서 활동했습니다. Fortea 박사는 제출된 논문 외에 AC Immune, Novartis, Lundbeck, Roche, Fujirebio 및 Biogen으로부터 자문 위원회, 심사 위원회 또는 연사 명예 봉사에 대한 개인 수수료를 받았다고 보고했습니다. Alcolea, Belbin, LLeó 및 Fortea 박사는 신경퇴행성 질환의 시냅토병증 마커에 대한 특허를 보유하고 있다고 보고합니다(ADx, EPI8382175.0 라이선스). 다른 공개는 보고되지 않았습니다. 다른 모든 저자는 더 이상 공개할 것이 없습니다.
감사의 말
저자는 시료 취급 및 준비를 위해 Soraya Torres, Shaimaa El Bounasri El Bennadi 및 Oriol Sanchez Lopez의 도움을 받은 것에 감사를 표합니다. 또한 바르셀로나 재료 과학 연구소(Barcelona Materials Science Institute)의 ICTS "NANBIOSIS", unit 6(Unit of CIBER in Bioingineering, Biomaterials & Nanomedicine)의 José Amable Bernabé, Universitat Autonoma de Barcelona의 전자 현미경 유닛의 Marti de Cabo Jaume, Sant Pau Biomedical Research Institute(IIB-Sant Pau)의 유세포 분석 플랫폼의 Marta Soler Castany 박사와 Lia Ros Blanco의 협력에 감사드립니다. IIB-Sant Pau의 지질 관련 질환 병태생리학 그룹의 Joan Carles Escolà-Gil 박사가 각각 NTA, cryo-EM, Luminex 및 ApoB 측정에 도움을 주었습니다.
저자는 Jérôme Lejeune Foundation(프로젝트 #1941 및 #1913을 MFI 및 MCI), Instituto de Salud Carlos III(PI20/01473을 JF로, PI20/01330을 AL로, PI18/00435를 DA로, INT19/00016을 DA로), National Institute of Health(1R01AG056850-01A1, R21AG056974 및 R01AG061566에서 JF), Alzheimer's Association 및 Global Brain Health Institute(GBHI_ALZ-18-543740에서 MCI)의 재정적 지원을 인정합니다. 전두측두엽 퇴행 협회(The Association for Frontotemporal Degeneration, Clinical Research Postdoctoral Fellowship, AFTD 2019–2021)에서 ODI, 카탈로니아 신경학 협회(Societat Catalana de Neurologia, Premi Beca Fundació SCN 2020에서 MCI). 이 작업은 CIBERNED 프로그램(프로그램 1, 알츠하이머병에서 AL까지 및 SIGNAL 연구)의 지원도 받았습니다. SS는 Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España)으로부터 박사후 연구원 "Juan de la Cierva-Incorporación"(IJC2019-038962-I)을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
참고문헌
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유