Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Anreicherung von extrazellulären Vesikeln aus Astrozyten aus menschlichem Plasma
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Anreicherung von extrazellulären Vesikeln (ADEVs) aus Astrozyten-abgeleiteten Vesikeln aus menschlichem Plasma. Es basiert auf der Trennung von EVs durch Polymerfällung, gefolgt von ACSA-1-basiertem Immunocapture von ADEVs. Die Analyse von ADEVs kann Hinweise darauf geben, Veränderungen der Entzündungswege lebender Patienten nicht-invasiv durch Flüssigbiopsie zu untersuchen.
Zusammenfassung
Extrazelluläre Vesikel (EVs) sind biologische Nanopartikel, die von allen Zellen für die zelluläre Kommunikation und Abfallausscheidung sezerniert werden. Sie nehmen an einer Vielzahl von Funktionen teil, indem sie unter physiologischen und pathologischen Bedingungen auf andere Zellen einwirken und diese übertragen. Aufgrund ihres Vorhandenseins in Bioflüssigkeiten stellen EVs eine hervorragende Ressource für die Untersuchung von Krankheitsprozessen dar und können als Flüssigbiopsie für die Entdeckung von Biomarkern angesehen werden. Ein attraktiver Aspekt der EV-Analyse ist, dass sie anhand von Markern ihrer Herkunftszelle ausgewählt werden können und so die Umgebung eines bestimmten Gewebes in ihrer Fracht widerspiegeln. Eines der größten Handicaps im Zusammenhang mit EV-Isolationsmethoden ist jedoch das Fehlen eines methodischen Konsenses und standardisierter Protokolle. Astrozyten sind Gliazellen, die eine wesentliche Rolle im Gehirn spielen. Bei neurodegenerativen Erkrankungen kann die Reaktivität der Astrozyten zu einer veränderten EV-Fracht und einer aberranten zellulären Kommunikation führen, was das Fortschreiten der Krankheit erleichtert/verstärkt. Daher kann die Analyse von Astrozyten-EVs zur Entdeckung von Biomarkern und potenziellen Krankheitszielen führen. Dieses Protokoll beschreibt eine 2-stufige Methode zur Anreicherung von Astrozyten-abgeleiteten EVs (ADEVs) aus menschlichem Plasma. Zunächst werden EVs aus defibriertem Plasma über polymerbasierte Fällung angereichert. Es folgt die Anreicherung von ADEVs durch ACSA-1-basierten Immuncapture mit magnetischen Mikrokügelchen, bei denen resuspendierte EVs auf eine Säule geladen werden, die in einem Magnetfeld platziert ist. Magnetisch markierte ACSA-1+-EVs werden in der Säule zurückgehalten, während andere EVs hindurchfließen. Sobald die Säule aus dem Magneten entfernt wird, werden die ADEVs eluiert und sind bereit für die Lagerung und Analyse. Um die Anreicherung von Astrozytenmarkern zu validieren, können gliale fibrilläre saure Proteine (GFAP) oder andere spezifische astrozytäre Marker intrazellulären Ursprungs im Eluat gemessen und mit dem Durchfluss verglichen werden. Dieses Protokoll bietet eine einfache, zeitsparende Methode zur Anreicherung von ADEVs aus Plasma, die als Plattform zur Untersuchung astrozyt-relevanter Marker verwendet werden kann.
Einleitung
Extrazelluläre Vesikel (EVs) sind eine heterogene Gruppe membranöser Nanopartikel, die von allen Arten von Zellen sezerniert werden und Proteine, Lipide und Nukleinsäuren transportieren1. Mikrovesikel (100-1000 nm), Exosomen (30-100 nm) und apoptotische Körper (1000-5000 nm) stellen die wichtigsten EV-Typen dar, die sich durch ihren Herkunftsort unterscheiden 2,3. EVs regulieren wichtige physiologische Prozesse, wie z. B. die Antigenpräsentation und Immunantwort4, das Rezeptorrecycling, die Eliminierung von Metaboliten5 und die zelluläre Kommunikation6. Die Regulation dieser Prozesse kann durch direkte Bindung zwischen Proteinen, die mit der EV-Zellmembran angereichert sind, und Zielen in Empfängerzellen und/oder durch die Internalisierung und Freisetzung ihrer Fracht im Zytoplasma der Empfängerzelle erfolgen7. Während Elektrofahrzeuge essentielle zelluläre Funktionen erfüllen, haben sie aus pathologischer Sicht in den Bereichen Krebs und Neurologie zunehmend an Interesse gewonnen. In der Tat haben mehrere Studien gezeigt, dass EVs dazu beitragen können, die Migration von Tumorzellenzu fördern 8,9 oder toxische Proteinaggregate bei neurodegenerativen Erkrankungen wie der Alzheimer-Krankheit zu säen10,11.
EVs können aus Bioflüssigkeiten auf der Grundlage von Zelloberflächenmarkern ausgewählt und angereichert werden, die sich auf ihre Herkunftszelle beziehen, und spiegeln so die Umgebung eines bestimmten Gewebes in ihrer Fracht wider 12,13,14,15,16,17,18,19,20. Darüber hinaus stellen EVs aufgrund ihres Vorhandenseins in Blut, Liquor cerebrospinalis, Speichel, Urin und Muttermilch ein hervorragendes, nicht-invasives Instrument für die Diagnose dar und können als Flüssigbiopsie zur Entdeckung von Biomarkern angesehen werden. Dies ist für die Neurologie von besonderem Interesse, da es schwierig ist, Hirnanalyten in anderen zugänglichen Flüssigkeiten als dem Liquor zu untersuchen.
Astrozyten haben zunehmend an Interesse gewonnen, da sie sich an der Schnittstelle der neurovaskulären Kommunikation befinden21. Unter physiologischen Bedingungen sind sie verantwortlich für die Erhaltung der Blut-Hirn-Schranke, das Recycling von Neurotransmittern, die Versorgung von Neuronen und anderen Gliazellen mit Nährstoffen und Wachstumsfaktoren 22,23,24 sowie für die neuroimmune Abwehr, da sie metabolische Plastizität von entzündungsfördernden zu entzündungshemmenden Zuständen und umgekehrt aufweisen 25,26,27. Ein wichtiger Mechanismus, durch den Astrozyten ihre regulatorischen Funktionen erfüllen, ist die Kommunikation über EVs28,29. Die reaktive Astrozytose ist ein wichtiges Kennzeichen mehrerer neurodegenerativer Erkrankungen wie der Alzheimer-Krankheit30, der Multisystematrophie (MSA), der progressiven supranukleären Lähmung (PSP)31 und der Amyotrophen Lateralsklerose (ALS)32. Die Reaktivität der Astrozyten kann zu einer veränderten EV-Fracht, der Freisetzung von Entzündungsmediatoren und einer aberranten zellulären Kommunikation führen, was die Ausbreitung der Pathologie erleichtert und zu Neurodegeneration führt10,11. Daher ist die Untersuchung von Astrozyten-abgeleiteten EVs (ADEVs) und Veränderungen in ihrer Fracht eine attraktive Ressource, um neurodegenerative Prozesse auf nicht-invasive Weise zu untersuchen.
Derzeit gibt es mehrere Methoden für die Isolierung von Elektrofahrzeugen, jede mit ihren entsprechenden Vor- und Nachteilen33. Es ist wichtig zu überlegen, welche Methode für eine bestimmte Verwendung besser geeignet ist, abhängig von der endgültigen Anwendung, die von Interesse ist. Im Bereich der Neurologie, und insbesondere in Astrozytenstudien, war die polymerbasierte Fällung mit anschließendem Immunocapture die am häufigsten verwendete Methode 12,18,19,20,34. Selbst bei Anwendung des gleichen Ansatzes bleibt jedoch eine Heterogenität zwischen den Studien in den verschiedenen Schritten, die für die Isolierung von Elektrofahrzeugen angewendet werden. Daher besteht ein Bedarf an einer klaren, standardisierten Schritt-für-Schritt-Methodik, um Astrozyten-EV-Studien zu erleichtern und die Reproduzierbarkeit von Studien zu ermöglichen. Die polymerbasierte Fällung erleichtert das Biomarker-Screening, da es sich um ein schnelles, einfaches Verfahren handelt, das keine komplexe Ausrüstung erfordert, was zu einer hohen Ausbeute an EVs führt, ohne ihre biologische Aktivität zu beeinträchtigen35.
Das vorliegende Protokoll beschreibt ein detailliertes, einfaches, zweistufiges Verfahren zur Anreicherung von ADEVs aus menschlichem Plasma. Sie basiert auf einer polymerbasierten Ausfällung der gesamten EV-Fraktion, gefolgt von einem Immunfang von Astrozyten-EVs. Angesichts der wichtigen Funktionen von Astrozyten kann die Analyse von ADEVs Aufschluss über die Entdeckung von Biomarkern und Entzündungswegen des Gehirns geben, die auf nicht-invasive Weise untersucht werden können.
Protokoll
Die in diesem Protokoll beschriebene Forschung wurde mit menschlichen Plasmaproben von gesunden erwachsenen Spendern beiderlei Geschlechts (Altersspanne 65,9-81,3 Jahre, 45,5 % Frauen) aus der Kohorte der Sant Pau Initiative on Neurodegeneration (SPIN), Barcelona, Spaniendurchgeführt 36. Die Teilnehmer gaben eine Einverständniserklärung. Die Studie wurde in Anlehnung an die internationalen ethischen Richtlinien für die medizinische Forschung, die in der Deklaration von Helsinki und dem spanischen Gesetz enthalten sind, durchgeführt. Die Forschungsethikkommission von Sant Pau (CEIC) hat das Protokoll für die Entnahme und Lagerung von menschlichen Plasmaproben aus der SPIN-Kohorte geprüft und genehmigt (#16/2013).
1. Anreicherung von Astrozyten-EVs aus menschlichem Plasma
HINWEIS: Dieses Protokoll beinhaltet die Verwendung von menschlichen Plasmaproben. Alle Einzelheiten zu den in diesem Protokoll verwendeten Reagenzien und Labormaterialien sind in der Materialtabelle enthalten. Für dieses Verfahren ist keine spezielle Ausrüstung erforderlich, bitte überprüfen Sie jedoch die Sicherheitsüberlegungen der einzelnen Reagenzien, die von jedem Hersteller individuell angegeben werden.
- Probenentnahme und -lagerung
- Entnehmen Sie Blut in Lavendel-EDTA-Vacutainer-Röhrchen nach standardisierten Protokollen für die Entnahme von Plasma36,37. Zentrifugieren Sie bei 2000 x g für 10 min bei 4 °C innerhalb von 30-120 min nach der Entnahme zur Plasmatrennung. Das Plasma, d. h. die obere klare Flüssigkeit, die als Überstand erscheint, wird in 500 μl Aliquote getrennt.
- Um Zelltrümmer zu entfernen, zentrifugieren Sie die Aliquote bei 3000 x g für 15 min bei Raumtemperatur. Den Überstand bergen. Lagern Sie das Plasma bis zur Analyse bei -80 °C. Wie bei Biofluidanalysen üblich, aliquotieren Sie die Proben vor der Lagerung und vermeiden Sie mehr als drei Gefrier-Tau-Zyklen.
- Vollständige EV-Anreicherung
HINWEIS: Alle verwendeten Reagenzien müssen durch einen 0,22-μm-Filter gefiltert werden.- Tauen Sie 500 μl Plasmaproben auf. Fügen Sie Thrombin im Verhältnis 1:100 hinzu, um Gerinnungsfaktoren zu entfernen. Dreimal durch Inversion mischen und 5 min bei Raumtemperatur ziehen lassen.
- Vervollständigen Sie das Volumen, um 1 ml zu erreichen, mit der phosphatgepufferten Kochsalzlösung (DPBS) von Dulbecco: DPBS + 3x konzentrierter Proteasehemmer-Cocktail (verdünnt aus 10x Proteasehemmer-Cocktailbrühe). Durch Inversion mischen.
- Die Proben werden bei 6000 x g für 20 min bei 4 °C zentrifugiert. Den Überstand bergen. Vervollständigen Sie das Volumen mit DBPS-Arbeitslösung, um 1 ml zu erreichen.
- 252 μl der EV-Fällungslösung zugeben und dreimal durch Inversion mischen. Bei 4 °C 60 min inkubieren.
- Die Proben werden bei 1500 x g für 20 min bei 4 °C zentrifugiert, um die gesamte EV-Fraktion (Pellet) auszufällen. Sammeln Sie 1 ml des Überstands. Die Fraktion wird als EV-abgereichertes Plasma gekennzeichnet, um sie als Negativkontrolle der EV-Anreicherungsmarker (keine EVs) zu verwenden, und bei -80 °C lagern.
- Das restliche Pellet bei 1500 x g für 5 min bei 4 °C zentrifugieren. Den restlichen Überstand verwerfen. Das Pellet wird in 500 μl Reinstwasser resuspendiert, das konzentrierte Protease- und Phosphatasehemmer enthält (Endkonzentration 3x, verdünnt aus einem Bestand von 100x, siehe Materialtabelle).
- Pipettieren Sie kräftig auf und ab, um das Pellet zu lösen und Schaumbildung zu vermeiden. Auf einem Drehrohrschüttler 30 min bei Raumtemperatur bis zur vollständigen Resuspension vortexen und rühren. Stellen Sie sicher, dass die Pellets vollständig resuspendiert werden, da dies ein kritischer Schritt für den nachfolgenden Immunerfassungsschritt ist.
- Immuneinfang von ADEVs
HINWEIS: ADEVs tragen Astrozytenmarker. Der ausgewählte Marker für die ADEV-Anreicherung mittels Immunocapture ist GLAST. GLAST, die Abkürzung für Glutamat-Aspartat-Transporter (UniProtKB-P43003), ist der am häufigsten vorkommende Glutamattransporter, der überwiegend von Astrozyten im Kleinhirn und im zerebralen Neokortex exprimiertwird 38. Der Anti-BLAST-Antikörper (ACSA-1, Astrocyte cell surface antigen-1) ist spezifisch für ein extrazelluläres Epitop von GLAST und wurde für die Identifizierung von Astrozyten entwickelt. Es ist das am weitesten verbreitete Ziel für die Immunerfassung von ADEVs aus menschlichem Plasma 12,20,34.- Geben Sie 10 μl biotinylierten Anti-GLAST (ACSA-1)-Antikörper zu jeder Probe, die das gesamte EV-Präparat enthält. Gut und vorsichtig mischen. 1 h bei 4 °C auf einem Drehrohrschüttler inkubieren.
- Fügen Sie 10 μl magnetische Mikrokügelchen hinzu, die an monoklonale Anti-Biotin-Antikörper (Maus-IgG1) konjugiert sind. Gut und vorsichtig mischen. 1 h bei 4 °C auf einem Drehrohrschüttler inkubieren.
- Platzieren Sie eine Mikrosäule in das Magnetfeld eines MACS-Separators. Bereiten Sie die Säule vor, indem Sie sie mit 500 μl PBS-0,5 % Rinderserumalbumin (BSA) spülen. Verwerfen Sie den Durchfluss.
- Laden Sie die EV/ACSA-1/Microbead-Suspension auf die Säule. Drücken Sie bei diesem Schritt nicht mit dem Kolben. Sammeln Sie den Durchfluss. Kennzeichnen Sie diese als nicht-astrozytäre EVs (keine ADEVs) und bewahren Sie sie bei Bedarf als Kontrolle auf.
- Waschen Sie die Säule zweimal mit 500 μl PBS-0,5 % BSA. Verwerfen Sie den Durchfluss.
- Nehmen Sie die Säule aus dem Magnetabscheider und legen Sie sie in ein 1,5-ml-Sammelröhrchen mit geringer Adhäsion. 500 μl PBS-0,5 % BSA auf den Säulen pipettieren. Drücken Sie mit einem Kolben fest in die Säule und fangen Sie das Eluat auf.
- Bezeichnung als ACSA-1+ EVs (ADEVs). Lagern Sie nicht lysierte Elektrofahrzeuge kurzzeitig bei -20 °C oder über längere Zeiträume (>6 Monate) bei -80 °C.
HINWEIS: Anti-ACSA-1-Antikörper binden an das GLAST-1/EAAT-1-Epitop. Magnetische Mikrokügelchen binden mit Affinität an den Anti-ACSA-1-EV-Komplex. MACS-Mikrosäulen enthalten eine optimierte Matrix, um ein starkes Magnetfeld zu erzeugen, wenn es in einen Magneten eingesetzt wird, das erforderlich ist, um die markierten ADEVs zurückzuhalten.
Eine schematische Darstellung des ADEV-Anreicherungsverfahrens finden Sie in Abbildung 1.
- Lyse von Elektrofahrzeugen
HINWEIS: EVs müssen für den Nachweis von intravesikulären Markern vollständig lysiert werden. Es wird empfohlen, zwei aufeinanderfolgende Methoden zu verwenden, z. B. eine chemische und eine mechanische Lyse.- Führen Sie eine chemische Lyse von EVs durch, indem Sie das Proteinextraktionsreagenz (siehe Materialtabelle) in einem Verhältnis von 100 μl Probe pro 150 μl Extraktionsreagenz hinzufügen. Fügen Sie 100x Protease- und Phosphatasehemmer hinzu, um eine 1x Endkonzentration zu erreichen. Kräftig einreiben und 15 min bei Raumtemperatur ziehen lassen.
- Führen Sie eine mechanische Lyse in einem zweistufigen Verfahren durch: Geben Sie die chemisch lysierte EV-Lösung zweimal durch eine Spritze (G29-Nadel). Anschließend werden die Proben 45 s lang in einem Ultraschall-Kaltwasserbad beschallt. Frieren Sie die lysierten EVs bei -80 °C ein.
- Tauen Sie die Proben bei 37 °C 5 Minuten lang auf. Erneut bei -80 °C einfrieren, um lysierte Elektrofahrzeuge zu lagern. Tauen Sie vor der Analyse erneut 5 Minuten bei 37 °C auf.
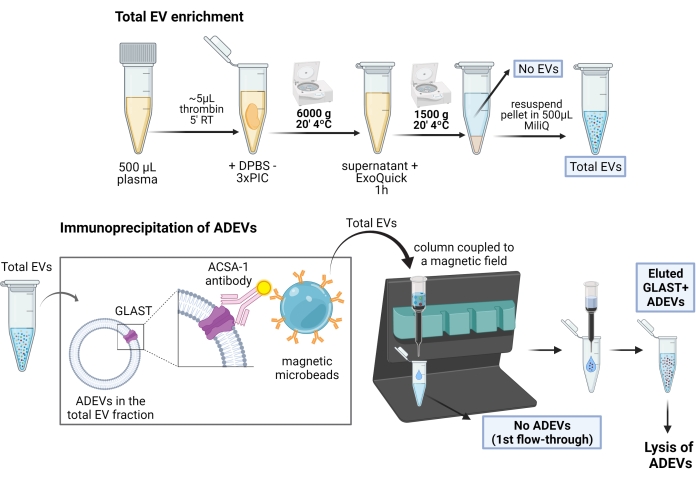
Abbildung 1: Schematische Darstellung des zweistufigen Verfahrens zur Anreicherung von aus Astrozyten gewonnenen EVs. Im ersten Schritt werden EVs aus defibriertem humanem Plasma durch polymerbasierte Fällungs- und Zentrifugationsschritte angereichert. Nach der totalen EV-Resuspension werden die Astrozyten-EVs dann durch Immuncapture mit biotinylierten Anti-GLAST (ACSA-1)-Antikörpern und magnetischen Anti-Biotin-Mikrokügelchen selektiert. Abkürzungen: ACSA-1 = Astrozytenzelloberflächenantigen-1; ADEVs = von Astrozyten abgeleitete extrazelluläre Vesikel; DPBS = Dulbecco-Phosphat-gepufferte Kochsalzlösung; EVs = extrazelluläre Vesikel; GLAST = Glutamat-Aspartat-Transporter; Keine ADEVs = nicht-astrozytäre extrazelluläre Vesikel; Keine EVs = keine extrazellulären Vesikel (EV-abgereichertes Plasma); PIC = Proteasehemmer-Cocktail; RT = Raumtemperatur. Mit BioRender erstellte Figur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Validierung des Protokolls
- Charakterisierung der gesamten EV-Fraktion vor dem Immuncapture
- Verwenden Sie lysierte Gesamt-EVs (resuspendiertes Granulat nach Polymerfällung) und verdünnte Plasmaproben für die Western-Blot-Analyse. Die Proben mit 4x Laemmli Probenpuffer (5 μl für 15 μl Probenpuffer) ergänzen, 10 min bei 90 °C kochen lassen und auf 10 % fleckenfreie Acrylamidgele auffüllen.
- Führen Sie die SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE) in Tris/Glycin/SDS-Puffer bei 80 V für 30 min und anschließend 200 V für 40 min durch. Entfernen Sie im Anschluss an die SDS-PAGE das Gel aus den Glasplatten und visualisieren Sie den Gesamtproteingehalt nach einer 1 min UV-Anregung.
- Übertragen Sie die Proteine aus dem Gel durch ein halbtrockenes System bei 25 V, 2,5 A für 10 Minuten auf eine methanolaktivierte 0,2 μm PVDF-Membran (siehe Materialtabelle für Details zur Ausrüstung). Nach dem Transfer wird die Membran 5 Minuten lang bei Raumtemperatur in einem Blockpuffer blockiert und anschließend über Nacht bei 4 °C mit den Primärantikörpern gegen Alix (1:1000), CD9 (1:1000) oder Calnexin (1:1000) inkubiert; Weitere Informationen finden Sie in der Materialtabelle .
- Die Membran wird dreimal 10 Minuten lang in Tris-gepufferter Kochsalzlösung mit 0,1 % Tween 20 (TBST) gewaschen und 1 h bei Raumtemperatur mit einem Anti-Kaninchen-HRP-Sekundärantikörper inkubiert, der bei 1:7500 in Blockpuffer verdünnt ist. Waschen Sie die Membran viermal 10 Minuten lang in TBST. Führen Sie alle Waschgänge und Inkubationsschritte unter sanftem Rühren der Membran auf einer Tischwippe durch.
- Mischen Sie die Chemilumineszenzlösung im Verhältnis 1:1 mit dem Peroxidpuffer und inkubieren Sie die Membranen 5 Minuten lang bei Raumtemperatur. Belichten und erfassen Sie Banden mit einem Chemilumineszenz-Bildgebungssystem (siehe Materialtabelle für Details).
- Validierung der Anreicherung von Astrozyten-spezifischen Markern in der ADEV-Fraktion
HINWEIS: Das saure Gliafibrillärprotein (GFAP) ist das wichtigste intermediäre Filamentprotein in astrozytären Zellen und ein wesentliches Element ihres Zytoskeletts während der Entwicklung. GFAP kann in Hirngewebe und Bioflüssigkeiten nachgewiesen werden, da es ein bekannter Astrozytenmarkerist 39. Daher wurde dieser Marker mit einer kommerziellen Biomarker-Detektionstechnologie quantifiziert, um die Anreicherung von Astrozyten-abgeleiteten Markern in der ADEV-Fraktion zu demonstrieren. Bei dieser Biomarker-Technologie handelt es sich um eine ultraempfindliche Technik, die die Messung einzelner Proteinmoleküle mit einer Empfindlichkeit ermöglicht, die bis zu 1.000-mal höher ist als bei herkömmlichen Immunmolekülen. Diese Technik beruht auf der Verwendung paramagnetischer Mikropartikel, die mit Antikörpern gekoppelt sind, die an spezifische Ziele bindensollen 40,41 (siehe Materialtabelle).- Verwenden Sie lysierte EV-Proben für die Biomarker-Analyse. Um die Anreicherung von Astrozytenmarkern zu testen, vergleichen Sie die GFAP-Spiegel im Eluat (ADEVs) mit denen im Durchfluss (keine ADEVs) mit einem kommerziellen ultrasensitiven Immunoassay.
- Verdünnen Sie die Proben im Verhältnis 1:4 (25 μl EVs + 75 μl Assay-Puffer), bereiten Sie die Kalibratoren vor und führen Sie den Assay in den Biomarker-Nachweisgeräten durch, wie in den Anweisungen des Herstellers angegeben (siehe Materialtabelle). Die Proben können direkt auf der Platte verdünnt werden.
- Testen Sie die Proben und Kalibratoren in doppelter Ausführung. Der Quantifizierungsbereich für den GFAP-Assay betrug 1,37-1000 pg/ml. Verwenden Sie die Software-Analyseplattform des Herstellers, um GFAP-Konzentrationen aus der Kalibrierkurve zu berechnen.
- Um den Variationskoeffizienten (CV) des Protokolls für die Anreicherung von Astrozytenmarkern zu schätzen, messen Sie die GFAP-Spiegel in ADEV-Präparaten, die aus identischen Replikaten gepoolter menschlicher Plasmaproben gewonnen wurden, und berechnen Sie die CV als Standardabweichung/Mittelwert x 100. In diesem Protokoll wurde die CV anhand von N = 10 identischen Plasmaproben berechnet.
- Validierung der Anreicherung von EV-Markern in der ADEV-Fraktion
- Um die Anreicherung von EV-Markern zu validieren, messen Sie die Alix- und CD81-Spiegel mittels ELISA (siehe Materialtabelle) in lysierten unverdünnten EV-Proben gemäß den Empfehlungen des Herstellers. Prüfmuster und Kalibratoren in zweifacher Ausfertigung.
- Lesen Sie die Platten bei 450 nm und 570 nm mit einem Mikroplatten-Reader ab. Verwenden Sie eine lineare Kalibrierkurve, um die Alix- und CD81-Konzentrationen zu berechnen. Der Bestimmungsbereich für den Alix-Assay betrug 47-3000 pg/ml und für CD81 0,156-10 ng/ml.
- Charakterisierung der Größe und Morphologie von ADEVs
- Analyse der Nanopartikel-Verfolgung
- Verwenden Sie die Nanopartikel-Tracking-Analyse (NTA), um die Partikelkonzentration und Größenverteilung von frischen, nicht lysierten EV-Präparaten zu messen.
- Verdünnen Sie frische, nicht lysierte ADEV-Suspensionen (10 μl) mit gefiltertem PBS entsprechend dem Nachweisbereich des Geräts (20-100 Partikel/Bild) und nehmen Sie mit der mitgelieferten Software drei 60-s-Videos mit folgenden Einstellungen auf: Spritzenflussrate bei 30 μI, Kamerapegel bei 13 und Nachweisschwelle bei 5. Korrigieren Sie die Partikelkonzentrationen für das Volumen der Eingangsprobe, das Volumen der EV-Resuspension und die Verdünnung, die für die NTA-Messung erforderlich sind.
HINWEIS: Es wird empfohlen, eine Probe mit der EV-Fahrzeuglösung vorab zu visualisieren, um den Matrixeffekt und die Reinheit des Mediums zu überprüfen, in dem EVs resuspendiert werden.
- Kryo-Elektronenmikroskopie
- Verwenden Sie die Kryo-Elektronenmikroskopie (Kryo-EM), um das Vorhandensein und die Morphologie von Evs in frischen, nicht lysierten ADEV-Suspensionen (4 μL) zu bestätigen. Verglasen Sie die Proben mit einem handelsüblichen Tauchfroster auf Holey-Kohlenstoffgittern mit den folgenden Einstellungen: 3,9 μl der Probe, Wartezeit 10 s, Blot-Zeit 2 s.
- Tauchen Sie in flüssigen Ethan-Stickstoff in einer Kryo-Workstation ein. Übertragen Sie die Gitter für die transmissionselektronenmikroskopische Analyse auf einen Kryohalter, der bei -179 °C gehalten wird. Untersuchen Sie die Elektrofahrzeuge mit einem Transmissionselektronenmikroskop, das mit einer Beschleunigungsspannung von 200 kV arbeitet und mit einer CCD-Kamera ausgestattet ist. Erfassen Sie Mikroaufnahmen mit Software.
- Analyse der Nanopartikel-Verfolgung
- Analyse der Lipoprotein-Co-Präzipitation
- Bestimmen Sie die humanen ApoB-Spiegel in unverdünntem Plasma, lysierten Gesamt-EV-Proben und lysierten ADEV-Proben mit einem immunturbidimetrischen Assay unter Verwendung eines kommerziellen Kits, das für einen kommerziellen Autoanalysator geeignet ist (weitere Informationen finden Sie in der Materialtabelle ).
- Analyse von Entzündungsmarkern in ADEVs
- Verwenden Sie einen Bead-basierten Assay (siehe Materialtabelle), um die Konzentration von 25 Entzündungsmarkern zu quantifizieren: Eotaxin, IFN Alpha2, IFN Gamma, IL-1 Alpha, IL-1 Beta, IL-3, IL-6, IL-8, IL-10, IL-12 (p40), IL-12 (p70), IL-15, IL-17A, IL-17E/IL-25, IL-17F, IL-18, IP-10, MCP-1, MCP-3, MDC, MIP-1 Alpha, MIP-1 Beta, TGF Alpha, TNF Alpha, TNF Beta.
- Verwenden Sie lysierte, unverdünnte EV-Präparate (25 μl) und inkubieren Sie die Proben mit den Kügelchen über Nacht bei 4 °C gemäß den Anweisungen des Herstellers. Waschen Sie die Platte, inkubieren Sie sie mit 25 μl Nachweisantikörpern und inkubieren Sie sie 1 h lang unter Rühren bei Raumtemperatur.
- 25 μl Streptavidin-PE in jede Vertiefung geben und 30 Minuten bei Raumtemperatur inkubieren. 150 μl Scheidenflüssigkeit zugeben und 5 min unter Rühren inkubieren. Lesen Sie das Schild auf dem Tellerleser ab, der an das System angeschlossen ist.
HINWEIS: Diese Technik basiert auf Immunoassays mit Antikörpern, die an die Oberfläche von fluoreszenzbeschichteten magnetischen Mikrokügelchen binden. Diese Technologie kodiert Mikrokügelchen intern nach ihrer Farbe mit verschiedenen Farbstoffen. Jede Art von Mikrosphäre ist mit einem spezifischen Capture-Antikörper beschichtet, so dass mehrere konjugierte Kügelchen die in die Proben eingebetteten Analyten einfangen, was den quantitativen Multiplex-Nachweis von Dutzenden von Analyten gleichzeitig ermöglicht. Das System verwendet die Bead-basierte Multiplex-Immunoassay-Plattform für die Signaldetektion43.
3. Datenanalyse
- Führen Sie statistische Analysen mit kommerzieller Software durch. Beurteilen Sie die Datennormalität mit dem Shapiro-Wilk-Test. Testen Sie Zwei-Gruppen-Vergleiche mit dem Mann-Whitney-U-Test und Drei-Gruppen-Vergleiche mit dem Kruskal-Wallis-Test und der Post-hoc-Korrektur von Dunn. Legen Sie die Signifikanz auf p < 0,05 fest.
Ergebnisse
Die Isolierung von ADEVs aus Plasma gesunder Spender wurde erfolgreich durchgeführt. Eine polymerbasierte Fällungsmethode wurde verwendet, um die gesamte EV-Fraktion zu erhalten, gefolgt von einem Immunfang mit magnetischen Mikrokügelchen, um ADEVs zu erhalten.
Die Western-Blot-Analyse der gesamten EV-Fraktion vor dem Immun-Capture-Schritt zeigte das Fehlen von Calnexin (zellulärer Kontaminationsmarker) und das Vorhandensein von Alix und dem Transmembranpr...
Diskussion
Elektrofahrzeuge haben aufgrund ihres diagnostischen und therapeutischen Potenzials ein starkes Interesse in der biomedizinischen Forschung geweckt. Derzeit ist eines der größten Handicaps im Zusammenhang mit EV-Isolationsmethoden das Fehlen eines methodischen Konsenses und standardisierter Protokolle. Diese Studie liefert ein detailliertes Protokoll für die Anreicherung von Astrozyten-EVs aus menschlichem Plasma durch polymerbasierte Fällung und GLAST Immunocapture.
Offenlegungen
Dr. Belbin berichtete, dass er außerhalb der eingereichten Arbeit persönliche Honorare von ADx NeuroSciences erhalten habe. Dr. Alcolea berichtete, dass er außerhalb der eingereichten Arbeit persönliche Honorare für Beiratsdienste und/oder Honorare für Referenten von Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. und Esteve erhalten hat. Dr. Lleó war außerhalb der eingereichten Arbeiten als Berater oder in Beiräten für Fujirebio-Europe, Roche, Biogen, Grifols und Nutricia tätig. Dr. Fortea berichtete, dass er außerhalb der eingereichten Arbeiten persönliche Honorare für die Mitarbeit in den Beiräten, Beurteilungsausschüssen oder Honorare für Referenten von AC Immune, Novartis, Lundbeck, Roche, Fujirebio und Biogen erhalten hat. Dr. Alcolea, Dr. Belbin, LLeó und Dr. Fortea berichten, dass sie ein Patent für Marker für Synaptopathie bei neurodegenerativen Erkrankungen besitzen (lizenziert für ADx, EPI8382175.0). Es wurden keine weiteren Offenlegungen gemeldet. Alle anderen Autoren haben nichts weiter offenzulegen.
Danksagungen
Die Autoren danken Soraya Torres, Shaimaa El Bounasri El Bennadi und Oriol Sanchez Lopez für die Handhabung und Vorbereitung der Proben. Wir möchten uns auch für die Zusammenarbeit von José Amable Bernabé von der ICTS "NANBIOSIS", Einheit 6 (Abteilung des CIBER in Bioing, Biomaterialien und Nanomedizin) des Barcelona Materials Science Institute, Marti de Cabo Jaume von der Abteilung für Elektronenmikroskopie an der Universitat Autónoma de Barcelona, Dr. Marta Soler Castany und Lia Ros Blanco von der Durchflusszytometrie-Plattform am Sant Pau Biomedical Research Institute (IIB-Sant Pau) bedanken. sowie Dr. Joan Carles Escolà-Gil von der Gruppe Pathophysiologie lipidbedingter Krankheiten am IIB-Sant Pau für die Unterstützung bei den NTA-, Kryo-EM-, Luminex- und ApoB-Bestimmungen.
Die Autoren danken für die finanzielle Unterstützung durch die Jérôme Lejeune Stiftung (Projekt #1941 und #1913 an MFI und MCI), das Instituto de Salud Carlos III (PI20/01473 an JF, PI20/01330 an AL, PI18/00435 an DA und INT19/00016 an DA), das National Institute of Health (1R01AG056850-01A1, R21AG056974 und R01AG061566 an JF), die Alzheimer's Association und das Global Brain Health Institute (GBHI_ALZ-18-543740 an MCI), die Association for Frontotemporal Degeneration (Clinical Research Postdoctoral Fellowship, AFTD 2019–2021) an ODI und die Societat Catalana de Neurologia (Premi Beca Fundació SCN 2020 an MCI). Diese Arbeit wurde auch durch das CIBERNED-Programm (Programm 1, Alzheimer Disease to AL und SIGNAL study) unterstützt. SS ist Stipendiatin eines Postdoc-Stipendiums "Juan de la Cierva-Incorporación" (IJC2019-038962-I) der Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España).
Materialien
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
Referenzen
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten