このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト血漿からのアストロサイト由来細胞外小胞の濃縮
要約
このプロトコルは、ヒト血漿からのアストロサイト由来の細胞外小胞(ADEV)の濃縮を説明しています。これは、ポリマー沈殿によるEVの分離と、それに続くACSA-1ベースのADEVの免疫捕捉に基づいています。ADEVの解析は、リキッドバイオプシーによる非侵襲的な生存患者の炎症経路の変化を研究する手がかりとなる可能性があります。
要約
細胞外小胞(EV)は、細胞のコミュニケーションと老廃物の除去のためにすべての細胞から分泌される生体ナノ粒子です。それらは、生理学的および病理学的条件で他の細胞に作用し、その貨物を他の細胞に移すことにより、幅広い機能に関与しています。生体液中に存在するEVは、疾患プロセスを研究するための優れたリソースであり、バイオマーカー発見のためのリキッドバイオプシーと見なすことができます。EV分析の魅力的な側面は、起源細胞のマーカーに基づいて選択できるため、貨物内の特定の組織の環境を反映できることです。しかし、EVの分離方法に関連する大きなハンディキャップの1つは、方法論的なコンセンサスと標準化されたプロトコルの欠如です。アストロサイトは、脳内で重要な役割を果たすグリア細胞です。神経変性疾患では、アストロサイトの反応性がEVカーゴの変化や細胞間コミュニケーションの異常を引き起こし、疾患の進行を促進/強化する可能性があります。したがって、アストロサイトEVの解析は、バイオマーカーや潜在的な疾患標的の発見につながる可能性があります。このプロトコルは、ヒト血漿からアストロサイト由来EV(ADEV)を濃縮する2段階の方法を説明しています。まず、EVは、ポリマーベースの沈殿 によって 除細動血漿から濃縮されます。これに続いて、磁気マイクロビーズを用いたACSA-1ベースの免疫捕捉によるADEVの濃縮が行われ、再懸濁されたEVが磁場中に置かれたカラムにロードされます。磁気で標識されたACSA-1+ EVはカラム内に保持され、他のEVは通過します。カラムを磁石から取り外すと、ADEVが溶出され、保存および分析の準備が整います。アストロサイトマーカーの濃縮を検証するために、グリア線維性酸性タンパク質(GFAP)またはその他の細胞内起源の特異的アストロサイトマーカーを溶出液で測定し、フロースルーと比較することができます。このプロトコルは、アストロサイト関連マーカーを調べるためのプラットフォームとして使用できる血漿からADEVを濃縮するための簡単で時間効率の良い方法を提案しています。
概要
細胞外小胞(EV)は、タンパク質、脂質、核酸を運ぶあらゆる種類の細胞から分泌される膜状ナノ粒子の不均一なグループです1。微小胞(100-1000 nm)、エクソソーム(30-100 nm)、およびアポトーシス体(1000-5000 nm)が主なEVタイプを構成し、その起源部位によって区別されます2,3。EVは、抗原提示や免疫応答4、受容体リサイクル、代謝物排泄5、細胞コミュニケーション6などの重要な生理学的プロセスを調節します。これらのプロセスの調節は、EV細胞膜に濃縮されたタンパク質とレシピエント細胞の標的との間の直接結合によって、および/またはレシピエント細胞の細胞質におけるそれらのカーゴの内在化および放出を通じて起こり得る7。EVは細胞の肝心な機能を果たす一方で、がんや神経領域では病理学的な観点からも注目が集まっています。実際、いくつかの研究では、EVが腫瘍細胞の遊走8,9を促進したり、アルツハイマー病10,11などの神経変性疾患における毒性タンパク質凝集体のシード化に役立つことが示されています。
EVは、その起源の細胞に関連する細胞表面マーカーに基づいて生体液から選択および濃縮することができ、したがって、それらの貨物12、13、14、15、16、17、18、19、20内の特定の組織の環境を反映することができる.さらに、血液、脳脊髄液(CSF)、唾液、尿、母乳中に存在することを考えると、EVは診断のための優れた非侵襲的ツールであり、バイオマーカー発見のためのリキッドバイオプシーと見なすことができます。これは、CSF以外のアクセス可能な液体中の脳分析物を研究することの難しさを考えると、神経学において特に興味深いものです。
アストロサイトは、神経-血管コミュニケーションの交差点にあるため、関心が高まっている21。生理学的条件下では、それらは血液脳関門の保存、神経伝達物質のリサイクル、ニューロンや他のグリア細胞22,23,24への栄養素および成長因子の供給、および炎症誘発性状態から抗炎症状態へ、またはその逆の代謝可塑性を考えると、神経免疫防御に関与しています25,26,27.アストロサイトがその調節機能を達成する重要なメカニズムは、EVを介した通信によるものである28,29。反応性星細胞症は、アルツハイマー病30、多系統萎縮症(MSA)、進行性核上性麻痺(PSP)31、筋萎縮性側索硬化症(ALS)32など、いくつかの神経変性疾患の重要な特徴です。アストロサイトの反応性は、EVカーゴの変化、炎症性メディエーターの放出、および細胞コミュニケーションの異常を引き起こし、病理の広がりを促進し、神経変性を引き起こす可能性があります10,11。したがって、アストロサイト由来EV(ADEV)とそのカーゴの変化を研究することは、非侵襲的な方法で神経変性プロセスを調べるための魅力的なリソースです。
現在、EVの分離にはいくつかの方法論が存在し、それぞれに対応する長所と短所がある33。関心のある最終的なアプリケーションに応じて、特定の用途にどの方法がより適しているかを検討することが不可欠です。神経学分野、より具体的にはアストロサイト研究では、ポリマーベースの沈殿とそれに続く免疫捕捉が主に使用されている方法である12,18,19,20,34。ただし、同じアプローチを適用しても、EVアイソレーションに適用されるさまざまなステップで研究間には不均一性が残ります。したがって、アストロサイトEVの研究と再現性の研究を促進するために、明確で段階的に標準化された方法論が必要です。ポリマーベースの沈殿は、複雑な機器を必要としない迅速で簡単な手順であるため、バイオマーカーのスクリーニングを容易にし、生物活性に影響を与えることなくEVの高収率につながる35。
本プロトコルは、ヒト血漿からのADEVの濃縮のための詳細で単純な2段階の方法を説明しています。これは、全EV画分のポリマーベースの沈殿と、それに続くアストロサイトEVの免疫捕捉に基づいています。アストロサイトの重要な機能を考えると、ADEVの解析は、非侵襲的な方法で研究できるバイオマーカーや脳の炎症経路の発見に光を当てるかもしれません。
プロトコル
このプロトコルに記載されている研究は、健康な成人ドナーからのヒト血漿サンプルを使用して実施されました 男女(年齢範囲65.9〜81.3歳、45.5%が女性)、 Sant Pau Initiative on Neurodegenerations(SPIN)コホート、バルセロナ、スペイン36。参加者はインフォームドコンセントを提供しました。この研究は、ヘルシンキ宣言とスペインの法律に含まれる医学研究の国際倫理ガイドラインに従って実施されました。Sant Pau Research Ethics Committee(CEIC)は、SPINコホートからのヒト血漿サンプルの収集と保存に関するプロトコルをレビューし、承認しました(#16/2013)。
1. ヒト血漿からのアストロサイトEVの濃縮
注:このプロトコルには、ヒト血漿サンプルの使用が含まれます。このプロトコルで使用される試薬および実験室材料に関するすべての詳細は、 材料表に記載されています。この手順に特別な機器は必要ありませんが、各メーカーが個別に指定している各試薬の安全性に関する考慮事項を確認してください。
- サンプルの収集と保存
- 血漿36,37の収集のための標準化されたプロトコルに従って、ラベンダーEDTA真空チューブで血液を収集します。血漿分離のために、回収後30〜120分以内に、2000 x gで4°Cで10分間遠心分離します。上清として現れる上部の透明な液体である血漿を500μLのアリコートで分離します。
- 細胞の破片を除去するには、アリコートを3000 x g で室温で15分間遠心分離します。上清を回収します。分析までプラズマを-80°Cで保存します。生体流体分析の一般的な方法と同様に、保存前にサンプルを分注し、3回以上の凍結融解サイクルを避けてください。
- トータルEVエンリッチメント
注:使用するすべての試薬は、0.22 μmフィルターでろ過する必要があります。- 500 μLの血漿サンプルを解凍します。トロンビンを1:100の割合で追加して、凝固因子を取り除きます。反転させて3回混合し、室温で5分間放置します。
- ダルベッコのリン酸緩衝生理食塩水(DPBS)ワーキング溶液(DPBS + 3倍濃縮プロテアーゼ阻害剤カクテル(10倍プロテアーゼ阻害剤カクテルストックから希釈))を使用して、容量を1 mLまで完成させます。反転して混ぜます。
- サンプルを6000 x g で4°Cで20分間遠心分離します。 上清を回収します。DBPSワーキング溶液で容量を1 mLになるまで完成させます。
- EV沈殿液252μLを加え、3回反転させて混合します。4°Cで60分間インキュベートします。
- サンプルを1500 x g で4°Cで20分間遠心分離し、全EV画分(ペレット)を沈殿させます。上清1mLを採取します。フラクションをEV枯渇血漿とラベル付けして、EV濃縮マーカー(EVなし)のネガティブコントロールとして使用し、-80°Cで保存します。
- 残りのペレットを1500 x g で4°Cで5分間遠心分離します。 残りの上澄みを捨てます。濃縮されたプロテアーゼおよびホスファターゼ阻害剤を含む500 μLの超純水(最終濃度3倍、ストック100倍から希釈、 材料表を参照)にペレットを再懸濁します。
- ピペットを激しく上下させてペレットを緩め、泡立ちを防ぎます。回転チューブシェーカーで回転チューブシェーカーで渦巻き、室温で30分間撹拌し、完全に再懸濁するまで撹拌します。ペレットの完全な再懸濁は、その後の免疫捕捉ステップにとって重要なステップであるため、必ず行ってください。
- ADEV の免疫捕捉
注:ADEVはアストロサイトマーカーを持っています。免疫捕捉によるADEV濃縮のために選択されたマーカーはGLASTです。GLASTは、グルタミン酸-アスパラギン酸トランスポーター(UniProtKB-P43003)の略で、主に小脳および大脳新皮質のアストロサイトによって発現される最も豊富なグルタミン酸トランスポーターです38。抗BLAST(ACSA-1、アストロサイト細胞表面抗原-1)抗体は、GLUTの細胞外エピトープに特異的であり、アストロサイトの同定のために開発されました。これは、ヒト血漿12,20,34からのADEVの免疫捕捉に最も広く使用されている標的です。- 10 μL の抗 GLAST (ACSA-1) ビオチン化抗体を、全 EV 調製物を含む各サンプルに添加します。よくやさしく混ぜます。回転チューブシェーカーで4°Cで1時間インキュベートします。
- モノクローナル抗ビオチン抗体(マウスIgG1)に結合した磁性マイクロビーズ10 μLを添加します。よくやさしく混ぜます。回転チューブシェーカーで4°Cで1時間インキュベートします。
- MACSセパレーターの磁場にマイクロカラムを置きます。カラムを 500 μL の PBS-0.5% ウシ血清アルブミン(BSA)ですすいでください。フロースルーを破棄します。
- EV/ACSA-1/マイクロビーズサスペンションをカラムにロードします。このステップではプランジャーで押さないでください。フロースルーを収集します。これを非アストロサイトEV(ADEVなし)とラベル付けし、必要に応じてコントロールとして保管します。
- カラムを 500 μL の PBS-0.5% BSA で 2 回洗浄します。フロースルーを破棄します。
- カラムをマグネティックセパレーターから取り外し、低接着性の 1.5 mL コレクションチューブに入れます。カラムにPBS-0.5% BSAを500 μLピペットで移します。プランジャーでカラムにしっかりと押し込み、溶出液を回収します。
- ACSA-1+ EV (ADEV) のラベルを付けます。非溶解EVは、-20°Cで短時間、または-80°Cで長期間(>6か月)保管してください。
注:抗ACSA-1抗体はGLAST-1/EAAT-1エピトープに結合します。磁性マイクロビーズは、抗ACSA-1-EV複合体に親和性を持って結合します。MACSマイクロカラムには、磁石中に置くと強い磁場を生成するように最適化されたマトリックスが含まれており、これは標識されたADEVを保持するために必要です。
ADEV エンリッチメント手順の概略図については、 図 1 を参照してください。
- EVの溶解
注:EVは、膀胱内マーカーを検出するために完全に溶解する必要があります。化学的溶解と機械的溶解の2つの連続した方法の使用が推奨されます。- 抽出試薬150 μLあたり100 μLのサンプルの割合でタンパク質抽出試薬( 材料表を参照)を添加することにより、EVの化学的溶解を行います。100xプロテアーゼ阻害剤とホスファターゼ阻害剤を添加して、最終濃度の1倍にします。激しく渦巻き、室温で15分間放置します。
- 化学的に溶解したEV溶液をシリンジ(G29針)に2回通すという2段階の手順で機械的溶解を行います。次に、超音波冷水浴でサンプルを45秒間超音波処理します。溶解したEVを-80°Cで凍結します。
- サンプルを37°Cで5分間解凍します。溶解したEVを保管するために、-80°Cで再度凍結します。分析する前に、37°Cで5分間再度解凍します。
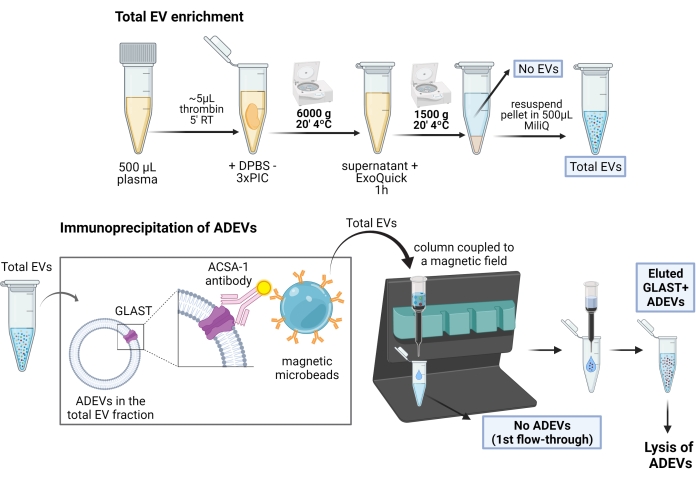
図1:アストロサイト由来EVの濃縮のための2段階の手順の概略図。 最初のステップでは、EVは、ポリマーベースの沈殿および遠心分離ステップによって、除細動されたヒト血漿から濃縮されます。全EV再懸濁後、アストロサイトEVは、ビオチン化抗GLAST(ACSA-1)抗体および抗ビオチン磁性マイクロビーズによる免疫捕捉によって選択されます。略語:ACSA-1 =星状細胞表面抗原-1;ADEVs = アストロサイト由来の細胞外小胞;DPBS = ダルベッコのリン酸緩衝生理食塩水。EV = 細胞外小胞;GLAST =グルタミン酸-アスパラギン酸トランスポーター;ADEVなし = 非星状細胞性細胞外小胞;EVなし=細胞外小胞なし(EV枯渇血漿)。PIC = プロテアーゼ阻害剤カクテル;RT =室温。BioRenderで作成されたフィギュア。 この図の拡大版を表示するには、ここをクリックしてください。
2. プロトコルの検証
- 免疫捕捉前の総EV画分の特性評価
- ウェスタンブロット分析には、溶解した全EV(ポリマー沈殿後に再懸濁したペレット)と希釈した血漿サンプルを使用します。4x Laemmli サンプルバッファー (15 μL のサンプルに対して 5 μL) をサンプルに添加し、90 °C で 10 分間煮沸し、10% 無染色アクリルアミドゲルにロードします。
- トリス/グリシン/SDSバッファー中でSDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)を80 Vで30分間、続いて200 Vで40分間実施します。SDS-PAGEに続いて、ガラスプレートからゲルを取り出し、1分間のUV励起後の総タンパク質含有量を視覚化します。
- タンパク質をゲルからメタノール活性化0.2 μm PVDFメンブレンに、セミドライシステム(25 V、2.5 A)で10分間移します(装置の詳細については 、材料の表 を参照)。移管後、メンブレンをブロッキングバッファーで室温で5分間ブロッキングし、その後、Alix(1:1000)、CD9(1:1000)、またはCalnexin(1:1000)に対する一次抗体と4°Cで一晩インキュベートします。詳細については 、資料の表 を参照してください。
- メンブレンをTris緩衝生理食塩水で0.1% Tween 20(TBST)で10分間3回洗浄し、ブロッキングバッファーで1:7500に希釈した抗ウサギHRP二次抗体と室温で1時間インキュベートします。TBSTでメンブレンを4回、10分間洗浄します。すべての洗浄とインキュベーションステップは、ベンチロッカーでメンブレンを穏やかに攪拌しながら行います。
- 化学発光溶液と過酸化物バッファーを1:1の比率で混合し、メンブレンを室温で5分間インキュベートします。化学発光イメージングシステムを使用してバンドを露光および取得します(詳細については 、材料の表 を参照)。
- ADEV 画分におけるアストロサイト特異的マーカーの濃縮の検証
注:グリア線維性酸性タンパク質(GFAP)は、アストロサイト細胞の主要な中間フィラメントタンパク質であり、発生中の細胞骨格の必須要素です。GFAPは、脳組織および生体液で検出でき、よく知られている星状細胞マーカーである39。したがって、このマーカーは、市販のバイオマーカー検出技術を使用して定量化され、ADEV 画分におけるアストロサイト由来マーカーの濃縮を実証しました。このバイオマーカー技術は、従来のイムノアサインの最大1,000倍の感度で単一のタンパク質分子を測定できる超高感度技術です。この技術は、特定の標的に結合するように設計された抗体と結合した常磁性微粒子の使用に基づいている40,41(材料の表を参照)。- 溶解したEVサンプルをバイオマーカー解析に使用してください。アストロサイトマーカーの濃縮をテストするには、市販の超高感度イムノアッセイを使用して、溶出液中のGFAPレベル(ADEV)とフロースルー(ADEVなし)を比較します。
- サンプルを1:4の比率(25 μLのEV+75 μLのアッセイバッファー)で希釈し、キャリブレーターを調製し、製造元の指示に従ってバイオマーカー検出装置でアッセイを実施します( 材料の表を参照)。サンプルはプレート上で直接希釈できます。
- サンプルとキャリブレーターを二重にテストします。GFAPアッセイの定量範囲は1.37-1000 pg/mLでした。メーカーのソフトウェア解析プラットフォームを使用して、検量線からGFAP濃度を計算します。
- アストロサイトマーカーの濃縮に関するプロトコルの変動係数(CV)を推定するには、プールされたヒト血漿サンプルの同一の複製から得られたADEV調製物のGFAPレベルを測定し、CVを標準偏差/平均x 100として計算します。このプロトコルでは、CV は N = 10 個の同一の血漿サンプルを使用して計算されました。
- ADEV 画分における EV マーカーの濃縮の検証
- EVマーカーの濃縮性を検証するには、メーカーの推奨に従って、溶解した原液EVサンプル中のALISA( 材料表を参照)によるAlixおよびCD81のレベルを測定します。サンプルとキャリブレーターを二重にテストします。
- マイクロプレートリーダーを使用して、450 nmおよび570 nmのプレートを読み取ります。線形検量線を使用して、AlixおよびCD81濃度を計算します。Alix アッセイの定量範囲は 47-3000 pg/mL で、CD81 の定量範囲は 0.156-10 ng/mL でした。
- ADEVのサイズと形態の特性評価
- ナノ粒子追跡分析
- ナノ粒子追跡分析(NTA)を使用して、新鮮な非溶解EV調製物の粒子濃度とサイズ分布を測定します。
- 付属のソフトウェアを使用して、装置の検出範囲(20-100粒子/フレーム)に従って、ろ過されたPBSで新鮮な非溶解ADEV懸濁液(10μL)を希釈し、シリンジの流量を30 a.u.、カメラレベルを13、検出しきい値を5に設定して、3つの60秒ビデオを録画します。NTAの読み取りに必要なインプットサンプル量、EV再懸濁液の量、希釈量の粒子濃度を補正します。
注:マトリックス効果とEVが再懸濁される媒体の純度を確認するために、EV車両溶液を含むサンプルを事前に視覚化することをお勧めします。
- クライオ電子顕微鏡
- クライオ電子顕微鏡(クライオ電子顕微鏡)を使用して、新鮮な非溶解ADEV懸濁液(4 μL)中のEvの存在と形態を確認します。Holeyカーボングリッド上の市販のプランジフリーザーを使用して、次の設定でサンプルをガラス化します:サンプルの3.9μL、待ち時間10秒、ブロット時間2秒。
- クライオワークステーションで液体エタン窒素に突入します。グリッドを-179°Cに維持されたクライオホルダーに移し、透過型電子顕微鏡分析を行います。加速電圧200kVで作動する透過型電子顕微鏡とCCDカメラでEVを検査します。ソフトウェアを使用して顕微鏡写真を取得します。
- ナノ粒子追跡分析
- リポタンパク質共沈の解析
- 市販のオートアナライザーに適合した市販のキットを使用して、免疫比濁法による免疫比濁法による未希釈血漿、溶解した総EVサンプル、および溶解したADEVサンプル中のヒトApoBレベルを測定します(詳細については 、材料の表 を参照)。
- ADEVにおける炎症マーカーの解析
- ビーズベースのアッセイ( 材料表を参照)を使用して、25種類の炎症マーカー(エオタキシン、IFN Alpha2、IFN Gamma、IL-1 Alpha、IL-1 Beta、IL-3、IL-6、IL-8、IL-10、IL-12 (p40)、IL-12 (p70)、IL-15、IL-17A、IL-17E/IL-25、IL-17F、IL-18、IP-10、MCP-1、MCP-3、MDC、MIP-1 Alpha、MIP-1 Beta、TGF Alpha、TNF Alpha、TNF Betaの濃度を定量します。
- 溶解した原液のEV調製物(25 μL)を使用し、製造元の指示に従って、サンプルをビーズと4°Cで一晩インキュベートします。プレートを洗浄し、25 μLの検出抗体とインキュベートし、室温で撹拌しながら1時間インキュベートします。
- 各ウェルに25 μLのストレプトアビジン-PEを添加し、室温で30分間インキュベートします。150 μLのシース液を加え、撹拌下で5分間インキュベートします。システムに取り付けられたプレートリーダーのプレートを読み取ります。
注:この技術は、蛍光コーティングされた磁気マイクロビーズの表面に結合する抗体を使用したイムノアッセイに基づいています。この技術は、さまざまな染料を使用して、マイクロスフィアを色ごとに内部的にコード化します。各タイプのマイクロスフェアは、特定の捕捉抗体でコーティングされているため、複数の標識ビーズがサンプルに埋め込まれた分析物を捕捉し、数十の分析物を同時に定量的にマルチプレックス検出できます。このシステムは、シグナル検出43のためにビーズベースのマルチプレックス免疫測定プラットフォームを使用する。
3. データ分析
- 商用ソフトウェアで統計分析を実行します。Shapiro-Wilk 検定でデータの正規性を評価します。Mann-Whitney U検定による2群比較、Kruskal-Wallis検定およびDunnの事後補正による3群比較を検定します。有意性を p < 0.05 に設定します。
結果
健康なドナーから採取した血漿からのADEVの単離は成功裏に達成されました。ポリマーベースの沈殿法を使用して総EV画分を取得し、続いて磁気マイクロビーズによる免疫捕捉を使用してADEVを取得しました。
免疫捕捉ステップ前の全EV画分のウェスタンブロット分析では、EV調製物中にカルネキシン(細胞汚染マーカー)が欠如していること、および...
ディスカッション
EVは、その診断および治療の可能性から、生物医学研究に強い関心を集めています。現在、EVの分離方法に関連する主要なハンディキャップの1つは、方法論的なコンセンサスと標準化されたプロトコルの欠如です。この研究では、ポリマーベースの沈殿法とGLAST免疫捕捉 法による ヒト血漿からのアストロサイトEVの濃縮に関する詳細なプロトコルを提供します?...
開示事項
Belbin博士は、提出された研究以外でADx NeuroSciencesから個人的な報酬を受け取ったと報告しました。アルコレア博士は、提出された研究以外で、Fujirebio-Europe、Roche、Nurtricia、Krka Farmacéutica、Zambon S.A.U.、およびEsteveから、諮問委員会サービスおよび/または講演者謝礼の個人的な報酬を受け取ったと報告しました。Lleó博士は、提出された研究以外にも、Fujirebio-Europe、Roche、Biogen、Grifols、Nutriciaのコンサルタントまたは諮問委員会を務めてきました。Fortea博士は、AC Immune、Novartis、Lundbeck、Roche、Fujirebio、Biogenから、諮問委員会、裁定委員会、または講演者謝礼の個人的な報酬を受け取ったと報告しました。Alcolea博士、Belbin博士、LLeó博士、Fortea博士は、神経変性疾患におけるシナプス障害のマーカーの特許を保有していると報告しています(ADx、EPI8382175.0にライセンス供与)。その他の開示は報告されていません。他のすべての著者は、他に開示するものは何もありません。
謝辞
著者らは、サンプルの取り扱いと調製について、Soraya Torres、Shaimaa El Bounasri El Bennadi、およびOriol Sanchez Lopezの協力に感謝します。また、ICTS「NANBIOSIS」のホセ・アマブル・ベルナベ氏、バルセロナ材料科学研究所のユニット6(CIBERのバイオインジニアリング、バイオマテリアル、ナノメディシンのユニット)、バルセロナ自治大学の電子顕微鏡ユニットのマルティ・デ・カボ・ジャウメ氏、サン・パウ生物医学研究所(IIB-Sant Pau)のフローサイトメトリープラットフォームのマルタ・ソレル・カスタニー博士とリア・ロス・ブランコ氏の協力に感謝いたします。 また、IIB-Sant Pauの脂質関連疾患の病態生理学グループのJoan Carles Escolà-Gil博士は、それぞれNTA、クライオEM、Luminex、およびApoBの測定を支援してくれました。
著者らは、Jérôme Lejeune Foundation(プロジェクト#1941および#1913からMFIおよびMCI)、Instituto de Salud Carlos III(PI20/01473からJF、PI20/01330からAL、PI18/00435からDA、INT19/00016からDA)、国立衛生研究所(1R01AG056850-01A1、R21AG056974、およびR01AG061566からJF)、Alzheimer's AssociationおよびGlobal Brain Health Institute(GBHI_ALZ-18-543740からMCI)、からの財政的支援に感謝します。 The Association for Frontotemporal Degeneration(Clinical Research Postdoctoral Fellowship、AFTD 2019–2021)からODI、およびSocietat Catalana de Neurologia(Premi Beca Fundació SCN 2020からMCI)。この研究は、CIBERNEDプログラム(プログラム1、アルツハイマー病からALおよびSIGNAL研究)によっても支援されました。SSは、Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España)からポスドク助成金「Juan de la Cierva-Incorporación」(IJC2019-038962-I)を受賞しています。
資料
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
参考文献
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved