Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Enrichissement de vésicules extracellulaires dérivées d’astrocytes à partir de plasma humain
Dans cet article
Résumé
Ce protocole décrit l’enrichissement des vésicules extracellulaires dérivées d’astrocytes (VEAD) à partir de plasma humain. Il est basé sur la séparation des VE par précipitation de polymère, suivie d’une immunocapture des VEDA basée sur l’ACSA-1. L’analyse des VEDA peut fournir des indices pour étudier les changements dans les voies inflammatoires de patients vivants, de manière non invasive par biopsie liquide.
Résumé
Les vésicules extracellulaires (VE) sont des nanoparticules biologiques sécrétées par toutes les cellules pour la communication cellulaire et l’élimination des déchets. Ils participent à un large éventail de fonctions en agissant et en transférant leurs cargaisons à d’autres cellules dans des conditions physiologiques et pathologiques. Compte tenu de leur présence dans les biofluides, les VE représentent une excellente ressource pour l’étude des processus pathologiques et peuvent être considérées comme une biopsie liquide pour la découverte de biomarqueurs. Un aspect intéressant de l’analyse des VE est qu’ils peuvent être sélectionnés en fonction des marqueurs de leur cellule d’origine, reflétant ainsi l’environnement d’un tissu spécifique dans leur cargaison. Cependant, l’un des principaux handicaps liés aux méthodes d’isolement des VE est le manque de consensus méthodologique et de protocoles standardisés. Les astrocytes sont des cellules gliales qui jouent un rôle essentiel dans le cerveau. Dans les maladies neurodégénératives, la réactivité des astrocytes peut entraîner une altération de la cargaison EV et une communication cellulaire aberrante, facilitant / améliorant la progression de la maladie. Ainsi, l’analyse des VE des astrocytes peut conduire à la découverte de biomarqueurs et de cibles potentielles de maladies. Ce protocole décrit une méthode en 2 étapes d’enrichissement des VE dérivées d’astrocytes (VED) à partir de plasma humain. Tout d’abord, les VE sont enrichis à partir de plasma défibriné par précipitation à base de polymères. S’ensuit l’enrichissement des VEDA par immunocapture basée sur ACSA-1 avec des microbilles magnétiques, où les VE remis en suspension sont chargés sur une colonne placée dans un champ magnétique. Les véhicules électriques ACSA-1+ marqués magnétiquement sont conservés dans la colonne, tandis que les autres véhicules électriques circulent. Une fois la colonne retirée de l’aimant, les ADEV sont élués et sont prêts à être stockés et analysés. Pour valider l’enrichissement des marqueurs astrocytaires, la protéine acide fibrillaire gliale (GFAP), ou d’autres marqueurs astrocytaires spécifiques d’origine intracellulaire, peuvent être mesurés dans l’éluat et comparés à l’écoulement. Ce protocole propose une méthode simple et rapide pour enrichir les ADEV à partir de plasma qui peut être utilisée comme plate-forme pour examiner les marqueurs pertinents pour les astrocytes.
Introduction
Les vésicules extracellulaires (VE) sont un groupe hétérogène de nanoparticules membraneuses sécrétées par tous les types de cellules, transportant des protéines, des lipides et des acides nucléiques1. Les microvésicules (100-1000 nm), les exosomes (30-100 nm) et les corps apoptotiques (1000-5000 nm) constituent les principaux types de VE, qui se distinguent par leur site d’origine 2,3. Les VE régulent des processus physiologiques importants, tels que la présentation de l’antigène et les réponses immunitaires4, le recyclage des récepteurs, l’élimination des métabolites5 et la communication cellulaire6. La régulation de ces processus peut se produire par liaison directe entre les protéines enrichies dans la membrane cellulaire EV et les cibles dans les cellules réceptrices, et/ou par l’internalisation et la libération de leur cargaison dans le cytoplasme de la cellule réceptrice7. Bien que les VE remplissent des fonctions cellulaires essentielles, elles suscitent un intérêt croissant d’un point de vue pathologique dans les domaines du cancer et de la neurologie. En effet, plusieurs études ont montré que les VE peuvent aider à favoriser la migration des cellules tumorales 8,9 ou les agrégats de protéines toxiques des graines dans les maladies neurodégénératives, telles que la maladie d’Alzheimer10,11.
Les VE peuvent être sélectionnées et enrichies à partir de biofluides en fonction de marqueurs de surface cellulaire liés à leur cellule d’origine, reflétant ainsi l’environnement d’un tissu spécifique dans leur cargaison 12,13,14,15,16,17,18,19,20. De plus, compte tenu de leur présence dans le sang, le liquide céphalo-rachidien (LCR), la salive, l’urine et le lait maternel, les VE représentent un excellent outil non invasif de diagnostic et peuvent être considérées comme une biopsie liquide pour la découverte de biomarqueurs. Ceci est d’un intérêt particulier en neurologie, étant donné les difficultés d’étudier les analytes cérébraux dans des fluides accessibles autres que le LCR.
Les astrocytes suscitent un intérêt croissant, car ils se trouvent à l’intersection de la communication neurovasculaire21. Dans des conditions physiologiques, ils sont responsables de la préservation de la barrière hémato-encéphalique, du recyclage des neurotransmetteurs, de l’apport de nutriments et de facteurs de croissance aux neurones et autres cellules gliales 22,23,24 ainsi que de la défense neuro-immunitaire, compte tenu de leur plasticité métabolique des états pro-inflammatoires aux états anti-inflammatoires et vice versa 25,26,27. Un mécanisme important par lequel les astrocytes accomplissent leurs fonctions régulatrices est la communication par l’intermédiaire des VE28,29. L’astrocytose réactive est une caractéristique clé de plusieurs maladies neurodégénératives, telles que la maladie d’Alzheimer30, l’atrophie multisystématisée (AMS), la paralysie supranucléaire progressive (PSP)31 et la sclérose latérale amyotrophique (SLA)32. La réactivité des astrocytes peut entraîner une altération de la cargaison EV, la libération de médiateurs inflammatoires et une communication cellulaire aberrante, facilitant ainsi la propagation de la pathologie et conduisant à la neurodégénérescence10,11. Par conséquent, l’étude des VE dérivées des astrocytes (ADEV) et des changements dans leur cargaison est une ressource intéressante pour examiner les processus neurodégénératifs de manière non invasive.
À l’heure actuelle, il existe plusieurs méthodologies pour l’isolement des VE, chacune avec ses avantages et ses inconvénientscorrespondants 33. Il est essentiel de déterminer quelle méthode est la plus adaptée à un usage spécifique, en fonction de l’application finale qui vous intéresse. Dans le domaine de la neurologie, et plus particulièrement dans les études sur les astrocytes, la précipitation à base de polymères suivie d’une immunocapture a été la méthode la plus utilisée 12,18,19,20,34. Cependant, même en appliquant la même approche, il reste une hétérogénéité entre les études dans les différentes étapes appliquées pour l’isolement des VE. Par conséquent, il est nécessaire de disposer d’une méthodologie claire, étape par étape, normalisée pour faciliter les études sur les VE des astrocytes et la reproductibilité des études. La précipitation à base de polymères facilite le criblage de biomarqueurs, car il s’agit d’une procédure simple et rapide qui ne nécessite pas d’équipement complexe, ce qui permet d’obtenir un rendement élevé de VE sans affecter leur activité biologique35.
Le présent protocole décrit une méthode simple, détaillée et détaillée en deux étapes pour l’enrichissement des VEDA à partir de plasma humain. Il est basé sur une précipitation à base de polymères de la fraction totale des VE, suivie d’une immunocapture des VE des astrocytes. Compte tenu de l’importance des fonctions des astrocytes, l’analyse des ADEV pourrait éclairer la découverte de biomarqueurs et de voies inflammatoires cérébrales qui peuvent être étudiés de manière non invasive.
Protocole
La recherche décrite dans ce protocole a été menée avec des échantillons de plasma humain provenant de donneurs adultes en bonne santé des deux sexes (tranche d’âge 65,9-81,3 ans, 45,5 % de femmes), de la cohorte de l’Initiative de Sant Pau sur la neurodégénérescence (SPIN), Barcelone, Espagne36. Les participants ont donné leur consentement éclairé. L’étude a été menée conformément aux directives éthiques internationales pour la recherche médicale contenues dans la déclaration d’Helsinki et la loi espagnole. Le Comité d’éthique de la recherche de Sant Pau (CEIC) a examiné et approuvé le protocole de collecte et de stockage des échantillons de plasma humain de la cohorte SPIN (#16/2013).
1. Enrichissement des VE astrocytaires à partir de plasma humain
REMARQUE : Ce protocole implique l’utilisation d’échantillons de plasma humain. Tous les détails sur les réactifs et le matériel de laboratoire utilisés dans ce protocole sont inclus dans la table des matériaux. Aucun équipement spécial n’est requis pour cette procédure, cependant, veuillez examiner les considérations de sécurité de chaque réactif, comme spécifié individuellement par chaque fabricant.
- Collecte et stockage des échantillons
- Prélever le sang dans des tubes vacutainer EDTA à la lavande, en suivant des protocoles standardisés pour la collecte de plasma36,37. Centrifugeuse à 2000 x g pendant 10 min à 4 °C dans les 30 à 120 minutes suivant la collecte pour la séparation du plasma. Séparer le plasma, qui est le liquide clair supérieur qui apparaît comme surnageant, en aliquotes de 500 μL.
- Pour éliminer les débris cellulaires, centrifugez les aliquotes à 3000 x g pendant 15 min à température ambiante. Récupérez le surnageant. Conservez le plasma à -80 °C jusqu’à l’analyse. Comme c’est la pratique courante pour les analyses de biofluides, aliquotez les échantillons avant l’entreposage et évitez plus de trois cycles de gel-dégel.
- Enrichissement total de la VE
REMARQUE : Tous les réactifs utilisés doivent être filtrés à travers un filtre de 0,22 μm.- Décongeler 500 μL d’échantillons de plasma. Ajouter de la thrombine dans une proportion de 1:100 pour éliminer les facteurs de coagulation. Mélangez par inversion trois fois et laissez reposer 5 min à température ambiante.
- Complétez le volume pour atteindre 1 mL avec la solution saline tamponnée au phosphate (DPBS) de Dulbecco : DPBS + 3x cocktail concentré d’inhibiteurs de protéase (dilué à partir de 10x stock de cocktail d’inhibiteurs de protéase). Mixage par inversion.
- Centrifuger les échantillons à 6000 x g pendant 20 min à 4 °C. Récupérez le surnageant. Complétez le volume avec la solution de travail DBPS pour atteindre 1 mL.
- Ajouter 252 μL de la solution de précipitation EV et mélanger par inversion trois fois. Incuber à 4 °C pendant 60 min.
- Centrifuger les échantillons à 1500 x g pendant 20 min à 4 °C pour précipiter la fraction EV totale (granulé). Prélever 1 mL de surnageant. Étiquetez la fraction comme plasma appauvri en EV à utiliser comme témoin négatif des marqueurs d’enrichissement en EV (pas de VE) et stockez-la à -80 °C.
- Centrifugez la pastille restante à 1500 x g pendant 5 min à 4 °C. Jetez le surnageant restant. Remettre la pastille en suspension dans 500 μL d’eau ultrapure contenant des inhibiteurs concentrés de protéase et de phosphatase (concentration finale 3x, diluée à partir d’un stock de 100x, voir tableau des matériaux).
- Pipette de haut en bas vigoureusement pour détacher la pastille, en évitant la mousse ; Agiter sur un agitateur à tube rotatif pendant 30 min à température ambiante jusqu’à remise en suspension complète. Assurer la remise en suspension complète des granulés, car il s’agit d’une étape critique pour l’étape d’immunocapture ultérieure.
- Immunocapture des VEDA
REMARQUE : Les ADEV portent des marqueurs d’astrocytes. Le marqueur choisi pour l’enrichissement de la DAEV par immunocapture est GLAST. GLAST, qui signifie transporteur de glutamate-aspartate (UniProtKB-P43003), est le transporteur de glutamate le plus abondant, principalement exprimé par les astrocytes dans le cervelet et le néocortex cérébral38. L’anticorps anti-GLAST (ACSA-1, astrocyte cell surface antigen-1) est spécifique d’un épitope extracellulaire de GLAST et a été développé pour l’identification des astrocytes. C’est la cible la plus largement utilisée pour l’immunocapture des ADEV à partir du plasma humain 12,20,34.- Ajouter 10 μL d’anticorps biotinylé anti-GLAST (ACSA-1) à chaque échantillon contenant la préparation totale de VE. Mélangez bien et doucement. Incuber pendant 1 h à 4 °C sur un agitateur à tube rotatif.
- Ajouter 10 μL de microbilles magnétiques conjuguées à des anticorps monoclonaux anti-biotine (IgG1 de souris). Mélangez bien et doucement. Incuber pendant 1 h à 4 °C sur un agitateur à tube rotatif.
- Placez une micro-colonne dans le champ magnétique d’un séparateur MACS. Préparez la colonne en la rinçant avec 500 μL de PBS-0,5 % d’albumine sérique bovine (BSA). Jetez le flux continu.
- Chargez la suspension EV/ACSA-1/microbilles sur la colonne. Ne poussez pas avec le piston à cette étape. Récupérez le flux continu. Étiquetez-les comme des VE non astrocytaires (pas d’ADEV) et conservez-les comme contrôle si nécessaire.
- Lavez la colonne deux fois avec 500 μL de PBS-0,5 % BSA. Jetez le flux continu.
- Retirez la colonne du séparateur magnétique et placez-la dans un tube de collecte à faible adhérence de 1,5 ml. Pipette 500 μL de PBS-0,5 % BSA sur la colonne. Enfoncez fermement avec un piston dans la colonne et récupérez l’éluat.
- Étiquetés comme ACSA-1+ EVs (ADEVs). Stockez les VE non lysés à -20 °C pendant de courtes périodes ou à -80 °C pendant de plus longues périodes (>6 mois).
REMARQUE : Les anticorps anti-ACSA-1 se lient à l’épitope GLAST-1 / EAAT-1. Les microbilles magnétiques se lient par affinité au complexe anti-ACSA-1-EV. Les micro-colonnes MACS contiennent une matrice optimisée pour générer un champ magnétique puissant lorsqu’elles sont placées dans un aimant, qui est nécessaire pour retenir les ADEV étiquetés.
Pour une représentation schématique de la procédure d’enrichissement ADEV, voir la figure 1.
- Lyse des VE
REMARQUE : Les EV doivent être complètement lysés pour la détection des marqueurs intravésiculaires. L’utilisation de deux méthodes séquentielles, telle que la lyse chimique suivie d’une lyse mécanique, est recommandée.- Effectuer une lyse chimique des VE en ajoutant un réactif d’extraction de protéines (voir le tableau des matériaux) dans une proportion de 100 μL d’échantillon pour 150 μL de réactif d’extraction. Ajoutez 100x inhibiteurs de protéase et de phosphatase pour atteindre une concentration finale 1x. Agiter vigoureusement et laisser reposer à température ambiante pendant 15 min.
- Effectuez une lyse mécanique par une procédure en deux étapes : passez deux fois la solution EV lysée chimiquement dans une seringue (aiguille G29). Ensuite, sonicer les échantillons pendant 45 s dans un bain d’eau froide à ultrasons. Congelez les VE lysés à -80 °C.
- Décongeler les échantillons à 37 °C pendant 5 min. Congeler à nouveau à -80 °C pour le stockage des VE lysés. Décongeler à nouveau pendant 5 min à 37 °C avant l’analyse.
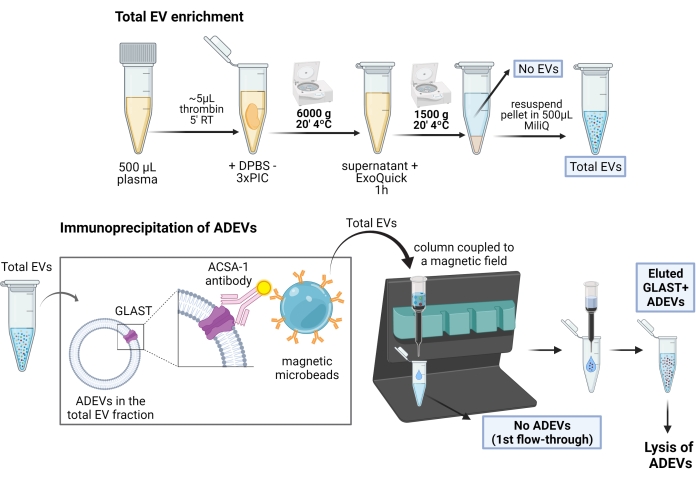
Figure 1 : Représentation schématique de la procédure en deux étapes pour l’enrichissement des VE dérivées d’astrocytes. Dans un premier temps, les VE sont enrichis à partir de plasma humain défibriné par des étapes de précipitation et de centrifugation à base de polymères. Après la remise en suspension totale des VE, les VE des astrocytes sont ensuite sélectionnées par immunocapture avec des anticorps anti-GLAST biotinylés (ACSA-1) et des microbilles magnétiques anti-biotine. Abréviations : ACSA-1 = antigène de surface des cellules astrocytaires-1 ; ADEV = vésicules extracellulaires dérivées d’astrocytes ; DPBS = solution saline tamponnée au phosphate de Dulbecco ; EV = vésicules extracellulaires ; GLAST = transporteur de glutamate-aspartate ; Pas d’ADEV = vésicules extracellulaires non astrocytaires ; Pas de VEs = Pas de vésicules extracellulaires (plasma appauvri en EV) ; PIC = cocktail d’inhibiteurs de protéase ; RT = température ambiante. Figurine créée avec BioRender. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Validation du protocole
- Caractérisation de la fraction totale de VE avant l’immunocapture
- Utilisez des VE totales lysées (pastilles remises en suspension après précipitation de polymères) et des échantillons de plasma dilué pour l’analyse par transfert Western. Complétez les échantillons avec 4 tampons d’échantillon Laemmli (5 μL pour 15 μL d’échantillon), faites bouillir pendant 10 min à 90 °C et chargez-les sur des gels d’acrylamide 10 % sans colorant.
- Effectuer une électrophorèse sur gel de polyacrylamide (SDS-PAGE) dans un tampon Tris/Glycine/SDS à 80 V pendant 30 min, puis à 200 V pendant 40 min. Après la page SDS, retirez le gel des plaques de verre et visualisez la teneur totale en protéines après une excitation UV de 1 min.
- Transférez les protéines du gel vers une membrane PVDF de 0,2 μm activée par le méthanol à travers un système semi-sec à 25 V, 2,5 A pendant 10 min (voir le tableau des matériaux pour plus de détails sur l’équipement). Après le transfert, bloquer la membrane dans un tampon de blocage pendant 5 minutes à température ambiante, puis incuber pendant une nuit à 4 °C avec les anticorps primaires contre Alix (1:1000), CD9 (1:1000) ou Calnexin (1:1000) ; voir la table des matériaux pour plus de détails.
- Laver la membrane dans une solution saline tamponnée au Tris avec 0,1 % de Tween 20 (TBST) trois fois pendant 10 min et incuber pendant 1 h à température ambiante avec un anticorps secondaire anti-HRP de lapin dilué à 1:7500 dans un tampon de blocage. Laver la membrane au TBST quatre fois pendant 10 min. Effectuez toutes les étapes de lavage et d’incubation en agitant doucement la membrane sur une bascule d’établi.
- Mélangez dans un rapport de 1:1 la solution chimiluminescente avec le tampon de peroxyde et incubez les membranes pendant 5 min à température ambiante. Exposer et acquérir des bandes à l’aide d’un système d’imagerie par chimiluminescence (voir le Tableau des matériaux pour plus de détails).
- Validation de l’enrichissement de marqueurs spécifiques aux astrocytes dans la fraction ADEV
REMARQUE : La protéine acide fibrillaire gliale (GFAP) est la principale protéine de filament intermédiaire dans les cellules astrocytaires et un élément essentiel de leur cytosquelette au cours du développement. La GFAP peut être détectée dans les tissus cérébraux et les biofluides, étant un marqueur astrocytaire bien connu39. Par conséquent, ce marqueur a été quantifié à l’aide d’une technologie commerciale de détection de biomarqueurs afin de démontrer l’enrichissement des marqueurs dérivés des astrocytes dans la fraction ADEV. Cette technologie de biomarqueurs est une technique ultrasensible qui permet de mesurer des molécules de protéines uniques avec une sensibilité jusqu’à 1 000 fois supérieure à celle des immunoanalyses conventionnelles. Cette technique est basée sur l’utilisation de microparticules paramagnétiques couplées à des anticorps conçus pour se lier à des cibles spécifiques40,41 (voir Tableau des matériaux).- Utilisez des échantillons de VE lysés pour l’analyse des biomarqueurs. Pour tester l’enrichissement des marqueurs astrocytaires, comparez les niveaux de GFAP dans l’éluat (ADEV) par rapport au flux continu (sans ADEV) à l’aide d’un test immunologique ultrasensible commercial.
- Diluer les échantillons dans un rapport de 1:4 (25 μL de VE + 75 μL de tampon de dosage), préparer les calibrateurs et effectuer le test dans l’équipement de détection de biomarqueurs, comme spécifié dans les instructions du fabricant (voir le tableau des matériaux). Les échantillons peuvent être dilués directement sur la plaque.
- Testez les échantillons et les calibrateurs en double. La plage de quantification pour le test GFAP était de 1,37 à 1000 pg/mL. Utilisez la plate-forme d’analyse logicielle du fabricant pour calculer les concentrations GFAP à partir de la courbe d’étalonnage.
- Pour estimer le coefficient de variation (CV) du protocole d’enrichissement des marqueurs astrocytaires, mesurer les niveaux de GFAP dans les préparations ADEV obtenues à partir de répétitions identiques d’échantillons de plasma humain mélangés et calculer le CV en tant qu’écart-type/moyenne x 100. Dans ce protocole, le CV a été calculé à l’aide de N = 10 échantillons de plasma identiques.
- Validation de l’enrichissement des marqueurs EV dans la fraction ADEV
- Pour valider l’enrichissement des marqueurs EV, mesurer les niveaux d’Alix et de CD81 par ELISA (voir Tableau des matériaux) dans des échantillons d’EV lysés non dilués, en suivant les recommandations du fabricant. Échantillons de test et calibrateurs en double.
- Lisez les plaques à 450 nm et 570 nm à l’aide d’un lecteur de microplaques. Utilisez une courbe d’étalonnage linéaire pour calculer les concentrations d’Alix et de CD81. La plage de quantification pour le test Alix était de 47 à 3000 pg/mL et pour le CD81, de 0,156 à 10 ng/mL.
- Caractérisation de la taille et de la morphologie des ADEV
- Analyse du suivi des nanoparticules
- Utilisez l’analyse de suivi des nanoparticules (NTA) pour mesurer la concentration et la distribution granulométrique des préparations EV fraîches non lysées.
- Diluez des suspensions ADEV fraîches et non lysées (10 μL) avec du PBS filtré selon la plage de détection de l’instrument (20-100 particules/image), à l’aide du logiciel fourni, enregistrez trois vidéos de 60 s avec les paramètres suivants : débit de la seringue à 30 u.a., niveau de la caméra à 13 et seuil de détection à 5. Corrigez les concentrations de particules en fonction du volume de l’échantillon d’entrée, du volume de remise en suspension de l’EV et de la dilution nécessaire pour la lecture du NTA.
REMARQUE : Il est recommandé de prévisualiser un échantillon contenant la solution de véhicule EV pour vérifier l’effet de matrice et la pureté du milieu dans lequel les VE sont remis en suspension.
- Cryo-microscopie électronique
- Utiliser la cryomicroscopie électronique (Cryo-EM) pour confirmer la présence et la morphologie des Evs dans des suspensions ADEV fraîches et non lysées (4 μL). Vitrifier les échantillons à l’aide d’un congélateur plongeant commercial sur des grilles de carbone Holey avec les réglages suivants : 3,9 μL d’échantillon, temps d’attente 10 s, temps de transfert 2 s.
- Plongez dans l’éthane-azote liquide dans un cryo-poste de travail. Transférez les grilles dans un cryosupport maintenu à -179 °C pour l’analyse au microscope électronique à transmission. Examinez les VE à l’aide d’un microscope électronique à transmission fonctionnant à une tension d’accélération de 200 kV et équipé d’une caméra CCD. Acquérir des micrographies à l’aide d’un logiciel.
- Analyse du suivi des nanoparticules
- Analyse de la co-précipitation des lipoprotéines
- Déterminez les niveaux d’ApoB humaine dans le plasma non dilué, les échantillons de VEe totale lysée et les échantillons de VEDA lysés à l’aide d’un test immunoturbidimétrique à l’aide d’un kit commercial adapté pour un auto-analyseur commercial (voir le tableau des matériaux pour plus de détails).
- Analyse des marqueurs inflammatoires dans les ADEV
- À l’aide d’un dosage à base de billes (voir le tableau des matières) pour quantifier la concentration de 25 marqueurs inflammatoires : éotaxine, IFN Alpha2, IFN Gamma, IL-1 Alpha, IL-1 Bêta, IL-3, IL-6, IL-8, IL-10, IL-12 (p40), IL-12 (p70), IL-15, IL-17A, IL-17E/IL-25, IL-17F, IL-18, IP-10, MCP-1, MCP-3, MDC, MIP-1 Alpha, MIP-1 Beta, TGF Alpha, TNF Alpha, TNF Beta.
- Utilisez des préparations EV lysées non diluées (25 μL) et incubez les échantillons avec les billes pendant une nuit à 4 °C, en suivant les instructions du fabricant. Laver la plaque, incuber avec 25 μL d’anticorps de détection et incuber pendant 1 h en agitant à température ambiante.
- Ajouter 25 μL de Streptavidin-PE dans chaque puits et incuber pendant 30 min à température ambiante. Ajouter 150 μL de liquide de gaine et incuber pendant 5 min sous agitation. Lisez la plaque sur le lecteur de plaque fixé au système.
REMARQUE : Cette technique est basée sur des immunoessais utilisant des anticorps qui se lient à la surface des microbilles magnétiques recouvertes de fluorescence. Cette technologie code en interne les microsphères par leur couleur avec différents colorants. Chaque type de microsphère est recouvert d’un anticorps de capture spécifique, de sorte que plusieurs billes conjuguées capturent les analytes intégrés dans les échantillons, permettant la détection multiplex quantitative de dizaines d’analytes simultanément. Le système utilise la plate-forme d’immunodosage multiplexé basée sur des billes pour la détection du signal43.
3. Analyse des données
- Effectuer des analyses statistiques à l’aide de logiciels commerciaux. Évaluez la normalité des données avec le test de Shapiro-Wilk. Testez des comparaisons à deux groupes avec le test U de Mann-Whitney et des comparaisons à trois groupes avec le test de Kruskal-Wallis et la correction post-hoc de Dunn. Fixez la signification à p < 0,05.
Résultats
L’isolement des VEDA à partir de plasma prélevé sur des donneurs sains a été réalisé avec succès. Une méthode de précipitation à base de polymères a été utilisée pour obtenir la fraction totale de VE, suivie d’une immunocapture avec des microbilles magnétiques pour obtenir des VED.
L’analyse par transfert Western de la fraction totale de VE avant l’étape d’immunocapture a indiqué l’absence de calnexine (marqueur de contamination c...
Discussion
Les VE ont suscité un fort intérêt dans la recherche biomédicale en raison de leur potentiel diagnostique et thérapeutique. Actuellement, l’un des principaux handicaps liés aux méthodes d’isolement des VE est l’absence de consensus méthodologique et de protocoles standardisés. Cette étude fournit un protocole détaillé pour l’enrichissement des VE astrocytaires à partir du plasma humain par précipitation à base de polymères et immunocapture BLAST.
Déclarations de divulgation
Le Dr Belbin a déclaré avoir reçu des honoraires personnels d’ADx NeuroSciences en dehors des travaux soumis. Le Dr Alcolea a déclaré avoir reçu des honoraires personnels pour des services au sein d’un conseil consultatif et/ou des honoraires de conférencier de Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. et Esteve en dehors du travail soumis. Le Dr Lleó a été consultant ou membre de conseils consultatifs pour Fujirebio-Europe, Roche, Biogen, Grifols et Nutricia en dehors des travaux soumis. Le Dr Fortea a déclaré avoir reçu des honoraires personnels pour ses services au sein des conseils consultatifs, des comités de sélection ou des honoraires de conférencier d’AC Immune, de Novartis, de Lundbeck, de Roche, de Fujirebio et de Biogen en dehors du travail soumis. Les Drs Alcolea, Belbin, LLeó et Fortea déclarent détenir un brevet pour des marqueurs de synaptopathie dans les maladies neurodégénératives (sous licence ADx, EPI8382175.0). Aucune autre divulgation n’a été signalée. Tous les autres auteurs n’ont rien d’autre à divulguer.
Remerciements
Les auteurs tiennent à remercier Soraya Torres, Shaimaa El Bounasri El Bennadi et Oriol Sanchez Lopez pour la manipulation et la préparation des échantillons. Nous tenons également à souligner la collaboration de José Amable Bernabé, de l’ICTS « NANBIOSIS », unité 6 (Unité de CIBER en Bioingénierie, Biomatériaux et Nanomédecine) de l’Institut de Science des Matériaux de Barcelone, Marti de Cabo Jaume de l’Unité de Microscopie Electronique de l’Universitat Autonoma de Barcelone, Dr. Marta Soler Castany et Lia Ros Blanco de la Plateforme de Cytométrie en Flux de l’Institut de Recherche Biomédicale de Sant Pau (IIB-Sant Pau), ainsi que le Dr Joan Carles Escolà-Gil du groupe de physiopathologie des maladies liées aux lipides de l’IIB-Sant Pau pour son aide dans les déterminations NTA, cryo-EM, Luminex et ApoB, respectivement.
Les auteurs remercient le soutien financier de la Fondation Jérôme Lejeune (Projet #1941 et #1913 à l’IMF et au MCI), de l’Instituto de Salud Carlos III (PI20/01473 à JF, PI20/01330 à AL, PI18/00435 à DA et INT19/00016 à DA), de l’Institut national de la santé (1R01AG056850-01A1, R21AG056974 et R01AG061566 à JF), de l’Alzheimer’s Association et du Global Brain Health Institute (GBHI_ALZ-18-543740 à MCI), l’Association pour la dégénérescence frontotemporale (bourse postdoctorale de recherche clinique, AFTD 2019-2021) à l’ODI, et la Societat Catalana de Neurologia (Premi Beca Fundació SCN 2020 au MCI). Ces travaux ont également été soutenus par le programme CIBERNED (Programme 1, Maladie d’Alzheimer à l’AL et étude SIGNAL. SS est récipiendaire d’une bourse postdoctorale « Juan de la Cierva-Incorporación » (IJC2019-038962-I) de l’Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España).
matériels
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
Références
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon