Method Article
מיקוד גנים יעיל ביותר בתיווך CRISPR/Cas9 בתאי גזע עובריים לפיתוח מודלים של עכברים שעברו מניפולציה גנטית
In This Article
Summary
כאן אנו מציגים פרוטוקול לפיתוח מודלים של עכברים מהונדסים גנטית באמצעות תאי גזע עובריים, במיוחד עבור דנ"א גדול (KI). פרוטוקול זה מכוונן באמצעות עריכת גנום CRISPR/Cas9, וכתוצאה מכך יעילות KI משופרת באופן משמעותי בהשוואה לשיטת מיקוד הדנ"א הליניארי ההומולוגית הקונבנציונלית בתיווך רקומבינציה.
Abstract
מערכת CRISPR/Cas9 אפשרה לפתח עכברים מהונדסים גנטית על ידי עריכת גנום ישירה באמצעות זיגוטים מופרים. עם זאת, אף על פי שהיעילות בפיתוח עכברי נוקאאוט גנים על ידי גרימת מוטציה קטנה של אינדל תספיק, היעילות של עריכת גנום העובר ליצירת דנ"א בגודל גדול (KI) עדיין נמוכה. לכן, בניגוד לשיטת KI הישירה בעוברים, מיקוד גנים באמצעות תאי גזע עובריים (ESCs) ולאחר מכן הזרקת עוברים לפיתוח עכברי כימרה עדיין יש מספר יתרונות (למשל, מיקוד תפוקה גבוהה במבחנה, מניפולציה מרובת אללים, ומניפולציה של גנים Cre ו - flox יכולה להתבצע בתקופה קצרה). בנוסף, זנים עם עוברים קשים לטיפול במבחנה, כגון BALB/c, יכולים לשמש גם למיקוד ESC. פרוטוקול זה מתאר את השיטה הממוטבת עבור דנ"א בגודל גדול (מספר קילובייט) KI בתאי גזע עובריים על ידי יישום עריכת גנום בתיווך CRISPR/Cas9 ולאחר מכן ייצור עכברי כימרה לפיתוח מודלים של עכברים שעברו מניפולציה גנטית.
Introduction
ייצור עכברים מהונדסים גנטית וניתוח הפנוטיפ שלהם מאפשרים לנו להבין פונקציות גנטיות ספציפיות בפירוט, in vivo. ממצאים חשובים רבים נחשפו באמצעות מודלים של בעלי חיים מהונדסים גנטית בתחום מדעי החיים. יתר על כן, מאז הדו"ח של טכנולוגיית עריכת הגנום באמצעות CRISPR/Cas91, מחקר באמצעות עכברים מהונדסים גנטית התפשט במהירות למעבדות רבות 2,3. עריכת גנום של זיגוטים של עכברים על ידי CRISPR/Cas9 השיגה יעילות מקובלת לפיתוח שינוי DNA קצר, כגון נוקאאוט גנים מונחה מוטציה של אינדל4, החלפת נוקלאוטידים בודדים, או החדרת תג פפטיד קצר באמצעות אוליגונוקלאוטידים חד-גדיליים (ssODNs) כתורמי נוק-אין (KI)5. מצד שני, ה-KI של מקטעי דנ"א גדולים לתוך זיגוטים על ידי עריכת גנום נשאר ביעילות נמוכה בהשוואה לשינוי הדנ"א הקצר 6,7. בנוסף, קשה להשתמש בזני עכברים כמו BALB/c, שהוא זן חשוב לתחומי מחקר ספציפיים כמו אימונולוגיה, לעריכת גנום מבוססת זיגוטה מכיוון שהעוברים שלהם לפני ההשרשה רגישים למניפולציה במבחנה.
דרך נוספת לפתח מודלים של עכברים מהונדסים גנטית היא להשתמש בטכניקת מיקוד תאי גזע עובריים (ESC) ואחריה הזרקת ESC לעובר טרום השרשה כדי לייצר כימרות 8,9,10, שעדיין משמשות באופן שגרתי כשיטה קונבנציונלית. למרות ששיעור הרכישה להשגת שיבוטים מדויקים של KI-ESC אינו גבוה במיוחד בשיטות מיקוד ESC קונבנציונליות, מיקוד ESC מציע כמה יתרונות בהשוואה לעריכת גנום של זיגוטה, במיוחד עבור KI DNA ארוך. לדוגמה, יעילות ה-KI של מקטעי דנ"א ארוכים (> כמה קילובייט) לתוך הגנום של הזיגוטה פחות ניכרת6,7, וזיגוטים רבים נדרשים כדי לפתח אפילו שורה אחת של עכבר KI, שאינה רצויה בפרספקטיבה הנוכחית של ניסויים בבעלי חיים. בניגוד לעריכת גנום של זיגוטה, דנ"א ארוך המכוון לתאי גזע עובריים ואחריו ייצור כימרה זקוק למספר קטן יותר של עוברים מאשר עריכת גנום של זיגוטה. יתר על כן, למרות שהעוברים טרום ההשרשה מ- BALB/c רגישים למניפולציה במבחנה, ניתן לשמור ולטפל ב- ESCs שלהם במבחנה 11 כ- ESCs מוסמכים אחרים של 129 או F1, ולכן ישימים להפקות כימרה. עם זאת, למרות שווקטור מיקוד מכיל זרועות הומולוגיות של 5' ו-3' וקלטות גנים של עמידות לתרופות לבחירה חיובית או שלילית, יעילות ה-KI הקונבנציונלית של תאי גזע עובריים בדרך כלל אינה מספקת, בגלל התדירות הגבוהה של אינטגרציה גנומית אקראית 8,10, לפיכך, נדרשת שיטה משופרת עם יעילות מיקוד ESC מדויקת. לאחרונה, דיווחנו על שיטת ESC KI מכוונת המשתמשת בעריכת גנום מבוססת CRISPR/Cas9 כדי להשיג יעילות KI גבוהה יותר משיטות מיקודקונבנציונליות 11. השיטה שאנו מתארים כאן מבוססת על הליך זה המאפשר דנ"א ארוך (> כמה עד 10 קילובייט) KI לתאי גזע עובריים ביעילות מקובלת לעבודות שגרתיות ללא בחירת תרופות; לפיכך, הליך בניית הווקטור יהיה הרבה יותר קל ויצטרך תקופה קצרה יותר, או שגם תקופת תרבית התאים תהיה קצרה משמעותית.
Protocol
כל הניסויים בעכבר אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת טוקיו (מספר אישור PA17-63) ואוניברסיטת אוסקה (מספר אישור Biken-AP-H30-01) ובוצעו על פי ההנחיות שלהם, כמו גם הנחיות ARRIVE (https://arriveguidelines.org).
1. מיקוד בניית וקטורים
- הגבירו קלטת KI (CreERT כאן, דנ"א תבניתי עבור ה-PCR הוא במקור מחברת סינתזת גנים מסחרית) וקטע של כ-1 קילובייט של זרועות הומולוגיה בגודל 5 או 3 אינץ' על ידי PCR. עבור שיבוט DNA (שלב 1.3), הוסף רצפי חפיפה של 15-mer בקצה 5' של כל פריימר PCR. טהרו את מקטעי הדנ"א של ה-PCR על ידי אלקטרופורזה של ג'ל אגרוז, ולאחר מכן הוציאו את מקטע הדנ"א באמצעות ערכת טיהור DNA.
- ליניאריזציה של פלסמיד עמוד השדרה (לדוגמה, pUC19 או pBS) באמצעות אנזימי הגבלה מתאימים שמתעכלים באופן ייחודי איפשהו באתר המולטי-שיבוט לצורך שיבוט. לאחר מכן, טהרו את הפלסמיד המעוכל באמצעות ערכת טיהור DNA.
- שכפלו כל מקטע PCR (למשל, זרוע הומולוגיה 5'-, זרוע הומולוגיה 3'-) ורצף KI בו זמנית לתוך הפלסמיד המעוכל באמצעות ערכת שיבוט DNA בהתאם להוראות היצרן.
- הפוך את התאים המתאימים באמצעות הפלסמיד הבנוי (שלב 1.3) על ידי חימום ב 42 מעלות צלזיוס למשך דקה אחת באמבט מים, ולאחר מכן זרע אותם על צלחת LB המכילה את הריכוז המתאים של אנטיביוטיקה כגון אמפיצילין או קנאמיצין. תרבות אותם בן לילה לבחירות שיבוט עמידות.
- לאסוף כמה (ארבע עד שמונה) מושבות בודדות באמצעות 200 μL פיפטה טיפים ולהעביר את הקצוות לתוך 3 מ"ל של LB נוזלי המכיל אנטיביוטיקה מתאימה (100 מיקרוגרם / מ"ל אמפיצילין או 20 μL / mL kanamycin) ותרבית לילה ב 37 מעלות צלזיוס עם רעידות.
- טהרו את הפלסמיד למחרת באמצעות ערכת טיהור פלסמידים מסחרית ללא אנדוטוקסין בהתאם להוראות היצרן. אשר את הרצף המשובט בפלסמיד על ידי ריצוף סנגר. התאימו את ריכוז הפלסמיד ל-1 מיקרוגרם DNA/μL באמצעות מים נטולי נוקלאזה. השתמש בפלסמיד כווקטור מיקוד הגנים.
2. הכנת הפיברובלסט העוברי של העכבר (MEF) כתאי הזנה ל-ESC
- להקריב עכברות ICR הרות בנות 8-10 שבועות (14.5 ימים לאחר הלידה) על ידי נקע צוואר הרחם. נגבו היטב את הבטן על ידי שימוש באתנול 70% (v/v) לעיקור, חתכו את הבטן באמצעות מספריים ומלקחיים מסלוליים, ושחזרו את הרחם המכיל את העובר.
- הכניסו את הרחם לצלחת בקוטר 100 מ"מ המכילה 10 מ"ל של סרום בקר פוספט (PBS) המכיל 100 פניצילין U/mL ו-100 מיקרוגרם/מ"ל סטרפטומיצין. הסר את השליה ואת הרקמות extraembryonic מן העוברים באמצעות מספריים מסלולית ומלקחיים. טחנו את העוברים באמצעות מספריים מסלוליים והעבירו את תמיסת ה- PBS המכילה את תאי העובר הטחונים לצינור חרוטי של 50 מ"ל.
- צנטריפוגה ב 280 x גרם במשך 5 דקות ב 4 מעלות צלזיוס ולהשליך את supernatant על ידי שאיפה. מוסיפים 10 מ"ל של תמיסת טריפסין-EDTA של 0.25% (w/v), מערבבים היטב על ידי פיפטציה, ואז דוגרים במשך 10 דקות בטמפרטורה של 37 מעלות צלזיוס באמצעות אמבט מים לעיכול טריפסין.
- הוסיפו 20 מ"ל של מדיום MEF (DMEM המכיל 10% (v/v) סרום בקר עוברי, 100 U/mL פניצילין ו-100 מיקרוגרם/מ"ל סטרפטומיצין) כדי לעצור את התגובה האנזימטית, ערבבו היטב על ידי היפוך עדין, וצנטריפוגה ב-280 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. השליכו את הסופר-נאטנט על ידי שאיפה, הוסיפו 10 מ"ל של מדיום MEF, וערבבו היטב על ידי פיפטציה.
- זרעו את מתלה התאים בכמה מנות חדשות בקוטר 100 מ"מ (הכינו את אותו מספר מנות כמו מספר העוברים עם 10 מ"ל של מדיום MEF למנה אחת של 100 מ"מ). שנו את המדיום 4 עד 5 שעות לאחר הזריעה כדי להסיר תאים לא מחוברים ותנו ל-MEF המצורף לגדול. הזז את התאים כאשר הם מגיעים ~ 80% מפגש באמצעות טריפסין.
- מניחים את מנות התרבית המכילות את ה-MEF המתרבה במדיום MEF, כ-12-15 יום לאחר הזריעה, במכשיר המקרין קרני רנטגן. חשוף את ה- MEF עם צילום רנטגן של 50 Gy (סה"כ) כדי לעצור את מחזור התא בהתאם להוראת היצרן.
- נסה את ה- MEF המוקרן על ידי הוספת 2 מ"ל של 0.25% טריפסין-EDTA למנה אחת של 100 מ"מ למשך 5 דקות ב- 37 מעלות צלזיוס, ולאחר מכן הוסף 4 מ"ל של מדיום MEF כדי לעצור את עיכול הטריפסין ולאסוף את תרחיף התאים בצינור חדש של 50 מ"ל.
- שטפו את ה-MEF במדיום MEF טרי על ידי צנטריפוגה בטמפרטורה של 280 x גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס, ספרו את מספר התאים באמצעות מונה תאים עם כתם כחול טריפאן, והקפאו אותם בטמפרטורה של 1.6 x 106 תאים /צינור במדיום להקפאת תאים. יש לאחסן עד לשימוש; תאים יכולים להיות מאוחסנים ביציבות בחנקן נוזלי במשך מספר שנים.
3. הכנת תערובת Cas9-RNP-DNA
- ממיסים tracrRNA ו-crisprRNA במאגר דילול (כל ריכוז RNA ב-200 μM) על ידי פיפטציה. ערבבו את תמיסת tracrRNA, תמיסת crisprRNA וחיץ הדילול (יחס נפח של 2:2:5) על ידי הקשה עדינה ו-anneal כל RNA באמצעות מחזור תרמי ב-95 מעלות צלזיוס למשך 10 דקות ולאחר מכן מחזורי הורדה של 1 °C/min עד שהטמפרטורה מגיעה ל-4 מעלות צלזיוס.
הערה: רצף ה-gRNA תוכנן באמצעות CRISPOR, http://crispor.tefor.net. - דגרו את ה-RNA החישול, 10 מיקרוגרם/μL Cas9 nuclease, ואת חיץ האלקטרופורציה מעורבב ביחס נפח של 5:3:2 ב-37 מעלות צלזיוס למשך 20 דקות כדי ליצור את קומפלקס Cas9-RNP. בעבודה שגרתית, ערבבו ודגרו 1.25 μL של RNA חישול, 0.75 μL של Nuclease Cas9, ו-0.5 μL של מאגר האלקטרופורציה עבור עריכת גנום לוקוס אחד.
- ערבבו את החומרים הבאים בצינור של 1.5 מ"ל: 10 μL של מאגר אלקטרופורציה, 1 μL של קומפלקס Cas9-RNP (שלב 3.2), ו-1 μL של וקטור מיקוד מעגלי (1 מיקרוגרם/μL, שלב 1.6). הכמות הכוללת של תערובת Cas9-RNP-DNA היא 12 μL. שמור את תערובת Cas9-RNP-DNA על הקרח עד לאלקטרופורציה.
הערה: כדי למנוע ביקוע מחדש של ה-gRNA לאחר KI, תכנן את ה-gRNA במיקום שבו רצף זיהוי ה-gRNA מפוצל על-ידי שילוב של תורם ה-KI. אם לא ניתן לתכנן את ה-gRNA במיקום כזה, מספר מוטציות שקטות של נוקלאוטידים, שבאמצעותן רצף חומצות האמינו אינו משתנה, נכללות בפלסמיד של תורם ה-KI.
4. מיקוד גנים של תאי גזע עובריים
- כדי להכין את כלי תרבית התאים המצופים בג'לטין, הוסיפו תמיסת ג'לטין של 0.1% (w/v) ב-2 מ"ל לצלחת של 60 מ"מ, 500 מיקרו-ליטר לצלחת של 24 בארות, 100 מיקרו-ליטר לצלחת של 96 בארות, ודגרה של שעתיים באינקובטור לח. יש להסיר את תמיסת הג'לטין, לשטוף פעמיים באותה כמות של PBS ולאחסן בטמפרטורת החדר עד לשימוש.
- הפשירו מלאי MEF קפוא ללא פעילות מיטוטית (שלב 2.2) באמצעות אמבט מים בטמפרטורה של 37 מעלות צלזיוס למשך דקה אחת, והניחו את ה-MEF על צלחת מצופה ג'לטין בקוטר 60 מ"מ (שפופרת אחת קפואה של MEF המכילה 1.6 x 106 תאים עבור שתי מנות בקוטר 60 מ"מ, שלב 2.2) יום אחד לפני זריעת ESC.
- להפשיר צינור מלאי ESC קפוא (מאוחסן ב 2 x 10 5 ESC / צינור; ספירת תאים בוצעה באמצעות מונה תאים) באמצעות אמבט מים 37 מעלות צלזיוס במשך דקה אחת, ולהניח 1 x 105 ESCs על צלחת 60 מ"מ המכילה MEF נזרע מראש (שלב 4.1).
- תרבית בתרבית ESC 4 מ"ל (ESCM, מדיום מותאם מבוסס DMEM עם סרום בקר עוברי 15% (v/v), 2 mM L-גלוטמין מצע, 100 U/mL פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין, 0.1 mM 2-מרקפטואתנול, גורם מעכב לוקמיה ו-t2i (0.2 μM PD0325901 ו-3 μM CHIR99021) השומר על פלוריפוטנטיות של ESC11) ב-37 °C עם 5% CO2 עד שה-ESC מגיע ל-50% עד 70% מפגש.
הערה: אנו משתמשים בשלושה קווים שונים של ESC: JM8. A3 מ-B6N, V6.5 מ-B6-129 F1, ו-BALB/c ESC שפותחו בתוך החברה. אותם פרוטוקולי KI בכתב יד זה משמשים לכל קווי ESC. - יש לשטוף את ה-ESC המתרבה עם 4 מ"ל של PBS, ולאחר מכן לטפל עם 800 μL של תמיסת טריפסין-EDTA של 0.25% למשך 5 דקות בטמפרטורה של 37 מעלות צלזיוס לעיכול. הוסף 1 מ"ל של ESCM כדי להשבית את הטריפסין ולנתק את תאי הגזע העובריים לתאים בודדים על ידי פיפטינג.
- צנטריפוגה של התמיסה המכילה ESC במשך 5 דקות ב 280 x גרם, להשליך את supernatant, להשעות ESCs ב 1 מ"ל טרי של ESCM, ולספור את מספר התאים באמצעות מונה תאים עם כתם כחול טריפאן. העבר 1 x 10 5 ESCs לצינור חדש1.5 מ"ל ולשטוף אותם שלוש פעמים עם PBS על ידי צנטריפוגה ב 500 x גרם, 4 °C.
- יש להשעות את גלולת ESC ב-12 μL של תערובת Cas9-RNP-DNA (שלב 3.3) ולערבב היטב על ידי פיפטה עדינה כדי למנוע מבעבעים. הגישו את ה-ESC המחודש לצורך אלקטרופורציה. מערכת האלקטרופורציה משתמשת בפעימה אחת ב-1,400 וולט וב-30 מילישניות עבור התמרת Cas9-RNP-DNA (איור 1).
- תרבית את תאי הגזע העובריים האלקטרופולטיביים בצלחת בקוטר 60 מ"מ המכילה 4 מ"ל של ESCM עם MEF מומת מיטוטית (סעיף 4.2). שנה את המדיום כל יום.
- לשטוף את תאי גזע עובריים עם 4 מ"ל של PBS 3 עד 5 ימים לאחר האלקטרופורציה, ולאחר מכן לטפל עם 800 μL של 0.25% טריפסין-EDTA ותרבית ב 37 מעלות צלזיוס במשך 5 דקות באינקובטור לח לעיכול. הוסף 2 מ"ל של ESCM כדי לעצור את עיכול הטריפסין וצנטריפוגה של תערובת התאים ב 280 x גרם במשך 5 דקות.
- השליכו את הסופר-נטנט, החזירו את תאי הגזע העובריים ב-1 מ"ל של ESCM טרי, וספרו את ריכוז התאים באמצעות מונה תאים עם כתם כחול טריפאן. העבירו את תאי הגזע העובריים ב-1 x 103 תאי גזע עובריים לכל צלחת בקוטר 60 מ"מ המכילה ESCM ו-MEF מזין. החליפו את המדיום כל יום עד שהמושבה תתפוס.
הערה: הסיבה לכך שה-ESC מועבר פעם אחת לפני האיסוף הייתה שעריכה גנומית עשויה להמשיך להתרחש לאחר חלוקת ESC, כך שהמושבה הראשונה אינה תמיד השיבוט במקרים רבים. לכן, המעבר הראשון של ESC לפני איסוף המושבה הוא צעד חיוני לאיסוף שיבוטים בודדים.
5. גנוטיפ PCR של תאי גזע עובריים ממוקדים
- שאפו ESCM מצלחת תרבות ESC 5 עד 7 ימים לאחר המעבר הראשון (שלב 4.9) והוסיפו 4 מ"ל של PBS. אסוף מושבות ESC בודדות עם 5 μL של PBS באמצעות פיפטה של 20 μL תחת סטריאומיקרוסקופ (הגדלה של 30x עד 40x). מניחים את המושבות הבודדות בבאר של צלחת 96 באר בעלת תחתית עגולה המכילה 15 μL של תמיסת טריפסין-EDTA של 0.25%.
- החזיקו את צלחת 96 הבארות על הקרח עד ש-48 מושבות בודדות ייאספו. דגרו את צלחת 96 הבאר במשך 5 דקות בחממה לחה של 37 מעלות צלזיוס 5% CO2 , ולאחר מכן הוסיפו 80 μL של ESCM כדי להפסיק את עיכול הטריפסין ולנתק מושבות ESC לתאים בודדים על ידי פיפטציה.
הערה: מכיוון שיעילות ה- KI של שיטה זו היא בדרך כלל 10%-50%, אנו קולטים באופן שגרתי 48 שיבוטים ומבצעים לראשונה גנוטיפ באמצעות 24 מהם. אם לא ניתן להשיג שיבוטים מרובים של KI בשלב זה, אנו ממשיכים לסנן עבור KI באמצעות 24 השיבוטים הנותרים. - העבר 40 μL של מתלה ESC (שלב 5) לצלחת הזנה ללא ציפוי ג'לטין 96 באר המכילה 50 μL של ESCM לכל באר עבור גנוטיפ PCR. העבירו את 60 המיקרוליטרים הנותרים של מתלי ESC לבאר בלוח 24 בארות מצופה ג'לטין, המכיל 500 מיקרון ליטר של ESCM ו-MEF מזין, כדי ליצור את מלאי ה-ESC הקפוא.
- שיבוטים בודדים של ESC שגודלו בתרבית בצלחת 24 הבארות (שלב 5.3) עד שיגיעו למפגש של 60% עד 80%. שחזר שיבוטים בודדים של ESC על ידי טריפסיניזציה כאמור לעיל, אסוף תאים בצינור חדש של 1.5 מ"ל, וצנטריפוגה בגודל 280 x g למשך 5 דקות. יש להשליך את הסופר-נטנט, לתלות מחדש את התאים ב-500 μL של מדיום הקפאת תאים, ולהקפיא אותם באמצעות מקפיא עמוק של -80 מעלות צלזיוס.
- עבור גנוטיפ PCR, תרבית ESC משתבטת בצלחת נטולת ההזנה 96 היטב (שלב 5.3) עד שה-ESC מגיע ליותר מ-90% מפגש. הסר ESCM מכל באר על ידי שאיפה ושטוף פעמיים עם 100 μL של PBS.
- שאפו את ה-PBS והוסיפו 100 מיקרון של חיץ ליזיס המכיל פרוטאינאז K, ערבבו היטב והעבירו את ה-ESC לליזאט לצינור חדש של 1.5 מ"ל. מחממים את ליזאט ESC ב-65°C למשך שעה אחת לפחות באמצעות תא חום. חלץ וטהר את הדנ"א הגנומי באמצעות שיטת טיהור DNA פנול-כלורופורם קונבנציונלית ואחריה משקעי אתנול.
- ממיסים את הדנ"א המואץ ב-20 מיקרון של מים נטולי DNase וקובעים את הטוהר והריכוז של הדנ"א באמצעות ספקטרופוטומטר. בצע PCR גנומי באמצעות ערכות פריימרים ספציפיות ללוקוס כדי להגביר את אזור היעד. לאחר מכן, בדוק את הרצף ובחר את שיבוטי ESC עם רצפי ה- KI הרצויים.
6. הכנת עובר בשלב שמונה תאים ומיקרו-הזרקה של תאי גזע עובריים
- להזריק 5 IU של גונדוטרופין בסוסה הרה (PMSG) באופן תוך-צפקי לנקבות ICR בוגרות. לאחר 48 שעות, הזריקו 5 IU של גונדוטרופין כוריוני אנושי (hCG) לאותן נקבות, ואז הזדווגו עם הנקבות שטופלו בהורמונים עם זכרי ה- ICR. בדוק את תקע copulatory בנרתיק למחרת (יום עוברי 0.5, ED0.5).
הערה: כדי להעריך כימריזם לפי יחסי צבע הציפוי, השתמש בבלסטוציסט מזן ICR כנמען עבור ESC בעל רקע בצבע ציפוי שחור או אגוטי, או בבלסטוציסט מזן C57BL/6 כמושתל עבור ESC בעל רקע לבקן. - אסוף את האובידוקט ב-ED1.5 והנח אותו בטיפות בינוניות חצובות HEPES (FHM). לשחזר את העוברים שלב שני תאים או ארבעה תאים על ידי שטיפת oviduct עם FHM באמצעות מחט שטיפה מוכנס לתוך infundibulum.
- שטפו את העוברים שנאספו על ידי העברתם למספר טיפות FHM טריות באמצעות פיפטה לפה. תרבית העוברים ב 50 μL של KSOM טיפה על צלחת תרבית תאים 35 מ"מ מכוסה שמן מינרלי ב 37 מעלות צלזיוס, 5% CO 2 אינקובטור במשך יום אחד עד שלב שמונה תאים או morula (ED2.5) הוא הגיע.
- אם לא נעשה שימוש בעוברים ביום האיסוף הבא, הקפיאו אותם על ידי ויטריפיקציה בהתאם לפרוטוקול CARD (http://card.medic.kumamoto-u.ac.jp/card/english/sigen/manual/ebvitri.html), ואחסנו אותם בחנקן נוזלי עד לשימוש.
- הכינו פיפטות זכוכית להחזקת העוברים (קוטר חיצוני 80-100 מיקרומטר) והזרקת ESC (קוטר של כ-13 מיקרומטר) באמצעות משיכה ומיקרופורג'.
- שלב פיפטה החזקה המכילה FHM לתוך מחזיק נימי המחובר למיקרו-אינז'קטור והוצב בצד שמאל של המיקרומניפולטור. חבר פיפטה הזרקה למיקרו-אינז'קטור אחר והגדר אותו בצד ימין. יישרו את שני הפיפטות ישר בשדה הראייה של המיקרוסקופ.
- יש לטפטף 5 טיפות מיקרו-ליטר של 12% (w/v) פוליוויניל פירולידון (PVP) ב-FHM בינוני ו-5 טיפות של 5 מיקרו-ל' של FHM על אותו מכסה של צלחת בקוטר 60 מ"מ זו לצד זו ולכסות את הטיפות בשמן מינרלי. החזירו עוברים בטיפה FHM של 5 μL והוסיפו 1-5 μL של מתלה ESC לטיפת FHM המכילה עוברים.
הערה: השאירו את מתלי ה-ESC וה-MEF למשך 30 דקות ב-ESM של 4 מ"ל על צלחת תרבית בקוטר 60 מ"מ לפני הכנת הנפילה. מאחר ש-MEFs נדבקים לתחתית מהר יותר מתאי גזע עובריים, הדגירה בת 30 הדקות הזו מאפשרת ריכוז של תאי ES לא מחוברים בסופר-נטנט. - שטפו בתוך פיפטה ההזרקה עם PVP, ואז עברו לטיפה המכילה את העוברים ואת תאי הגזע העובריים.
- הרם שלושה כפילי ECS בודדים שזה עתה סיימו את חלוקת התאים שלהם (שישה תאים) בפיפטת ההזרקה. להחזיק עובר שלב שמונה תאים או מורולה, אשר השלים דחיסה, עם פיפטה החזקה על ידי שאיפה. לעשות חור ב zona pellucida עם פולס פיאזואלקטרי (עוצמה: 3; מהירות: 3). לגרש את ESC שישה תאים בתוך zona pellucida ולמשוך את פיפטה מתוך העוברים.
- שטפו את העוברים המוזרקים על ידי ESC עם מספר טיפות KSOM בעדינות באמצעות פיפטה בפה ודגרו אותם בטיפת KSOM חדשה של 50 μL המכוסה בשמן מינרלי בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 עד שהעוברים מתפתחים לשלב הבלסטוציסט.
- מעבירים את 10 הבלסטוציסטים המוזרקים על ידי ESC לכל קרן רחם של נקבות עכברים מדומות (2.5 ימים לאחר הלידה, 20 בלסטוציסטים לכל ראש).
- לאחר שהאם הפונדקאית ילדה, בחר לפחות שתי כימרות זכריות עם יחס הכימריזם הגבוה ביותר (70% ומעלה כפי שאושר על ידי צבע הפרווה), ולאחר מכן הזדווג אותן עם נקבות זן מתאימות כדי לקבל F1 heterozygous KI.
- לגדל עכברי KI בודדים עם שותפים מתאימים כדי להשיג עכברים עם גנוטיפ(ים) רצויים או רקע גנטי המתאים למחקר.
תוצאות
התמקדנו בגנים ספציפיים ב-ESC ולאחר מכן בייצור כימרה כדי לפתח ייצור עכברים שעברו מניפולציה גנטית על פי כתב היד הקודם שלנו11. גנוטיפ ESC (המתואר בסעיף 4) מתבצע באופן שגרתי על ידי PCR באמצעות פריימרים. הפריימרים מתוכננים על רצפים גנומיים מחוץ לזרועות ההומולוגיות ועל הרצפים הספציפיים במקטע הדנ"א של KI (איור 2A). במקרה זה, אף אלל מסוג בר אינו מוגבר, בעוד שאמפליקון PCR בגודל מסוים מזוהה רק כאשר הדנ"א האקסוגני הממוקד הוא KI במוקד המטרה. תוצאות PCR מייצגות של גנוטיפ מוצגות באיור 2B. תשעה מתוך 22 שיבוטים (40.9%) הראו להקה ספציפית ל-KI במקרה זה. שלוש תוצאות מיקוד מייצגות, כולל התוצאה המוצגת באיור 2, מוצגות בטבלה 1. תוצאות אלה מצביעות על כך שהשיטה המוצגת כאן יעילה וניתנת לשחזור עבור KI גן ללא כל בחירות תרופות.
ESC נאסף בפיפטה בהזרקה, ואז נוצר חור בזונה פלוצ'ידה באמצעות פלוס פיאזואלקטרי, וה-ESC משתחרר בין התאים העובריים (איור 3). מבחינה טכנית, פרוטוקול זה להזרקת ESC לעובר בן שמונה תאים או שלב מורולה דומה לפרוטוקול להזרקת ESC לבלסטוציסט הנפוץ במתקני עכברים רבים. עכברים כימריים מייצגים מוצגים באיור 4. לצורך הערכת צבע הפרווה של כימריזם, העובר מזן ה-ICR (לבקנים, שיער לבן) שימש כמקבל B6 או B6-129 F1 ESC, ועוברי B6 שימשו כמקבלי BALB/c ESCs (איור 4).
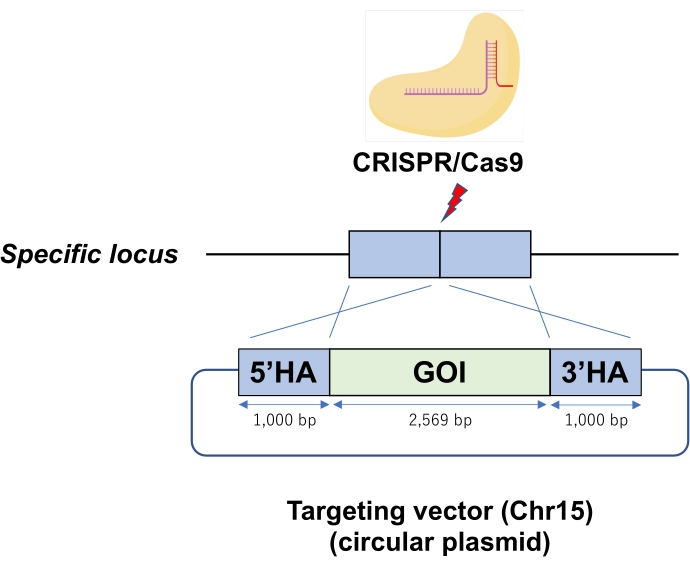
איור 1: שרטוט של שילוב פלסמיד מעגלי בתיווך CRISPR/Cas9 ריבונוקלאופרוטאין (RNP) לתוך המוקד הספציפי של גנום ESC. אלקטרופורציה מציגה פלסמיד מעגלי כווקטור מיקוד לתוך תאי גזע עובריים עם Cas9-RNP. קיצורים: GOI = גן של עניין, HA = זרוע הומולוגיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
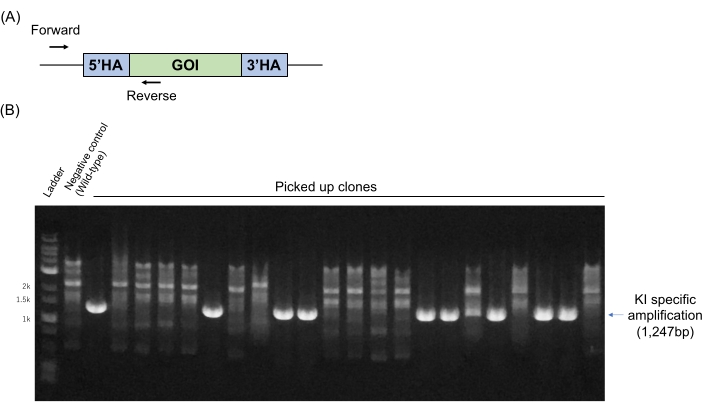
איור 2: ניתוחי PCR גנומיים לבדיקת KI של שיבוטים ממוקדים של ESC. (A) פריימרים ספציפיים ל-PCR של KI מתוכננים על רצפים גנומיים מחוץ לזרועות ההומולוגיות (קדימה) וברצפים הספציפיים במקטע הדנ"א של KI (הפוך). (B) תוצאות PCR של גנוטיפ מייצג. גנום מסוג בר שימש כבקרה שלילית. קיצורים: GOI = גן של עניין, HA = זרוע הומולוגיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
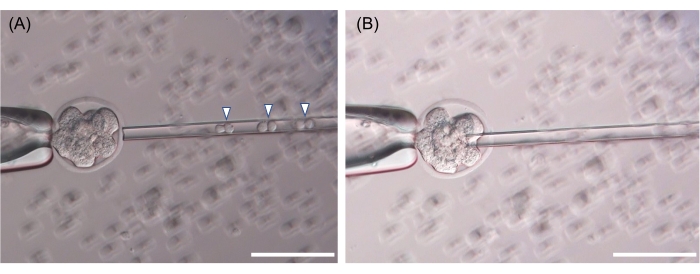
איור 3: תמונות מייצגות של הזרקת עובר בשלב שמונה תאים. (A) עבור מיקרו-הזרקה, שלושה כפילים של תאי גזע עובריים (שישה תאים, ראשי חץ) נאספים. (B) חור בזונה פלוצ'ידה נוצר עם פולס פיאזואלקטרי, ותאי גזע עובריים מגורשים בין כל בלסטומר. סרגל קנה המידה המוצג הוא 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: תמונות מייצגות של עכברי כימרה. (A,B) ה-ESC נגזר מ-C57BL/6N (JM8). A3, שיער אגוטי; A) או B6-129 F1 (שיער אגוטי; B) מוזרקים לעוברי ICR (לבקנים, שיער לבן), ולאחר מכן מעבירים את העוברים לפונדקאיות האם. (C) ה-ESC שמקורו ב-BALB/c (לבקנים, שיער לבן) מוזרק לעוברי C57BL/6J (שיער שחור), ולאחר מכן מעביר את העוברים לפונדקאיות אם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| מזהה פרויקט | כורומוזום | אורך 5'HA (bp) | אורך 3'HA (bp) | הוספת גודל (bp) | מספר השיבוטים שנותחו | מספר שיבוטים של KI | יעילות (%) | הערות |
| R26-CC* | Chr6 | 965 | 1006 | 5321 | 23 | 2 | 8.7% | - |
| ₪10-03* | Chr8 | 1000 | 997 | 3070 | 22 | 6 | 27.3% | - |
| P4-01* | Chr15 | 1000 | 1000 | 2569 | 22 | 9 | 40.9% | מוצג באיור 2 |
טבלה 1: יעילות KI בשלושה מוקדים גנומיים עצמאיים ב-ESC. *פרויקטים אלה לא פורסמו עד כה. שמם של גנים אלה ייחשף בכתבי יד עצמאיים בעתיד.
Discussion
מיקוד גנים של תאי גזע עובריים ואחריו ייצור כימרה שימשו באופן קונבנציונלי לפיתוח עכברים שעברו מניפולציה גנטית. אף על פי כן, יעילות הדפיקה של הגנים נותרה נמוכה למרות שווקטור המיקוד מכיל זרועות הומולוגיות ארוכות (> כמה קילובייט בדרך כלל) עם קלטות גנים חיוביות או שליליות לבחירת תרופות. הפרוטוקול שלנו הציג שיטת ESC KI מכוונת של דנ"א אקסוגני ארוך באמצעות פלסמיד מעגלי ללא קלטות לבחירת תרופות כווקטור מיקוד המלווה בעריכת גנום בתיווך Cas9-RNP ביעילות מקובלת לעבודות שגרתיות. לפיכך, פרוטוקול זה יכול לעזור להפחית באופן משמעותי את משך הזמן הנדרש בייצור עכברים כימריים מהונדסים גנטית בהשוואה למיקוד ESC הקונבנציונלי.
בפרוטוקול זה השתמשנו ב-CRISPR/Cas9-RNP כדי לגרום לשברים דו-גדיליים ספציפיים לאתר בגנום, ופלסמיד מעגלי שימש כווקטור המיקוד במקום וקטור ליניארי. פלסמידים ליניאריים משמשים באופן קונבנציונלי כווקטור מיקוד לגן KI בגלל היעילות המוגברת שלהם של אינטגרציה גנומית 8,9,10. עם זאת, אינטגרציות גנומיות רבות אינן ספציפיות למרות שהווקטור מכיל זרועות הומולוגיות9. מצד שני, פלסמידים מעגליים משמשים לעתים רחוקות כווקטורים ממוקדים בגלל התכונה הקשה לשילוב שלהם בגנום של תאי גזע עובריים12 או פיברובלסטים13. לפיכך, ייתכן שיישום פלסמיד מעגלי כווקטור מיקוד המלווה בעריכת גנום בתיווך CRISPR/Cas9 ממזער אינטגרציה אקראית לא ספציפית, אך ממקסם את האינטגרציה הספציפית לאתר בגנום ESC. ראוי לציין כי יעילות האינדוקציה של שבירת הגדילים הכפולים על ידי CRISPR/Cas9 חשובה למדי14, ולכן יהיה חיוני להשתמש ב-gRNA הגורם לשבר דו-גדילי ביעילות גבוהה. יש לשקול תכנון מחדש של gRNA כאשר יעילות ה-KI נמוכה מדי. במקרה המוצג באיור 2, 40.9% משיבוטי ESC הראו פס ספציפי ל-KI. למעשה, כמעבדת הליבה של המכון, אנו מבצעים באופן שגרתי מיקוד גנים באמצעות תאי גזע עובריים בשיטה המתוארת כאן והשגנו יעילות KI של 10%-50% עבור רצפים של 1-2 קילובייט כגון Cre, CreERT או כתבים פלואורסצנטיים, אם כי יש כמה וריאציות בהתאם למוקד הגן. רצפי הדנ"א הארוכים ביותר שיש לנו בהצלחה KI בשיטה זו הם בערך 11.2 קילובייט לתוך לוקוס Rosa26, והיעילות הייתה 12.2% (חמש מושבות KI מתוך 41 מושבות שנותחו).
כמו כן, יש לציין כי פרוטוקול זה משתמש בעוברים בעלי שמונה תאים או בשלב מורולה כמושתלים עבור מיקרו-הזרקות ESC אך לא עוברים בשלב הבלסטוציסט. למרות שלא ערכנו ניסויים משווים במאמר זה, מספר דיווחים הראו כי הזרקה של תאי גזע עובריים לעוברים בשלב שמונה תאים או מורולה משפרת באופן משמעותי את היעילות של תרומת ESC לצאצאים כימריים בהשוואה להזרקת ESC לבלסטוציסטים15,16,17,18 . ואכן, הזרקות ESC של קווי ESC שונים, כולל C57BL/6, B6-129 F1 ו-BALB/c, גרמו בדרך כלל להתפתחות כימרה בצבע פרווה גבוהה אצל חלק מהצאצאים, אך לא בכולם (ראו איור 4). המגבלה של השיטה היא שתאי גזע עובריים שהוזרקו לעובר טרום השרשה לא תמיד יכלו לתרום לתאי נבט בכימרה19,20. העברת Germline של ESCs תהיה תלויה באיכות של כל שיבוט ESC19. לכן, יהיה זה יתרון לפתח קווי שיבוט ESC מרובים כגיבוי לייצור עכברים כימריים יציבים. לסיכום, הפרוטוקולים המוצגים כאן משתמשים בווקטורי מיקוד פשוטים הכוללים רק כל זרוע הומולוגיה וגן שמעניין את KI ללא כל קלטת עמידה לתרופות. לכן, בניית הווקטור תהיה הרבה יותר קלה, וניתן יהיה לקצר את תקופת התרבות בהשוואה לטכניקת המיקוד הקונבנציונלית של ESC. זה יעזור לייצר במהירות ובהקלה סוגים שונים של עכברים מהונדסים גנטית לניתוח עתידי במדעי החיים.
Disclosures
למחברים אין אינטרסים מתחרים לחשוף.
Acknowledgements
אנו מודים לסאקי נישיוקה באוניברסיטת אוסקה, מחקר ופיתוח ביוטכנולוגיה (ארגון ללא מטרות רווח), ולמיו קיקוצ'י ורייקו סאקאמוטו במכון למדעי הרפואה, אוניברסיטת טוקיו, על הסיוע הטכני המצוין שלהם. עבודה זו נתמכה על ידי: משרד החינוך, התרבות, הספורט, המדע והטכנולוגיה (MEXT)/האגודה היפנית לקידום המדע (JSPS) מענקי KAKENHI ל- MI (JP19H05750, JP21H05033), ו- MO (20H03162); מחקר הליבה למדע וטכנולוגיה אבולוציונית (CREST), מענק סוכנות המדע והטכנולוגיה של יפן (JST) ל- MI (JPMJCR21N1 ); המכון הלאומי לבריאות הילד והתפתחות האדם ע"ש יוניס קנדי שרייבר ל-MI (R01HD088412); קרן ביל ומלינדה גייטס ל-MI (מענק חקר האתגרים הגדולים INV-001902); והמענק לפרויקט מחקר משותף של מכון המחקר למחלות מיקרוביאליות, אוניברסיטת אוסקה ל-MI ו-MO.
Materials
| Name | Company | Catalog Number | Comments |
| BALB/c ESC | - | - | ESC developed from BALB/c strain |
| Bambanker | Nippon Genetics | CS-02-001 | Cell-freezeing medium. Section 2.6 and elsewhere |
| Cas9 Nuclease V3 | IDT | 1081059 | Section 3.2 and elsewhere. |
| CHIR99021 | FUJIFILM Wako | 038-23101 | Section 4.3 |
| CreERT gene fragment | GeneWiz | Section 1.1. | |
| CRISPR-Cas9 crisprRNA | IDT | crisprRNA. Section 3.1 and elsewhere. | |
| CRISPR-Cas9 tracrRNA | IDT | 1072534 | tracrRNA. Section 3.1 and elsewhere. |
| DMEM | Nacalai | 08458-45 | MEF medium. Section 2.3 and elsewhere |
| Duplex buffer | IDT | 1072534 | RNA dilution buffer. Section 3.1 and elsewhere. |
| FastGene Gel/PCR Extraction Kit | Nippon Genetics | FG-91302 | Section 1.1 and 1.2. |
| GlutaMax | Thermo Fisher | 35-050-061 | L-glutatime substrate |
| hCG | ASKA Animal Health | Section 6.1. | |
| In-Fusion HD Cloning Kit | Clontech | 639648 | DNA cloning kit. Section 1.3 and elsewhere |
| JM8.A3 ESC | EuMMCR | - | ESC developed from C57BL/6N strain |
| Knock-out DMEM | Thermo Fisher | 10829018 | Section 4.3 and elsewhere, DMEM-based modified commercial medium. |
| KSOM | Merck | MR-121-D | Section 6.3 and 6.9. |
| Leukemia inhibitory factor | FUJIFILM Wako | 125-05603 | Section 4.3. No unit concentration data is supplied by the provider. Used 1,000-fold dilution in this protocol. |
| Neon Electroporation system | Thermo Fisher | MPK5000 | Section 3.2, 4.5 and elsewhere. The system containes electroporation buffer as well used in section 3.2. |
| NucleoSpin Plasmid Transfection-grade | Takara | U0490B | Section 1.6. |
| PD0325901 | FUJIFILM Wako | 162-25291 | Section 4.3 |
| PMSG | ASKA Animal Health | Section 6.1. | |
| Tail lysis buffer | Nacalai | 06169-95 | Section 5.5. |
| Trypsin-EDTA | Nacalai | 32777-15 | Section 2.2 and elsewhere |
| V6.5 ESC | - | - | ESC developed from B6J-129 F1 strain |
| X-ray irradiation device | Hitachi | MBR-1618R-BE | Section 2.6. |
References
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Oji, A., et al. CRISPR/Cas9 mediated genome editing in ES cells and its application for chimeric analysis in mice. Scientific Reports. 6, 31666 (2016).
- Kaneko, T., Mashimo, T. Simple genome editing of rodent intact embryos by electroporation. PLoS One. 10 (11), 0142755 (2015).
- Chen, F., et al. High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nature Methods. 8 (9), 753-755 (2011).
- Hashimoto, M., Yamashita, Y., Takemoto, T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Developmental Biology. 418 (1), 1-9 (2016).
- Mansour, S. L., Thomas, K. R., Capecchi, M. R. Disruption of the proto-oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes. Nature. 336 (6197), 348-352 (1988).
- Johnson, R. S., et al. Targeting of nonexpressed genes in embryonic stem cells via homologous recombination. Science. 245 (4923), 1234-1236 (1989).
- Hasty, P., Ramires-Solis, R., Krumlauf, R., Bradley, A. Introduction of a subtle mutation into the Hox-2.6 locus in embryonic stem cells. Nature. 350 (6315), 243-246 (1991).
- Ozawa, M., Emori, C., Ikawa, M., Hatada, I. Gene targeting in mouse embryonic stem cells via CRISPR/Cas9 ribonucleoprotein (RNP) mediated genome editing. Genome Editing in Animals - Methods and Protocols 2nd edition. , (2022).
- Yagi, M., et al. Derivation of ground-state female ES cells maintaining gamete-derived DNA methylation. Nature. 548 (7666), 224-227 (2017).
- Gassmann, M., Donoho, G., Berg, P. Maintenance of an extrachromosomal plasmid vector in mouse embryonic stem cells. Proceedings of National Academy of Sciences. 92 (5), 1292-1296 (1995).
- Okita, K., Nakagawa, M., Hyenjong, H., Ichisaka, T., Yamanaka, S. Generation of mouse induced pluripotent stem cells without viral vectors. Science. 322 (5903), 949-953 (2008).
- Poueymirou, W. T., et al. F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses. Nature Biotechnology. 25 (1), 91-99 (2007).
- Hu, M., et al. Efficient production of chimeric mice from embryonic stem cells injected into 4- to 8-cell and blastocyst embryos. Journal of Animal Science and Biotechnology. 4 (1), 1-7 (2013).
- Guo, J., et al. Contribution of Mouse Embryonic Stem Cells and Induced Pluripotent Stem Cells to Chimeras through Injection and Coculture of Embryos. Stem Cells International. 2014, 409021 (2014).
- Bodai, Z., Bishop, A. L., Gantz, V. M., Komor, A. C. Targeting double-strand break indel byproducts with secondary guide RNAs improves Cas9 HDR-mediated genome editing efficiencies. Nature Communications. 13 (1), 2351 (2022).
- Kobayashi, T., Goto, T., Oikawa, M., Sanbo, M., Yoshida, F., Terada, R., Niizeki, N., Kajitani, N., Kazuki, K., Kazuki, Y., Hochi, S., Nakauchi, H., Surani, A., Hirabayashi, M. Blastocyst complementation using Prdm14-deficient rats enables efficient germline transmission and generation of functional mouse spermatids in rats. Nature Communications. 12 (1), 1328 (2021).
- Miura, K., Matoba, S., Hirose, M., Ogura, A. Generation of chimeric mice with spermatozoa fully derived from embryonic stem cells using a triple-target CRISPR method for Nanos3. Biology of Reproduction. 104 (1), 223-233 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved