Method Article
CRISPR/Cas9-опосредованный высокоэффективный нацеливание генов в эмбриональных стволовых клетках для разработки моделей мышей, манипулируемых генами
В этой статье
Резюме
Здесь мы представляем протокол для разработки генетически модифицированных моделей мышей с использованием эмбриональных стволовых клеток, особенно для больших ДНК(KI). Этот протокол настроен с использованием редактирования генома CRISPR / Cas9, что приводит к значительному повышению эффективности KI по сравнению с обычным гомологичным методом линеаризации ДНК, опосредованным рекомбинацией.
Аннотация
Система CRISPR/Cas9 позволила развивать генетически модифицированных мышей путем прямого редактирования генома с использованием оплодотворенных зигот. Тем не менее, хотя эффективность в разработке мышей с нокаутом генов путем индуцирования небольшой мутации инделя была бы достаточной, эффективность редактирования генома эмбриона для создания днк большого размера (KI) все еще низка. Поэтому, в отличие от метода прямого КИ в эмбрионах, нацеливание генов с использованием эмбриональных стволовых клеток (ЭСК) с последующей инъекцией эмбриона для развития мышей-химер все еще имеет ряд преимуществ (например, высокая пропускная способность таргетирования in vitro, многоаллельные манипуляции и манипуляции с генами Cre и flox могут быть выполнены за короткий период). Кроме того, штаммы с труднообрабатываемыми эмбрионами in vitro, такие как BALB/c, также могут использоваться для нацеливания на ЭКУ. Этот протокол описывает оптимизированный метод для крупногабаритной ДНК (несколько кб) КИ в ЭСК путем применения CRISPR/Cas9-опосредованного редактирования генома с последующим производством мышей-химер для разработки моделей мышей, манипулируемых генами.
Введение
Производство генетически модифицированных мышей и анализ их фенотипа позволяет нам понять конкретные функции генов в деталях, in vivo. Многочисленные важные результаты были обнаружены с использованием генно-модифицированных моделей животных в области наук о жизни. Кроме того, начиная с отчета о технологии редактирования генома с использованием CRISPR / Cas91, исследования с использованием генетически модифицированных мышей быстро распространились во многих лабораториях 2,3. Редактирование генома зигот мышей с помощью CRISPR/Cas9 достигло приемлемой эффективности для разработки коротких модификаций ДНК, таких как нокаут гена4, ориентированный на мутацию индел, замена одного нуклеотида или короткая вставка пептидной метки с использованием одноцепочечных олигонуклеотидов (ssODNs) в качестве доноров5. С другой стороны, КИ крупных фрагментов ДНК в зиготы путем редактирования генома остается с низкой эффективностью по сравнению с короткоразмерной модификацией ДНК 6,7. Кроме того, трудно использовать мышиные штаммы, такие как BALB / c, который является важным штаммом для конкретных областей исследований, таких как иммунология, для редактирования генома на основе зигот, потому что их предимплантационные эмбрионы восприимчивы к манипуляциям in vitro.
Другим способом разработки генетически модифицированных моделей мышей является использование метода нацеливания на эмбриональные стволовые клетки (ESC) с последующей инъекцией ESC в предимплантационный эмбрион для получения химер 8,9,10, которые до сих пор обычно используются в качестве обычного метода. Хотя скорость сбора для получения точных клонов KI-ESC не очень высока в обычных методах нацеливания ESC, нацеливание ESC дает некоторые преимущества по сравнению с редактированием генома зиготы, особенно для длинных ДНК KI. Например, эффективность КИ длинных фрагментов ДНК (> несколько кб) в геном зиготы менее очевидна 6,7, и многие зиготы необходимы для развития даже одной линии KI мыши, что нежелательно в нынешней перспективе экспериментов на животных. В отличие от редактирования генома зиготы, длинная ДНК, нацеленная на ЭСК с последующим производством химер, требует значительно меньше эмбрионов, чем редактирование генома зиготы. Кроме того, несмотря на то, что преимплантационные эмбрионы из BALB/c восприимчивы к манипуляциям in vitro, их ЭСК могут поддерживаться и обрабатываться in vitro11 как другие компетентные фоновые ЭСК 129 или F1, следовательно, применимые для производства химер. Однако, несмотря на то, что вектор нацеливания содержит 5' и 3' гомологичные руки и кассеты генов лекарственной устойчивости для положительного или отрицательного отбора, обычная эффективность КИ ЭСК, как правило, недостаточна из-за высокой частоты случайной геномной интеграции 8,10, таким образом, требуется улучшенный метод с точной эффективностью нацеливания ЭКУ. Недавно мы сообщили о настроенном методе ESC KI с использованием редактирования генома на основе CRISPR / Cas9 для достижения более высокой эффективности KI, чем обычные методы нацеливания11. Метод, который мы здесь описываем, основан на этой процедуре, которая позволяет длинную ДНК (> от нескольких до 10 кб) КИ к ЭСК с приемлемой эффективностью для рутинных работ без выбора препарата; таким образом, процедура построения вектора была бы намного проще и требовала бы более короткого периода, или период клеточной культуры также стал бы значительно короче.
протокол
Все эксперименты на мышах были одобрены Институциональным комитетом по уходу за животными и их использованию Токийского университета (номер одобрения PA17-63) и Университетом Осаки (номер одобрения Biken-AP-H30-01) и выполнены в соответствии с их руководящими принципами, а также руководящими принципами ARRIVE (https://arriveguidelines.org).
1. Векторное построение таргетинга
- Амплифицируйте кассету KI (CreERT здесь, шаблон ДНК для ПЦР первоначально от коммерческой компании по синтезу генов) и приблизительный фрагмент 1 кб 5'- или 3'-гомологических рукавов с помощью ПЦР. Для клонирования ДНК (этап 1.3) добавьте 15-мерные перекрывающиеся последовательности на 5' конце каждого праймера ПЦР. Очищают фрагменты ДНК ПЦР электрофорезом агарозного геля с последующим извлечением фрагмента ДНК с помощью набора для очистки ДНК.
- Линеаризуйте основную плазмиду (например, pUC19 или pBS) с помощью соответствующего фермента (ферментов) рестрикции, который уникально переваривает где-то в мультиклонирующем участке для клонирования. Затем очистите переваренную плазмиду с помощью набора для очистки ДНК.
- Клонирование каждого фрагмента ПЦР (например, 5'-гомологического плеча, 3'-гомологического плеча) и последовательности KI одновременно в переваренную плазмиду с использованием набора для клонирования ДНК в соответствии с инструкциями производителя.
- Трансформируйте компетентные клетки с помощью построенной плазмиды (стадия 1.3) путем нагревания при 42 °C в течение 1 мин на водяной бане, затем посейте их на пластине LB, содержащей соответствующую концентрацию антибиотиков, таких как ампициллин или канамицин. Культивируйте их в течение ночи для устойчивого отбора клонов.
- Возьмите несколько (от четырех до восьми) отдельных колоний с помощью кончиков пипетки 200 мкл и перенесите наконечники в 3 мл жидкого LB, содержащего соответствующие антибиотики (100 мкг / мл ампициллина или 20 мкл / мл канамицина) и культивируйте на ночь при 37 ° C с встряхиванием.
- Очистите плазмиду на следующий день, используя коммерческий набор для очистки плазмид без эндотоксинов в соответствии с инструкциями производителя. Подтвердите клонированную последовательность в плазмиде с помощью секвенирования Сэнгера. Отрегулируйте концентрацию плазмиды при 1 мкг ДНК/мкл с помощью воды, не содержащей нуклеазы. Используйте плазмиду в качестве вектора нацеливания на гены.
2. Подготовка эмбрионального фибробласта мыши (MEF) в качестве питающих клеток для ESC
- Жертвоприношение 8-10-недельной беременной самки мышей ICR (14,5 дней после родов) при вывихе шейки матки. Хорошо протрите живот, используя 70% (v/v) этанол для стерилизации, разрезайте живот с помощью орбитальных ножниц и щипцов и восстановите матку, содержащую плод.
- Поместите матку в 100-миллиметровую посуду, содержащую 10 мл фосфатной бычьей сыворотки (PBS), содержащей 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина. Удалить плаценту и внеэмбрионарные ткани из плода с помощью орбитальных ножниц и щипцов. Измельчите плоды с помощью орбитальных ножниц и перенесите раствор PBS, содержащий измельченные клетки плода, в коническую трубку объемом 50 мл.
- Центрифугу при 280 х г в течение 5 мин при 4 °С и выбросьте супернатант путем аспирации. Добавьте 10 мл 0,25% (мас./об.) раствора трипсина-ЭДТА, хорошо перемешайте путем пипетки, а затем инкубируйте в течение 10 мин при 37 °C на водяной бане для переваривания трипсина.
- Добавьте 20 мл среды MEF (DMEM, содержащей 10% (v/v) фетальной бычьей сыворотки, 100 U/mL пенициллина и 100 мкг/мл стрептомицина), чтобы остановить ферментативную реакцию, хорошо перемешайте путем мягкой инверсии и центрифугируйте при 280 х г в течение 5 мин при 4 °C. Выбросьте супернатант путем аспирации, добавьте 10 мл среды MEF и хорошо перемешайте путем пипетки.
- Засейте клеточную суспензию в несколько новых блюд по 100 мм (приготовьте такое же количество блюд, как и количество плодов с 10 мл среды MEF для одного блюда 100 мм). Измените среду через 4-5 ч после посева, чтобы удалить неприкрепленные клетки и дать прикрепленному MEF расти. Прохождение клеток, когда они достигают ~80% слияния с использованием трипсина.
- Поместите культуральную посуду, содержащую размножающийся MEF, в среду MEF, примерно через 12-15 дней после посева, в рентгеновское облучающее устройство. Подвергайте MEF рентгеновскому излучению 50 Гр (всего), чтобы остановить клеточный цикл в соответствии с инструкцией производителя.
- Трипсинизируют облученный MEF, добавляя 2 мл 0,25% трипсина-ЭДТА на одну тарелку 100 мм в течение 5 мин при 37 °C, затем добавляют 4 мл среды MEF, чтобы остановить переваривание трипсина и собирают клеточную суспензию в новую трубку 50 мл.
- Промыть MEF свежей средой MEF центрифугированием при 280 х г в течение 5 мин при 4 °C, подсчитать количество клеток с помощью счетчика клеток с трипановым синим окрашиванием и заморозить их при 1,6 х 106 клеток/трубке в среде для замораживания клеток. Хранить до использования; клетки могут стабильно храниться в жидком азоте в течение нескольких лет.
3. Приготовление смеси Cas9-RNP-ДНК
- Растворяют тракрРНК и крисперРНК в буфере разбавления (каждая концентрация РНК при 200 мкМ) путем пипетирования. Смешайте раствор тракрРНК, раствор крисперРНК и буфер разбавления (объемное соотношение 2:2:5) путем мягкого постукивания и отжига каждой РНК с помощью термоциклера при 95 °C в течение 10 мин с последующим циклом 1 °C / мин до тех пор, пока температура не достигнет 4 °C.
ПРИМЕЧАНИЕ: Последовательность гРНК была разработана с использованием CRISPOR, http://crispor.tefor.net. - Инкубируют отожженные РНК, 10 мкг/мкл cas9 нуклеазы, и электропорационный буфер смешивают в объемном соотношении 5:3:2 при 37 °C в течение 20 мин с образованием комплекса Cas9-RNP. В рутинной работе смешивают и инкубируют 1,25 мкл отожженной РНК, 0,75 мкл нуклеазы Cas9 и 0,5 мкл электропорационного буфера для редактирования генома одного локуса.
- Смешайте следующие материалы в трубке объемом 1,5 мл: 10 мкл электропорационного буфера, 1 мкл комплекса Cas9-RNP (стадия 3,2) и 1 мкл кругового вектора нацеливания (1 мкг/мкл, этап 1,6). Общее количество смеси Cas9-RNP-ДНК составляет 12 мкл. Держите смесь Cas9-RNP-ДНК на льду до электропорации.
ПРИМЕЧАНИЕ: Чтобы предотвратить повторное расщепление гРНК после KI, спроектируйте гРНК в положении, когда последовательность распознавания гРНК разделяется интеграцией донора KI. Если гРНК не может быть спроектирована в таком месте, в плазмиду донора KI включается несколько нуклеотидных бесшумных мутаций, при которых аминокислотная последовательность не изменяется.
4. Генная таргетация ЭСК
- Для приготовления блюд для культивирования клеток, покрытых желатиновым покрытием, добавляют 0,1% (мас./об.) раствор желатина в 2 мл для чашки 60 мм, 500 мкл для 24-луночной пластины, 100 мкл для 96-луночной пластины и инкубируют в течение 2 ч во влажном инкубаторе. Удалите желатиновый раствор, дважды промойте с тем же количеством PBS и храните при комнатной температуре до использования.
- Разморозьте митотически инактивированный замороженный запас MEF (стадия 2.2) с использованием водяной бани 37 °C в течение 1 мин и поместите MEF на блюдо с желатиновым покрытием 60 мм (одна замороженная бульонная трубка MEF, содержащая 1,6 x 106 ячеек для двух блюд по 60 мм, стадия 2.2) за 1 день до посева ESC.
- Разморозьте замороженную трубку ESC (хранится при 2 x 105 ESC/трубке; подсчет клеток проводили с помощью счетчика клеток) с использованием водяной бани 37 °C в течение 1 мин и поместите 1 x 105 ESC на 60-миллиметровую чашку, содержащую предварительно засеянный MEF (этап 4.1).
- Культивирование в 4 мл питательной среды ESC (ESCM, модифицированная среда на основе DMEM с 15% (v/v) фетальной бычьей сывороткой, 2 мМ L-глутаминового субстрата, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина, 0,1 мМ 2-меркаптоэтанола, ингибирующего лейкемии фактора и t2i (0,2 мкМ PD0325901 и 3 мкМ CHIR99021), которая поддерживает плюрипотентность ESC11) при 37 °C с 5% CO2 до тех пор, пока ESC не достигнет 50-70% конфюлюзии.
ПРИМЕЧАНИЕ: Мы используем три различные линии ESC: JM8. A3 от B6N, V6.5 от B6-129 F1 и собственная разработка BALB/c ESC. Одни и те же протоколы KI в этой рукописи используются для всех линий ESC. - Культивирующий ЭСК промыть 4 мл ПБС, затем обработать 800 мкл 0,25% раствора трипсина-ЭДТА в течение 5 мин при 37 °C для пищеварения. Добавьте 1 мл ESCM для инактивации трипсина и диссоциации ESC к одиночным ячейкам путем пипетирования.
- Центрифугируйте ESC-содержащий раствор в течение 5 мин при 280 х г, выбросьте супернатант, повторно суспендируйте ЭСК в свежем 1 мл ESCM и подсчитайте количество клеток с помощью счетчика клеток с окрашиванием трипановым синим цветом. Переложите 1 x 105 ESC в новую трубку объемом 1,5 мл и промыть их три раза PBS центрифугированием при 500 x g, 4 °C.
- Повторно суспендировать гранулу ESC в 12 мкл смеси Cas9-RNP-ДНК (стадия 3.3) и хорошо перемешать путем мягкого пипетирования, чтобы избежать пузырьков. Подавайте повторно суспендированный ESC для электропорации. Электропорационная система использует один импульс при 1 400 В и 30 мс для трансдукции Cas9-RNP-ДНК (рисунок 1).
- Культивируйте электропорированные ЭСК в 60 мм чашке, содержащей 4 мл ESCM, с митотически инактивированным MEF (раздел 4.2). Меняйте среду каждый день.
- Промыть ЭСК 4 мл PBS через 3-5 дней после электропорации, затем обработать 800 мкл 0,25% трипсина-ЭДТА и культивировать при 37 °C в течение 5 мин во влажном инкубаторе для пищеварения. Добавьте 2 мл ESCM, чтобы остановить переваривание трипсина, и центрифугируйте клеточную смесь при 280 х г в течение 5 мин.
- Отбросьте супернатант, повторно суспендируйте ЭСК в 1 мл свежего ESCM и подсчитайте концентрацию клеток с помощью счетчика клеток с окрашиванием в синий цвет трипана. Проходите ESC со скоростью 1 x 103 ESC на 60 мм тарелку, содержащую ESCM и питатель MEF. Меняйте среду каждый день, пока колония не поднимется.
ПРИМЕЧАНИЕ: Причина, по которой ESC передается один раз перед подбором, заключается в том, что редактирование генома может продолжаться после деления ESC, поэтому первая колония не всегда является клоном во многих случаях. Таким образом, первое прохождение ESC перед сбором колонии является важным шагом для сбора одиночных клонов.
5. Генотипирование ПЦР целевых ЭСК
- Аспирировать ESCM из чашки для культивирования ESC через 5-7 дней после первого прохождения (этап 4.9) и добавить 4 мл PBS. Соберите одиночные колонии ESC с 5 мкл PBS с помощью пипетки 20 мкл под стереомикроскопом (увеличение от 30 до 40 раз). Поместите отдельные колонии в лунку круглодонной 96-луночной пластины, содержащей 15 мкл 0,25% раствора трипсина-ЭДТА.
- Держите плиту из 96 скважин на льду до тех пор, пока не будут собраны 48 отдельных колоний. Инкубируют 96-луночную пластину в течение 5 мин во влажном 5%CO2 инкубаторе с температурой 37 °C, затем добавляют 80 мкл ESCM, чтобы остановить переваривание трипсина и диссоциировать колонии ESC на отдельные клетки путем пипетирования.
ПРИМЕЧАНИЕ: Поскольку эффективность КИ этого метода обычно составляет 10%-50%, мы обычно берем 48 клонов и сначала выполняем генотипирование, используя 24 из них. Если на данный момент не удается получить несколько клонов KI, мы дополнительно проверяем KI, используя оставшиеся 24 клона. - Перенесите 40 мкл суспензии ЭКУ (стадия 5) на 96-луночную пластину без желатинового покрытия, содержащую 50 мкл ESCM на скважину для генотипирования ПЦР. Переложите оставшиеся 60 мкл суспензии ЭКУ в скважину в 24-луночной пластине с желатиновым покрытием, которая содержит 500 мкл ESCM и питателя MEF, чтобы получить замороженный запас ЭКУ.
- Запасайте отдельные клоны ЭКУ, культивируемые в 24-луночной пластине (этап 5.3), пока они не достигнут 60-80% сливаемости. Восстанавливайте отдельные клоны ESC путем трипсинизации, как упоминалось выше, собирайте клетки в новую трубку объемом 1,5 мл и центрифугу при 280 х г в течение 5 мин. Отбросьте супернатант, повторно суспендируйте клетки в 500 мкл среды замораживания клеток и заморозьте их с помощью морозильной камеры с температурой -80 °C.
- Для генотипирования ПЦР культивирование клонов ЭКУ в 96-луночной пластине без питателя (этап 5.3) до тех пор, пока ЭКУ не достигнет более 90% слива. Удалите ESCM из каждой лунки путем аспирации и дважды промыть 100 мкл PBS.
- Аспирировать PBS и добавить 100 мкл лизисного буфера, содержащего протеиназу K, хорошо перемешать и перенести лизат ESC в новую трубку объемом 1,5 мл. Нагревайте лизат ЭКУ при 65°С в течение не менее 1 ч с помощью тепловой камеры. Извлеките и очистите геномную ДНК с использованием обычного метода очистки ДНК фенол-хлороформ с последующим осаждением этанола.
- Растворите осажденную ДНК в 20 мкл воды, не содержащей ДНКазы, и определите чистоту и концентрацию ДНК с помощью спектрофотометра. Выполняйте геномную ПЦР с использованием локус-специфических наборов праймеров для амплификации целевой области. Затем проверьте последовательность и выберите клоны ESC с желаемыми последовательностями KI.
6. Подготовка эмбриона восьмиклеточной стадии и микроинъекция ЭСК
- Ввести 5 МЕ беременной кобыльей сывороточного гонадотропина (ПМСГ) внутрибрюшинно взрослым женщинам МЦР. Через 48 ч вводят 5 МЕ хорионического гонадотропина человека (ХГЧ) тем же самкам, а затем спаривают женщин, получавших гормоны, с самцами МЦР. Проверьте копуляторную пробку во влагалище на следующий день (эмбриональный день 0,5, ЭД0,5).
ПРИМЕЧАНИЕ: Для оценки химеризма по соотношениям цветов шерсти используйте бластоцисту из штамма ICR в качестве реципиента для ЭКУ, который имеет черный или агути цвет шерсти, или бластоцисту из штамма C57BL/6 в качестве реципиента для ЭКУ, которая имеет фон альбиноса. - Соберите яйцевод при ED1,5 и поместите его в капли буферной среды HEPES (FHM). Восстановите двухклеточные или четырехклеточные эмбрионы стадии, промыв яйцевод FHM с помощью промывочной иглы, вставленной в инфундибулу.
- Вымойте собранные эмбрионы, переместив их в несколько свежих капель FHM с помощью пипетки для рта. Культивируйте эмбрионы в 50 мкл KSOM каплей на 35 мм чашку для культивирования клеток, покрытую минеральным маслом при 37 °C, 5% CO2 инкубатора в течение 1 дня до достижения стадии восьмиклеточной или морулы (ED2,5).
- Если эмбрионы не используются на следующий день сбора, заморозьте их путем витрификации в соответствии с протоколом CARD (http://card.medic.kumamoto-u.ac.jp/card/english/sigen/manual/ebvitri.html) и храните их в жидком азоте до использования.
- Подготовьте стеклянные пипетки для удержания эмбрионов (наружный диаметр 80-100 мкм) и инъекции ESC (диаметр около 13 мкм) с помощью съемника и микроклепки.
- Интегрируйте удерживающую пипетку, содержащую FHM, в капиллярный держатель, подключенный к микроинжектору и установленный с левой стороны микроманипулятора. Подключите инъекционную пипетку к другому микроинжектору и установите ее с правой стороны. Выровняйте две пипетки прямо в поле зрения микроскопа.
- Дозировать 5 мкл капель 12% (мас./об.) поливинилпирролидона (PVP) в среде FHM и 5 мкл капель FHM на ту же крышку 60-миллиметровой посуды бок о бок и накрыть капли минеральным маслом. Перенесите эмбрионы в капле FHM 5 мкл и добавьте 1-5 мкл суспензии ESC к капле FHM, содержащей эмбрионы.
ПРИМЕЧАНИЕ: Оставьте суспензию ESC и MEF в течение 30 мин в 4 мл ESM на 60-миллиметровой чашке для культивирования перед приготовлением капли. Поскольку MEF прилипают ко дну быстрее, чем ESC, эта 30-минутная инкубация позволяет концентрацию неприсоединенных ES-клеток в супернатанте. - Промыть внутри инъекционную пипетку с ПВП, затем перейти к капле, содержащей эмбрионы и ЭСК.
- Возьмите три отдельных дублета ECS, которые только что закончили свое деление клеток (шесть клеток) в инъекционной пипетке. Удерживайте восьмиклеточный или эмбрион стадии морулы, который завершил уплотнение, держа пипеткой путем аспирации. Сделайте отверстие в пеллюцидной зоне пьезоэлектрическим импульсом (интенсивность: 3; скорость: 3). Вытолкните шестиклеточный ESC внутрь зоны пеллюцида и вытащите пипетку из эмбрионов.
- Промыть эмбрионы, введенные ESC, несколькими каплями KSOM осторожно с помощью пипетки для рта и инкубировать их в новой капле KSOM объемом 50 мкл, покрытой минеральным маслом при 37 °C, 5% CO2 , пока эмбрионы не разовьются до стадии бластоцисты.
- Переведите 10 введенных ESC бластоцист в каждый маточный рог псевдобеременных самок мышей (2,5 дня после полового созревания, 20 бластоцист на голову).
- После того, как суррогатная мать родила, выберите по крайней мере двух мужских химер с самым высоким коэффициентом химеризма (70% или выше, что подтверждается цветом шерсти), а затем спаривайте их с соответствующим штаммом самок для получения гетерозиготного КИ F1.
- Разводите отдельных мышей KI с соответствующими партнерами, чтобы получить мышей с желательным генотипом (генотипами) или генетическим фоном, подходящим для исследований.
Результаты
Мы нацелились на конкретный ген (ы) в ESC с последующим производством химер для развития генно-манипулируемого производства мышей в соответствии с нашей предыдущей рукописью11. Генотипирование ЭКУ (описанное в разделе 4) обычно проводится методом ПЦР с использованием праймеров. Праймеры разработаны на геномных последовательностях вне гомологических рукавов и специфических последовательностях в фрагменте ДНК KI (рисунок 2A). В этом случае аллель дикого типа не амплифицируется, тогда как ампликон ПЦР определенного размера обнаруживается только тогда, когда целевая экзогенная ДНК находится в ki в целевом локусе. Репрезентативные результаты генотипирования ПЦР показаны на рисунке 2B. Девять из 22 клонов (40,9%) показали в этом случае специфичную для KI полосу. Три репрезентативных результата таргетинга, включая результат, показанный на рисунке 2, показаны в таблице 1. Эти результаты показывают, что метод, показанный здесь, эффективен и воспроизводим для гена KI без какого-либо выбора лекарств.
ESC подбирается в инъекционной пипетке, затем отверстие в пеллюцидной зоне делается с помощью пьезоэлектрического плюса, и ESC высвобождается между эмбриональными клетками (рисунок 3). Технически этот протокол для введения ЭКУ в эмбрион стадии восьми клеток или морулы аналогичен протоколу инъекции ЭКУ в бластоцисту, обычно используемому во многих мышечных установках. Репрезентативные химерные мыши показаны на рисунке 4. Для оценки цвета шерсти химеризма эмбрион из штамма ICR (альбинос, белые волосы) использовался в качестве реципиента B6 или B6-129 F1 ESC, а эмбрионы B6 использовались в качестве реципиента BALB/c ESC (рисунок 4).
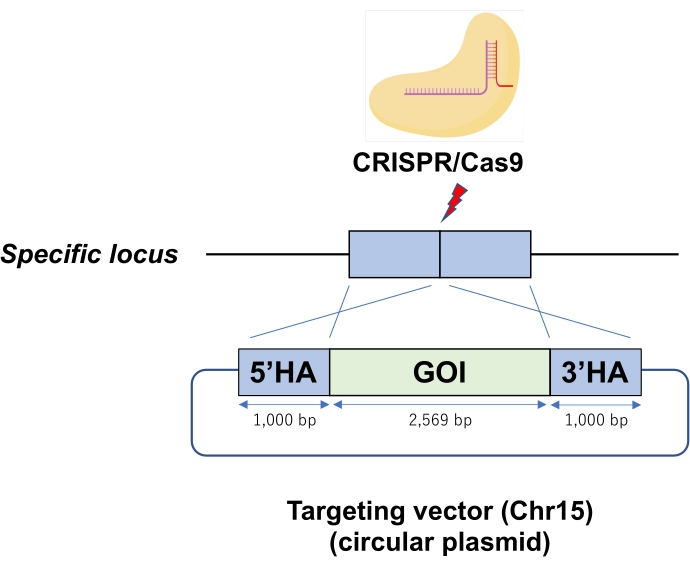
Рисунок 1: Схема RPGR/Cas9 рибонуклеопротеина (RNP)-опосредованной круговой плазмидной интеграции в специфический локус генома ESC. Электропорация вводит круговую плазмиду в качестве вектора-мишени в ЭСК с Cas9-RNP. Сокращения: GOI = ген интереса, HA = гомологическая рука. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
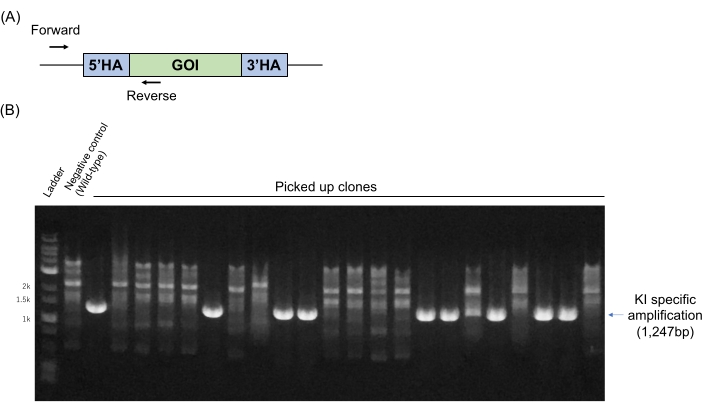
Рисунок 2: Геномные ПЦР-анализы для скрининга KI целевых клонов ESC. (A) КИ-специфические ПЦР-праймеры предназначены для геномных последовательностей вне гомологических рукавов (вперед) и в специфических последовательностях в фрагменте ДНК KI (реверс). (B) Репрезентативное генотипирование результатов ПЦР. Геном дикого типа использовался в качестве отрицательного контроля. Сокращения: GOI = ген интереса, HA = гомологическая рука. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
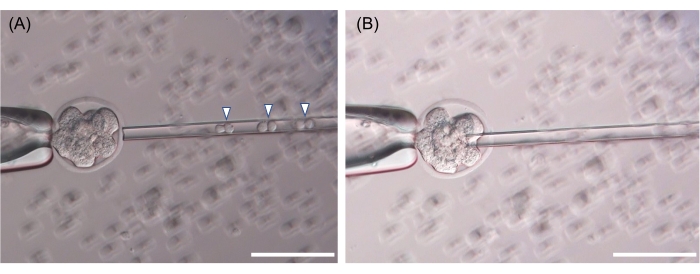
Рисунок 3: Репрезентативные изображения инъекции эмбриона на восьмиклеточной стадии. (А) Для микроинъекции подбираются три дублета ЭСК (шесть клеток, наконечники стрел). (B) Отверстие в пеллюцидной зоне делается пьезоэлектрическим импульсом, и ЭСК вытесняются между каждым бластомером. Показанная шкала составляет 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Репрезентативные изображения мышей-химер. (A,B) ESC, полученный из C57BL/6N (JM8. A3, волосы Агути; A) или B6-129 F1 (волосы Агути; Б) вводятся в эмбрионы ICR (альбиносы, белые волосы) с последующим переносом эмбрионов матерям-суррогатам. (C) ЭКУ, полученная из BALB/c (альбинос, белые волосы), вводится эмбрионам C57BL/6J (черные волосы) с последующим переносом эмбрионов матерям-суррогатам. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Идентификатор проекта | Хоромосома | Длина 5'HA (bp) | Длина 3'HA (bp) | Размер вкладыша (bp) | Количество проанализированных клонов | Количество клонов KI | КПД (%) | Замечания |
| R26-CC* | Хр6 | 965 | 1006 | 5321 | 23 | 2 | 8.7% | - |
| Р4-03* | Хр8 | 1000 | 997 | 3070 | 22 | 6 | 27.3% | - |
| П4-01* | Хр15 | 1000 | 1000 | 2569 | 22 | 9 | 40.9% | Показано на рисунке 2 |
Таблица 1: Эффективность КИ в трех независимых геномных локусах в ЭКУ. *Эти проекты до сих пор не опубликованы. Название этих генов будет раскрыто в независимых рукописях в будущем.
Обсуждение
Генное нацеливание на ЭСК с последующим производством химер традиционно используется для разработки мышей, манипулируемых генами. Тем не менее, эффективность выбивания генов остается низкой, даже несмотря на то, что целевой вектор содержит длинные (> несколько кб в обычном режиме) гомологические рукава с положительными или отрицательными кассетами генов выбора лекарств. Наш протокол представил настроенный метод ESC KI длинной экзогенной ДНК с использованием круговой плазмиды без каких-либо кассет выбора лекарств в качестве вектора-мишени, сопровождаемого Cas9-RNP-опосредованным редактированием генома с приемлемой эффективностью для рутинных работ. Таким образом, этот протокол может помочь существенно сократить время, затрачиваемое на производство генетически модифицированных химерных мышей, по сравнению с обычным нацеливанием ЭКУ.
В этом протоколе мы использовали CRISPR/Cas9-RNP для индуцирования сайт-специфических двухцепочечных разрывов в геноме, а в качестве вектора нацеливания вместо линеаризованного вектора использовалась круговая плазмида. Линеаризованные плазмиды традиционно используются в качестве целевого вектора для гена KI из-за их повышенной эффективности геномной интеграции 8,9,10. Однако многие геномные интеграции неспецифичны, хотя вектор содержит гомологичные плечи9. С другой стороны, круговые плазмиды редко используются в качестве векторов-мишеней из-за их трудно интегрируемой особенности в геном ESCs12 или фибробластов13. Таким образом, возможно, что применение круговой плазмиды в качестве целевого вектора, сопровождаемого редактированием генома, опосредованным CRISPR/Cas9, сводит к минимуму неспецифическую случайную интеграцию, но максимизирует сайт-специфическую интеграцию в геном ESC. Было бы примечательно, что эффективность индукции двухцепочечного разрыва CRISPR/Cas9 довольно важна14, поэтому было бы важно использовать гРНК, которая индуцирует двухцепочечный разрыв с высокой эффективностью. Следует рассмотреть возможность перепроектирования гРНК, когда эффективность КИ слишком низкая. В случае, показанном на рисунке 2, 40,9% клонов ESC показали полосу, специфичную для KI. Фактически, как основная лаборатория института, мы регулярно выполняем нацеливание на гены с использованием ESC методом, описанным здесь, и достигли эффективности KI 10%-50% для последовательностей размером 1-2 кб, таких как Cre, CreERT или флуоресцентные репортеры, хотя есть некоторые вариации в зависимости от локуса гена. Самые длинные последовательности ДНК, которые мы успешно имеем с использованием этого метода, составляют около 11,2 кб в локус Rosa26, а эффективность составила 12,2% (пять колоний KI из 41 проанализированной колонии).
Следует также отметить, что в этом протоколе в качестве реципиентов для микроинъекции ЭКУ используются эмбрионы с восемью клетками или эмбрионами стадии морулы, но не эмбрионы стадии бластоцисты. Хотя мы не проводили сравнительных экспериментов в этой статье, несколько отчетов показали, что инъекция ЭСК в эмбрионы восьмиклеточной или стадии морулы значительно повышает эффективность вклада ЭКУ в химерное потомство по сравнению с инъекцией ЭКУ в бластоцисты 15,16,17,18 . Действительно, инъекции ЭКУ различных линий ЭКУ, включая C57BL/6, B6-129 F1 и BALB/c, обычно приводили к развитию химер цвета высокой шерсти у некоторых, но не у всех потомков (см. рисунок 4). Ограничение метода заключается в том, что ЭСК, вводимые в предимплантационный эмбрион, не всегда могли способствовать половым клеткам в химере19,20. Передача ESC по зародышевой линии будет зависеть от качества каждого клона ESC19. Поэтому было бы выгодно разработать несколько линий клонирования ESC в качестве резервной копии для стабильного производства химерных мышей. В заключение, протоколы, представленные здесь, используют простые векторы таргетинга, которые включают только каждую гомологическую руку и ген, представляющий интерес для KI, без какой-либо лекарственно-устойчивой кассеты. Таким образом, векторное построение было бы намного проще, а период культивирования можно было бы сократить по сравнению с обычным методом наведения ЭКУ. Это помогло бы быстро и легко производить различные типы генетически модифицированных мышей для будущего анализа в области наук о жизни.
Раскрытие информации
У авторов нет конкурирующих интересов для раскрытия.
Благодарности
Мы благодарим Саки Нисиоку из Университета Осаки, Биотехнологические исследования и разработки (некоммерческая организация) и Мио Кикути и Рейко Сакамото из Института медицинских наук Токийского университета за их отличную техническую помощь. Эта работа была поддержана: Министерством образования, культуры, спорта, науки и техники (MEXT)/Японским обществом содействия развитию науки (JSPS) KAKENHI грантами MI (JP19H05750, JP21H05033) и MO (20H03162); грант Японского агентства по науке и технике (JST), предоставленный MI (JPMJCR21N1); Национальный институт детского здоровья и развития человека имени Юнис Кеннеди Шрайвер в ИМ (R01HD088412); Фонд Билла и Мелинды Гейтс для MI (грант Grand Challenges Explorations INV-001902); и грант на совместный исследовательский проект Научно-исследовательского института микробных заболеваний Университета Осаки для МИ и МО.
Материалы
| Name | Company | Catalog Number | Comments |
| BALB/c ESC | - | - | ESC developed from BALB/c strain |
| Bambanker | Nippon Genetics | CS-02-001 | Cell-freezeing medium. Section 2.6 and elsewhere |
| Cas9 Nuclease V3 | IDT | 1081059 | Section 3.2 and elsewhere. |
| CHIR99021 | FUJIFILM Wako | 038-23101 | Section 4.3 |
| CreERT gene fragment | GeneWiz | Section 1.1. | |
| CRISPR-Cas9 crisprRNA | IDT | crisprRNA. Section 3.1 and elsewhere. | |
| CRISPR-Cas9 tracrRNA | IDT | 1072534 | tracrRNA. Section 3.1 and elsewhere. |
| DMEM | Nacalai | 08458-45 | MEF medium. Section 2.3 and elsewhere |
| Duplex buffer | IDT | 1072534 | RNA dilution buffer. Section 3.1 and elsewhere. |
| FastGene Gel/PCR Extraction Kit | Nippon Genetics | FG-91302 | Section 1.1 and 1.2. |
| GlutaMax | Thermo Fisher | 35-050-061 | L-glutatime substrate |
| hCG | ASKA Animal Health | Section 6.1. | |
| In-Fusion HD Cloning Kit | Clontech | 639648 | DNA cloning kit. Section 1.3 and elsewhere |
| JM8.A3 ESC | EuMMCR | - | ESC developed from C57BL/6N strain |
| Knock-out DMEM | Thermo Fisher | 10829018 | Section 4.3 and elsewhere, DMEM-based modified commercial medium. |
| KSOM | Merck | MR-121-D | Section 6.3 and 6.9. |
| Leukemia inhibitory factor | FUJIFILM Wako | 125-05603 | Section 4.3. No unit concentration data is supplied by the provider. Used 1,000-fold dilution in this protocol. |
| Neon Electroporation system | Thermo Fisher | MPK5000 | Section 3.2, 4.5 and elsewhere. The system containes electroporation buffer as well used in section 3.2. |
| NucleoSpin Plasmid Transfection-grade | Takara | U0490B | Section 1.6. |
| PD0325901 | FUJIFILM Wako | 162-25291 | Section 4.3 |
| PMSG | ASKA Animal Health | Section 6.1. | |
| Tail lysis buffer | Nacalai | 06169-95 | Section 5.5. |
| Trypsin-EDTA | Nacalai | 32777-15 | Section 2.2 and elsewhere |
| V6.5 ESC | - | - | ESC developed from B6J-129 F1 strain |
| X-ray irradiation device | Hitachi | MBR-1618R-BE | Section 2.6. |
Ссылки
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Oji, A., et al. CRISPR/Cas9 mediated genome editing in ES cells and its application for chimeric analysis in mice. Scientific Reports. 6, 31666(2016).
- Kaneko, T., Mashimo, T. Simple genome editing of rodent intact embryos by electroporation. PLoS One. 10 (11), 0142755(2015).
- Chen, F., et al. High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nature Methods. 8 (9), 753-755 (2011).
- Hashimoto, M., Yamashita, Y., Takemoto, T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Developmental Biology. 418 (1), 1-9 (2016).
- Mansour, S. L., Thomas, K. R., Capecchi, M. R. Disruption of the proto-oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes. Nature. 336 (6197), 348-352 (1988).
- Johnson, R. S., et al. Targeting of nonexpressed genes in embryonic stem cells via homologous recombination. Science. 245 (4923), 1234-1236 (1989).
- Hasty, P., Ramires-Solis, R., Krumlauf, R., Bradley, A. Introduction of a subtle mutation into the Hox-2.6 locus in embryonic stem cells. Nature. 350 (6315), 243-246 (1991).
- Ozawa, M., Emori, C., Ikawa, M. Gene targeting in mouse embryonic stem cells via CRISPR/Cas9 ribonucleoprotein (RNP) mediated genome editing. Genome Editing in Animals - Methods and Protocols 2nd edition. Hatada, I. , (2022).
- Yagi, M., et al. Derivation of ground-state female ES cells maintaining gamete-derived DNA methylation. Nature. 548 (7666), 224-227 (2017).
- Gassmann, M., Donoho, G., Berg, P. Maintenance of an extrachromosomal plasmid vector in mouse embryonic stem cells. Proceedings of National Academy of Sciences. 92 (5), 1292-1296 (1995).
- Okita, K., Nakagawa, M., Hyenjong, H., Ichisaka, T., Yamanaka, S. Generation of mouse induced pluripotent stem cells without viral vectors. Science. 322 (5903), 949-953 (2008).
- Poueymirou, W. T., et al. F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses. Nature Biotechnology. 25 (1), 91-99 (2007).
- Hu, M., et al. Efficient production of chimeric mice from embryonic stem cells injected into 4- to 8-cell and blastocyst embryos. Journal of Animal Science and Biotechnology. 4 (1), 1-7 (2013).
- Guo, J., et al. Contribution of Mouse Embryonic Stem Cells and Induced Pluripotent Stem Cells to Chimeras through Injection and Coculture of Embryos. Stem Cells International. 2014, 409021(2014).
- Bodai, Z., Bishop, A. L., Gantz, V. M., Komor, A. C. Targeting double-strand break indel byproducts with secondary guide RNAs improves Cas9 HDR-mediated genome editing efficiencies. Nature Communications. 13 (1), 2351(2022).
- Kobayashi, T., Goto, T., Oikawa, M., Sanbo, M., Yoshida, F., Terada, R., Niizeki, N., Kajitani, N., Kazuki, K., Kazuki, Y., Hochi, S., Nakauchi, H., Surani, A., Hirabayashi, M. Blastocyst complementation using Prdm14-deficient rats enables efficient germline transmission and generation of functional mouse spermatids in rats. Nature Communications. 12 (1), 1328(2021).
- Miura, K., Matoba, S., Hirose, M., Ogura, A. Generation of chimeric mice with spermatozoa fully derived from embryonic stem cells using a triple-target CRISPR method for Nanos3. Biology of Reproduction. 104 (1), 223-233 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены