Method Article
유전자 조작 마우스 모델 개발을 위한 배아 줄기 세포에서 CRISPR/Cas9 매개 고효율 유전자 표적화
요약
여기에서는 배아 줄기 세포를 사용하여 유전자 변형 마우스 모델, 특히 대형 DNA 녹인 (KI)을 개발하기위한 프로토콜을 제시합니다. 이 프로토콜은 CRISPR/Cas9 게놈 편집을 사용하여 조정되어 기존의 상동 재조합 매개 선형화된 DNA 표적화 방법에 비해 KI 효율이 크게 향상되었습니다.
초록
CRISPR/Cas9 시스템은 수정된 접합체를 사용한 직접 게놈 편집을 통해 유전자 변형 마우스를 개발하는 것을 가능하게 했습니다. 그러나, 작은 indel 돌연변이를 유도하여 유전자 녹아웃 마우스를 개발하는 효율은 충분할 것이지만, 대형 DNA 녹인 (KI)을 만들기위한 배아 게놈 편집의 효율은 여전히 낮다. 따라서, 배아에서의 직접 KI 방법과는 대조적으로, 배아 줄기 세포 (ESCs)를 이용한 유전자 표적화에 이어 키메라 마우스를 개발하기 위한 배아 주입은 여전히 몇 가지 이점을 갖는다 (예를 들어, 시험 관 내 고처리량 표적화, 다중 대립유전자 조작, 및 Cre 및 플록스 유전자 조작은 단기간에 수행될 수 있다). 또한 BALB/c와 같이 시험관 내에서 다루기 어려운 배아가 있는 균주도 ESC 표적화에 사용할 수 있습니다. 이 프로토콜은 CRISPR/Cas9 매개 게놈 편집을 적용한 후 키메라 마우스 생산을 적용하여 유전자 조작 마우스 모델을 개발함으로써 ESC에서 대형 DNA(수 kb) KI에 최적화된 방법을 설명합니다.
서문
유전자 변형 마우스를 생산하고 표현형을 분석하면 생체 내에서 특정 유전자 기능을 자세히 이해할 수 있습니다. 생명 과학 분야에서 유전자 변형 동물 모델을 사용하여 수많은 중요한 발견이 밝혀졌습니다. 더욱이, CRISPR/Cas91을 이용한 게놈 편집 기술에 대한 보고가 있은 이후, 유전자 변형 마우스를 이용한 연구는 많은 실험실로 빠르게 확산되었다2,3. CRISPR/Cas9에 의한 마우스 접합체의 게놈 편집은 인델 돌연변이 지향 유전자 녹아웃4, 단일 뉴클레오티드 교체 또는 단일 가닥 올리고뉴클레오티드(ssODN)를 녹인(KI) 기증자5로 사용하는 짧은 펩타이드 태그 삽입과 같은 짧은 DNA 변형을 개발하는 데 허용 가능한 효율성을 달성했습니다. 반면에, 게놈 편집에 의해 접합체로의 큰 DNA 단편의 KI는 짧은 크기의 DNA 변형 6,7에 비해 낮은 효율을 유지한다. 또한 면역학과 같은 특정 연구 분야에서 중요한 균주인 BALB/c와 같은 마우스 균주를 접합체 기반 게놈 편집에 사용하는 것은 착상 전 배아가 체외 조작에 취약하기 때문입니다.
유전자 변형 마우스 모델을 개발하는 또 다른 방법은 배아 줄기 세포 (ESC) 표적화 기술을 사용한 다음 착상 전 배아에 ESC를 주입하여 여전히 기존의 방법으로 일상적으로 사용되는 키메라 8,9,10을 생산하는 것입니다. 정확한 KI-ESC 클론을 얻기 위한 획득률은 종래의 ESC 표적화 방법에서 그리 높지 않지만, ESC 표적화는 접합체 게놈 편집에 비해, 특히 긴 DNA KI에 비해 몇 가지 이점을 제공한다. 예를 들어, 접합체 게놈으로의 긴 DNA 단편 (> 수 kb)의 KI 효율은덜 분명하며, KI 마우스의 한 줄이라도 개발하기 위해 많은 접합체가 필요하며, 이는 동물 실험의 현재 관점에서 바람직하지 않습니다. 접합체 게놈 편집과 달리 ESC에 대한 긴 DNA 표적화 후 키메라 생산은 접합체 게놈 편집보다 훨씬 적은 수의 배아를 필요로 합니다. 또한, BALB/c로부터의 착상 전 배아가 시험관 내 조작에 취약하더라도, 그들의 ESC는 다른 유능한 129 또는 F1 배경 ESC로서 시험관내(11)에서 유지 및 취급될 수 있으므로, 키메라 생산에 적용할 수 있다. 그러나, 표적 벡터가 양성 또는 음성 선택을 위한 5' 및 3' 상동 암 및 약제 내성 유전자 카세트를 포함하더라도, 종래의 ESC의 KI 효율은 일반적으로 불충분하며, 무작위 게놈 통합의 빈도가 높기 때문에 8,10, 이에 따라 정밀한 ESC 표적화 효율을 갖는 개선된 방법이 요구된다. 최근에, 우리는 기존의 표적화 방법11보다 더 높은 KI 효율을 달성하기 위해 CRISPR / Cas9 기반 게놈 편집을 사용하는 조정 된 ESC KI 방법을보고했다. 여기서 설명하는 방법은 약물 선택없이 일상적인 작업에 허용 가능한 효율성으로 긴 DNA (>에서 10kb까지) KI를 ESC로 가능하게하는이 절차를 기반으로합니다. 따라서, 벡터 구성 절차는 훨씬 더 쉽고 더 짧은 기간이 필요하거나 세포 배양 기간도 상당히 짧아질 것이다.
프로토콜
모든 마우스 실험은 도쿄 대학 기관 동물 관리 및 이용위원회 (승인 번호 PA17-63)와 오사카 대학 (승인 번호 Biken-AP-H30-01)의 승인을 받았으며 REACH 지침 (https://arriveguidelines.org)뿐만 아니라 지침에 따라 수행되었습니다.
1. 타겟팅 벡터 구성
- KI 카세트(여기서 CreERT, PCR을 위한 주형 DNA는 원래 상용 유전자 합성 회사에서 제공됨) 및 5'- 또는 3'-상동성 암의 대략 1kb 단편을 PCR로 증폭한다. DNA 클로닝(단계 1.3)의 경우, 각 PCR 프라이머의 5' 말단에 15-mer 중첩 서열을 추가한다. PCR DNA 단편을 아가로스 겔 전기영동으로 정제한 다음, DNA 정제 키트를 이용하여 DNA 단편을 추출하였다.
- 클로닝을 위해 다중 클로닝 부위의 어딘가에서 고유하게 소화되는 적절한 제한 효소(들)를 사용하여 백본 플라스미드(예: pUC19 또는 pBS)를 선형화합니다. 이어서, DNA 정제 키트를 사용하여 소화된 플라스미드를 정제한다.
- 각각의 PCR 단편 (예를 들어, 5'-상동성 암, 3'-상동성 암) 및 KI 서열을 제조자의 지시에 따라 DNA 클로닝 키트를 사용하여 소화된 플라스미드 내로 동시에 클로닝한다.
- 수조에서 42°C에서 1분 동안 가열하여 구축된 플라스미드(단계 1.3)를 사용하여 적격 세포를 형질전환한 다음, 암피실린 또는 카나마이신과 같은 적절한 농도의 항생제를 함유하는 LB 플레이트에 시드합니다. 저항성 클론 선택을 위해 밤새 배양하십시오.
- 200 μL 피펫 팁을 사용하여 여러 개의(4-8개) 개별 콜로니를 집어 들고 팁을 적절한 항생제(100μg/mL 암피실린 또는 20μL/mL 카나마이신)가 포함된 3mL의 액체 LB에 옮기고 흔들면서 37°C에서 밤새 배양합니다.
- 다음 날 제조사의 지시에 따라 내독소가 없는 등급의 상용 플라스미드 정제 키트를 사용하여 플라스미드를 정제한다. Sanger 염기서열분석으로 플라스미드에서 클로닝된 서열을 확인하였다. 뉴클레아제가 없는 물을 사용하여 플라스미드 농도를 1μg DNA/μL로 조정합니다. 플라스미드를 유전자 표적화 벡터로 사용합니다.
2. ESC용 영양세포로서의 마우스 배아 섬유아세포(MEF)의 제조
- 8-10주령의 임신한 ICR 암컷 마우스(출산 후 14.5일)를 자궁경부 탈구로 희생시켰다. 살균을 위해 70 % (v / v) 에탄올을 사용하여 복부를 잘 닦고 안와 가위와 집게로 복부를 자르고 태아 함유 자궁을 회복하십시오.
- 100 U/mL 페니실린과 100 μg/mL 스트렙토마이신을 함유한 10 mL의 인산 소 혈청(PBS)이 들어 있는 100mm 접시에 자궁을 넣습니다. 궤도 가위와 집게를 사용하여 태아에서 태반과 배아 외 조직을 제거하십시오. 궤도 가위를 사용하여 태아를 다지고 다진 태아 세포가 들어있는 PBS 용액을 50mL 원추형 튜브에 옮깁니다.
- 4°C에서 5분 동안 280 x g 에서 원심분리하고, 흡인하여 상청액을 버린다. 0.25%(w/v) 트립신-EDTA 용액 10mL를 넣고 피펫팅으로 잘 혼합한 다음 트립신 소화를 위해 수조를 사용하여 37°C에서 10분 동안 배양합니다.
- 20mL의 MEF 배지(10%(v/v) 태아 소 혈청, 100U/mL 페니실린 및 100μg/mL 스트렙토마이신을 포함하는 DMEM)를 추가하여 효소 반응을 중지하고 부드러운 반전으로 잘 혼합하고 280 x g 에서 4°C에서 5분 동안 원심분리합니다. 흡인으로 상청액을 버리고 MEF 배지 10mL를 추가하고 피펫팅으로 잘 혼합합니다.
- 몇 가지 새로운 100mm 접시에 세포 현탁액을 씨를 뿌립니다(100mm 접시 하나에 대해 10mL의 MEF 배지로 태아 수와 동일한 수의 접시를 준비). 시드 후 배지를 4-5시간으로 변경하여 연결되지 않은 셀을 제거하고 연결된 MEF가 증가하도록 합니다. 트립신을 사용하여 ~ 80 % 컨플루언시에 도달하면 세포를 계대합니다.
- 증식하는 MEF를 함유하는 배양 접시를 파종 후 대략 12-15일 후에 MEF 배지에 X선 조사 장치에 둔다. MEF를 50Gy X선(총계)으로 노출시켜 제조업체의 지시에 따라 세포 주기를 중지합니다.
- 37°C에서 5분 동안 100mm 접시 하나에 0.25% 트립신-EDTA 2mL를 추가하여 조사된 MEF를 트립신화한 다음, MEF 배지 4mL를 추가하여 트립신 소화를 중지하고 새로운 50mL 튜브에 세포 현탁액을 수집합니다.
- MEF를 4°C에서 5분 동안 280 x g 에서 원심분리하여 새로운 MEF 배지로 세척하고, 트리판 블루 염색이 있는 셀 카운터를 사용하여 세포 수를 계산하고, 세포 동결 배지에서 1.6 x 106 세포/튜브로 동결합니다. 사용할 때까지 보관하십시오. 세포는 수년 동안 액체 질소에 안정적으로 저장 될 수 있습니다.
3. Cas9-RNP-DNA 혼합물 제제
- tracrRNA와 crisprRNA를 피펫팅으로 희석 완충액(각 RNA 농도 200μM)에 녹입니다. tracrRNA 용액, crisprRNA 용액 및 희석 완충액(2:2:5의 부피비)을 95°C에서 열 순환기를 사용하여 10분 동안 가볍게 두드리고 어닐링하여 혼합한 다음 온도가 4°C에 도달할 때까지 1°C/min 스텝다운 사이클을 수행합니다.
참고: gRNA 서열은 http://crispor.tefor.net CRISPOR를 사용하여 설계하였다. - 어닐링된 RNA, 10μg/μL Cas9 뉴클레아제 및 전기천공 완충액을 37°C에서 5:3:2의 부피비로 혼합하여 Cas9-RNP 복합체를 형성한다. 일상적인 작업에서, 하나의 유전자좌 게놈 편집을 위해 1.25μL의 어닐링된 RNA, 0.75μL의 Cas9 뉴클레아제, 0.5μL의 전기천공 완충액을 혼합하고 배양한다.
- 1.5mL 튜브에 다음 물질을 혼합합니다: 전기천공 완충액 10μL, Cas9-RNP 복합체 1μL(단계 3.2) 및 원형 표적 벡터 1μL(1μg/μL, 단계 1.6). Cas9-RNP-DNA 혼합물의 총량은 12 μL입니다. 전기천공이 될 때까지 Cas9-RNP-DNA 혼합물을 얼음 위에 보관하십시오.
참고: KI 후 gRNA의 재절단을 방지하려면 KI 공여체의 통합에 의해 gRNA 인식 서열이 분할되는 위치에 gRNA를 설계합니다. gRNA가 그러한 위치에서 설계 될 수없는 경우, 아미노산 서열이 변하지 않는 여러 뉴클레오티드 침묵 돌연변이가 KI 공여체의 플라스미드에 포함된다.
4. ESC의 유전자 표적화
- 젤라틴 코팅 세포 배양 접시를 준비하려면 60mm 접시의 경우 2mL, 24웰 플레이트의 경우 500μL, 96웰 플레이트의 경우 100μL에 0.1%(w/v) 젤라틴 용액을 추가하고 습한 인큐베이터에서 2시간 동안 배양합니다. 젤라틴 용액을 제거하고 같은 양의 PBS로 두 번 씻은 다음 사용할 때까지 실온에서 보관하십시오.
- ESC 파종 1일 전에 37°C 수조를 사용하여 유사분열적으로 불활성화된 동결 MEF 스톡을 해동(단계 2.2), MEF를 젤라틴 코팅된 60 mm 디쉬 (1.6 x 106 세포 2개의 60 mm 디쉬, 단계 2.2를 함유하는 MEF의 냉동 스톡 튜브 1개) 상에 놓았다.
- 37°C 수조를 사용하여 냉동 ESC 스톡 튜브(2 x 10 5 ESC/튜브에 보관, 세포 계수기는 세포 계수기를 사용하여 수행됨)를 1분 동안 해동하고 미리 파종된 MEF가 포함된 60mm 접시에 1 x 105 ESC를 놓습니다(단계 4.1).
- 4mL ESC 배양 배지(ESCM, 15%(v/v) 태아 소 혈청, 2mM L-글루타민 기질, 100U/mL 페니실린, 100μg/mL 스트렙토마이신, 0.1mM 2-메르캅토에탄올, 백혈병 억제 인자 및 ESC11의 다능성을 유지하는 t2i(0.2μM PD0325901 및 3μM CHIR99021)가 있는 DMEM 기반 변형 배지)에서 ESC가 50% 내지 70% 컨플루언시에 도달할 때까지 5%CO2 로 37°C에서 배양합니다.
참고: 우리는 세 가지 ESC 라인을 사용합니다: JM8. B6N의 A3, B6-129 F1의 V6.5 및 자체 개발 BALB / c ESC. 이 원고의 동일한 KI 프로토콜이 모든 ESC 라인에 사용됩니다. - 배양 ESC를 4mL의 PBS로 세척한 다음 소화를 위해 37°C에서 5분 동안 0.25% 트립신-EDTA 용액 800μL로 처리합니다. 1mL의 ESCM을 추가하여 트립신을 비활성화하고 피펫팅을 통해 ESC를 단일 세포로 해리합니다.
- ESC 함유 용액을 280 x g에서 5분 동안 원심분리하고, 상층액을 버리고, ESC를 새로운 1mL의 ESCM에 재현탁하고, 트리판 블루 염색이 있는 세포 카운터를 사용하여 세포 수를 계수합니다. 1 x 105 ESC를 새 1.5mL 튜브로 옮기고 500 x g, 4 °C에서 원심분리하여 PBS로 3회 세척합니다.
- ESC 펠릿을 12μL의 Cas9-RNP-DNA 혼합물(단계 3.3)에 재현탁하고 거품이 발생하지 않도록 부드러운 피펫팅으로 잘 혼합합니다. 전기 천공을 위해 재중단 된 ESC를 제공하십시오. 전기천공 시스템은 Cas9-RNP-DNA 형질도입을 위해 1,400V 및 30ms에서 단일 펄스를 사용합니다(그림 1).
- 유사분열적으로 비활성화된 MEF가 있는 4mL의 ESCM을 포함하는 60mm 접시에서 전기천공된 ESC를 배양합니다(섹션 4.2). 매일 매체를 교체하십시오.
- 전기천공 후 3-5일 후에 4mL의 PBS로 ESC를 세척한 다음 800μL의 0.25% 트립신-EDTA로 처리하고 소화를 위해 습한 인큐베이터에서 37°C에서 5분 동안 배양합니다. 2mL의 ESCM을 추가하여 트립신 소화를 중지하고 세포 혼합물을 280 x g 에서 5분 동안 원심분리합니다.
- 상청액을 버리고 ESC를 1mL의 새로운 ESCM에 재현탁시킨 다음 트리판 블루 염색이 있는 세포 카운터를 사용하여 세포 농도를 계산합니다. ESCM 및 피더 MEF가 포함된 60mm 접시당 1 x 103 ESC에서 ESC를 통과시킵니다. 식민지가 픽업 될 때까지 매일 매체를 교체하십시오.
참고: ESC가 픽업 전에 한 번 전달되는 이유는 ESC 분열 후에도 게놈 편집이 계속 발생할 수 있으므로 많은 경우 첫 번째 콜로니가 항상 클론이 되는 것은 아니기 때문입니다. 따라서 콜로니 픽업 전에 ESC의 첫 번째 통과는 단일 클론을 픽업하는 데 필수적인 단계입니다.
5. 표적 ESC의 PCR 유전형 분석
- 첫 번째 계대 후 5 내지 7일 후에 ESC 배양 접시로부터 ESCM을 흡인하고(단계 4.9) PBS 4 mL를 첨가한다. 실체 현미경으로 20μL 피펫을 사용하여 5μL의 PBS로 단일 ESC 콜로니를 선택합니다(30x - 40x 배율). 개별 콜로니를 0.25% 트립신-EDTA 용액 15μL를 함유하는 둥근 바닥 96웰 플레이트의 웰에 놓는다.
- 48개의 개별 콜로니가 픽업될 때까지 96웰 플레이트를 얼음 위에 보관하십시오. 96웰 플레이트를 37°C 습한 5%CO2 인큐베이터에서 5분 동안 배양한 다음 80μL의 ESCM을 추가하여 트립신 소화를 중지하고 피펫팅을 통해 ESC 콜로니를 단일 세포로 해리합니다.
참고 :이 방법의 KI 효율은 일반적으로 10 % -50 %이므로 일상적으로 48 개의 클론을 선택하고 먼저 24 개를 사용하여 유전형 분석을 수행합니다. 이 시점에서 여러 KI 클론을 얻을 수 없는 경우 나머지 24개의 클론을 사용하여 KI를 추가로 스크리닝합니다. - PCR 유전형 분석을 위해 40μL의 ESC 현탁액(단계 5)을 웰당 50μL의 ESCM이 포함된 젤라틴 코팅 피더가 없는 96웰 플레이트로 옮깁니다. 나머지 60μL의 ESC 현탁액을 500μL의 ESCM 및 피더 MEF가 포함된 젤라틴 코팅된 24웰 플레이트의 웰로 옮겨 동결된 ESC 스톡을 만듭니다.
- 개별 ESC 클론을 24-웰 플레이트에서 배양하여(단계 5.3) 이들이 60% 내지 80% 컨플루언시에 도달할 때까지 저장한다. 위에서 언급한 대로 트립신화로 개별 ESC 클론을 복구하고 새로운 1.5mL 튜브에서 세포를 수집하고 280 x g 에서 5분 동안 원심분리합니다. 상청액을 버리고, 세포를 500 μL의 세포 동결 배지에 재현탁시키고, -80°C 딥 프리저를 사용하여 동결시킨다.
- PCR 유전형 분석의 경우, ESC가 90% 컨플루언시(confluency)에 도달할 때까지 96웰 피더가 없는 플레이트(단계 5.3)에서 ESC 클론을 배양합니다. 흡인하여 각 웰에서 ESCM을 제거하고 100μL의 PBS로 두 번 세척합니다.
- PBS를 흡인하고 프로테이나제 K를 함유한 용해 완충액 100μL를 추가하고 잘 혼합한 다음 ESC 용해물을 새로운 1.5mL 튜브로 옮깁니다. 열 챔버를 사용하여 ESC 용해물을 65°C에서 최소 1시간 동안 가열합니다. 종래의 페놀-클로로포름 DNA 정제 방법을 이용하여 게놈 DNA를 추출하고 정제한 후 에탄올 침전시킨다.
- 침전된 DNA를 20μL의 DNase가 없는 물에 용해시키고 분광 광도계를 사용하여 DNA의 순도와 농도를 결정합니다. 표적 영역을 증폭하기 위해 유전자좌 특이적 프라이머 세트를 사용하여 게놈 PCR을 수행합니다. 그런 다음 시퀀스를 확인하고 원하는 KI 시퀀스를 가진 ESC 클론을 선택합니다.
6. 8세포 단계 배아의 제조 및 ESC의 미세주입
- 임신 한 암말 혈청 성선 자극 호르몬 (PMSG) 5IU를 성인 ICR 여성에게 복강 내 주사하십시오. 48 시간 후, 5 IU의 인간 융모 성 성선 자극 호르몬 (hCG)을 동일한 암컷에 주사 한 다음 호르몬 처리 된 암컷을 ICR 수컷과 교미시킵니다. 다음날 질의 교합 플러그를 확인하십시오 (배아 일 0.5, ED0.5).
알림: 털 색상 비율로 키메라를 평가하려면 ICR 균주의 배반포를 검은색 또는 아구티 코트 색상 배경이 있는 ESC의 수혜자로 사용하거나 C57BL/6 균주의 배반포를 알비노 배경이 있는 ESC의 수혜자로 사용하십시오. - ED1.5에서 난관을 수집하고 HEPES 완충 배지 (FHM) 방울에 넣습니다. 내저부에 삽입된 플러싱 바늘을 사용하여 난관을 FHM으로 플러싱하여 2세포 또는 4세포 단계 배아를 회수합니다.
- 수집 된 배아를 구강 피펫을 사용하여 여러 개의 신선한 FHM 방울로 옮겨 씻으십시오. 배아를 50 μL의 KSOM에서 37°C, 5% CO2 배양기에서 미네랄 오일로 덮인 35 mm 세포 배양 접시에 떨어뜨려 8-세포 또는 모룰라 단계(ED2.5 )에 도달할 때까지 1일 동안 배양한다.
- 배아를 다음 수집 일에 사용하지 않으면 CARD 프로토콜 (http://card.medic.kumamoto-u.ac.jp/card/english/sigen/manual/ebvitri.html)에 따라 유리화하여 동결하고 사용할 때까지 액체 질소에 보관하십시오.
- 풀러와 마이크로 포지를 사용하여 배아 (외경 80-100 μm)와 ESC 주입 (직경 약 13 μm)을 고정하기위한 유리 피펫을 준비하십시오.
- FHM이 포함된 홀딩 피펫을 마이크로인젝터에 연결된 모세관 홀더에 통합하고 마이크로매니퓰레이터의 왼쪽에 설치합니다. 주입 피펫을 다른 마이크로 주입기에 연결하고 오른쪽에 설치하십시오. 두 개의 피펫을 현미경 시야에 똑바로 정렬합니다.
- FHM 배지에 12%(w/v) 폴리비닐피롤리돈(PVP) 5μL 방울과 FHM 5μL 방울을 60mm 접시의 동일한 뚜껑에 나란히 떨어뜨리고 방울을 미네랄 오일로 덮습니다. 배아를 5 μL FHM 방울로 옮기고 배아를 포함하는 FHM 방울에 1-5 μL의 ESC 현탁액을 추가합니다.
알림: 방울을 준비하기 전에 ESC 및 MEF 현탁액을 30mm 배양 접시의 4mL ESM에 60분 동안 그대로 두십시오. MEF는 ESC보다 바닥에 더 빨리 달라붙기 때문에 이 30분 배양을 통해 상청액에 부착되지 않은 ES 세포를 농축할 수 있습니다. - PVP로 주입 피펫 내부를 씻은 다음 배아와 ESC가 들어있는 방울로 이동하십시오.
- 주입 피펫에서 세포 분열(6개 세포)을 막 마친 3개의 개별 ECS 더블릿을 선택합니다. 압축이 완료된 8 세포 또는 morula 단계 배아를 흡인에 의해 피펫을 잡고 있습니다. 압전 펄스 (강도 : 3, 속도 : 3)로 zona pellucida에 구멍을 뚫습니다. zona pellucida의 6 세포 ESC를 배출하고 배아에서 피펫을 꺼냅니다.
- ESC 주입 배아를 구강 피펫을 사용하여 여러 KSOM 방울로 부드럽게 세척하고 배아가 배반포 단계로 발달할 때까지 37°C, 5%CO2 에서 미네랄 오일로 덮인 새로운 50μL KSOM 방울에 배양합니다.
- 10 개의 ESC 주입 된 배반포를 가짜 임신 한 암컷 마우스의 각 자궁 뿔로 옮깁니다 (출산 후 2.5 일, 머리 당 20 개의 배반포).
- 대리모가 출산 한 후 키메라 비율이 가장 높은 수컷 키메라 (털 색으로 확인 된 70 % 이상)를 선택한 다음 적절한 균주 암컷과 교배하여 F1 이형 접합체 KI를 얻습니다.
- 개별 KI 마우스를 적절한 파트너와 교배시켜 연구에 적합한 바람직한 유전자형 또는 유전적 배경을 가진 마우스를 얻습니다.
결과
우리는 이전 원고11에 따라 유전자 조작 마우스 생산을 개발하기 위해 ESC의 특정 유전자를 표적으로 삼은 후 키메라 생산을 목표로 삼았습니다. ESC 유전형 분석(섹션 4에 기재됨)은 프라이머를 사용한 PCR에 의해 일상적으로 수행된다. 프라이머는 상동성 암 외부의 게놈 서열 및 KI DNA 단편 내의 특정 서열에 대해 설계된다(도 2A). 이 경우 야생형 대립 유전자는 증폭되지 않지만 특정 크기의 PCR 앰플리콘은 표적 외인성 DNA가 표적 유전자좌에서 KI 인 경우에만 검출됩니다. 대표적인 유전형 분석 PCR 결과를 도 2B에 나타내었다. 이 경우 22개의 클론 중 9개(40.9%)가 KI 특이적 밴드를 보였다. 도 2에 나타낸 결과를 포함하여 3개의 대표적인 타겟팅 결과를 표 1에 나타내었다. 이들 결과는 여기에 제시된 방법이 임의의 약물 선택 없이 유전자 KI에 대해 효율적이고 재현가능하다는 것을 나타낸다.
ESC를 주입 피펫에서 집어 올린 다음 압전 플러스를 사용하여 zona pellucida의 구멍을 만들고 ESC를 배아 세포 사이에서 방출합니다 (그림 3). 기술적으로 ESC를 8세포 또는 모룰라 단계 배아에 주입하는 이 프로토콜은 많은 마우스 시설에서 일반적으로 사용되는 배반포에 ESC 주입 프로토콜과 유사합니다. 대표적인 키메라 마우스는 도 4에 나타내었다. 키메라의 털 색상 평가를 위해 ICR 균주(알비노, 흰머리)의 배아를 B6 또는 B6-129 F1 ESC의 수용자로 사용하고 B6 배아를 BALB/c ESC의 수용자로 사용했습니다(그림 4).
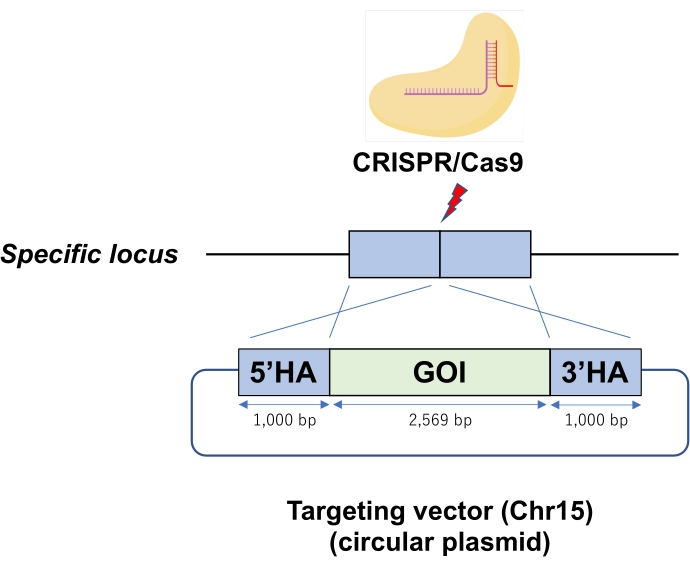
그림 1: ESC 게놈의 특정 유전자좌에 CRISPR/Cas9 리보핵단백질(RNP) 매개 원형 플라스미드 통합의 개략도. 전기천공은 원형 플라스미드를 Cas9-RNP가 있는 ESC에 표적 벡터로 도입합니다. 약어 : GOI = 관심 유전자, HA = 상 동성 팔. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
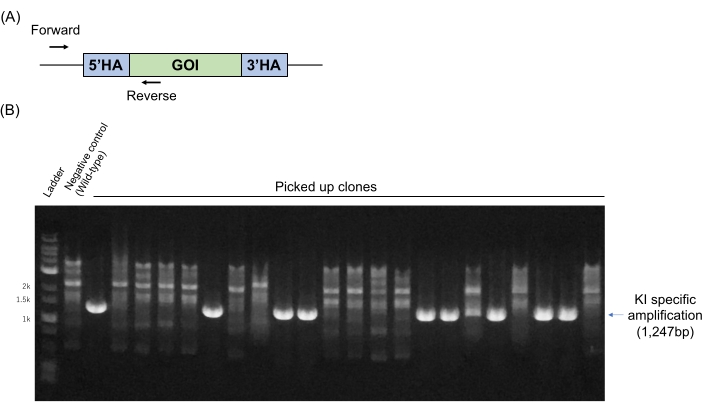
그림 2: 표적 ESC 클론의 KI 스크리닝을 위한 게놈 PCR 분석. (A) KI-특이적 PCR 프라이머는 상동성 암 외부의 게놈 서열(전방) 및 KI DNA 단편의 특정 서열(역방향)에 설계된다. (B) 대표적인 유전형 분석 PCR 결과. 야생형 게놈을 음성 대조군으로 사용하였다. 약어 : GOI = 관심 유전자, HA = 상 동성 팔. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
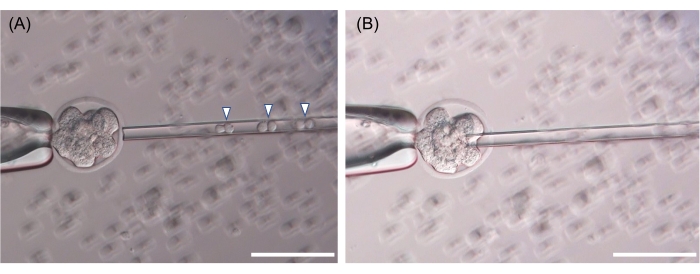
그림 3: 8세포 단계 배아 주입의 대표 이미지 . (A) 미세 주입의 경우 3 개의 이중 ESC (6 개의 세포, 화살촉)를 집어 듭니다. (B) 조나 펠루시다의 구멍은 압전 펄스로 만들어지고 ESC는 각 분열구 사이에서 배출됩니다. 표시된 스케일 바는 50μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 키메라 마우스의 대표 이미지 . (A,B) C57BL/6N에서 파생된 ESC(JM8. A3, 아구티 헤어; A) 또는 B6-129 F1 (아구티 헤어; B) ICR (흰둥이, 흰 머리카락) 배아에 주입 한 다음 배아를 어머니 대리모에게 옮깁니다. (C) BALB/c(흰둥이, 흰머리)에서 추출한 ESC를 C57BL/6J(흑발) 배아에 주입한 후 배아를 모체 대리모에게 이식합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 프로젝트 아이디 | 코로모솜 | 5' HA 길이 (bp) | 3' HA 길이 (bp) | 인서트 크기(bp) | 분석된 클론 수 | KI 클론의 수 | 효율(%) | 발언 |
| R26-CC* | 크리스6 | 965 | 1006 | 5321 | 23 | 2 | 8.7% | - |
| R4-03* | ᄏ�� | 1000 | 997 | 3070 | 22 | 6 | 27.3% | - |
| P4-01* | 크리스15 | 1000 | 1000 | 2569 | 22 | 9 | 40.9% | 그림 2 그림 |
표 1: ESC에서 3개의 독립적인 게놈 유전자좌에서의 KI 효율. *이 프로젝트는 지금까지 게시되지 않았습니다. 이 유전자의 이름은 향후 독립적 인 원고에 공개 될 것입니다.
토론
키메라 생산에 따른 ESC의 유전자 표적화는 유전자 조작 마우스를 개발하는 데 통상적으로 사용되어 왔다. 그럼에도 불구하고, 표적화 벡터가 양성 또는 음성 약물 선택 유전자 카세트를 갖는 긴(보통 > 수 kb) 상동성 팔을 포함하더라도 유전자 녹인 효율은 여전히 낮다. 우리의 프로토콜은 약물 선택 카세트가 없는 원형 플라스미드를 표적 벡터로 사용하여 일상적인 작업에 허용 가능한 효율성으로 Cas9-RNP 매개 게놈 편집을 동반하는 긴 외인성 DNA의 튜닝된 ESC KI 방법을 도입했습니다. 따라서, 이 프로토콜은 기존의 ESC 표적화와 비교하여 유전자 변형 키메라 마우스를 생산하는 데 걸리는 시간을 실질적으로 줄이는 데 도움이 될 수 있다.
이 프로토콜에서는 CRISPR/Cas9-RNP를 사용하여 게놈에서 부위 특이적 이중 가닥 절단을 유도했으며 선형화된 플라스미드 대신 원형 플라스미드를 표적 벡터로 사용했습니다. 선형화된 플라스미드는 통상적으로 유전자 KI에 대한 표적화 벡터로서 사용되는데, 그 이유는 그의 증가된 게놈 통합효율 8,9,10 때문이다. 그러나, 많은 게놈 통합은 벡터가 상동 무기9를 포함하더라도 비특이적이다. 반면에, 원형 플라스미드는 ESCs12 또는 섬유아세포(13)의 게놈 내로의 통합하기 어려운 특징 때문에 표적 벡터로서 거의 사용되지 않는다. 따라서 CRISPR/Cas9 매개 게놈 편집을 수반하는 표적 벡터로 원형 플라스미드를 적용하면 비특이적 무작위 통합이 최소화되지만 ESC 게놈으로의 부위 특이적 통합은 극대화될 수 있습니다. CRISPR/Cas9에 의한 이중 가닥 절단의 유도 효율은 매우 중요하므로(14) 고효율에서 이중 가닥 절단을 유도하는 gRNA를 사용하는 것이 필수적이라는 점은 주목할 만하다. KI 효율이 너무 낮은 경우 gRNA를 재설계하는 것을 고려해야 합니다. 도 2에 나타낸 경우, ESC 클론의 40.9%가 KI 특이적 밴드를 나타내었다. 실제로 연구소의 핵심 실험실로서 여기에 설명된 방법으로 ESC를 이용한 유전자 표적화를 일상적으로 수행하고 있으며, 유전자 좌위에 따라 약간의 차이가 있지만 Cre, CreERT 또는 형광 리포터와 같은 1-2kb 서열에 대해 10%-50%의 KI 효율을 달성했습니다. 이 방법을 사용하여 KI에 성공적으로 도달한 가장 긴 DNA 서열은 Rosa26 유전자좌 내로 약 11.2kb이고 효율은 12.2%였습니다(분석된 41개의 콜로니 중 5개의 KI 콜로니).
또한 이 프로토콜은 8세포 또는 모룰라 단계 배아를 ESC 미세 주입의 수혜자로 사용하지만 배반포 단계 배아는 사용하지 않는다는 점에 유의해야 합니다. 이 논문에서 비교 실험을 수행하지는 않았지만 여러 보고서에 따르면 8 세포 또는 morula 단계 배아에 ESC를 주입하면 배반포에 ESC 주입에 비해 키메라 자손에 대한 ESC 기여의 효율성이 크게 향상됩니다 15,16,17,18 . 실제로 C57BL/6, B6-129 F1 및 BALB/c를 포함한 다양한 ESC 라인의 ESC 주입은 일반적으로 전부는 아니지만 일부 자손에서 높은 털 색상 키메라 발달을 초래했습니다(그림 4 참조). 이 방법의 한계는 착상 전 배아에 주입 된 ESC가 키메라19,20의 생식 세포에 항상 기여할 수는 없다는 것입니다. ESC의 생식계열 전송은 각각의 ESC 클론(19)의 품질에 의존할 것이다. 따라서, 안정적인 키메라 마우스 생산을 위한 백업으로서 다수의 ESC 클론 라인을 개발하는 것이 유리할 것이다. 결론적으로, 여기에 제시된 프로토콜은 약물 내성 카세트 없이 KI에 대한 각 상동성 팔 및 관심 유전자만을 포함하는 간단한 표적화 벡터를 사용합니다. 따라서 벡터 구성이 훨씬 쉬워지고 기존의 ESC 타겟팅 기술에 비해 배양 기간을 단축 할 수 있습니다. 이것은 생명 과학에서 미래의 분석을 위해 다양한 유형의 유전자 변형 마우스를 신속하고 촉진적으로 생산하는 데 도움이 될 것입니다.
공개
저자는 공개 할 경쟁 이익이 없습니다.
감사의 말
오사카 대학의 니시오카 사키 생명 공학 연구 개발 (비영리 단체)과 도쿄 대학 의학 연구소의 기쿠치 미오와 사카모토 레이코의 훌륭한 기술 지원에 감사드립니다. 이 작업은 문부 과학성 (MEXT) / 일본 과학 진흥회 (JSPS) KAKENHI MI (JP19H05750, JP21H05033) 및 MO (20H03162)에 대한 보조금; 진화 과학 기술 핵심 연구 (CREST), 일본 과학 기술기구 (JST)가 MI (JPMJCR21N1)에 보조금을 지급합니다. 유니스 케네디 슈라이버 국립 아동 건강 및 인간 발달 연구소 MI (R01HD088412); Bill & Melinda Gates Foundation to MI (Grand Challenge Explorations grant INV-001902); 및 미생물 질병 연구소, 오사카 대학 MI 및 MO의 공동 연구 프로젝트 보조금.
자료
| Name | Company | Catalog Number | Comments |
| BALB/c ESC | - | - | ESC developed from BALB/c strain |
| Bambanker | Nippon Genetics | CS-02-001 | Cell-freezeing medium. Section 2.6 and elsewhere |
| Cas9 Nuclease V3 | IDT | 1081059 | Section 3.2 and elsewhere. |
| CHIR99021 | FUJIFILM Wako | 038-23101 | Section 4.3 |
| CreERT gene fragment | GeneWiz | Section 1.1. | |
| CRISPR-Cas9 crisprRNA | IDT | crisprRNA. Section 3.1 and elsewhere. | |
| CRISPR-Cas9 tracrRNA | IDT | 1072534 | tracrRNA. Section 3.1 and elsewhere. |
| DMEM | Nacalai | 08458-45 | MEF medium. Section 2.3 and elsewhere |
| Duplex buffer | IDT | 1072534 | RNA dilution buffer. Section 3.1 and elsewhere. |
| FastGene Gel/PCR Extraction Kit | Nippon Genetics | FG-91302 | Section 1.1 and 1.2. |
| GlutaMax | Thermo Fisher | 35-050-061 | L-glutatime substrate |
| hCG | ASKA Animal Health | Section 6.1. | |
| In-Fusion HD Cloning Kit | Clontech | 639648 | DNA cloning kit. Section 1.3 and elsewhere |
| JM8.A3 ESC | EuMMCR | - | ESC developed from C57BL/6N strain |
| Knock-out DMEM | Thermo Fisher | 10829018 | Section 4.3 and elsewhere, DMEM-based modified commercial medium. |
| KSOM | Merck | MR-121-D | Section 6.3 and 6.9. |
| Leukemia inhibitory factor | FUJIFILM Wako | 125-05603 | Section 4.3. No unit concentration data is supplied by the provider. Used 1,000-fold dilution in this protocol. |
| Neon Electroporation system | Thermo Fisher | MPK5000 | Section 3.2, 4.5 and elsewhere. The system containes electroporation buffer as well used in section 3.2. |
| NucleoSpin Plasmid Transfection-grade | Takara | U0490B | Section 1.6. |
| PD0325901 | FUJIFILM Wako | 162-25291 | Section 4.3 |
| PMSG | ASKA Animal Health | Section 6.1. | |
| Tail lysis buffer | Nacalai | 06169-95 | Section 5.5. |
| Trypsin-EDTA | Nacalai | 32777-15 | Section 2.2 and elsewhere |
| V6.5 ESC | - | - | ESC developed from B6J-129 F1 strain |
| X-ray irradiation device | Hitachi | MBR-1618R-BE | Section 2.6. |
참고문헌
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154 (6), 1370-1379 (2013).
- Oji, A., et al. CRISPR/Cas9 mediated genome editing in ES cells and its application for chimeric analysis in mice. Scientific Reports. 6, 31666 (2016).
- Kaneko, T., Mashimo, T. Simple genome editing of rodent intact embryos by electroporation. PLoS One. 10 (11), 0142755 (2015).
- Chen, F., et al. High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nature Methods. 8 (9), 753-755 (2011).
- Hashimoto, M., Yamashita, Y., Takemoto, T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Developmental Biology. 418 (1), 1-9 (2016).
- Mansour, S. L., Thomas, K. R., Capecchi, M. R. Disruption of the proto-oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes. Nature. 336 (6197), 348-352 (1988).
- Johnson, R. S., et al. Targeting of nonexpressed genes in embryonic stem cells via homologous recombination. Science. 245 (4923), 1234-1236 (1989).
- Hasty, P., Ramires-Solis, R., Krumlauf, R., Bradley, A. Introduction of a subtle mutation into the Hox-2.6 locus in embryonic stem cells. Nature. 350 (6315), 243-246 (1991).
- Ozawa, M., Emori, C., Ikawa, M., Hatada, I. Gene targeting in mouse embryonic stem cells via CRISPR/Cas9 ribonucleoprotein (RNP) mediated genome editing. Genome Editing in Animals - Methods and Protocols 2nd edition. , (2022).
- Yagi, M., et al. Derivation of ground-state female ES cells maintaining gamete-derived DNA methylation. Nature. 548 (7666), 224-227 (2017).
- Gassmann, M., Donoho, G., Berg, P. Maintenance of an extrachromosomal plasmid vector in mouse embryonic stem cells. Proceedings of National Academy of Sciences. 92 (5), 1292-1296 (1995).
- Okita, K., Nakagawa, M., Hyenjong, H., Ichisaka, T., Yamanaka, S. Generation of mouse induced pluripotent stem cells without viral vectors. Science. 322 (5903), 949-953 (2008).
- Poueymirou, W. T., et al. F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses. Nature Biotechnology. 25 (1), 91-99 (2007).
- Hu, M., et al. Efficient production of chimeric mice from embryonic stem cells injected into 4- to 8-cell and blastocyst embryos. Journal of Animal Science and Biotechnology. 4 (1), 1-7 (2013).
- Guo, J., et al. Contribution of Mouse Embryonic Stem Cells and Induced Pluripotent Stem Cells to Chimeras through Injection and Coculture of Embryos. Stem Cells International. 2014, 409021 (2014).
- Bodai, Z., Bishop, A. L., Gantz, V. M., Komor, A. C. Targeting double-strand break indel byproducts with secondary guide RNAs improves Cas9 HDR-mediated genome editing efficiencies. Nature Communications. 13 (1), 2351 (2022).
- Kobayashi, T., Goto, T., Oikawa, M., Sanbo, M., Yoshida, F., Terada, R., Niizeki, N., Kajitani, N., Kazuki, K., Kazuki, Y., Hochi, S., Nakauchi, H., Surani, A., Hirabayashi, M. Blastocyst complementation using Prdm14-deficient rats enables efficient germline transmission and generation of functional mouse spermatids in rats. Nature Communications. 12 (1), 1328 (2021).
- Miura, K., Matoba, S., Hirose, M., Ogura, A. Generation of chimeric mice with spermatozoa fully derived from embryonic stem cells using a triple-target CRISPR method for Nanos3. Biology of Reproduction. 104 (1), 223-233 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유