A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יישום AlDeSense לריבוד תאי סרטן השחלות על בסיס פעילות אלדהיד דהידרוגנאז 1A1
* These authors contributed equally
In This Article
Summary
שיטות למדידת פעילות ALDH1A1 בתאים חיים הן קריטיות בחקר הסרטן בשל מעמדו כסמן ביולוגי של גזע. במחקר זה, השתמשנו בבדיקה פלואורוגנית איזופורמית-סלקטיבית כדי לקבוע את הרמות היחסיות של פעילות ALDH1A1 בפאנל של חמישה קווי תאים של סרטן השחלות.
Abstract
הישנות לאחר טיפול בסרטן מיוחסת לעתים קרובות להתמדה של תת-אוכלוסייה של תאי גידול המכונים תאי גזע סרטניים (CSC), המאופיינים ביכולת ייזום הגידול וההתחדשות העצמית המרשימה שלהם. בהתאם למקור הגידול (למשל, השחלות), פרופיל הסמן הביולוגי של פני השטח של CSC יכול להשתנות באופן דרמטי, מה שהופך את הזיהוי של תאים כאלה באמצעות צביעה אימונוהיסטוכימית למאמץ מאתגר. להיפך, אלדהיד דהידרוגנאז 1A1 (ALDH1A1) התגלה כסמן מצוין לזיהוי CSCs, בשל פרופיל הביטוי השמור שלו כמעט בכל תאי האב כולל CSC. האיזופורם ALDH1A1 שייך למשפחת על של 19 אנזימים האחראים לחמצון של אלדהידים אנדוגניים וקסנוביוטיים שונים לתוצרי החומצה הקרבוקסילית המתאימים. Chan et al. פיתחו לאחרונה את AlDeSense, גשושית "הפעלה" איזופורמית-סלקטיבית לזיהוי פעילות ALDH1A1, כמו גם מגיב בקרת התאמה לא תגובתי (Ctrl-AlDeSense) כדי להסביר צביעה מחוץ למטרה. כלי איזופורם-סלקטיבי זה כבר הוכח ככלי כימי רב-תכליתי באמצעות זיהוי פעילות ALDH1A1 בתאי לוקמיה מיאלוגניים K562, ממוספרות וקסנוגרפטים CSC שמקורם במלנומה. במאמר זה, התועלת של הגשושית הודגמה באמצעות ניסויי פלואורימטריה נוספים, מיקרוסקופ קונפוקלי וציטומטריית זרימה, שבהם הפעילות היחסית של ALDH1A1 נקבעה בפאנל של חמישה קווי תאים של סרטן השחלות.
Introduction
תאי גזע סרטניים (CSC) הם תת-אוכלוסייה של תאי גידול בעלי תכונות דמויות תאי גזע1. בדומה לעמיתיהם הלא סרטניים, ל-CSCs יש יכולת יוצאת דופן לחדש את עצמם ולהתרבות. יחד עם מנגנונים מובנים אחרים, כגון upregulation של מובילי קלטות קושרי ATP, CSCs נחסכים לעתים קרובות ממאמצי debulking כירורגיים ראשוניים, כמו גם טיפול אדג'ובנטיהבא 2. בשל תפקידם הקריטי בעמידות לטיפול3, הישנות4 וגרורות5, CSCs הפכו לעדיפות בחקר הסרטן. למרות שיש מגוון של אנטיגנים בפני השטח של התא (למשל, CD133) שניתן להשתמש בהם כדי לזהות CSCs6, מינוף הפעילות האנזימטית של אלדהיד דהידרוגנאזות (ALDHs) שנמצא בציטופלסמה התגלה כחלופה אטרקטיבית7. ALDHs הם משפחת על של 19 אנזימים האחראים לזרז את החמצון של אלדהידים אנדוגניים וקסנוביוטיים תגובתיים לתוצרי חומצה קרבוקסילית המתאימים8.
באופן כללי, ניקוי רעלים מאלדהיד חיוני להגנה על התאים מפני אירועי קישור צולב בלתי רצויים ועקה חמצונית שעלולה לפגוע בשלמות תאי הגזע9. יתר על כן, האיזופורם 1A1 שולט במטבוליזם של חומצה רטינואית, שבתורה משפיעה על הגבעול באמצעות איתות רטינאלדהיד10. AlDeSense 11,12, גשושית חישה מבוססת פעילות מולקולה קטנה (ABS) לזיהוי סלקטיבי של פעילות ALDH1A1, פותחה לאחרונה. תכנוני ABS משיגים זיהוי אנליטי באמצעות שינוי כימי ולא אירוע קשירה, מה שמאפשר סלקטיביות גבוהה וירידה בתגובות מחוץ למטרה13,14,15,16. עקרון התכנון של הגשושית הפלואורוגנית האיזופורמית-סלקטיבית מסתמך על מנגנון מרווה17 של העברת אלקטרונים פוטואינדוקציה מתורם (d-PeT), שמקורו בקבוצה הפונקציונלית אלדהיד, המשמש לדיכוי החתימה הפלואורסצנטית של הגשושית18. עם המרה בתיווך ALDH1A1 לחומצה קרבוקסילית, הרפיה קרינתית נפתחת כדי להניב מוצר פלואורסצנטי מאוד. מכיוון שמרווה d-PeT לעולם אינה יעילה ב-100%, הפלואורסצנטיות השיורית שעלולה להוביל לתוצאות חיוביות כוזבות אפשריות נלקחה בחשבון בעת ביסוס בדיקה זו באמצעות פיתוח Ctrl-AlDeSense, מגיב שאינו מגיב עם מאפיינים פוטופיזיים תואמים (למשל, תפוקה קוונטית) ודפוס צביעה ציטופלזמי זהה בתאים. כאשר משתמשים בו במקביל, זיווג ייחודי זה יכול להבדיל באופן אמין בין תאים עם פעילות ALDH1A1 גבוהה לבין תאים עם רמות נמוכות באמצעות פלואורימטריה, הדמיה מולקולרית וציטומטריית זרימה. מספר יתרונות עיקריים קשורים לשימוש בצבעים מפעילים איזופורמיים-סלקטיביים על פני שיטות אימונוהיסטוכימיות מסורתיות. לדוגמה, משערים כי CSCs קבורים עמוק בתוך גידול, ולכן הם נגישים יותר למולקולה קטנה יחסית לנוגדנים גדולים19. בנוסף, המוצר הפלואורסצנטי ההפוך אינו משנה באופן קוולנטי שום רכיב תאי, כלומר ניתן להסיר אותו בקלות באמצעות מחזורי שטיפה כדי להשאיר CSC במצב ללא שינוי. לבסוף, תגובת ההפעלה מזהה רק תאים ותפקודים בני קיימא, בדומה לבדיקת MTT, הודות להסתמכותה על קו-פקטור NAD+.
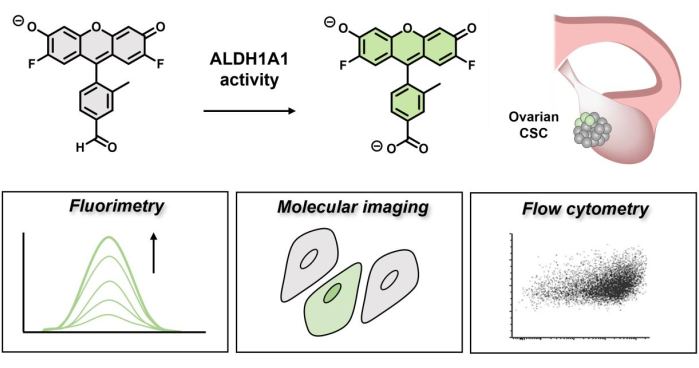
איור 1: הדגמה סכמטית של הפעלה פלואורסצנטית של AlDeSense. הצבע האיזופורמי-סלקטיבי מופעל על ידי ALDH1A1 וניתן להשתמש בו לזיהוי פעילות מוגברת של ALDH1A1 בתאי סרטן השחלות באמצעות פלואורימטריה, הדמיה מולקולרית וציטומטריית זרימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
בעבודות קודמות, בדיקת הבדיקה הפלואורוגנית האיזופורמית-סלקטיבית הצליחה לרבד תאים גבוהים של ALDH (ALDH+) מתאי ALDH נמוכים (ALDH-) בתאי לוקמיה כרונית אנושיים K562, בתאי סרטן שד אנושיים MDA-MB-231 ובתאי מלנומה מורין B16F0. זה חשוב מכיוון שעבור סוגי סרטן רבים, ביטוי חלבון ALDH1A1 גבוה מסמל פרוגנוזה קלינית גרועה יותר20. זה מניח כי רמות גבוהות של ALDH1A1 מעידות על CSCs אשר יכול לחמוק מטיפול, לפתח התנגדות, ולהפיץ בכל הגוף. עם זאת, במקרה של סרטן השחלות, ישנם מחקרים המדווחים על ממצא הפוך (ביטוי ALDH1A1 גבוה קשור לשיפור בהישרדות המטופלת)21,22,23,24. בעוד שזה עשוי להיראות סותר במבט ראשון, ביטוי אינו בהכרח בקורלציה לפעילות האנזים, אשר עשוי להיות מושפע משינויים במיקרו-סביבה של הגידול (למשל, שטף pH, שיפועי חמצן), זמינות של קו-פקטור NAD+ או מצעי אלדהיד, רמות של חומצות קרבוקסיליות (עיכוב מוצר), ושינויים לאחר תרגום שיכולים לשנות את פעילות האנזים25 . בנוסף, סרטן השחלות מחולק לחמישה סוגים היסטולוגיים עיקריים (סרוסי בדרגה גבוהה, סרוסי בדרגה נמוכה, אנדומטריואיד, תא שקוף ומוציני), אשר אנו משערים כי יכללו רמות משתנות של פעילות ALDH1A126. במטרה לחקור את פעילות ALDH1A1 בגידולים בשחלות, נעשה שימוש בבדיקת בדיקה פלואורוגנית איזופורמית-סלקטיבית כדי לזהות אוכלוסיות ALDH1A1+ בפאנל של חמישה קווי תאים של סרטן השחלות השייכים לסוגים ההיסטולוגיים השונים שהוזכרו לעיל. קווי התאים שנבדקו במחקר זה כוללים תאי BG-1, Caov-3, IGROV-1, OVCAR-3 ו-PEO4, המכסים תאים ברורים והיסטוטיפים סרוסיים. כאן, הרבגוניות וההכללה של הגשושית הודגשה כדי לזהות CSCs עבור החוקרים המבקשים לבצע מחקרים דומים בשורות תאים סרטניים אימורטליים אחרים, כמו גם דגימות חולים. השימוש ב-AlDeSense ישפוך אור על המסלולים הביוכימיים המעורבים בתחזוקת CSC במיקרו-סביבות מורכבות של רקמות ועשוי לשמש כלי קליני לקביעת פרוגנוזה ולמדידת אגרסיביות של סרטן.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. למדוד את הפעילות הכוללת של ALDH1A1 בהומוגנאטים של תאי סרטן השחלות באמצעות פלואורימטריה
- הפשרה 1 × 106 תאים בבקבוק תרבית תאים T25 ב 5 מ"ל של אמצעי תרבית התאים הבאים:
- IGROV-1 ו-PEO4: Roswell Park Memorial Institute (RPMI) 1640 בינוני עם 10% נסיוב בקר עוברי (FBS) ו-1% פניצילין/סטרפטומיצין (P/S).
- BG-1 ו-Caov-3: מדיום הנשר המתוקן של דולבקו (DMEM) עם 10% FBS ו-1% P/S.
- OVCAR-3: סל"ד 1640 עם 20% FBS, 1% P/S ו-0.01 מ"ג/מ"ל אינסולין.
- שמור על התאים באינקובטור ב 37 ° C ו 5% CO2 במשך שניים עד שלושה מעברים. ודא שהתאים אינם עולים על מפגש של 80%-90% לפני המעבר.
- טריפסין את התאים ב 0.25% טריפסין במשך 10 דקות, לספור אותם באמצעות מונה תאים אוטומטי, גלולה 1 ×10 7 תאים באמצעות צנטריפוגה (180 × גרם) ב 25 ° C במשך 5 דקות.
- הסר את הסופרנאטנט בזהירות באמצעות שאיפה, שטוף את הגלולה על ידי השעיית התאים ב 1 מ"ל של 1x PBS, וגלולה מחדש את התאים באמצעות צנטריפוגה באותם תנאים המתוארים בשלב 4.
- השהה מחדש את התאים בתמיסה של מעכב פרוטאז 1x ב- 1x PBS. השתמש 1 מ"ל של פתרון זה לכל 2.5 × 106 תאים.
- הפעל את תרחיף התא על קרח למשך 2 דקות (פולס של שנייה אחת, משרעת של 40%) באמצעות בדיקה הומוגנייזר של התא.
- שברי קרום בלתי מסיסים באמצעות צנטריפוגה (3,200 × גרם) ב-25°C למשך 15 דקות. הסר ושמור את supernatant, כמו זה homogenate כי ישמש בשלבים הבאים. הפרידו את ההומוגנטים לשלוש קוביות כדי לבצע את הניסוי במשולש.
- הוסף את הגשושית להומוגנט כדי לקבל ריכוז בדיקה סופי של 4 מיקרומטר. פיפטה למעלה ולמטה שלוש פעמים כדי לערבב את התמיסה היטב.
- מדוד את האות הפלואורסצנטי מיד לאחר החיבור ולאחר זמני הדגירה הרצויים על פלואורימטר. ניתן למטב את זמן הדגירה כדי לראות את סיבוב הקיפול המרבי (שעה אחת בניסוי זה). זמן הדגירה חייב להיות קבוע בכל קווי התאים בהשוואה.
- הגדר את אורך גל העירור ל- 496 ננומטר.
- הגדר את הפליטה ל 510-600 ננומטר.
- הגדר את רוחב החריץ ל- 0.5 מ"מ.
- פיפטפו את התמיסה לקובט קוורץ בנפח 1 מ"ל, הכניסו לפלואורימטר ולחצו על הסריקה.
- חלק את עוצמת הפלואורסצנטיות הסופית ב- 516 ננומטר (אורך גל פלואורסצנטי מרבי) בעוצמה באותו אורך גל מהקריאה הראשונית כדי לקבוע את הפעלת הקיפול של הצבע האיזופורמי-סלקטיבי.
2. שימוש במיקרוסקופ פלואורסצנטי לתאי תמונה בעלי פעילות ALDH1A1 גבוהה
- הפשרה 1 × 106 תאים בבקבוק תרבית תאים T25 ב 5 מ"ל של מדיה תרבית תאים מתאימה.
- שמור על התאים באינקובטור ב 37 ° C ו 5% CO2 במשך שניים עד שלושה מעברים. ודא שהתאים אינם עולים על מפגש של 80%-90% לפני המעבר.
- יום לפני הדמיה קונפוקלית, צלחת 4 × 105 תאים בשקופית תא 8 בארות.
- מצפים את החלק התחתון של כל באר עם פולי-L-ליזין (0.1 מ"ג / מ"ל, 100 μL לכל באר) במשך 10 דקות, לאחר מכן שאיפה.
- יש לשטוף כל באר 3 פעמים על ידי הוספת מים בדרגת תרבית תאים (100 מיקרוליטר לבאר) ולשאוף.
- טריפסין את התאים ב 0.25% טריפסין במשך 10 דקות, לספור אותם באמצעות מונה תאים אוטומטי, צלחת את התאים ב 4 × 105 תאים לכל באר.
- תנו לתאים להתיישב ולהתחבר למשך הלילה (12-16 שעות).
- שאפו את מצע הגידול והוסיפו מדיה נטולת סרום (500 מיקרוליטר לבאר), בתוספת 2 מיקרומטר של הגשושית או של בדיקת הבקרה.
- יש לדגור עם הגשושית בטמפרטורת החדר למשך 30 דקות ולצלם את התאים מיד.
- הפעל את המיקרוסקופ הקונפוקלי והתאם לדגימה.
- טען את הדגימה בזהירות בהגדלה הנמוכה ביותר; מצא את התאים כדי להבטיח מיקום נכון.
- ודא שהעדשה האובייקטיבית נמצאת בהגדלה של פי 10 ואתר את התאים.
- לצורך ניסוי זה נדרשים ערוץ FITC (עירור: לייזר 488 ננומטר; פליטה: 516-521 ננומטר) וערוץ T-PMT (אור משודר). אתר והתמקד בתאים באמצעות T-PMT כדי להתמקד באותו מישור z במשך כל הניסוי כדי להסיר הטיה.
- כוונן את עוצמת הלייזר ואת רווח FITC להגדרה המתאימה, שבה האות מדגימות AM של Ctrl-AlDeSense ניתן לזיהוי מינימלי, ועדיין רואה אות בדגימות AM של AlDeSense. ניתן להתאים כל פרמטר על ידי הזזה של הסרגל המתאים. ייתכן שיהיה צורך להתאים את ההגדרות כמה פעמים כדי לזהות את הפרמטרים הנכונים. לאחר האופטימיזציה, השלימו את שאר הניסוי בתוך קו התא באמצעות פרמטרים זהים.
- צלם שלוש תמונות לכל באר ובסך הכל שלוש בארות לכל תנאי טיפול (תשע תמונות בסך הכל). התמקד במישור הנכון באמצעות T-PMT כדי למנוע הטיה במקום להשתמש בערוץ הפלואורסצנטי או בתמונה הממוזגת.
- עבד את התמונות כדי לקבוע את אחוז תאי ALDH1A1+.
- באמצעות תוכנת עיבוד תמונה, פצל את קובץ czi לערוצים שונים.
- ספור את מספר התאים הכולל ואת המספר הכולל של תאים פלואורסצנטיים.
- כדי לקבוע את אחוז תאי ALDH1A1+, חלק את מספר התאים הפלואורסצנטיים במספר התאים הכולל בכל תמונה. זה הכרחי לספור באותו אופן עבור כל תמונה מבלי לתפעל את התמונות, כמו, למשל, התאמת הבהירות עשויה להוסיף משתנה מבלבל.
3. יישום ציטומטריית זרימה לזיהוי תאים בעלי פעילות ALDH1A1 גבוהה
- הפשרה 1 × 106 תאים בבקבוק תרבית תאים T25 ב 5 מ"ל של מדיה תרבית תאים מתאימה.
- שמור על התאים באינקובטור ב 37 ° C ו 5% CO2 במשך שניים עד שלושה מעברים. ודא שהתאים אינם עולים על מפגש של 80%-90% לפני המעבר.
- טריפסיניזציה, ספירה וגלולה של התאים בצינור צנטריפוגה של 15 מ"ל באמצעות צנטריפוגה (180 × גרם) ב 25 ° C למשך 5 דקות.
- להשהות מחדש את התאים ב 1 מ"ל של 2 מיקרומטר בדיקה / פתרון בדיקה בקרה ב PBS. רוקנו את התאים בטמפרטורת החדר למשך 60 דקות כדי להבטיח חשיפה אחידה לצבע.
- לאחר תקופת הדגירה, גלולה את התאים באמצעות צנטריפוגה (180 × גרם) ב 25 ° C במשך 5 דקות. להשעות מחדש את התאים ב 0.5 מ"ל של PBS. הפעל את התאים דרך מסננת תאים (רשת ניילון של 35 מיקרומטר) כדי להסיר גושי תאים שעלולים לסתום את ציטומטר הזרימה. מיד מניחים את התאים על קרח.
- הפעל את המכשיר והפעל את פרוטוקול ההפעלה.
- בדוק אם יש נוזל נדן ופסולת ריקה.
- הפעל את הקווים עם 10% אקונומיקה ומים במשך 5 דקות כל אחד.
- הפעל חרוזי בקרת איכות כדי להבטיח תפקוד תקין.
- בכרטיסיה הגדרות, בחר FSC (פיזור קדימה), SSC (פיזור צדדי) ו- FITC (fluorescein isothiocyanate) עבור מסנן הפלואורסצנציה.
- צייר את הגרפים הבאים כדי לשער עבור כדאיות, סינגלטים ופלואורסצנטיות. מטב את עוצמת הלייזר (ספציפית למכשיר המשתמש) כך שאוכלוסיות התאים יהיו בתוך הפרמטרים הנתונים לניתוח נוסף.
- תרשים פיזור FSC-A לעומת SSC-A: אוכלוסיית התאים העיקרית קרובה למרכז הגרף.
- תרשים פיזור FSC-A לעומת FSC-W: פס אופקי צר המעיד על סינגלים (ולא על גושי תאים).
- תרשים פיזור FITC-A לעומת FSC-A: שימו לב להתפלגות התאים הממוינים על ידי בדיקת הפנייה הפלואורוגנית האיזופורמית-סלקטיבית.
- היסטוגרמה של FITC-A: שימו לב לשינוי באוכלוסייה בהתבסס על FITC כדי לקבוע את אחוז תאי ALDH1A1+.
- כדי למטב את עוצמת הלייזר של FITC, הפעל דגימה עם הבדיקה כך שהזנב הימני של עקומת ההיסטוגרמה יהיה קרוב לאות FITC-A המרבי. לאחר מכן, הפעל מדגם עם בדיקת הבקרה. יש לצפות בשינוי אוכלוסייה כדי לחשוף את הטווח הדינמי המרבי. ייתכן שיהיה צורך לחזור על שלב מיטוב עוצמת הלייזר מספר פעמים, אך אין לשנות את עוצמת הלייזר בין הדגימות לאחר שהוגדרה הגדרה לניסוי.
- הפעל כל דגימה עבור 10,000 ספירות (נעשה בשלשה).
- חזור על שלב 3.12 עבור כל קו תא, מכיוון שתהיה שונות בקליטה ובפעילות ALDH1A1.
- לאחר השלמת איסוף הדגימות, הפעל את הקווים עם 10% אקונומיקה ומים במשך 5 דקות כל אחד, ולאחר מכן התחל כיבוי של המכשיר.
- עבד את הנתונים באמצעות תוכנת ציטומטריית זרימה ושער אוכלוסיית התאים הרצויה. הגדר את השערים כך שכל האירועים ייכנסו לשער ALDH1A1 או ALDH1A1+. באמצעות בחירת שער המלבן, הגדר את שער ALDH1A1 כך ש- >99.5% מהאירועים בדגימות בדיקת הבקרה יתרחשו בתוך שער זה. התאים הנותרים ייחשבו ALDH1A1+. לאחר מכן ניתן להחיל את אותם שערים על מדגם הגשושית כדי לכמת את מספר האירועים הנחשבים ALDH1A1- ו- ALDH1A1+.
Access restricted. Please log in or start a trial to view this content.
תוצאות
סה"כ פעילות ALDH1A1 של הומוגנאטים של תאי סרטן השחלות
סיבובי הקיפול הממוצעים עבור כל קו תאים המתקבלים מבדיקה זו הם: BG-1 (1.12 ± 0.01); איגרוב-1 (1.30 ± 0.03); Caov-3 (1.72 ± 0.06); PEO4 (2.51 ± 0.29); ו-OVCAR-3 (10.25 ± 1.46) (איור 2).
Access restricted. Please log in or start a trial to view this content.
Discussion
פאן-סלקטיביות היא מגבלה עיקרית של בדיקות ALDH רבות; עם זאת, לאחרונה דווח על מספר דוגמאות איזופורמיות-סלקטיביות 32,33,34,35,36,37,38,39,40,41....
Access restricted. Please log in or start a trial to view this content.
Disclosures
אנו חושפים פטנט תלוי ועומד (US20200199092A1) עבור טכנולוגיית AlDeSense.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות (R35GM133581 ל- JC) ומרכז הסרטן באילינוי מלגת בוגר (הוענקה ל- SG). JC מודה לקרן קמיל והנרי דרייפוס על התמיכה. המחברים מודים לד"ר Thomas E. Bearrood על תרומתו הראשונית להכנת מניות של AlDeSense ו-AlDeSense AM. אנו מודים למר אוליבר ד. פיצ'רדו פגרו ולמר ג'וזף א. פורזאנו על עזרתם בהכנת קודמנים סינתטיים שונים. אנו מודים לפרופ' אריק נלסון (המחלקה לפיזיולוגיה מולקולרית ואינטגרטיבית, UIUC) עבור תאי Caov-3, IGROV-1 ו-PEO4. אנו מודים לפרופ' פול הרגנרותר (המחלקה לכימיה, UIUC) על תאי BG-1. אנו מודים למתקני הליבה במכון קארל ר. ווז לביולוגיה גנומית על הגישה למיקרוסקופ הקונפוקלי Zeiss LSM 700 ולתוכנה המתאימה. אנו מודים למתקן Flow Cytometry Facility על הגישה ל-BD LSR II CMtO Analyzer. אנו מודים לד"ר סנדרה מקמאסטרס ולמתקן המדיה התאית על הסיוע בהכנת מדיה של תרביות תאים.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
References
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362(2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142(2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277(2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502(2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662(2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved