É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aplicação do AlDeSense na Estratificação de Células de Câncer de Ovário com Base na Atividade da Aldeído Desidrogenase 1A1
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Métodos para medir a atividade de ALDH1A1 em células vivas são críticos na pesquisa do câncer devido ao seu status como um biomarcador de tronco. Neste estudo, empregamos uma sonda fluorogênica isoforme-seletiva para determinar os níveis relativos de atividade de ALDH1A1 em um painel de cinco linhagens de células de câncer de ovário.
Resumo
A recidiva após o tratamento do câncer é frequentemente atribuída à persistência de uma subpopulação de células tumorais conhecidas como células-tronco cancerosas (CSCs), que são caracterizadas por sua notável capacidade de iniciação tumoral e auto-renovação. Dependendo da origem do tumor (por exemplo, ovários), o perfil de biomarcadores de superfície da CSC pode variar drasticamente, tornando a identificação de tais células por meio de coloração imuno-histoquímica um esforço desafiador. Ao contrário, a aldeído desidrogenase 1A1 (ALDH1A1) tem emergido como um excelente marcador para identificar CSCs, devido ao seu perfil de expressão conservado em quase todas as células progenitoras, incluindo CSCs. A isoforma ALDH1A1 pertence a uma superfamília de 19 enzimas que são responsáveis pela oxidação de vários aldeídos endógenos e xenobióticos aos produtos correspondentes do ácido carboxílico. desenvolveram recentemente o AlDeSense, uma sonda "turn-on" isoform-seletiva para a detecção da atividade de ALDH1A1, bem como um reagente de controle de correspondência não reativo (Ctrl-AlDeSense) para explicar a coloração fora do alvo. Esta ferramenta isoform-seletiva já demonstrou ser uma ferramenta química versátil através da detecção da atividade de ALDH1A1 em células de leucemia mielóide K562, mamosferas e xenoenxertos CSC derivados de melanoma. Neste artigo, a utilidade da sonda foi mostrada através de experimentos adicionais de fluorimetria, microscopia confocal e citometria de fluxo, onde a atividade relativa de ALDH1A1 foi determinada em um painel de cinco linhagens de células de câncer de ovário.
Introdução
As células-tronco cancerosas (CSCs) são uma subpopulação de células tumorais que exibem propriedades semelhantes às células-tronco1. Semelhante aos seus homólogos não cancerosos, os CSCs possuem a extraordinária capacidade de se auto-renovar e proliferar. Juntamente com outros mecanismos incorporados, como a regulação positiva dos transportadores de de ligação de ATP, as CSCs são frequentemente poupadas dos esforços iniciais de remoção cirúrgica, bem como da terapia adjuvante subsequente2. Devido ao seu papel crítico na resistência ao tratamento3, recidiva4 e metástase5, as CSCs tornaram-se uma prioridade na pesquisa do câncer. Embora haja uma variedade de antígenos de superfície celular (por exemplo, CD133) que podem ser usados para identificar CSCs6, alavancar a atividade enzimática de aldeídos desidrogenases (ALDHs) encontradas no citoplasma tem emergido como uma alternativa atraente7. ALDHs são uma superfamília de 19 enzimas responsáveis por catalisar a oxidação de aldeídos endógenos e xenobióticos reativos aos produtos correspondentes do ácido carboxílico8.
Em geral, a desintoxicação de aldeídos é crucial na proteção das células contra eventos indesejáveis de ligações cruzadas e estresse oxidativo que podem danificar a integridade das células-tronco9. Além disso, a isoforma 1A1 controla o metabolismo do ácido retinóico, que por sua vez influencia a haste via sinalização retinaldeído10. O AlDeSense 11,12, uma sonda de detecção baseada em atividade de pequenas moléculas (ABS) para detectar seletivamente a atividade de ALDH1A1, foi recentemente desenvolvido. Os projetos em ABS alcançam a detecção do analito através de uma mudança química em vez de um evento de ligação, permitindo alta seletividade e diminuição das respostas fora do alvo13,14,15,16. O princípio de projeto da sonda fluorogênica seletiva de isoformas baseia-se em um mecanismo de têmpera de transferência de elétrons (d-PeT) doador-fotoinduzido17, originário do grupo funcional aldeído, que serve para suprimir a assinatura fluorescente da sonda18. Após a conversão mediada por ALDH1A1 para o ácido carboxílico, o relaxamento radiativo é desbloqueado para produzir um produto altamente fluorescente. Como a têmpera d-PeT nunca é 100% eficiente, a fluorescência residual que pode levar a possíveis resultados falso-positivos foi considerada ao estabelecer este ensaio através do desenvolvimento de Ctrl-AlDeSense, um reagente não responsivo com características fotofísicas correspondentes (por exemplo, rendimento quântico) e um padrão de coloração citoplasmático idêntico nas células. Quando usado em conjunto, este emparelhamento único pode distinguir de forma confiável células com alta atividade de ALDH1A1 daquelas que exibem baixos níveis via fluorimetria, imagem molecular e citometria de fluxo. Várias vantagens importantes estão associadas ao uso de corantes ativados por isoforma seletiva em relação aos métodos tradicionais de imuno-histoquímica. Por exemplo, as CSCs são hipotetizadas para serem enterradas profundamente dentro de um tumor e, portanto, são mais acessíveis a uma molécula pequena em relação a anticorpos grandes19. Além disso, o produto fluorescente transformado não modifica covalentemente nenhum componente celular, o que significa que pode ser prontamente removido através de ciclos de lavagem para deixar um CSC em um estado não modificado. Por fim, a resposta ativada identifica apenas células e funções viáveis, assim como o ensaio MTT, devido à sua dependência do cofator NAD+.
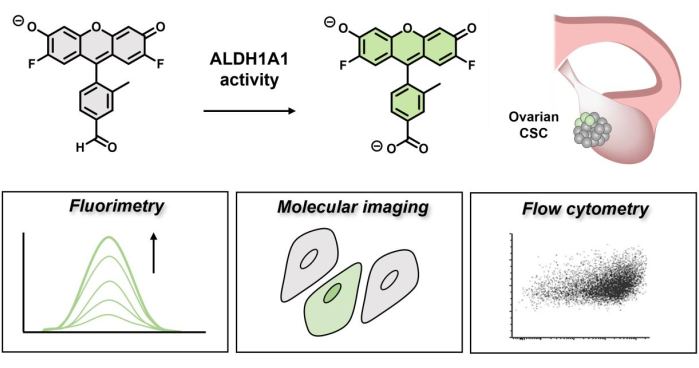
Figura 1: Esquema demonstrando o acionamento fluorescente do AlDeSense. O corante isoform-seletivo é ativado pela ALDH1A1 e pode ser usado para identificar a atividade elevada da ALDH1A1 em células cancerosas do ovário via fluorimetria, imagem molecular e citometria de fluxo. Clique aqui para ver uma versão maior desta figura.
Em trabalhos anteriores, o ensaio de sonda fluorogênica isoform-seletiva estratificada com sucesso em células ALDH altas (ALDH+) de células ALDH baixas (ALDH-) em células K562 de leucemia crônica humana, células de câncer de mama humano MDA-MB-231 e células de melanoma murino B16F0. Isso é importante porque, para muitos tipos de câncer, a alta expressão da proteína ALDH1A1 significa pior prognóstico clínico20. Isso pressupõe que níveis elevados de ALDH1A1 são indicativos de CSCs que podem escapar do tratamento, desenvolver resistência e disseminar-se por todo o corpo. No entanto, no caso do câncer de ovário, há estudos relatando o achado oposto (alta expressão de ALDH1A1 está ligada à melhora da sobrevida das pacientes)21,22,23,24. Embora isso possa parecer contraditório à primeira vista, a expressão não necessariamente se correlaciona com a atividade enzimática, que pode ser influenciada por mudanças no microambiente tumoral (por exemplo, fluxo de pH, gradientes de oxigênio), disponibilidade do cofator NAD+ ou substratos de aldeídos, níveis de ácidos carboxílicos (inibição do produto) e modificações pós-traducionais que podem alterar a atividade enzimática25 . Além disso, o câncer de ovário é dividido em cinco tipos histológicos principais (seroso de alto grau, seroso de baixo grau, endometrioide, de células claras e mucinoso), os quais hipotetizamos que apresentarão níveis variáveis de atividade da ALDH1A126. Com o objetivo de investigar a atividade de ALDH1A1 em tumores ovarianos, um ensaio de sonda fluorogênica isoforme-seletiva foi empregado para identificar populações de ALDH1A1+ em um painel de cinco linhagens de células de câncer de ovário pertencentes aos diferentes tipos histológicos mencionados acima. As linhagens celulares testadas neste estudo incluem células BG-1, Caov-3, IGROV-1, OVCAR-3 e PEO4, cobrindo histotipos de células claras e serosas. Neste trabalho, destacou-se a versatilidade e a generalizabilidade da sonda para identificar CSCs para os pesquisadores que buscam realizar estudos semelhantes em outras linhagens de células cancerosas imortalizadas, bem como em amostras de pacientes. O uso do AlDeSense lançará luz sobre as vias bioquímicas envolvidas na manutenção da CSC em microambientes teciduais complexos e potencialmente servirá como uma ferramenta clínica para determinar o prognóstico e medir a agressividade do câncer.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Medir a atividade total de ALDH1A1 em homogeneizados de células de câncer de ovário via fluorimetria
- Descongelar 1 × 106 células num balão de cultura de células T25 em 5 ml dos seguintes meios de cultura celular:
- IGROV-1 e PEO4: meio Roswell Park Memorial Institute (RPMI) 1640 com 10% de soro fetal bovino (SFB) e 1% de penicilina/estreptomicina (P/S).
- BG-1 e Caov-3: Meio de Águia Modificado de Dulbecco (DMEM) com 10% de SFB e 1% de P/S.
- OVCAR-3: RPMI 1640 com SFB a 20%, P/S a 1% e insulina a 0,01 mg/mL.
- Manter as células numa incubadora a 37 °C e 5% CO2 durante duas a três passagens. Certifique-se de que as células não excedam 80%-90% de confluência antes da passagem.
- Tripsinizar as células em tripsina a 0,25% por 10 min, contá-las usando um contador de células automatizado e pellet 1 × 107 células por centrifugação (180 × g) a 25 °C por 5 min.
- Remova o sobrenadante cuidadosamente por aspiração, lave o pellet ressuspendendo as células em 1 mL de PBS 1x e repeletize as células por centrifugação nas mesmas condições descritas na etapa 4.
- Ressuspender as células em solução de 1x inibidor de protease em 1x PBS. Utilizar 1 ml desta solução por 2,5 × 106 células.
- Sonicar a suspensão celular sobre gelo por 2 min (pulso de 1 s, amplitude de 40%) com uma sonda homogeneizadora de células.
- Frações insolúveis/membrana em pellet por centrifugação (3.200 × g) a 25 °C por 15 min. Retire e mantenha o sobrenadante, pois este é o homogeneizado que será utilizado nas etapas subsequentes. Separe os homogeneizados em três cubetas para realizar o experimento em triplicata.
- Adicione a sonda ao homogeneizado para obter uma concentração final da sonda de 4 μM. Pipetar três vezes para cima e para baixo para misturar bem a solução.
- Medir o sinal fluorescente imediatamente após a adição e após os tempos de incubação desejados em um fluorímetro. O tempo de incubação pode ser otimizado para ver o máximo de dobra girando (1 h neste experimento). O tempo de incubação deve ser constante em todas as linhagens celulares comparadas.
- Ajuste o comprimento de onda de excitação para 496 nm.
- Ajuste a emissão para 510-600 nm.
- Defina a largura da fenda para 0,5 mm.
- Pipetar a solução para uma cubeta de quartzo de 1 mL, colocar no fluorímetro e bater varredura.
- Divida a intensidade final da fluorescência a 516 nm (comprimento de onda fluorescente máximo) pela intensidade no mesmo comprimento de onda da leitura inicial para determinar a ativação da dobra do corante seletivo de isoformas.
2. Uso de microscopia de fluorescência para obtenção de imagens de células com alta atividade de ALDH1A1
- Descongelar 1 × 106 células num frasco de cultura de células T25 em 5 ml do meio de cultura celular adequado.
- Manter as células numa incubadora a 37 °C e 5% CO2 durante duas a três passagens. Certifique-se de que as células não excedam 80%-90% de confluência antes da passagem.
- No dia anterior à imagem confocal, a placa 4 × 105 células em uma lâmina de câmara de 8 poços.
- Revestir o fundo de cada poço com poli-L-lisina (0,1 mg/mL, 100 μL por poço) por 10 min, aspirando posteriormente.
- Lave cada poço 3x adicionando água de grau de cultura celular (100 μL por poço) e aspirando.
- Tripsinizar as células em tripsina a 0,25% por 10 min, contá-las usando um contador de células automatizado e plaquear as células em 4 × 105 células por poço.
- Deixe as células se acomodarem e se fixarem durante a noite (12-16 h).
- Aspirar o meio de crescimento e adicionar o meio livre de soro (500 μL por poço), suplementado com 2 μM da sonda ou da sonda controle.
- Incubar com a sonda à temperatura ambiente durante 30 minutos e obter imagens imediatas das células.
- Ligue o microscópio confocal e ajuste para a amostra.
- Carregar a amostra cuidadosamente na menor ampliação; Encontre as células para garantir o posicionamento adequado.
- Verifique se a lente objetiva está com ampliação de 10x e localize as células.
- Para este experimento, são necessários o canal FITC (excitação: laser de 488 nm; emissão: 516-521 nm) e o canal T-PMT (luz transmitida). Localize e concentre-se nas células usando T-PMT para se concentrar no mesmo plano z durante todo o experimento para remover o viés.
- Ajuste a potência do laser e o ganho de FITC para a configuração apropriada, onde o sinal das amostras Ctrl-AlDeSense AM é minimamente detectável, enquanto ainda vê o sinal nas amostras AlDeSense AM. Cada parâmetro pode ser ajustado deslizando a barra correspondente. As configurações podem ter que ser ajustadas algumas vezes para identificar os parâmetros corretos. Uma vez otimizado, complete o resto do experimento dentro dessa linhagem celular usando parâmetros idênticos.
- Tire três imagens por poço para um total de três poços por condição de tratamento (nove imagens no total). Concentre-se no plano adequado usando T-PMT para evitar viés em vez de usar o canal de fluorescência ou a imagem mesclada.
- Processar as imagens para determinar a porcentagem de células ALDH1A1+.
- Usando software de processamento de imagem, divida o arquivo czi em diferentes canais.
- Conte o número total de células e o número total de células fluorescentes.
- Para determinar a porcentagem de células ALDH1A1+, divida o número de células fluorescentes pelo número total de células em cada imagem. É imprescindível contar da mesma forma para cada imagem sem manipular as imagens, pois, por exemplo, ajustar o brilho pode adicionar uma variável de confusão.
3. Aplicação da citometria de fluxo na identificação de células com alta atividade da ALDH1A1
- Descongelar 1 × 106 células num frasco de cultura de células T25 em 5 ml do meio de cultura celular adequado.
- Manter as células numa incubadora a 37 °C e 5% CO2 durante duas a três passagens. Certifique-se de que as células não excedam 80%-90% de confluência antes da passagem.
- Tripsinizar, contar e peltar as células em um tubo de centrífuga de 15 mL por centrifugação (180 × g) a 25 °C por 5 min.
- Ressuspender as células em 1 mL de solução de sonda de 2 μM/sonda de controle em PBS. Balançar as células à temperatura ambiente por 60 min para garantir que a exposição ao corante seja uniforme.
- Após o período de incubação, pellet as células via centrifugação (180 × g) a 25 °C por 5 min. Ressuspender as células em 0,5 mL de PBS. Execute as células através de um filtro de células (malha de nylon de 35 μm) para remover aglomerados celulares que possam obstruir o citômetro de fluxo. Coloque imediatamente as células no gelo.
- Ligue o instrumento e execute o protocolo de inicialização.
- Verifique se há líquido de bainha e resíduos vazios.
- Execute as linhas com 10% de água sanitária e água por 5 min cada.
- Execute contas de controle de qualidade para garantir o funcionamento adequado.
- Na guia configurações, selecione FSC (dispersão direta), SSC (dispersão lateral) e FITC (isotiocianato de fluoresceína) para o filtro de fluorescência.
- Desenhe os gráficos a seguir para verificar viabilidade, singletes e fluorescência. Otimizar a potência do laser (específica para o instrumento do usuário) para que as populações celulares estejam dentro dos parâmetros fornecidos para análise posterior.
- Gráfico de dispersão FSC-A versus SSC-A: a população celular principal está próxima ao centro do gráfico.
- Gráfico de dispersão FSC-A versus FSC-W: banda horizontal estreita indicativa de singlets (em vez de aglomerados celulares).
- Gráfico de dispersão FITC-A versus FSC-A: observar a distribuição das células ordenadas pela sonda de giro fluorogênico seletivo de isoformas.
- Histograma FITC-A: observar a mudança na população com base no FITC para determinar a porcentagem de células ALDH1A1+.
- Para otimizar a potência do laser FITC, execute uma amostra com a sonda de modo que a cauda direita da curva do histograma esteja próxima do sinal máximo do FITC-A. Posteriormente, execute uma amostra com a sonda de controle. Um deslocamento populacional deve ser observável para revelar a faixa dinâmica máxima. A etapa de otimização da potência do laser pode ter que ser repetida várias vezes, mas a potência do laser não deve ser alterada em todas as amostras uma vez que uma configuração tenha sido designada para um experimento.
- Execute cada amostra para 10.000 contagens (feitas em triplicata).
- Repita o passo 3.12 para cada linhagem celular, pois haverá variabilidade na captação e na atividade da ALDH1A1.
- Após a conclusão da coleta da amostra, execute as linhas com água sanitária a 10% e água por 5 min cada, em seguida, inicie o desligamento do instrumento.
- Processe os dados usando o software de citometria de fluxo e armazene a população celular desejada. Defina os portões para que todos os eventos caiam no portão ALDH1A1- ou ALDH1A1+. Usando a seleção da porta retangular, ajuste a porta ALDH1A1- de modo que >99,5% dos eventos nas amostras da sonda de controle ocorram dentro dessa comporta. As demais células serão consideradas ALDH1A1+. Essas mesmas portas podem então ser aplicadas à amostra de sonda para quantificar o número de eventos considerados ALDH1A1- e ALDH1A1+.
Access restricted. Please log in or start a trial to view this content.
Resultados
Atividade total de ALDH1A1 de homogeneizados de células cancerosas de ovário
As dobras médias para cada linhagem celular obtidas neste ensaio são: BG-1 (1,12 ± 0,01); IGROV-1 (1,30 ± 0,03); Caov-3 (1,72 ± 0,06); PEO4 (2,51 ± 0,29); e OVCAR-3 (10,25 ± 1,46) (Figura 2).
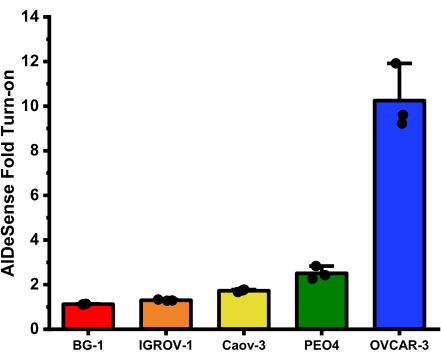
Figura 2
Access restricted. Please log in or start a trial to view this content.
Discussão
A pan-seletividade é uma limitação importante de muitas sondas ALDH; no entanto, vários exemplos de isoformas seletivas foram recentemente relatados 32,33,34,35,36,37,38,39,40,41. A s...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Divulgamos uma patente pendente (US20200199092A1) para a tecnologia AlDeSense.
Agradecimentos
Este trabalho foi apoiado pelo National Institutes of Health (R35GM133581 para JC) e pelo Cancer Center at Illinois Graduate Scholarship (concedido à SG). JC agradece à Fundação Camille e Henry Dreyfus pelo apoio. Os autores agradecem ao Dr. Thomas E. Bearrood por sua contribuição inicial para preparar estoques de AlDeSense e AlDeSense AM. Agradecemos ao Sr. Oliver D. Pichardo Peguero e ao Sr. Joseph A. Forzano por sua assistência na preparação de vários precursores sintéticos. Agradecemos ao Prof. Erik Nelson (Departamento de Fisiologia Molecular e Integrativa, UIUC) pelas células Caov-3, IGROV-1 e PEO4. Agradecemos ao Prof. Paul Hergenrother (Departamento de Química, UIUC) pelas células BG-1. Agradecemos às instalações centrais do Carl R. Woese Institute for Genomic Biology pelo acesso ao microscópio confocal Zeiss LSM 700 e ao software correspondente. Agradecemos ao Flow Cytometry Facility pelo acesso ao BD LSR II CMtO Analyzer. Agradecemos à Dra. Sandra McMasters e ao Cell Media Facility pela assistência na preparação de meios de cultura celular.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
Referências
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362(2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142(2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277(2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502(2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662(2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados