JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
알데히드 탈수소효소 1A1 활성을 기반으로 난소암 세포를 계층화하기 위한 AlDeSense 적용
* 이 저자들은 동등하게 기여했습니다
요약
살아있는 세포에서 ALDH1A1 활성을 측정하는 방법은 줄기의 바이오마커로서의 지위로 인해 암 연구에서 매우 중요합니다. 이 연구에서 우리는 5개의 난소암 세포주 패널에서 ALDH1A1 활성의 상대적 수준을 결정하기 위해 동형 선택적 형광 프로브를 사용했습니다.
초록
암 치료 후 재발은 종종 암 줄기 세포(CSC)로 알려진 종양 세포 하위 집단의 지속성에 기인하며, 이는 놀라운 종양 개시 및 자가 재생 능력을 특징으로 합니다. 종양(예: 난소)의 기원에 따라 CSC 표면 바이오마커 프로파일이 크게 달라질 수 있으므로 면역조직화학적 염색을 통해 이러한 세포를 식별하는 것은 어려운 일입니다. 반대로, 알데히드 탈수소효소 1A1(ALDH1A1)은 CSC를 포함한 거의 모든 전구 세포에서 보존된 발현 프로필로 인해 CSC를 식별하는 우수한 마커로 부상했습니다. ALDH1A1 이소형은 다양한 내인성 및 생체 이물 알데히드를 해당 카르복실산 생성물로 산화시키는 19개 효소의 슈퍼패밀리에 속합니다. Chan et al. 최근 ALDH1A1 활성 검출을 위한 동형 선택적 "턴온" 프로브인 AlDeSense와 비표적 염색을 설명하기 위한 비반응성 매칭 제어 시약(Ctrl-AlDeSense)을 개발했습니다. 이 동형 선택적 도구는 K562 골수성 백혈병 세포, 유방구 및 흑색종 유래 CSC 이종이식편에서 ALDH1A1 활성의 검출을 통해 다재다능한 화학 도구임이 이미 입증되었습니다. 이 기사에서는 5개의 난소암 세포주 패널에서 상대적인 ALDH1A1 활성을 측정하는 추가 형광 측정법, 공초점 현미경 및 유세포 분석 실험을 통해 프로브의 유용성을 보여주었습니다.
서문
암 줄기 세포(CSC)는 줄기 세포와 유사한 특성을 나타내는 종양 세포의 하위 집단입니다1. 비암성 환자와 마찬가지로 CSC는 자가 재생 및 증식 능력이 뛰어납니다. ATP 결합 카세트 수송체의 상향 조절과 같은 다른 내장 메커니즘과 함께 CSC는 종종 초기 외과적 용적축소 노력과 후속 보조 요법에서 벗어날 수 있습니다2. CSC는 치료 저항성3, 재발4 및 전이5에서 중요한 역할을 하기 때문에 암 연구에서 우선 순위가 되었습니다. CSCs6를 식별하는데 사용될 수 있는 다양한 세포 표면 항원(예: CD133)이 존재하지만, 세포질에서 발견되는 알데히드 탈수소효소(ALDH)의 효소 활성을 활용하는 것이매력적인 대안으로 떠올랐다7. ALDH는 반응성 내인성 알데히드와 생체이물성 알데히드의 산화를 촉매하는 역할을 하는 19가지 효소의 슈퍼패밀리이다8.
일반적으로 알데히드 해독은 줄기 세포의 무결성을 손상시킬 수 있는 바람직하지 않은 가교 작용과 산화 스트레스로부터 세포를 보호하는 데 중요합니다9. 또한, 1A1 이소형은 레티노산 대사를 조절하고, 이는 레틴알데히드 신호전달10을 통해 줄기에 영향을 미친다. ALDH1A1 활성을 선택적으로 검출하기 위한 소분자 활성 기반 센싱(ABS) 프로브인 AlDeSense11,12가 최근 개발되었습니다. ABS 설계는 결합 이벤트가 아닌 화학적 변화를 통해 분석물 검출을 달성하여 높은 선택성과 감소된 off-target 반응을 허용합니다13,14,15,16. 동형-선택적 형광 프로브의 설계 원리는 프로브(18)의 형광 시그니처를 억제하는 역할을 하는 알데히드 작용기에서 유래하는 도너-광유도 전자 전달(d-PeT) 소광 메커니즘(17)에 의존합니다. 카르복실산으로의 ALDH1A1 매개 전환시, 복사 이완이 잠금 해제되어 고형광 생성물을 생성한다. d-PeT 퀀칭은 결코 100% 효율적이지 않기 때문에, 광물리학적 특성(예: 양자 수율)과 세포에서 동일한 세포질 염색 패턴이 일치하는 비반응성 시약인 Ctrl-AlDeSense의 개발을 통해 이 분석을 확립할 때 위양성 결과를 초래할 수 있는 잔류 형광을 고려했습니다. 이 독특한 결합을 함께 사용하면 형광 측정, 분자 이미징 및 유세포 분석을 통해 높은 ALDH1A1 활성을 가진 세포와 낮은 수준을 나타내는 세포를 안정적으로 구별할 수 있습니다. 몇 가지 주요 이점은 전통적인 면역조직화학적 방법에 비해 동형 선택적 활성화 가능한 염료의 사용과 관련이 있습니다. 예를 들어, CSC는 종양 깊숙이 묻혀 있는 것으로 가정되며, 따라서 큰 항체에 비해 작은 분자에 더 쉽게 접근할 수 있다19. 또한, 뒤집힌 형광 제품은 세포 성분을 공유 결합으로 변형시키지 않으므로 세척 사이클을 통해 쉽게 제거하여 CSC를 변형되지 않은 상태로 유지할 수 있습니다. 마지막으로, 턴온 반응은 NAD+ 보조 인자에 의존하기 때문에 MTT 분석과 마찬가지로 생존 가능한 세포와 기능만 식별합니다.
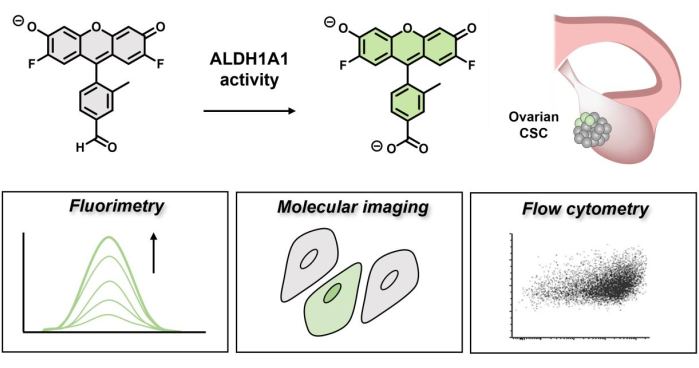
그림 1: AlDeSense의 형광등 켜짐을 보여주는 회로도. 동형 선택적 염료는 ALDH1A1에 의해 활성화되며 형광 측정, 분자 이미징 및 유세포 분석을 통해 난소암 세포에서 상승된 ALDH1A1 활성을 확인하는 데 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
과거 연구에서 동형 선택적 형광 프로브 분석은 K562 인간 만성 백혈병 세포, MDA-MB-231 인간 유방암 세포 및 B16F0 쥐 흑색종 세포의 ALDH 낮음(ALDH-) 세포에서 ALDH 높은(ALDH+) 세포를 성공적으로 계층화했습니다. 이는 많은 암 유형에서 높은 ALDH1A1 단백질 발현이 더 나쁜 임상적 예후를 의미하기 때문에 중요하다20. 이것은 ALDH1A1의 상승된 수치가 치료를 회피하고 내성을 발달시키며 몸 전체에 퍼질 수 있는 CSC를 나타내는 것으로 가정합니다. 그러나 난소 암의 경우 반대 결과를보고하는 연구가 있습니다 (높은 ALDH1A1 발현은 환자 생존율 향상과 관련이 있음)21,22,23,24. 언뜻 보기에는 모순되는 것처럼 보일 수 있지만, 발현이 반드시 효소 활성과 상관관계가 있는 것은 아니며, 이는 종양 미세 환경의 변화(예: pH 플럭스, 산소 구배), NAD+ 보조인자 또는 알데히드 기질의 가용성, 카르복실산 수준(생성물 억제) 및 효소 활성을 변경할 수 있는 번역 후 변형에 의해 영향을 받을 수 있다25 . 또한, 난소암은 5가지 주요 조직학적 유형(고등급 장액성, 저등급 장액성, 자궁내막양, 투명 세포 및 점액성)으로 나뉘며, 우리는 이러한 가설이 다양한 수준의 ALDH1A1 활성을 특징으로 할 것이라고 가정한다26. 난소 종양에서 ALDH1A1 활성을 조사하기 위해 동형 선택적 형광 프로브 분석을 사용하여 위에서 언급한 다양한 조직학적 유형에 속하는 5개의 난소암 세포주 패널에서 ALDH1A1+ 집단을 식별했습니다. 이 연구에서 테스트한 세포주에는 투명 세포 및 장액 조직형을 포함하는 BG-1, Caov-3, IGROV-1, OVCAR-3 및 PEO4 세포가 포함됩니다. 여기에서 프로브의 다양성과 일반화 가능성은 환자 샘플뿐만 아니라 다른 불멸화된 암 세포주에서 유사한 연구를 수행하려는 연구자들을 위해 CSC를 식별하기 위해 강조되었습니다. AlDeSense의 사용은 복잡한 조직 미세 환경에서 CSC 유지 관리와 관련된 생화학적 경로를 밝히고 잠재적으로 예후를 결정하고 암 공격성을 측정하기 위한 임상 도구 역할을 할 것입니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 형광 측정을 통해 난소암 세포 균질액의 총 ALDH1A1 활성 측정
- T25 세포 배양 플라스크에서 1 ×10 6 세포를 다음 세포 배양 배지 5 mL에서 해동합니다.
- IGROV-1 및 PEO4: 10% 소 태아 혈청(FBS) 및 1% 페니실린/스트렙토마이신(P/S)이 포함된 Roswell Park Memorial Institute(RPMI) 1640 배지.
- BG-1 및 Caov-3: 10% FBS 및 1% P/S를 갖는 Dulbecco의 DMEM(Modified Eagle's Medium).
- OVCAR-3: 20% FBS, 1% P/S 및 0.01mg/mL 인슐린을 함유한 RPMI 1640.
- 세포를 37°C 및 5%CO2 에서 2 내지 3 계대 동안 인큐베이터에 유지한다. 통과하기 전에 셀이 80%-90% 밀도를 초과하지 않는지 확인하십시오.
- 세포를 0.25% 트립신에서 10분 동안 트립신화하고, 자동 세포 계수기를 사용하여 계수하고, 25°C에서 5분 동안 원심분리(180 × g)를 통해 펠렛 1 ×10 7 세포를 계수합니다.
- 흡인을 통해 상청액을 조심스럽게 제거하고, 세포를 1x PBS 1mL에 재현탁하여 펠릿을 세척하고, 4단계에서 설명한 것과 동일한 조건에서 원심분리를 통해 세포를 다시 펠렛화합니다.
- 세포를 1x PBS에 1x 프로테아제 억제제 용액에 재현탁합니다. 2.5 × 106 세포 당 1mL의이 용액을 사용하십시오.
- 세포 균질화 프로브를 사용하여 2 분 (1 초 펄스, 40 % 진폭) 동안 얼음 위에서 세포 현탁액을 초음파 처리합니다.
- 25°C에서 15분 동안 원심분리(3,200 × g)를 통한 펠렛 불용성/막 분획. 상층액은 후속 단계에서 사용될 균질액이므로 제거하고 보관하십시오. 균질액을 세 개의 큐벳으로 분리하여 실험을 세 번 수행합니다.
- 프로브를 균질액에 첨가하여 4 μM의 최종 프로브 농도를 얻고, 용액을 잘 섞기 위해 상하로 세 번 피펫팅한다.
- 형광계에서 첨가 직후와 원하는 배양 시간 후에 형광 신호를 측정합니다. 배양 시간은 최대 접힘 턴온(이 실험에서 1시간)을 확인하기 위해 최적화될 수 있습니다. 배양 시간은 비교된 모든 세포주에 걸쳐 일정해야 합니다.
- 여기 파장을 496nm로 설정합니다.
- 방출을 510-600 nm로 설정하십시오.
- 슬릿 너비를 0.5mm로 설정합니다.
- 용액을 1mL 석영 큐벳에 피펫팅하고 형광계에 넣고 스캔을 누릅니다.
- 516nm에서의 최종 형광 강도(최대 형광 파장)를 초기 판독값으로부터의 동일한 파장에서의 강도로 나누어 동형 선택적 염료의 폴드 활성화를 결정합니다.
2. 높은 ALDH1A1 활성을 가진 세포를 이미지화하기 위한 형광 현미경의 사용
- T25 세포 배양 플라스크에서 1 ×10 6 세포를 적절한 세포 배양 배지 5 mL에서 해동한다.
- 세포를 37°C 및 5%CO2 에서 2 내지 3 계대 동안 인큐베이터에 유지한다. 통과하기 전에 셀이 80%-90% 밀도를 초과하지 않는지 확인하십시오.
- 공초점 이미징 전날, 플레이트 4 ×10 5 세포를 8웰 챔버 슬라이드에 넣었다.
- 각 웰의 바닥을 폴리-L-라이신(0.1mg/mL, 웰당 100μL)으로 10분 동안 코팅한 후 흡인합니다.
- 세포 배양 등급 물(웰당 100μL)을 추가하고 흡인하여 각 웰을 3배 세척합니다.
- 세포를 0.25% 트립신에서 10분 동안 트립신화하고, 자동 세포 계수기를 사용하여 계수하고, 웰당 4 × 105 세포에서 세포를 플레이트합니다.
- 세포를 침전시키고 밤새 부착하십시오 (12-16 시간).
- 성장 배지를 흡인하고 무혈청 배지(웰당 500μL)를 추가하고 2μM의 프로브 또는 대조군 프로브를 보충합니다.
- 실온에서 30분 동안 프로브와 함께 배양하고 즉시 세포를 이미지화합니다.
- 컨포칼 현미경을 켜고 샘플을 조정합니다.
- 가장 낮은 배율로 샘플을 조심스럽게 로드합니다. 적절한 위치를 보장하기 위해 셀을 찾으십시오.
- 대물 렌즈가 10x 배율인지 확인하고 세포를 찾습니다.
- 이 실험을 위해서는 FITC 채널(여기: 488nm 레이저, 방출: 516-521nm) 및 T-PMT(투과광) 채널이 필요합니다. 편향을 제거하기 위해 전체 실험에서 동일한 z-평면에 초점을 맞추기 위해 T-PMT를 사용하여 세포를 찾고 초점을 맞춥니다.
- 레이저 출력과 FITC 게인을 적절한 설정으로 조정하여 Ctrl-AlDeSense AM 샘플의 신호를 최소한으로 감지할 수 있는 동시에 AlDeSense AM 샘플에서 신호를 계속 볼 수 있습니다. 각 매개변수는 해당 막대를 밀어 조정할 수 있습니다. 올바른 매개변수를 식별하기 위해 설정을 몇 번 조정해야 할 수도 있습니다. 최적화되면 동일한 매개 변수를 사용하여 해당 세포주 내에서 나머지 실험을 완료합니다.
- 처리 조건당 총 3개의 웰에 대해 웰당 3개의 이미지를 스냅합니다(총 9개의 이미지). 형광 채널이나 병합된 이미지를 사용하는 대신 편향을 피하기 위해 T-PMT를 사용하여 적절한 평면에 초점을 맞춥니다.
- 이미지를 처리하여 ALDH1A1+ 세포의 백분율을 결정합니다.
- 이미지 처리 소프트웨어를 사용하여 czi 파일을 다른 채널로 분할합니다.
- 총 세포 수와 총 형광 세포 수를 계산합니다.
- ALDH1A1+ 세포의 백분율을 결정하려면 형광 세포 수를 각 이미지의 총 세포 수로 나눕니다. 예를 들어 밝기를 조정하면 혼란스러운 변수가 추가될 수 있으므로 이미지를 조작하지 않고 각 이미지에 대해 동일한 방식으로 계산하는 것이 중요합니다.
3. 높은 ALDH1A1 활성을 가진 세포를 식별하기 위한 유세포 분석의 적용
- T25 세포 배양 플라스크에서 1 ×10 6 세포를 적절한 세포 배양 배지 5 mL에서 해동한다.
- 세포를 37°C 및 5%CO2 에서 2 내지 3 계대 동안 인큐베이터에 유지한다. 통과하기 전에 셀이 80%-90% 밀도를 초과하지 않는지 확인하십시오.
- 트립신화, 계수 및 펠릿화하여 25°C에서 5분 동안 원심분리(180×g)를 통해 15mL 원심분리기 튜브에서 세포를 펠릿화합니다.
- PBS에서 2μM 프로브/대조군 프로브 용액 1mL에 세포를 재현탁합니다. 세포를 실온에서 60분 동안 흔들어 염료에 대한 노출이 균일한지 확인합니다.
- 배양 기간 후, 세포를 25°C에서 5분 동안 원심분리(180 × g)를 통해 펠렛화한다. 세포를 0.5mL의 PBS에 재현탁합니다. 세포 여과기(35μm 나일론 메쉬)를 통해 세포를 실행하여 유세포 분석기를 막을 수 있는 세포 덩어리를 제거합니다. 즉시 세포를 얼음 위에 놓습니다.
- 계측기를 켜고 시동 프로토콜을 실행합니다.
- 피복액과 빈 폐기물이 있는지 확인하십시오.
- 10% 표백제와 물로 각각 5분 동안 라인을 실행합니다.
- 적절한 기능을 보장하기 위해 품질 관리 비드를 실행하십시오.
- 설정 탭에서 형광 필터로 FSC(순방향 산란), SSC(측면 산란) 및 FITC(플루오레세인 이소티오시아네이트) 를 선택합니다.
- 다음 그래프를 그려 생존력, 단일항 및 형광을 측정합니다. 레이저 출력(사용자 기기에 따라 다름)을 최적화하여 세포 집단이 추가 분석을 위해 주어진 매개변수 내에 있도록 합니다.
- FSC-A 대 SSC-A 산점도: 주요 세포 집단이 그래프 중앙 근처에 있습니다.
- FSC-A 대 FSC-W 산점도: 세포 덩어리가 아닌 단일체를 나타내는 좁은 수평 밴드.
- FITC-A 대 FSC-A 산점도: isoform-selective fluorogenic turn-on probe로 분류된 세포의 분포를 관찰합니다.
- FITC-A 히스토그램: FITC를 기반으로 모집단의 이동을 관찰하여 ALDH1A1+ 세포의 백분율을 결정합니다.
- FITC 레이저 출력을 최적화하려면 히스토그램 곡선의 오른쪽 꼬리가 최대 FITC-A 신호 근처에 오도록 프로브로 샘플을 실행합니다. 그런 다음 제어 프로브로 샘플을 실행합니다. 최대 동적 범위를 나타내기 위해 인구 이동을 관찰할 수 있어야 합니다. 레이저 출력 최적화 단계는 여러 번 반복해야 할 수 있지만 실험에 대한 설정이 지정되면 샘플 전체에서 레이저 출력을 변경해서는 안 됩니다.
- 각 샘플을 10,000카운트 동안 실행합니다(세 번 수행).
- 흡수 및 ALDH1A1 활성에 가변성이 있으므로 각 세포주에 대해 3.12단계를 반복합니다.
- 샘플 수집이 완료된 후 10% 표백제와 물로 각각 5분 동안 라인을 실행한 다음 기기 종료를 시작합니다.
- 유세포 분석 소프트웨어를 사용하여 데이터를 처리하고 원하는 세포 집단을 게이트합니다. 모든 이벤트가 ALDH1A1- 또는 ALDH1A1+ 게이트에 속하도록 게이트를 설정하십시오. 직사각형 게이트 선택을 사용하여 ALDH1A1- 게이트를 설정하여 제어 프로브 샘플의 이벤트 중 >99.5%가 이 게이트 내에서 발생하도록 합니다. 나머지 세포는 ALDH1A1+로 간주됩니다. 그런 다음 이러한 동일한 게이트를 프로브 샘플에 적용하여 ALDH1A1- 및 ALDH1A1+로 간주되는 이벤트의 수를 정량화할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
결과
난소암 세포 균질액의 총 ALDH1A1 활성
이 분석으로부터 얻어진 각각의 세포주에 대한 평균 폴드 턴온은 다음과 같다: BG-1 (1.12 ± 0.01); IGROV-1 (1.30 ± 0.03); Caov-3 (1.72 ± 0.06); PEO4 (2.51 ± 0.29); 및 OVCAR-3 (10.25 ± 1.46) (그림 2).
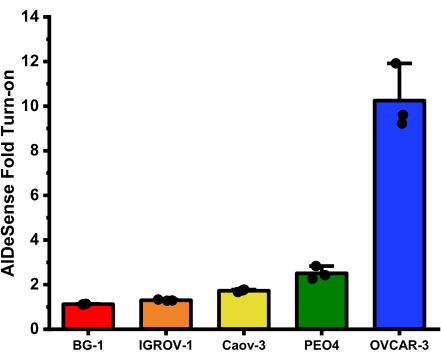
그림 2
Access restricted. Please log in or start a trial to view this content.
토론
범 선택성은 많은 ALDH 프로브의 주요 제한 사항입니다. 그러나, 몇몇 이소형-선택적인 예가 최근에 보고되었다 32,33,34,35,36,37,38,39,40,41. 이 연?...
Access restricted. Please log in or start a trial to view this content.
공개
AlDeSense 기술에 대한 출원 중인 특허(US20200199092A1)를 공개합니다.
감사의 말
이 연구는 국립 보건원 (R35GM133581에서 JC로)과 일리노이 암 센터 대학원 장학금 (SG에 수여)의 지원을 받았습니다. JC는 카밀과 헨리 드레퓌스 재단의 지원에 감사드립니다. 저자는 AlDeSense 및 AlDeSense AM의 재고 준비에 초기 기여를 한 Thomas E. Bearrood 박사에게 감사드립니다. 다양한 합성 전구체를 준비하는 데 도움을 주신 Oliver D. Pichardo Peguero 씨와 Joseph A. Forzano 씨에게 감사드립니다. Caov-3, IGROV-1 및 PEO4 세포에 대해 Erik Nelson 교수(UIUC 분자 및 통합 생리학과)에게 감사드립니다. BG-1 세포에 대해 Paul Hergenrother 교수(UIUC 화학과)에게 감사드립니다. Zeiss LSM 700 컨포칼 현미경 및 해당 소프트웨어를 이용할 수 있도록 해주신 Carl R. Woese 게놈 생물학 연구소의 핵심 시설에 감사드립니다. BD LSR II CMtO 분석기를 사용해 주신 유세포 분석 시설에 감사드립니다. 세포 배양 배지 준비에 도움을 주신 Sandra McMasters 박사와 Cell Media Facility에 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
참고문헌
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362(2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142(2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277(2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502(2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662(2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유