A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקרודיסקציה ומיקרוסקופ אלקטרונים סורק הר שלם הדמיה של מקלעת כורואיד עכבר
In This Article
Summary
מקלעת הכורואיד (CP), רקמה שלא נחקרה מספיק במדעי המוח, ממלאת תפקיד מפתח בבריאות ובמחלות של מערכת העצבים המרכזית. פרוטוקול זה מתאר טכניקת מיקרודיסקציה לבידוד CP ושימוש במיקרוסקופ אלקטרונים סורק כדי לקבל מבט כולל על המבנה התאי שלו.
Abstract
מקלעת הכורואיד (CP), מבנה וסקולרי מאוד הבולט לתוך חדרי המוח, היא אחת הרקמות הנחקרות ביותר במדעי המוח. ככל שמתברר יותר ויותר כי מבנה זעיר זה ממלא תפקיד מכריע בבריאות ובמחלות של מערכת העצבים המרכזית (CNS), יש חשיבות עליונה לנתח כראוי את ה- CP מתוך חדרי המוח באופן המאפשר עיבוד במורד הזרם, החל מניתוח פונקציונלי ועד ניתוח מבני. כאן מתואר בידוד של CP עכבר המוח הצידי והרביעי ללא צורך בכלים או ציוד מיוחדים. טכניקת בידוד זו משמרת את הכדאיות, התפקוד והמבנה של תאים בתוך CP. בשל כלי הדם הגבוהים שלו, ניתן לדמיין את CP צף בתוך חללי החדרים במוח באמצעות מיקרוסקופ דו-עיני. עם זאת, זילוח קרום הלב הדרוש לניתוח במורד הזרם יכול לסבך את זיהוי רקמת CP. בהתאם לשלבי העיבוד הנוספים (למשל, RNA וניתוח חלבונים), ניתן לפתור זאת על ידי הדמיה של CP באמצעות זילוח קרום הלב עם ברומופנול כחול. לאחר בידוד, CP יכול להיות מעובד באמצעות מספר טכניקות, כולל RNA, חלבון, או ניתוח תא בודד, כדי לקבל הבנה נוספת על הפונקציה של מבנה המוח המיוחד הזה. כאן, מיקרוסקופ אלקטרונים סורק (SEM) על כל הר CP משמש כדי לקבל תצוגה כוללת של המבנה.
Introduction
מחסומים הדוקים מפרידים בין מערכת העצבים המרכזית (CNS) לבין הפריפריה, כולל מחסום הדם-מוח (BBB) ומחסום הדם-מוח השדרתי (CSF). מחסומים אלה מגנים על מערכת העצבים המרכזית מפני עלבונות חיצוניים ומבטיחים מיקרו-סביבה מאוזנת ומבוקרת 1,2,3. בעוד BBB נחקר בהרחבה לאורך זמן, מחסום הדם-CSF הממוקם במקלעת הכורואיד (CP) רק זכה להתעניינות מחקרית גוברת במהלך העשור האחרון. המחסום האחרון הזה נמצא בארבעת חדרי המוח (איור 1A, B), והוא מאופיין על-ידי שכבה אחת של תאי אפיתל מקלעת כורואיד (CPE) המקיפה סטרומה מרכזית, נימים דולפים, פיברובלסטים ואוכלוסיית תאים לימפואידים ומיאלואידים (איור 1C)4,5,6. תאי ה-CPE מחוברים היטב זה לזה על ידי צמתים הדוקים, ובכך מונעים דליפה מנימי הדם המוגנים הבסיסיים לתוך CSF והמוח. בנוסף, ההובלה על פני תאי CPE מווסתת על ידי מספר מערכות הובלה פנימה והחוצה המנהלות את זרם התרכובות המועילות (למשל, חומרים מזינים והורמונים) מהדם ל- CSF ואת זרם המולקולות המזיקות (למשל, פסולת מטבולית, מוליכים עצביים עודפים) בכיוון השני 1,6. כדי להיות מסוגלים להפעיל את פונקציית ההובלה הפעילה שלהם, תאי CPE מכילים מיטוכונדריה רבים בציטופלסמהשלהם 7. יתר על כן, CP הוא המקור העיקרי של CSF ופועל כשומר הסף של המוח על ידי נוכחות של תאים דלקתיים תושב1. בשל מיקומו הייחודי בין הדם למוח, CP נמצא גם במיקום מושלם לביצוע מעקב חיסוני8.
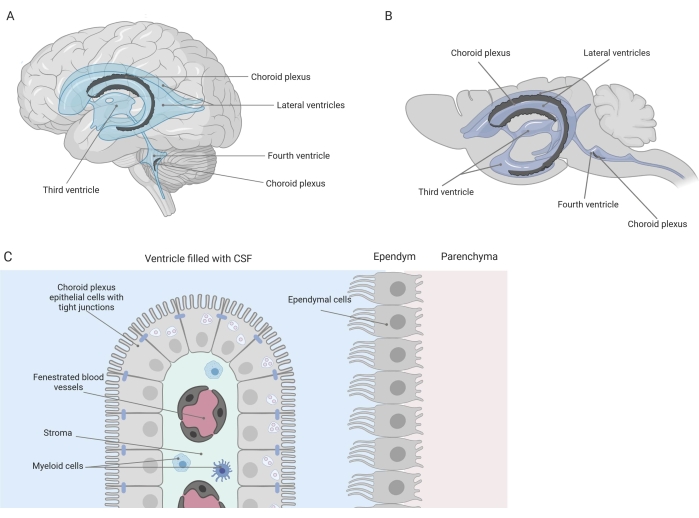
איור 1: סקירה סכמטית של המיקום וההרכב של מקלעת הכורואיד (CP). (A,B) רקמת CP נמצאת בשני החדרים הצדיים, השלישי והרביעי של (A) מוח אנושי ו-(B) מוח עכבר. (C) רקמת ה-CP מורכבת משכבה אחת של תאי אפיתל CPE (CPE) קובואידים המחוברים זה לזה באופן הדוק, המקיפים נימים מוגנים, רקמת חיבור רופפת ותאי לימפה ומיאלואידים, ויוצרת את מחסום נוזל הדם-המוח השדרה (מותאם ושונה מהפניה23). איור שנוצר באמצעות Biorender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
במהלך העשור האחרון, ראיות הולכות וגדלות, כולל מספר דוחות מקבוצת המחקר שלנו, גילו כי CP ממלא תפקיד מרכזי בבריאות ובמחלות 9,10,11,12,13,14,15,16,17,18 . לדוגמה, ידוע כי מחסום הדם-CSF המזדקן מציג שינויים מורפולוגיים, בין היתר, בגרעינים, מיקרוווילי ובקרום המרתף 1,19. בנוסף, בהקשר של מחלת אלצהיימר, שלמות המחסום הכללית נפגעת וכל השינויים הקשורים לגיל נראים בולטים עוד יותר 1,8,20. בנוסף לשינויים מורפולוגיים, התמלול, הפרוטאום וההפרשה של CP משתנים במהלך מחלה 12,21,22,23. לפיכך, ידע מתקדם של CP הוא חיוני כדי להבין טוב יותר את תפקידו במחלות נוירולוגיות ואולי לפתח אסטרטגיות טיפוליות חדשות.
שיטה יעילה למיקרודיסקציה מדויקת של CP מחוץ לחדרי המוח היא הצעד הראשון שלא יסולא בפז כדי לאפשר חקירה נכונה של מבנה המוח הזעיר הזה. בשל אופיו הווסקולרי מאוד (איור 2B), ניתן לזהות את ה-CP שצף בתוך חללי החדרים במוח באמצעות מיקרוסקופ דו-עיני. אולם לעתים קרובות נדרש זילוח טרנסקרדיאלי לניתוח במורד הזרם, מה שמסבך את הזיהוי והבידוד הנכונים של רקמת ה-CP (איור 2C). אם שלבי העיבוד הנוספים מאפשרים (למשל, במקרה של ניתוח רנ"א וחלבונים), ניתן לדמיין את ה-CP באמצעות זילוח טרנסקרדיאלי עם ברומופנול כחול (איור 2A). מספר פרסומים כבר מתארים את בידודו של ה-CP ממוחות של עכברוש24 ועכבר25. כאן מתוארת טכניקת בידוד מיקרודיסקציה כדי לבודד את ה-CP מעכברים בוגרים. חשוב לציין שטכניקת בידוד זו משמרת את הכדאיות, התפקוד והמבנה של התאים בתוך ה-CP. הבידוד של ה-CP הצף בחדרים הרביעי והצידי מתואר כאן. בקיצור, העכברים מורדמים סופנית, ואם יש צורך, מחוררים טרנסקרדילית. עם זאת, יש לציין כי זילוח יכול לפגוע במבנה התאים בתוך CP. כתוצאה מכך, אם יש לנתח את הדגימה באמצעות מיקרוסקופ אלקטרונים תמסורת (TEM), מיקרוסקופ אלקטרונים לסריקת פנים בלוק טורי (SBF-SEM), או קרן יונים ממוקדת SEM (FIB-SEM), אין לבצע זילוח. לאחר מכן, המוח כולו מבודד, ומלקחיים משמשים כדי לחצות את המוח. מכאן, ניתן לזהות ולנתח את ה-CPs הצפים בחדרים הצדיים, בעוד שניתן לבודד את ה-CP מהחדר הרביעי מהצד הקטן של המוח.

איור 2: הדמיה של מקלעת כורואיד החדר הצידית (C-C) הרביעית ו-(D-F) הצידית (CP) לאחר (A,D) זילוח כחול ברומופנול, (B,E) ללא זילוח, ו-(C,F) זילוח עם PBS/הפרין. התמונות מצולמות במיקרוסקופ סטריאו (הגדלה של 8x-32x). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
ברגע שה-CP מנותח כראוי מחדרי המוח, ניתן ליישם רפרטואר שלם של טכניקות כדי להשיג הבנה נוספת על תפקודו של מבנה זה. לדוגמה, ניתן לבצע ציטומטריית זרימה או ריצוף RNA של תא בודד כדי לכמת ולנתח פנוטיפית את תאי הדלקת החודרים בתנאי מחלה מסוימים26,27. בנוסף להרכב התאי, ניתן לנתח את ההרכב המולקולרי של CP כדי להעריך את נוכחותם של ציטוקינים וכימוקינים באמצעות בדיקת אימונוסורבנט מקושרת אנזימים (ELISA), אימונובלוט, או באמצעות ניתוח סימולטני של ציטוקינים מרובים באמצעות מערך חרוזי ציטוקינים28. יתר על כן, ניתן לבצע ניתוחי שעתוק, כלי דם, היסטולוגיה של תאי מערכת החיסון והפרשה על צמחי CP מנותחיםבמיקרו 29. כאן, מיקרוסקופ אלקטרונים סורק (SEM) על כל הר CP משמש כדי לקבל תצוגה כוללת של מבנה CP. SEM משתמש באלומה של אלקטרונים ממוקדים כדי לסרוק על פני השטח וליצור תמונה של הטופוגרפיה וההרכב של המשטח. מכיוון שאורך הגל של אלקטרונים קטן בהרבה מזה של האור, הרזולוציה של SEM היא בתחום הננומטרי ועדיפה על זו של מיקרוסקופ אור. כתוצאה מכך, מחקרים מורפולוגיים ברמה התת-תאית יכולים להתבצע באמצעות SEM. בקצרה, CP מנותח מועבר מיד לתוך קיבוע המכיל גלוטראלדהיד עבור קיבוע לילה, ואחריו osmication ו uranyl אצטט צביעה. הדגימות מטופלות לאחר מכן בכתם אספרטט עופרת, מיובשות ובסופו של דבר מוטמעות להדמיה.
לפיכך, פרוטוקול זה מאפשר בידוד יעיל של CP מחדרי המוח של העכבר, אשר ניתן לנתח עוד יותר באמצעות מגוון רחב של טכניקות במורד הזרם כדי לחקור את המבנה והתפקוד שלה.
Protocol
כל הניסויים בבעלי חיים המתוארים במחקר זה נערכו על פי החקיקה הלאומית (החוק הבלגי 14/08/1986 ו- 22/12/2003, הצו המלכותי הבלגי 06/04/2010) והחקיקה האירופית (הנחיות האיחוד האירופי 2010/63/EU, 86/609/EEC). כל הניסויים בעכברים ובפרוטוקולים של בעלי חיים אושרו על ידי ועדת האתיקה של אוניברסיטת גנט (מספרי היתרים LA1400091 ו- EC 2017-026).
1. הכנה
- חומרי הרדמה: הכינו חומר הרדמה סופני. לדוגמה, ניתן להכין תמיסת נתרן פנטוברביטל (≥100 מ"ג/ק"ג) במי מלח חוצצי פוספט (PBS).
- תמיסת זילוח לב: הכינו 10 מ"ל (לכל עכבר) של תמיסת PBS/הפרין (המכילה 0.2% הפרין) בתוספת 0.5% ברומופנול כחול.
הערה: אם שלבי העיבוד במורד הזרם מאפשרים (למשל, במקרה של ניתוח RNA וחלבונים), ניתן לדמיין את מקלעת הכורואיד (CP) באמצעות זילוח טרנסקרדיאלי עם ברומופנול כחול. אם ברומופנול כחול אינו תואם לשלבי עיבוד נוספים (למשל, להדמיה), השתמש PBS/הפרין כדי לנקב. - הכן את הפתרונות הדרושים לניתוח SEM.
- הכינו חיץ Na-cacodylate בנפח 0.1 מ' (pH 7.4). הכינו תמיסה של 2% פרפורמאלדהיד ו-2.5% גלוטראלדהיד במאגר Na-cacodylate 0.1 M. הפוך 20 מ"ל של פתרון זה לכל דגימה.
- הכינו 2% אוסמיום טטרוקסיד בחיץ Na-cacodylate 0.1 M (5 מ"ל לדגימה).
- הכינו פתרונות EtOH של 50%, 70%, 85% ו-100%. הכינו 5 מ"ל מכל תמיסת EtOH לדגימה.
2. מיקרודיסקציה של מקלעת הכורואיד מתוך החדר הלטרלי והרביעי
הערה: במחקר זה נעשה שימוש בעכברי C57BL/6 נקבות בנות 9 שבועות. עם זאת, טכניקת הבידוד המתוארת אינה תלויה במתח, מין וגיל של העכבר הבוגר.
- בודדו את מוח העכבר.
- הזרקה תוך צפקית מנה קטלנית של ברביטוראט קצר טווח (>100 מ"ג/ק"ג, מוכן בשלב 1.1) באמצעות מחט 26G כדי להרדים את העכבר סופנית. בדוק את רפלקס כף הרגל של העכבר על ידי צביטת כפו האחורית במלקחיים.
- כאשר אין רפלקס כף הרגל, הניחו את בעל החיים המורדם הסופנית במצב דקוביטוס גבי וקבעו את העכבר על ידי הצמדת הגפיים לצלחת.
הערה: אם אין צורך בזילוח טרנסקרדיאלי של העכברים, בהתאם לשיטת הניתוח במורד הזרם (למשל, עבור הדמיית SEM), המשך לשלב 2.1.7. עם זאת, אם יש צורך בזילוח כדי להסיר תאי דם או רכיבים אחרים בדם, CP ניתן לדמיין כמו מבנה כחול צף בחדרי המוח באמצעות זילוח עם ברומופנול כחול. - לחטא את החזה על ידי ריסוס 70% אתנול. מניחים וילון סטרילי סביב אזור הניתוח. בצע חתך של ~ 4 ס"מ ממש מתחת לסרעפת באמצעות להב כירורגי מפלדת פחמן (ראה טבלת חומרים).
- לפתוח את העור ולחשוף את החזה באמצעות מספריים כירורגיים. חותכים את הסרעפת פתוחה לחלוטין.
- הפרידו את בית החזה כדי לחשוף את הריאות ואת הלב הפועם.
- יש לנקב את העכברים ב-10 מ"ל של תמיסת הזילוח בקצב של 4.5 מ"ל/דקה, באמצעות משאבת זילוח (ראו טבלת חומרים). הזילוח ייקח ~ 2 דקות. הכנס מחט 26G לחדר השמאלי כדי לשאוב את התמיסה לתוך המעגל המערכתי. בנוסף, לבצע חתך עם מספריים כירורגיים באטריום הימני, כך הדם יכול לצאת מתוך מחזור הדם.
הערה: משאבת זילוח עדיפה על פני ניהול ידני של הנוזל, מכיוון שהיא תעביר את הנוזלים בקצב מתוכנת מדויק ותבטיח שכוחות הגזירה הנגרמים על ידי הזילוח אינם חזקים מדי. כוחות גזירה מוגזמים יפגעו בכדאיות ובמבנה התאים בתוך המחסום. בנוסף, קצב זרימת הזילוח המומלץ כאן הוא אופטימלי לניקוב עכברים בוגרים מגיל 7 שבועות ואילך. אם משתמשים בעכברים צעירים יותר, יש להשתמש בקצב זרימה נמוך יותר. חשוב גם לטפוח את הדם שיוצא מהאטריום הימני על מנת לשמור על אתר ניתוח נקי. - ערפו את ראשו של העכבר.
הערה: היזהר לחתוך את הראש נמוך ככל האפשר לכתף כדי לשמור על מבנה המוח. אם החתך גבוה מדי, המוח הקטן יכול להיפגע. - לאחר עריפת הראש, יש לפתוח את הקרקפת על ידי ביצוע חתך בין האוזניים לעליון על העיניים. משוך את העור לרוחב כדי לחשוף את הגולגולת. לאחר מכן, פתח את הגולגולת על ידי ביצוע התפרים הקשקשיים, לכיוון חלק האף.
הערה: חשוב להסיר בעדינות את הגולגולת כדי לשמור על שלמות המוח. - הניחו את המוח בצלוחית פטרי קרה כקרח והוסיפו 1 מ"ל של PBS 1x קר כקרח על רקמת המוח.
הערה: אין צורך בציפוי של המנה.
- בודדו את ה-CP הצף בחדר הרביעי.
- חתכו בעדינות את המוח הקטן מהמוח בעזרת אזמל. המוח הקטן הוא החלק הגדול ביותר במוח, בעוד המוח הקטן הוא חלק קטן בהרבה בחלק האחורי של המוח. במידת הצורך, הסר את חלקי רקמת גזע המוח שנותרו מהמוח הקטן.
- סובבו את המוח כך שקו החיתוך פונה כלפי מעלה. ודא כי חלל החדר הרביעי נראה כעת באמצע הקטע, כאשר ה- CP צף באתר הגב. במידת הצורך, לפתוח את החדר קצת על ידי משיכת רקמת החיבור עם מלקחיים חדים. בדרך זו, CP יהיה גלוי יותר וקל יותר להגיע.
- תלשו בעדינות את המחסום מדופן החדר באמצעות מלקחיים זעירים וחדים.
הערה: חשוב רק לגעת ולהוציא את CP בשלב זה על מנת לא לזהם את הדגימה עם הרקמה שמסביב. פתיחת החדרים כמתואר בשלב 2.2.2 תקל על שלב 2.2.3.
- בודד את ה- CP הבולט מהחדר הצידי.
- השתמשו במלקחיים זעירות וחדות כדי לחתוך את המוח לשתי המיספרות.
- סובבו את המוח כך שקו החיתוך פונה כלפי מעלה. כדי לחשוף את החדר הצידי, למשוך בעדינות את קליפת המוח מן התלמוס.
- משכו את ההיפוקמפוס לקו החיתוך האמצעי. החדר הצידי נראה כעת כאשר ה- CP שוכב בתחתית החדר. במידת הצורך, לפתוח את החדר קצת על ידי משיכת רקמת החיבור עם מלקחיים חדים. בדרך זו, CP יהיה גלוי יותר וקל יותר להגיע.
- השתמשו במלקחיים זעירות וחדות כדי לתלוש בעדינות את המחסום מדופן החדר.
הערה: חשוב רק לגעת ולהוציא את ה-CP בשלב זה על מנת לא לזהם את הדגימה ברקמה שמסביב. פתיחת החדרים כמתואר בשלב 2.3.4 תקל על שלב 2.3.5. השתמש בזהירות הנדרשת בשלב זה כדי לשמר את מבנה ה- CP ככל האפשר. הכי קל להתחיל למשוך את ה-CP בכיוון הרוסטרלי לכיוון הקאודלי.
3. ניתוח מורפולוגי של רקמת CP באמצעות מיקרוסקופ אלקטרונים סורק (SEM)
זהירות: תמיסות רעילות משמשות בשלבי העיבוד הבאים. מומלץ לבצע את הכנת הדגימה במכסה אדים.
- בצע הכנה לדוגמה עבור SEM כמתואר להלן.
- העבירו את ה-CP המבודד הטרי לתמיסת קיבוע טרייה המכילה 2% פרפורמאלדהיד ו-2.5% גלוטראלדהיד במאגר Na-cacodylate 0.1 M (pH 7.4). לדגור לילה ב 4 °C (75 °F).
הערה: מכיוון שרקמת CP שברירית ודקה מאוד, יש לשים את הרקמה בסלסילות דגימה קטנות (ראה טבלת חומרים) כדי להעביר אותה בין חוצצים. בדרך זו, מבנה הרקמה יישמר טוב יותר. קיבוע מבוסס קקודילט משמש על פני קיבוע מבוסס PBS, כמו חיץ cacodylate חזק יכול להתמודד עם pH נמוך של glutaraldehyde ב EM fixative. - שטפו את הדגימה 3x במשך 5 דקות כל אחד עם 3-5 מ"ל של 0.1 M Na-cacodylate buffer (pH 7.4).
- לאחר תיקון הדגימות ב 3-5 מ"ל של 2% osmium tetroxide ב 0.1 M Na-cacodylate חיץ במשך 30 דקות. לשטוף את הדגימות 3x במשך 5 דקות כל אחד עם 3-5 מ"ל של מים טהורים במיוחד.
- יש לייבש את הדגימות בסדרה של תמיסות קרות כקרח של ריכוז EtOH עולה (50%, 70%, 85%, 100%), למשך 15 דקות לכל תמיסת EtOH. השתמשו במייבש כביסה נקודתי קריטי כדי לייבש את הדגימה כראוי.
הערה: מעבר משלב הנוזל לשלב הגז משפיע על מתח פני השטח וגורם נזק למבנה פני השטח. שלב ייבוש הנקודה הקריטית מאפשר שימור מבנה פני השטח. - מקם את הדגימה בזהירות על תושבת דגימה המסופקת עם מדבקת פחמן (ראה טבלת חומרים).
- מצפים את הדגימות בשכבה דקה (2-5 ננומטר) של פלטינה. לשם כך, הרכיבו מקור פלטינה במערכת ואקום בין שני הדקים חשמליים בעלי זרם גבוה וחממו את הפלטינה לטמפרטורת האידוי שלה. זרם דק של פלטינה מופקד על הדגימה.
הערה: פרוטוקול מפורט יותר עבור שלב זה מסופק בהפניה30. מלבד פלטינה, זהב או זהב / פלדיום יכול לשמש גם.
- העבירו את ה-CP המבודד הטרי לתמיסת קיבוע טרייה המכילה 2% פרפורמאלדהיד ו-2.5% גלוטראלדהיד במאגר Na-cacodylate 0.1 M (pH 7.4). לדגור לילה ב 4 °C (75 °F).
- הצג באופן חזותי את דוגמאות CP באמצעות SEM (ראה טבלת חומרים). הליך ההדמיה של רקמת CP באמצעות SEM דומה לזה של סוגים אחרים של רקמות ותלוי בתוכנה ובמכשירים המשומשים. פרוטוקול SEM שלב אחר שלב עם סרטון נלווה זמין בהפניה31 או בהפניה30.
תוצאות
הפרוטוקול המתואר מאפשר בידוד יעיל של CP מהמוח הצידי של העכבר (איור 2A-C) ומהחדר הרביעי (איור 2D-F). לאחר בידוד המוח כולו, מלקחיים משמשים כדי לחצות את המוח ולזהות את CPs צפים בחדרים הצדיים. CP מהחדר הרביעי יכול להיות מבודד מן הצד cer...
Discussion
כאן מתוארת שיטה לבידוד מקלעת הכורואיד (CP) מהחדר הצידי ומהחדר הרביעי במוח עכבר. כל שיטת הרכבה זו של CP מאפשרת ניתוח נוסף באמצעות רפרטואר של טכניקות כדי לקבל תצוגה מלאה של המורפולוגיה של CP, הרכב התא, תעתוק, פרוטאום והפרשה. ניתוחים כאלה חיוניים כדי להשיג הבנה טובה יותר של המבנה המדהים הזה הבולט ?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הבלגית לחקר האלצהיימר (SAO; מספר פרויקט: 20200032), קרן המחקר פלנדריה (FWO Vlaanderen; מספרי הפרויקט: 1268823N, 11D0520N, 1195021N) וקרן Baillet Latour. אנו מודים ל-VIB BioImaging Core על ההכשרה, התמיכה והגישה לפארק המכשירים.
Materials
| Name | Company | Catalog Number | Comments |
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
References
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer's disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer's disease. Journal of Alzheimer's Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer's disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved