このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マイクロダイセクションとホールマウント走査型電子顕微鏡によるマウス脈絡叢の可視化
要約
神経科学で十分に研究されていない組織である脈絡叢(CP)は、中枢神経系の健康と病気に重要な役割を果たしています。このプロトコルは、CPを単離するためのマイクロダイセクション技術と、その細胞構造の全体像を得るための走査型電子顕微鏡の使用について説明しています。
要約
脈絡叢(CP)は、脳の心室に突き出た高度に血管新生した構造であり、神経科学で最も研究されていない組織の1つです。この小さな構造が中枢神経系(CNS)の健康と病気に重要な役割を果たしていることがますます明らかになるにつれて、機能解析から構造解析に至るまで、下流の処理を可能にする方法で脳室からCPを適切に解剖することが最も重要です。ここでは、特殊なツールまたは機器を必要としない側脳室および第4脳室マウスCPの単離について説明する。この単離技術は、CP内の細胞の生存率、機能、および構造を維持します。その高い血管新生のために、CPは双眼顕微鏡を使用して脳の心室腔内に浮かんでいるのを視覚化することができる。しかしながら、下流の分析に必要な経心的灌流は、CP組織の同定を複雑にする可能性がある。さらなる処理ステップ(RNAおよびタンパク質分析など)に応じて、これはブロモフェノールブルーとの経心灌流 を介して CPを視覚化することによって解決することができる。単離後、CPは、RNA、タンパク質、または単一細胞分析を含むいくつかの技術を使用して処理され、この特別な脳構造の機能についてさらに理解することができます。ここでは、マウントCP全体の走査型電子顕微鏡(SEM)を使用して、構造の全体像を把握します。
概要
タイトなバリアは、血液脳関門(BBB)や血液脳脊髄液(CSF)バリアなど、中枢神経系(CNS)を末梢から分離します。これらの障壁は、CNSを外部の侮辱から保護し、バランスのとれた制御された微小環境を保証します1,2,3。BBBは時間をかけて広く研究されてきましたが、脈絡叢(CP)にある血液CSFバリアは、過去10年間で研究の関心が高まっています。この後者の障壁は、脳の4つの脳室に見られ(図1A、B)、中心間質、漏出毛細血管、線維芽細胞、およびリンパ系および骨髄系細胞集団を取り巻く脈絡叢上皮(CPE)細胞の単層によって特徴付けられます(図1C)4,5,6 .CPE細胞はタイトジャンクションによってしっかりと相互接続されているため、下にある開窓毛細血管からCSFと脳への漏れを防ぎます。さらに、CPE細胞を横切る輸送は、血液からCSFへの有益な化合物(例えば、栄養素およびホルモン)の流入および有害分子(例えば、代謝廃棄物、過剰な神経伝達物質)の流出を他の方向へ管理する多数の内向きおよび外向き輸送システムによって調節される1,6。CPE細胞は、その能動輸送機能を発揮するために、細胞質内に多数のミトコンドリアを含む7。さらに、CPはCSFの主な供給源であり、常在する炎症細胞の存在によって脳のゲートキーパーとして機能します1。血液と脳の間のその独特の位置のために、CPはまた、免疫監視を実行するのに最適な位置にあります8。
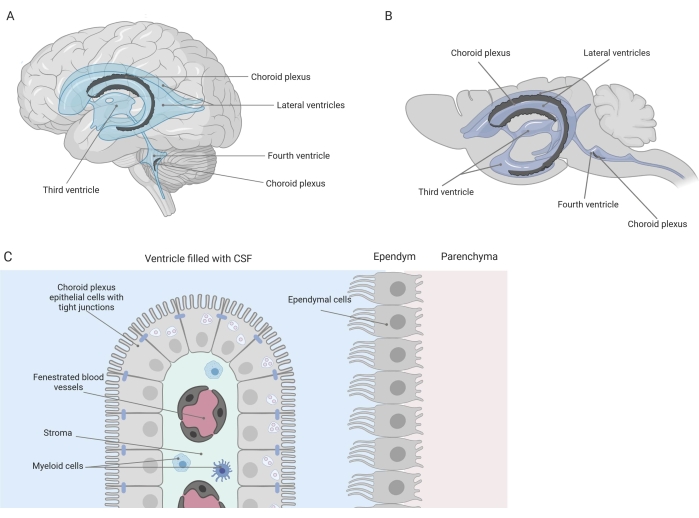
図1:脈絡叢(CP)の位置と組成の概略概要 。 (A,B)CP組織は、(A)ヒトおよび(B)マウス脳の2つの側方脳室、第3脳室、および第4脳室内に見出される。(C)CP組織は、開窓毛細血管、緩い結合組織、リンパ系および骨髄系細胞を取り囲む緊密に接続された直方体CP上皮(CPE)細胞の単層からなり、血液脳脊髄液バリアを形成する(参考文献23から適応および修正)。Biorender.com で作成した図。 この図の拡大版を表示するには、ここをクリックしてください。
過去10年間で、私たちの研究グループからのいくつかの報告を含むますます多くの証拠が、CPが健康と病気の中心的な役割を果たしていることが明らかになりました9,10,11,12,13,14,15,16,17,18 .例えば、老化した血液-CSFバリアは、とりわけ、核、微絨毛、および基底膜に形態学的変化を示すことが知られている1,19。さらに、アルツハイマー病の状況では、全体的なバリアの完全性が損なわれ、これらの加齢に伴う変化はすべてさらに顕著であるように見えます1、8、20。形態学的変化に加えて、CPのトランスクリプトーム、プロテオーム、およびセクレトームは、疾患12、21、22、23の間に変化します。したがって、CPの高度な知識は、神経疾患におけるCPの役割をよりよく理解し、新しい治療戦略を開発するために不可欠です。
脳室からのCPの正確なマイクロダイセクションのための効率的な方法は、この小さな脳構造の適切な調査を可能にする最初の貴重なステップです。その高度に血管新生した性質(図2B)のために、脳の心室腔内に浮かぶCPは双眼顕微鏡を使用して識別することができます。しかし、下流の分析には経心灌流が必要になることが多く、CP組織の適切な同定と分離が複雑になります(図2C)。さらなる処理ステップが許す場合(例えば、RNAおよびタンパク質分析の場合)、CPはブロモフェノールブルーによる経心灌流 を介して 視覚化することができる(図2A)。いくつかの刊行物は、ラット24 およびマウス仔の脳25からのCPの単離を既に記載している。ここでは、成体マウスからCPを単離するための微小解剖単離技術について説明する。重要なことに、この単離技術は、CP内の細胞の生存率、機能、および構造を維持します。ここでは、第4脳室および側脳室に浮遊するCPの単離について説明する。要するに、マウスは終末麻酔され、必要に応じて経心灌流される。しかしながら、灌流はCP内の細胞の構造を損傷する可能性があることに注意すべきである。したがって、透過型電子顕微鏡(TEM)、シリアルブロック面走査電子顕微鏡(SBF-SEM)、または集束イオンビームSEM(FIB-SEM)を使用してサンプルを分析する場合は、灌流を実行しないでください。次に、脳全体を隔離し、鉗子を使用して脳を矢状に半解します。ここから、側脳室に浮遊するCPを特定して解剖し、第4脳室のCPを脳の小脳側から分離することができます。

図2:(A,D)ブロモフェノールブルー灌流後の(A-C)第4および(D-F)側脳室脈絡叢(CP)の可視化、(B,E)灌流なし、および(C,F)PBS /ヘパリンによる灌流。 画像は実体顕微鏡(8倍〜32倍の倍率)で撮影されます。 この図の拡大版を表示するには、ここをクリックしてください。
CPが脳室から適切に解剖されると、この構造の機能についてさらに理解するために、技術のレパートリー全体を適用することができます。例えば、フローサイトメトリーまたはシングルセルRNAシーケンシングは、特定の疾患条件下で浸潤炎症細胞を定量および表現型的に分析するために行うことができる26、27。細胞組成に加えて、CPの分子組成を分析して、酵素結合免疫吸着アッセイ(ELISA)、イムノブロット を介して 、またはサイトカインビーズアレイ28を用いた複数のサイトカインの同時分析を通じて、サイトカインおよびケモカインの存在を評価することができる。さらに、トランスクリプトーム、血管、免疫細胞組織学、およびセクレトーム解析は、微小解剖されたCP外植片29に対して行うことができる。ここでは、CP全体のマウントCP上の走査型電子顕微鏡(SEM)を使用して、CP構造の全体像を取得します。SEMは、集束された電子のビームを使用して表面をスキャンし、表面の地形と組成の画像を作成します。電子の波長は光よりもはるかに小さいため、SEMの分解能はナノメートル範囲であり、光学顕微鏡よりも優れています。その結果、細胞内レベルでの形態学的研究は SEMを介して 行うことができる。 簡単に言えば、解剖されたCPは、一晩固定するためにグルタルアルデヒド含有固定液に直ちに移され、続いてオスミケーションおよび酢酸ウラニル染色が行われる。次に、サンプルをアスパラギン酸鉛染色で処理し、脱水し、最終的にイメージング用に埋め込みます。
したがって、このプロトコルは、マウス脳室からのCPの効率的な単離を容易にし、その構造および機能を調査するために様々な下流技術を用いてさらに分析することができる。
プロトコル
この研究に記載されているすべての動物実験は、国内(ベルギー法14/08/1986および22/12/2003、ベルギー王室令06/04/2010)および欧州法(EU指令2010/63 / EU、86/609 / EEC)に従って実施されました。マウスおよび動物プロトコルに関するすべての実験は、ゲント大学の倫理委員会によって承認されました(許可番号LA1400091およびEC 2017-026)。
1. 事前準備
- 麻酔薬:終末麻酔薬を準備します。例えば、リン酸緩衝生理食塩水(PBS)中のペントバルビタールナトリウム(≥100 mg / kg)溶液を調製することができます。
- 経心灌流溶液:0.5%ブロモフェノールブルーを添加したPBS /ヘパリン(0.2%ヘパリンを含む)溶液10 mL(マウスあたり)を準備します。.
注:下流の処理ステップで可能な場合(RNAおよびタンパク質分析など)、脈絡叢(CP)はブロモフェノールブルーによる経心灌流 を介して 視覚化できます。ブロモフェノールブルーが以降の処理ステップ(イメージングなど)と互換性がない場合は、PBS /ヘパリンを使用して灌流します。 - SEM分析に必要な溶液を準備します。
- 0.1 MNa-カコジル酸緩衝液(pH 7.4)を調製します。2%パラホルムアルデヒドと2.5%グルタルアルデヒドを0.1 M Na-カコジル酸緩衝液に溶解した溶液を調製します。サンプルごとにこの溶液を20 mLにします。
- 0.1 M Na-カコジル酸バッファー(サンプルあたり5 mL)で2%四酸化オスミウムを調製します。
- 50%、70%、85%、および100%のEtOH溶液を調製します。サンプルごとに5 mLの各EtOH溶液を調製します。
2.側脳室および第四脳室からの脈絡叢の微小解剖
注:この研究では、雌の9週齢のC57BL / 6マウスを使用しました。しかしながら、記載された単離技術は、成体マウスの系統、性別、および年齢とは無関係である。
- マウスの脳を分離します。
- 致死量の短時間作用型バルビツール酸塩(>100 mg / kg、ステップ1.1で調製)を26G針を使用して腹腔内注射し、マウスを最終麻酔します。.マウスの後足を鉗子でつまんで、マウスの足の反射を確認します。
- 足の反射がない場合は、終末麻酔を受けた動物を背側褥瘡位置に置き、手足を皿に固定してマウスを固定します。
注:マウスの経心灌流が必要ない場合は、下流の分析方法(SEMイメージングなど)に応じて、ステップ2.1.7に進みます。しかし、血液中の血球やその他の成分を除去するために灌流が必要な場合は、ブロモフェノールブルーとの灌流 を介して 脳室に浮遊する青色構造としてCPを視覚化できます。 - 70%エタノールをスプレーして胸部を消毒します。手術領域の周りに滅菌ドレープを置きます。炭素鋼製の外科用ブレードを使用して、横隔膜のすぐ下に~4cmの切開を行います( 材料の表を参照)。
- 皮膚を開き、外科用ハサミを使用して胸部を露出させます。ダイヤフラムを完全に開きます。
- 胸部を分離して、肺と鼓動する心臓を露出させます。
- 灌流ポンプを使用して、マウスに10 mLの灌流溶液を4.5 mL / minの速度で経心灌流します( 材料の表を参照)。灌流には~2分かかります。左心室に26G針を挿入して、溶液を全身回路に送り込みます。さらに、血液が循環から出るように、右心房で外科用ハサミで切り込みを入れます。
注:灌流ポンプは、正確にプログラムされた速度で流体を供給し、灌流によって引き起こされるせん断力が強すぎないようにするため、流体の手動投与よりも好まれます。過度のせん断力は、CP内の細胞の生存率と構造を損ないます。 さらに、ここで推奨される灌流流量は、7週間以降の成体マウスの灌流に最適です。若いマウスを使用する場合は、より低い流量を使用する必要があります。また、手術部位を清潔に保つために、右心房から出てくる血液を軽くたたくことも重要です。 - マウスを斬首します。
注意: 脳の構造を維持するために、頭を肩までできるだけ低く切り落とすように注意してください。切り傷が高すぎると、小脳が損傷する可能性があります。 - 断頭後、耳の間から目より上方を切開して頭皮を切り開きます。皮膚を横方向に引っ張って頭蓋骨を露出させます。次に、扁平上皮縫合糸をたどって頭蓋骨を切り開き、鼻の部分に向かって開きます。
注:脳の完全性を維持するために、頭蓋骨をそっと取り除くことが重要です。 - 脳を氷のように冷たいペトリ皿に入れ、脳組織に1mLの氷冷1x PBSを加えます。
注:皿のコーティングは必要ありません。
- 第4脳室に浮かぶCPを隔離します。
- メスで小脳を大脳からそっと切り取ります。大脳は脳の最大の部分であり、小脳は脳の後ろにあるはるかに小さな部分です。必要に応じて、小脳から残りの脳幹組織部分を取り除きます。
- 切断線が上を向くように脳を回転させます。CPが背側に浮かんでいる状態で、第4脳室腔がセクションの中央に見えることを確認します。必要に応じて、鋭い鉗子で結合組織を引き開いて心室を少し開きます。このようにして、CPがより見やすくなり、到達しやすくなります。
- 小さな鋭い鉗子を使用して、心室壁からCPをそっと引き裂きます。
注 サンプルを周囲の組織と汚染しないように、このステップではCPに触れて取り出すだけです。ステップ2.2.2で説明されているように心室を開くと、ステップ2.2.3が容易になります。
- 側脳室から突き出ているCPを隔離します。
- 小さな鋭い鉗子を使用して、脳を矢状に2つの半球に切断します。
- 切断線が上を向くように脳を回転させます。側脳室を明らかにするには、視床から皮質をそっと引き離します。
- 海馬を矢状中切断線まで引っ込めます。側脳室が見えるようになり、CPが心室の下部に横たわっています。必要に応じて、鋭い鉗子で結合組織を引き開いて心室を少し開きます。このようにして、CPがより見やすくなり、到達しやすくなります。
- 小さな鋭利な鉗子を使用して、CPを心室壁からそっと引き裂きます。
注意: サンプルを周囲の組織と汚染しないように、このステップではCPに触れて取り出すだけです。ステップ2.3.4で説明されているように心室を開くと、ステップ2.3.5が容易になります。このステップでは、CP の構造を可能な限り維持するために、必要な注意を払ってください。CPを吻側から尾側に引っ張り始めるのが最も簡単です。
3. 走査型電子顕微鏡(SEM)を用いたCP組織の形態解析
注意: 有毒溶液は、次の処理ステップで使用されます。サンプル調製はドラフト内で行うことをお勧めします。
- 下記のようにSEM用のサンプル調製を行います。
- 新たに単離したCPを、0.1 M Na-カコジル酸緩衝液(pH 7.4)中の2%パラホルムアルデヒドおよび2.5%グルタルアルデヒドを含む新たに作製した固定溶液に移します。4°Cで一晩インキュベートします。
注:CP組織は非常に壊れやすく薄いため、組織を小さな標本バスケット( 材料表を参照)に入れてバッファー間で移動させる必要があります。このようにして、組織の構造はよりよく保存されます。強力なカコジル酸バッファーはEM固定液中の低pHのグルタルアルデヒドに対抗できるため、PBSベースの固定液よりもカコジル酸ベースの固定液が使用されます。 - サンプルを3〜5 mLの0.1 MNa-カコジル酸緩衝液(pH 7.4)でそれぞれ5分間洗浄します。
- サンプルを0.1 MNa-カコジル酸バッファー中の2%四酸化オスミウム3〜5 mLに30分間後固定します。サンプルを3〜5 mLの超純水でそれぞれ5分間3回洗浄します。
- EtOH濃度が上昇する一連の氷冷溶液(50%、70%、85%、100%)で、EtOH溶液あたり15分間サンプルを脱水します。臨界点乾燥機を使用して、サンプルを適切にポイントドライします。
注意 液相から気相に変化すると表面張力に影響し、表面構造に損傷を与えます。臨界点乾燥ステップは、表面構造の保存を可能にする。 - カーボンステッカーが貼られた試料台紙にサンプルを慎重に配置します( 材料表を参照)。
- サンプルを白金の薄層(2〜5 nm)でコーティングします。これを行うには、2つの大電流電気端子の間の真空システムにプラチナ源を取り付け、プラチナを蒸発温度まで加熱します。白金の微細な流れがサンプル上に堆積します。
注:この手順の詳細なプロトコルは、参考文献30に記載されています。プラチナの他に、金または金/パラジウムも使用できます。
- 新たに単離したCPを、0.1 M Na-カコジル酸緩衝液(pH 7.4)中の2%パラホルムアルデヒドおよび2.5%グルタルアルデヒドを含む新たに作製した固定溶液に移します。4°Cで一晩インキュベートします。
- SEMでCPサンプルを視覚化します( 材料表を参照)。SEM による CP組織の視覚化手順は、他のタイプの組織と同様であり、使用するソフトウェアと機器によって異なります。ビデオを伴う段階的なSEMプロトコルは、参考文献31 または参考文献30で入手可能である。
結果
記載されたプロトコルは、マウス脳外側(図2A−C)および第4脳室(図2D−F)からのCPの効率的な単離を容易にする。脳全体を隔離した後、鉗子を使用して脳を矢状に半解し、側脳室に浮かぶCPを識別します。第4脳室からのCPは、脳の小脳側から単離することができる。ブロモフェノールブルーとの灌流?...
ディスカッション
ここでは、脈絡叢(CP)をマウス脳の側脳室及び第四脳室から分離する方法について説明する。CPのこの全体のマウント方法は、CPの形態、細胞組成、トランスクリプトーム、プロテオーム、およびセクレトームの完全なビューを取得するための技術のレパートリーを使用したさらなる分析を容易にします。このような分析は、脳室から突き出ているこの驚くべき構造をよりよく理解するために?...
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、ベルギーアルツハイマー病研究財団(SAO、プロジェクト番号:20200032)、フランダース研究財団(FWO Vlaanderen、プロジェクト番号:1268823N、11D0520N、1195021N)、およびBaillet Latour基金の支援を受けました。VIBバイオイメージングコアのトレーニング、サポート、インストゥルメントパークへのアクセスに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
参考文献
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer's disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer's disease. Journal of Alzheimer's Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer's disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved