Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Koroid Pleksusunun Mikrodiseksiyonu ve Tüm Montajlı Taramalı Elektron Mikroskobu Görselleştirmesi
Bu Makalede
Özet
Nörobilimde az çalışılmış bir doku olan koroid pleksus (SP), merkezi sinir sisteminin sağlığında ve hastalığında önemli bir rol oynar. Bu protokol, SP'yi izole etmek için bir mikrodiseksiyon tekniğini ve hücresel yapısının genel bir görünümünü elde etmek için taramalı elektron mikroskobunun kullanımını açıklar.
Özet
Beynin ventriküllerine çıkıntı yapan oldukça vaskülarize bir yapı olan koroid pleksus (SP), nörobilimde en az çalışılan dokulardan biridir. Bu küçük yapının merkezi sinir sisteminin (CNS) sağlığı ve hastalığında çok önemli bir rol oynadığı giderek daha açık hale geldiğinden, SP'nin beyin ventriküllerinden düzgün bir şekilde diseke edilmesi, fonksiyonel analizden yapısal analize kadar aşağı akış işlemeye izin verecek şekilde son derece önemlidir. Burada, lateral ve dördüncü beyin ventrikül faresi CP'nin özel alet veya ekipmanlara ihtiyaç duymadan izolasyonu açıklanmaktadır. Bu izolasyon tekniği, SP içindeki hücrelerin canlılığını, işlevini ve yapısını korur. Yüksek vaskülarizasyonu nedeniyle, SP bir binoküler mikroskop kullanılarak beynin ventrikül boşlukları içinde yüzerken görselleştirilebilir. Bununla birlikte, aşağı akış analizi için gerekli olan transkardiyal perfüzyon, SP dokusunun tanımlanmasını zorlaştırabilir. Daha sonraki işleme adımlarına (örneğin, RNA ve protein analizi) bağlı olarak, bu, SP'yi bromofenol mavisi ile transkardiyal perfüzyon yoluyla görselleştirerek çözülebilir. İzolasyondan sonra, SP, bu özel beyin yapısının işlevi hakkında daha fazla bilgi edinmek için RNA, protein veya tek hücre analizi de dahil olmak üzere çeşitli teknikler kullanılarak işlenebilir. Burada, yapının genel bir görünümünü elde etmek için tüm montaj CP'sindeki taramalı elektron mikroskobu (SEM) kullanılır.
Giriş
Sıkı bariyerler, merkezi sinir sistemini (CNS), kan-beyin bariyeri (BBB) ve kan-beyin omurilik sıvısı (BOS) bariyeri dahil olmak üzere çevreden ayırır. Bu engeller CNS'yi dış hakaretlere karşı korur ve dengeli ve kontrollü bir mikro çevre sağlar 1,2,3. BBB zaman içinde kapsamlı bir şekilde çalışılmış olsa da, koroid pleksusta (SP) bulunan kan-BOS bariyeri sadece son on yılda artan araştırma ilgisi kazanmıştır. Bu son bariyer beynin dört ventrikülünde bulunabilir (Şekil 1A, B) ve merkezi bir stroma, sızdıran kılcal damarlar, fibroblastlar ve bir lenfoid ve miyeloid hücre popülasyonunu çevreleyen tek bir koroid pleksus epitel (CPE) hücresi tabakası ile karakterizedir (Şekil 1C)4,5,6. CPE hücreleri sıkı bağlantılarla sıkıca birbirine bağlanır, böylece altta yatan federe kan kılcal damarlarından BOS ve beyne sızıntıyı önler. Ek olarak, CPE hücreleri boyunca taşıma, yararlı bileşiklerin (örneğin, besinler ve hormonlar) kandan BOS'a akışını ve zararlı moleküllerin (örneğin, metabolik atıklar, aşırı nörotransmiterler) diğer yöndeki efflüksünü yöneten bir dizi içe ve dışa taşıma sistemi tarafından düzenlenir 1,6. Aktif taşıma fonksiyonlarını yerine getirebilmek için, CPE hücreleri sitoplazmalarında çok sayıda mitokondri içerir7. Dahası, SP BOS'un ana kaynağıdır ve yerleşik enflamatuar hücrelerin varlığı ile beynin bekçisi olarak işlev görür1. Kan ve beyin arasındaki eşsiz konumu nedeniyle, SP ayrıca bağışıklık gözetimini gerçekleştirmek için mükemmel bir konuma sahiptir8.
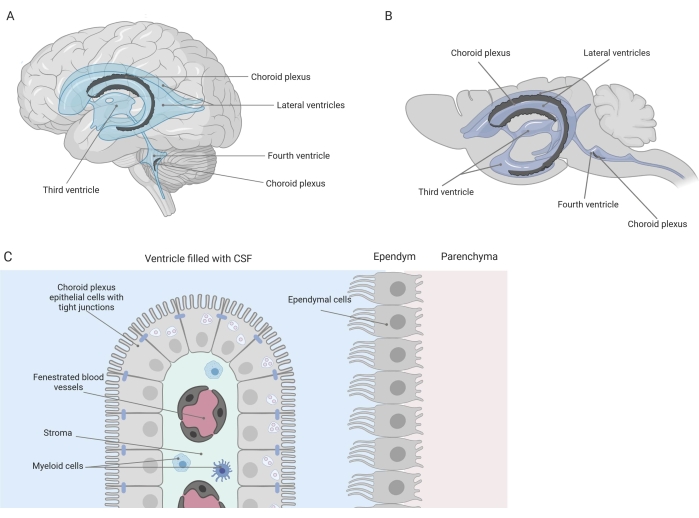
Şekil 1: Koroid pleksusun (SP) yeri ve bileşimine şematik genel bakış . (A,B) CP dokusu, (A) insan ve (B) fare beyinlerinin iki lateral, üçüncü ve dördüncü ventriküllerinde bulunur. (C) SP dokusu, fenestrated kılcal damarları, gevşek bağ dokusunu ve lenfoid ve miyeloid hücreleri çevreleyen sıkıca bağlanmış küboidal CP epitel (CPE) hücrelerinin tek bir katmanından oluşur ve kan-beyin omurilik sıvısı bariyerini oluşturur (referans23'ten uyarlanmış ve modifiye edilmiştir). Şekil Biorender.com ile oluşturulmuştur. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Son on yılda, araştırma grubumuzdan birkaç rapor da dahil olmak üzere artan kanıtlar, SP'nin sağlık ve hastalıkta merkezi bir rol oynadığını ortaya koymuştur 9,10,11,12,13,14,15,16,17,18 . Örneğin, yaşlanan kan-BOS bariyerinin, diğerlerinin yanı sıra, çekirdeklerde, mikrovilluslarda ve bazal membranda morfolojik değişiklikler gösterdiği bilinmektedir 1,19. Ek olarak, Alzheimer hastalığı bağlamında, genel bariyer bütünlüğü tehlikeye girer ve yaşa bağlı tüm bu değişikliklerin daha da belirgin olduğu görülmektedir 1,8,20. Morfolojik değişikliklere ek olarak, SP'nin transkriptom, proteom ve sekretomu hastalık 12,21,22,23 sırasında değişir. Bu nedenle, SP'nin nörolojik hastalıklardaki rolünü daha iyi anlamak ve potansiyel olarak yeni terapötik stratejiler geliştirmek için SP'nin ileri düzeyde bilgisi gereklidir.
SP'nin beyin ventriküllerinden doğru mikrodiseksiyonu için etkili bir yöntem, bu küçük beyin yapısının düzgün bir şekilde araştırılmasına izin veren ilk paha biçilmez adımdır. Yüksek vaskülarize doğası nedeniyle (Şekil 2B), beynin ventrikül boşluklarında yüzen SP, bir binoküler mikroskop kullanılarak tanımlanabilir. Bununla birlikte, aşağı akış analizi için sıklıkla transkardiyal perfüzyon gereklidir, bu da SP dokusunun doğru tanımlanmasını ve izolasyonunu zorlaştırır (Şekil 2C). Daha sonraki işlem adımları izin veriyorsa (örneğin, RNA ve protein analizi durumunda), SP, bromofenol mavisi ile transkardiyal perfüzyon yoluyla görselleştirilebilir (Şekil 2A). Birkaç yayın, SP'nin sıçan24 ve fare yavrusu beyinlerinden25'ten izole edildiğini zaten tanımlamaktadır. Burada, SP'yi yetişkin farelerden izole etmek için bir mikrodiseksiyon izolasyon tekniği tanımlanmıştır. Önemli olarak, bu izolasyon tekniği SP içindeki hücrelerin canlılığını, işlevini ve yapısını korur. Dördüncü ve lateral ventriküllerde yüzen SP'nin izolasyonu burada açıklanmaktadır. Kısacası, fareler terminal anestezi altına alınır ve gerekirse transkardiyal olarak perfüze edilir. Bununla birlikte, perfüzyonun SP içindeki hücrelerin yapısına zarar verebileceği unutulmamalıdır. Sonuç olarak, numune transmisyon elektron mikroskobu (TEM), seri blok yüz taramalı elektron mikroskobu (SBF-SEM) veya odaklanmış iyon ışını SEM (FIB-SEM) kullanılarak analiz edilecekse, perfüzyon yapılmamalıdır. Daha sonra, tüm beyin izole edilir ve forsepsler beyni sagittal olarak hemiseke etmek için kullanılır. Buradan, lateral ventriküllerde yüzen SP'ler tanımlanabilir ve diseke edilebilirken, dördüncü ventrikülden gelen SP beynin serebellar tarafından izole edilebilir.

Şekil 2: (A-D) bromofenol mavi perfüzyonundan sonra (A-K) dördüncü ve (D-F) lateral ventrikül koroid pleksusunun (SP) görüntülenmesi, (B,E) perfüzyon olmaması ve (C,F) perfüzyonunun PBS/heparin ile görüntülenmesi. Görüntüler stereo mikroskopla (8x-32x büyütme) alınır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
SP beyin ventriküllerinden düzgün bir şekilde diseke edildikten sonra, bu yapının işlevi hakkında daha fazla bilgi edinmek için bütün bir teknik repertuarı uygulanabilir. Örneğin, akış sitometrisi veya tek hücreli RNA dizilimi, belirli hastalık koşulları altında sızan enflamatuar hücreleri ölçmek ve fenotipik olarak analiz etmek için yapılabilir26,27. Hücresel bileşime ek olarak, SP'nin moleküler bileşimi, enzime bağlı immünosorbent testi (ELISA), immünoblot yoluyla veya sitokin boncuk dizisi28 kullanılarak çoklu sitokinlerin eşzamanlı analizi yoluyla sitokinlerin ve kemokinlerin varlığını değerlendirmek için analiz edilebilir. Ayrıca mikrodiseke SP eksplantları29 üzerinde transkriptom, vasküler, immün hücre histolojisi ve sekretom analizleri yapılabilmektedir. Burada, CP yapısının genel bir görünümünü elde etmek için tüm montaj CP'sinde taramalı elektron mikroskobu (SEM) kullanılır. SEM, yüzeyi taramak ve yüzeyin topografyasının ve kompozisyonunun bir görüntüsünü oluşturmak için odaklanmış elektronlardan oluşan bir ışın kullanır. Elektronların dalga boyu ışığınkinden çok daha küçük olduğundan, SEM'in çözünürlüğü nanometre aralığındadır ve bir ışık mikroskobunkinden daha üstündür. Sonuç olarak, hücre altı seviyedeki morfolojik çalışmalar SEM aracılığıyla yapılabilir. kısaca, diseke edilen SP derhal bir gece fiksasyonu için glutaraldehit içeren bir fiksatife aktarılır, ardından osmikasyon ve uranil asetat boyanması yapılır. Numuneler daha sonra kurşun aspartat lekesi ile muamele edilir, dehidre edilir ve nihayetinde görüntüleme için gömülür.
Böylece, bu protokol, SP'nin fare beyin ventriküllerinden verimli bir şekilde izole edilmesini kolaylaştırır; bu, yapısını ve işlevini araştırmak için çeşitli aşağı akış teknikleri kullanılarak daha fazla analiz edilebilir.
Protokol
Bu çalışmada açıklanan tüm hayvan deneyleri ulusal (Belçika Kanunu 14/08/1986 ve 22/12/2003, Belçika Kraliyet Kararnamesi 06/04/2010) ve Avrupa mevzuatına (AB Direktifleri 2010/63/EU, 86/609/EEC) göre gerçekleştirilmiştir. Fareler ve hayvan protokolleri üzerindeki tüm deneyler Ghent Üniversitesi etik komitesi tarafından onaylanmıştır (izin numaraları LA1400091 ve EC 2017-026).
1. Hazırlık
- Anestezikler: Bir terminal anestezi hazırlayın. Örneğin, fosfat tamponlu salin (PBS) içinde bir sodyum pentobarbital (≥100 mg / kg) çözeltisi hazırlanabilir.
- Transkardiyal perfüzyon çözeltisi: % 0.5 bromofenol mavisi ile desteklenmiş 10 mL (fare başına) PBS / heparin (% 0.2 heparin içeren) çözeltisi hazırlayın.
NOT: Aşağı akış işleme adımları izin veriyorsa (örneğin, RNA ve protein analizi durumunda), koroid pleksus (SP), bromofenol mavisi ile transkardiyal perfüzyon yoluyla görselleştirilebilir. Bromofenol mavisi diğer işleme adımlarıyla uyumlu değilse (örneğin, görüntüleme için), perfüzyon yapmak için PBS / heparin kullanın. - SEM analizi için gerekli çözümleri hazırlar.
- 0.1 M Na-kakodilat tamponu (pH 7.4) hazırlayın. 0.1 M Na-kakodilat tamponunda% 2 paraformaldehit ve% 2.5 glutaraldehit çözeltisi hazırlayın. Numune başına bu çözeltiden 20 mL yapın.
- 0,1 M Na-kakodilat tamponunda (numune başına 5 mL) %2 ozmiyum tetroksit hazırlayın.
- %50, %70, %85 ve %100 EtOH çözeltileri hazırlayın. Numune başına her bir EtOH çözeltisinden 5 mL hazırlayın.
2. Koroid pleksusun lateral ve dördüncü ventrikülden mikrodiseksiyonu
NOT: Bu çalışmada dişi, 9 haftalık C57BL/6 fareler kullanıldı. Bununla birlikte, tarif edilen izolasyon tekniği, yetişkin farenin gerginliğinden, cinsiyetinden ve yaşından bağımsızdır.
- Fare beynini izole edin.
- İntraperitoneal olarak, fareyi ölümcül bir şekilde uyuşturmak için 26G'lik bir iğne kullanarak kısa etkili bir barbitüratın (>1.1. adımda hazırlanan 100 mg / kg) ölümcül bir dozunu enjekte edin. Arka pençesini forseps ile sıkıştırarak farenin ayak refleksini kontrol edin.
- Ayak refleksi olmadığında, terminal anestezi uygulanan hayvanı dorsal decubitus pozisyonuna yerleştirin ve uzuvları bir tabağa sabitleyerek fareyi sabitleyin.
NOT: Farelerin transkardiyal perfüzyonu gerekli değilse, aşağı akış analiz yöntemine bağlı olarak (örneğin, SEM görüntüleme için), adım 2.1.7'ye geçin. Bununla birlikte, kandaki kan hücrelerini veya diğer bileşenleri çıkarmak için perfüzyon gerekiyorsa, SP, bromofenol mavisi ile perfüzyon yoluyla beyin ventriküllerinde yüzen mavi bir yapı olarak görselleştirilebilir. - Göğsü% 70 etanol püskürterek dezenfekte edin. Ameliyat alanının etrafına steril bir örtü yerleştirin. Karbon çelik cerrahi bıçak kullanarak diyaframın hemen altında ~ 4 cm'lik bir kesi yapın (bkz.
- Cildi açın ve cerrahi makas kullanarak göğsü açığa çıkarın. Diyaframı tamamen açın.
- Akciğerleri ve atan kalbi açığa çıkarmak için göğüs kafesini ayırın.
- Bir perfüzyon pompası kullanarak, fareleri 10 mL perfüzyon çözeltisi ile 4.5 mL / dak hızında transkardiyal olarak perfüze edin (bkz. Perfüzyon ~ 2 dakika sürecektir. Çözeltiyi sistemik devreye pompalamak için sol ventriküle bir 26G iğnesi yerleştirin. Ek olarak, sağ atriyumda cerrahi makasla bir kesim yapın, böylece kan dolaşımdan çıkabilir.
NOT: Bir perfüzyon pompası, sıvıları hassas bir şekilde programlanmış bir hızda ileteceği ve perfüzyonun neden olduğu kesme kuvvetlerinin çok güçlü olmamasını sağlayacağı için sıvının manuel olarak uygulanmasına göre tercih edilir. Ek olarak, burada önerilen perfüzyon akış hızı, yetişkin fareleri 7 haftadan itibaren perfüze etmek için en uygunudur. Daha genç fareler kullanılıyorsa, daha düşük bir akış hızı kullanılmalıdır. Temiz bir cerrahi bölgeyi korumak için sağ atriyumdan çıkan kanı atmak da önemlidir. - Farenin kafasını kesin.
NOT: Beyin yapısını korumak için başın omuza mümkün olduğunca alçaktan kesilmesine dikkat edin. Kesim çok yüksekse, beyincik zarar görebilir. - Dekapitasyondan sonra, kulakların arasından gözlerden üstünlüğe doğru bir kesi yaparak kafa derisini kesin. Kafatasını açığa çıkarmak için cildi yanal olarak çekin. Ardından, burun kısmına doğru skuamozal dikişleri takip ederek kafatasını kesin.
NOT: Beyin bütünlüğünü korumak için kafatasını nazikçe çıkarmak önemlidir. - Beyni buz gibi soğuk bir Petri kabına yerleştirin ve beyin dokusuna 1 mL buz gibi soğuk 1x PBS ekleyin.
NOT: Çanağın kaplanmasına gerek yoktur.
- Dördüncü ventrikülde yüzen CP'yi izole edin.
- Beyinciği beyincikten bir neşterle yavaşça kesin. Serebrum beynin en büyük kısmıdır, beyincik ise beynin arkasında çok daha küçük bir kısımdır. Gerekirse, kalan beyin sapı dokusu parçalarını beyincikten çıkarın.
- Beyni, kesme çizgisi yukarı bakacak şekilde döndürün. Dördüncü ventrikül boşluğunun artık bölümün ortasında görünür olduğundan ve SP'nin dorsal bölgede yüzdüğünden emin olun. Gerekirse, bağ dokusunu keskin forsepslerle açarak ventrikülü biraz açın. Bu şekilde, CP daha görünür ve ulaşılması daha kolay olacaktır.
- SP'yi küçük keskin forsepsler kullanarak ventrikül duvarından yavaşça yırtın.
NOT - Numuneyi çevreleyen doku ile kirletmemek için bu adımda sadece CP'ye dokunmak ve çıkarmak önemlidir. Ventriküllerin adım 2.2.2'de açıklandığı gibi açılması adım 2.2.3'ü kolaylaştıracaktır.
- Lateral ventrikülden dışarı çıkıntı yapan CP'yi izole edin.
- Beyni sagittal olarak iki yarım küreye ayırmak için küçük keskin forseps kullanın.
- Beyni, kesme çizgisi yukarı bakacak şekilde döndürün. Lateral ventrikülü ortaya çıkarmak için, korteksi talamustan yavaşça çekin.
- Hipokampüsü orta sagital kesme hattına geri çekin. Lateral ventrikül artık ventrikülün dibinde yatan SP ile görülebilir. Gerekirse, bağ dokusunu keskin forsepslerle açarak ventrikülü biraz açın. Bu şekilde, CP daha görünür ve ulaşılması daha kolay olacaktır.
- CP'yi ventrikül duvarından nazikçe yırtmak için küçük keskin forseps kullanın.
NOT: Numuneyi çevreleyen doku ile kirletmemek için bu adımda sadece SP'ye dokunmak ve çıkarmak önemlidir. Ventriküllerin adım 2.3.4'te açıklandığı gibi açılması adım 2.3.5'i kolaylaştıracaktır. CP'nin yapısını mümkün olduğunca korumak için bu adımda gerekli dikkati gösterin. CP'yi rostralde kaudal yöne çekmeye başlamak en kolay yoldur.
3. SP dokusunun taramalı elektron mikroskobu (SEM) kullanılarak morfolojik analizi
DİKKAT: Aşağıdaki işleme adımlarında toksik çözeltiler kullanılır. Numune hazırlamanın bir duman davlumbazında yapılması önerilir.
- Aşağıda açıklandığı gibi SEM için numune hazırlama işlemi gerçekleştirin.
- Taze izole edilmiş CP'yi, 0.1 M Na-kakodilat tamponunda (pH 7.4) %2 paraformaldehit ve %2.5 glutaraldehit içeren taze yapılmış fiksasyon çözeltisine aktarın. Gece boyunca 4 ° C'de inkübe edin.
NOT: CP dokusu çok kırılgan ve ince olduğundan, doku tamponlar arasında aktarılması için küçük numune sepetlerine konulmalıdır (bakınız Malzeme Tablosu). Bu sayede dokunun yapısı daha iyi korunmuş olacaktır. Güçlü kakodilat tamponu, EM fiksatifindeki düşük glutaraldehit pH'ına karşı koyabildiğinden, PBS bazlı bir fiksatif üzerinde bir kakodilat bazlı fiksatif kullanılır. - Numuneyi her biri 5 dakika boyunca 3 kez yıkayın, 3-5 mL 0,1 M Na-kaudilat tamponu (pH 7,4).
- Numuneleri 30 dakika boyunca 0,1 M Na-kakodilat tamponunda 3-5 mL% 2 osmiyum tetroksit içinde sabitleyin. Numuneleri her biri 5 dakika boyunca 3 kez 3-5 mL ultra saf su ile yıkayın.
- Numuneleri, EtOH çözeltisi başına 15 dakika boyunca artan EtOH konsantrasyonlarına (% 50,% 70,% 85,% 100) sahip bir dizi buz gibi soğuk çözeltide kurutun. Numuneyi düzgün bir şekilde kurutmak için kritik bir nokta kurutucu kullanın.
NOT - Sıvıdan gaz fazına geçiş, yüzey gerilimini etkileyerek yüzey yapısına zarar verir. Kritik nokta kurutma adımı, yüzey yapısının korunmasını sağlar. - Numuneyi, karbon etiketle birlikte verilen bir numune montajına dikkatlice yerleştirin (bkz.
- Numuneleri ince bir platin tabakası (2-5 nm) ile kaplayın. Bunu yapmak için, iki yüksek akımlı elektrik terminali arasındaki bir vakum sistemine bir platin kaynağı monte edin ve platini buharlaşma sıcaklığına ısıtın. Numune üzerinde ince bir platin akışı biriktirilir.
NOT: Bu adım için daha ayrıntılı bir protokol referans30'da sağlanmıştır. Platinin yanı sıra altın veya altın/paladyum da kullanılabilir.
- Taze izole edilmiş CP'yi, 0.1 M Na-kakodilat tamponunda (pH 7.4) %2 paraformaldehit ve %2.5 glutaraldehit içeren taze yapılmış fiksasyon çözeltisine aktarın. Gece boyunca 4 ° C'de inkübe edin.
- CP örneklerini SEM ile görselleştirin (bkz. SP dokusunun SEM ile görüntülenme prosedürü diğer doku tiplerine benzer ve kullanılan yazılım ve aletlere bağlıdır. Beraberindeki bir videoyla birlikte adım adım SEM protokolü referans31 veyareferans 30'da mevcuttur.
Sonuçlar
Tarif edilen protokol, SP'nin fare beyni lateral (Şekil 2A-C) ve dördüncü (Şekil 2D-F) ventriküllerinden etkili bir şekilde izole edilmesini kolaylaştırır. Tüm beyni izole ettikten sonra, forsepsler beyni sagittal olarak hemiseke etmek ve lateral ventriküllerde yüzen CP'leri tanımlamak için kullanılır. Dördüncü ventrikülden SP, beynin serebellar tarafından izole edilebilir....
Tartışmalar
Burada, koroid pleksusun (SP) lateral ventrikülden ve bir fare beyninin dördüncü ventrikülünden izole edilmesi için bir yöntem açıklanmaktadır. SP'nin tüm bu montaj yöntemi, CP morfolojisinin, hücresel kompozisyonun, transkriptomun, proteomun ve sekretomun tam bir görünümünü elde etmek için bir teknik repertuarı kullanarak daha fazla analizi kolaylaştırır. Bu tür analizler, beynin ventriküllerinden çıkıntı yapan bu olağanüstü yapıyı daha iyi anlamak için çok önemlidir. Bu bilgi, SP'n...
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma Belçika Alzheimer Araştırma Vakfı (SAO; proje numarası: 20200032), Flanders Araştırma Vakfı (FWO Vlaanderen; proje numaraları: 1268823N, 11D0520N, 1195021N) ve Baillet Latour Fonu tarafından desteklenmiştir. VIB BioImaging Core'a eğitim, destek ve enstrüman parkına erişim için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
Referanslar
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer's disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer's disease. Journal of Alzheimer's Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer's disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır