Method Article
תכנון ובנייה של מיקרוסקופ פלואורסצנטי הניתן להתאמה אישית, חד-אובייקטיבי, עבור הדמיה של רשתות שלד ציטו-שלד
In This Article
Summary
פרוטוקול זה מתאר בפירוט כיצד לבנות מיקרוסקופ פלואורסצנטי בעל מטרה אחת ויריעות אור ואת השימוש בו להדמיית רשתות שלד.
Abstract
חומרים מרוכבים של שלד ציטו-שלד משוחזר התפתחו כמערכת מודל רבת ערך לחקר חומר רך שאינו שיווי משקל. הלכידה הנאמנה של הדינמיקה של רשתות תלת-ממדיות וצפופות אלה דורשת חתך אופטי, הקשור לעתים קרובות למיקרוסקופים קונפוקליים פלואורסצנטיים. עם זאת, התפתחויות אחרונות במיקרוסקופ פלואורסצנטי של יריעות אור (LSFM) ביססו אותו כחלופה חסכונית, ולעתים עדיפה. כדי להפוך את LSFM לנגיש לחוקרי שלד ציטו-שלד שפחות בקיאים באופטיקה, אנו מציגים מדריך שלב אחר שלב למתחילים לבניית מיקרוסקופ פלואורסצנטי רב-תכליתי מרכיבי מדף. כדי לאפשר הרכבה של דגימות עם דגימות שקופיות מסורתיות, LSFM זה עוקב אחר עיצוב גיליון האור (SOLS) בעל מטרה יחידה, המשתמש במטרה אחת הן עבור איסוף העירור והן עבור איסוף הפליטה. אנו מתארים את הפונקציה של כל רכיב ב- SOLS בפירוט מספיק כדי לאפשר לקוראים לשנות את המכשור ולעצב אותו כך שיתאים לצרכים הספציפיים שלהם. לבסוף, אנו מדגימים את השימוש במכשיר SOLS מותאם אישית זה על ידי הדמיה של אסטרים ברשתות מיקרוטובולים מונעות קינזין.
Introduction
מיקרוסקופ פלואורסצנטי של יריעות אור (LSFM) מייצג משפחה של טכניקות הדמיה פלואורסצנטית ברזולוציה גבוהה שבהן אור העירור מעוצב לגיליון 1,2, כולל מיקרוסקופ הארה מישורית סלקטיבית (SPIM), עירור מישורי קונפוקלי (SCAPE) ומיקרוסקופ מישורי אלכסוני (OPM)3,4,5,6,7. שלא כמו שיטות מיקרוסקופיה אחרות כגון epi-fluorescence, total internal reflection fluorescence microscopy (TIRFM), או מיקרוסקופ קונפוקלי, phototoxicity הוא מינימלי ב- LSFM וניתן לצלם דגימות על פני טווחי זמן ארוכים יותר מכיוון שרק מישור הדגימה המצולמת באופן פעיל מואר 8,9,10. לכן, טכניקות LSFM שימושיות ביותר להדמיית דגימות תלת-ממדיות על פני תקופות זמן ממושכות, במיוחד אלה עבות מדי עבור טכניקות מיקרוסקופיה קונפוקלית. מסיבות אלה, מאז פיתוחה המקורי בשנת 2004, LSFM הפכה לטכניקת הדמיה המועדפת על פיזיולוגים רבים, ביולוגים התפתחותיים ומדעני מוח להדמיה של אורגניזמים שלמים כגון דגי זברה חיים ועוברי דרוזופילה 3,4,6,11 . בשני העשורים האחרונים, היתרונות של LSFM מונפו כדי לדמיין מבנה ודינמיקה בסקאלות קטנות יותר ויותר, כולל קשקשים רקמתיים 11,12, תאיים ותת-תאיים, הן in vivo והן in vitro 13,14,15,17.
למרות הדיווחים על מקרי שימוש מוצלחים בספרות, העלות הגבוהה של מערכות LSFM מסחריות (~ 0.25 מיליון דולר נכון לזמן כתיבת שורות אלה)18,19 מונעת שימוש נרחב בטכניקה. כדי להפוך את בניית DIY לחלופה ישימה לחוקרים, פורסמו מספר מדריכי בנייה 8,13,20,21, כולל מאמץ הגישה הפתוחה OpenSPIM 22. אולם נכון להיום, חוקרים עם ניסיון מינימלי באופטיקה יכולים להשתמש רק בתכנוני LSFM מוקדמים יותר, שאינם תואמים לדגימות מסורתיות המותקנות על שקופיות (איור 1A). יישום גיליון אור (SOLS) שבוצע לאחרונה משתמש במטרה אחת הן לעירור והן לזיהוי (איור 1C), ובכך מתגבר על המגבלה הקשורה לתאימות 5,6,8,13,20. עם זאת, העלות עבור הרבגוניות של תכנון SOLS היא עלייה משמעותית במורכבות הבנייה עקב הדרישה של שתי מטרות נוספות להעביר, לבטל הטיה ותמונה מחדש של מישור האובייקט על המצלמה לצורך הדמיה (איור 1D). כדי להקל על הגישה להגדרות מורכבות בסגנון SOLS, מאמר זה מציג מדריך שלב אחר שלב על התכנון, הבנייה, תהליך היישור והשימוש במערכת SOLS תואמת שקופיות, אשר יהיה שימושי לחוקרים עם ידע של קורס אופטיקה ברמת הכניסה בלבד.
למרות שהפרוטוקול עצמו הוא תמציתי, על הקוראים להפנות למשאבים אחרים במהלך שלבי ההכנה כדי ללמוד עוד על חלקים מסוימים של שיקולי התכנון או החומרה. עם זאת, אם הקורא מתכוון לעקוב אחר המפרט של עיצוב זה, ייתכן שלא יהיה צורך להבין כיצד לבחור רכיבים אופטיים מסוימים.
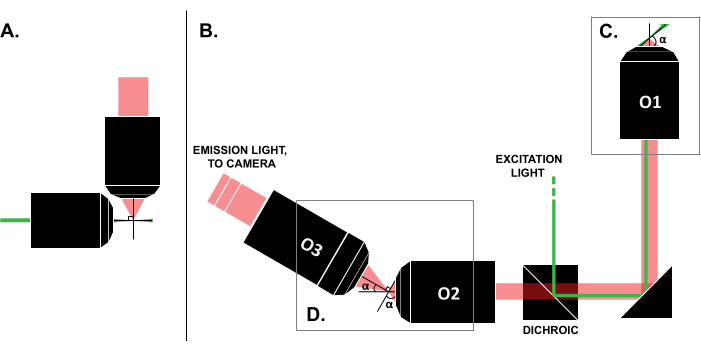
איור 1: מאפיינים של תצורות LSFM שונות. (A) התקנה עם שתי מטרות אורתוגונליות שהיו נפוצות בתכנוני LSFM מוקדמים. בתצורה זו, צינור נימי או גליל ג'ל משמש להכיל את המדגם, אשר אינו תואם טכניקות מסורתיות הרכבה שקופיות. (B) סכמה של עיצוב גיליון אור SOLS המראה את הדברים הבאים: (ג) המטרה היחידה המשמשת הן לעירור והן לאיסוף הפליטה במישור הדגימה (O1); הדבר מאפשר להרכיב שקופית מסורתית על גביו, ו-(D) את מערכת יעדי הממסר בנתיב הפליטה של SOLS. O2 אוסף את אור הפליטה ומקטין את התמונה. O3 מצלם את המישור בזווית ההטיה הנכונה אל חיישן המצלמה. קיצורים: LSFM = מיקרוסקופ פלואורסצנטי של גיליון אור; SOLS = יריעת אור חד-אובייקטיבית; O1-O3 = מטרות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
1. הכנה ליישור
- לפני תחילת הבנייה, בצע את כל סקירות הספרות הדרושות כדי לקבל מושג ברור על מקרה השימוש המיועד (למשל, הפלואורופורים שיש לצלם, נפח ההדמיה הדרוש, דרישות הרזולוציה). בפרט, עיין בסעיף התוצאות המייצגות להלן כדי להחליט אם ביצוע העיצוב המדויק המתואר כאן מתאים. אם כן, דלג לשלב 1.2. אם לא, מצא הצעות והדרכה לבחירת חומרה במדריך הבנייה של Sheunglab SOLS23.
הערה: המשתמש יכול למצוא מידע נוסף לגבי המפרטים של מערכת מסוימת זו בסעיף הדיון. - אסוף את כל הרכיבים האופטיים, האופטו-מכניים והחשמליים הדרושים כמפורט בטבלת החומרים. עבור משתמשים המשנים את המערכת, אסוף את כל החלקים השקולים.
- בנו את לייזר היישור כפי שמתואר באיור 2A. בדקו שהקרן מתנגשת באמצעות לוח הגזירה.
- בנו את כלוב יישור הדיסק הכפול מזכוכית חלבית כפי שמתואר באיור 2B.
- הכינו את דוגמת הבדיקה המצופה בצבע פלואורסצנטי.
- צור תמיסת צבע רודמין רווי על ידי הוספה הדרגתית של 1 מ"ל מים מזוקקים ל -0.2 גרם של אבקה ליופילית עד שהכל מומס. מערבולת להומוגניזציה.
הערה: פתרון זה רגיש לאור. למרות שאין אמצעי זהירות הכרחיים במהלך ההכנה, יש לוודא כי התמיסה מאוחסנת באזור חשוך לאחר הכנתה.
אזהרה: יש ללבוש תמיד כפפות ומסכה בעת הטיפול באבקת רודמין. - פיפטה 10 μL במרכז שקופית בדיקה.
- הניחו כיסוי בגודל 22 מ"מ x 22 מ"מ על גבי הנוזל, כדי להבטיח ששכבת הפלואורסצנטיות תהיה דקה ככל האפשר.
- יש לאטום בלק שקוף.
הערה: דגימה זו רגישה לאור. כדי להאריך את חיי הדגימה, ודא שהשקופית מאוחסנת באזור חשוך כאשר היא אינה בשימוש.
- צור תמיסת צבע רודמין רווי על ידי הוספה הדרגתית של 1 מ"ל מים מזוקקים ל -0.2 גרם של אבקה ליופילית עד שהכל מומס. מערבולת להומוגניזציה.
- הכינו את דוגמת החרוזים התלת-ממדית (1 מיקרומטר חרוזים משובצים בג'ל).
- השתמש בסרט דו-צדדי ליצירת ערוץ אנכי ברוחב 4-5 מ"מ בשקופית לדוגמה בגובה שלוש שכבות של סרט הדבקה.
- הנח זכוכית כיסוי בגודל 22 מ"מ x 22 מ"מ על גבי סרט הדבק במרכז השקופית. לחץ בחוזקה על האזורים המודבקים כדי להבטיח אטימה טובה בין סרט הדבק לזכוכית הכיסוי.
- השתמש בסכין גילוח כדי להסיר את הסרט העודף.
- הכינו 125 מ"ל של תמיסת גומי גלן רווי על ידי הוספה הדרגתית של מי DI לגרם אחד של אבקת גומי גלאן. תמיסה זו תהיה מוצקה בטמפרטורת החדר ונוזל ב 65 ° C.
- הכנס 1 מ"ל של תמיסת מסטיק gellan לתוך צינור microcentrifuge. מחממים מיכל מים על צלחת חמה בטמפרטורה של 65°C, ומחממים את צינור המיקרוצנטריפוגה עד שמסטיק הגלן צמיג באופן ניכר.
- מכינים 10 מיקרוליטר של דילול 1:1,000 חרוזים בתמיסת גומי גלן מחוממת.
- בזהירות pipete את הפתרון לתוך החדר עד מלא. השתמשו בקיסם כדי לטפוח כמות קטנה של אפוקסי משני צידי התעלה, וכיסו את הפתחים במלואם כדי לאטום. כדי להבטיח איטום נכון, בדקו ויזואלית את שני הקצוות כדי לוודא שהאפוקסי חדר מעט לכל קצה של התעלה.

איור 2: תמונות של כלי היישור. (A) לייזר יישור משולב. AL1: עדשת יישור 1, −50 מ"מ; AL2: עדשת יישור 2, 100 מ"מ (B) כלוב יישור דיסק זכוכית חלבית כפולה. קיצורים: RMS CP = צלחת כלוב מושחלת RMS; SM1 CP = צלחת כלוב מושחלת SM1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. יישור נתיב העירור
- שרטט את פריסת המיקרוסקופ על פני השטח של הטבלה האופטית. למדוד את כל המרחקים בצורה מדויקת ככל האפשר.
הערה: עיין באיור 3 לקבלת מיקום הרכיבים בתוך המערכת. - הרכיבו את לייזר העירור על השולחן. הגדר שתי קשתית לגובה המיועד של הלייזר, והרכיב אותן במרחק של 2-3 רגל זו מזו על קו החורים הרצוי מאחורי המיקום של מראה 1 (M1). השתמש בקשתית זו כדי להבטיח שהקרן מפולסת עם משטח השולחן וממורכזת בקו החורים בשולחן האופטי.
הערה: יש להרכיב משקפי בטיחות בלייזר להגנה על העיניים, ולחסום קרני לייזר תועות באמצעות מסכי בטיחות בלייזר כאמצעי בטיחות. עד שכל הרכיבים מהודקים לצמיתות, היסחפות בסדר גודל של שעות אפשרית. הגדר קשתית בנקודה הרחוקה ביותר של היישור בסוף כל יום כבדיקה חזותית מהירה לסחף בעת החזרה למבנה. תנודות, שולחן אופטי שצף בצורה לא נכונה וזרמי אוויר הם הגורמים השכיחים ביותר לסחף אופטי. - הרכיבו את תריס הלייזר קרוב ככל האפשר ללייזר העירור. השתמש בתריס זה כדי לחסום במהירות את אור הלייזר במהלך היישור, במקום להפעיל ולכבות את הלייזר שוב ושוב.
- הרכיבו את מסנני ה-ND בגלגל מסנן ה-ND (ND 0.5, 1.0. 2.0, 3.0, 4.0 וחריץ ריק), והרכבו אותם לאחר תריס הלייזר.
- העבר את המפעיל הממונע לשלב תרגום אחד (TS1) ולאחר מכן הכנס את הבמה תחת המיקום של M1. ודא שהבמה מתורגמת באופן אקסיאלי לאורך אותו קו חורים שאור הלייזר עוקב אחריו. הנח את הבמה באמצע הטווח שלה עבור המיקום הראשוני.
- בשלבים הבאים 2.6-2.10, הכנס את הרכיבים האופטיים הרפלקטיביים לנתיב הקרן בזה אחר זה כדי לכוון את הלייזר לאורך הנתיב כפי שהוא משורטט על השולחן. השתמש בזוג הקשתית המוגדרת לגובה המדויק כדי להגדיר את נתיב קרן היציאה הרצוי ולהנחות את המיקום והיישור של כל רכיב מחזיר אור. עבור כל אלמנט, התאם את הגובה והמיקום של התושבת כדי להבטיח שהקרן הנכנסת תפגע במרכז. לאחר מכן, סובב את בסיס התושבת כדי לכוון את הקרן לאורך נתיב הקורה הנמשך על השולחן כך שהיא תעבור דרך שני האיריסים, וכוונן בעדינות את ההטיה של הקורה היוצאת עם הידיות בגב כל תושב.
הערה: לאחר שכל רכיב מיושר לגובה הנכון, הוסף צווארון מחליק לעמוד כדי להבטיח את הגובה.
- בשלבים הבאים 2.6-2.10, הכנס את הרכיבים האופטיים הרפלקטיביים לנתיב הקרן בזה אחר זה כדי לכוון את הלייזר לאורך הנתיב כפי שהוא משורטט על השולחן. השתמש בזוג הקשתית המוגדרת לגובה המדויק כדי להגדיר את נתיב קרן היציאה הרצוי ולהנחות את המיקום והיישור של כל רכיב מחזיר אור. עבור כל אלמנט, התאם את הגובה והמיקום של התושבת כדי להבטיח שהקרן הנכנסת תפגע במרכז. לאחר מכן, סובב את בסיס התושבת כדי לכוון את הקרן לאורך נתיב הקורה הנמשך על השולחן כך שהיא תעבור דרך שני האיריסים, וכוונן בעדינות את ההטיה של הקורה היוצאת עם הידיות בגב כל תושב.
- הרכבה ויישור של M1 על גבי TS1.
- הרכיבו ויישרו את הדיכרואית על השולחן.
- בהתאם להוראות היצרן, חבר את הגאלבו לגנרטור ספק הכוח והפונקציה.
- הרכיבו את הגלבו כך שהלייזר נמצא בדיוק במרכז המראה. הפעל את ה- galvo ולאחר מכן לחץ והחזק את לחצן AM במחולל צורת הגל כדי להגדיר את הטיית המראה לזרם DC של 0 V (מרכז הטווח). כעת, יישרו את הגלבו לאיריסים.
- הרכבה ויישור של מראה 2 (M2).
- הכנס את המראה הגלילית הגדולה לתושבת המראה הגלילית. השתמש במוטות כלוב 1 כדי לחבר מתאם כלוב 30-60 מ"מ מעל מראה 3 (M3). השתמש בידיות על תושבת המראה כדי לשטח את ההטיה של מראה M3 לצורך המיקום הראשוני.
- הרכיבו את כלוב יישור הזכוכית בעלת החלבית הכפולה במתאם הכלוב מעל M3; הקפד להדק את הברגים הקבועים במתאם הכלוב המחזיקים את כלוב היישור במקומו בכל פעם שהוא משמש ליישור. הרכיבו את M3 על השולחן, וכווננו את הגובה והמיקום עד שהקרן ממורכזת בערך בשני דיסקי היישור מזכוכית חלבית. הדקו את M3 לשולחן והשתמשו בתושבת עמוד, 3 בעמוד, מהדק 90° ו-2 בפוסט משני צידי M3 כדי להוסיף תמיכה באמצעות החורים המודבקים משני צדי תושבת המראה. השתמש בידיות בגב המראה כדי לכוונן את הקורה.
הערה: כל האלמנטים הרפלקטיביים בנתיב העירור מוגדרים כעת ואין לגעת בהם. - הרכיבו את עדשה 1 (L1) על השולחן. עבור כל מיקומי העדשה הראשוניים, השתמש במטרה מוברגת של העדשה כדי למרכז את הקרן הנכנסת בחלק הקדמי של העדשה. כוונן את ההטיה ואת המיקום הצידי של עדשה 1 (L1) עד שהקרן תתרכז בשני לוחות הזכוכית החלבית בכלוב היישור מעל M3.
- הר עדשה 2 (L2) במיקומו המתאים ליצירת מערכת 4f עם L1. הזיזו את L2 באופן אקסיאלי כדי לקבל קרן התנגשות, והשתמשו בלייזר העירור ובלוח הגזירה כדי לבדוק את ההתנגשות. כוונן את ההטיה ואת המיקום הצידי של L2 כדי למרכז את הקרן בשני דיסקי הזכוכית החלבית מעל M3.
- הרכיבו את חור הסיכה לתוך תושבת תרגום xy. הרכיבו זאת על גבי שלב תרגום 1D כדי לספק תרגום צירי עדין. הרכיבו את חור הסיכה והבמה על עמוד ועמוד, והניחו אותם בנקודת המוקד המשותפת בין L1 ל-L2. כוונן את חור הסיכה ביד עד שניתן יהיה לראות את אור הלייזר דרך חור הסיכה.
- הרכיבו את חיישן מד החשמל מיד לאחר חור הסיכה, והשתמשו בלחצן אורך הגל בקונסולה הדיגיטלית של מד החשמל כדי לבחור את אורך הגל של לייזר העירור. התאם את מיקום xy של חור הסיכה כדי למקסם את השידור ולקבל פרופיל קרן TEM00 קרוב. לאחר מכן, כוונן את חור הסיכה באופן אקסיאלי עם שלב 1D כדי למקסם עוד יותר את השידור.
- הרכיבו את עדשה 4 (L4) על השולחן במקומה, וכווננו את התושבת לגובה הנכון. כוונן את L4 באופן אקסיאלי כך שקרן העירור תתמקד על פני השטח של הגאלבו. כוונן את ההטיה ואת המיקום הצידי של L4 כדי למרכז את הקרן בשני דיסקי הזכוכית החלבית מעל M3.
- הרכיבו את עדשה 3 (L3) על השולחן במיקומה, וכווננו את התושבת לגובה הנכון. השתמש בלייזר העירור ובלוח הגזירה כדי לבדוק את ההתנגשות של L3 ו- L4. כוונן את ההטיה ואת המיקום הצידי של L3 כדי למרכז את הקרן בשני דיסקי הזכוכית החלבית מעל M3.
- הסר זמנית את L3. הרכיבו את עדשת סריקה 1 (SL1) על השולחן, וכווננו את המרחק הצירי ליצירת טלסקופ משולב עם L4, כפי שנמדד באמצעות לוח הגזירה. כוונן את ההטיה ואת המיקום הצידי של SL1 כדי למרכז את הקרן בשני דיסקי הזכוכית החלבית מעל M3.
- הכנס מחדש את L3. הרכיבו את עדשת הצינור 1 (TL1), והשתמשו בקרן העירור ובלוח הגזירה כדי לשלב SL1 ו-TL1. כוונן את ההטיה ואת המיקום הצידי של TL1 כדי למרכז את הקרן בשני דיסקי הזכוכית החלבית מעל M3.
- באמצעות טבעת מתאם, הברג את Objective 1 (O1) לתוך צלחת הכלוב שמעל M3. הסר SL1 באופן זמני, ותן לקרן לפגוע בתקרה. כוונן את הגובה (מרחק צירי) של O1 במערכת הכלוב עד שהקרן יוצרת דיסק אוורירי על התקרה, ולאחר מכן המשך לכוונן עד למזעור גודל הדיסק.
- כאשר O1 במקומו, הרכיבו את שלב הדגימה במיקום המתאים.
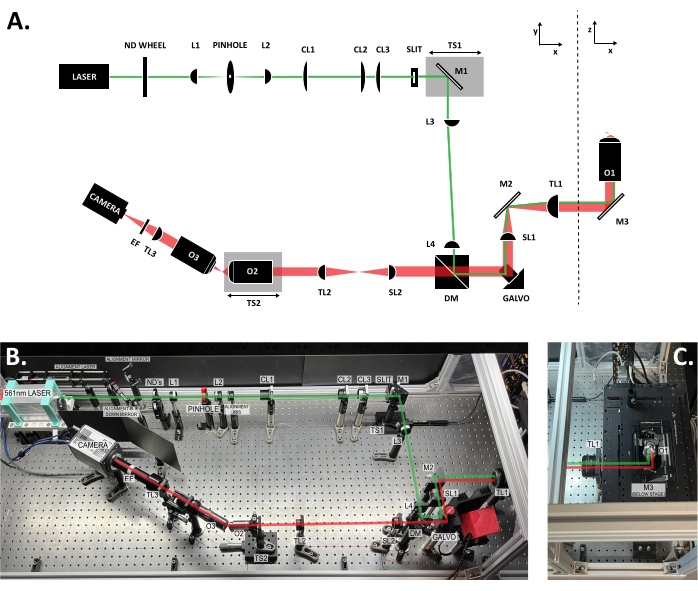
איור 3: מיקום הרכיבים בתוך מערכת SOLS. (A) פריסה סכמטית של מערכת SOLS עם כל הרכיבים המסומנים. (B) תמונה מלמעלה למטה של מערכת SOLS הפיזית בטבלה האופטית, למעט אזור שלב הדגימה. (C) תמונה מלמעלה למטה של אזור שלב הדגימה (הרחבה לאיור 3B). נתיב העירור מוצג בירוק. נתיב הפליטה מוצג באדום. אורכי מוקד של העדשות: L1: 100 מ"מ; L2: 45 מ"מ; CL1: 50 מ"מ; CL2: 200 מ"מ; CL3: 100 מ"מ; אורך 3:150 מ"מ; L4: 100 מ"מ; SL1: 75 מ"מ; TL1: 200 מ"מ; SL2: 150 מ"מ; TL2: 125 מ"מ; TL3: 200 מ"מ. עיין בטבלת החומרים לקבלת מפרטי חלקים מפורטים יותר. קיצורים: SOLS = גיליון אור חד-אובייקטיבי; גלגל ND = גלגל מסנן צפיפות נייטרלית משתנה; L1-L4 = עדשות כרומט קעורות פלאנו; CL1-CL3 = עדשות גליליות; M1-M3 = מראות; TS1-TS2 = שלבי תרגום; DM = מראה דיכרואית; Galvo = גלוונומטר סריקה; SL1-SL2 = עדשות סריקה; TL1-TL2 = עדשות צינור; O1-O3 = מטרות; EF = מסנן פליטה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. יישור נתיב הפליטה
- הגדר את לייזר היישור.
- הרכיבו שתי צלחות כלוב ריקות לצד לייזר העירור באותו גובה כמו הלייזר. השתמש בלוחות כלוב אלה כדי להרכיב את לייזר היישור על ידי החלקת מוטות הכלוב של לייזר היישור לתוך החורים הריקים בשני לוחות הכלוב. ודא שניתן לכוון את הלייזר למצב מופעל, על-ידי הקשה סביב לחצן ההפעלה או על-ידי חיווט מתג הפעלה/כיבוי.
- הסר את O1 והכנס מחדש את כלוב היישור מזכוכית חלבית. השתמש בתושבת מראה קינמטית אחת ובמראה נפתחת אחת כדי ליישר את קרן היישור לנתיב קרן העירור.
- השתמש במד החשמל כדי למקסם את האות של קרן היישור לאחר חור הסיכה על-ידי כוונון עדין של שתי המראות. ודא שהקרן נשארת מרוכזת בכלוב היישור של זכוכית חלבית.
- הסר את כלוב היישור והכנס מחדש את O1. מקם את המראה המרובעת על שלב הדגימה של O1, וכוונן את המראה באופן אקסיאלי עד למזעור גודל פרופיל הקרן לאחר הדיכרואית.
- הרכיבו קשתית אחת בנתיב הפליטה ומספיק רחוק לאחור כך שניתן יהיה להחדיר את עדשת הסריקה 2 (SL2), עדשת הצינור 2 (TL2) והמטרה 2 (O2) ללא הפרעה. ישר קשתית זו ללייזר היישור. הרכיבו דיסק זכוכית חלבית לפחות 1 אינץ' מאחורי הקשתית, וודאו שגם הוא מיושר לאור הלייזר.
- הכנס SL2 במרחק הנכון, כפי שנמדד מהגלבו עם סרגל. כוונן את ההטיה ואת המיקום הצידי של SL2 כך שקרן היישור הנכנסת תהיה ממורכזת ב-SL2 והקרן היוצאת תעבור דרך הקשתית ודיסק הזכוכית החלבית.
- הכנס את TL2 במרחק הנכון, כפי שנמדד מ- SL2 עם סרגל. כוונן את ההטיה ואת המיקום הצידי של TL2 כך שקרן היישור הנכנסת תהיה ממורכזת ב- TL2 והקרן היוצאת תעבור דרך הקשתית ודיסק הזכוכית החלבית.
- הרכיבו TS2 על השולחן. ודא שהבמה מתורגמת לאורך הציר האופטי של O2.
- הברג את O2 לתושבת תרגום xy. חבר פוסט מתחת לתושבת xy כדי לטעון את O2 לשלב התרגום. השתמש במטרה מוברגת כדי למרכז את החלק האחורי של O2 בלייזר האדום.
- כוונן את ידיות xy ואת ההטיה של O2 כך שקרן היישור האדומה תעבור דרך הקשתית ודיסק הזכוכית החלבית.
- הזיזו את לייזר היישור אל מעל O1 וכוונו כלפי מטה אל נתיב הפליטה. הפעל את הלייזר, וודא שקרן זו ממורכזת בכל העדשות בנתיב הפליטה.
- הצמידו את מישורי האישון של O1 ו-O2 על-ידי פתיחת הקשתית והסרת דיסקת הזכוכית החלבית כך שקרן היישור היוצאת מ-O2 תמשיך ללא הפרעה למשטח או קיר מרוחקים (0.5 מ' >0.5 מ') (איור 4). כוונן את TS2 עד שהקרן יוצרת דיסק איירי קטן על פני השטח, ולאחר מכן המשך לכוונן TS2 כדי למזער את גודל דיסק איירי.
הערה: אלומה שסטתה בחוזקה מציינת מיקום שגוי של O2. עם זאת, מכיוון שקרן זו עוברת דרך שתי מטרות, כמות קטנה של סטייה היא אינהרנטית. ככזה, הדיסק האוורירי הוא המדריך הטוב ביותר. - מטב את הגאלבו לסריקה אינווריאנטית נטויה: לחץ על לחצן FSK במחולל צורת הגל כדי לבחור אות גל משולש עבור הגאלבו, והגדר לתדר נמוך (~1 הרץ). שימו לב לקרן היישור על אותו משטח או קיר מרוחק.
הערה: אם הגלבו ממוקם בצורה שגויה, הקרן תטאטא אופקית על פני השטח יחד עם תנועת הגלבו. ניתן לפתור זאת באמצעות התאמות עדינות (ידניות) של מיקום ההטיה וה-xy של בסיס הגלבו עד שלא ניתן להבחין בתזוזת הקרן בעין. - בדוק את איכות המערכת על ידי הדמיה ב- 0°.
- הברג את O3 לתושבת תרגום xy. הבריגו צינור עדשה 1 בתוך שלב התרגום של הכלוב, והבריגו את שלב התרגום xy לתוך הצינור. השתמש בשני מוטות כלוב כדי לחבר את החלק הקדמי של שלב תרגום הכלוב לצלחת כלוב, והרכיב את צלחת הכלוב על עמוד. הר מטרה 3 (O3) קרוב לחזית O2 (~ 4-5 מ"מ) ב- 0°, וכוונן את הגובה בהתאם.
- הרכיבו דיסק יישור זכוכית חלבית במישור המוקד המשותף בין SL2 ל-TL2, כפי שנמדד באמצעות סרגל. הרכיבו את שקופית בדיקת הפלואורסצנט האקרילית על הבמה, והאירו את השקופית באמצעות לייזר העירור. הסתכלו דרך החלק האחורי של O3, התאימו הן את הגובה והן את המיקום הצירי של O3 כדי למצוא את אור הפליטה, ואז כווננו את O3 באופן אקסיאלי עד שאור הפליטה ימלא את הצמצם האחורי (איור 5).
- הבריגו שני מוטות 8 בכלוב לחלק האחורי של שלב התרגום של O3. החלק צלחת כלוב עם דיסק זכוכית חלבית מותקן על המוטות, ולאחר מכן כוונן את O3 באמצעות תושבת xy כדי להבטיח שנורית הפליטה תצא מ- O3 ממורכזת. לאחר מכן, הסר את מוטות הכלוב.
- הרכיבו דיסק זכוכית חלבית במיקום המחוספס של חיישן המצלמה, והתאימו את הגובה והמיקום של הדיסק לאור הפליטה.
- הברג את עדשת הצינור 3 (TL3) לתוך צלחת כלוב, והרכיב אותה מיד מאחורי O3. מרכז את TL3 באור הפליטה הנכנס, ולאחר מכן כוונן את ההטיה של TL3 כדי ליישר את האור היוצא לדיסק הזכוכית החלבית.
- הרכיבו את המצלמה במרחק הנכון מעדשת הצינור, כפי שנמדד באמצעות סרגל.
- הברג את 2 צינורות העדשה ואת מסנן הפליטה למצלמה.
- הרכיבו מחדש את דיסק היישור מזכוכית חלבית במישור המוקד המשותף בין SL2 ל-TL2. הרכיבו את דגימת בדיקת הצבע הפלואורסצנטי, והאירו את הדגימה עם קרן העירור.
- הפעל את המצלמה ולאחר מכן פתח את התוכנית Micromanager במחשב המחובר. לחץ על Live כדי להיכנס לתצוגה חיה. לחץ על Auto Once כדי להגדיר את הגדרות החשיפה הראשוניות, ולאחר מכן אפס את החשיפה לפי הצורך בעת ההדמיה.
הערה: Micromanager לא יפעל כראוי אלא אם כן הוא נפתח לאחר הפעלת המצלמה. - כוונן את ידיות התרגום xy בתושבת O3 עד שהחור הקטן בדיסק יישור הזכוכית יהיה ממורכז בשדה הראייה (FoV). כוונן את O3 באופן אקסיאלי עם שלב תרגום הכלוב עד שהחור יהיה ממוקד; הקצוות צריכים להיראות חדים (איור 6).
- תמונה חרוזים פלואורסצנטיים כדי לבדוק את איכות המערכת.
- הסר את דיסק היישור של זכוכית חלבית, טען את דוגמת החרוזים התלת-ממדית והאר את הדגימה באמצעות קרן העירור.
- התאימו את גובה הדגימה ביחס ל-O1 עד שהחרוזים הפלואורסצנטיים ימלאו אזור מעגלי במרכז ה-FoV.
- כוונן בעדינות את המיקום של O3 באמצעות שלב xy ושלב התרגום הצירי עד שפונקציות פיזור הנקודות (PSFs) יהיו עגולות (המעידות על סטיות מינימליות) ובהירות (המעידות על יחס אות לרעש טוב) (איור 7). אם לא ניתן להשיג זאת על ידי התאמת O3, סביר מאוד להניח שהמערכת האופטית בין רכיבי O1 ו- O2 מיושרת באופן תת-אופטימלי; בצע את בדיקות האבחון בשלב 3.13 להלן.
- אם ניתן להשיג PSF עגול, דלג על שלב האבחון, ועבור להטיית מערכת ההדמיה.
- בצע בדיקות אבחון במידת הצורך.
הערה: לאחר קבלת PSF טובים, ניתן לדלג על שאר שלבי האבחון.- הרכיבו את אור השדה הבהיר (BF) מעל O1. הרכיבו את יעד בדיקת הרשת החיובית על שלב הדגימה באותו גובה ציר כמו מראה היישור. מרכז את הרשת בגודל 10 מיקרומטר, והאיר את הרשת באור BF.
- צלם את הרשת במצלמה ותרגם את הדגימה עד שהרשת תהיה ממוקדת. השתמש בתמונת הרשת כדי לאשר שהשדה על פני ה- FoV שטוח: אם לא, הרשת תיראה מעוותת וקמורה. כדי לתקן תמונת רשת שגויה, התאם את מיקום xyz ואת ההטיה של O3 ולאחר מכן כוונן את TL3 ואת המצלמה בהתאם.
הערה: אם ניתן להשיג רשת שטוחה, חזור על שלב 3.12.10 ולאחר מכן עבור להטיית מערכת ההדמיה. - הגדר את מצלמת היישור או את מצלמת ההדמיה במרחק הנכון כך ש- SL2 ימקד את התמונה לחיישן. דמיינו את יעד הרשת במישור הביניים (איור 8). אם גם רשת זו מוטה, סביר מאוד להניח שהמערכת האופטית בין רכיבי O1 ו-SL2 מיושרת באופן תת-אופטימלי ויש לבחון אותה מחדש. מטב את היישור לפי הצורך לפני ההתקדמות.
הערה: אם המצלמה אינה מתאימה בין SL2 ל-TL2, השתמש במראה נוספת כדי להקפיץ את התמונה ב-90° לאחר SL2 אל המצלמה. - בדוק את PSFs במישור הביניים: לאחר בדיקת הרשת, בדיקת אבחון טובה נוספת היא לבדוק את PSFs באותו מישור ביניים. תמונה טובה במישור הזה, שדומה לאיור 7 אך בהגדלה שונה (איור 9), מצביעה על יישור טוב דרך SL2.
הערה: אם ניתן להשיג רשת שטוחה ו-PSF עגולים במישור הביניים, חזור על שלב 3.13.2, לאחר מכן על שלב 3.12.10 ולאחר מכן עבור להטיית מערכת ההדמיה.
- הטה את תת-מערכת ההדמיה O3 ל-30°.
- הסר את O3, TL3 ואת המצלמה.
- הכנס מחדש את O3 ב- 30° לציר האופטי של O2 באמצעות הקווים שבטבלה כקו מנחה.
- הרכיבו דיסק יישור זכוכית חלבית במישור המוקד המשותף בין SL2 ו-TL2. הרכיבו את שקופית בדיקת הפלואורסצנט האקרילית על הבמה, והאירו את השקופית באמצעות לייזר העירור. שוב, הסתכל דרך החלק האחורי של O3, כוונן הן את הגובה והן את המיקום הצירי של O3 כדי למצוא את אור הפליטה ב- 30°, ולאחר מכן כוונן את O3 באופן אקסיאלי עד שנורית הפליטה תמלא את הצמצם האחורי.
- הסר את דיסק היישור של הזכוכית החלבית בין SL2 ל-TL2 כדי לקבל אות פליטה חזק יותר.
- הבריגו שני מוטות 8 בכלוב לחלק האחורי של שלב התרגום של O3. החלק צלחת כלוב עם דיסק זכוכית חלבית מותקן על המוטות, ולאחר מכן כוונן את O3 באמצעות תושבת xy כדי להבטיח שנורית הפליטה תצא מ- O3 ממורכזת. לאחר מכן, הסר את מוטות הכלוב.
- הרכיבו דיסק זכוכית חלבית במיקום המחוספס של חיישן המצלמה, והתאימו את הגובה והמיקום של הדיסק לאור הפליטה.
- הר TL3 מיד מאחורי O3. מרכז את TL3 באור הפליטה הנכנס, ולאחר מכן כוונן את ההטיה של TL3 כדי ליישר את האור היוצא לדיסק הזכוכית החלבית.
- כדי להגדיר בצורה מדויקת יותר את מרחק מצלמת TL3, פתח בזהירות את בורג O3 והרכיב את לייזר היישור כך שהוא יתמקד על ידי TL3 על המצלמה. השתמש במסנני ND לפי הצורך כך שעוצמת הלייזר תהיה <1 mW. הפעל את התצוגה החיה של המצלמה וכוונן את TL3 באופן אקסיאלי כדי למזער את נקודת הלייזר במצלמה.
- הרכיבו מחדש את דיסק היישור מזכוכית חלבית במישור המוקד המשותף בין SL2 ל-TL2. הרכיבו את דגימת בדיקת הצבע הפלואורסצנטי, והאירו את הדגימה עם קרן העירור. כוונן את ידיות התרגום xy בתושבת O3 עד שהחור הקטן בדיסק יישור הזכוכית יהיה בתוך ה- FoV במצלמה. כוונן את שלב תרגום הכלוב כדי להזיז את O3 באופן אקסיאלי עד שהחור יהיה ממוקד; ודא שהחור נראה דומה לזה שבו הוא נראה ב-0°.
- הרכיבו מחדש את יעד בדיקת הרשת החיובית באותו גובה ציר, והאירו את הרשת באור BF. ודא שרק מקטע אנכי אחד נמצא בפוקוס (עקב הטיה של 30°). שוב, השתמש בתמונת הרשת כדי לאשר שהשדה על פני ה- FoV שטוח, גם כאשר אינו ממוקד. כאשר השקופית מתורגמת באופן אקסיאלי, ודא שהחלק במיקוד של ה- FoV (יעד רשת) מסתובב אופקית על-פני המסך, בעוד שריבועי הרשת שומרים על גודל עקבי (איור 10).
הערה: עקב ההטיה של מישור ההדמיה בדגימה, הרשת עשויה להיראות מתוחה מעט במישור x.
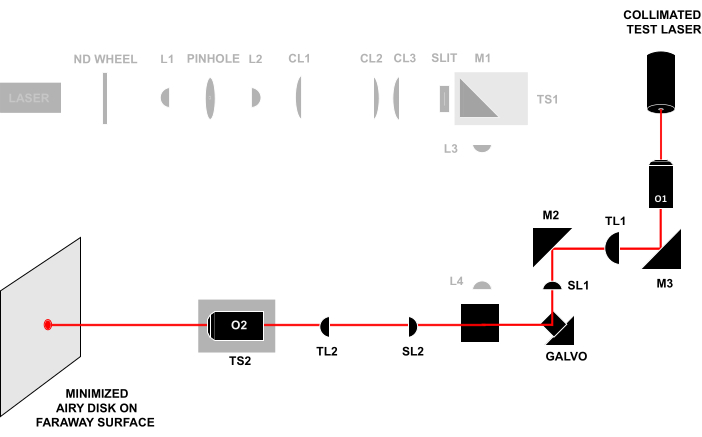
איור 4: טכניקת לייזר בלייזר. שליחת אלומת בדיקה מעורבת דרך חזית O1 והתבוננות באלומה היוצאת מ-O2 על משטח מרוחק. אם כל הרכיבים מיושרים במרחק הנכון, הקרן תיצור דיסק אוורירי קטן על המשטח הרחוק. כל הקיצורים זהים לאלה שבאיור 3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: ניצול אור פליטה לצורך יישור. (A) אור פליטה משקופית פלואורסצנטית אקרילית על מטרת הברגה מאחורי BFP של O2. (B) מציאת אור הפליטה על ידי ראייה דרך החלק האחורי של O3. קיצורים: O2-O3 = מטרות; BFP = מישור מוקד אחורי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: תמונה במצלמה של דיסק היישור מזכוכית חלבית ממוקד כהלכה. הדיסק הוצב במישור הביניים בין SL2 ל-TL2. סרגל קנה מידה = 50 מיקרומטר. קיצורים: SL2 = עדשת סריקה; TL2 = עדשת צינור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 7: תמונת מצלמה של דגימת חרוזים תלת-ממדית. התמונה מציגה חרוזים בגודל 1 ננומטר כאשר מודול ההדמיה מוגדר ל-0° ומואר על ידי קרן עגולה לפני החדרת העדשות הגליליות. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 8: יעד בדיקת רשת חיובי ממוקד נכון במישור הביניים בין SL2 ל-TL2. הרשתות השטוחות לאורך כל השדה מצביעות על יישור טוב של הרכיבים SL2 ולפני כן. סרגל קנה מידה = 30 מיקרומטר. קיצורים: SL2 = עדשת סריקה; TL2 = עדשת צינור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
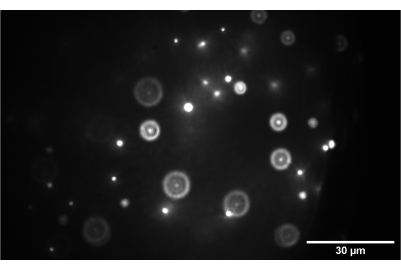
איור 9: תמונת מצלמה של דגימת החרוזים התלת-ממדית. התמונה מציגה חרוזים בגודל 1 ננומטר הממוקדים כראוי במישור הביניים בין SL2 ל-TL2. סרגל קנה מידה = 30 מיקרומטר. קיצורים: SL2 = עדשת סריקה; TL2 = עדשת צינור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 10: יעד בדיקת רשת חיובי עם ריבוע צהוב בגודל עקבי כדי להתאים לריבועי הרשת. (A) רשת ממוקדת בצד שמאל. (B) רשת ממוקדת בצד ימין. הריבוע הצהוב תואם את גודל תיבות הרשת משני צידי ה- FoV. פסי קנה מידה = 30 מיקרומטר. קיצור = FoV = שדה הראייה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. יישור יריעת האור האלכסונית
- הסר את O1 והכנס מחדש את כלוב היישור של זכוכית חלבית כפולה במקומו. ודא כי הקרן היא collimated ומרוכז על שני דיסקים זכוכית חלבית.
- הברג עדשה גלילית 1 (CL1) לתושבת עדשה מסתובבת. חבר CL1 לתוך הנתיב האופטי, וסובב את התושבת כך שהקרן תורחב בכיוון אנכי לטבלה האופטית. כוונן את ההטיה ואת המיקום הצידי של CL1 כך שהקרן תהיה ממורכזת בחזית ותשמור על מיקום ממורכז בשני דיסקי הזכוכית החלבית.
- הברג עדשה גלילית 2 (CL2) לתושבת עדשה מסתובבת, והרכיב את CL2 בנתיב האופטי במרחק הנכון כדי ליצור מערכת 4f עם CL1. סובב את CL2 לאותו כיוון כמו CL1 כך שהקרן תימתח בכיוון אנכי לשולחן האופטי ותתלכד. השתמש בכרטיס בדיקה כדי למדוד את גובה פרופיל הקרן הגלילית במספר מיקומים כדי להבטיח שהקרן מתנגשת. כוונן את ההטיה ואת המיקום הצידי של CL2, כפי שמבוצע בשלב 4.2.
- הברג עדשה גלילית 3 (CL3) לתושבת עדשה מסתובבת, והרכיב את CL3 בנתיב האופטי במרחק הנכון כדי ליצור מערכת 4f עם L3. סובב את CL3 לאותו כיוון כמו CL1 ו-CL2 כך שהקרן תתמקד כלפי מטה לפרופיל יריעה אופקי במישור המוקד. כוונן את ההטיה ואת המיקום הצידי של CL3, כפי שמבוצע בשלב 4.2.
- הכנס את החריץ: באמצעות ארבעה מוטות כלוב 4 אינץ' ותושבת הכלוב CL3, התקן את החריץ בכיוון אנכי במישור המוקד בין CL3 ל- L3, כפי שנמדד באמצעות סרגל. השתמש בפרופיל קרן העירור המתוחה כדי להתאים את הגובה ואת המיקום הרוחבי של החריץ עד שהוא ממורכז בקורה.
- הכנס מחדש את O1, הרכיב את דגימת בדיקת הצבע הפלואורסצנטי והאיר את הדגימה עם גיליון נורית העירור. בחיישן המצלמה, ודא שגיליון האור 0° מופיע כגיליון אנכי דק (איור 11A).
- הסירו את דגימת בדיקת הצבע הפלואורסצנטי ונגבו את O1 נקי. תן לגיליון האור להתרחב מעל O1 ללא הפרעה. באמצעות בקרת שלב התרגום הממונעת, תרגם את M1 לכיוון העדשות הגליליות כדי להגדיר את זווית יריעת האור לכ- 60° ביחס לציר האופטי של O1.
הערה: חיוני שגיליון האור יהיה מוטה בכיוון הנכון כדי ליישר קו עם מישור ההדמיה המוטה באופן דומה (איור 12); אם מערכת ערוכה באופן שונה מעיצוב ספציפי זה, ניתן להבין את הכיוון הנכון של ההטיה באמצעות מעקב קרניים גיאומטרי.
הערה: לשם השוואה, תרגום M1 2.647 מ"מ לכיוון החריץ כיוון את גיליון האור להטיה הנכונה בהגדרה זו. - הכנס מחדש את דוגמת בדיקת הצבע הפלואורסצנטי כדי לצלם את הגיליון המוטה. ודא שיריעת האור שמרה על צורת אלומה אנכית במצלמה, אך היא רחבה וחלשה יותר (איור 11B).
- תרגם את הדגימה באופן אקסיאלי עם הבמה כך שהצבע הפלואורסצנטי יואר על ידי יריעת האור בחמישה עומקים שונים בין מרכז ה- FoV לצד הימני של המסך. שמור כל תמונה.
- פתח את התמונות בפיג'י. לכל תמונה, בחרו בכלי קו וציירו קו אופקי ממרכז ה-FoV למרכז גיליון האור. כדי למדוד את התזוזה, עבור אל ניתוח | מדדו כדי לראות את אורך הקווים. לאחר מכן, התווה את התזוזה של גיליון האור כפונקציה של עומק הדגימה כדי לחשב את זווית יריעת האור מעל O1.
- תרגם מעט את M1. חזור על שלבים 4.9 ו- 4.10 עד שזווית גיליון האור תהיה 60° מהציר האופטי של O1, בהתאם לזווית מישור ההדמיה.

איור 11: תמונות מצלמה של דגימת בדיקת הצבע הפלואורסצנטי מוארות על-ידי יריעת אור בעלת צורה נכונה. (A) היריעה ב-90°, ישרה כלפי מעלה לאורך הציר האופטי של O1, ו-(B) מוטה ל-30° (60° לציר האופטי של O1). פסי קנה מידה = 50 מיקרומטר. קיצור: O1 = אובייקטיבי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
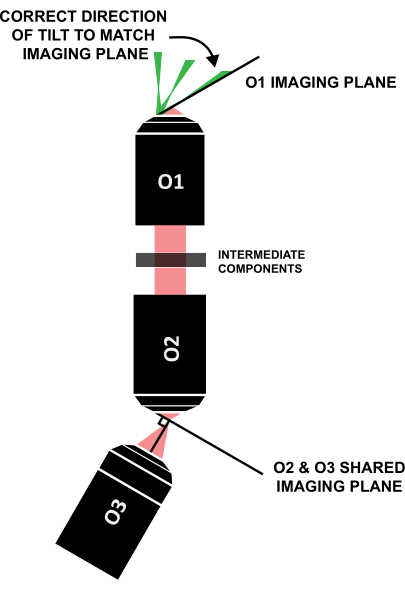
איור 12: כיוון נכון של הטיית גיליון האור כדי ליישר עם מישור ההדמיה של O1. קיצור: O1-O3 = מטרות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. כוונון עדין של המערכת להדמיה ואיסוף נתונים
- הרכיבו את שקופית החרוזים התלת-ממדית, ותרגמו את הדגימה באופן אקסיאלי עם הבמה עד שהחרוזים ימלאו את ה-FoV במצלמה.
- כוונן את O3 באמצעות שלב xy ושלב תרגום הכלוב, במטרה למזער סטיות ולמטב את יחס האות לרעש בתמונה (איור 13).
- התאימו את צווארון התיקון של O1, במטרה למזער סטיות ולמטב את יחס האות לרעש בתמונה.
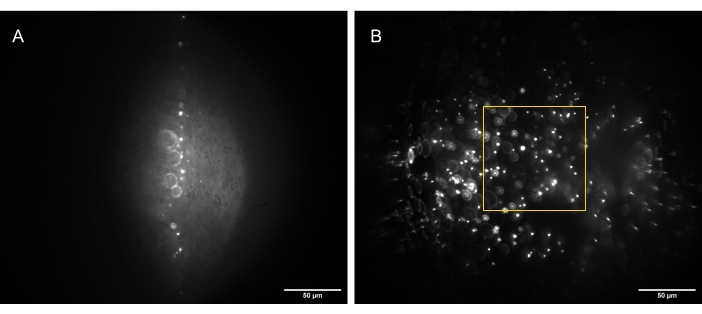
איור 13: תמונות מצלמה של דגימת חרוזים תלת-ממדית (חרוזים של 1 מיקרומטר) מוארות על-ידי יריעת אור בעלת צורה נכונה. (A) גיליון ב-90°, ישר כלפי מעלה לאורך הציר האופטי של O1, ו-(B) מוטה ל-30° לציר האופטי של O1. התיבה הצהובה מציינת את החלק של ה- FoV שהוא שטוח, עקבי וניתן לשימוש (80 מיקרומטר x 80 מיקרומטר) ובו ניתן ללכוד נתונים אמינים. פסי קנה מידה = 50 מיקרומטר. קיצורים: O1 = אובייקטיבי; FoV = שדה ראייה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. כיול ההגדלה של המערכת
- הרכיבו את יעד בדיקת הרשת החיובית על שלב הדגימה, והאירו באור השדה הבהיר.
- תרגם את שקופית הרשת באופן אקסיאלי עם הבמה כדי למקד את שקופית הרשת. מקד את מרכז הרשת.
- צלם ושמור את התמונה ולאחר מכן פתח אותה בפיג'י.
- השתמשו בכלי קו ובפונקציה 'מדידה' בפיג'י כדי למדוד במדויק את המרחק בין שני קווי רשת בפיקסלים. חלק ערך זה במרחק הידוע (10 מיקרומטר), כדי לקבוע את כיול הפיקסל למיקרון.
- חשב את ההגדלה (M) של המערכת באמצעות הגודל הנמדד של הפיקסל והגודל הידוע של פיקסל באמצעות משוואה (1).
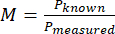 (1)
(1)
7. רכישת סריקות נפחיות
- מקם את המדגם.
- הפעל את התצוגה המקדימה של המצלמה, galvo, מחולל פונקציות, ספק כוח, במה ולייזר עירור.
- הר את הדגימה ולאחר מכן לחץ על לחצן FSK במחולל הפונקציות כדי להגדיר גל משולש. כדי למצוא את הדגימה, השתמש במחולל הפונקציות כדי להגדיר את הדברים הבאים: משרעת שיא לשיא של 400 mV (באמצעות לחצן Ampl. ), היסט 0 (באמצעות לחצן היסט ) ותדר 200 MHz. השתמש בחלון Micromanager כדי להגדיר זמן חשיפה של 100 אלפיות השנייה.
- גלול ב- z באופן ידני עד שתגיע למישור הדגימה. מטב את הגדרת z כך שהאזור הרצוי לסריקה נפחית יעבור דרך המסך במהלך מחזור אחד.
- בחר את פרמטרי הסריקה.
- ודא שמשרעת השיא מוגדרת כראוי על-ידי בדיקה חזותית שהתצוגה המקדימה נראית ממוקדת למשך הסריקה. אם איכות התמונה יורדת מוקדם יותר בקצה אחד של הסריקה מאשר בקצה השני, ערוך את ההסטה במחולל הפונקציות כדי להזיז את מרכז הסריקה לכיוון האזור הטוב יותר.
- בתוכנית Micromanager, בחר זמן חשיפה, ולחץ על Multi-D Acq. כדי לפתוח את חלון רכישה רב מימדית. השתמש בתיבה ספירה כדי לבחור את מספר המסגרות, שתגדיר את זמן הרכישה הכולל. המרווח בין מסגרות (קצב מסגרות) ייקבע לפי זמן החשיפה , אלא אם צוין בתיבה מרווח זמן ארוך יותר. במחולל הפונקציות, הגדר את התדר ליצירת סריקה בנפח מלא במחצית מהתקופה של פונקציית הגל המשולש (סריקה ליניארית בכיוון אחד).
הערה: אם קצב המסגרות והתדירות נמוכים מדי, יתקבלו מעט מדי מסגרות לסריקת נפח, ומספר המסגרות הנמוך ייצור לכלוכים גלויים בעיבוד שלאחר העיבוד. לשם השוואה, איור 13 הורכב מ ~100 פריימים בסריקה, ואיור 14 הורכב מ ~800. זה גם קריטי לשקול את המדגם עצמו בעת בחירת הפרמטרים. ודא שזמן החשיפה מוגדר כך שהדגימה תהיה מספיק נרגשת אך לא רוויה. ניתן לכוונן גם את עוצמת לייזר העירור למטרה זו. אם המשתמש רוכש סדרה של סריקות נפחיות כדי לאפיין תהליך משתנה זמן בתלת-ממד, ודא שציר הזמן של הסריקה חורג מהדינמיקה של ציר הזמן של המערכת.
- איסוף סרטונים: השג קיטועי זמן שלוכדים לפחות את משך הזמן של עלייה או רמפה מלאה של גל המשולש, המתאים לסריקה מלאה אחת של עוצמת הקול.
8. הליכים לאחר עיבוד
- הטיית ערימות תמונות נפחיות
- הטה את סריקות עוצמת הקול כדי להמיר את ערימת התמונות במישורים מוטים לסדרת תמונות בקואורדינטות xyz אמיתיות.
הערה: קיימים מדריכים מצוינים רבים על עיבוד תמונה בגיליון אור ותוכנות קוד פתוח לביצוע הטיית השולחן של סריקות נפח קיימות, כמו גם לביצוע הטיית שולחן ושמירת תמונות מוטות במהלך רכישה24. - כדי להטות את סריקות עוצמת הקול, קבל את שני הפרמטרים הבאים: המרחק האמיתי בין שתי מסגרות בפיקסלים (d), והזווית בין מישור המסגרת למישור x-y (θ נקבע לפי זווית יריעת האור האלכסונית (במערכת זו, 30°). המרחק בין המסגרות יהיה תלוי באופטיקת ההדמיה ובהגדרות הרכישה.
- הטה את סריקות עוצמת הקול כדי להמיר את ערימת התמונות במישורים מוטים לסדרת תמונות בקואורדינטות xyz אמיתיות.
- מציאת הפרמטר d
- כייל את המרחק בין מסגרות עבור כל פעם שהמערכת מיושרת מחדש באופן משמעותי. בצע כיול זה עם ערימה של תמונות של חרוזים פלואורסצנטיים, מכיוון שהם הקלים ביותר לשימוש לאבחון בעיות.
- רכוש ערימה של תמונות, והפעל את קוד ההטיה באמצעות כל ניחוש ראשוני עבור הפרמטר d . פתחו את אוסף התמונות המוטה ב-ImageJ וגללו בערימה. אם d הוגדר רחוק משמעותית מערכו האמיתי, שימו לב שהחרוזים ייראו מוארכים באופן מלאכותי ב-x או y, וחרוזים בודדים ייראו כאילו הם נעים במישור xy כשהמשתמש גולל בין המסגרות ב-z (במקום להתמקד ולבטל מיקוד מאותה נקודה מרכזית). חזור על הפרמטר d מספר פעמים עד שבעיות אלה אינן גלויות עוד.
- ברגע שהפרמטר d נראה קרוב במידה סבירה לערך האמיתי, חשב הקרנות בעוצמה מרבית של אוסף התמונות לאורך הכיוונים x ו- y. שימו לב שחרוזים בקוטר הקרוב לגבול העקיפה עשויים להיראות מוארכים ב-z, אך באופן אידיאלי הם לא צריכים להיראות חרוטיים או מוארכים באלכסון. כוונן את פרמטרי ההטיה עד שקריטריונים אלה לא ישתפרו באופן משמעותי עם חזרות חדשות. לשם השוואה, הנתונים המוצגים באיור 13 היו מוטים ב-d = 2.50 פיקסלים, והנתונים באיור 14 היו מוטים ב-d = 1.0 פיקסלים.
הערה: המרחק בין מסגרות יהיה תלוי באופן ליניארי באמפליטודת הסריקה, בתדירות ובקצב המסגרות.
תוצאות
ביצענו סריקות נפחיות של חרוזי 1 מיקרומטר המשובצים בגומי גלן. איור 14 מראה את התחזיות בעוצמה מרבית של סריקות נפחיות מוטות לאורך כיווני x, y ו-z.

איור 14: הדמיה נפחית של חרוזים פלואורסצנטיים של 1 מיקרומטר בגומי גלאן. מוצגות הקרנות בעוצמה מרבית של סריקות נפחיות מוטות. פסי קנה מידה = 30 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הדגמנו את השימוש במיקרוסקופ אור חד-תכליתי כדי לאפיין רשתות ציטו-שלד משוחזרות על ידי ביצוע סריקות נפחיות של דגימות של אסטרים מיקרוטובוליים. בקצרה, מיקרוטובולים מיוצבים בתווית רודמין וטקסול עברו פולימריזציה מדימרים משוחזרים על ידי GTP; לאחר מכן, לאחר פילמור, אשכולות מוטוריים קינזין מבוססי סטרפטווידין עורבבו לדגימות יחד עם ATP עבור ריכוזים סופיים של 6 מיקרוטובולים של 6 מיקרו-צינורות, דימרים קינזין של 0.5 מיקרומטר ו-10 מילימטר ATP. פרוטוקולים ומדריכים נרחבים להכנת מיקרוטובולים מיוצבי טקסול וצברי מנוע קינזין ניתן למצוא באתרי האינטרנט Mitchson Lab ו- Dogic Lab25,26. הדגימות הוכנסו בעדינות לשקופיות מיקרוסקופ, נאטמו והורשו לשבת במשך 8 שעות לפני ההדמיה כדי לאפשר הפסקת פעילות מוטורית כך שהדגימות הגיעו למצב מבני יציב הדומה לאסטרים.
מחקרים על מערכות שלד ציטו-שלד משוחזרות משתמשים לרוב במיקרוסקופ קונפוקלי או אפיפלואורסצנטי כדי לסמן חוטים מסומנים. עם זאת, שתי הטכניקות הללו מוגבלות ביכולתן לצלם דגימות תלת-ממד צפופות27. בעוד התקדמות רבה נעשתה במחקר חומר פעיל מבוסס שלד חוץ גופי על ידי הגבלת דגימות להיות quasi2D 28,29, רשתות cytoskeleton הן תלת ממדיות מטבען, ומאמצים עכשוויים רבים טמונים בהבנת ההשפעות שיכולות להתעורר רק בדגימות תלת ממד29,30, ובכך ליצור צורך בהדמיה תלת ממדית ברזולוציה גבוהה.
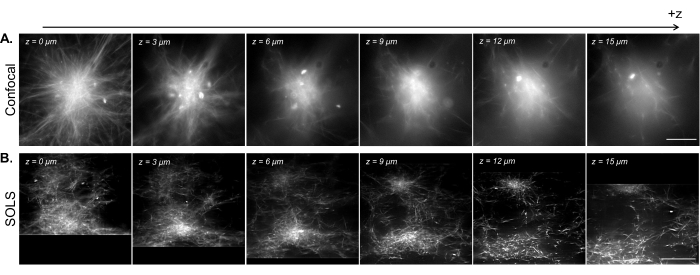
איור 15: הנחיית הדמיה תלת-ממדית של דגימות שלד ציטו-שלד משוחזרות באמצעות מיקרוסקופ יריעות אור חד-אובייקטיבי. (A) תמונות של אסטרים פלואורסצנטיים של מיקרוטובולים שנרכשו במיקרוסקופ קונפוקלי סורק לייזר של Leica DMi8. התמונות מציגות מישורים שונים מסריקת Z. סרגל קנה מידה = 30 מיקרומטר. (B) תמונות מפותלות מסריקה נפחית המבוצעת על הגדרת גיליון אור חד-אובייקטיבי של אותה דגימה. סרגל קנה מידה = 30 מיקרומטר. אזור התמונה המוטה כאן מתאים ל-FoV (קופסה צהובה) השמיש שהודגם באיור 13B. בעוד שהקונפוקל מצטיין בהדמיה של מישורים בודדים ליד הכיסוי, צפיפות הדגימה הפלואורסצנטית גורמת לסיבוכים בעת הדמיה במישורים גבוהים יותר בשל האות הנוסף מתחת למישור ההדמיה. יריעת האור עוקפת בעיה זו על ידי הארת מישור ההדמיה בלבד, ובכך מאפשרת הדמיה חדה אחידה במישורים שונים ב-z. קיצורים: SOLS = גיליון אור חד-אובייקטיבי; FoV = שדה ראייה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
באיור 15 אנו מדגימים הדמיה נפחית של רשת מיקרוטובולים משוחזרת שהתכווצה למבנים דמויי אסטר על-ידי צבירי מנועי קינזין. כפי שהוכח במחקר קודם 28,31, מבנים תלת-ממדיים אלה נוטים לגדול צפופים לכיוון המרכז, וכתוצאה מכך אזורים בהירים של פלואורסצנטיות השולטים באות. במישורי הדמיה ליד הכיסוי (רמת z נמוכה), מיקרוסקופ קונפוקלי (איור 15A) יכול לפתור חוטים בודדים סביב הפריפריה של האסטר, עם רקע נוסף לכיוון המרכז עקב אותות פלואורסצנטיים לא ממוקדים מלמעלה. עם זאת, הזזת כמה מיקרונים ב-z מפחיתה במהירות את איכות התמונות בשל העובדה שחלקים צפופים מחוץ למיקוד של האסטר שולטים באות במישור ההדמיה. ההארה החד-מישורית של יריעת האור (איור 15B) מבטלת את האותות מחוץ למיקוד מהחלקים הצפופים של האסטר מעל ומתחת למישור ההדמיה, ובכך מאפשרת איכות תמונה דומה בין המישורים. יכולתה של יריעת האור להפיק נתוני סריקה נפחית איכותיים ואמינים פותחת את האפשרות להמחיש ולאפיין תופעות תלת-ממדיות במערכות ציטו-שלד משוחזרות.
Discussion
שני פרטים חשובים לגבי פרוטוקול זה הם העלות הכוללת של המערכת וזמן הבנייה והיישור הצפוי. למרות שהעלות המדויקת משתנה, אנו יכולים להעריך בנוחות כי עלות הטוטו של SOLS זה או מערכת DIY דומה תיפול בטווח של 85,000 דולר. נציין כי אומדן זה לוקח בחשבון את המחיר הקמעונאי של כל הרכיבים, ולכן מחיר כולל זה עשוי להיות מופחת מאוד על ידי מיקור רכיבים משומשים. מבחינת זמן הבנייה, יהיה זה הגיוני לצפות ממשתמש עם ניסיון מועט באופטיקה לבנות וליישר את כל מערכת ה-SOLS הזו תוך 1-2 חודשים, בתנאי שכל הרכיבים זמינים ומוכנים. למרות אורכו ומורכבותו של הפרוטוקול, אנו מאמינים כי כמות הפרטים בכתב היד הכתוב, יחד עם פרוטוקול הווידאו, צריכה להפוך פרוטוקול זה לפשוט ומהיר לביצוע.
ישנם שני שלבים קריטיים בפרוטוקול זה. ראשית, מיקום הגלבו קובע את מיקומן של עדשות רבות מכיוון שהוא חלק משלושה זוגות נפרדים של עדשות 4f. חיוני שהגלבו יהיה מצומד עם מישורי המוקד האחוריים של O1 ו-O2 וממורכז כראוי כדי להבטיח סריקה אינווריאנטית נטויה. שנית, איכות התמונה רגישה ביותר ליישור של O2 ו-O3 זה ביחס לזה. כאן, יש להקפיד לוודא שראשית, זווית היישור של O3 ל-O2 תואמת את ההטיה של יריעת אור העירור, ובכך מספקת תאורה שטוחה מקסימלית על פני ה-FoV המוטה באופן דומה. שנית, O3 חייב להיות ממוקם במרחק הציר הנכון כדי לשמור על FoV שטוח עם שטח גדול ככל האפשר. שלישית, O3 חייב להיות ממוקם במרחק הרוחבי הנכון מ- O2 כדי למקסם את האות שעובר דרך ממשק O2-O3.
במונחים של FoV שמיש, מערכת זו השיגה שדה שטוח ואמין עם תאורה עקבית על פני שטח 80 מיקרומטר x 80 מיקרומטר. שטח זה קטן יותר מה-FoV המרבי שמספקת המצלמה, כך שה-FoV השמיש מצוין על-ידי הקופסה הצהובה באיור 13. במונחים של כוח הפתרון, מערכת זו השיגה מרחק מינימלי ניתן לפתרון של 432 ננומטר לאורך ציר x ו 421 ננומטר לאורך ציר y, אשר נמדד על ידי מציאת הממוצע סיגמא x ו- y של התאמות גאוס לפונקציות התפשטות נקודתית (PSFs) ב- FoV הטוב והכפלה בשניים. נציין כי מערכת זו לא עברה אופטימיזציה במונחים של ה-NA הכולל שלה, כלומר יש מקום לשיפור משמעותי אם המשתמשים רוצים כוח פתרון גבוה יותר ממה שמערכת זו השיגה. ישנן מספר רב של אפשרויות אובייקטיביות תואמות עבור סוג זה של בניית SOLS, שרבות מהן יתרמו לרזולוציית מערכת גבוהה יותר אך עם חסרונות של עלות גבוהה יותר, FoV קטן יותר, או טכניקות יישור מסובכות יותר בממשק הממסר 8,11,13,20. בנפרד, אם המשתמשים ירצו ב-FoV גדול יותר, שילוב גלבו שני שיאפשר סריקה דו-ממדית ישיג מטרה זו, אך ידרוש אופטיקה נוספת ומכניקת בקרה כדי להשתלב בעיצוב32. סיפקנו פרטים נוספים לגבי שינויים במערכת בדף האתר שלנו, לצד קישורים למשאבים מועילים אחרים הנוגעים לתהליך העיצוב23.
מעבר לשיפור הרכיבים הספציפיים עבור עיצוב ספציפי זה, יהיה זה ריאלי מאוד להוסיף טכניקות מיקרוסקופיה אחרות ברזולוציה גבוהה או שיטות לבנות זו. שיפור אחד כזה יהיה לשלב תאורה רב-אורכית, שתכלול יישור לייזרים עירור נוספים לנתיב העירור המקורי8. יתר על כן, מכיוון שסוג זה של תכנון SOLS משאיר את הדגימה נגישה, הוספת פונקציות נוספות למיקרוסקופ, כולל אך מוגבל לציוצים אופטיים, מיקרופלואידיקה וריומטריה, היא פשוטה יחסית 2,33.
בהשוואה לאינספור מדריכי גיליון האור שפורסמו, פרוטוקול זה מספק הוראות ברמת הבנה שמשתמש ללא ניסיון אופטי משמעותי עשוי להועיל. על ידי הנגשת בניית SOLS ידידותית למשתמש עם יכולות מסורתיות של הרכבה על שקופיות לדוגמה לקהל גדול יותר, אנו מקווים לאפשר הרחבה נוספת של היישומים של מחקר מבוסס SOLS בכל התחומים שבהם המכשיר שימש או יכול להיות בשימוש. למרות שהיישומים של מכשירי SOLS גדלים במהירות במספר 2,34,35, אנו מאמינים כי יתרונות ושימושים רבים של מכשירים מסוג SOLS עדיין לא נחקרו ומביעים התרגשות מהאפשרויות לסוג זה של מכשירים להתקדם.
Disclosures
למחברים אין מה לחשוף. כל המחקר נערך בהיעדר קשרים מסחריים או פיננסיים שיכולים להתפרש כניגוד עניינים.
Acknowledgements
עבודה זו נתמכה על ידי פרס RUI של הקרן הלאומית למדע (NSF) (DMR-2203791) ל- J.S. אנו אסירי תודה על ההדרכה שניתנה על ידי ד"ר בין יאנג וד"ר מאניש קומאר במהלך תהליך היישור. אנו מודים לד"ר ג'ני רוס ולק. אליס לינדזי על הוראות ההכנה למנועי קינזין.
Materials
| Name | Company | Catalog Number | Comments |
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 | |
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25x36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer - 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free | |
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free | |
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A | |
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free | |
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free | |
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 | ||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved