Method Article
Hücre iskeleti ağlarının görselleştirilmesi için özelleştirilebilir, tek objektifli, ışık tabakalı floresan mikroskobunun tasarımı ve inşası
Bu Makalede
Özet
Bu protokol, tek objektifli, hafif tabakalı bir floresan mikroskobunun nasıl oluşturulacağını ve hücre iskeleti ağlarını görselleştirmek için kullanımını ayrıntılı olarak açıklar.
Özet
Sulandırılmış hücre iskeleti kompozitleri, denge dışı yumuşak maddeyi incelemek için değerli bir model sistem olarak ortaya çıkmıştır. Bu 3D, yoğun ağların dinamiklerinin sadık bir şekilde yakalanması, genellikle floresan konfokal mikroskoplarla ilişkilendirilen optik kesit almayı gerektirir. Bununla birlikte, ışık tabakası floresan mikroskobundaki (LSFM) son gelişmeler, onu uygun maliyetli ve zaman zaman üstün bir alternatif olarak ortaya koymuştur. LSFM'yi optiğe daha az aşina olan hücre iskeleti araştırmacıları için erişilebilir kılmak için, kullanıma hazır bileşenlerden çok yönlü bir ışık tabakası floresan mikroskobu oluşturmaya yönelik adım adım bir başlangıç kılavuzu sunuyoruz. Geleneksel slayt numuneleriyle numune montajını mümkün kılmak için bu LSFM, hem uyarma hem de emisyon toplama için tek bir objektif kullanan tek objektifli ışık tabakası (SOLS) tasarımını takip eder. Okuyucuların enstrümantasyonu değiştirmesine ve kendi özel ihtiyaçlarına uyacak şekilde tasarlamasına izin vermek için SOLS'nin her bir bileşeninin işlevini yeterince ayrıntılı olarak açıklıyoruz. Son olarak, kinesin güdümlü mikrotübül ağlarında asterleri görselleştirerek bu özel SOLS cihazının kullanımını gösteriyoruz.
Giriş
Işık tabakası floresan mikroskobu (LSFM), seçici düzlem aydınlatma mikroskobu (SPIM), süpürülmüş konfokal hizalı düzlemsel uyarma (SCAPE) ve eğik düzlem mikroskobu (OPM) dahil olmak üzere, uyarma ışığının bir tabaka 1,2 şeklinde şekillendirildiği yüksek çözünürlüklü floresan görüntüleme teknikleri ailesini temsil eder3,4,5,6,7. Epi-floresan, toplam iç yansıma floresan mikroskobu (TIRFM) veya konfokal mikroskopi gibi diğer mikroskopi modalitelerinin aksine, LSFM'de fototoksisite minimumdur ve numuneler daha uzun zaman ölçeklerinde görüntülenebilir çünkü sadece aktif olarak görüntülenen numunenin düzlemi aydınlatılır 8,9,10. Bu nedenle, LSFM teknikleri, özellikle konfokal mikroskopi teknikleri için çok kalın olanlar olmak üzere, uzun süreler boyunca 3D numuneleri görüntülemek için son derece yararlıdır. Bu nedenlerden dolayı, 2004 yılındaki orijinal gelişiminden bu yana, LSFM, canlı zebra balığı ve Drosophila embriyoları gibi tüm organizmaların görselleştirilmesi için birçok fizyolog, gelişim biyoloğu ve sinirbilimci için tercih edilen görüntüleme tekniği haline gelmiştir 3,4,6,11 . Bu son yirmi yılda, LSFM'nin avantajları, hem in vivo hem de in vitro 13,14,15,17 doku11,12, hücresel ve hücre altı ölçekler dahil olmak üzere giderek daha küçük ölçeklerde yapı ve dinamikleri görselleştirmek için kullanılmıştır.
Literatürde başarılı kullanım durumlarına dair raporlara rağmen, ticari LSFM sistemlerinin yüksek maliyeti (bu yazının yazıldığı tarih itibariyle ~0,25 milyon USD)18,19 tekniğin yaygın kullanımını engellemektedir. Kendin Yap yapılarını araştırmacılar için uygun bir alternatif haline getirmek için, açık erişim çabası OpenSPIM 22 de dahil olmak üzere birden fazla derleme kılavuzu 8,13,20,21 yayınlandı. Bununla birlikte, bugüne kadar, minimum optik deneyime sahip araştırmacılar, yalnızca geleneksel slayta monte edilmiş örneklerle uyumlu olmayan daha önceki LSFM tasarımlarını kullanabilirler (Şekil 1A). Son zamanlardaki tek amaçlı, ışık sayfası (SOLS) uygulaması, hem uyarma hem de algılama için tek bir amaç kullanır (Şekil 1C), böylece uyumluluk 5,6,8,13,20 ile ilgili sınırlamanın üstesinden gelir. Bununla birlikte, SOLS tasarımının çok yönlülüğünün maliyeti, nesne düzlemini görüntüleme için kameraya aktarmak, eğmek ve yeniden görüntülemek için iki ek hedefin gerekliliği nedeniyle yapının karmaşıklığında önemli bir artıştır (Şekil 1D). Karmaşık SOLS tarzı kurulumlara erişimi kolaylaştırmak için bu makale, yalnızca giriş seviyesi bir optik kursu hakkında bilgi sahibi olan araştırmacılar için yararlı olacak slayt uyumlu bir SOLS sisteminin tasarımı, yapımı, hizalama süreci ve kullanımı hakkında adım adım kılavuz sunmaktadır.
Protokolün kendisi kısa ve öz olsa da, okuyucular tasarımın belirli bölümleri veya donanım hususları hakkında daha fazla bilgi edinmek için hazırlık adımları sırasında diğer kaynaklara başvurmalıdır. Bununla birlikte, bir okuyucu bu tasarımın özelliklerini takip etmeyi planlıyorsa, belirli optik bileşenlerin nasıl seçileceğini anlamak gerekli olmayabilir.
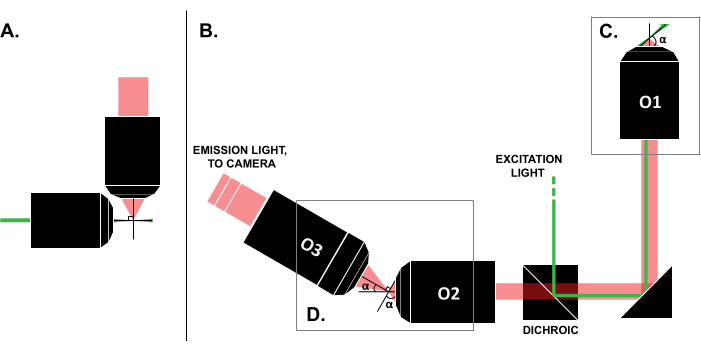
Şekil 1: Farklı LSFM konfigürasyonlarının özellikleri. (A) Erken LSFM tasarımlarında ortak olan iki ortogonal hedefe sahip kurulum. Bu konfigürasyonda, numuneyi içermek için geleneksel slayt montaj teknikleriyle uyumlu olmayan bir kılcal tüp veya bir jel silindiri kullanılır. (B) Aşağıdakileri gösteren bir SOLS ışık tabakası tasarımının şeması: (C) numune düzleminde (O1) hem uyarma hem de emisyon toplama için kullanılan tek hedef; bu, geleneksel bir kızağın üstüne monte edilmesine ve (D) SOLS emisyon yolundaki röle hedef sistemine izin verir. O2 emisyon ışığını toplar ve görüntüyü büyütür. O3, düzlemi kamera sensörüne doğru eğim açısında görüntüler. Kısaltmalar: LSFM = ışık tabakası floresan mikroskobu; SOLS = tek objektifli ışık levhası; O1-O3 = hedefler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Hizalama için hazırlık
- Derlemeye başlamadan önce, amaçlanan kullanım durumu hakkında net bir fikre sahip olmak için gerekli literatür taramalarını yapın (örneğin, görüntülenecek floroforlar, gerekli görüntüleme hacmi, çözünürlük gereksinimleri). Özellikle, burada açıklanan tasarımı tam olarak takip etmenin uygun olup olmadığına karar vermek için aşağıdaki temsili sonuçlar bölümüne bakın. Öyleyse, adım 1.2'ye atlayın. Değilse, Sheunglab SOLS Derleme Kılavuzu23'te donanım seçimi için öneriler ve rehberlik bulun.
NOT: Kullanıcı, bu özel sistemin özellikleri hakkında daha fazla bilgiyi tartışma bölümünde bulabilir. - Gerekli tüm optik, opto-mekanik ve elektrikli bileşenleri Malzeme Tablosunda ayrıntılı olarak açıklandığı gibi toplayın. Sistemi değiştiren kullanıcılar için, tüm eşdeğer parçaları toplayın.
- Hizalama lazerini Şekil 2A'da gösterildiği gibi oluşturun. Kirişin kesme plakası kullanılarak kolimasyona tabi tutulduğunu kontrol edin.
- Çift buzlu cam disk hizalama kafesini Şekil 2B'de gösterildiği gibi oluşturun.
- Floresan boya kaplı test örneğini hazırlayın.
- Hepsi eriyene kadar 0.2 g liyofilize toza kademeli olarak 1 mL damıtılmış su ekleyerek doymuş bir rodamin boya çözeltisi oluşturun. Homojenleştirmek için girdap.
NOT: Bu çözüm ışığa duyarlıdır. Hazırlama sırasında gerekli önlemler olmamasına rağmen, çözelti hazırlandıktan sonra karanlık bir alanda saklandığından emin olun.
DİKKAT: Rodamin tozunu tutarken daima eldiven ve maske takın. - Bir test slaytının ortasına 10 μL pipetleyin.
- Sıvının üzerine 22 mm x 22 mm'lik bir kapak camı yerleştirin ve floresan tabakasının mümkün olduğunca ince olduğundan emin olun.
- Şeffaf oje ile kapatın.
NOT: Bu örnek ışığa duyarlıdır. Numunenin ömrünü en üst düzeye çıkarmak için, slaytın kullanılmadığı zamanlarda karanlık bir alanda saklandığından emin olun.
- Hepsi eriyene kadar 0.2 g liyofilize toza kademeli olarak 1 mL damıtılmış su ekleyerek doymuş bir rodamin boya çözeltisi oluşturun. Homojenleştirmek için girdap.
- 3D boncuk örneğini hazırlayın (jele gömülü 1 μm boncuk).
- Üç kat bant yüksekliğinde bir numune slaytı üzerinde 4-5 mm genişliğinde dikey bir kanal oluşturmak için çift taraflı bant kullanın.
- Sürgünün ortasındaki bandın üzerine 22 mm x 22 mm'lik bir kapak camı yerleştirin. Bant ile kapak camı arasında iyi bir sızdırmazlık sağlamak için bantlanmış bölgelere sıkıca bastırın.
- Fazla bandı çıkarmak için bir tıraş bıçağı kullanın.
- 1 g gellan sakızı tozuna yavaş yavaş DI su ekleyerek 125 mL doymuş gellan sakızı çözeltisi hazırlayın. Bu çözelti oda sıcaklığında katı ve 65 °C'de sıvı olacaktır.
- Bir mikrosantrifüj tüpüne 1 mL gellan sakızı çözeltisi ekleyin. Bir su kabını sıcak bir plaka üzerinde 65 °C'de ısıtın ve mikrosantrifüj tüpünü gellan sakızı gözle görülür şekilde viskoz olana kadar ısıtın.
- Isıtılmış gellan sakızı çözeltisinde 10 μL 1:1,000 seyreltilmiş boncuk hazırlayın.
- Çözeltiyi dolana kadar dikkatlice hazneye pipetleyin. Kanalın her iki tarafına az miktarda epoksi sürmek için bir kürdan kullanın ve sızdırmaz hale getirmek için açıklıkları tamamen kapatın. Düzgün sızdırmazlığı sağlamak için, epoksinin kanalın her iki ucuna hafifçe nüfuz ettiğinden emin olmak için her iki ucu da görsel olarak inceleyin.

Şekil 2: Hizalama araçlarının fotoğrafları. (A) Kolimasyonlu hizalama lazeri. AL1: Hizalama Lensi 1, −50 mm; AL2: Hizalama Lensi 2, 100 mm (B) Çift buzlu cam disk hizalama kafesi. Kısaltmalar: RMS CP = RMS dişli kafes plakası; SM1 CP = SM1 dişli kafes plakası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Uyarma yolunu hizalama
- Optik tablanın yüzeyindeki mikroskop düzenini çizin. Tüm mesafeleri mümkün olduğunca doğru bir şekilde ölçün.
NOT: Sistem içindeki bileşenlerin konumu için Şekil 3'e bakın. - Uyarma lazerini masaya monte edin. İki iris'i lazerin amaçlanan yüksekliğine ayarlayın ve bunları Ayna 2'in (M3) konumunun arkasındaki istenen delik hattına 1-1 ft aralıklarla monte edin. Işının masa yüzeyi ile aynı hizada olduğundan ve optik tabla üzerindeki delik çizgisinde ortalandığından emin olmak için bu irisleri kullanın.
NOT: Gözlerin korunması için lazer güvenlik gözlükleri takın ve güvenlik önlemi olarak lazer güvenlik ekranlarıyla başıboş lazer ışınlarını engelleyin. Tüm bileşenler kalıcı olarak sıkıştırılana kadar, saatler sırasına göre sürüklenme mümkündür. Yapıya geri dönerken sapma olup olmadığını hızlı bir görsel kontrol olarak her günün sonunda hizalamanın en uzak noktasına bir iris kurun. Titreşimler, yanlış yüzdürülmüş bir optik tabla ve hava akımları, optik kaymanın en yaygın nedenleridir. - Lazer deklanşörünü uyarma lazerine mümkün olduğunca yakın monte edin. Hizalama sırasında lazeri tekrar tekrar açıp kapatmak yerine lazer ışığını hızlı bir şekilde engellemek için bu deklanşörü kullanın.
- ND filtrelerini ND filtre tekerleğine (ND 0.5, 1.0. 2.0, 3.0, 4.0 ve boş bir yuva) monte edin ve lazer deklanşörden sonra monte edin.
- Motorlu aktüatörü bir çeviri aşamasına (TS1) geçirin ve ardından aşamayı M1'in konumunun altına yerleştirin. Sahnenin, lazer ışığının takip ettiği aynı delik çizgisi boyunca eksenel olarak çevrildiğinden emin olun. İlk yerleştirme için sahneyi aralığının ortasına ayarlayın.
- Aşağıdaki 2.6-2.10 adımlarında, lazeri masada çizildiği gibi yol boyunca yönlendirmek için yansıtıcı optik bileşenleri birer birer ışın yoluna yerleştirin. İstenen çıkış ışını yolunu tanımlamak ve her bir yansıtıcı elemanın yerleşimini ve hizalamasını yönlendirmek için tam yüksekliğe ayarlanmış süsen çiftini kullanın. Her eleman için, gelen ışının merkeze çarpmasını sağlamak için montajın yüksekliğini ve konumunu ayarlayın. Ardından, kirişi her iki iristen geçecek şekilde masa üzerindeki çizilmiş ışın yolu boyunca yönlendirmek için montajın tabanını döndürün ve her bir montajın arkasındaki düğmelerle giden kirişin eğimini ince ayarlayın.
NOT: Her eleman doğru yüksekliğe hizalandıktan sonra, yüksekliği sabitlemek için direğe geçmeli bir bilezik ekleyin.
- Aşağıdaki 2.6-2.10 adımlarında, lazeri masada çizildiği gibi yol boyunca yönlendirmek için yansıtıcı optik bileşenleri birer birer ışın yoluna yerleştirin. İstenen çıkış ışını yolunu tanımlamak ve her bir yansıtıcı elemanın yerleşimini ve hizalamasını yönlendirmek için tam yüksekliğe ayarlanmış süsen çiftini kullanın. Her eleman için, gelen ışının merkeze çarpmasını sağlamak için montajın yüksekliğini ve konumunu ayarlayın. Ardından, kirişi her iki iristen geçecek şekilde masa üzerindeki çizilmiş ışın yolu boyunca yönlendirmek için montajın tabanını döndürün ve her bir montajın arkasındaki düğmelerle giden kirişin eğimini ince ayarlayın.
- M1'i TS1'in üzerine monte edin ve hizalayın.
- Dikroiği masaya monte edin ve hizalayın.
- Üreticinin talimatlarını izleyerek galvoyu güç kaynağına ve fonksiyon üretecine bağlayın.
- Galvo'yu, lazer aynanın tam ortasına gelecek şekilde monte edin. Galvoyu açın ve ardından ayna eğimini 0 V DC akıma (aralığın merkezi) ayarlamak için dalga biçimi üreteci üzerindeki düğmesini basılı tutun. Şimdi, galvo'yu süsenlere hizalayın.
- Ayna 2'yi (M2) monte edin ve hizalayın.
- Büyük silindirik aynayı silindirik ayna yuvasına yerleştirin. Ayna 1'ün (M30) üzerine 60-3 mm'lik bir kafes adaptörü takmak için kafes çubuklarında 3 kullanın. İlk yerleştirme için M3 aynanın eğimini düzleştirmek için ayna montajındaki düğmeleri kullanın.
- Çift buzlu cam hizalama kafesini M3'ün üzerindeki kafes adaptörüne monte edin; Hizalama için her kullanıldığında hizalama kafesini yerinde tutan kafes adaptöründeki ayar vidalarını sıktığınızdan emin olun. M3'ü masaya monte edin ve kiriş her iki buzlu cam hizalama diskinde kabaca ortalanana kadar yüksekliği ve konumu ayarlayın. M3'ü masaya kelepçeleyin ve ayna montajının her iki yanındaki bantlanmış delikleri kullanarak destek eklemek için M3'ün her iki tarafında 3 direk montajı, 90° kelepçe ve 2 direk montajı kullanın. Işını ince ayarlamak için aynanın arkasındaki düğmeleri kullanın.
NOT: Uyarma yolundaki tüm yansıtıcı elemanlar artık ayarlanmıştır ve dokunulmamalıdır. - Lens 1'i (L1) masaya monte edin. Tüm ilk lens yerleşimleri için, gelen ışını lensin ön tarafında ortalamak için vidalı bir lens hedefi kullanın. Işın M1'ün üzerindeki hizalama kafesindeki buzlu cam plakaların her ikisinde ortalanana kadar Lens 1'in (L3) eğimini ve yanal konumunu ayarlayın.
- L2 ile bir 4f sistemi oluşturmak için Lens 1'yi (L1) ilgili konumuna takın. Kolimasyonlu bir ışın elde etmek için L2'yi eksenel olarak hareket ettirin ve kolimasyonu kontrol etmek için uyarma lazerini ve kesme plakasını kullanın. Işını M2'ün üzerindeki her iki buzlu cam diskte ortalamak için L3'nin eğimini ve yanal konumunu ayarlayın.
- İğne deliğini bir xy çeviri yuvasına monte edin. İnce eksenel öteleme sağlamak için bunu bir 1D çeviri aşamasının üzerine monte edin. İğne deliğini ve sahneyi bir direk ve direk montajına monte edin ve L1 ile L2 arasındaki ortak odak noktasına yerleştirin. Lazer ışığı iğne deliğinden görünene kadar iğne deliğini elle ayarlayın.
- Güç ölçer sensörünü iğne deliğinden hemen sonra monte edin ve uyarma lazerinin dalga boyunu seçmek için güç ölçerin dijital konsolundaki dalga boyu düğmesini kullanın. İletimi en üst düzeye çıkarmak ve TEM00'e yakın bir ışın profili elde etmek için iğne deliğinin xy konumunu ayarlayın. Ardından, iletimi daha da maksimize etmek için iğne deliğini 1D kademe ile eksenel olarak ayarlayın.
- Lens 4'ü (L4) masaya yerine monte edin ve montajı doğru yüksekliğe ayarlayın. L4'ü eksenel olarak ayarlayın, böylece uyarma ışını galvo yüzeyine odaklanır. Işını M4'ün üzerindeki her iki buzlu cam diskte ortalamak için L3'ün eğimini ve yanal konumunu ayarlayın.
- Lens 3'ü (L3) masaya konumunda monte edin ve montajı doğru yüksekliğe ayarlayın. L3 ve L4'ün kolimasyonunu kontrol etmek için uyarma lazerini ve kesme plakasını kullanın. Işını M3'ün üzerindeki her iki buzlu cam diskte ortalamak için L3'ün eğimini ve yanal konumunu ayarlayın.
- L3'ü geçici olarak kaldırın. Tarama Lensi 1'i (SL1) masaya monte edin ve kesme plakası ile ölçüldüğü gibi L4 ile kolimasyonlu bir teleskop oluşturmak için eksenel mesafeyi ayarlayın. Işını M1'ün üzerindeki her iki buzlu cam disk üzerinde ortalamak için SL3'in eğimini ve yanal konumunu ayarlayın.
- L3'ü yeniden takın. Tüp Lens 1'i (TL1) takın ve SL1 ve TL1'i kolimasyon yapmak için uyarma ışını ve kesme plakasını kullanın. Işını M1'ün üzerindeki her iki buzlu cam disk üzerinde ortalamak için TL3'in eğimini ve yanal konumunu ayarlayın.
- Bir adaptör halkası kullanarak Objektif 1'i (O1) M3'ün üzerindeki kafes plakasına vidalayın. SL1'i geçici olarak çıkarın ve kirişin tavana çarpmasına izin verin. Kiriş tavanda Airy bir disk oluşturana kadar kafes sistemindeki O1'in yüksekliğini (eksenel mesafeyi) ayarlayın ve ardından diskin boyutu küçülene kadar ayarlamaya devam edin.
- O1 yerindeyken, s'yi monte edin.tage'yi uygun konumda.
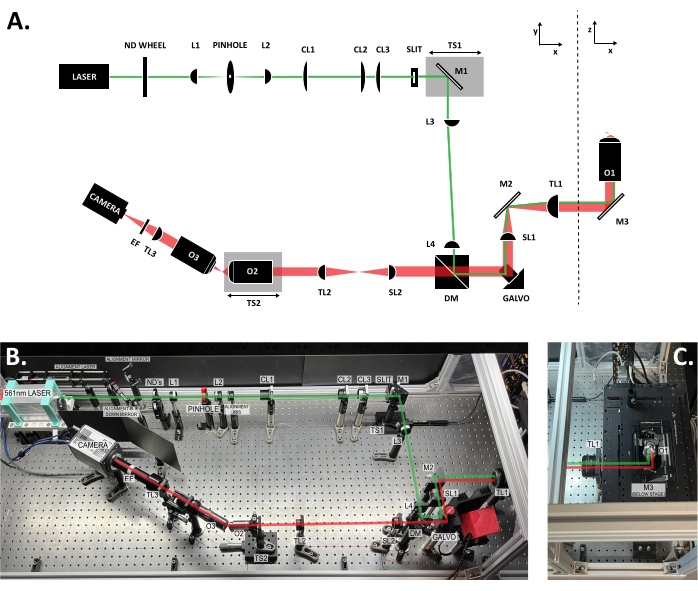
Şekil 3: SOLS sistemi içindeki bileşenlerin konumu. (A) Tüm bileşenlerin etiketli olduğu SOLS sisteminin şematik yerleşimi. (B) Örnek aşama alanı hariç, optik tabla üzerindeki fiziksel SOLS sisteminin yukarıdan aşağıya fotoğrafı. (C) Örnek aşama alanının yukarıdan aşağıya fotoğrafı ( Şekil 3B'ye uzantı). Uyarma yolu yeşil renkle gösterilir. Emisyon yolu kırmızı ile gösterilmiştir. Lenslerin odak uzaklıkları: L1: 100 mm; L2: 45 mm; CL1: 50 mm; CL2: 200 mm; CL3: 100 mm; U3:150 mm; L4: 100 mm; SL1: 75 mm; TL1: 200 mm; SL2: 150 mm; TL2: 125 mm; TL3: 200 mm'dir. Daha ayrıntılı parça özellikleri için Malzeme Tablosuna bakın. Kısaltmalar: SOLS = tek amaçlı ışık sayfası; ND Tekerleği = değişken nötr yoğunluklu filtre tekerleği; L1-L4 = plano içbükey akromat lensler; CL1-CL3 = silindirik lensler; M1-M3 = aynalar; TS1-TS2 = çeviri aşamaları; DM = dikroik ayna; Galvo = taramalı galvanometre; SL1-SL2 = tarama lensleri; TL1-TL2 = tüp lensler; O1-O3 = hedefler; EF = emisyon filtresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Emisyon yolunun hizalanması
- Hizalama lazerini ayarlayın.
- Uyarma lazerinin yanına, lazerle aynı yükseklikte iki boş kafes plakası monte edin. Hizalama lazerinin kafes çubuklarını iki kafes plakasındaki boş deliklere kaydırarak hizalama lazerini monte etmek için bu kafes plakalarını kullanın. Güç düğmesinin etrafına bantlayarak veya bir açma/kapama anahtarı bağlayarak lazerin açık konuma ayarlanabildiğinden emin olun.
- O1'i çıkarın ve buzlu cam hizalama kafesini yeniden takın. Hizalama ışınını uyarma ışını yoluna hizalamak için bir kinematik ayna montajı ve bir açılır ayna kullanın.
- İki aynayı ince ayarlayarak iğne deliğinden sonra hizalama ışınının sinyalini en üst düzeye çıkarmak için güç ölçeri kullanın. Işının buzlu cam hizalama kafesi üzerinde ortalandığından emin olun.
- Hizalama kafesini çıkarın ve O1'i yeniden takın. Kare aynayı O1'in örnek aşamasına yerleştirin ve dikroikten sonra kiriş profilinin boyutu en aza indirilene kadar aynayı eksenel olarak ayarlayın.
- Tarama Merceği 2 (SL2), Tüp Mercek 2 (TL2) ve Objektif 2'nin (O2) parazit olmadan takılabilmesi için bir irisi emisyon yoluna ve yeterince geriye monte edin. Bu irisi hizalama lazerine hizalayın. İrisin arkasına en az 1 inç buzlu bir cam disk monte edin ve bunun da lazer ışığıyla hizalandığından emin olun.
- SL2'yi galvodan bir cetvelle ölçüldüğü gibi doğru mesafeye yerleştirin. SL2'nin eğimini ve yanal konumunu, gelen hizalama ışını SL2'de ortalanacak ve giden ışın iris ve buzlu cam diskten geçecek şekilde ayarlayın.
- TL2'yi SL2'den bir cetvelle ölçüldüğü gibi doğru mesafeye yerleştirin. TL2'nin eğimini ve yanal konumunu, gelen hizalama ışını TL2'de ortalanacak ve giden ışın iris ve buzlu cam diskten geçecek şekilde ayarlayın.
- TS2'yi masanın üzerine monte edin. Aşamanın O2'nin optik ekseni boyunca çevrildiğinden emin olun.
- O2'yi bir xy çeviri yuvasına vidalayın. O2'yi çeviri aşamasına monte etmek için xy montajının altına bir direk bağlayın. O2'nin arkasını kırmızı lazerde ortalamak için vidalı bir hedef kullanın.
- xy düğmelerini ve O2'nin eğimini, kırmızı hizalama ışını iris ve buzlu cam diskten geçecek şekilde ayarlayın.
- Hizalama lazerini O1'in üzerine getirin ve aşağı doğru emisyon yoluna yönlendirin. Lazeri açın ve bu ışının emisyon yolundaki tüm lensler üzerinde ortalandığından emin olun.
- İrisi açarak ve buzlu cam diski çıkararak O1 ve O2'nin pupil düzlemlerini eşlenik edin, böylece O2'den çıkan hizalama ışını uzak bir yüzeye veya duvara (>0,5 m) engelsiz devam eder (Şekil 4). Işın yüzeyde küçük bir Airy disk oluşturana kadar TS2'yi ayarlayın ve ardından Airy diskin boyutunu en aza indirmek için TS2'yi ayarlamaya devam edin.
NOT: Güçlü bir şekilde uzaklaşan bir ışın, O2'nin yanlış yerleştirildiğini gösterir. Bununla birlikte, bu ışın iki hedeften geçtiğinden, az miktarda sapma doğaldır. Bu nedenle, Airy disk en iyi kılavuzdur. - Eğim-değişmez tarama için galvo'yu optimize edin: Galvo için bir üçgen dalga sinyali seçmek için dalga formu üreteci üzerindeki FSK düğmesine basın ve düşük bir frekansa (~1 Hz) ayarlayın. Hizalama ışınını aynı uzak yüzeyde veya duvarda gözlemleyin.
NOT: Galvo yanlış yerleştirilirse, kiriş galvo hareketi ile birlikte yüzeyde yatay olarak süpürülecektir. Bu, ışın yer değiştirmesi gözle algılanamayana kadar galvo tabanının eğim ve xy konumunun ince ayarlamaları (elle) ile çözülebilir. - 0°'de görüntüleyerek sistemin kalitesini kontrol edin.
- O3'ü bir xy çeviri yuvasına vidalayın. 1 inç lens tüpünü kafes çeviri aşamasına vidalayın ve xy çeviri aşamasını tüpe vidalayın. Kafes öteleme aşamasının önünü bir kafes plakasına bağlamak için iki kafes çubuğu kullanın ve kafes plakasını bir direğe monte edin. Objektif 3'ü (O3) O2'nin önüne (~4-5 mm) 0°'de yakın monte edin ve yüksekliği buna göre ayarlayın.
- Bir cetvelle ölçüldüğü gibi, SL2 ve TL2 arasındaki paylaşılan odak düzlemine buzlu cam hizalama diski monte edin. Akrilik floresan test slaytını sahneye monte edin ve slaytı uyarma lazeri ile aydınlatın. O3'ün arkasından bakın, emisyon ışığını bulmak için O3'ün hem yüksekliğini hem de eksenel konumunu ayarlayın ve ardından emisyon ışığı arka açıklığı doldurana kadar O3'ü eksenel olarak ayarlayın (Şekil 5).
- İki adet 8 kafes çubuğunu O3 öteleme aşamasının arkasına vidalayın. Çubukların üzerine monte edilmiş buzlu cam diskli bir kafes plakasını kaydırın ve ardından emisyon ışığının O3'ten ortalanmış olarak çıkmasını sağlamak için xy yuvasını kullanarak O3'e ince ayar yapın. Ardından kafes çubuklarını çıkarın.
- Kamera sensörünün pürüzlü konumuna buzlu bir cam disk monte edin ve diskin yüksekliğini ve konumunu emisyon ışığıyla hizalayın.
- Tüp Lens 3'ü (TL3) bir kafes plakasına vidalayın ve O3'ün hemen arkasına monte edin. TL3'ü gelen emisyon ışığına ortalayın ve ardından giden ışığı buzlu cam diske hizalamak için TL3'ün eğimini ayarlayın.
- Kamerayı, bir cetvelle ölçüldüğü gibi tüp merceğinden doğru mesafeye monte edin.
- Hem 2 lens tüpünü hem de emisyon filtresini kameraya vidalayın.
- Buzlu cam hizalama diskini SL2 ve TL2 arasındaki paylaşılan odak düzlemine yeniden monte edin. Floresan boya test örneğini monte edin ve örneği uyarma ışını ile aydınlatın.
- Kamerayı açın ve ardından bağlı bilgisayarda Micromanager programını açın. Canlı görüntüye girmek için Canlı'ya tıklayın. İlk pozlama ayarlarını yapmak için Otomatik Bir Kez'e tıklayın ve ardından görüntüleme sırasında pozlamayı gerektiği gibi sıfırlayın.
NOT: Micromanager, kamera açıldıktan sonra açılmadığı sürece düzgün çalışmayacaktır. - Cam hizalama diskindeki küçük delik görüş alanı (FoV) içinde ortalanana kadar O3 yuvasındaki xy çeviri düğmelerini ayarlayın. Delik odakta olana kadar O3'ü kafes öteleme aşamasıyla eksenel olarak ayarlayın; kenarlar keskin görünmelidir (Şekil 6).
- Sistemin kalitesini kontrol etmek için floresan boncukları görüntüleyin.
- Buzlu cam hizalama diskini çıkarın, 3D boncuk örneğini monte edin ve s'yi aydınlatınampuyarma ışını ile.
- Floresan boncuklar FoV'nin ortasındaki dairesel bir bölgeyi doldurana kadar numunenin yüksekliğini O1'e göre ayarlayın.
- Nokta yayılma fonksiyonları (PSF'ler) yuvarlak (minimum sapmaların göstergesi) ve parlak (iyi bir sinyal-gürültü oranının göstergesi) olana kadar xy aşamasını ve eksenel öteleme aşamasını kullanarak O3'ün konumunu ince ayarlayın (Şekil 7). Bu, O3'ü ayarlayarak elde edilemezse, O1 ve O2 bileşenleri arasındaki optik sistemin optimal olmayan bir şekilde hizalanmış olması muhtemeldir; Aşağıdaki adım 3.13'teki tanılama kontrollerini izleyin.
- Yuvarlak PSF'ler elde edilebiliyorsa, tanılama adımını atlayın ve görüntüleme sistemini eğmeye geçin.
- Gerekirse tanılama kontrolleri gerçekleştirin.
NOT: İyi PSF'ler elde edildikten sonra, tanılama adımlarının geri kalanı atlanabilir.- Parlak alan (BF) ışığını O1'in üzerine monte edin. Pozitif ızgara testi hedefini s'ye monte edinamphizalama aynası ile aynı eksenel yükseklikte. 10 μm ızgarayı ortalayın ve ızgarayı BF ışığıyla aydınlatın.
- Kameradaki ızgarayı görüntüleyin ve ızgara odakta olana kadar örneği çevirin. FoV boyunca alanın düz olduğunu doğrulamak için ızgara görüntüsünü kullanın: değilse, ızgara bozuk ve eğik görünecektir. Kötü bir ızgara görüntüsünü düzeltmek için, O3'ün xyz konumunu ve eğimini ayarlayın ve ardından TL3'ü ve kamerayı buna göre ayarlayın.
NOT: Düz bir ızgara elde edilebiliyorsa, 3.12.10 adımını tekrarlayın ve ardından görüntüleme sistemini eğmeye geçin. - SL2'nin görüntüyü sensöre odaklaması için hizalama kamerasını veya görüntüleme kamerasını doğru mesafeye ayarlayın. Izgara hedefini ara düzlemde görüntüleyin (Şekil 8). Bu ızgara da çarpıksa, O1 ve SL2 bileşenleri arasındaki optik sistemin optimal olmayan bir şekilde hizalanmış olması ve yeniden gözden geçirilmesi muhtemeldir. İlerlemeden önce hizalamayı gerektiği gibi optimize edin.
NOT: Fotoğraf makinesi SL2 ve TL2 arasına sığmıyorsa, görüntüyü SL2'den sonra 90° ve fotoğraf makinesine yansıtmak için fazladan bir ayna kullanın. - Ara düzlemdeki PSF'leri kontrol edin: Izgarayı kontrol ettikten sonra, başka bir iyi teşhis kontrolü, PSF'leri aynı ara düzlemde kontrol etmektir. Şekil 7'ye benzeyen ancak farklı bir büyütmede (Şekil 9) olan bu düzlemde iyi bir görüntü, SL2 boyunca iyi hizalamayı gösterir.
NOT: Ara düzlemde düz bir ızgara ve yuvarlak PSF'ler elde edilebiliyorsa, adım 3.13.2'yi, ardından adım 3.12.10'u tekrarlayın ve ardından görüntüleme sistemini eğmeye geçin.
- O3 görüntüleme alt sistemini 30° eğin.
- O3, TL3 ve kamerayı çıkarın.
- Tablodaki çizgileri kılavuz olarak kullanarak O3'ü 30°'de O2'nin optik eksenine yeniden takın.
- SL2 ve TL2 arasındaki paylaşılan odak düzlemine buzlu cam hizalama diski monte edin. Akrilik floresan test slaytını sahneye monte edin ve slaytı uyarma lazeri ile aydınlatın. Bir kez daha, O3'ün arkasından bakın, 3°'deki emisyon ışığını bulmak için O30'ün hem yüksekliğini hem de eksenel konumunu ayarlayın ve ardından emisyon ışığı arka açıklığı doldurana kadar O3'ü eksenel olarak ayarlayın.
- Daha güçlü bir emisyon sinyali elde etmek için buzlu cam hizalama diskini SL2 ve TL2 arasından çıkarın.
- İki adet 8 kafes çubuğunu O3 öteleme aşamasının arkasına vidalayın. Çubukların üzerine monte edilmiş buzlu cam diskli bir kafes plakasını kaydırın ve ardından emisyon ışığının O3'ten ortalanmış olarak çıkmasını sağlamak için xy yuvasını kullanarak O3'e ince ayar yapın. Ardından kafes çubuklarını çıkarın.
- Kamera sensörünün pürüzlü konumuna buzlu bir cam disk monte edin ve diskin yüksekliğini ve konumunu emisyon ışığıyla hizalayın.
- TL3'ü O3'ün hemen arkasına monte edin. TL3'ü gelen emisyon ışığına ortalayın ve ardından giden ışığı buzlu cam diske hizalamak için TL3'ün eğimini ayarlayın.
- TL3 kamera mesafesini daha doğru bir şekilde ayarlamak için O3'ü dikkatlice sökün ve hizalama lazerini TL3 ile kameraya odaklanacak şekilde monte edin. Lazer yoğunluğunun <1 mW olması için gerektiğinde ND filtreleri kullanın. Kamera canlı görüntüsünü başlatın ve kameradaki lazer noktasını en aza indirmek için TL3'ü eksenel olarak ayarlayın.
- Buzlu cam hizalama diskini SL2 ve TL2 arasındaki paylaşılan odak düzlemine yeniden monte edin. Floresan boya test örneğini monte edin ve örneği uyarma ışını ile aydınlatın. O3 yuvasındaki xy çeviri düğmelerini, cam hizalama diskindeki küçük delik kameradaki FoV'nin içine gelene kadar ayarlayın. Delik odakta olana kadar O3'ü eksenel olarak hareket ettirmek için kafes öteleme aşamasını ayarlayın; Deliğin 0°'de olduğu gibi göründüğünden emin olun.
- Pozitif ızgara testi hedefini aynı eksenel yüksekliğe yeniden monte edin ve ızgarayı BF ışığıyla aydınlatın. Yalnızca bir dikey bölümün odakta olduğunu onaylayın (30° eğim nedeniyle). Bir kez daha, odak dışındayken bile FoV boyunca alanın düz olduğunu doğrulamak için ızgara görüntüsünü kullanın. Slayt eksenel olarak çevrildiğinde, FoV'nin (ızgara hedefi) odak kısmının ekran boyunca yatay olarak süpürüldüğünü, ızgara karelerinin ise tutarlı bir boyutu koruduğunu onaylayın (Şekil 10).
NOT: Örnekteki görüntüleme düzleminin eğimi nedeniyle, ızgara x düzleminde hafifçe gerilmiş görünebilir.
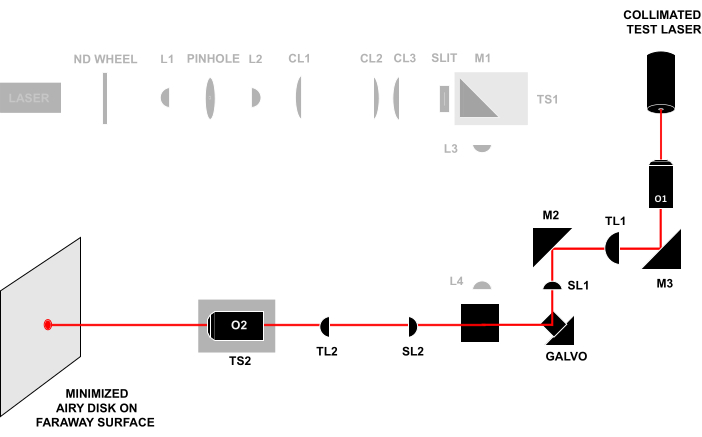
Şekil 4: Lazerle girme ve çıkarma tekniği. O1'in önünden kolimasyonlu bir test ışını göndermek ve O2'den çıkan ışını uzak bir yüzeyde gözlemlemek. Tüm bileşenler doğru mesafede hizalanırsa, kiriş uzak yüzeyde küçük bir Airy diski oluşturacaktır. Tüm kısaltmalar Şekil 3'teki ile aynıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Hizalama için emisyon ışığının kullanılması. (A) O2'nin BFP'sinin arkasındaki vidalı bir hedef üzerindeki akrilik floresan slayttan emisyon ışığı. (B) Emisyon ışığını O3'ün arkasından görerek bulmak. Kısaltmalar: O2-O3 = hedefler; BFP = arka odak düzlemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Doğru odaklanmış buzlu cam hizalama diskinin kamera görüntüsü. Disk, SL2 ve TL2 arasındaki ara düzleme yerleştirildi. Ölçek çubuğu = 50 μm. Kısaltmalar: SL2 = tarama merceği; TL2 = tüp lens. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: 3D boncuk örneğinin kamera görüntüsü. Görüntü, görüntüleme modülü 0°'ye ayarlanmış ve silindirik lensler yerleştirilmeden önce dairesel bir ışınla aydınlatılmış 1 nm boncukları göstermektedir. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: SL2 ve TL2 arasındaki ara düzleme doğru odaklanmış pozitif ızgara testi hedefi. Alanın tamamı boyunca düz ızgaralar, SL2 ve önceki bileşenlerin iyi hizalandığını gösterir. Ölçek çubuğu = 30 μm. Kısaltmalar: SL2 = tarama merceği; TL2 = tüp lens. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 9: 3D boncuk örneğinin kamera görüntüsü. Görüntü, SL2 ve TL2 arasındaki ara düzleme doğru şekilde odaklanmış 1 nm boncukları göstermektedir. Ölçek çubuğu = 30 μm. Kısaltmalar: SL2 = tarama merceği; TL2 = tüp lens. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 10: Izgaranın kareleriyle eşleşecek şekilde üst üste bindirilmiş tutarlı boyutta sarı bir kare ile pozitif ızgara testi hedefi. (A) Sol tarafta odaktaki ızgara. (B) Sağ tarafta odakta ızgara. Sarı kare, FoV'nin her iki tarafındaki ızgara kutularının boyutuyla eşleşir. Ölçek çubukları = 30 μm. Kısaltma = FoV = görüş alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Eğik ışık tabakasının hizalanması
- O1'i çıkarın ve çift buzlu cam hizalama kafesini yerine yeniden takın. Işının her iki buzlu cam disk üzerinde toplandığını ve ortalandığını onaylayın.
- Silindirik Lens 1'i (CL1) dönen bir lens yuvasına vidalayın. CL1'i optik yola monte edin ve ışın optik tablaya dikey yönde genişleyecek şekilde montajı döndürün. CL1'in eğimini ve yanal konumunu, ışın ön tarafta ortalanacak ve her iki buzlu cam disk üzerinde ortalanmış bir konumu koruyacak şekilde ayarlayın.
- Silindirik Lens 2'yi (CL2) dönen bir lens yuvasına vidalayın ve CL1 ile bir 4f sistemi oluşturmak için CL2'yi optik yola doğru mesafede monte edin. CL2'yi CL1 ile aynı yöne döndürün, böylece ışın optik tablaya dikey yönde gerilir ve toplanır. Kirişin kolimasyonlu olduğundan emin olmak için silindirik kiriş profilinin yüksekliğini birden fazla yerde ölçmek için bir test kartı kullanın. CL2'nin eğimini ve yanal konumunu adım 4.2'de gerçekleştirildiği gibi ayarlayın.
- Silindirik Lens 3'ü (CL3) dönen bir lens yuvasına vidalayın ve L3 ile bir 4f sistemi oluşturmak için CL3'ü optik yola doğru mesafede monte edin. CL3'ü hem CL1 hem de CL2 ile aynı yöne döndürün, böylece ışın odak düzleminde yatay bir tabaka profiline odaklanır. CL3'ün eğimini ve yanal konumunu adım 4.2'de gerçekleştirildiği gibi ayarlayın.
- Yarığı yerleştirin: Dört adet 4 inç kafes çubuğu ve CL3 kafes montajı kullanarak, yarığı bir cetvelle ölçüldüğü gibi CL3 ve L3 arasındaki odak düzlemine dikey yönde monte edin. Kiriş üzerinde ortalanana kadar yarığın yüksekliğini ve yanal konumunu ayarlamak için gerilmiş uyarma ışını profilini kullanın.
- O1'i yeniden takın, floresan boya test örneğini monte edin ve s'yi aydınlatınampuyarma ışık tabakası ile. Kamera sensöründe, 0° ışıklı tabakanın ince bir dikey tabaka olarak göründüğünü onaylayın (Şekil 11A).
- Floresan boya test örneğini çıkarın ve O1'i silerek temizleyin. Işık tabakasının engellenmeden O1'in üzerine genişlemesine izin verin. Motorlu öteleme aşaması kontrolünü kullanarak, ışık tabakasının açısını O1'in optik eksenine göre kabaca 60°'ye ayarlamak için M1'i silindirik lenslere doğru çevirin.
NOT: Işık tabakasının benzer şekilde eğimli görüntüleme düzlemi ile hizalanması için doğru yönde eğilmesi çok önemlidir (Şekil 12); Bir sistem bu özel tasarımdan farklı bir şekilde düzenlenirse, eğimin doğru yönü geometrik ışın izleme ile anlaşılabilir.
NOT: Referans olarak, M1 2.647 mm'yi yarığa doğru çevirmek, bu kurulumda ışık sayfasını doğru eğime ayarlayın. - Eğik tabakayı görüntülemek için floresan boya test örneğini yeniden yerleştirin. Işık tabakasının kamera üzerinde dikey bir ışın şeklini koruduğundan, ancak daha geniş ve daha sönük olduğundan emin olun (Şekil 11B).
- Floresan boya, FoV'nin merkezi ile ekranın sağ tarafı arasında beş farklı derinlikte ışık tabakası tarafından aydınlatılacak şekilde s'yi sahne ile eksenel olarak çevirin. Her görüntüyü kaydedin.
- Görüntüleri Fiji'de açın. Her görüntü için Çizgi aracını seçin ve Görüş Alanı'nın ortasından ışık sayfasının ortasına yatay bir çizgi çizin. Yer değiştirmeyi ölçmek için Analiz | Çizgilerin uzunluğunu görmek için ölçün. Ardından, ışık tabakasının O1 üzerindeki açısını hesaplamak için ışık tabakasının yer değiştirmesini örnek derinliğinin bir fonksiyonu olarak çizin.
- M1'i hafifçe çevirin. Işık tabakasının açısı, görüntüleme düzleminin açısıyla eşleşecek şekilde O1'in optik ekseninden 60° olana kadar adım 4.9 ve adım 4.10'u tekrarlayın.

Şekil 11: Doğru şekillendirilmiş bir ışık tabakası ile aydınlatılan floresan boya test numunesinin kamera görüntüleri. (A) 90°'de, O1'in optik ekseni boyunca düz yukarı ve (B) 30°'ye (O1'in optik eksenine 60°) eğik levha. Ölçek çubukları = 50 μm. Kısaltma: O1 = amaç. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
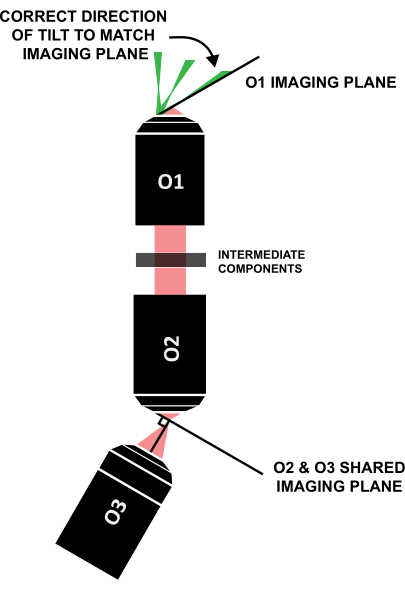
Şekil 12: O1'in görüntüleme düzlemi ile hizalamak için ışık tabakası eğiminin doğru yönü. Kısaltma: O1-O3 = hedefler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Görüntüleme ve veri toplama için sistemde ince ayar yapmak
- 3D boncuk slaytını monte edin ve boncuklar kameradaki FoV'yi doldurana kadar örneği sahne ile eksenel olarak çevirin.
- Sapmaları en aza indirmeyi ve görüntüdeki sinyal-gürültü oranını optimize etmeyi amaçlayan xy aşamasını ve kafes öteleme aşamasını kullanarak O3'ü ayarlayın (Şekil 13).
- Sapmaları en aza indirmeyi ve görüntüdeki sinyal-gürültü oranını optimize etmeyi amaçlayan O1'in düzeltme bileziğini ayarlayın.
Şekil 13: Doğru şekillendirilmiş bir ışık tabakası ile aydınlatılan 3D boncuk örneğinin (1 μm boncuk) kamera görüntüleri. (A) 90°'de, O1'in optik ekseni boyunca düz ve (B) O1'in optik eksenine 30°'ye eğik levha. Sarı kutu, FoV'nin düz, tutarlı ve kullanılabilir (80 μm x 80 μm) ve güvenilir verilerin yakalanabileceği kısmını gösterir. Ölçek çubukları = 50 μm. Kısaltmalar: O1 = amaç; FoV = görüş alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Sistemin büyütme oranını kalibre etme
- Pozitif ızgara test hedefini s'ye monte edinamptage ve parlak alan ışığıyla aydınlatın.
- Izgara slaytını odağa getirmek için ızgara slaytını sahne alanıyla eksenel olarak çevirin. Izgaranın merkezini odağa getirin.
- Görüntüyü yakalayıp kaydedin ve ardından Fiji'de açın.
- İki ızgara çizgisi arasındaki mesafeyi piksel cinsinden doğru bir şekilde ölçmek için Fiji'deki Çizgi aracını ve Ölçü işlevini kullanın. Piksel-mikron kalibrasyonunu belirlemek için bu değeri bilinen mesafeye (10 μm) bölün.
- Denklem (1) ile pikselin ölçülen boyutunu ve bir pikselin bilinen boyutunu kullanarak sistemin büyütmesini (M) hesaplayın.
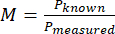 (1)
(1)
7. Hacimsel taramaların elde edilmesi
- Numuneyi konumlandırın.
- Kamera önizlemesini, galvo'yu, işlev oluşturucuyu, güç kaynağını, s'yi açıntage ve uyarma lazeri.
- Numuneyi monte edin ve ardından bir üçgen dalgası ayarlamak için fonksiyon üretecindeki FSK düğmesine tıklayın. Örneği bulmak için, aşağıdakileri ayarlamak için işlev oluşturucuyu kullanın: 400 mV tepeden tepeye genlik (Ampl. düğmesini kullanarak), 0 ofset (Ofset düğmesini kullanarak) ve 200 mHz frekansı. 100 ms pozlama süresi ayarlamak için Micromanager penceresini kullanın.
- Örnek düzleme ulaşılana kadar manuel olarak z içinde kaydırın. Hacimsel tarama için istenen bölge bir döngü sırasında ekrandan geçecek şekilde z ayarını optimize edin.
- Tarama parametrelerini seçin.
- Taramanın süresi boyunca önizlemenin odakta görünüp görünmediğini görsel olarak kontrol ederek tepeden tepeye genliğin doğru ayarlandığından emin olun. Görüntü kalitesi, taramanın bir ucuna yaklaştıkça diğerinden daha erken düşerse, taramanın merkezini daha iyi bölgeye doğru hareket ettirmek için işlev oluşturucudaki ofseti düzenleyin.
- Micromanager programında, bir pozlama süresi seçin ve Multi-D Acq.'ye tıklayarak Multi-Dimensional Acquisition (Çok Boyutlu Alım) penceresini açın. Toplam alım süresini ayarlayacak kare sayısını seçmek için Sayı kutusunu kullanın. Kareler arasındaki aralık (kare hızı), Aralık kutusunda daha uzun bir aralık belirtilmediği sürece pozlama süresine göre ayarlanacaktır. Fonksiyon üretecinde, üçgen dalga fonksiyonunun periyodunun yarısı kadar tam hacim taraması oluşturmak için frekansı ayarlayın (bir yönde doğrusal tarama).
NOT: Kare hızı ve frekansı çok düşükse, birim taraması için çok az kare alınır ve düşük kare sayısı, son işlemede görünür yapaylıklar oluşturur. Referans olarak, Şekil 13 taramada ~100 kareden ve Şekil 14 ~800'den oluşturulmuştur. Parametreleri seçerken numunenin kendisini dikkate almak da çok önemlidir. Maruz kalma süresinin, numune yeterince heyecanlanacak ancak doygun olmayacak şekilde ayarlandığından emin olun. Uyarma lazer yoğunluğu da bu amaçla ayarlanabilir. Kullanıcı, zamanla değişen bir işlemi 3B olarak karakterize etmek için bir dizi hacimsel tarama alıyorsa, tarama zaman ölçeğinin sistemin zaman ölçeği dinamiklerini aştığından emin olun.
- Video toplama: Birimin bir tam taramasına karşılık gelen, üçgen dalganın en azından tam bir rampa yukarı veya aşağı rampa süresini yakalayan bir hızlandırılmış çekim elde edin.
8. İşlem sonrası prosedürler
- Hacimsel görüntü yığınlarının eğriliğini kesme
- Eğik düzlemlerdeki görüntü yığınını gerçek xyz koordinatlarındaki bir dizi görüntüye dönüştürmek için birim taramalarını eğriltin.
NOT: Açık renkli sayfa görüntü son işleme ve açık kaynaklı yazılımlar hakkında, mevcut birim taramalarının eğriliğini gerçekleştirmenin yanı sıra, eğrilik düzeltme işlemi gerçekleştirmek ve alma sırasında eğriliği düzeltilmiş görüntüleri kaydetmek için birçok mükemmel kılavuz vardır24. - Hacim taramalarını eğriltmek için şu iki parametreyi elde edin: piksel cinsinden iki kare arasındaki gerçek mesafe (d) ve çerçeve düzlemi ile xy düzlemi arasındaki açı (θ, eğik ışık tabakasının açısı ile ayarlanır (bu sistemde, 30°). Çerçeveler arasındaki mesafe, görüntüleme optiklerine ve çekim ayarlarına bağlı olacaktır.
- Eğik düzlemlerdeki görüntü yığınını gerçek xyz koordinatlarındaki bir dizi görüntüye dönüştürmek için birim taramalarını eğriltin.
- d parametresini bulma
- Sistem büyük ölçüde yeniden hizalandığında çerçeveler arasındaki mesafeyi kalibre edin. Bu kalibrasyonu, sorunları teşhis etmek için kullanımı en kolay olanlardan oluşan bir floresan boncuk görüntüsü yığınıyla gerçekleştirin.
- Bir görüntü yığını alın ve d parametresi için herhangi bir ilk tahmini kullanarak eğrilik düzeltme kodunu çalıştırın. Eğriliği düzeltilmiş görüntü yığınını ImageJ'de açın ve yığında ilerleyin. d, gerçek değerinden önemli ölçüde uzağa ayarlanmışsa, boncukların x veya y'de yapay olarak uzatılmış görüneceğini ve kullanıcı z'deki kareler arasında gezinirken (aynı merkezi noktadan odaklanmak ve bulanıklaştırmak yerine) tek tek boncukların xy düzleminde hareket ediyormuş gibi görüneceğini gözlemleyin. Bu sorunlar artık belirgin olmayana kadar d parametresini birden çok kez yineleyin.
- d parametresi gerçek değere makul ölçüde yakın göründüğünde, görüntü yığınının x ve y yönleri boyunca maksimum yoğunluk projeksiyonlarını hesaplayın. Kırınım sınırına yakın bir çapa sahip boncukların z'de uzamış görünebileceğini, ancak ideal olarak konik görünmemeleri veya çapraz olarak uzatılmamaları gerektiğini unutmayın. Bu ölçütler yeni yinelemelerle önemli ölçüde iyileşmeyene kadar eğrilik düzeltme parametrelerinde ince ayar yapın. Referans olarak, Şekil 13'te gösterilen veriler d = 2.50 pikselde eğrilik düzeltme ve Şekil 14'teki veriler d = 1.0 pikselde eğrilik düzeltme yapılmıştır.
NOT: Kareler arasındaki mesafe, tarama genliğine, frekansına ve kare hızına doğrusal olarak bağlı olacaktır.
Sonuçlar
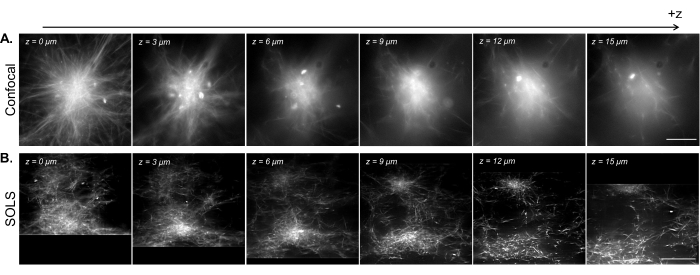
Gellan sakızına gömülü 1 μm boncukların hacimsel taramalarını gerçekleştirdik. Şekil 14 , x, y ve z yönleri boyunca eğrilik eğri hacimsel taramaların maksimum yoğunluk projeksiyonlarını göstermektedir.

Şekil 14: Gellan sakızında 1 μm floresan boncukların hacimsel görüntülemesi. Eğrilik eğriliği olan hacimsel taramaların maksimum yoğunluk projeksiyonları gösterilir. Ölçek çubukları = 30 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
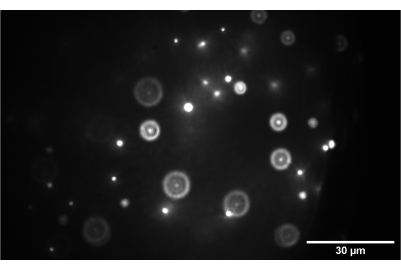
Mikrotübül aster örneklerinin hacimsel taramalarını gerçekleştirerek yeniden yapılandırılmış hücre iskeleti ağlarını karakterize etmek için tek objektifli, ışık tabakalı mikroskobun kullanımını gösterdik. Kısaca, rodamin etiketli, taksol ile stabilize edilmiş mikrotübüller, GTP ile sulandırılmış dimerlerden polimerize edildi; daha sonra, polimerizasyonu takiben, streptavidin bazlı kinesin motor kümeleri, 6 μM mikrotübüller, 0.5 μM kinesin dimerleri ve 10 mM ATP'nin nihai konsantrasyonları için ATP ile birlikte numunelere karıştırıldı. Taksol ile stabilize edilmiş mikrotübüllerin ve kinesin motor kümelerinin hazırlanması için kapsamlı protokoller ve kılavuzlar Mitchson Lab ve Dogic Lab web sitelerindebulunabilir 25,26. Numuneler nazikçe mikroskop lamlarına pipetlendi, mühürlendi ve motor aktivitenin durmasına izin vermek için görüntülemeden önce 8 saat bekletildi, böylece numuneler asterlere benzeyen sabit bir yapısal duruma ulaştı.
Sulandırılmış hücre iskeleti sistemleri üzerine yapılan çalışmalar, en sık olarak etiketli filamentleri görüntülemek için konfokal veya epifloresan mikroskobu kullanır. Bununla birlikte, bu tekniklerin her ikisi de yoğun 3D örnekleri görüntüleme yetenekleri bakımından sınırlıdır27. İn vitro hücre iskeleti tabanlı aktif madde araştırmalarında, numuneleri yarı2D 28,29 olarak sınırlayarak çok ilerleme kaydedilmiş olsa da, hücre iskeleti ağları doğası gereği 3D'dir ve mevcut birçok çaba, yalnızca 3D örneklerde ortaya çıkabilecek etkileri anlamaktayatmaktadır 29,30, bu nedenle yüksek çözünürlüklü 3D görüntülemeye ihtiyaç yaratır.
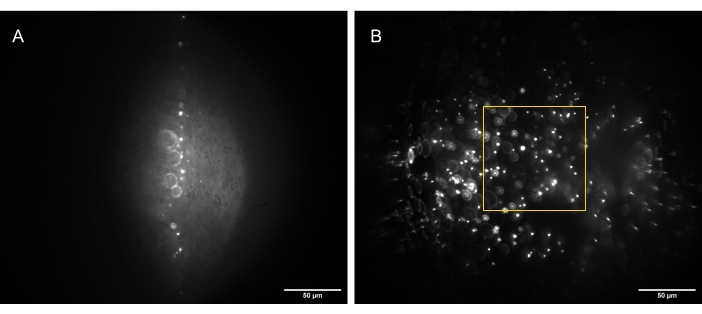
Şekil 15: Sulandırılmış hücre iskeleti örneklerinin tek objektifli ışık tabakası mikroskobu ile 3D görselleştirilmesinin kolaylaştırılması. (A) Leica DMi8 lazer taramalı konfokal mikroskopta elde edilen floresan mikrotübül asterlerinin görüntüleri. Görüntüler, bir z-taramasından farklı düzlemleri gösterir. Ölçek çubuğu = 30 μm. (B) Aynı numunenin tek objektifli ışık sayfası kurulumunda gerçekleştirilen hacimsel bir taramadan elde edilen eğriliği giderilmiş görüntüler. Ölçek çubuğu = 30 μm. Buradaki eğrilik düzeltilmiş görüntü alanı, Şekil 13B'de gösterilen kullanılabilir FoV'ye (sarı kutu) karşılık gelir. Konfokal, lamel yakınındaki tek düzlemleri görüntülemede üstün olsa da, floresan numunenin yoğunluğu, görüntüleme düzleminin altından gelen ek sinyal nedeniyle daha yüksek düzlemlerde görüntüleme sırasında komplikasyonlara neden olur. Işık tabakası, yalnızca görüntüleme düzlemini aydınlatarak bu sorunu ortadan kaldırır, böylece z'de farklı düzlemlerde eşit derecede keskin görüntülemeye izin verir. Kısaltmalar: SOLS = tek amaçlı ışık sayfası; FoV = görüş alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 15'te, kinesin motor kümeleri tarafından aster benzeri yapılara büzülen yeniden yapılandırılmış bir mikrotübül ağının hacimsel görüntülemesini gösteriyoruz. Önceki araştırmalarda gösterildiği gibi28,31, bu 3D yapılar merkeze doğru yoğunlaşma eğilimindedir ve bu da sinyalde baskın olan parlak floresan bölgelerine neden olur. Lamelin yakınındaki görüntüleme düzlemlerinde (düşük z seviyesi), konfokal mikroskopi (Şekil 15A), yukarıdan gelen odak dışı floresan sinyalleri nedeniyle merkeze doğru ek arka plan ile asterin çevresindeki tek filamentleri çözebilir. Bununla birlikte, z'de birkaç mikron hareket etmek, asterin odak dışı yoğun bölümlerinin görüntüleme düzlemindeki sinyalde baskın olması nedeniyle görüntülerin kalitesini hızla düşürür. Işık tabakasının tek düzlemli aydınlatması (Şekil 15B), asterin görüntüleme düzleminin üstündeki ve altındaki yoğun kısımlarından gelen odak dışı sinyalleri ortadan kaldırır, böylece düzlemler arasında karşılaştırılabilir görüntü kalitesine izin verir. Işık tabakasının yüksek kaliteli, güvenilir hacimsel tarama verileri üretme yeteneği, yeniden yapılandırılmış hücre iskeleti sistemlerinde 3D fenomenleri görselleştirme ve karakterize etme olasılığını açar.
Tartışmalar
Bu protokolle ilgili iki önemli ayrıntı, sistemin toplam maliyeti ve beklenen derleme ve hizalama süresidir. Kesin maliyet değişken olsa da, bu SOLS veya benzer bir DIY sisteminin toplam maliyetinin 85.000 USD aralığında olacağını rahatlıkla tahmin edebiliriz. Bu tahminin tüm bileşenlerin perakende fiyatını dikkate aldığını, bu nedenle bu genel fiyatın kullanılmış bileşenlerin tedarik edilmesiyle büyük ölçüde azaltılabileceğini not ediyoruz. Yapım süresi açısından, optik deneyimi az olan bir kullanıcının, tüm bileşenlerin mevcut ve hazır olması koşuluyla, tüm bu SOLS sistemini 1-2 ay içinde kurmasını ve hizalamasını beklemek mantıklı olacaktır. Protokolün uzunluğuna ve karmaşıklığına rağmen, video protokolüyle eşleştirilen yazılı makaledeki ayrıntı miktarının bu protokolü basit ve takip edilmesi hızlı hale getirmesi gerektiğine inanıyoruz.
Bu protokolde iki kritik adım vardır. İlk olarak, galvo'nun yerleşimi, üç ayrı 4f lens çiftinin parçası olduğu için birçok lensin yerleşimini belirler. Galvo'nun hem O1 hem de O2'nin arka odak düzlemleri ile konjuge olması ve eğim-değişmez taramayı sağlamak için doğru şekilde ortalanması çok önemlidir. İkincisi, görüntü kalitesi O2 ve O3'ün birbirine göre hizalanmasına son derece duyarlıdır. Burada, ilk olarak, O3'ün O2'ye hizalama açısının, uyarma ışık tabakasının eğimiyle eşleştiğinden ve böylece benzer şekilde eğimli FoV boyunca maksimum düz aydınlatma sağladığından emin olmak için özen gösterilmelidir. İkincisi, mümkün olduğunca geniş bir alana sahip düz bir FoV'yi korumak için O3 doğru eksenel mesafeye yerleştirilmelidir. Üçüncüsü, O2-O3 arayüzünden geçen sinyali en üst düzeye çıkarmak için O3, O2'den doğru yanal mesafeye yerleştirilmelidir.
Kullanılabilir FoV açısından, bu sistem 80 μm x 80 μm'lik bir alanda tutarlı aydınlatma ile düz, güvenilir bir alan elde etti. Bu alan, kamera tarafından sağlanan maksimum FoV'den daha küçüktür, bu nedenle kullanılabilir FoV, Şekil 13'teki sarı kutu ile gösterilir. Çözümleme gücü açısından, bu sistem, x ekseni boyunca 432 nm ve y ekseni boyunca 421 nm'lik minimum çözülebilir bir mesafe elde etti, bu da Gauss uyumlarının ortalama sigma x ve y'sinin iyi FoV'de nokta yayılma fonksiyonlarına (PSF'ler) bulunmasıyla ve iki ile çarpılmasıyla ölçüldü. Bu sistemin toplam NA açısından optimize edilmediğini not ediyoruz, yani kullanıcılar bu sistemin elde ettiğinden daha yüksek bir çözümleme gücü istiyorlarsa önemli bir iyileştirme için yer var. Bu tür SOLS yapısı için, birçoğu daha yüksek bir sistem çözünürlüğüne katkıda bulunacak, ancak daha yüksek bir maliyet, daha küçük bir FoV veya röle arayüzünde daha karmaşık hizalama teknikleri gibi dezavantajlara sahip çok sayıda uyumlu objektif seçeneği vardır 8,11,13,20. Ayrı olarak, kullanıcılar daha büyük bir FoV isterlerse, 2D taramaya izin vermek için ikinci bir galvo dahil etmek bu hedefe ulaşacaktır, ancak tasarıma entegre edilecek ek optik ve kontrol mekaniğigerektirecektir 32. Web sitemizdeki sayfada sistemde yapılan değişikliklerle ilgili daha fazla ayrıntı ve tasarım süreciyle ilgili diğer yararlı kaynaklara bağlantılar sağladık23.
Bu özel tasarım için belirli bileşenleri geliştirmenin ötesinde, bu yapıya başka yüksek çözünürlüklü mikroskopi teknikleri veya modaliteleri eklemek çok uygun olacaktır. Böyle bir gelişme, ek uyarma lazerlerinin orijinal uyarma yolu8'e hizalanmasını içeren çok dalga boylu aydınlatmayı dahil etmek olacaktır. Ayrıca, bu tür SOLS tasarımı numuneyi erişilebilir bıraktığından, mikroskoba optik cımbızlama, mikroakışkanlar ve reometri dahil ancak bunlarla sınırlı ek işlevler eklemek nispeten basittir 2,33.
Yayınlanmış sayısız ışıklı sayfa kılavuzuyla karşılaştırıldığında, bu protokol, önemli optik deneyimi olmayan bir kullanıcının yararlı bulabileceği bir anlayış düzeyinde talimatlar sağlar. Geleneksel örnek slayt montaj yeteneklerine sahip kullanıcı dostu bir SOLS yapısını daha geniş bir kitle için erişilebilir hale getirerek, cihazın kullanıldığı veya kullanılabileceği tüm alanlarda SOLS tabanlı araştırma uygulamalarının daha da genişletilmesini sağlamayı umuyoruz. 2,34,35 sayısı hızla artan SOLS enstrümanlarının uygulamalarına rağmen, SOLS tipi enstrümanların birçok faydasının ve kullanımının hala keşfedilmemiş olduğuna inanıyoruz ve bu tür enstrümanların ileriye dönük olasılıklarına heyecan duyuyoruz.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok. Tüm araştırmalar, çıkar çatışması olarak yorumlanabilecek ticari veya finansal ilişkilerin yokluğunda yapılmıştır.
Teşekkürler
Bu çalışma, Ulusal Bilim Vakfı (NSF) RUI Ödülü (DMR-2203791) tarafından J.S.'ye desteklenmiştir. Uyum sürecinde Dr. Bin Yang ve Dr. Manish Kumar tarafından sağlanan rehberlik için minnettarız. Kinesin motorlarının hazırlık talimatları için Dr. Jenny Ross ve K. Alice Lindsay'e teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 | |
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25x36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer - 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free | |
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free | |
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A | |
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free | |
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free | |
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 | ||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
Referanslar
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002(2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834(2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681(2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, F1000 Faculty Rev-998 (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441(2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss. , Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023).
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss. , Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023).
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Sheung Lab, Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab. , Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023).
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- Harvard University. Mitchison Lab. , Available from: https://mitchison.hms.harvard.edu/home (2023).
- Research at Dogic Lab. , Available from: http://dogiclab.physics.ucsb.edu/research/ (2023).
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119(2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002(2016).
- Millett-Sikking, A., et al. High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969(2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır