Method Article
Conception et construction d’un microscope à fluorescence à feuillet de lumière personnalisable à objectif unique pour la visualisation des réseaux de cytosquelettes
Dans cet article
Résumé
Ce protocole décrit en détail comment construire un microscope à fluorescence à feuillet de lumière à objectif unique et son utilisation pour visualiser les réseaux de cytosquelettes.
Résumé
Les composites de cytosquelettes reconstitués sont apparus comme un système modèle précieux pour l’étude de la matière molle hors équilibre. La capture fidèle de la dynamique de ces réseaux denses en 3D nécessite un sectionnement optique, souvent associé aux microscopes confocaux à fluorescence. Cependant, les développements récents de la microscopie à fluorescence à feuillet de lumière (LSFM) l’ont établie comme une alternative rentable et, parfois, supérieure. Pour rendre le LSFM accessible aux chercheurs en cytosquelette moins familiers avec l’optique, nous présentons un guide du débutant étape par étape pour construire un microscope à fluorescence à feuillet de lumière polyvalent à partir de composants prêts à l’emploi. Pour permettre le montage d’échantillons avec des échantillons de lames traditionnels, ce LSFM suit la conception à feuille de lumière à objectif unique (SOLS), qui utilise un seul objectif pour l’excitation et la collecte d’émission. Nous décrivons la fonction de chaque composant du SOLS avec suffisamment de détails pour permettre aux lecteurs de modifier l’instrumentation et de la concevoir en fonction de leurs besoins spécifiques. Enfin, nous démontrons l’utilisation de cet instrument SOLS personnalisé en visualisant les asters dans des réseaux de microtubules pilotés par la kinésine.
Introduction
La microscopie à fluorescence à feuillet de lumière (LSFM) représente une famille de techniques d’imagerie par fluorescence à haute résolution dans lesquelles la lumière d’excitation est façonnée en une feuille 1,2, y compris la microscopie à éclairage plan sélectif (SPIM), l’excitation planaire alignée confocalement balayée (SCAPE) et la microscopie à plan oblique (OPM)3,4,5,6,7. Contrairement à d’autres modalités de microscopie telles que l’épifluorescence, la microscopie à fluorescence à réflexion interne totale (TIRFM) ou la microscopie confocale, la phototoxicité est minime dans la LSFM et les échantillons peuvent être imagés sur des échelles de temps plus longues car seul le plan de l’échantillon activement imagé est éclairé 8,9,10. Par conséquent, les techniques LSFM sont extrêmement utiles pour l’imagerie d’échantillons 3D sur de longues périodes, notamment celles trop épaisses pour les techniques de microscopie confocale. Pour ces raisons, depuis son développement initial en 2004, le LSFM est devenu la technique d’imagerie de choix pour de nombreux physiologistes, biologistes du développement et neuroscientifiques pour la visualisation d’organismes entiers tels que les embryons vivants de poisson-zèbre et de drosophile 3,4,6,11 . Au cours de ces deux dernières décennies, les avantages de la LSFM ont été exploités pour visualiser la structure et la dynamique à des échelles de plus en plus petites, y compris les tissus11,12, les échelles cellulaires et subcellulaires, à la fois in vivo et in vitro 13,14,15,17.
Malgré les rapports de cas d’utilisation réussis dans la littérature, le coût élevé des systèmes LSFM commerciaux (~0,25 million USD au moment de la rédaction de cet article)18,19 empêche l’utilisation généralisée de la technique. Pour faire des constructions DIY une alternative réalisable pour les chercheurs, plusieurs guides de construction ont été publiés 8,13,20,21, y compris l’effort en libre accès OpenSPIM 22. Cependant, à ce jour, les chercheurs ayant une expérience minimale de l’optique ne peuvent utiliser que des modèles LSFM antérieurs, qui sont incompatibles avec les échantillons traditionnels montés sur lame (Figure 1A). La récente mise en œuvre d’un seul objectif et d’une feuille de lumière (SOLS) utilise un seul objectif pour l’excitation et la détection (Figure 1C), surmontant ainsi la limitation liée à la compatibilité 5,6,8,13,20. Cependant, le coût de la polyvalence de la conception SOLS est une augmentation substantielle de la complexité de la construction en raison de la nécessité de deux objectifs supplémentaires pour relayer, désincliner et réimager le plan de l’objet sur la caméra pour l’imagerie (Figure 1D). Pour faciliter l’accès aux configurations complexes de style SOLS, cet article présente un guide étape par étape sur la conception, la construction, le processus d’alignement et l’utilisation d’un système SOLS compatible avec les diapositives, qui serait utile aux chercheurs ne connaissant qu’un cours d’optique de niveau débutant.
Bien que le protocole lui-même soit succinct, les lecteurs doivent se référer à d’autres ressources pendant les étapes de préparation pour en savoir plus sur des parties particulières de la conception ou des considérations matérielles. Cependant, si un lecteur a l’intention de suivre les spécifications de cette conception, il peut ne pas être nécessaire de comprendre comment sélectionner des composants optiques particuliers.
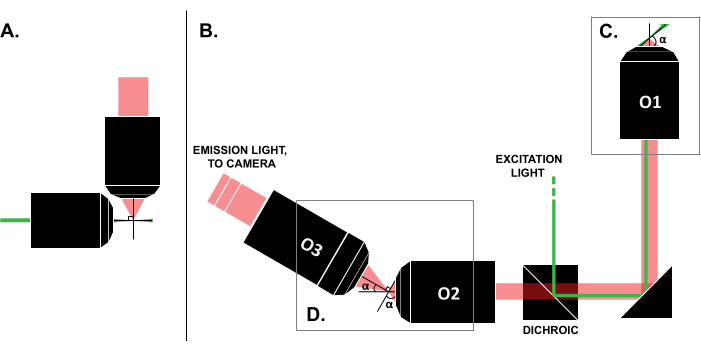
Figure 1 : Caractéristiques des différentes configurations LSFM. (A) La configuration avec deux objectifs orthogonaux communs dans les premières conceptions LSFM. Dans cette configuration, un tube capillaire ou un cylindre de gel est utilisé pour contenir l’échantillon, ce qui n’est pas compatible avec les techniques traditionnelles de montage sur lame. (B) un schéma d’une feuille de lumière SOLS montrant les éléments suivants : (C) l’objectif unique utilisé pour l’excitation et la collecte d’émission au niveau du plan d’échantillonnage (O1) ; cela permet de monter une glissière traditionnelle sur le dessus, et (D) le système d’objectif de relais dans le trajet d’émission SOLS. O2 recueille la lumière d’émission et dégrossit l’image. O3 prend des images de l’avion avec le bon angle d’inclinaison sur le capteur de la caméra. Abréviations : LSFM = microscopie à fluorescence à feuillet de lumière ; SOLS = feuille de lumière à objectif unique ; O1-O3 = objectifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
1. Préparation à l’alignement
- Avant de commencer la construction, effectuez toutes les analyses documentaires nécessaires pour avoir une idée claire du cas d’utilisation prévu (par exemple, les fluorophores à imager, le volume d’imagerie nécessaire, les exigences de résolution). En particulier, reportez-vous à la section des résultats représentatifs ci-dessous pour décider s’il est approprié de suivre le plan exact décrit ici. Si c’est le cas, passez à l’étape 1.2. Si ce n’est pas le cas, trouvez des suggestions et des conseils pour la sélection du matériel dans le Guide de construction Sheunglab SOLS23.
REMARQUE : L’utilisateur peut trouver plus d’informations concernant les spécifications de ce système particulier dans la section de discussion. - Rassemblez tous les composants optiques, optomécaniques et électriques nécessaires, comme indiqué dans la table des matériaux. Pour les utilisateurs modifiant le système, récupérez toutes les pièces équivalentes.
- Construisez le laser d’alignement comme illustré à la figure 2A. Vérifiez que la poutre est collimatée à l’aide de la plaque de cisaillement.
- Construisez la cage d’alignement du disque en verre dépoli double comme illustré à la Figure 2B.
- Préparez l’échantillon d’essai enduit d’un colorant fluorescent.
- Créez une solution de colorant saturé à la rhodamine en ajoutant progressivement 1 mL d’eau distillée à 0,2 g de poudre lyophilisée jusqu’à ce qu’elle soit entièrement dissoute. Vortex pour homogénéiser.
REMARQUE : Cette solution est sensible à la lumière. Bien qu’il n’y ait pas de précautions nécessaires lors de la préparation, assurez-vous que la solution est conservée dans un endroit sombre après sa préparation.
ATTENTION : Portez toujours des gants et un masque lorsque vous manipulez de la poudre de rhodamine. - Pipeter 10 μL au centre d’une lame de test.
- Placez un verre de protection de 22 mm x 22 mm sur le liquide, en veillant à ce que la couche de fluorescence soit aussi fine que possible.
- Sceller avec du vernis à ongles transparent.
REMARQUE : Cet échantillon est sensible à la lumière. Pour maximiser la durée de vie de l’échantillon, assurez-vous que la lame est stockée dans un endroit sombre lorsqu’elle n’est pas utilisée.
- Créez une solution de colorant saturé à la rhodamine en ajoutant progressivement 1 mL d’eau distillée à 0,2 g de poudre lyophilisée jusqu’à ce qu’elle soit entièrement dissoute. Vortex pour homogénéiser.
- Préparer l’échantillon de billes 3D (billes de 1 μm noyées dans du gel).
- Utilisez du ruban adhésif double face pour créer un canal vertical de 4 à 5 mm de large sur une lame d’échantillon, trois couches de ruban adhésif de haut.
- Placez un verre de protection de 22 mm x 22 mm sur le ruban adhésif au centre de la diapositive. Appuyez fermement sur les zones collées pour assurer une bonne étanchéité entre le ruban et le verre de protection.
- Utilisez une lame de rasoir pour enlever l’excès de ruban adhésif.
- Préparer 125 mL de solution de gomme gellane saturée en ajoutant graduellement de l’eau DI à 1 g de poudre de gomme gellane. Cette solution sera solide à température ambiante et liquide à 65 °C.
- Introduire 1 mL de solution de gomme gellane dans un tube de microcentrifugation. Faites chauffer un récipient d’eau sur une plaque chauffante à 65 °C et réchauffez le tube de la microcentrifugeuse jusqu’à ce que la gomme gellane soit visiblement visqueuse.
- Préparez 10 μL d’une dilution de 1:1 000 de billes dans une solution de gomme gellane réchauffée.
- Pipeter soigneusement la solution dans la chambre jusqu’à ce qu’elle soit pleine. Utilisez un cure-dent pour tamponner une petite quantité d’époxy des deux côtés du canal, en couvrant entièrement les ouvertures à sceller. Pour assurer une bonne étanchéité, inspectez visuellement les deux extrémités pour vous assurer que l’époxy a légèrement pénétré chaque extrémité du canal.

Figure 2 : Photos des outils d’alignement. (A) Laser d’alignement collimaté. AL1 : Lentille d’alignement 1, −50 mm ; AL2 : Lentille d’alignement 2, 100 mm (B) Double cage d’alignement de disque en verre dépoli. Abréviations : RMS CP = plaque de cage filetée RMS ; SM1 CP = SM1 plaque de cage filetée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Alignement du chemin d’excitation
- Esquissez la disposition du microscope sur la surface de la table optique. Mesurez toutes les distances aussi précisément que possible.
REMARQUE : reportez-vous à la Figure 3 pour connaître l’emplacement des composants dans le système. - Montez le laser d’excitation sur la table. Placez deux iris à la hauteur prévue du laser et montez-les à 2-3 pieds l’un de l’autre sur la ligne de trous souhaitée derrière l’emplacement du miroir 1 (M1). Utilisez ces iris pour vous assurer que le faisceau est au niveau de la surface de la table et centré sur la ligne de trous de la table optique.
REMARQUE : Portez des lunettes de sécurité laser pour la protection des yeux et bloquez tout faisceau laser parasite avec des écrans de sécurité laser par mesure de sécurité. Jusqu’à ce que tous les composants soient fixés en permanence, une dérive de l’ordre de quelques heures est possible. Installez un iris au point le plus éloigné de l’alignement à la fin de chaque journée pour vérifier visuellement rapidement la dérive lors du retour à la construction. Les vibrations, une table optique mal flottante et les courants d’air sont les causes les plus courantes de dérive optique. - Montez l’obturateur laser aussi près que possible du laser d’excitation. Utilisez cet obturateur pour bloquer rapidement la lumière laser pendant l’alignement, plutôt que d’allumer et d’éteindre le laser à plusieurs reprises.
- Assemblez les filtres ND dans la roue à filtres ND (ND 0.5, 1.0. 2.0, 3.0, 4.0 et une fente vide) et montez-les après l’obturateur laser.
- Basculez l’actionneur motorisé sur un étage de translation (TS1), puis insérez l’étage sous l’emplacement de M1. Assurez-vous que la platine se déplace axialement le long de la même ligne de trous que la lumière laser. Placez le terrain au milieu de sa gamme pour le placement initial.
- Dans les étapes 2.6 à 2.10 suivantes, insérez les composants optiques réfléchissants dans le trajet du faisceau un par un pour diriger le laser le long du trajet tel qu’il est dessiné sur la table. Utilisez la paire d’iris réglée à la hauteur exacte pour définir la trajectoire de sortie du faisceau souhaitée et guider le placement et l’alignement de chaque élément réfléchissant. Pour chaque élément, ajustez la hauteur et la position du support pour vous assurer que le faisceau entrant touche le centre. Ensuite, faites pivoter la base du support pour diriger le faisceau le long du trajet du faisceau allongé sur la table afin qu’il passe à travers les deux iris, et ajustez avec précision l’inclinaison du faisceau sortant avec les boutons à l’arrière de chaque support.
REMARQUE : Une fois que chaque élément est aligné à la bonne hauteur, ajoutez un collier à enfiler au poteau pour sécuriser la hauteur.
- Dans les étapes 2.6 à 2.10 suivantes, insérez les composants optiques réfléchissants dans le trajet du faisceau un par un pour diriger le laser le long du trajet tel qu’il est dessiné sur la table. Utilisez la paire d’iris réglée à la hauteur exacte pour définir la trajectoire de sortie du faisceau souhaitée et guider le placement et l’alignement de chaque élément réfléchissant. Pour chaque élément, ajustez la hauteur et la position du support pour vous assurer que le faisceau entrant touche le centre. Ensuite, faites pivoter la base du support pour diriger le faisceau le long du trajet du faisceau allongé sur la table afin qu’il passe à travers les deux iris, et ajustez avec précision l’inclinaison du faisceau sortant avec les boutons à l’arrière de chaque support.
- Montez et alignez M1 sur TS1.
- Montez et alignez le dichroïque sur la table.
- En suivant les instructions du fabricant, connectez le galvo à l’alimentation électrique et au générateur de fonction.
- Montez le galvo de manière à ce que le laser soit incident au centre exact du miroir. Allumez le galvo, puis maintenez enfoncé le bouton AM du générateur de forme d’onde pour régler l’inclinaison du miroir sur un courant continu de 0 V (centre de la plage). Maintenant, alignez le galvo sur les iris.
- Montez et alignez le miroir 2 (M2).
- Insérez le grand miroir cylindrique dans le support de miroir cylindrique. Utilisez des tiges de cage de 1 po pour fixer un adaptateur de cage de 30 à 60 mm au-dessus du miroir 3 (M3). Utilisez les boutons du support de miroir pour aplatir l’inclinaison du miroir M3 pour le placement initial.
- Montez la cage d’alignement en verre dépoli double dans l’adaptateur de cage au-dessus de M3 ; Assurez-vous de serrer les vis de réglage de l’adaptateur de cage qui maintiennent la cage d’alignement en place chaque fois qu’elle est utilisée pour l’alignement. Montez M3 sur la table et ajustez la hauteur et la position jusqu’à ce que la poutre soit à peu près centrée sur les deux disques d’alignement en verre dépoli. Fixez M3 à la table et utilisez un support de poteau, un poteau de 3 pouces, une pince à 90° et un poteau de 2 pouces des deux côtés du M3 pour ajouter un support à l’aide des trous collés de chaque côté du support de miroir. Utilisez les boutons à l’arrière du miroir pour régler finement le faisceau.
REMARQUE : Tous les éléments réfléchissants dans le chemin d’excitation sont maintenant réglés et ne doivent pas être touchés. - Montez l’objectif 1 (L1) sur la table. Pour tous les placements initiaux de l’objectif, utilisez une cible d’objectif à visser pour centrer le faisceau entrant sur l’avant de l’objectif. Ajustez l’inclinaison et la position latérale de la lentille 1 (L1) jusqu’à ce que le faisceau soit centré sur les deux plaques de verre dépoli de la cage d’alignement au-dessus de M3.
- Monture de l’objectif 2 (L2) dans sa position respective pour créer un système 4f avec L1. Déplacer L2 axialement pour obtenir un faisceau collimaté, et utiliser le laser d’excitation et la plaque de cisaillement pour vérifier la collimation. Ajustez l’inclinaison et la position latérale de L2 pour centrer le faisceau sur les deux disques de verre dépoli au-dessus de M3.
- Montez le sténopé dans un support de translation xy. Montez celui-ci sur une platine de translation 1D pour fournir une translation axiale fine. Montez le sténopé et la platine sur un poteau et un support de poteau, et placez-les au point focal partagé entre L1 et L2. Ajustez le sténopé à la main jusqu’à ce que la lumière laser soit visible à travers le sténopé.
- Montez le capteur du wattmètre immédiatement après le sténopé et utilisez le bouton de longueur d’onde sur la console numérique du wattmètre pour sélectionner la longueur d’onde du laser d’excitation. Ajustez la position xy du sténopé pour maximiser la transmission et obtenir un profil de faisceau proche de TEM00. Ensuite, ajustez le sténopé axialement avec la platine 1D pour maximiser davantage la transmission.
- Fixez l’objectif 4 (L4) sur la table dans sa position et ajustez la monture à la bonne hauteur. Ajustez L4 axialement de manière à ce que le faisceau d’excitation soit focalisé sur la surface du galvo. Ajustez l’inclinaison et la position latérale de L4 pour centrer le faisceau sur les deux disques de verre dépoli au-dessus de M3.
- Montez l’objectif 3 (L3) sur la table dans sa position et ajustez la monture à la bonne hauteur. Utilisez le laser d’excitation et la plaque de cisaillement pour vérifier la collimation de L3 et L4. Ajustez l’inclinaison et la position latérale de L3 pour centrer le faisceau sur les deux disques de verre dépoli au-dessus de M3.
- Supprimez temporairement L3. Montez l’objectif de balayage 1 (SL1) sur la table et ajustez la distance axiale pour former un télescope collimaté avec L4, tel que mesuré avec la plaque de cisaillement. Ajustez l’inclinaison et la position latérale du SL1 pour centrer le faisceau sur les deux disques en verre dépoli au-dessus de M3.
- Réinsérez L3. Montez la lentille du tube 1 (TL1) et utilisez le faisceau d’excitation et la plaque de cisaillement pour collimater SL1 et TL1. Ajustez l’inclinaison et la position latérale de TL1 pour centrer le faisceau sur les deux disques de verre dépoli au-dessus de M3.
- À l’aide d’une bague d’adaptation, vissez l’objectif 1 (O1) dans la plaque de cage au-dessus de M3. Retirez temporairement SL1 et laissez la poutre toucher le plafond. Ajustez la hauteur (distance axiale) de O1 sur le système de cage jusqu’à ce que le faisceau forme un disque d’Airy au plafond, puis continuez à ajuster jusqu’à ce que la taille du disque soit minimisée.
- Avec O1 en place, montez la platine d’échantillonnage dans la position appropriée.
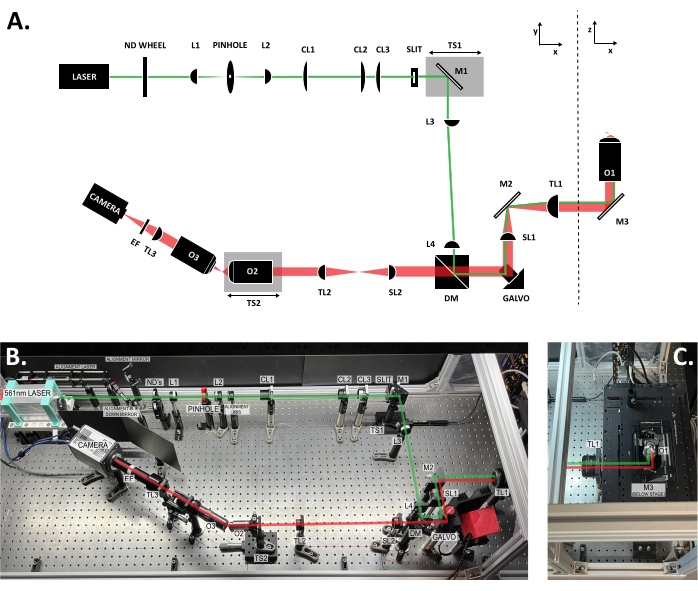
Figure 3 : Emplacement des composants dans le système SOLS. (A) Schéma du système SOLS avec tous les composants étiquetés. (B) Photo de haut en bas du système SOLS physique sur la table optique, à l’exclusion de la zone de l’étage d’échantillonnage. (C) Photo de haut en bas de la zone de la platine d’échantillonnage (extension de la figure 3B). Le chemin d’excitation est indiqué en vert. Le trajet d’émission est indiqué en rouge. Distances focales des objectifs : L1 : 100 mm ; L2 : 45 mm ; CL1 : 50 mm ; CL2 : 200 mm ; CL3 : 100 mm ; L3:150 mm ; L4 : 100 mm ; SL1 : 75 mm ; TL1 : 200 mm ; SL2 : 150 mm ; TL2 : 125 mm ; TL3 : 200 mm. Voir la table des matériaux pour des spécifications de pièces plus détaillées. Abréviations : SOLS = feuille de lumière à objectif unique ; Roue ND = roue à filtres à densité neutre variable ; L1-L4 = lentilles achromatiques concaves plano ; CL1-CL3 = lentilles cylindriques ; M1-M3 = miroirs ; TS1-TS2 = étapes de translation ; DM = miroir dichroïque ; Galvo = galvanomètre à balayage ; SL1-SL2 = objectifs de balayage ; TL1-TL2 = lentilles à tube ; O1-O3 = objectifs ; EF = filtre d’émission. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Alignement de la trajectoire d’émission
- Configurez le laser d’alignement.
- Montez deux plaques de cage vides à côté du laser d’excitation à la même hauteur que le laser. Utilisez ces plaques de cage pour monter le laser d’alignement en faisant glisser les tiges de cage du laser d’alignement dans les trous vides des deux plaques de cage. Assurez-vous que le laser peut être réglé sur la position marche, soit en collant autour du bouton d’alimentation, soit en câblant un interrupteur marche/arrêt.
- Retirez O1 et réinsérez la cage d’alignement en verre dépoli. Utilisez un support de miroir cinématique et un miroir déroulant pour aligner le faisceau d’alignement sur la trajectoire du faisceau d’excitation.
- Utilisez le capteur de puissance pour maximiser le signal du faisceau d’alignement après le sténopé en ajustant finement les deux miroirs. Assurez-vous que le faisceau reste centré sur la cage d’alignement en verre dépoli.
- Retirez la cage d’alignement et réinsérez O1. Placez le miroir carré sur la platine d’échantillonnage de O1 et ajustez le miroir axialement jusqu’à ce que la taille du profil du faisceau soit minimisée après le dichroïque.
- Montez un iris dans le trajet d’émission et suffisamment loin pour que l’objectif de balayage 2 (SL2), l’objectif tubulaire 2 (TL2) et l’objectif 2 (O2) puissent être insérés sans interférence. Alignez cet iris sur le laser d’alignement. Montez un disque en verre dépoli à au moins 1 pouce derrière l’iris et assurez-vous qu’il est également aligné sur la lumière laser.
- Insérez SL2 à la bonne distance, mesurée à partir du galvo avec une règle. Ajustez l’inclinaison et la position latérale du SL2 de sorte que le faisceau d’alignement entrant soit centré sur SL2 et que le faisceau sortant passe à travers l’iris et le disque de verre dépoli.
- Insérez TL2 à la bonne distance, mesurée à partir de SL2 avec une règle. Ajustez l’inclinaison et la position latérale de TL2 de sorte que le faisceau d’alignement entrant soit centré sur TL2 et que le faisceau sortant passe à travers l’iris et le disque de verre dépoli.
- Montez TS2 sur la table. Assurez-vous que la platine se déplace le long de l’axe optique de O2.
- Vissez O2 sur un support de translation xy. Connectez un poteau sous le support xy pour monter O2 sur la platine de translation. Utilisez une cible à visser pour centrer l’arrière de l’O2 sur le laser rouge.
- Ajustez les boutons xy et l’inclinaison de O2 de sorte que le faisceau d’alignement rouge passe à travers l’iris et le disque de verre dépoli.
- Déplacez le laser d’alignement au-dessus de O1 et dirigez-le vers le bas dans le trajet d’émission. Allumez le laser et assurez-vous que ce faisceau est centré sur toutes les lentilles du chemin d’émission.
- Conjuguez les plans pupillaires de O1 et O2 en ouvrant l’iris et en retirant le disque de verre dépoli de sorte que le faisceau d’alignement sortant d’O2 continue sans obstruction vers une surface ou un mur éloigné (>0,5 m) (Figure 4). Ajustez TS2 jusqu’à ce que le faisceau forme un petit disque d’Airy à la surface, puis continuez à ajuster TS2 pour minimiser la taille du disque d’Airy.
REMARQUE : Un faisceau fortement divergent indique un placement incorrect de l’O2. Cependant, comme ce faisceau passe par deux objectifs, une petite divergence est inhérente. En tant que tel, le disque Airy est le meilleur guide. - Optimiser le galvo pour un balayage invariant en inclinaison : appuyez sur le bouton FSK du générateur de forme d’onde pour sélectionner un signal d’onde triangulaire pour le galvo et régler sur une basse fréquence (~1 Hz). Observez le faisceau d’alignement sur la même surface ou mur éloigné.
REMARQUE : Si le galvo est mal placé, le faisceau balayera horizontalement la surface avec le mouvement du galvo. Cela peut être résolu par des ajustements fins (à la main) de l’inclinaison et de la position xy de la base galvo jusqu’à ce que le déplacement du faisceau soit indétectable à l’œil nu. - Vérifiez la qualité du système en imageant à 0°.
- Vissez O3 dans un support de translation xy. Vissez un tube d’objectif de 1 po dans l’étage de translation de la cage et vissez l’étage de translation xy dans le tube. Utilisez deux tiges de cage pour connecter l’avant de la platine de translation de cage à une plaque de cage et montez la plaque de cage sur un poteau. Montez l’objectif 3 (O3) près de l’avant de O2 (~4-5 mm) à 0° et ajustez la hauteur en conséquence.
- Montez un disque d’alignement en verre dépoli dans le plan focal partagé entre SL2 et TL2, tel que mesuré avec une règle. Montez la lame de test fluorescente acrylique sur la scène et éclairez la lame avec le laser d’excitation. Regardez à l’arrière de O3, ajustez la hauteur et la position axiale de O3 pour trouver la lumière d’émission, puis ajustez O3 axialement jusqu’à ce que la lumière d’émission remplisse l’ouverture arrière (Figure 5).
- Vissez deux tiges de cage de 8 pouces à l’arrière de la platine de translation O3. Faites glisser une plaque de cage avec un disque en verre dépoli monté sur les tiges, puis ajustez finement O3 à l’aide de la monture xy pour vous assurer que la lumière d’émission sort de l’O3 centrée. Ensuite, retirez les tiges de la cage.
- Montez un disque en verre dépoli dans la position approximative du capteur de la caméra et alignez la hauteur et la position du disque sur la lumière d’émission.
- Vissez la lentille du tube 3 (TL3) dans une plaque de cage et montez-la immédiatement derrière O3. Centrez TL3 sur la lumière d’émission entrante, puis ajustez l’inclinaison de TL3 pour aligner la lumière sortante sur le disque en verre dépoli.
- Montez la caméra à la bonne distance de l’objectif du tube, mesurée avec une règle.
- Vissez les 2 tubes d’objectif et le filtre d’émission sur l’appareil photo.
- Remontez le disque d’alignement du verre dépoli dans le plan focal partagé entre SL2 et TL2. Montez l’échantillon de test de colorant fluorescent et éclairez l’échantillon avec le faisceau d’excitation.
- Mettez l’appareil photo sous tension, puis ouvrez le programme Micromanager sur l’ordinateur connecté. Cliquez sur Live pour accéder à la vue en direct. Cliquez sur Auto Once pour définir les paramètres d’exposition initiaux, puis réinitialisez l’exposition si nécessaire lors de l’imagerie.
REMARQUE : Micromanager ne fonctionnera pas correctement s’il n’est pas ouvert après la mise sous tension de l’appareil photo. - Ajustez les boutons de translation xy sur la monture O3 jusqu’à ce que le petit trou du disque d’alignement du verre soit centré dans le champ de vision (FoV). Ajustez l’O3 axialement avec la platine de translation de la cage jusqu’à ce que le trou soit net ; les bords doivent sembler nets (Figure 6).
- Image de billes fluorescentes pour vérifier la qualité du système.
- Retirez le disque d’alignement en verre dépoli, montez l’échantillon de billes 3D et illuminez l’échantillon avec le faisceau d’excitation.
- Ajustez la hauteur de l’échantillon par rapport à O1 jusqu’à ce que les billes fluorescentes remplissent une région circulaire au centre du champ de vision.
- Ajustez finement la position de l’O3 à l’aide de l’étage xy et de l’étage de translation axiale jusqu’à ce que les fonctions d’étalement des points (PSF) soient rondes (indiquant des aberrations minimales) et brillantes (indiquant un bon rapport signal/bruit) (Figure 7). Si cela ne peut être réalisé en ajustant O3, il est fort probable que le système optique entre les composants O1 et O2 soit aligné de manière sous-optimale ; Suivez les vérifications de diagnostic à l’étape 3.13 ci-dessous.
- Si des PSF rondes peuvent être obtenues , sautez l’étape de diagnostic et passez à l’inclinaison du système d’imagerie.
- Effectuez des vérifications de diagnostic si nécessaire.
REMARQUE : Une fois que les PSF sont obtenus, le reste des étapes de diagnostic peut être ignoré.- Montez la lumière en fond clair (BF) au-dessus de O1. Montez la cible de test de grille positive sur la platine d’échantillonnage à la même hauteur axiale que le miroir d’alignement. Centrez la grille de 10 μm et éclairez la grille avec la lumière BF.
- Imagez la grille sur la caméra et transférez l’échantillon jusqu’à ce que la grille soit nette. Utilisez l’image de la grille pour confirmer que le champ de vision est plat : sinon, la grille apparaîtra déformée et courbée. Pour corriger une mauvaise image de grille, ajustez la position xyz et l’inclinaison de O3, puis ajustez le TL3 et l’appareil photo en conséquence.
REMARQUE : Si une grille plate peut être obtenue, répétez l’étape 3.12.10, puis passez à l’inclinaison du système d’imagerie. - Installez la caméra d’alignement ou la caméra d’imagerie à la bonne distance afin que SL2 fasse la mise au point de l’image sur le capteur. Imagez la cible de la grille au niveau du plan intermédiaire (Figure 8). Si cette grille est également asymétrique, il est fort probable que le système optique entre les composants O1 et SL2 soit aligné de manière sous-optimale et doive être revisité. Optimisez l’alignement si nécessaire avant de progresser.
REMARQUE : si l’appareil photo ne s’insère pas entre SL2 et TL2, utilisez un miroir supplémentaire pour faire rebondir l’image de 90° après SL2 et sur l’appareil photo. - Vérifier les PSF sur le plan intermédiaire : Après avoir vérifié la grille, un autre bon contrôle de diagnostic consiste à vérifier les PSF sur le même plan intermédiaire. Une bonne image sur ce plan, qui est similaire à la figure 7 mais à un grossissement différent (figure 9), indique un bon alignement à travers SL2.
REMARQUE : Si une grille plate et des PSF ronds peuvent être obtenus dans le plan intermédiaire, répétez l’étape 3.13.2, puis l’étape 3.12.10, puis passez à l’inclinaison du système d’imagerie.
- Inclinez le sous-système d’imagerie O3 à 30°.
- Retirez O3, TL3 et l’appareil photo.
- Réinsérez O3 à 30° par rapport à l’axe optique de O2 en utilisant les lignes sur la table comme guide.
- Montez un disque d’alignement en verre dépoli dans le plan focal partagé entre SL2 et TL2. Montez la lame de test fluorescente acrylique sur la scène et éclairez la lame avec le laser d’excitation. Encore une fois, regardez à travers l’arrière de O3, ajustez à la fois la hauteur et la position axiale de O3 pour trouver la lumière d’émission à 30°, puis ajustez O3 axialement jusqu’à ce que la lumière d’émission remplisse l’ouverture arrière.
- Retirez le disque d’alignement en verre dépoli entre SL2 et TL2 pour obtenir un signal d’émission plus fort.
- Vissez deux tiges de cage de 8 pouces à l’arrière de la platine de translation O3. Faites glisser une plaque de cage avec un disque en verre dépoli monté sur les tiges, puis ajustez finement O3 à l’aide de la monture xy pour vous assurer que la lumière d’émission sort de l’O3 centrée. Ensuite, retirez les tiges de la cage.
- Montez un disque en verre dépoli dans la position approximative du capteur de la caméra et alignez la hauteur et la position du disque sur la lumière d’émission.
- Mont TL3 juste derrière O3. Centrez TL3 sur la lumière d’émission entrante, puis ajustez l’inclinaison de TL3 pour aligner la lumière sortante sur le disque en verre dépoli.
- Pour régler plus précisément la distance entre la caméra TL3 et la caméra, dévissez soigneusement O3 et montez le laser d’alignement de manière à ce qu’il soit focalisé par TL3 sur la caméra. Utilisez des filtres ND si nécessaire pour que l’intensité du laser soit de <1 mW. Démarrez la vue en direct de la caméra et ajustez le TL3 axialement pour minimiser le point laser sur la caméra.
- Remontez le disque d’alignement du verre dépoli dans le plan focal partagé entre SL2 et TL2. Montez l’échantillon de test de colorant fluorescent et éclairez l’échantillon avec le faisceau d’excitation. Ajustez les boutons de translation xy sur la monture O3 jusqu’à ce que le petit trou dans le disque d’alignement du verre se trouve dans le champ de vision de l’appareil photo. Ajustez la platine de translation de la cage pour déplacer l’O3 axialement jusqu’à ce que le trou soit net ; Assurez-vous que le trou semble similaire à ce qu’il était à 0°.
- Remontez la cible de test de grille positive à la même hauteur axiale et éclairez la grille avec la lumière BF. Vérifiez qu’une seule section verticale est nette (en raison de l’inclinaison de 30°). Encore une fois, utilisez l’image de la grille pour confirmer que le champ de vision est plat, même lorsqu’il est flou. Lorsque la diapositive est translatée axialement, vérifiez que la partie nette du champ de vision (cible de la grille) balaie horizontalement l’écran, tandis que les carrés de la grille conservent une taille constante (Figure 10).
REMARQUE : En raison de l’inclinaison du plan d’imagerie au niveau de l’échantillon, la grille peut sembler légèrement étirée dans le plan x.
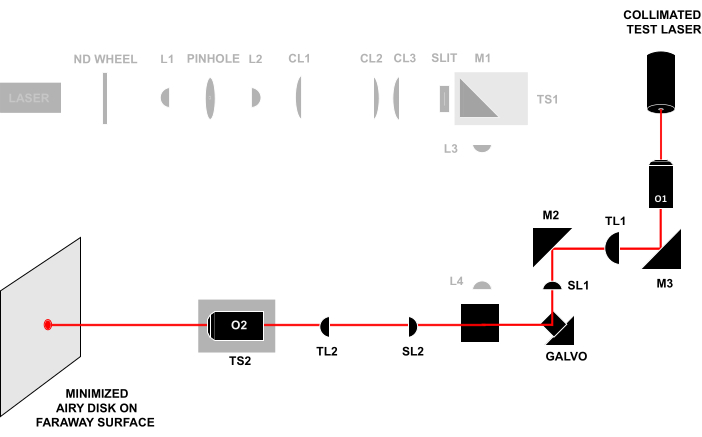
Figure 4 : Technique laser-in-laser-out. Envoi d’un faisceau d’essai collimaté à travers l’avant de O1 et observation du faisceau qui sort d’O2 sur une surface éloignée. Si tous les composants sont alignés à la bonne distance, le faisceau formera un petit disque d’Airy sur la surface lointaine. Toutes les abréviations sont les mêmes que dans la figure 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Utilisation de la lumière d’émission pour l’alignement. (A) Lumière d’émission d’une lame fluorescente acrylique sur une cible vissée derrière le BFP d’O2. (B) Détection de la lumière d’émission à vue à travers l’arrière de O3. Abréviations : O2-O3 = objectifs ; BFP = plan focal arrière. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Image sur la caméra du disque d’alignement en verre dépoli correctement mis au point. Le disque a été placé sur le plan intermédiaire entre SL2 et TL2. Barre d’échelle = 50 μm. Abréviations : SL2 = objectif de balayage ; TL2 = lentille tubulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Image de la caméra de l’échantillon de billes 3D. L’image montre des billes de 1 nm avec le module d’imagerie réglé à 0° et éclairé par un faisceau circulaire avant l’insertion des lentilles cylindriques. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Cible de test de grille positive correctement focalisée sur le plan intermédiaire entre SL2 et TL2. Les grilles plates sur l’ensemble du terrain indiquent un bon alignement des composants SL2 et antérieurs. Barre d’échelle = 30 μm. Abréviations : SL2 = objectif de balayage ; TL2 = lentille tubulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
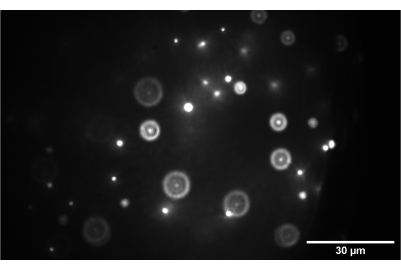
Figure 9 : Image de la caméra de l’échantillon de billes 3D. L’image montre des billes de 1 nm correctement focalisées sur le plan intermédiaire entre SL2 et TL2. Barre d’échelle = 30 μm. Abréviations : SL2 = objectif de balayage ; TL2 = lentille tubulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 10 : Cible de test de grille positive avec un carré jaune de taille constante superposé pour correspondre aux carrés de la grille. (A) Grille en point sur le côté gauche. (B) Grille en point sur le côté droit. Le carré jaune correspond à la taille des cases de grille des deux côtés du FoV. Barres d’échelle = 30 μm. Abréviation = FoV = champ de vision. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Alignement de la feuille de lumière oblique
- Retirez O1 et réinsérez la double cage d’alignement en verre dépoli à sa place. Vérifiez que le faisceau est collimaté et centré sur les deux disques en verre dépoli.
- Vissez l’objectif cylindrique 1 (CL1) dans une monture d’objectif rotative. Montez CL1 dans le chemin optique et faites pivoter la monture de manière à ce que le faisceau soit étendu dans la direction verticale de la table optique. Ajustez l’inclinaison et la position latérale du CL1 de manière à ce que le faisceau soit centré sur l’avant et maintienne une position centrée sur les deux disques en verre dépoli.
- Vissez l’objectif cylindrique 2 (CL2) dans une monture d’objectif rotative et montez CL2 dans le chemin optique à la bonne distance pour former un système 4f avec CL1. Faites pivoter CL2 dans la même orientation que CL1 afin que le faisceau soit étiré dans la direction verticale par rapport à la table optique et collimaté. Utilisez une carte de test pour mesurer la hauteur du profil de faisceau cylindrique à plusieurs endroits afin de vous assurer que le faisceau est collimaté. Ajustez l’inclinaison et la position latérale du CL2, comme indiqué à l’étape 4.2.
- Vissez l’objectif cylindrique 3 (CL3) dans une monture d’objectif rotative et montez CL3 dans le chemin optique à la bonne distance pour former un système 4f avec L3. Faites pivoter CL3 dans la même orientation que CL1 et CL2 afin que le faisceau soit focalisé vers le bas jusqu’à un profil de feuille horizontale au niveau du plan focal. Ajustez l’inclinaison et la position latérale du CL3, comme effectué à l’étape 4.2.
- Insérez la fente : À l’aide de quatre tiges de cage de 4 pouces et du support de cage CL3, montez la fente dans une orientation verticale au niveau du plan focal entre CL3 et L3, tel que mesuré avec une règle. Utilisez le profil du faisceau d’excitation étiré pour ajuster la hauteur et la position latérale de la fente jusqu’à ce qu’elle soit centrée sur le faisceau.
- Réinsérez O1, montez l’échantillon de test de colorant fluorescent et éclairez l’échantillon avec la feuille de lumière d’excitation. Au niveau du capteur de l’appareil photo, vérifiez que la feuille de lumière 0° apparaît sous la forme d’une fine feuille verticale (Figure 11A).
- Retirez l’échantillon de test de colorant fluorescent et essuyez O1. Laissez la feuille de lumière s’étendre au-dessus de O1 sans obstruction. À l’aide de la commande de la platine de translation motorisée, déplacez M1 vers les lentilles cylindriques pour régler l’angle de la feuille de lumière à environ 60° par rapport à l’axe optique de O1.
REMARQUE : Il est crucial que la feuille de lumière soit inclinée dans la bonne direction pour s’aligner avec le plan d’imagerie incliné de la même manière (Figure 12) ; Si un système est disposé différemment de cette conception spécifique, la direction correcte de l’inclinaison peut être déterminée grâce au lancer de rayons géométrique.
REMARQUE : Pour référence, la translation de M1 2,647 mm vers la fente règle la feuille d’éclairage sur l’inclinaison correcte dans cette configuration. - Réinsérez l’échantillon de test de colorant fluorescent pour imager la feuille inclinée. Assurez-vous que la feuille de lumière a conservé une forme de faisceau vertical sur la caméra, mais qu’elle est plus large et plus faible (Figure 11B).
- Traduisez l’échantillon axialement avec la platine de sorte que le colorant fluorescent soit éclairé par la feuille de lumière à cinq profondeurs différentes entre le centre du champ de vision et le côté droit de l’écran. Enregistrez chaque image.
- Ouvrez les images en Fidji. Pour chaque image, sélectionnez l’outil Ligne et tracez une ligne horizontale du centre du champ de vision au centre de la feuille de lumière. Pour mesurer le déplacement, accédez à Analyser | Mesurez pour voir la longueur des lignes. Ensuite, tracez le déplacement de la feuille de lumière en fonction de la profondeur de l’échantillon pour calculer l’angle de la feuille de lumière au-dessus de O1.
- Traduisez légèrement M1. Répétez les étapes 4.9 et 4.10 jusqu’à ce que l’angle de la feuille de lumière soit de 60° par rapport à l’axe optique de O1, correspondant à l’angle du plan d’imagerie.

Figure 11 : Images de caméra de l’échantillon d’essai de colorant fluorescent éclairé par une feuille de lumière de forme correcte. (A) La feuille à 90°, droite le long de l’axe optique de O1, et (B) inclinée à 30° (60° par rapport à l’axe optique de O1). Barres d’échelle = 50 μm. Abréviation : O1 = objectif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
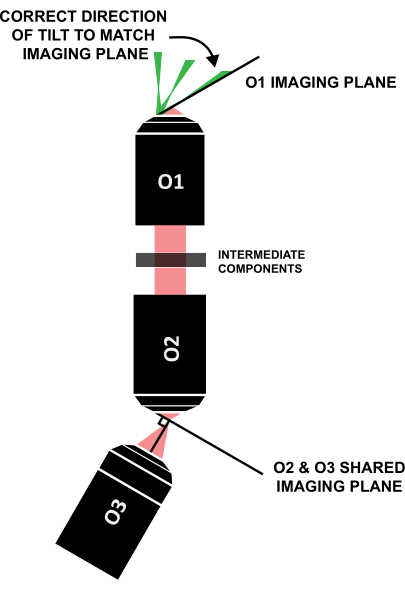
Figure 12 : Direction correcte de l’inclinaison de la feuille de lumière pour s’aligner sur le plan d’imagerie de O1. Abréviation : O1-O3 = objectifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Affiner le système pour l’imagerie et la collecte de données
- Montez la diapositive de perles 3D et transmettez l’échantillon axialement avec la platine jusqu’à ce que les perles remplissent le champ de vision de la caméra.
- Ajustez O3 à l’aide de l’étage xy et de l’étage de translation de la cage, dans le but de minimiser les aberrations et d’optimiser le rapport signal/bruit dans l’image (Figure 13).
- Ajustez le collier de correction de O1, dans le but de minimiser les aberrations et d’optimiser le rapport signal/bruit dans l’image.
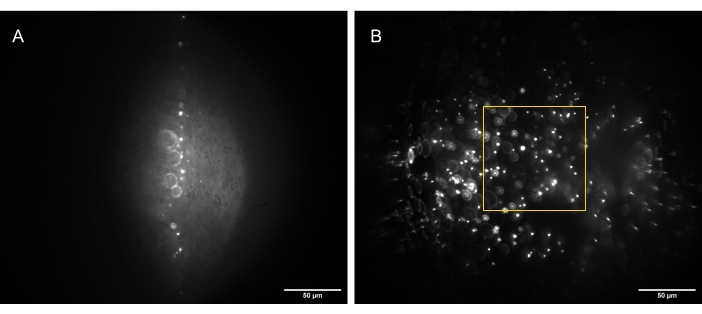
Figure 13 : Images de la caméra de l’échantillon de billes 3D (billes de 1 μm) éclairées par une feuille de lumière de forme correcte. (A) Feuille à 90°, droite vers le haut le long de l’axe optique de O1, et (B) inclinée à 30° par rapport à l’axe optique de O1. La case jaune indique la partie du champ de vision qui est plate, cohérente et utilisable (80 μm x 80 μm) et dans laquelle des données fiables peuvent être saisies. Barres d’échelle = 50 μm. Abréviations : O1 = objectif ; FoV = champ de vision. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Calibrer le grossissement du système
- Montez la cible de test de grille positive sur la platine d’échantillon et éclairez-la avec la lumière en fond clair.
- Déplacez la diapositive de la grille axialement avec la platine pour mettre la grille au point. Mettez au point le centre de la grille.
- Capturez et enregistrez l’image, puis ouvrez-la aux Fidji.
- Utilisez l’outil Ligne et la fonction Mesurer dans Fidji pour mesurer avec précision la distance entre deux lignes de grille en pixels. Divisez cette valeur par la distance connue (10 μm), pour déterminer l’étalonnage pixel par micron.
- Calculer le grossissement (M) du système en utilisant la taille mesurée du pixel et la taille connue d’un pixel avec l’équation (1).
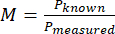 (1)
(1)
7. Acquisition de scans volumétriques
- Positionnez l’échantillon.
- Allumez l’aperçu de la caméra, le galvo, le générateur de fonctions, l’alimentation, la platine et le laser d’excitation.
- Montez l’échantillon, puis cliquez sur le bouton FSK du générateur de fonctions pour définir une onde triangulaire. Pour trouver l’échantillon, utilisez le générateur de fonctions pour définir les éléments suivants : amplitude crête à crête de 400 mV (à l’aide de la touche Ampl.), décalage de 0 (à l’aide de la touche Offset ) et fréquence de 200 mHz. Utilisez la fenêtre Micromanager pour définir un temps d’exposition de 100 ms.
- Faites défiler z manuellement jusqu’à ce que le plan d’échantillonnage soit atteint. Optimisez le réglage z afin que la région souhaitée pour le balayage volumétrique traverse l’écran pendant un cycle.
- Sélectionnez les paramètres de numérisation.
- Assurez-vous que l’amplitude crête à crête est correctement définie en vérifiant visuellement que l’aperçu semble être net pendant toute la durée de l’analyse. Si la qualité de l’image se dégrade plus tôt à l’approche d’une extrémité du balayage que de l’autre, modifiez le décalage sur le générateur de fonctions pour déplacer le centre du balayage vers la meilleure région.
- Dans le programme Micromanager, sélectionnez un temps d’exposition et cliquez sur Acquisition multidimensionnelle pour ouvrir la fenêtre Acquisition multidimensionnelle. Utilisez la zone Nombre pour choisir le nombre d’images, ce qui définira le temps total d’acquisition. L’intervalle entre les images (fréquence d’images) sera défini par le temps d’exposition, sauf si un intervalle plus long est spécifié dans la zone Intervalle. Sur le générateur de fonctions, réglez la fréquence pour créer un balayage de volume complet par la moitié de la période de la fonction d’onde triangulaire (balayage linéaire dans une direction).
REMARQUE : Si la fréquence d’images et la fréquence sont trop faibles, trop peu d’images seront acquises pour un balayage de volume, et le nombre d’images faible créera des artefacts visibles lors du post-traitement. À titre de référence, la figure 13 était composée de ~100 images dans le scan, et la figure 14 était composée de ~800. Il est également essentiel de prendre en compte l’échantillon lui-même lors de la sélection des paramètres. Assurez-vous que le temps d’exposition est réglé de manière à ce que l’échantillon soit suffisamment excité mais pas saturé. L’intensité du laser d’excitation peut également être ajustée à cette fin. Si l’utilisateur acquiert une série de balayages volumétriques pour caractériser un processus variant dans le temps en 3D, assurez-vous que l’échelle de temps de balayage dépasse la dynamique de l’échelle de temps du système.
- Collecte de vidéos : Acquérir un time-lapse qui capture au moins la durée d’une montée ou d’une descente complète de l’onde triangulaire, correspondant à un balayage complet du volume.
8. Procédures de post-traitement
- Redressement des piles d’images volumétriques
- Redressez les balayages de volume pour convertir la pile d’images dans des plans inclinés en une série d’images en coordonnées xyz réelles.
REMARQUE : Il existe de nombreux excellents guides sur le post-traitement des images en feuille de lumière et les logiciels open source pour effectuer le redressement des scans de volume existants, ainsi que pour effectuer le redressement et enregistrer les images redressées pendant l’acquisition24. - Pour redresser les balayages volumiques, on obtient les deux paramètres suivants : la distance réelle entre deux images en pixels (d), et l’angle entre le plan de l’image et le plan x-y (θ est défini par l’angle de la feuille de lumière oblique (dans ce système, 30°). La distance entre les images dépendra de l’optique d’imagerie et des paramètres d’acquisition.
- Redressez les balayages de volume pour convertir la pile d’images dans des plans inclinés en une série d’images en coordonnées xyz réelles.
- Détermination du paramètre d
- Calibrez la distance entre les cadres pour chaque fois que le système est considérablement réaligné. Effectuez ce calibrage avec une pile d’images de billes fluorescentes, car elles sont les plus faciles à utiliser pour diagnostiquer les problèmes.
- Acquérir une pile d’images et exécuter le code de redressement en utilisant n’importe quelle estimation initiale pour le paramètre d . Ouvrez la pile d’images redressée dans ImageJ et faites défiler la pile. Si d a été défini de manière substantiellement éloignée de sa valeur réelle, observez que les perles apparaîtront artificiellement allongées en x ou y, et que les perles individuelles sembleront se déplacer dans le plan xy lorsque l’utilisateur fera défiler les images en z (plutôt que de faire la mise au point et de la défocalisation à partir du même point central). Itérez plusieurs fois sur le paramètre d jusqu’à ce que ces problèmes ne soient plus apparents.
- Une fois que le paramètre d semble être raisonnablement proche de la valeur réelle, calculez les projections d’intensité maximale de la pile d’images le long des directions x et y. Notez que les billes d’un diamètre proche de la limite de diffraction peuvent apparaître allongées en z, mais elles ne doivent idéalement pas apparaître coniques ou allongées en diagonale. Affinez les paramètres de redressement jusqu’à ce que ces critères ne s’améliorent pas considérablement avec de nouvelles itérations. À titre de référence, les données présentées dans la figure 13 ont été redressées à d = 2,50 pixels, et les données de la figure 14 ont été redressées à d = 1,0 pixels.
REMARQUE : La distance entre les images dépend linéairement de l’amplitude, de la fréquence et de la fréquence d’images du balayage.
Résultats
Nous avons effectué des scans volumétriques de billes de 1 μm incrustées dans de la gomme gellane. La figure 14 montre les projections d’intensité maximale des balayages volumétriques redressés le long des directions x, y et z.

Figure 14 : Imagerie volumétrique de billes fluorescentes de 1 μm dans de la gomme gellane. Les projections d’intensité maximale des balayages volumétriques redressés sont montrées. Barres d’échelle = 30 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Nous avons démontré l’utilisation du microscope à feuillet de lumière à objectif unique pour caractériser les réseaux de cytosquelettes reconstitués en effectuant des balayages volumétriques d’échantillons d’asters microtubulaires. En bref, des microtubules marqués à la rhodamine et stabilisés au taxol ont été polymérisés à partir de dimères reconstitués par GTP ; puis, après polymérisation, des grappes de moteurs kinésines à base de streptavidine ont été mélangées à des échantillons avec de l’ATP pour des concentrations finales de microtubules de 6 μM, de dimères de kinésine de 0,5 μM et d’ATP de 10 mM. Des protocoles et des guides complets pour la préparation de microtubules stabilisés au taxol et de groupes moteurs de kinésine sont disponibles sur les sites Web du laboratoire Mitchson et du laboratoire Dogic25,26. Les échantillons ont été pipetés doucement dans des lames de microscope, scellés et laissés reposer pendant 8 heures avant l’imagerie pour permettre à l’activité motrice de cesser afin que les échantillons atteignent un état structurel stable qui ressemble à des asters.
Les études sur les systèmes de cytosquelettes reconstitués utilisent le plus souvent la microscopie confocale ou l’épifluorescence pour imager les filaments marqués. Cependant, ces deux techniques sont limitées dans leur capacité à imager des échantillons 3D denses27. Alors que de nombreux progrès ont été réalisés dans la recherche in vitro sur la matière active basée sur le cytosquelette en contraignant les échantillons à être quasi2D 28,29, les réseaux de cytosquelettes sont intrinsèquement 3D, et de nombreux efforts actuels consistent à comprendre les effets qui ne peuvent survenir que dans les échantillons 3D29,30, créant ainsi un besoin d’imagerie 3D haute résolution.
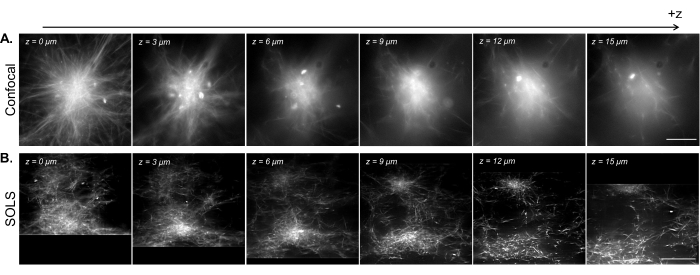
Figure 15 : Facilitation de la visualisation 3D d’échantillons de cytosquelette reconstitués par microscopie à feuillet de lumière à objectif unique. (A) Images d’asters microtubules fluorescents acquises sur un microscope confocal à balayage laser Leica DMi8. Les images montrent différents plans d’un z-scan. Barre d’échelle = 30 μm. (B) Images redressées déconvoluées d’un balayage volumétrique effectué sur la configuration de la feuille de lumière à objectif unique du même échantillon. Barre d’échelle = 30 μm. La zone d’image redressée correspond ici au champ de vision utilisable (boîte jaune) illustré à la figure 13B. Alors que le confocal excelle dans l’imagerie de plans uniques près de la lamelle, la densité de l’échantillon fluorescent introduit des complications lors de l’imagerie à des plans plus élevés en raison du signal supplémentaire provenant du dessous du plan d’imagerie. La feuille de lumière contourne ce problème en éclairant uniquement le plan d’imagerie, permettant ainsi une imagerie uniformément nette à différents plans en z. Abréviations : SOLS = feuille de lumière à objectif unique ; FoV = champ de vision. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dans la figure 15, nous démontrons l’imagerie volumétrique d’un réseau de microtubules reconstitués contractés en structures de type aster par des clusters moteurs de kinésine. Comme l’ont montré des recherches antérieures28,31, ces structures 3D ont tendance à se densifier vers le centre, ce qui donne des régions de fluorescence brillantes qui sont prédominantes dans le signal. Dans les plans d’imagerie près de la lamelle (faible niveau z), la microscopie confocale (Figure 15A) peut résoudre des filaments uniques autour de la périphérie de l’aster, avec un bruit de fond supplémentaire vers le centre en raison de signaux de fluorescence flous provenant d’en haut. Cependant, le déplacement de quelques microns en z réduit rapidement la qualité des images en raison de la prédominance des sections denses floues de l’aster dans le signal dans le plan d’imagerie. L’éclairage à plan unique de la feuille de lumière (figure 15B) élimine les signaux flous des parties denses de l’aster au-dessus et au-dessous du plan d’imagerie, permettant ainsi une qualité d’image comparable entre les plans. La capacité de la feuille de lumière à produire des données de balayage volumétrique fiables et de haute qualité ouvre la possibilité de visualiser et de caractériser des phénomènes 3D dans des systèmes de cytosquelettes reconstitués.
Discussion
Deux détails importants concernant ce protocole sont le coût global du système et le temps de construction et d’alignement prévu. Bien que le coût exact soit variable, nous pouvons facilement estimer que le coût total de ce SOLS ou d’un système de bricolage similaire serait de l’ordre de 85 000 USD. Nous notons que cette estimation tient compte du prix de détail de tous les composants, de sorte que ce prix global peut être considérablement réduit en s’approvisionnant en composants usagés. En termes de temps de construction, il serait raisonnable de s’attendre à ce qu’un utilisateur ayant peu d’expérience en optique construise et aligne l’ensemble de ce système SOLS dans un délai de 1 à 2 mois, à condition que tous les composants soient disponibles et prêts. Malgré la longueur et la complexité du protocole, nous pensons que la quantité de détails dans le manuscrit écrit, associée au protocole vidéo, devrait rendre ce protocole simple et rapide à suivre.
Il y a deux étapes critiques dans ce protocole. Tout d’abord, l’emplacement du galvo détermine l’emplacement de nombreuses lentilles car il fait partie de trois paires de lentilles 4f distinctes. Il est crucial que le galvo soit à la fois conjugué avec les plans focaux arrière de O1 et O2 et centré correctement pour assurer un balayage invariant en inclinaison. Deuxièmement, la qualité de l’image est extrêmement sensible à l’alignement de O2 et O3 l’un par rapport à l’autre. Ici, il faut veiller à ce que, d’abord, l’angle d’alignement de O3 à O2 corresponde à l’inclinaison de la feuille de lumière d’excitation, fournissant ainsi un éclairage maximum plat sur le champ de vision incliné de la même manière. Deuxièmement, O3 doit être placé à la bonne distance axiale pour maintenir un champ de vision plat avec une surface aussi grande que possible. Troisièmement, O3 doit être placé à la bonne distance latérale de O2 pour maximiser le signal qui passe par l’interface O2-O3.
En termes de champ de vision utilisable, ce système a permis d’obtenir un champ plat et fiable avec un éclairage constant sur une zone de 80 μm x 80 μm. Cette zone est plus petite que le champ de vision maximal fourni par la caméra, de sorte que le champ de vision utilisable est indiqué par la case jaune de la figure 13. En termes de pouvoir de résolution, ce système a atteint une distance minimale résolvable de 432 nm le long de l’axe des x et de 421 nm le long de l’axe des y, qui a été mesurée en trouvant les sigma x et y moyens des ajustements gaussiens aux fonctions d’étalement ponctuel (PSF) dans le bon FoV et en multipliant par deux. Nous notons que ce système n’a pas été optimisé en termes de NA total, ce qui signifie qu’il y a place à une amélioration significative si les utilisateurs souhaitent un pouvoir de résolution supérieur à ce que ce système a atteint. Il existe une multitude d’options d’objectifs compatibles pour ce type de construction SOLS, dont beaucoup contribueraient à une résolution système plus élevée, mais avec les inconvénients d’un coût plus élevé, d’un champ de vision plus petit ou de techniques d’alignement plus compliquées à l’interface de relais 8,11,13,20. Par ailleurs, si les utilisateurs souhaitent un champ de vision plus grand, l’incorporation d’un deuxième galvo pour permettre la numérisation 2D permettrait d’atteindre cet objectif, mais nécessiterait l’intégration d’optiques et de mécanismes de contrôle supplémentaires dans la conception32. Nous avons fourni plus de détails concernant les modifications apportées au système sur la page de notre site Web, ainsi que des liens vers d’autres ressources utiles concernant le processus de conception23.
Au-delà de l’amélioration des composants spécifiques pour cette conception particulière, il serait tout à fait possible d’ajouter d’autres techniques ou modalités de microscopie à haute résolution à cette construction. L’une de ces améliorations consisterait à incorporer un éclairage multi-longueurs d’onde, ce qui impliquerait d’aligner des lasers d’excitation supplémentaires sur le chemin d’excitation d’origine8. De plus, comme ce type de conception SOLS laisse l’échantillon accessible, l’ajout de fonctions supplémentaires au microscope, y compris, mais sans s’y limiter, la pince optique, la microfluidique et la rhéométrie, est relativement simple 2,33.
Comparé à la myriade de guides de feuilles de lumière qui ont été publiés, ce protocole fournit des instructions à un niveau de compréhension qu’un utilisateur sans expérience significative de l’optique peut trouver utile. En rendant accessible à un public plus large une construction SOLS conviviale avec des capacités traditionnelles de montage de lames d’échantillons, nous espérons permettre une expansion encore plus importante des applications de la recherche basée sur SOLS dans tous les domaines dans lesquels l’instrument a été ou pourrait être utilisé. Même si les applications des instruments SOLS augmentent rapidement dans les numéros2, 34 et 35, nous pensons que de nombreux avantages et utilisations des instruments de type SOL restent encore inexplorés et exprimons notre enthousiasme quant aux possibilités de ce type d’instrument à l’avenir.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer. Toutes les recherches ont été menées en l’absence de relations commerciales ou financières qui pourraient être interprétées comme un conflit d’intérêts.
Remerciements
Ce travail a été soutenu par le prix RUI de la National Science Foundation (NSF) (DMR-2203791) à J.S. Nous sommes reconnaissants des conseils fournis par le Dr Bin Yang et le Dr Manish Kumar pendant le processus d’alignement. Nous remercions le Dr Jenny Ross et K. Alice Lindsay pour les instructions de préparation des moteurs à kinésine.
matériels
| Name | Company | Catalog Number | Comments |
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 | |
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25x36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer - 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free | |
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free | |
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A | |
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free | |
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free | |
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 | ||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
Références
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002(2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834(2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681(2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, F1000 Faculty Rev-998 (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441(2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss. , Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023).
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss. , Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023).
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Sheung Lab, Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab. , Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023).
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- Harvard University. Mitchison Lab. , Available from: https://mitchison.hms.harvard.edu/home (2023).
- Research at Dogic Lab. , Available from: http://dogiclab.physics.ucsb.edu/research/ (2023).
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119(2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002(2016).
- Millett-Sikking, A., et al. High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969(2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon