A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תגובת שרשרת פולימראז והכלאה של כתם נקודה לזיהוי לפטוספירה בדגימות מים
In This Article
Summary
במחקר זה, יישום כתם נקודה תוכנן לזהות לפטוספירה משלושת הקלאדים העיקריים בדגימות מים. שיטה זו מאפשרת זיהוי של כמויות DNA מינימליות הממוקדות באופן ספציפי על ידי בדיקה המסומנת בדיגוקסיגנין, המזוהה בקלות על ידי נוגדן אנטי דיגוקסיגנין. גישה זו היא כלי רב ערך ומספק למטרות מיון.
Abstract
כתם הנקודות הוא טכניקה פשוטה, מהירה, רגישה ורב-תכליתית המאפשרת זיהוי כמויות מינימליות של DNA הממוקדות ספציפית על ידי הכלאת בדיקה בנוכחות DNA נשא. הוא מבוסס על העברת כמות ידועה של DNA לתמיכה מוצקה אינרטית, כגון קרום ניילון, תוך שימוש במנגנון כתם הנקודה וללא הפרדה אלקטרופורטית. לקרומי ניילון יש יתרון של יכולת קשירה גבוהה של חומצות גרעין (400 מיקרוגרם לסמ"ק2), חוזק גבוה, והם טעונים חיובית או ניטרלית. הגשושית המשמשת היא מקטע ssDNA ספציפי ביותר של 18 עד 20 בסיסים ארוכים המסומנים בדיגוקסיגנין (DIG). הגשושית תצומד לדנ"א של לפטוספירה (Leptospira ). לאחר שהגשושית ביצעה הכלאה עם דנ"א המטרה, היא מזוהה על ידי נוגדן אנטי-דיגוקסיגנין, המאפשר את זיהויו בקלות באמצעות פליטותיו המתגלות בסרט רנטגן. הנקודות עם הפליטה יתאימו למקטעי הדנ"א המעניינים. שיטה זו משתמשת בתיוג לא איזוטופי של הבדיקה, אשר עשוי להיות זמן מחצית חיים ארוך מאוד. החיסרון של תווית חיסונית סטנדרטית זו הוא רגישות נמוכה יותר מאשר בדיקות איזוטופיות. עם זאת, היא מתמתנת על ידי צימוד תגובת שרשרת פולימראז (PCR) ומבחני כתם נקודה. גישה זו מאפשרת העשרת רצף המטרה ואיתורו. בנוסף, ניתן להשתמש בו כיישום כמותי בהשוואה לדילול סדרתי של תקן ידוע. יישום נקודתי לזיהוי לפטוספירה משלושת הקלאדים העיקריים בדגימות מים מוצג כאן. מתודולוגיה זו יכולה להיות מיושמת על כמויות גדולות של מים לאחר שהם רוכזו על ידי צנטריפוגה כדי לספק ראיות לנוכחות של DNA לפטוספירלי. זהו כלי בעל ערך ומספק למטרות סינון כלליות, וניתן להשתמש בו עבור חיידקים אחרים שאינם ניתנים לגידול שעשויים להימצא במים, ובכך לשפר את הבנת המערכת האקולוגית.
Introduction
לפטוספירוזיס בבני אדם מקורו בעיקר במקורות סביבתיים 1,2. נוכחותה של לפטוספירה באגמים, נהרות ונחלים היא אינדיקטור להעברת לפטוספירוזיס בקרב חיות בר, וחיות בית וייצור שעלולות בסופו של דבר לבוא במגע עם גופי מים אלה 1,3,4. יתר על כן, לפטוספירה זוהתה במקורות לא טבעיים, כולל ביוב, עומדים ומי ברז 5,6.
לפטוספירה הוא חיידקמופץ ברחבי העולם 7,8, ותפקיד הסביבה בשימורו ובהעברתו מוכר היטב. לפטוספירה יכולה לשרוד במי שתייה תחת pH משתנה ומינרלים9, ובמקווי מים טבעיים1. הוא יכול לשרוד גם תקופות ארוכות במים מזוקקים10, ותחת pH קבוע (7.8), הוא עשוי לשרוד עד 152 ימים11. יתר על כן, לפטוספירה עשויה לקיים אינטראקציה בקונסורציום חיידקים כדי לשרוד בתנאים קשים12,13. זה עשוי להיות חלק biofilms במים מתוקים עם Azospirillum ו Sphingomonas והוא אפילו מסוגל לגדול ולסבול טמפרטורות מעל 49 °C (75 °F)14,15. הוא יכול גם להתרבות בקרקע ספוגה במים ולהישאר בר קיימא עד 379 ימים16, תוך שמירה על יכולתו לגרום למחלה למשך שנה17,18. עם זאת, מעט ידוע על האקולוגיה בתוך גופי מים וכיצד היא מופצת בתוכם.
מאז גילויו, המחקר של הסוג Leptospira התבסס על בדיקות סרולוגיות. זה לא היה עד המאה הנוכחית כי טכניקות מולקולריות הפך נפוץ יותר במחקר של spirochaete זה. כתם הנקודה כמעט ולא שימש לזיהויו באמצעות (1) בדיקה איזוטופית המבוססת על rRNA 16S ועל רצף בין-פשוט חוזר (ISSR)19,20, (2) כבדיקה חיסונית מבוססת ננו-זהב עבור לפטוספירוזיס אנושי המיושמת על שתן21, או (3) כבדיקה מבוססת נוגדנים לדגימות שתן של בקר22. הטכניקה יצאה מכלל שימוש מכיוון שהתבססה במקור על בדיקות איזוטופיות. עם זאת, זוהי טכניקה ידועה, יחד עם PCR, מניב תוצאות משופרות, וזה נחשב בטוח בשל השימוש של בדיקות לא איזוטופיות. PCR ממלא תפקיד מכריע בהעשרת ה- DNA של לפטוספירה על ידי הגברת מקטע DNA ספציפי שעשוי להימצא בכמויות זעירות בדגימה. במהלך כל מחזור PCR, כמות מקטע הדנ"א הממוקד מוכפלת בתגובה. בסוף התגובה, האמפליקון הוכפל פי יותר ממיליון23. המוצר המוגבר על ידי PCR, לעתים קרובות לא נראה באלקטרופורזה אגרוז, הופך גלוי באמצעות הכלאה ספציפית עם בדיקה מסומנת DIG בכתם נקודה 24,25,26.
טכניקת כתם הנקודה פשוטה, חזקה ומתאימה לדגימות רבות, מה שהופך אותה לנגישה למעבדות עם משאבים מוגבלים. הוא שימש במגוון מחקרי חיידקים, כולל (1) חיידקים אוראליים27, (2) סוגי דגימות אחרים כגון מזון וצואה28, ו-(3) זיהוי חיידקים בלתי ניתנים לגידול29, לעתים קרובות בהסכמה עם טכניקות מולקולריות אחרות. בין היתרונות המוצעים על ידי טכניקת dot-blot הם: (1) לממברנה יכולת קשירה גבוהה, המסוגלת לקשור מעל 200 מיקרוגרם / ס"מ2 של חומצות גרעין ועד 400 מיקרוגרם / ס"מ2; (2) תוצאות כתם נקודה ניתנות לפירוש חזותי ללא צורך בציוד מיוחד, ו-(3) ניתן לאחסן אותן בנוחות במשך שנים בטמפרטורת החדר (RT).
הסוג Leptospira סווג לקלאדים פתוגניים, בינוניים וספרופיטיים30,31. ההבחנה בין קלאדים אלה יכולה להיות מושגת על בסיס גנים ספציפיים כגון lipL41, lipL32, ואת 16S rRNA. LipL32 קיים בקלאדיות הפתוגניות ומפגין רגישות גבוהה בכלים סרולוגיים ומולקולריים שונים, בעוד שהוא נעדר במיני ספרופיטים21. הגן lipL41 ידוע בביטוי היציב שלו ומשמש בטכניקות מולקולריות32, בעוד הגן 16S rRNA מנוצל לסיווגם.
מתודולוגיה זו יכולה להיות מיושמת על כמויות גדולות של מים לאחר שהם רוכזו על ידי צנטריפוגה. הוא מאפשר להעריך נקודות ועומקים שונים בתוך גוף המים כדי לזהות את נוכחותו של DNA לפטוספירלי ואת הקלאדה שאליה הוא שייך. כלי זה הוא בעל ערך הן למטרות אקולוגיות והן למטרות סינון כלליות וניתן להשתמש בו גם כדי לזהות חיידקים אחרים שאינם ניתנים להתרבות שעשויים להימצא במים.
בנוסף, בדיקות PCR ו-dot-blot משתלמות מבחינה טכנית וכלכלית למגוון רחב של מעבדות, גם כאלה שאין להן ציוד מתוחכם או יקר. מחקר זה נועד ליישם את כתם הנקודות המבוסס על דיגוקסיגנין לזיהוי שלושת קלאדי הלפטוספירה בדגימות מים שנאספו מגופי מים טבעיים.
זני חיידקים
במחקר זה נכללו שנים עשר סרוברים של לפטוספירה (Autumnalis, Bataviae, Bratislava, Canicola, Celledoni, Grippothyphosa, Hardjoprajitno, Icterohaemorrhagiae, Pomona, Pyrogenes, Tarassovi ו-Wolffi). סרוברים אלה הם חלק מהאוסף במחלקה למיקרוביולוגיה ואימונולוגיה, הפקולטה לרפואה וטרינרית וזואוטכניקה, האוניברסיטה הלאומית האוטונומית של מקסיקו, והם משמשים כיום במבחן microagglutination (MAT).
כל הסרוברים של לפטוספירה גודלו בתרבית EMJH, והדנ"א שלהם הופק באמצעות ערכת מיצוי DNA מסחרית (ראו טבלת חומרים). תערובת DNA גנומית של שנים-עשר הסרוברים שימשה כבקרה חיובית עבור הקלאדה הפתוגנית של לפטוספירה (Leptospira ). כבקרה חיובית של Leptospira intermediate clade, נכלל DNA גנומי מזן Leptospira fainei serovar Hurstbridge BUT6, וכבקרה חיובית עבור Leptospira saprophyte clade, נכלל גם DNA גנומי של זן Leptospira biflexa serovar Patoc Patoc I.
הבקרות השליליות כללו פלסמיד ריק, DNA מחיידקים שאינם קשורים זה לזה (Ureaplasma urealyticum, Staphylococcus aureus, Brucella abortus, Salmonella typhimurium, Shigella boydii, Klebsiella pneumoniae, Acinetobacter baumannii ו-Escherichia coli), ומים בדרגת PCR, ששימשו כבקרה שאינה תבנית.
דגימות מים
שתים עשרה דגימות ניסוי נאספו בשיטת דגימה מרובדת-אקראית ממרכז המחקר הביולוגי והחקלאות הימית Cuemanco (CIBAC) (19° 16' 54" N 99° 6' 11" W). הדגימות האלה התקבלו בשלושה עומקים: שטחי, 10 ו-30 ס"מ (איור 1A, B). נהלי איסוף המים לא השפיעו על אף מין בסכנת הכחדה או מוגן. כל דגימה נאספה בצינור מיקרוצנטריפוגה סטרילי של 15 מ"ל. כדי לאסוף את הדגימה, כל צינור היה שקוע בעדינות במים, מלא בעומק שנבחר, ולאחר מכן נאטם. הדגימות נשמרו בטמפרטורה של 22 מעלות צלזיוס והועברו מייד למעבדה לעיבוד.
כל דגימה רוכזה על ידי צנטריפוגה בצינורות מיקרוצנטריפוגות סטריליים של 1.5 מ"ל ב 8000 x גרם במשך 20 דקות בטמפרטורת החדר. השלב הזה חזר על עצמו עד שכל הדגימות רוכזו בצינור אחד, ששימש לאחר מכן למיצוי דנ"א (איור 1C).
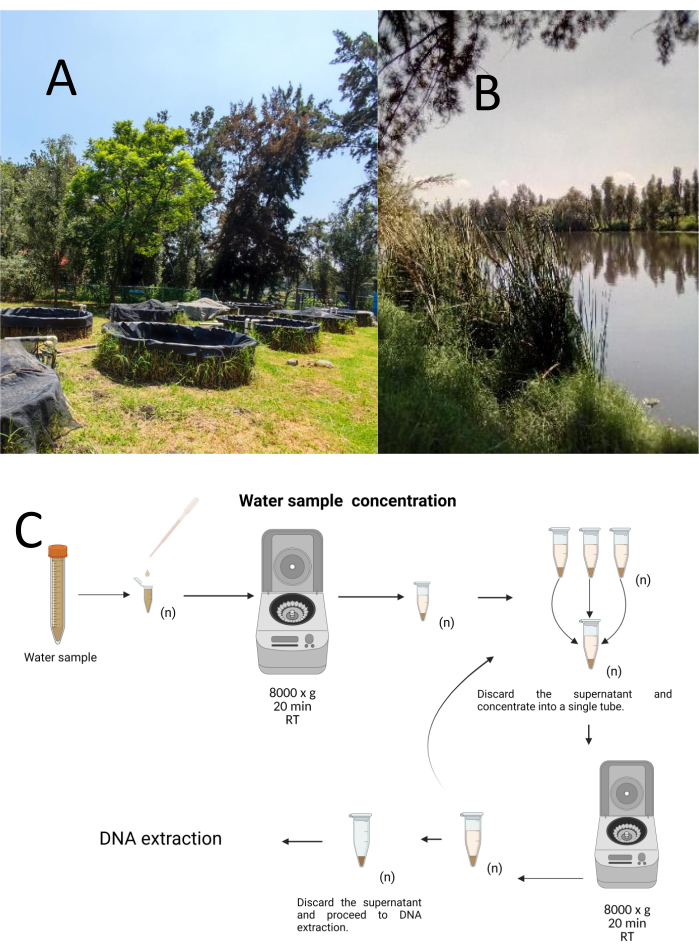
איור 1: ריכוז דגימות מים באמצעות צנטריפוגה. (A) בריכות דיגום מים, ו-(B) נחלים טבעיים. (C) עיבוד דגימות מים מבוססות צנטריפוגה בשלבים חוזרים ונשנים כמה פעמים לפי הצורך (n). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
מיצוי DNA
סה"כ DNA בודד באמצעות ערכת DNA גנומית מסחרית בהתאם להוראות היצרן (ראה טבלת חומרים). מיצויי DNA נמהלו ב-20 μL של חיץ אלוציה, וריכוז הדנ"א נקבע על ידי ספקטרופוטומטר UV ב-260-280 ננומטר, ואוחסן ב-4 מעלות צלזיוס עד לשימוש.
הגברה PCR
מטרות ה-PCR היו הגנים 16S rRNA, lipL41 ו-lipL32, המזהים DNA מהסוג Leptospira ומאפשרים הבחנה בין שלושת הקלאדים: פתוגני, ספרופיטי וביניים. הן הפריימרים והן עיצובי הגשושית התבססו על עבודותיהם הקודמות של אחמד ואחרים, אזאלי ואחרים, בורהי ואחרים, וייס ואחרים וברנגר ואחרים 33,34,35,36,37. הרצף של כל בדיקה, פריימר ומקטע מוגבר מתוארים בטבלה 1, ויישורם עם רצפי הייחוס מופיע בקובץ משלים 1, קובץ משלים 2, קובץ משלים 3, קובץ משלים 4 וקובץ משלים 5. ריאגנטים PCR ותנאי thermocycling מתוארים בסעיף פרוטוקול.
מוצרי הגברה הודגמו על-ידי הפרדה אלקטרופורטית על ג'ל אגרוז 1% ב-TAE (בסיס טריס של 40 מילימטר, חומצה אצטית של 20 מילימטר ו-1 מילימטר EDTA; pH 8.3), במתח של 60 וולט למשך 45 דקות עם זיהוי אתידיום-ברומיד, כפי שמוצג באיור משלים 1. דנ"א גנומי שהתקבל מכל סרובר שימש בריכוזים הנעים בין 6 x 106 ל 1 x 104 עותקים גנומיים שווי ערך (GEq) בכל תגובת PCR, בהתבסס על גודל הגנום של L. interrogans (4, 691, 184 bp)38 עבור לפטוספירה פתוגנית, גודל הגנום של L. biflexa (3, 956, 088 bp)39 עבור לפטוספירה ספרופיטית, וגודל הגנום של זן L. fainei serovar Hurstbridge BUT6 (4, 267, 324 bp) עם מספר הצטרפות AKWZ00000000.2.
רגישות הגשושיות הוערכה באמצעות DNA מכל סרובר פתוגני, זן L. biflexa serovar Patoc Patoc I וזן L. fainei serovar Hurstbridge BUT6 בכל ניסוי. כדי להעריך את הספציפיות של בדיקת PCR והכלאת כתם נקודה, נכלל DNA מחיידקים שאינם קשורים.
טבלה 1: פריימרים ובדיקות PCR להגברת מוצרים לזיהוי קלאדים פתוגניים, ספרופיטים ובינוניים של לפטוספירה. אנא לחץ כאן כדי להוריד טבלה זו.
בדיקת הכלאה של כתם נקודה
הטכניקה נקראת dot-blot מכיוון שלחורים שבהם דגימת הדנ"א ממוקמת יש צורת נקודה, וכאשר הם נשאבים כדי להתקבע במקומם על ידי שאיבת ואקום, הם מקבלים צורה זו. טכניקה זו פותחה על ידי Kafatos et al.40. הטכניקה מאפשרת כימות למחצה של לפטוספירה בכל דגימה חיובית ל-PCR. הפרוטוקול מורכב מדנטורציה עם NaOH 0.4 M בטמפרטורת החדר, דגימות עם DNA של לפטוספירה מ 30 ng עד 0.05 ng, המתאים 6 x 106 ל 1 x 104 leptospires, מוכתמים על קרום ניילון עם מנגנון 96 באר נקודה כתם. לאחר אימוביליזציה, הדנ"א נקשר לממברנה על ידי חשיפה לאור UV של 120 mJ. כל בדיקת DNA מצומדת עם digoxigenin-11 dUTP על ידי שלב קטליזה transferase מסוף בקצה 3' (Digoxigenin הוא סטרואיד צמחי המתקבל מ Digitalis purpurea, המשמש ככתב41). לאחר ההכלאה המחמירה של בדיקת הדנ"א המסומנת (50 pmol) בטמפרטורה הספציפית על גבי דנ"א המטרה, הכלאות הדנ"א מודגמות על ידי תגובת הכימילומינסנציה עם נוגדן האנטי-דיגוקסיגנין אלקליין פוספטאז מצומד באופן קוולנטי עם המצע CSPD שלו. ההארה נלכדת על-ידי חשיפה לסרט רנטגן (איור 2).
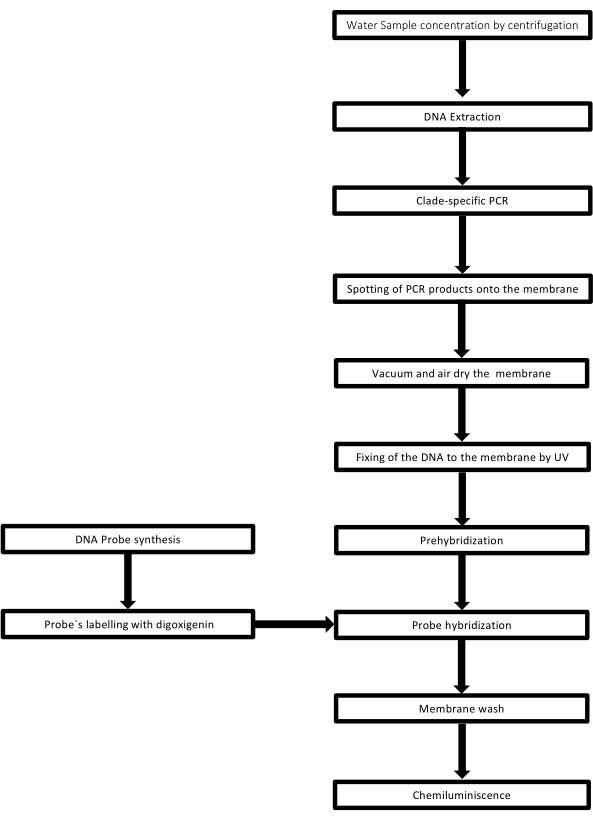
איור 2: שלבי ההליך עבור בדיקת PCR-dot-blot. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
1. הכנת מדגם
- רכז כל דגימת מים בצינורות מיקרוצנטריפוגות של 1.5 מ"ל באמצעות צנטריפוגה ב 8,000 x גרם למשך 10 דקות ב -4 ° C. חזור על שלב זה, כמה פעמים שנדרש, כדי לרכז את הדגימה לנפח של 250 μL.
- השתמש בערכת מיצוי ה- DNA בהתאם להוראות היצרן (ראה טבלת חומרים).
- בצע את ה- PCR הספציפי בהתאם לבדיקת כתם הנקודה שתשמש (טבלה 1).
- בצע את ההגברה בצינורות PCR עם נפח סופי של 25 μL המכיל 1 X חיץ, 2.5 יחידות של Taq פולימראז, 1 מיקרומטר של כל פריימר, 0.2 מילימטר של כל dNTP, 1.5 mM MgCl2, ו 100 ng של DNA המטרה מכל דגימת מים או DNA גנומי ייחוס.
- תכנת את תגובת ה-PCR בתרמוסייקלר בהתאם לתנאי התרמו-מחזור (טבלה 2).
- אחסנו את התגובות בטמפרטורה של 4°C עד לשימוש.
- מניחים 10 μL של כל מוצר PCR כדי להיות מוכתמים בבאר נפרדת של צלחת 96 באר.
- מוסיפים 40 μL של TE לכל באר ומערבבים על ידי pipetting.
הערה: ניתן לאטום את הצלחת בעלת 96 הבארות ולאחסן אותה בטמפרטורה של 4°C למשך הלילה. בצע את ההוראות המופיעות בקובץ משלים 6 כדי להכין מאגרים ופתרונות עבור הפרוטוקול. איור 3 מתאר את שלבי הכנת הדגימה.
טבלה 2: תנאי PCR thermocycling עבור הגנים16 S, lipL41 ו- lipL32. אנא לחץ כאן כדי להוריד טבלה זו.
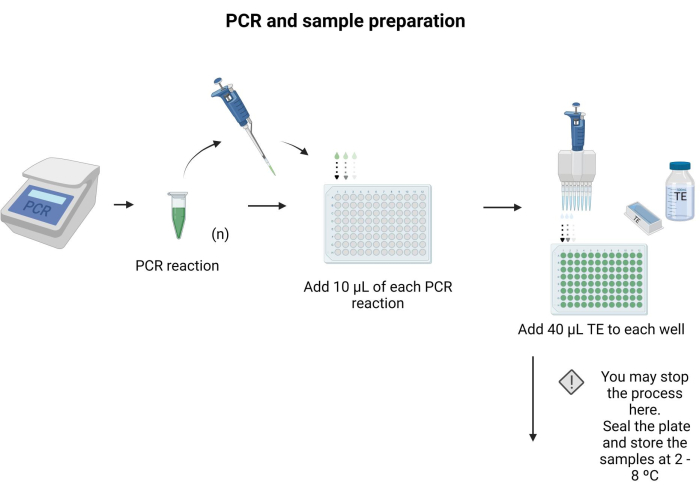
איור 3: PCR והכנת דגימה. יישום פרוטוקול PCR ספציפי, מוצר PCR הועבר צלחת microtiter, ו 40 μL של TE נוסף לכל באר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הרכבת מנגנון כתם הנקודות
הערה: ההרכבה של מנגנון כתם הנקודות מוצגת באיור 4. במהלך ההליך, ללבוש כפפות כדי לטפל בתמיסות אלקליות ולהגן על קרום הניילון מפני זיהום.
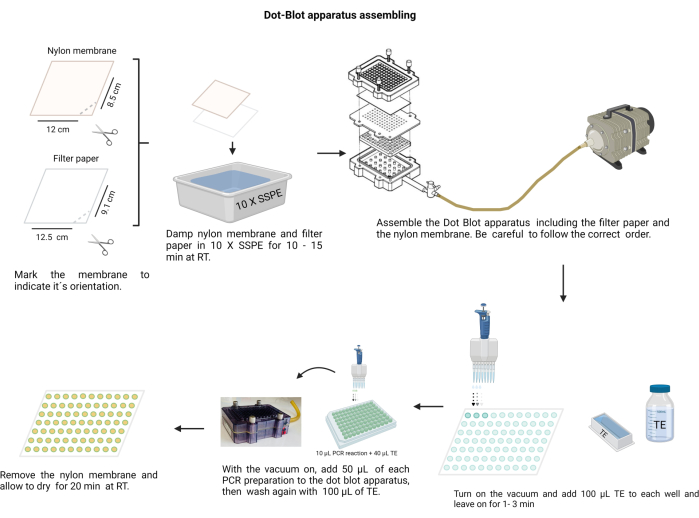
איור 4: הרכבת מנגנון כתם נקודה. נייר הסינון וקרום הניילון (שהורטבו בעבר ב- 10 X SSPE) חייבים להיות מסודרים בסדר הנכון. יש לאבטח את המכלול באמצעות הברגים היטב לפני הפעלת הוואקום. כל באר צריכה להישטף עם TE, ומוצרי PCR נטענים לתוך הבארות שלהם. לאחר העברת מוצר ה- PCR דרך הממברנה, כל באר נשטפת שוב עם TE ומותר להתייבש. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- חותכים את קרום הניילון (ראו טבלת חומרים) ומסננים נייר לגיליונות בגודל 12X8.5 ס"מ.
- סמן את הממברנה בטוש קבוע.
- צור חריץ עם מספריים בקצה אחד כדי לציין את הכיוון הנכון. השתמש בסימן כדי לזכור את סדר הדגימה.
- יש להרטיב את הממברנה ואת נייר הסינון עם 10 X חיץ Saline-sodium phosphate-EDTA (SSPE; 3 M NaCl, 0.2 M NaH2PO4 ו-0.02 M EDTA, pH 7.4) (קובץ משלים 6). טפל בקרום עם טוויטר נקי וקהה.
- להרכיב את תא כתם הנקודות; ראשית, נייר הפילטר, ואחריו הקרום מעל אטם הפלסטיק. הדקו את הכיסוי עם הברגים בצורה צולבת.
- חבר את התא לוואקום, מקם 100 μL של TE בכל באר, להחזיק את השואב במשך 1 דקות, ולאחר מכן לעצור אותו.
- הפעל את הוואקום במהירות נמוכה וטען 50 μL מכל דגימה לבאר המתאימה על הממברנה של מנגנון כתם הנקודה (בעקבות התפלגות הממברנה שנקבעה מראש).
הערה: הומוגניזציה של כל דגימה בצלחת הבאר hemagglutination 96 לפני הצבתה בתא כתם הנקודות. - הניחו לוואקום לייבש את הממברנה. במידת הצורך, הכו את החדר בעדינות כדי לשחרר את הבועות בדגימה.
- שטפו כל באר על ידי הכנסת 100 μL של TE לתוכו עם ואקום מתמשך ואפשרו לו להתייבש.
הערה: לאחר השלמת ההעברה, חשוב לכבות תחילה את המשאבה ולנתק אותה. אי ביצוע פעולה זו עלול לגרום לכניסת ריפלוקס למנגנון. דנ"א אינו זקוק לשלב דנטורציה אם משתמשים בקרום ניילון טעון חיובית, אך אם משתמשים בתמיכה אינרטית אחרת, ייתכן שיהיה צורך בשלב קדם-דנטורציה ודנטורציה מבוססת אלקליות41.
3. דנטורציה וקיבוע DNA
הערה: איור 5 מדגים את תהליך קיבוע קרום הדנ"א.
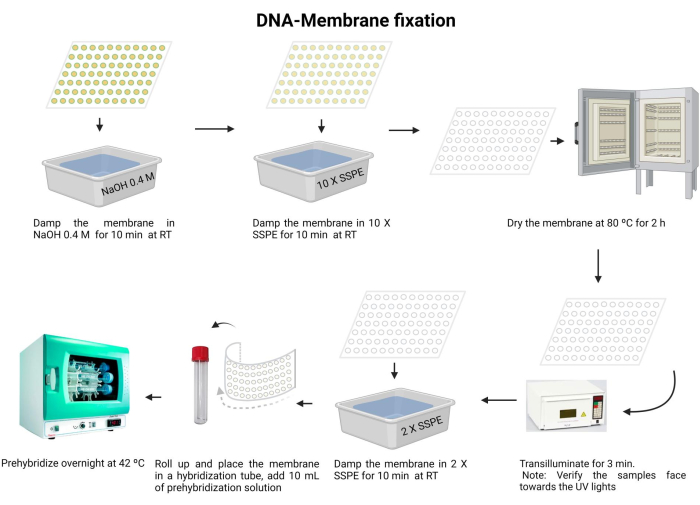
איור 5: תהליך קיבוע קרום הדנ"א. הדנ"א מפורק בתמיסה בסיסית. לאחר מכן, הוא מנוטרל עם 10 X SSPE, ואת הממברנה מיובש. לאחר מכן, הממברנה מוארת. הממברנה מיובשת מחדש עם 2 X SSPE ועוברת הכלאה מראש למשך הלילה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- לדגור על הממברנה עם 0.4 M NaOH במשך 10 דקות בטמפרטורת החדר.
- אזנו את הממברנה עם 10 X SSPE למשך 10 דקות בטמפרטורת החדר.
- יבש את הממברנה ב 80 ° C במשך 2 שעות.
- האירו באור UV של 120 mJ למשך 3 דקות. ודא שהדגימות מכוונות כלפי מטה לכיוון מקור האור UV. אם אתה משתמש ב- UV-crosslinker, ודא שהדגימות פונות כלפי מעלה וחזור על שלב זה פעמיים.
הערה: הממברנה חייבת להיות יבשה לחלוטין לפני הצלבת UV. הדנ"א ישותק על ידי קשר קוולנטי לקרום הניילון. כל קישור צולב לוקח בערך 18 אינץ 'עד 1' עם מינון אופטימלי של הקרנת UV, עבור רוב ניסויי ההכלאה, של כ 0.6-0.8 kJ / m2.
חשיפה לקרינת UV מזיקה לעיניים ולעור. יש ללבוש ציוד מגן מתאים ולהימנע מחשיפה לעור חשוף. - שטפו את הממברנה עם 2 X SSPE במשך 10 דקות.
- קפלו בזהירות את הממברנה והכניסו אותה לצינור ההכלאה (השתמשו בצינור מיקרוצנטריפוגה של 15 מ"ל).
- מוסיפים 10 מ"ל של תמיסת קדם-הכלאה (קובץ משלים 6) לצינור ודגרים ב-42°C למשך הלילה. ודא שהצינור אטום כראוי כדי למנוע דליפה.
4. הכלאה
- הסר 5 מ"ל של פתרון טרום הכלאה מצינור ההכלאה. כדי להשתמש 5 מ"ל בפעם השנייה, לשמור אותו בצינור אחר ולאחסן אותו ב -4 ° C.
- הוסף 15 μL של הבדיקה המסומנת (טבלה 1) לצינור ההכלאה. שטפו את החוד לתוך התמיסה כדי לוודא שהבדיקה המסומנת הוחדרה היטב לדילול.
הערה: הקישור של בדיקת ה- DNA אינו חזק כמו קשירת נוגדני האנטיגן. לכן, שינויים בריכוז הבדיקה או ה- DNA בדגימה יכולים להשפיע על עוצמת הפלואורסצנטיות הנפלטת. גשושיות דנ"א הן סטויכיומטריות, כלומר מספר מולקולות הגשושית הקשורות לדנ"א שווה למספר מולקולות הדנ"א הקיימות בתמיסה. איור 6 מתאר הכלאה של הגשושית. - לדגור ב 42 °C (75 °F) במשך הלילה.
- בצע בדיקת DNA DIG תיוג. בצע את ההוראות המפורטות בטבלה 3 כדי לערבב את הריאגנטים, ולאחר מכן דגור על התערובת בטמפרטורה של 37°C למשך שעה אחת. לאחר מכן, להוסיף 80 μL של מים מזוקקים ולאחסן את הבדיקה זנב ב 4 ° C.
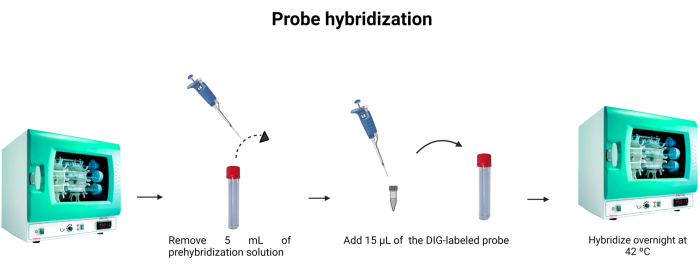
איור 6: הכלאה של גשושיות. נפח חיץ ההכלאה מותאם, והגשושית המסומנת בדיגוקסיגנין משולבת כדי לאפשר הכלאה של הגשושית בן לילה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 3: ריאגנטים לתיוג הגשושיות עם דיגוקסיגנין (DIG). אנא לחץ כאן כדי להוריד טבלה זו.
5. Chemiluminescence (תיוג נגד DIG)
- שטפו את הממברנה פעמיים עם 2 X SSPE/0.1% SDS בטמפרטורת החדר למשך 10 דקות.
- יש לדגור על הממברנה עם 5 X SSPE/0.1% SDS בטמפרטורת החישול של הגשושית למשך 15 דקות.
הערה: בשלב זה, השתמש במיכל עם מכסה כדי לשמור על הטמפרטורה זמן רב ככל האפשר. הקפידו על טמפרטורה אחידה וקבועה על פני הממברנה. הנפח המשוער בכל כביסה הוא 100 מ"ל של הפתרון שצוין. - שטפו את הממברנה פעם אחת עם חיץ 1 (קובץ משלים 6) בטמפרטורת החדר למשך 5 דקות.
- שטפו את הממברנה פעם אחת עם חיץ 2 (קובץ משלים 6) בטמפרטורת החדר למשך 30 דקות.
- שטפו את הממברנה עם Buffer 2 והוסיפו את נוגדן האנטי-דיגוקסיגנין (15 μL) (ראו טבלת חומרים), ולאחר מכן דגרו במשך 45 דקות (זמן הדגירה עשוי לנוע בין 30-60 דקות). נוגדן משני זה מתייג את הבדיקה לזיהוי.
הערה: ניתן לאחסן את הממברנה בחיץ 2 עם נוגדן אנטי-דיגוקסיגנין למשך הלילה בטמפרטורה של 4-8 מעלות צלזיוס. תיוג אנטי-DIG של תהליך הכימילומינסנציה מתואר באיור 7.
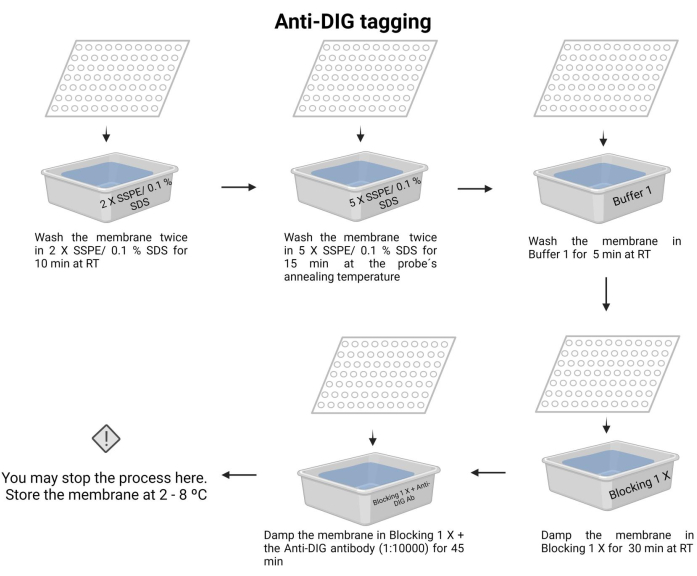
איור 7: תיוג אנטי-DIG של תהליך הכימילומינסנציה. חומצות הגרעין הבלתי מלוכדות מוסרות באמצעות תמיסות חיץ. הגשושית מיושרת עם דנ"א המטרה, והעודף מוסר. הממברנה חסומה באמצעות המאגר החוסם 1 X, ומוסיפים נוגדן אנטי-DIG (1:10000). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. Chemiluminescence (יישום המצע)
- שטפו את הממברנה פעמיים ב-Buffer 1 בטמפרטורת החדר למשך 15 דקות.
- יש לכבס פעם אחת במאגר 3 (ראה קובץ משלים 6) בטמפרטורת החדר למשך 5 דקות, מה שמאפשר לממברנה לנקז את רוב החיץ ולהשאיר אותו כמעט יבש.
- הוסף CSPD מוכן לשימוש (דיסודיום 3-(4-methoxyspiro {1,2-dioxetane-3,2′-(5′-chloro) tricyclo [3.3.1.13,7] decan}-4-yl) פניל פוספט, ראה טבלה של חומרים), ולתת להישאר במשך 5 דקות, (עם אצבעות לחות הומוגניזציה CSPD מצד אחד לשני).
- מניחים את הממברנה בשקית ניילון שקופה (12.5X9 ס"מ) המתאימה לממד הממברנה. הסירו בזהירות בועות אוויר, פזרו באופן שווה את ה-CSPD ואטמו בחום את השקית.
- לדגור את הממברנה באמבט מים ב 37 ° C במשך 15 דקות (זה יכול להיות עד 30 דקות), ולוודא כי הממברנה עם דגימות ממוקם כלפי מטה, כך שהוא שקוע היטב. ודא כי הטמפרטורה נשארת קבועה ומופצת היטב על פני הממברנה.
- יבשו את שקית הניילון וקבעו אותה עם סקוטש טייפ על סרט רדיוגרפי שכבר נמצא בשימוש. זה יאפשר טיפול קל במהלך הליך החשיפה.
הערה: איור 8 מראה את יישום המצע של תהליך הכימילומינסנציה.

איור 8: יישום המצע של תהליך הכימילומינסנציה. הנוגדן החופשי מוסר, והמצע CSPD (1:250) מתווסף לממברנה. התגובה מופעלת על ידי דגירה ב 37 ° C והקרום מסודר להקליט את chemiluminescence בסרט רנטגן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
7. Chemiluminescence (זיהוי)
- בצע את הליך החשיפה. בחדר החושך, הכינו את פתרונות המפתח והמתקן (ראו טבלת חומרים) במגשים המתאימים.
- בחושך, הניחו בזהירות את הקרום הקבוע מול סרט רדיוגרפי חדש והכניסו אותו לקלטת רדיוגרפית (ראו טבלת חומרים).
- רשום את זמן החשיפה. זמן החשיפה עשוי לנוע בין דקה ל-30 דקות או יותר. התחל עם 5 דקות והתאם את הזמן בהתאם.
- יש להרטיב את סרט הרנטגן בתמיסת מפתח למשך 1-3 דקות ולשטוף בעדינות במי ברז (15-45 שניות).
- יש להרטיב את סרט הרנטגן בתמיסת קיבוע למשך 1-3 דקות ולשטוף בעדינות במי ברז (45 שניות).
- אפשר לסרט הרנטגן להתייבש באוויר ותעד את הבדיקה בקופסת אור לבנה גלויה.
הערה: יש להימנע מטלטול הממברנה בזמן החשיפה לקרני רנטגן. תהליך הזיהוי מתואר באיור 9. - המשך לפרשנות התוצאה. בסרט הרנטגן החשוף, הנקודות עם הפליטה יכולות להיות ממוקמות חזותית ומתאימות למקטעי הדנ"א עם הכלאה של הגשושית. עוצמת האות הנפלט תלויה באור ובמשך החשיפה.
הערה: ניתן לאחסן ממברנות מיובשות בין נייר סינון במשך מספר חודשים בטמפרטורת החדר.
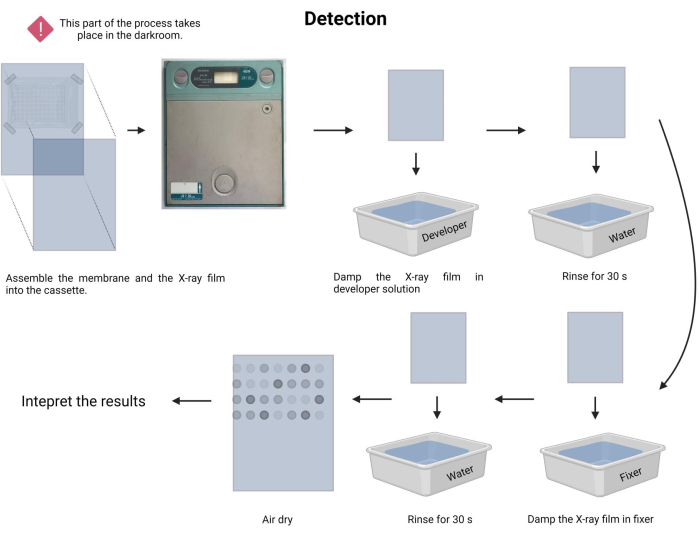
איור 9: זיהוי תהליך הכימילומינסנציה. בתנאים חשוכים, הממברנה נחשפת לסרט רנטגן בתוך קלטת רנטגן. לאחר מכן, הוא הורשה לעמוד בזמן התערוכה, ולאחר מכן הסרט רנטגן פותח קבוע. לבסוף, הוא יובש באוויר ופורש. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
8. הליך דה-הכלאה של הממברנה
- שטפו את הממברנה פעמיים במשך 10 דקות במים מזוקקים.
- שטפו את הממברנה במשך 20 דקות עם 0.4 M NaOH בטמפרטורה של 53°C (פעמיים).
- שטפו פעמיים את הממברנה במשך 10 דקות עם 2 X SSPE.
- הניחו לממברנה להתייבש בטמפרטורת החדר.
- שמור על הממברנה וחזור לשלב 3.5 של הפרוטוקול.
הערה: ניתן לאחסן את הממברנה במאגר שלפני ההכלאה למשך הלילה בטמפרטורה של 4-8 מעלות צלזיוס. למחרת, הפעל מחדש עם דגירה ב 42 ° C במשך 1 שעה, המאפשר את חיץ טרום הכלאה להגיע לטמפרטורה. לאחר מכן, המשך לשלב 3.5 של הפרוטוקול.
תוצאות
כדי להעריך את יעילות הטכניקה, נעשה שימוש בדנ"א גנומי מתרביות טהורות של כל לסרובר לפטוספירה (Leptospira serovar), יחד עם הגשושית הספציפית לקלייד. הממברנות הוכנו עם 100 ננוגרם של DNA גנומי לכל תגובת PCR עבור כל סרובר, ולאחר מכן שמונה דנ"א גנומי של חיידקים שאינם קשורים וריכוזים משתנים של DNA גנומי של סרו?...
Discussion
השלבים הקריטיים של טכניקת כתם הנקודה כוללים (1) אימוביליזציה של דנ"א, (2) חסימת אתרי הקישור החופשיים על הממברנה עם דנ"א לא הומולוגי, (3) השלמה בין הגשושית לבין מקטע המטרה בתנאי חישול, (4) הסרת הגשושית הבלתי היברידית, ו-(5) גילוי מולקולת הכתב41.
לכתם PCR-Dot-blot יש מגבלות מסוי?...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
אנו אסירי תודה לאוסף לפטוספירה של המחלקה למיקרוביולוגיה ואימונולוגיה, הפקולטה לרפואה וטרינרית וזואוטכניקה, האוניברסיטה הלאומית האוטונומית של מקסיקו. אנו אסירי תודה על תרומתם הנדיבה של זני הייחוס לפטוספירה (Leptospira ); Leptospira fainei serovar זן Hurstbridge BUT6 וזן Leptospira biflexa serovar Patoc Patoc I לד"ר Alejandro de la Peña Moctezuma. אנו מודים לד"ר חוסה אנטוניו אוקמפו סרוונטס, מתאם CIBAC, ולצוות על תמיכתם הלוגיסטית. EDT היה תחת תוכנית פרויקט מסוף לסטודנטים לתואר ראשון של האוניברסיטה האוטונומית מטרופוליטן קמפוס Cuajimalpa. אנו מכירים בתוכנת Biorender.com ליצירת איורים 1, 3 עד 9.
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Purelink DNA extraction kit | Invitrogen | K182002 | |
| Gotaq Flexi DNA Polimerase (End-Point PCR Taq polymerase kit) | Promega | M3001 | |
| Whatman filter paper, grade 1, | Merk | WHA1001325 | |
| Nylon Membranes, positively charged Roll 30cm x 3 m | Roche | 11417240001 | |
| Anti-Digoxigenin-AP, Fab fragments Sheep Polyclonal Primary-antibody | Roche | 11093274910 | |
| Medium Base EMJH | Difco | S1368JAA | |
| Leptospira Enrichment EMJH | Difco | BD 279510 | |
| Blocking Reagent | Roche | 11096176001 | |
| CSPD ready to use Disodium 3-(4-methoxyspiro {1,2-dioxetane-3,2′-(5′-chloro) tricyclo [3.3.1.13,7] decan}8-4-yl) phenyl phosphate | Merk | 11755633001 | |
| Deoxyribonucleic acid from herring sperm | Sigma Aldrich | D3159 | |
| Developer Carestream | Carestream Health Inc | GBX5158621 | |
| Digoxigenin-11-ddUTP | Roche | 11363905910 | |
| EDTA, Disodium Salt (Dihydrate) | Promega | H5032 | |
| Ficoll 400 | Sigma Aldrich | F8016 | |
| Fixer Carestream | Carestream Health Inc | GBX 5158605 | |
| Lauryl sulfate Sodium Salt (Sodium dodecyl sulfate; SDS) C12H2504SNa | Sigma Aldrich | L5750 | |
| N- Lauroylsarcosine sodium salt CH3(CH2)10CON(CH3) CH2COONa | Sigma Aldrich | L-9150 | It is an anionic surfactant |
| Polivinylpyrrolidone (PVP-40) | Sigma Aldrich | PVP40 | |
| Polyethylene glycol Sorbitan monolaurate (Tween 20) | Sigma Aldrich | 9005-64-5 | |
| Sodium Chloride (NaCl) | Sigma Aldrich | 7647-14-5 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | 151-21-3 | |
| Sodium hydroxide (NaOH) | Sigma Aldrich | 1310-73-2 | |
| Sodium phosphate dibasic (NaH2PO4) | Sigma-Aldrich | 7558-79-4 | |
| Terminal transferase, recombinant | Roche | 3289869103 | |
| Tris hydrochloride (Tris HCl) | Sigma-Aldrich | 1185-53-1 | |
| SSPE 20X | Sigma-Aldrich | S2015-1L | It can be Home-made following Supplementary File 6 |
| Primers | Sigma-Aldrich | On demand | Follow table 1 |
| Probes | Sigma-Aldrich | On demand | Follow table 1 |
| Equipment | |||
| Nanodrop™ One Spectrophotometer | Thermo-Scientific | ND-ONE-W | |
| Refrigerated microcentrifuge Sigma 1-14K, suitable for centrifugation of 1.5 ml microcentrifuge tubes at 14,000 rpm | Sigma-Aldrich | 1-14K | |
| Disinfected adjustable pipettes, range 2-20 µl, 20-200 µl | Gilson | SKU:F167360 | |
| Disposable 1.5 ml microcentrifuge tubes (autoclaved) | Axygen | MCT-150-SP | |
| Disposable 600 µl microcentrifuge tubes (autoclaved) | Axygen | 3208 | |
| Disposable Pipette tips 1-10 µl | Axygen | T-300 | |
| Disposable Pipette tips 1-200 µl | Axygen | TR-222-Y | |
| Dot-Blot apparatus Bio-Dot | BIORAD | 1706545 | |
| Portable Hergom Suction | Hergom | 7E-A | |
| Scientific Light Box (Visible-light PH90-115V) | Hoefer | PH90-115V | |
| UV Crosslinker | Hoefer | UVC-500 | |
| Thermo Hybaid PCR Express Thermocycler | Hybaid | HBPX110 | |
| Radiographic cassette with IP Plate14 X 17 | Fuji |
References
- Bierque, E., Thibeaux, R., Girault, D., Soupé-Gilbert, M. E., Goarant, C. A systematic review of Leptospira in water and soil environments. PLOS One. 15 (1), e0227055 (2020).
- Haake, D. A., Levett, P. N. Leptospirosis in humans. Current Topics in Microbiology and Immunology. 387, 65-97 (2015).
- Tripathy, D. N., Hanson, L. E. Leptospires from water sources at Dixon Springs Agricultural Center. Journal of Wildlife Diseases. 9 (3), 209-212 (1973).
- Smith, D. J., Self, H. R. Observations on the survival of Leptospira australis A in soil and water. The Journal of Hygiene. 53 (4), 436-444 (1955).
- Karpagam, K. B., Ganesh, B. Leptospirosis: a neglected tropical zoonotic infection of public health importance-an updated review. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 39 (5), 835-846 (2020).
- Casanovas-Massana, A., et al. Spatial and temporal dynamics of pathogenic Leptospira in surface waters from the urban slum environment. Water Research. 130, 176-184 (2018).
- Costa, F., et al. Global morbidity and mortality of Leptospirosis: A systematic review. PLOS Neglected Tropical Diseases. 9 (9), e0003898 (2015).
- Mwachui, M. A., Crump, L., Hartskeerl, R., Zinsstag, J., Hattendorf, J. Environmental and behavioural determinants of Leptospirosis transmission: A systematic review. PLOS Neglected Tropical Diseases. 9 (9), e0003843 (2015).
- Andre-Fontaine, G., Aviat, F., Thorin, C. Waterborne Leptospirosis: Survival and preservation of the virulence of pathogenic Leptospira spp. in fresh water. Current Microbiology. 71 (1), 136-142 (2015).
- Trueba, G., Zapata, S., Madrid, K., Cullen, P., Haake, D. Cell aggregation: A mechanism of pathogenic Leptospira to survive in freshwater. International Microbiology: the Official Journal of the Spanish Society for Microbiology. 7 (1), 35-40 (2004).
- Smith, C. E., Turner, L. H. The effect of pH on the survival of leptospires in water. Bulletin of the World Health Organization. 24 (1), 35-43 (1961).
- Barragan, V. A., et al. Interactions of Leptospira with environmental bacteria from surface water. Current Microbiology. 62 (6), 1802-1806 (2011).
- Abdoelrachman, R. Comparative investigations into the influence of the presence of bacteria on the life of pathogenic and apathogenic leptospirae. Antonie van Leeuwenhoek. 13 (1), 21-32 (1947).
- Singh, R., et al. Microbial diversity of biofilms in dental unit water systems. Applied and Environmental Microbiology. 69 (6), 3412-3420 (2003).
- Kumar, K. V., Lall, C., Raj, R. V., Vedhagiri, K., Vijayachari, P. Coexistence and survival of pathogenic leptospires by formation of biofilm with Azospirillum. FEMS Microbiology Ecology. 91 (6), 051 (2015).
- Yanagihara, Y., et al. Leptospira Is an environmental bacterium that grows in waterlogged soil. Microbiology Spectrum. 10 (2), 0215721 (2022).
- Gillespie, R. W., Ryno, J. Epidemiology of leptospirosis. American Journal of Public Health and Nation’s Health. 53 (6), 950-955 (1963).
- Bierque, E., et al. Leptospira interrogans retains direct virulence after long starvation in water. Current Microbiology. 77 (10), 3035-3043 (2020).
- Zhang, Y., Dai, B. Marking and detection of DNA of leptospires in the dot-blot and situ hybridization with digoxigenin-labeled probes. Journal of West China University of Medical Sciences. 23 (4), 353-435 (1992).
- Mérien, F., Amouriaux, P., Perolat, P., Baranton, G., Saint Girons, I. Polymerase chain reaction for detection of Leptospira spp. in clinical samples. Journal of Clinical Microbiology. 30 (9), 2219-2224 (1992).
- Veerapandian, R., et al. Silver enhanced nano-gold dot-blot immunoassay for leptospirosis. Journal of Microbiological Methods. 156, 20-22 (2019).
- Junpen, S., et al. Evaluation of a monoclonal antibody-based dot-blot ELISA for detection of Leptospira spp in bovine urine samples. American Journal of Veterinary Research. 66 (5), 762-766 (2005).
- Ishmael, F. T., Stellato, C. Principles and applications of polymerase chain reaction: basic science for the practicing physician. Annals of Allergy, Asthma & Immunology: Official Publication of the American College of Allergy, Asthma, & Immunology. 101 (4), 437-443 (2008).
- Boerner, B., Weigelt, W., Buhk, H. J., Castrucci, G., Ludwig, H. A sensitive and specific PCR/Southern blot assay for detection of bovine herpesvirus 4 in calves infected experimentally. Journal of Virological Methods. 83 (1-2), 169-180 (1999).
- Curry, E., Pratt, S. L., Kelley, D. E., Lapin, D. R., Gibbons, J. R. Use of a Combined duplex PCR/Dot-blot assay for more sensitive genetic characterization. Biochemistry Insights. 1, 35-39 (2008).
- Pilatti, M. M., Ferreira, S. d. e. A., de Melo, M. N., de Andrade, A. S. Comparison of PCR methods for diagnosis of canine visceral leishmaniasis in conjunctival swab samples. Research in Veterinary Science. 87 (2), 255-257 (2009).
- Conrads, G., et al. PCR reaction and dot-blot hybridization to monitor the distribution of oral pathogens within plaque samples of periodontally healthy individuals. Journal of Periodontology. 67 (10), 994-1003 (1996).
- Langa, S., et al. Differentiation of Enterococcus faecium from Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus strains by PCR and dot-blot hybridisation. International Journal of Food Microbiology. 88 (2-3), 197-200 (2003).
- Francesca, C., Lucilla, I., Marco, F., Giuseppe, C., Marisa, M. Identification of the unculturable bacteria Candidatus arthromitus in the intestinal content of trouts using dot-blot and Southern blot techniques. Veterinary Microbiology. 156 (3-4), 389-394 (2012).
- Arent, Z., Pardyak, L., Dubniewicz, K., Plachno, B. J., Kotula-Balak, M. Leptospira taxonomy: then and now. Medycyna Weterynaryjna. 78 (10), 489-496 (2022).
- Thibeaux, R., et al. Biodiversity of environmental Leptospira: Improving identification and revisiting the diagnosis. Frontiers in Microbiology. 9, 816 (2018).
- Carrillo-Casas, E. M., Hernández-Castro, R., Suárez-Güemes, F., de la Peña-Moctezuma, A. Selection of the internal control gene for real-time quantitative RT-PCR assays in temperature treated Leptospira. Current Microbiology. 56 (6), 539-546 (2008).
- Azali, M. A., Yean Yean, C., Harun, A., Aminuddin Baki A, N. N., Ismail, N. Molecular characterization of Leptospira spp. in environmental samples from North-Eastern Malaysia revealed a pathogenic strain, Leptospira alstonii. Journal of Tropical Medicine. 2016, 2060241 (2016).
- Ahmed, N., et al. Multilocus sequence typing method for identification and genotypic classification of pathogenic Leptospira species. Annals of Clinical Microbiology and Antimicrobials. 5, 28 (2006).
- Bourhy, P., Collet, L., Brisse, S., Picardeau, M. Leptospira mayottensis sp. nov., a pathogenic species of the genus Leptospira isolated from humans. International Journal of Systematic and Evolutionary Microbiology. 64, 4061-4067 (2014).
- Weiss, S., et al. An extended Multilocus Sequence Typing (MLST) scheme for rapid direct typing of Leptospira from clinical samples. PLOS Neglected Tropical Diseases. 10 (9), e0004996 (2016).
- Branger, C., et al. Polymerase chain reaction assay specific for pathogenic Leptospira based on the gene hap1 encoding the hemolysis-associated protein-1. FEMS Microbiology Letters. 243 (2), 437-445 (2005).
- Ren, S. X., et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing. Nature. 422 (6934), 888-893 (2003).
- Picardeau, M., et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLOS One. 3 (2), e1607 (2008).
- Kafatos, F. C., Jones, C. W., Efstratiadis, A. Determination of nucleic acid sequence homologies and relative concentrations by a dot hybridization procedure. Nucleic Acids Research. 7 (6), 1541-1552 (1979).
- Bhat, A. I., Rao, G. P. Dot-blot hybridization technique. Characterization of Plant Viruses. , 303-321 (2020).
- Yadav, J. P., Batra, K., Singh, Y., Singh, M. Comparative evaluation of indirect-ELISA and Dot-blot assay for serodetection of Mycoplasma gallisepticum and Mycoplasma synoviae antibodies in poultry. Journal of Microbiological Methods. 189, 106317 (2021).
- Malinen, E., Kassinen, A., Rinttilä, T., Palva, A. Comparison of real-time PCR with SYBR Green I or 5'-nuclease assays and dot-blot hybridization with rDNA-targeted oligonucleotide probes in quantification of selected faecal bacteria. Microbiology. 149, 269-277 (2003).
- Wyss, C., et al. Treponema lecithinolyticum sp. nov., a small saccharolytic spirochaete with phospholipase A and C activities associated with periodontal diseases. International Journal of Systematic Bacteriology. 49, 1329-1339 (1999).
- Shah, J. S., I, D. C., Ward, S., Harris, N. S., Ramasamy, R. Development of a sensitive PCR-dot-blot assay to supplement serological tests for diagnosing Lyme disease. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 37 (4), 701-709 (2018).
- Niu, C., Wang, S., Lu, C. Development and evaluation of a dot-blot assay for rapid determination of invasion-associated gene ibeA directly in fresh bacteria cultures of E. coli. Folia microbiologica. 57 (6), 557-561 (2012).
- Wetherall, B. L., McDonald, P. J., Johnson, A. M. Detection of Campylobacter pylori DNA by hybridization with non-radioactive probes in comparison with a 32P-labeled probe. Journal of Medical Microbiology. 26 (4), 257-263 (1988).
- Kolk, A. H., et al. Detection of Mycobacterium tuberculosis in clinical samples by using polymerase chain reaction and a nonradioactive detection system. Journal of Clinical Microbiology. 30 (10), 2567-2575 (1992).
- Scherer, L. C., et al. PCR colorimetric dot-blot assay and clinical pretest probability for diagnosis of Pulmonary Tuberculosis in smear-negative patients. BMC Public Health. 7, 356 (2007).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist Reviews. 29, S49-S52 (2008).
- Zhang, Y., Dai, B. Detection of Leptospira by dot-blot hybridization with photobiotin- and 32P-labeled DNA. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (2), 130-132 (1992).
- Terpstra, W. J., Schoone, G. J., ter Schegget, J. Detection of leptospiral DNA by nucleic acid hybridization with 32P- and biotin-labeled probes. Journal of Medical Microbiology. 22 (1), 23-28 (1986).
- Shukla, J., Tuteja, U., Batra, H. V. DNA probes for identification of leptospires and disease diagnosis. The Southeast Asian Journal of Tropical Medicine and Public Health. 35 (2), 346-352 (2004).
- Jiang, N., Jin, B., Dai, B., Zhang, Y. Identification of pathogenic and nonpathogenic leptospires by recombinant probes. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 26 (1), 1-5 (1995).
- Fach, P., Trap, D., Guillou, J. P. Biotinylated probes to detect Leptospira interrogans on dot-blot hybridization or by in situ hybridization. Letters in Applied Microbiology. 12 (5), 171-176 (1991).
- Huang, N., Dai, B. Assay of genomic DNA homology among strains of different virulent leptospira by DNA hybridization. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (2), 122-125 (1992).
- Dong, X., Dai, B., Chai, J. Homology study of leptospires by molecular hybridization. Journal of West China University of Medical Sciences = Huaxi like daxue xuebao. 23 (1), 1-4 (1992).
- Komminoth, P. Digoxigenin as an alternative probe labeling for in situ hybridization. Diagnostic Molecular Pathology: The American Journal of Surgical Pathology, part B. 1 (2), 142-150 (1992).
- Saengjaruk, P., et al. Diagnosis of human leptospirosis by monoclonal antibody-based antigen detection in urine. Journal of Clinical Microbiology. 40 (2), 480-489 (2002).
- Okuda, M., et al. Enzyme-linked immunosorbent assay for the detection of canine Leptospira antibodies using recombinant OmpL1 protein. The Journal of Veterinary Medical Science. 67 (3), 249-254 (2005).
- Suwimonteerabutr, J., et al. Evaluation of a monoclonal antibody-based dot-blot ELISA for detection of Leptospira spp in bovine urine samples. American Journal of Veterinary Research. 66 (5), 762-766 (2005).
- Kanagavel, M., et al. Peptide-specific monoclonal antibodies of Leptospiral LigA for acute diagnosis of leptospirosis. Scientific reports. 7 (1), 3250 (2017).
- Levett, P. N. Leptospirosis. Clinical Microbiology Reviews. 14 (2), 296-326 (2001).
- Monahan, A. M., Callanan, J. J., Nally, J. E. Proteomic analysis of Leptospira interrogans shed in urine of chronically infected hosts. Infection and Immunity. 76 (11), 4952-4958 (2008).
- Rojas, P., et al. Detection and quantification of leptospires in urine of dogs: a maintenance host for the zoonotic disease leptospirosis. European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. 29 (10), 1305-1309 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved