Method Article
הדמיה in vivo של מעברי סידן במהלך הפריה והתפתחות מוקדמת ב - C. elegans
In This Article
Summary
כאן, אנו מציגים פרוטוקולים וכלים להמחשת סידן במהלך הפריה ועובריות מוקדמות באמצעות מדווח סידן מקודד גנטית המתבטא בקו הנבט של נמטודת המודל C. elegans.
Abstract
סידן הוא מולקולת איתות חשובה במהלך המעבר מהביצית לעובר (OET) והאמבריוגנזה המוקדמת. הנמטודה ההרמפרודיטית Caenorhabditis elegans מספקת מספר יתרונות ייחודיים לחקר ה-OET מכיוון שהיא שקופה ובעלת בלוטת מין מסודרת המייצרת ביצית בוגרת אחת כל ~23 דקות ב-20 מעלות צלזיוס. שינינו את מחוון הסידן המקודד גנטית jGCaMP7s כדי לציין באופן פלואורסצנטי את רגע ההפריה בתוך אורגניזם חי. קראנו לכתב זה "CaFE" לסידן במהלך ההפריה ב - C. elegans. כתב ה-CaFE תוכנן למיקום נמל מבטחים בעותק יחיד, אין לו השפעה משמעותית על הפיזיולוגיה או הפוריות, ומייצר אות חזק בעת ההפריה. כאן, מוצגת סדרה של פרוטוקולים לשימוש במדווח CaFE ככלי in vivo לניתוח ה-OET והאמבריוגנזה. אנו כוללים שיטות לסנכרון תולעים, בחינת ההשפעות של דפיקת RNAi, הרכבת תולעים להדמיה והדמיית סידן בביציות ובעוברים. בנוסף, אנו מציגים את הדור של זני תולעים נוספים כדי לסייע בניתוח מסוג זה. כדי להדגים את התועלת של מדווח CaFE להמחשת עיתוי ההפריה, אנו מדווחים כי ביוץ כפול מתרחש כאשר ipp-5 ממוקד על ידי RNAi וכי רק הביצית הראשונה עוברת הפריה מיידית. יתר על כן, מדווח כאן על גילוי מעברי סידן חד-תאיים במהלך האמבריוגנזה המוקדמת, מה שמדגים כי מדווח ה-CaFE נמשך עד להתפתחות מוקדמת. חשוב לציין, מדווח CaFE בתולעים פשוט מספיק לשימוש לשילוב בשיעורי מעבדה למחקר לתואר ראשון (CURE). מדווח CaFE, יחד עם בלוטת המין המסודרת וקלות ה-RNAi בתולעים, מקל על חקירה של הדינמיקה של תא-תא הנדרשת לוויסות הפריה פנימית ועובריות מוקדמת.
Introduction
ההפריה מסמנת את תחילתו של מחזור חיים חדש, אך הגדרת הרגע המדויק של ההפריה היא מאתגרת. מאפיין שמור של הפריה הוא גל של סידן על פני הביצית מיד לאחר איחוי זרע1. למרות שאופי גל הסידן, מבחינת תדירות ומהירות, שונה בין המינים, כמעט כל האורגניזמים מציגים עלייה זמנית בסידן תוך תאי לאחר ההפריה. גל הסידן ממלא תפקיד קריטי בחסימה לפוליספרמיה, הפעלת ביציות ואירועים תאיים חשובים אחרים2. מכיוון שגל הסידן מתחיל באתר איחוי הזרע, הסידן משמש כסמן להפריה3.
Caenorhabditis elegans הוא אורגניזם מודל אידיאלי לחקר התפתחות מוקדמת. התולעים הן הרמפרודיטים שקופים הניתנים למעקב גנטי4. החשוב ביותר לחקר ההפריה, C. elegans בוגרים מייצרים ביציות באופן רציף באמצעות בלוטת מיןמסודרת בקפדנות 5. למעשה, ביציות הן התאים החדשים היחידים המיוצרים מכיוון שהסומה פוסט-מיטוטית בבגרות6. איור 1 מדגיש את בלוטת המין, המורכבת מ-2 צינורות סימטריים בצורת U של ביציות מתפתחות. הביצית הקרובה ביותר לזרע (איבר האחסון של הזרע) נקראת הביצית -1. עיצוב פס ייצור זה של בלוטת התולעת מבייצת ביצית בוגרת לתוך הזרע כל ~23 דקות ב-20 מעלות צלזיוס אצל מבוגרים צעירים7. לאחר מכן, העובר החדש שהופרה עובר לרחם משותף לפני שהוא מונח דרך פות אחת.
טכניקות קודמות להמחשת סידן במהלך ההפריה ב- C. elegans הסתמכו על מיקרו-הזרקה של צבעים רגישים לסידן 3,8. כדי לראות ביתר קלות את גל הסידן בעת איחוי זרע-ביצית, אינדיקטור סידן מקודד גנטית המבוסס על jGCaMP7s הוכנס בעותק יחיד בלוקוס נמל מבטחים באמצעות חזרות פלינדרומיות קצרות מקובצות (CRISPR)7,9. הכתב נקרא CaFE לסידן במהלך ההפריה ב- C. elegans. הכתב לא מראה פגמים משמעותיים בפיזיולוגיה או בפוריות.
כאן, מוצגים פרוטוקולים להדמיה של גל הסידן בביציות ובעוברים של C. elegans באמצעות מדווח CaFE. בשילוב עם שלל הכלים הזמינים בקהילת התולעים, כגון הפרעות RNA (RNAi) וסמני בלוטת המין mCherry , מדווח CaFE מקל על חקירה של ויסות אירועי הפריה פנימיים, במיוחד יכולת ההפריה ותזמון ההפריה. בנוסף, מדווח ה-CaFE ממשיך להתפתח מוקדם ומהווה כלי ייחודי לחקירת אמבריוגנזה.
Protocol
1. תחזוקת C. elegans
- הכנת צלחת מדיום גידול נמטודה (NGM).
- שלב 3 גרם נתרן כלורי (NaCl), 2.5 גרם בקטו-פפטון, 20 גרם אגר ו-1 ליטר מים נטולי יונים בבקבוק של 4 ליטר (ראה טבלת חומרים). מכסים את החלק העליון של הבקבוק בנייר אלומיניום לפני החיטוי.
- חיטוי לעיקור באמצעות הגדרות מחזור עיקור נוזלי. מומלץ מחזור עיקור המוגדר על 121 מעלות צלזיוס למשך 30 דקות.
- הניחו לתערובת להתקרר ל-~50 מעלות צלזיוס, כ-20 דקות בטמפרטורת החדר (RT).
- הוסף 25 מ"ל סטרילי של 1 M KH2PO4 סטרילי (מומס במים, pH = 6), 1 מ"ל של 1 M CaCl2 סטרילי (מומס במים), 1 מ"ל סטרילי של 1 M MgSO4 סטרילי (מומס במים), ו-1 מ"ל של 5 מ"ג/מ"ל כולסטרול (מומס ב-100% אתנול), תוך ערבוב עדין לאחר כל הוספה (ראה טבלת חומרים).
- בעזרת טכניקה סטרילית, העבירו חלק מהתערובת לכוס סטרילית של 300 מ"ל למזיגה קלה יותר. יוצקים את המדיה החמה לכיסוי תחתית הצלחת.
הערה: כ-10 מ"ל לצלחת בלוחות פטרי סטריליים בגודל 60 מ"מ על 15 מ"מ (ראה טבלת חומרים) יפיקו 100 צלחות. לחלופין, ניתן להשתמש בצלחות פטרי סטריליות בגודל 35 מ"מ על 10 מ"מ, כאשר ~4 מ"ל לצלחת יפיקו ~250 צלחות. - הניחו לצלחות ה-NGM להתייבש ב-RT לפחות יום אחד לפני הזריעה עם חיידקים. אחסן צלחות הפוכות ב-4 מעלות צלזיוס לשימוש עתידי.
- הכנת דשא חיידקי OP50
- הכינו מרק לוריא (LB) על ידי שילוב של 5 גרם תמצית שמרים, 10 גרם Bacto-Tryptone, 5 גרם NaCl ו-1 ליטר מים נטולי יונים בבקבוק של 2 ליטר (ראו טבלת חומרים). בעזרת צלחת ערבוב ומוט ערבוב, מערבבים עד להמסה.
- Aliquot LB לבקבוקים ואוטוקלאב באמצעות הגדרות מחזור עיקור נוזלי. מומלץ מחזור עיקור המוגדר על 121 מעלות צלזיוס למשך 30 דקות. אם אתה משתמש במיכל עם מכסה בורג, שחרר את מכסה הבורג רבע סיבוב לאוורור נאות במהלך מחזור החיטוי.
- הניחו למרק להתקרר ל-RT לפני השימוש.
- בטכניקה סטרילית, יש לחסן 50 מ"ל של LB בבקבוק ארלנמאייר של 250 מ"ל עם חיידקי OP50 ולגדל בן לילה בטמפרטורה של 37 מעלות צלזיוס עם טלטול.
- באמצעות טכניקה סטרילית, העבירו 300 מיקרוליטר של תרבית רוויה למרכז צלחת NGM בגודל 60 מ"מ על 15 מ"מ. עבור צלחות בגודל 35 מ"מ על 10 מ"מ, מומלץ 100 מיקרוליטר של תרבית רוויה.
- הניחו לצלחות להתייבש ב-RT למשך 1-3 ימים עד שכתם החיידק OP50 כבר לא נוזלי. ודא שהצלחות יבשות ונקיות מזיהום לפני השימוש. אחסן את הצלחות בטמפרטורה של 4 מעלות צלזיוס לשימוש עתידי. אחסון צלחות הפוכות מפחית עיבוי על פני הצלחת.
- בניית קטיף תולעים
- שחרר את צווארון הכסף לכיוון ראש ידית איסוף התולעת (ראה טבלת חומרים) על ידי שחרור עדין כך שארבעת החלקים יתפרקו.
- חותכים 1.5 אינץ' (בערך אורך האגודל) של חוט פלטינה (ראה טבלת חומרים) בעזרת מספריים ומניחים אותו באמצע ארבעת החלקים; בערך סנטימטר יבלוט מהידית.
- החזק את החוט במרכז תוך הידוק הצווארון; ארבעת החלקים יתאחדו באמצע ויחזיקו את חוט הפלטינה במקומו.
- עצבו בזהירות את החוט בעזרת צבת אף שטוח. צורת קשת או קשת נוטה לעבוד הכי טוב לקטיף.
- צור כ"רגל" של 2-3 מ"מ בקצה החוט על ידי הידוק חוזר ונשנה עם צבת האף השטוח. השתמש ב"רגל" זו כדי להרים את התולעים ולשמור על "כף הרגל" שטוחה לפני השטח של הצלחת.
הערה: Clamp חזק מדי יחתוך את חוט הפלטינה. הימנע מיצירת קצוות חדים באמצעות צבת האף השטוח (או שווה ערך) כדי למנוע ניקוב התולעים או הצלחות.
- טיפול בתולעת
- החזק את מכוש התולעת הדומה לעיפרון ועקר את "כף הרגל" על ידי הנחת החוט בלהבה של מנורת אתנול 95% עד שהוא כתום בוהק.
- הנח צלחת זרעים OP50 על הבמה של היקף ניתוח והסר את המכסה. גע בעדינות ב"כף הרגל" של הקיסם באזור של מדשאת החיידקים והשתמש בתנועת החלקה עדינה כדי לאסוף חיידקים לתחתית. החיידקים שנדבקים למכוש (המכונים "גו") ישמשו כדבק לאיסוף תולעים.
- העבירו צלחת תולעים לשלב היקף החיתוך והסירו את המכסה תוך שמירה על הבחירה מלגעת במשטחים אחרים. גע במהירות ובעדינות ב"כף הרגל" של הפיק בתולעת כדי להרים אותה. טכניקה זו מאפשרת להעביר מספר תולעים בין צלחות בו זמנית.
- גע בעדינות ב"רגל" של הקטיף בחלק הלא זרוע של צלחת חדשה כדי להעביר את התולעים; בדרך כלל, זו אותה צלחת שהחיידקים נלקחו ממנה בסעיף 1.4.2.
- עקר את הפיק בין כל צלחת ו/או זן תולעת כדי למנוע זיהום ולאפשר לפיק להתקרר לאחר העיקור.
הערה: נגיעה בפיק חם בתולעת תלחיץ או תהרוג את החיה. קטיף התולעים יתקרר לאחר נגיעה במדשאת החיידקים כדי לאסוף "גו" להעברת תולעים.
- שמור על תולעים בטמפרטורה של 20 מעלות צלזיוס על צלחות NGM (שלב 1.1) שנזרעו עם חיידקי OP50 Escherichia coli (שלב 1.2). תולעי מעבר 2-3 פעמים בשבוע על ידי העברת מספר בוגרים לצלחות טריות (60 מ"מ על 15 מ"מ) באמצעות קיסם תולעים (שלבים 1.3-1.4) כדי למנוע רעב, שעלול לשנות את הפיזיולוגיה.
הערה: זני C. elegans וחיידקי OP50 זמינים דרך המרכז לגנטיקה של Caenorhabditis (CGC).
2. סנכרון התפתחותי של C. elegans
- סנכרון גיל תולעים באמצעות הטלת ביצים מתוזמנת (מתואר כאן). אם יש צורך במספר רב של תולעים לכיתה או למטרה אחרת, בצע סנכרון אקונומיקה כמתואר ב-Golden et al.10.
- העבירו תולעים בוגרות לצלחת OP50 חדשה באמצעות קיסם חוט פלטינה (מתואר בסעיף 1). מספר התולעים מוכתב על ידי הצורך הניסיוני. ביום 1 תולעים מטילות כ-3 ביצים בשעה. לכן, 10 תולעים ייצרו כ-30 ביצים בשעה אחת. רצוי להשתמש בתולעים ביום הראשון לבגרות (יום 1).
- לאחר כשעה, הוציאו את התולעים הבוגרות מהצלחת והשאירו רק את הביצים.
הערה: השארת תולעת מאחור בטעות היא שגיאה נפוצה. תולעים שיישארו ימשיכו להטיל ביצים ולשבש את הסנכרון. תולעים מתבגרות לבוגרות ביום הראשון כ-72 שעות מההטלה כאשר הן מודגרות ב-20 מעלות צלזיוס.
3. תולעים הרכבה להדמיה
- בעת הדמיית אירועי הפריה, השתמש במבוגרים ביום הראשון כדי למקסם את הזדמנויות ההדמיה.
הערה: במבוגרים ביום הראשון, ביצית מופרית כל ~23 דקות. עם זאת, הביוץ מאט עם הגיל, והרמפרודיטה טיפוסית תפסיק להטיל ביצים לאחר היום הרביעי. - הכינו תמיסה של 3% אגרוז במים על ידי ערבוב 3 גרם אגרוז ב 100 מ"ל מים. מחממים את תמיסת האגרוז בעזרת מיקרוגל עד להמסה מלאה של האגרוז. לשימוש חוזר בתמיסה מוצקה, יש לחמם עד להמסה מלאה. לאחר מספר שימושים, צור פתרון חדש.
- הנח שקופית מיקרוסקופ ריקה להדמיה בין שתי שקופיות מיקרוסקופ אחרות שיש להן שכבה אחת של סרט מעבדה על פני הציר הארוך של השקופית (ראה טבלת חומרים). הסרט יוצר מרווח לכרית האגרוז, המאפשר פיזור אחיד ורוחב אחיד. ודא ששלוש השקופיות נמצאות בשורה כשהצדדים הארוכים נוגעים: שתי שקופיות עם סרט שמשני צדי שקופית מיקרוסקופ ריקה.
- זרוק את תמיסת האגרוז המחוממת של 3% (~100-150 מיקרוליטר) על מרכז שקופית המיקרוסקופ שנמצאת בין השקופיות המודבקות באמצעות פיפטה של 1 מ"ל.
- הנח במהירות שקופית מיקרוסקופ חדשה על טיפת האגרוז, וודא שהמגלשה החדשה מאונכת לשקופית עם טיפת האגרוז ונחה על פני השקופיות המודבקות הסמוכות.
- הפרד בעדינות את השקופיות. הימנע מקריעת הכרית.
- הכינו את רפידות האגרוז טריות בכל יום הדמיה. מומלץ להכין מספר רפידות בעת ההכנה להדמיה, אך להימנע מחשיפת יותר מפד אחד בו זמנית. רפידות חשופות יתייבשו במהירות.
- בעזרת פיפטה של 20 מיקרוליטר, הוסף טיפה קטנה (~7 מיקרוליטר) של 1 מ"מ לבאמיסול במאגר M9 למרכז כרית האגרוז כדי לשתק את התולעים. השתמש בתמיסת מלאי מעוקרת של 100 מ"מ של levamisole כדי ליצור את פתרון העבודה של 1 מ"מ.
- כדי ליצור מאגר M9, שלבו 6 גרם של Na2HPO4, 3 גרם של KH2PO4, 0.5 גרם NaCl, 1 גרם NH4Cl ו-1 ליטר מים נטולי יונים במיכל מתאים (ראה טבלת חומרים).
- חיטוי התמיסה באמצעות הגדרות מחזור עיקור נוזלי ותן לתמיסה להתקרר ל-RT לפני השימוש. אם משתמשים במיכל עם מכסה בורג, שחררו את מכסה הבורג כרבע סיבוב לאוורור נאות. מומלץ מחזור עיקור המוגדר על 121 מעלות צלזיוס למשך 30 דקות.
- בחר לפחות 5 תולעים מסונכרנות וגע בעדינות ב"כף הרגל" בטיפה של הלבמיסול כדי להעביר את כל התולעים. השתמש לפחות ב-5 תולעים בכל מגלשה, מכיוון שכיוון הגוף יכול לגרום למעי לטשטש את קו הנבט, ולחסום את ההדמיה של גל הסידן בביצית.
הערה: ודא שהתולעים מועברות במהירות מכיוון שהלבמיסול יתאדה אם יישאר יושב על כרית האגרוז למשך יותר מ-5 דקות. - מכסים בזהירות את כרית האגרוז בכיסוי. בדוק את מיקום התולעים, מכיוון שהחלקת הכיסוי עלולה לגרום לפיזור התולעים מהמיקום הראשוני. סמן את שקופית המיקרוסקופ בפרטים מתאימים, כגון שם זן התולעת (ראה טבלת חומרים).
הערה: ודא שההדמיה נעשית בהקדם האפשרי לאחר הרכבה של תולעים, מכיוון שחשיפה ממושכת ללבמיסול היא רעילה.
4. הדמיית סידן במהלך הפריה ב - C. elegans
- אתר את התולעים באמצעות מטרה בעלת עוצמה נמוכה, כגון 4x, במיקרוסקופ לבחירתך. השתמש בתאורת שדה בהיר.
- השתמש במטרת אוויר של פי 20 לפחות להמחשה ברורה של גל הסידן בביציות. השתמש ביעד טבילה של פי 40 ומעלה.
- בהתאם למערכת בה משתמשים, עוצמת העירור היא בדרך כלל ערך קבוע. להדמיה אופטימלית של מדווחי הפלורסנט, התאם את זמן הרווח או החשיפה.
הערה: אור מתמשך בעוצמה גבוהה יפגע בדגימה ומזיק לבריאות התולעת. אם תרצה, כבה את הלייזר בזמן ההמתנה לאירוע הפריה כדי למנוע תאורת GFP רציפה. ראה את סימני ההיכר של אירוע הפריה בסעיפים 4.8 - 4.9. - ודא שערוץ ה-GFP של 488 ננומטר מוגדר לעוצמת לייזר שבה אות הדיווח של CaFE נראה בקלות.
- עבור קונפוקל סריקת לייזר Nikon ECLIPSE Ti2, זהה את מדווח CaFE בעוצמת לייזר של 30% עבור ערוץ GFP ורווח של 75. גודל חור הסיכה עבור סריקת לייזר קונפוקלית Nikon ECLIPSE Ti2 הוא 30 מיקרומטר.
- עבור הדיסק המסתובב של Andor Dragonfly באמצעות מצלמת Zyla, זהה את מדווח CaFE בעוצמת לייזר של 30% עבור ערוץ GFP. גודל חור הסיכה עבור הדיסק המסתובב של אנדור שפירית הוא 40 מיקרומטר.
- התאם את הגדרות הלייזר וזמן החשיפה עבור כל דגימה שנבדקה.
- אם אתה משתמש ב-EAG28 (CaFE; PH-mCherry) או EAG25 (CaFE; H2B-mCherry), ודא שהערוץ האדום מוגדר לעוצמת לייזר שבה אות ה-mCherry נראה בקלות בנוסף לערוץ ה-GFP.
- עבור קונפוקל סריקת הלייזר Nikon ECLIPSE Ti2, זהה את מדווח mCherry בעוצמת לייזר של 15 עבור ערוץ ה-RFP ורווח של 130.
- עבור הדיסק המסתובב של Andor Dragonfly קונפוקלי באמצעות מצלמת Zyla, זהה את כתב ה-mCherry בעוצמת לייזר של 30% עבור ערוץ ה-RFP.
- התאם את הגדרות הלייזר וזמן החשיפה עבור כל דגימה שנבדקה.
- קבעו את קצב המסגרות או את הפריימים לשנייה (fps) במהירות שהמערכת מאפשרת.
הערה: מדווח CaFE נצפה בדרך כלל בכ-1 פריימים לשנייה עבור סריקת לייזר קונפוקלית של Nikon ECLIPSE Ti2 ו-10 פריימים לשנייה עבור הדיסק המסתובב של Andor Dragonfly קונפוקלי עם מצלמת Zyla. - בחר פרוטוקול טיים לאפס או סדרות זמן והתאם להגדרות הרצויות. השג תמונות דולג זמן למשך 30 דקות או פחות, כאשר אפשרות החזרות מוגדרת ל-'1'.
הערה: אם אירוע ההפריה מתרחש לפני השלמת מרווח הזמן, עצור את הווידאו כדי לשמור על גודל הקובץ. - אתר את התולעים בשקופית ובחר תולעת שבה נראית בלוטת המין הפרוקסימלית. המעי ובלוטת המין מתפתלים זה סביב זה בתוך התולעת. ככזה, זרוע בלוטת המין מוסתרת לעתים קרובות על ידי המעי, ומונעת הדמיה של הפריה. אם הביצית -1 מוסתרת, בחר תולעת אחרת להמחשה. כדי להגדיל את ההסתברות שלתולעת שנבחרה תהיה זרוע בלוטת מין גלויה, הרכיב מינימום 5 תולעים לכל שקופית. השתמש במבוגרים בתחילת היום הראשון כדי לדמיין הפריה.
- בדוק כל ביצית -1 בזרועות בלוטת המין של התולעת כדי לקבוע אם אירוע הפריה קרוב.
הערה: לפני ההפריה, במהלך ההתבגרות המיוטית, הגרעין בביצית -1 ינדוד לחלק האחורי של הביצית, והמעטפת הגרעינית תתמוסס. אירועים אלה נראים הן בערוצי Nomarksi והן בערוצי GFP באמצעות מדווח CaFE, ואירועים כאלה מצביעים על כך שהביוץ יתרחש בתוך ~10 הדקות הבאות. - לאחר פירוק המעטפת הגרעינית, השלד הציטולוגי של הביצית הפרוקסימלית ביותר, -1 יתארגן מחדש, יקבל מראה מעוגל וייפרד מהביצית -2. בשלב זה, הביוץ יתרחש בקרוב. התחל להקליט את הסרטון מיד אם נצפים אירועים אלה. צלם סרטונים בסביבה רחבה.
הערה: אם תנועת הגרעין או עיגול הביצית אינם נראים לאחר 20 דקות, לא סביר שיתרחש אירוע ביוץ. התמקדו בתולעת אחרת ו/או הכינו שקופית חדשה.
5. כימות מעברי סידן בהפריה של C. elegans
- כמת מעברי סידן מסרטוני הפריה באמצעות תוכנת מערכת מיקרוסקופ כגון Nikon NIS Elements (מתואר כאן). ImageJ/FIJI מתאימים גם לניתוח תמונות11.
- כדי לכמת את השינוי בקרינה של סרטוני הפריה, השתמש בערכי האות הבאים: האות בזמן 0, האות ממסגרת העניין ואות הבסיס.
- זהה את הזמן והמסגרת הלוכדים את פרץ הקרינה הראשון המתרחש בביצית -1. הגדר מסגרת זו כזמן 0.
- כדי לקבל את האות ממסגרת העניין, צייר את אזור העניין (ROI) כך שיקיף את האזורים הבאים: הביצית -1 לפני ההפריה, הזרע והביצית המופרית החדשה ברחם. האות המוצג בהחזר ה-ROI נקרא F1.
הערה: ודא שהחזר ה-ROI מכסה את כל האזור הנסחר על ידי הביצית. ההחזר על ההשקעה צריך להיות זהה בכל פריים של הקלטת ה-Time-lapse המנותחת. - הגדר אזור ריק בתמונה ללא פלואורסצנטיות באמצעות אותם ממדים כמו ההחזר על ההשקעה שהוגדר בשלב 5.4 על מנת לחשב את אות הרקע בכל פריים. הפחיתו את אות הרקע מכל פריים.
- כדי להשיג את אות הבסיס (F0), אתר את המסגרת במינימום של 15 פריימים לפני זמן 0. באמצעות אותו החזר ROI כמו בשלב 5.4, שים לב לאות בכל מסגרת עד לזמן 0. ממוצע של האותות (עם חיסור רקע) ממסגרת ההתחלה עד לזמן 0 כדי לחשב את האות הבסיסי.
- חשב את השינוי בקרינה (ΔF) באמצעות הנוסחה הבאה:
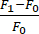 . F1 מוגדר בכל מסגרת כאות בהחזר ה-ROI ללא אות הרקע. הוא F0 הוא האות הפלואורסצנטי הממוצע של ≥15 פריימים לפני זמן 0, כפי שמחושב בסעיף 5.6.
. F1 מוגדר בכל מסגרת כאות בהחזר ה-ROI ללא אות הרקע. הוא F0 הוא האות הפלואורסצנטי הממוצע של ≥15 פריימים לפני זמן 0, כפי שמחושב בסעיף 5.6. - קבע את קצב השינוי בין מסגרות על ידי הפחתת השינוי בקרינה בין 2 פריימים וחלוקה בזמן.
6. RNAi ב - C. elegans
- הכן לוחות RNAi
- הכן צלחות לפי שלב 1.1 והוסף את הריאגנטים הנוספים הבאים כדי לאפשר הפלת גנים באמצעות RNAi בשלב 6.1.4.
- הוסף 1 מ"ל של איזופרופיל β-d-1-thiogalactopyranoside (IPTG) מסונן סטרילי 1 M (מומס במים נטולי יונים) לריכוז סופי של 1 מ"מ IPTG במדיה (ראה טבלת חומרים).
- הוסף 1 מ"ל של 100 מ"ג/מ"ל אמפיצילין מסונן סטרילי (מומס במים נטולי יונים) לריכוז סופי של 100 מיקרוגרם/מ"ל אמפיצילין במדיה (ראה טבלת חומרים). לחלופין, השתמש ב-40 מיקרוגרם/מ"ל קרבניצילין12.
- מערבבים בעדינות אך ביסודיות כדי לערבב ולשפוך צלחות כמתואר בשלבים 1.1.4 - 1.1.5.
- הכנת תרבית רוויה RNAi
- חשב את כמות התרבות הרוויה על ידי הכפלת מספר לוחות ה-RNAi הזרעים הדרושים ב-300 מיקרוליטר בעת שימוש בלוחות של 60 מ"מ על 15 מ"מ או ב-100 מיקרוליטר בעת שימוש בלוחות של 35 מ"מ על 10 מ"מ.
- באמצעות טכניקה סטרילית, יש לגדל חיידקי RNAi רצויים ב-LB (המתואר בשלבים 1.2.1-1.2.3) המכילים 100 מיקרוגרם/מ"ל אמפיצילין למשך הלילה ב-37 מעלות צלזיוס עד לרוויה. כלול זן חיידקי המכיל את הווקטור הריק L4440 כבקרה שלילית וזן חיידקי המכיל בקרה חיובית של RNAi (למשל, ביצה-5) כדי לוודא שה-RNAi פועל. בנוסף, כלול תנאי "ריק" המכיל LB בלבד כדי לוודא שאין זיהום ב-LB המלאי.
- הוסף IPTG מסונן סטרילי לריכוז סופי של 1 מ"מ לתרבית הלילה הרוויה לאינדוקציה של ביטוי dsRNA ודגירה למשך שעתיים ו-30 דקות לפחות ב-37 מעלות צלזיוס לפני הזריעה. לחלופין, יש לדלל בחזרה את תרבית הלילה הרוויה מחוץ לשלב היומן לפני השראת IPTG.
הערה: IPTG כלול הן בצלחות והן בתרבית הרוויה לביטוי dsRNA אופטימלי. - באמצעות טכניקה סטרילית, העבירו 300 מיקרוליטר מהתרבית המושרה למרכז צלחת RNAi בגודל 60 מ"מ על 15 מ"מ (מוצקה). לחלופין, השתמש ב-100 מיקרוליטר של תרבית רוויה עבור צלחת של 35 מ"מ על 10 מ"מ.
- הניחו לצלחות להתייבש ב-RT למשך 1-3 ימים עד שכתם חיידקי ה-RNAi כבר לא נוזלי. ודא שהצלחות יבשות ונקיות מזיהום לפני השימוש. אחסן צלחות בטמפרטורה של 4 מעלות צלזיוס הפוך לשימוש עתידי.
הערה: השתמש בלוחות RNAi בהקדם האפשרי להפלה אופטימלית, מכיוון שיעילות ה-RNAi פוחתת עם הזמן. יש להשליך אם > חודש.
- כמתואר בסעיף 2, סנכרן את התולעים על לוחות RNAi.
- בדוק תולעים 1-2 ימים לאחר סנכרון הטלת הביצים לאיתור עיכובים התפתחותיים.
- חלק מה-RNAi עלול לגרום לפגמים התפתחותיים כאשר הנוקדאון מתחיל בהטלת הביצה. במידת הצורך, הנח תולעים על לוחות ה-RNAi בשלב מאוחר יותר, כגון L3.
- כמתואר בסעיפים 3 ו-4, הרכיבו את התולעים והתכוננו להדמיה באמצעות כל מערכת מיקרוסקופ המצוידת בזיהוי פלואורסצנטיות GFP.
7. הדמיית סידן במהלך אמבריוגנזה מוקדמת ב - C. elegans
- סנכרן תולעים כמתואר בסעיף 2. השתמש בזן EAG28, המשלב את מדווח CaFE וסמן דומיין-הומולוגיה-mCherry המדגיש את גבול קרום הפלזמה. לחלופין, כדי לדמיין עוברים מופרים מחוץ לרחם, חתכו בעדינות את התולעת לאורך הרחם באמצעות מחט מזרק סטרילית כדי לשחרר את העוברים.
- הכן תולעים או עוברים להדמיה כמתואר בסעיף 3, ופעל לפי אותן הוראות המתוארות בסעיף 4 לקביעת פרמטרי הדמיה.
- מרכז את אזור העניין ברחם התולעת כדי לדמיין עוברים או ביצה מוטלת.
- עבור עוברים ברחם, ודא שהרחם אינו מאחורי המעי, הרחם אינו צפוף, וכי התאים הבודדים בעובר ברורים במישור המוקד.
- עבור ביציות מחוץ לרחם, ודא ששלבי התאים לא עברו את שלב הפסיק של מחזור החיים של התולעת.
- בחר פרוטוקול טיים לאפס או סדרות זמן והתאם להגדרות הרצויות.
- להדמיה אופטימלית של מעברי סידן עובריים, הגדל את הגדרות הזמן לסרטים ממושכים. יש לזכור כי חשיפה מתמדת ללייזר תפגע בעובר לאורך זמן.
- צלם סרטונים או תמונות על ידי התמקדות בתאים בעוברים בשלב התא הרצוי.
- השתמש במטרת טבילה של פי 40 ומעלה להדמיה, אם כי הארעיים מזוהים בקלות באמצעות מטרת אוויר פי 20.
תוצאות
באמצעות הפרוטוקולים המתוארים בכתב יד זה, הדפוסים הדינמיים של איתות סידן בהפריה ובאמבריוגנזה נצפו ב - C. elegans.
רצף הפריה טיפוסי בתולעים המכילות את מדווח ה-CaFE מוצג באיור 2. כדי להקל על הניתוח, נעשה שימוש בזן EAG28 המשלב את מדווח CaFE עם תחום הומולוגיה של pleckstrin (PH-mCherry) טרנסגן13. סמן PH-mCherry מתמקם בקרום הפלזמה ומאפשר הדמיה קלה יותר של גבולות התא, במיוחד בזרוע בלוטת המין. זן EAG28 נוצר על ידי הכלאה של זן EAG16 המכיל את מדווח CaFE עם זן OD70 PH-mCherry reporter13. ב - C. elegans, ביוץ והפריה מתרחשים בו זמנית. זמן 0 של הפריה נחשב למסגרת הראשונה שבה מזוהה אות פלואורסצנטי בביצית הביוץ (איור 2). פרץ בהיר של פלואורסצנטיות מתרחש באתר איחוי הזרע ברגע שהקצה המוביל של הביצית נכנס לזרע, איבר האחסון של הזרע7. האות מופיע לפני השלמת הביוץ. גל הסידן הוא דו-פאזי, עם התפרצות ראשונית מהירה ואחריה גל של פלואורסצנטיות מנקודת הכניסה לכיוון הקוטב הנגדי. הביצית כולה הופכת פלואורסצנטית תוך <30 שניות.
שימו לב שמדווח ה-CaFE נמצא בעותק יחיד, ולכן האות אינו בהיר כמו טרנסגנים אחרים. Z-stack זמן-lapse אינו מומלץ במהלך הביוץ אלא אם כן דיסק מסתובב קונפוקלי זמין ומותאם. ניתן להשיג תמונות מחסנית Z לפני או אחרי סרט כדי ללכוד שינויים תלת מימדיים במורפולוגיה של בלוטת המין. למרות שהתמונות כאן צולמו במיקרוסקופ קונפוקלי, הארעיות נצפו גם באמצעות מיקרוסקופ פלואורסצנטי רחב שדה שהוא נפוץ וזול יותר מאשר קונפוקלי. באמצעות קונפוקל סריקת לייזר, קצב הפריימים הוא כ-1 פריימים לשנייה. באמצעות קונפוקל דיסק מסתובב, קצב הפריימים הוא 10 פריימים לשנייה או מהיר יותר. אות הרקע של מדווח CaFE מספיק כדי להאיר את הביציות המתבגרות בזרוע בלוטת המין. עם ההפריה, נצפית בדרך כלל עלייה של פי 1.5-2 בעוצמת אות GFP.
קיימות מספר שיטות חלופיות לכימות לדוגמה, לתוכנת ניתוח התמונות של Imaris, שנוצרה על ידי Oxford Instruments (אותה חברת אם של המיקרוסקופ הקונפוקלי של הדיסק המסתובב Andor Dragonfly), יש את היכולת לכמת את האות בכל פריים רק מהביצית החולפת במקום החזר ROI גדול יותר. עם זאת, תוכנת Imaris אינה חינמית. בנוסף, אסטרטגיית ניתוח תמונה מפורטת למדידת גלי סידן בביצית תוארה בפירוט מצוין על ידי טקיאמה, פוג'יטה ואונאמי ומשתמשת ב-ImageJ, הזמין בחינם14. לחלופין, קימוגרפים להמחשת גל האות הפלואורסצנטי על פני ביצית בודדת דורשים מניפולציה נרחבת יותר של התמונה ממה שמתואר כאן, אך מתוארים ב-Takayama ו-Onami3.
יתרון מובהק של C. elegans הוא יכולתו להפיל את הביטוי של כמעט כל גן על ידי הזנת חיידקי התולעים המבטאים dsRNA כדי להפעיל RNAi אנדוגני15,16. לביטוי dsRNA אופטימלי, גם לוחות ה-RNAi וגם תרבית ה-RNAi הרוויה מכילים IPTG. ה-dsRNA מיוצר על ידי ביטוי הגן המעניין עם מקדמים מאגפים. כאן, השתמשנו בספריית Ahringer המכוונת לרוב הגנום של התולעת באמצעות שימוש ב-16,256 זני חיידקים17. לחלופין, ORFeome של ~11,000 שיבוטי RNAi נוצר על ידי מעבדת Vidal באמצעות מערכת Gateway וזמין לרכישה דרך Horizon Discovery18.
כדי להדגים את התועלת של מדווח CaFE בשילוב עם RNAi, בדקנו ביוץ מוקדם. מחיקה חלקית ב-ipp-5 גורמת לאירוע ביוץ כפול שבו גם הביצית -1 וגם הביצית -2 נכנסות לזרע הזרע במהלך אותו ביוץ19. IPP-5 הוא פוספטאז הפועל על IP3 ומפחית ביעילות את רמות השליח השני IP3. מצאנו כי הפלת RNAi של ipp-5 מעוררת פנוטיפ ביוץ כפול הדומה למוטנט.
ניתוח של מדווח CaFE במהלך הביוץ הכפול שנגרם על ידי נוקדאון ipp-5 RNAi חשף היבטים חדשים של ה-OET. ראשית, אות סידן נצפה מיד עם הכניסה לתוך הזרע בביצית המובילה -1 אך לא בביצית -2 הנגררת (איור 3). למרות ש-2 ביציות מבייצות, הביצית -1 היא עדיין הביצית היחידה שמראה סימני התבגרות תקינה, בפרט, פירוק המעטפת הגרעינית (NEBD). נתונים אלה מצביעים על כך שלמרות שהביצית -2 נמצאת בנוכחות זרע, היא אינה כשירה להפריה מכיוון שהיא עדיין לא הבשילה כראוי. שנית, הביצית -2 מציגה גל סידן מושהה, בדרך כלל כאשר הביצית יוצאת מהזרע לרחם. למרות שהבשלת הביציות היא בדרך כלל תנאי מוקדם לביוץ, נתונים אלה מצביעים על כך שהבשלת הביצית והיכולת להפריה עדיין יכולים להתרחש לאחר הביוץ. ההדמיה של גל הסידן המושהה במהלך נוקדאון ipp-5 מדגישה את היתרונות של מדווח CaFE לחקירת יכולת ההפריה והתזמון.
יתר על כן, גילינו כי מדווח ה-CaFE ניתן לזיהוי בביצים מוטלות וחושף מעברי סידן חד-תאיים במהלך האמבריוגנזה המוקדמת ב-C. elegans. עוברים מיום 1 בוגר מסונכרן EAG28 (CaFE; תולעי PH-mCherry) צולמו באמצעות הפרוטוקולים מחלקים 1-5 עם דיסק מסתובב של Andor Dragonfly קונפוקלי באמצעות מצלמת Zyla (איור 4). ארעי הסידן מוגבלים לתאים בודדים ולוקח פחות זמן מגל הסידן להפריה להשלים (~9 שניות, n=11). עם זאת, נראה שגל הסידן במהלך האמבריוגנזה אינו דו-פאזי. מעברי סידן לא נצפו לפני שלב 8 התאים. יש לציין כי סידן אינו מתמקם בתלם המחשוף ב-C. elegans, כפי שניתן לראות באורגניזמים רבים אחרים, כולל בני אדם ו-Xenopus 20,21,22. מעברי סידן חד-תאיים נצפו זמן רב לאחר הקיבה (~200 דקות לאחר ההפריה) ובביצים מטילות. עובר בודד מציג מספר מעברי סידן לאורך זמן אך בתאים שונים ובדרך כלל תא אחד בכל פעם. שימו לב שחשיפה מתמשכת לגירוי לייזר תפגע בעוברים. מומלץ להשתמש בעוצמת LED/לייזר נמוכה יותר או בחשיפה לא רציפה. עם זאת, מכיוון שגלי הסידן קצרים יחסית ב-~9 שניות, איננו ממליצים על איטיות מ-2 שניות בין אירועי גירוי LED/לייזר.
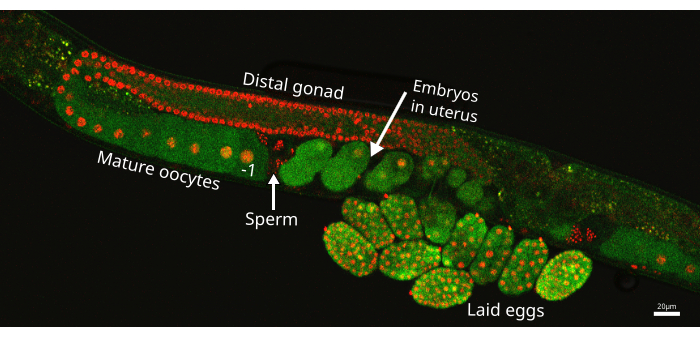
איור 1: זרוע בלוטת המין C. elegans . תמונה של זרוע בלוטת מין אחת מזן התולעת EAG25, המציגה את מדווח CaFE GFP (ירוק) ואת סמן ההיסטון 2B-mCherry (אדום), המדגיש גרעינים בקו הנבט. הביצית הפרוקסימלית מסומנת על ידי -1 ישירות לפני הזרע, שם מאוחסן הזרע (חץ). העובר הממוקם הכי קרוב לזרע הזרע אך בתוך הרחם הוא העובר האחרון. התמונה צולמה באמצעות קונפוקל סריקת הלייזר Nikon ECLIPSE Ti2. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
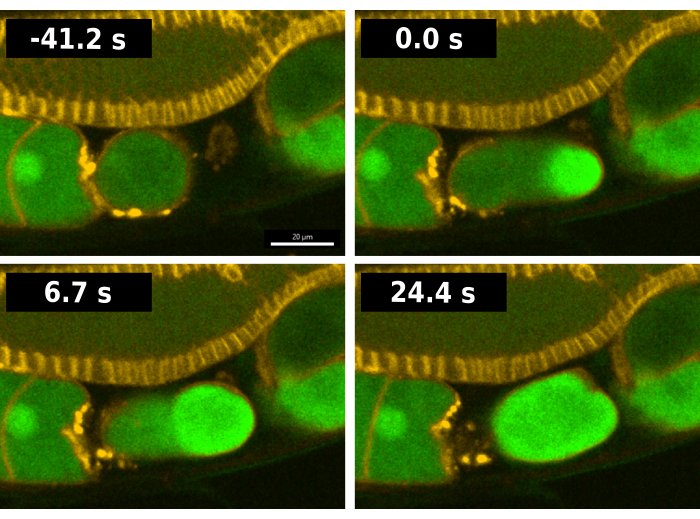
איור 2: הדמיה של גל הסידן במהלך ההפריה. תמונות סדרות זמן של פלואורסצנטיות המשקפות סידן תוך תאי במהלך הפריה בזן התולעת EAG28. זן EAG28 מכיל גם את מדווח CaFE (ירוק) וגם את היתוך הדומיין של פלקסטרין-הומולוגיה (צהוב), המדגיש את ממברנות הפלזמה. זמן 0 מציין את המסגרת הראשונה המתארת עלייה ברורה באות הפלואורסצנטי בביצית. זמן 24.4 שניות משקף את המסגרת הראשונה המציגה פלואורסצנטיות ביצית שלמה. תמונות מסדרות הזמן צולמו באמצעות הדיסק המסתובב של Andor Dragonfly עם מצלמת Zyla. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
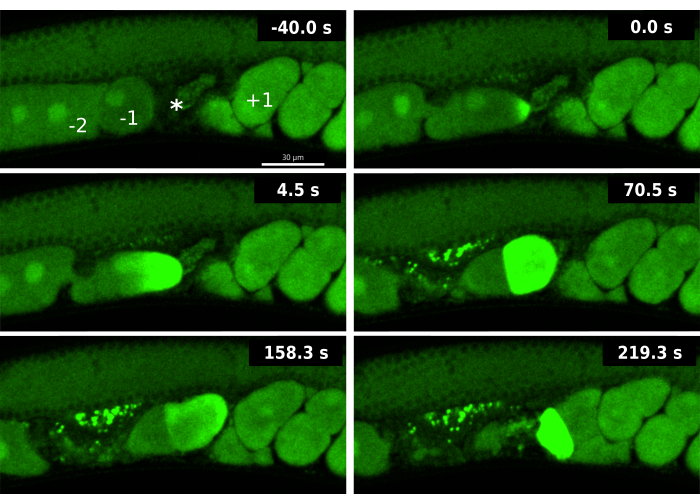
איור 3: גלי סידן במהלך אירוע ביוץ כפול המושרה על ידי ipp-5 RNAi. תמונות זמן-lapse של גלי סידן עוקבים של הביצית -1 והביצית -2 בזן EAG16 (CaFE בירוק GFP) שנחשפו ל-ipp-5 RNAi. מסגרת ה-40.0 s כוללת תוויות עבור הביצית -1 (-1), -2 ביצית (-2), זרע זרע (*) ועובר +1 (+1). זמן 0 שניות מציג את העלייה הראשונית בקרינה של גל הסידן של הביצית -1. זמן 4.5 שניות מראה את גל הסידן מתפשט לעבר הקוטב הנגדי בביצית -1. זמן 70.5 שניות מציג פלואורסצנטיות של תא שלם בביצית -1 מלווה בביצית -2 באות GFP הבסיסי; שתי הביציות נמצאות בזרעונים. הביצית המופרית -1 והביצית הלא מופרית -2 נכנסות לרחם בזמן 158.3 שניות. ב-219.3 שניות, הביצית -2 מציגה גל סידן פלואורסצנטי מאוחר. התמונות צולמו באמצעות הדיסק המסתובב של Andor Dragonfly עם מצלמת Zyla. סרגל קנה מידה = 30 מיקרומטר אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
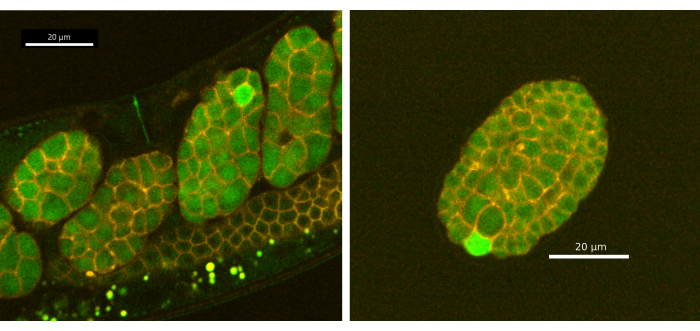
איור 4: מעברי סידן חד-תאיים באמבריוגנזה מוקדמת. (A) עוברים ברחם ו- (B) מחוץ לרחם (ביצה מטילה) הראו אות פלואורסצנטי בתא בודד במהלך האמבריוגנזה. התמונות צולמו באמצעות הדיסק המסתובב של Andor Dragonfly עם מצלמת Zyla. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
כלי פשוט עם פרוטוקול חזק הוא שילוב רב עוצמה להתמודדות עם שאלות מדעיות קשות. כאן, שיטות להדמיה של סידן כפרוקסי הניתן לזיהוי בקלות להפריה מוצגות באמצעות מדווח CaFE. אותו מדווח ממשיך לתוך האמבריוגנזה המוקדמת ומאפשר גם הדמיה של מעברי סידן בהמשך ההתפתחות. איתות סידן משמש כשליח שני קריטי התוחם שינויים גדולים בתפקוד התאי, במיוחד עבור ביולוגיה התפתחותית. בביצית, שלב ההתפרצות הראשון של גל הסידן מסמן לא רק את עיתוי ההפריה אלא גם את אתר איחוי הזרע3. ב - C. elegans, ציר ה- A-P נקבע גם על ידי אתר איחוי הזרע23. לכן, היכולת לדמיין סידן בביציות ובעוברים מאפשרת לחקור שאלות מורכבות שהן מרכזיות בביולוגיה של התא וההתפתחות.
השיטה המתוארת כאן עם כתב CaFE צריכה להיות פשוטה מספיק עבור טירונים בנמטודות. שיטות קודמות לאיתור גלי סידן בביציות של C. elegans הסתמכו על הזרקת צבע 3,8,14. בעוד שמחקרים אלה היו חשובים ומאירי עיניים, הזרקת צבע היא עתירת עבודה, וציוד הזרקה אינו זמין בכל מעבדה.
הפרוטוקולים המוצגים כאן עברו אופטימיזציה עבור תולעים בריאות. כדי למקסם את סיכויי ההצלחה, ודא שאין זיהום במצע התולעים או במדשאת החיידקים שממנה ניזונות התולעים. אין לחשוף את התולעים לתנאי עקה, כגון טמפרטורה, שכן אלה ישפיעו על הביוץ וההפריה. בנוסף, יש לכלול בקרות ליעילות RNAi בכל ניסוי מכיוון שהיעילות פוחתת עם הזמן. השתמש בבקרה חיובית ליעילות RNAi כמו ביצה-5, המייצר עוברים, אך לא צאצאים ברי קיימא מכיוון שהיווצרות קליפת הביצה נפגעת24. יתר על כן, יש לבצע אופטימיזציה של פרמטרי לכידת התמונה עבור כל מערכת מיקרוסקופיה. המפרט שלנו כלול כאן כהפניה, אך יש לצפות לסטיות. למרות שמערכת זו מזהה בקלות סידן ציטופלזמי כפרוקסי להפריה, היא לא בהכרח מייצגת אירוע איחוי זרע-ביצית בתום לב.
המגוון הרחב של כלים ומוטציות המופצים באופן חופשי בקהילת התולעים משפרים את התועלת של מדווח CaFE. המדווח משולב בגנום התולעת וניתן לחצות אותו בקלות לזנים מוטנטיים או מדווחים אחרים C. elegans 25. מדווח כאן על יצירת EAG25 המבטא את מדווח CaFE עם סמן היסטון H2B-mCherry כדי להמחיש גרעינים (איור 1) ו-EAG28 עם מדווח CaFE וסמן דומיין-mCherry של פלקסטרין, המדגיש את פריפריית התא (איור 2)13,26. שני הזנים מסייעים בהדמיה של תאים בקו הנבט ובמהלך האמבריוגנזה. יתר על כן, המתקן של RNAi ב
C. elegans, בשימוש עם מדווח CaFE, חשף תובנות חדשות לגבי יכולת ההפריה. כפי שמוצג בביוץ הכפול המושרה על ידי נוקדאון ipp-5 RNAi באיור 3, נוכחות של זרע וביצית ביוץ אינה מספיקה כדי לעורר אירוע הפריה.
תוצאות אלו מצביעות על כך שחייב להתקיים אות אחר, או היעדר מעכב, המאפשר לביצית להיות מופרית. הביצית המיויצת בטרם עת מציגה חולף סידן מושהה כאשר הביצית עוברת לתוך הרחם. גל סידן מאוחר זה מצביע על כך שביצית -2 שביוצה בטרם עת יכולה לפתח יכולת הפריה עם הזמן. אנו צופים כי מחקרים על עיתוי ההפריה, במיוחד בכל הנוגע לאיתות וויסות תאים, יסייעו בשימוש במדווח CaFE. בנוסף, מדווח ה-CaFE ממשיך לתוך האמבריוגנזה ומציג מעברי סידן חד-תאיים. איתות סידן עוברי זה דווח גם במהלך 24 השעות הראשונות להתפתחות דג הזברה27. תפקידם של מעברי הסידן אינו ידוע, אך נוכחותם מצביעה על אירוע איתות תאים במהלך ההתפתחות שטרם נחקר. יש לציין כי ארעי הסידן לא נצפו בזיגוטות שהופרו לאחרונה. לכן, סידן אינו מתמקם בתלם המחשוף כפי שתועד במספר אורגניזמים אחרים, כולל קסנופוס ובני אדם 20,21,22.
חשוב לציין, כתב CaFE קל מספיק לשימוש על ידי סטודנטים לתואר ראשון עם הכשרה מינימלית. עיצבנו וביצענו מעבדת CURE (ניסיון מחקר לתואר ראשון מבוססת קורס) עם 1 נקודות זכות לסטודנטים לביולוגיה עם הזנים והפרוטוקולים המתוארים כאן. במהלך סמסטר, הכיתה נפגשה פעם בשבוע למשך 3 שעות או פעמיים בשבוע למשך שעה ו-30 דקות כל אחת. לתלמידים ניתנה האפשרות לעבוד לבד או בקבוצות של 2. כל תלמיד/זוג בחר גן אחר למחקר מתוך רשימה שנאספה. הם ביצעו RNAi כנגד הגן שנבחר בזן EAG28 ובדקו תולעים להשפעות על פוריות, הפריה ו/או מורפולוגיה של בלוטת המין. על סמך תוצאותיהם וקריאת הרקע שלהם באמצעות ספרות ראשונית, התלמידים פיתחו השערות שיוכלו לבחון בניסויים הבאים. עיצוב איטרטיבי זה היה קריטי להגברת מעורבות התלמידים28. הסטודנטים רכשו ניסיון מחקרי אותנטי ורכשו מיומנויות באורגניזמים מודלים, מסכים גנטיים ומיקרוסקופיה פלואורסצנטית. בהתחשב בקלות השימוש בכתב CaFE, סטודנטים ללא ניסיון מחקרי הצליחו להצליח. לאחר מכן, הסטודנטים הביעו באופן גורף העדפה לפורמט CURE על פני שיעורי מעבדה מסורתיים, כאשר סטודנטים רבים הביעו רצון להמשיך במחקר. יחד, כלים ופרוטוקולים אלה מסייעים הן בחינוך והן במחקר של תהליכי התפתחות מוקדמים.
Disclosures
המחברים מצהירים שאין אינטרסים מתחרים או כלכליים.
Acknowledgements
KSKG מומן על ידי מענק מהמכון הלאומי לבריאות הילד והתפתחות האדם ע"ש יוניס קנדי שרייבר (R15HD111986). חלק מהזנים סופקו על ידי ה-CGC, הממומן על ידי המשרד לתוכניות תשתיות מחקר של ה-NIH (P40 OD4010440). אנו מודים ל-WormBase.
Materials
| Name | Company | Catalog Number | Comments |
| Agar | Fisher Scientific | DF0140-07-4 | 2 kg; Powder dissolves easier than flakes |
| Agarose | MidSci | BE-A125 | 500 g |
| Alcohol lamp | Fisher Scientific | S13475 | Use with 95% ethanol |
| Ammonium chloride (NH4Cl) | Fisher Scientific | AAA1500030 | 250 g |
| Ampicillin | Fisher Scientific | BP1760-5 | 5 g |
| AMSCO 400 Series Small Steam Sterilizer | Steris Healthcare | N/A | |
| Bacto-peptone | Fisher Scientific | BP1420-500 | 500 g |
| Bacto-tryptone | Fisher Scientific | DF0123-17-3 | 500 g |
| Calcium chloride (CaCl2) | Fisher Scientific | C69-500 | 500 g |
| Cholesterol | Thermo Scientific | A11470.18 | 50 g |
| Dragonfly 200 spinning disk confocal | Oxford Instruments Andor | N/A | Used with Leica microscope |
| Fisherbrand Superfrost Cytogenics Microscope Slides | Fisher Scientific | 22-035-900 | 144 slides per pack |
| Flat Nose Pliers, Smooth Jaw | Home Depot | 305530604 | Ensure pliers are smooth jaw |
| Isopropyl β- d-1-thiogalactopyranoside (IPTG) | Fisher Scientific | BP1755-10 | 10 g; dioxane-free |
| Laboratory tape | Fisher Scientific | 15-901-10R | 0.5 inch tape is used to tape microscope slides |
| Levamisole | Fisher Scientific | AC187870100 | 10 g |
| Magnesium sulfate (MgSO4) | Fisher Scientific | M63-500 | 500 g |
| Microscope cover glass | Fisher Scientific | 12541016 | 1 oz pack |
| Nikon ECLIPSE Ti2 laser scanning confocal | Nikon | N/A | |
| Nikon NIS Elements software | Nikon | N/A | Confocal |
| OP50 Escherichia coli | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Platinum Wire | TriTech | PT-9010 | |
| Potassium phosphate dibasic (K2HPO4) | Fisher Scientific | P288-500 | 500 g |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | AA1159436 | 500 g |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | 500 g |
| Sodium phosphate dibasic heptahydrate (Na2HPO4) | Fisher Scientific | S471-3 | 3 kg |
| Stereo microscope | Leica | KL300 LED | |
| Sterile Petri dish (35 mm x 10 mm) | CellTreat | 229638 | 960 Petri dishes per case |
| Sterile Petri dish (60 mm x 15 mm) | CellTreat | 229665 | 500 Petri dishes per case |
| Strain EAG16 spn-4p::jGCaMP7s::pie-1u | Caenorhabditis Genetics Center (CGC) | EAG16 | Created by Kim Guisbert Lab |
| Strain EAG25 spn-4p::jGCaMP7s::pie-1u; ujIs113 II. | Caenorhabditis Genetics Center (CGC) | EAG25 | Created by Kim Guisbert Lab |
| Strain EAG28 spn-4p::jGCaMP7s::pie-1u; unc-119(ed3) III; ltIs44 V. | Caenorhabditis Genetics Center (CGC) | EAG28 | Created by Kim Guisbert Lab |
| Strain JIM113 ujIs113 II [pie-1p::mCherry::H2B::pie-1 3'UTR + nhr-2p::his-24::mCherry::let-858 3'UTR + unc-119(+)] | Caenorhabditis Genetics Center (CGC) | JIM113 | Created by E. Preston - Murray Lab |
| Strain OD70 unc-119(ed3) III; ltIs44 V [pie-1p::mCherry::PH(PLC1delta1) + unc-119(+)] | Caenorhabditis Genetics Center (CGC) | OD70 | Created by Audhya/Oegema - Greenstein Lab |
| Tritech Worm Pick Handle | TriTech | TWPH1 | |
| Yeast extract | IBI Scientific | IB49160 | 500 g |
References
- Stein, P., Savy, V., Williams, A. M., Williams, C. J. Modulators of calcium signalling at fertilization. Open Biol. 10 (7), 200118 (2020).
- McAvey, B. A., Wortzman, G. B., Williams, C. J., Evans, J. P. Involvement of calcium signaling and the actin cytoskeleton in the membrane block to polyspermy in mouse eggs. Biolo Reprod. 67 (4), 1342-1352 (2002).
- Takayama, J., Onami, S. The sperm TRP-3 channel mediates the onset of a Ca 2+ wave in the fertilized C. elegans oocyte. Cell Rep. 15 (3), 625-637 (2016).
- Yamamoto, I., Kosinski, M. E., Greenstein, D. Start me up: Cell signaling and the journey from oocyte to embryo in C. elegans. Dev Dyn. 235 (3), 571-585 (2006).
- Hubbard, E. J. A., Greenstein, D. The Caenorhabditis elegans gonad: A test tube for cell and developmental biology. Dev Dyn. 218 (1), 2-22 (2000).
- Korta, D. Z., Hubbard, E. J. A. Soma-germline interactions that influence germline proliferation in Caenorhabditis elegans. Dev Dyn. 239 (5), 1449-1459 (2010).
- Toperzer, K. M., Brennan, S. J., Carroll, D. J., Guisbert, E. A., Kim Guisbert, ., S, K. Visualization of the biphasic calcium wave during fertilization in Caenorhabditis elegans using a genetically encoded calcium indicator. Biol Open. 12 (9), 059832 (2023).
- Samuel, A. D., Murthy, V. N., Hengartner, M. O. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol. 1 (1), 8 (2001).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nat Methods. 16 (7), 649-657 (2019).
- Golden, N. L., Plagens, R. N., Kim Guisbert, K. S., Guisbert, E. Standardized methods for measuring induction of the heat shock response in Caenorhabditis elegans. J Vis Exp. (161), e61030 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Kamath, R., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Kachur, T. M., Audhya, A., Pilgrim, D. B. UNC-45 is required for NMY-2 contractile function in early embryonic polarity establishment and germline cellularization in C. elegans. Dev Biol. 314 (2), 287-299 (2008).
- Takayama, J., Fujita, M., Onami, S. In vivo live imaging of calcium waves and other cellular processes during fertilization in Caenorhabditis elegans. Bio Protoc. 7 (7), e2205 (2017).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391 (6669), 806-811 (1998).
- Conte, D., MacNeil, L. T., Walhout, A. J. M., Mello, C. C. RNA Interference in Caenorhabditis elegans. Curr Protoc Mol Biol. 109, 1-30 (2015).
- Kamath, R. S., et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421 (6920), 231-237 (2003).
- Reboul, J., et al. elegans ORFeome version 1.1: experimental verification of the genome annotation and resource for proteome-scale protein expression. Nat Genet. 34 (1), 35-41 (2003).
- Bui, Y. K., Sternberg, P. W. Caenorhabditis elegans inositol 5-phosphatase homolog negatively regulates inositol 1,4,5-triphosphate signaling in ovulation. Mol Biol Cell. 13 (5), 1641-1651 (2002).
- Muto, A., Kume, S., Inoue, T., Okano, H., Mikoshiba, K. Calcium waves along the cleavage furrows in cleavage-stage Xenopus embryos and its inhibition by heparin. J Cell Biol. 135 (1), 181-190 (1996).
- Paudel, S., Sindelar, R., Saha, M. Calcium signaling in vertebrate development and its role in disease. Int J Mol Sci. 19 (11), 3390 (2018).
- Paudel, S., Yue, M., Nalamalapu, R., Saha, M. S. Deciphering the calcium code: A review of calcium activity analysis methods employed to identify meaningful activity in early neural development. Biomolecules. 14 (1), 138 (2024).
- Goldstein, B., Hird, S. N. Specification of the anteroposterior axis in Caenorhabditis elegans. Development. 122 (5), 1467-1474 (1996).
- Johnston, W. L., Dennis, J. W. The eggshell in the C. elegans oocyte-to-embryo transition. Genesis. 50 (4), 333-349 (2012).
- Stevenson, Z. C., Moerdyk-Schauwecker, M. J., Jamison, B., Phillips, P. C. Rapid self-selecting and clone-free integration of transgenes into engineered CRISPR safe harbor locations in Caenorhabditis elegans. G3. 10 (10), 3775-3782 (2020).
- Zacharias, A. L., Walton, T., Preston, E., Murray, J. I. Quantitative differences in nuclear β-catenin and TCF pattern embryonic cells in C. elegans. PLoS Genet. 11 (10), e1005585 (2015).
- Webb, S. E., Miller, A. L. Calcium signalling during zebrafish embryonic development. BioEssays. 22 (2), 113-123 (2000).
- Wiseman, E., Carroll, D. J., Fowler, S. R., Guisbert, E. Iteration in an inquiry-based undergraduate laboratory strengthens student engagement and incorporation of scientific skills. J Scholarsh Teach Learn. 20 (2), 99-112 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved