Method Article
Визуализация in vivo переходных процессов кальция во время оплодотворения и раннего развития у C. elegans
В этой статье
Резюме
Здесь мы представляем протоколы и инструменты для визуализации кальция во время оплодотворения и раннего эмбриогенеза с использованием генетически кодируемого кальциевого репортера, экспрессируемого в зародышевой линии модельной нематоды C. elegans.
Аннотация
Кальций является важной сигнальной молекулой во время перехода ооцитов в эмбрион (OET) и раннего эмбриогенеза. Гермафродитная нематода Caenorhabditis elegans имеет несколько уникальных преимуществ для изучения ОЭТ, поскольку она прозрачна и имеет упорядоченную гонаду, которая производит один зрелый ооцит каждые ~23 минуты при 20 °C. Мы модифицировали генетически кодируемый кальциевый индикатор jGCaMP7s таким образом, чтобы он флуоресцентно указывал на момент оплодотворения в живом организме. Мы назвали этот репортер "CaFE" для кальция во время оплодотворения у C. elegans. Репортер CaFE был спроектирован в безопасном месте в единственном экземпляре, не оказывает существенного влияния на физиологию или плодовитость и выдает надежный сигнал при оплодотворении. В данной работе представлен ряд протоколов для использования репортера CaFE в качестве инструмента in vivo для анализа OET и эмбриогенеза. Мы включаем методы синхронизации червей, изучения эффектов нокдауна РНК-интерференции, монтирования червей для визуализации, а также визуализации кальция в ооцитах и эмбрионах. Кроме того, мы представляем генерацию дополнительных штаммов червей, чтобы помочь в этом типе анализа. Демонстрируя полезность репортера CaFE для визуализации времени оплодотворения, мы сообщаем, что двойная овуляция происходит, когда ipp-5 является мишенью РНК-интерференции, и что только первый ооцит подвергается немедленному оплодотворению. Кроме того, здесь сообщается об открытии переходных процессов кальция в одиночных клетках во время раннего эмбриогенеза, демонстрирующее, что репортер CaFE сохраняется на ранних стадиях развития. Важно отметить, что репортер CaFE в червях достаточно прост для использования для включения в лабораторные классы бакалавриата на основе курсов исследований на основе курсов (CURE). Репортер CaFE в сочетании с упорядоченной гонадой и легкостью РНК-интерференции у червей облегчает исследование межклеточной динамики, необходимой для регуляции внутреннего оплодотворения и раннего эмбриогенеза.
Введение
Внесение удобрений знаменует собой начало нового жизненного цикла, но определить точный момент внесения удобрений непросто. Консервативным признаком оплодотворения является волна кальция через яйцеклетку сразу после слияния сперматозоидов1. Хотя природа кальциевой волны, с точки зрения частоты и скорости, различается у разных видов, почти все организмы демонстрируют временное увеличение внутриклеточного кальция после оплодотворения. Волна кальция играет решающую роль в блокировании полиспермии, активации яйцеклеток и других важных клеточных событиях2. Поскольку кальциевая волна инициируется в месте слияния сперматозоидов, кальций служит маркером для оплодотворения3.
Caenorhabditis elegans является идеальным модельным организмом для изучения раннего развития. Черви представляют собой прозрачных гермафродитов, которые генетически поддаются лечению4. Наиболее важным для изучения оплодотворения является то, что взрослые особи C. elegans непрерывно производят ооциты, используя строго упорядоченную гонаду5. На самом деле, ооциты являются единственными новыми клетками, образующимися в постмитотическом состоянии во взрослом возрасте. На рисунке 1 выделена гонада, которая состоит из 2 симметричных U-образных трубок развивающихся ооцитов. Ооцит, ближайший к сперматеке (органу хранения сперматозоидов), называется ооцитом -1. Эта конвейерная конструкция гонады червя овулирует зрелый ооцит в сперматеке каждые ~23 минуты при 20 °C у молодых людей7. Затем вновь оплодотворенный эмбрион перемещается в общую матку, прежде чем быть заложенным через одну вульву.
Предыдущие методы визуализации кальция во время оплодотворения у C. elegans основывались на микроинъекции кальций-чувствительных красителей 3,8. Чтобы легче наблюдать за волной кальция при слиянии сперматозоида и яйцеклетки, генетически кодируемый индикатор кальция на основе jGCaMP7s был вставлен в единственном экземпляре в локус «безопасной гавани» с использованием кластеризованных регулярно чередующихся коротких палиндромных повторов (CRISPR)7,9. Репортер был назван CaFE для кальция во время оплодотворения у C. elegans. У репортера не проявляется никаких существенных дефектов в физиологии или плодовитости.
Здесь представлены протоколы визуализации кальциевой волны в ооцитах и эмбрионах C. elegans с использованием репортера CaFE. В сочетании с множеством инструментов, доступных в сообществе червей, таких как РНК-интерференция (РНК-интерференция) и маркеры гонад mCherry, репортер CaFE облегчает исследование регуляции внутренних событий оплодотворения, в частности, компетентности в оплодотворении и времени оплодотворения. Кроме того, репортер CaFE сохраняется на ранних стадиях развития и является уникальным инструментом для исследования эмбриогенеза.
протокол
1. Уход за C. elegans
- Подготовка тарелок для питательной среды нематоды (NGM)
- Смешайте 3 г хлорида натрия (NaCl), 2,5 г бакто-пептона, 20 г агара и 1 л деионизированной воды в колбе объемом 4 л (см. Таблицу материалов). Перед автоклавированием накройте верхнюю часть колбы алюминиевой фольгой.
- Автоклав для стерилизации с использованием настроек цикла жидкой стерилизации. Рекомендуется цикл стерилизации, установленный при температуре 121 °C в течение 30 минут.
- Дайте смеси остыть до ~50 °C, примерно 20 минут при комнатной температуре (RT).
- Добавьте 25 мл стерильного 1 M KH2PO4 (растворенного в воде, pH = 6), 1 мл стерильного 1 M CaCl2 (растворенного в воде), 1 мл стерильного 1 M MgSO4 (растворенного в воде) и 1 мл холестерина 5 мг/мл (растворенного в 100% этаноле), осторожно взбивая после каждого добавления (см. Таблицу материалов).
- Используя стерильную технику, переложите часть смеси в стерильный стакан объемом 300 мл для более удобного наливания. Налейте теплый слой так, чтобы он покрыл дно тарелки.
ПРИМЕЧАНИЕ: Приблизительно 10 мл на планшет в стерильных чашках Петри размером 60 мм x 15 мм (см. Таблицу материалов) получится 100 планшетов. В качестве альтернативы можно использовать стерильные чашки Петри размером 35 мм x 10 мм, где ~4 мл на тарелку дадут ~250 тарелок. - Дайте планшетам NGM высохнуть при RT не менее 1 суток перед посевом бактериями. Храните тарелки вверх дном при температуре 4 °C для дальнейшего использования.
- OP50 бактериальная подготовка газона
- Приготовьте бульон Luria (LB), смешав 5 г дрожжевого экстракта, 10 г Bacto-Tryptone, 5 г NaCl и 1 л деионизированной воды в колбе объемом 2 л (см. Таблицу материалов). Используя тарелку для перемешивания и перемешивание, перемешайте до полного растворения.
- Аликвоту ЛБ разложить по бутылкам и автоклавировать с использованием настроек цикла жидкой стерилизации. Рекомендуется цикл стерилизации, установленный при температуре 121 °C в течение 30 минут. Если вы используете емкость с завинчивающейся крышкой, ослабьте завинчивающуюся крышку на четверть оборота для надлежащей вентиляции во время цикла автоклава.
- Перед использованием дайте бульону остыть до температуры RT.
- Используя стерильную методику, ввести 50 мл LB в колбу Эрленмейера объемом 250 мл с бактериями OP50 и вырастить в течение ночи при 37 °C при встряхивании.
- Используя стерильную технику, перенесите 300 мкл насыщенной культуры на центр планшета NGM размером 60 мм x 15 мм. Для планшетов размером 35 мм x 10 мм рекомендуется 100 мкл насыщенной культуры.
- Дайте планшетам высохнуть при RT в течение 1-3 дней, пока бактериальное пятно OP50 не перестанет быть жидким. Перед использованием убедитесь, что пластины сухие и на них нет загрязнений. Храните пластины при температуре 4 °C для дальнейшего использования. Хранение пластин в перевернутом положении уменьшает образование конденсата на поверхности пластины.
- Конструкция червячной кирки
- Ослабьте серебряный воротник по направлению к головке ручки червячной кирки (см. Таблицу материалов), осторожно открутив его так, чтобы четыре секции разошлись.
- Отрежьте 1,5 дюйма (примерно длину большого пальца) платиновой проволоки (см. Таблицу материалов) с помощью ножниц и поместите ее в середину четырех секций; Из ручки будет торчать примерно на дюйм.
- Удерживайте проволоку в центре, затягивая хомут; Четыре секции соединятся посередине и удерживают платиновую проволоку на месте.
- Аккуратно сформируйте проволоку с помощью плоскогубцев с плоским носиком. Радужная или дуговая форма, как правило, лучше всего подходит для выбора.
- Создайте около 2-3 мм «ноги» на конце проволоки, многократно зажимая плоскогубцами. Используйте эту «ножку», чтобы поднять червей, и держите «ногу» плашмя к поверхности пластины.
ПРИМЕЧАНИЕ: Слишком сильный зажим приведет к резью платиновой проволоки. Избегайте создания острых краев с помощью плоскогубцев с плоским носиком (или аналогичных), чтобы предотвратить прокол червей или пластин.
- Работа с червями
- Держите червячную кирку так же, как карандаш, и простерилизуйте «лапку», поместив проволоку в пламя лампы из 95% этанола до тех пор, пока она не станет ярко-оранжевой.
- Поместите пластину с семенами OP50 на столик для препарирования и снимите крышку. Осторожно прикоснитесь «ножкой» кирки к участку бактериального газона и легкими движениями смахивайте бактерии на дно. Бактерии, прилипшие к кирке (называемые «слизью»), будут действовать как клей для сбора червей.
- Переместите тарелку с червями на столик для препарирования и снимите крышку, не допуская касания киркой других поверхностей. Быстро и осторожно коснитесь «ножкой» кирки червячка, чтобы поднять его. Этот метод позволяет одновременно перемещать несколько червяков между пластинами.
- Аккуратно прикоснитесь «ножкой» кирки к незасеянной части новой пластины, чтобы перенести червей; Как правило, это та же самая пластина, с которой были взяты бактерии в разделе 1.4.2.
- Стерилизуйте кирку между каждой пластиной и/или червячным штаммом, чтобы избежать загрязнения и дать кирке остыть после стерилизации.
ПРИМЕЧАНИЕ: Прикосновение горячей кирки к червю вызовет стресс или убьет животное. Червячная кирка охлаждается после прикосновения к бактериальной лужайке, чтобы собрать «слизь» для передачи червей.
- Поддерживайте червей при температуре 20 °C на планшетах NGM (шаг 1.1), засеянных бактериями кишечной палочки OP50 (шаг 1.2). Пассаж червей 2 - 3 раза в неделю, пересаживая нескольких взрослых особей в свежие тарелки (60 мм х 15 мм) с помощью червячной кирки (шаги 1.3-1.4), чтобы избежать голодания, которое может изменить физиологию.
ПРИМЕЧАНИЕ: Штаммы C. elegans и бактерии OP50 доступны в Центре генетики Caenorhabditis (CGC).
2. Синхронизация развития C. elegans
- Синхронизируйте возраст червей с помощью временной кладки яиц (описано здесь). Если для работы в классе или для других целей требуется большое количество червей, выполните синхронизацию отбеливателя, как описано в Golden et al.10.
- Пересадите взрослых червей на новую засеянную пластину OP50 с помощью отмычки из платиновой проволоки (описанной в разделе 1). Количество червей продиктовано экспериментальной необходимостью. В 1 день черви откладывают примерно 3 яйца в час. Таким образом, 10 червей произведут примерно 30 яиц за 1 ч. Предпочтительно использовать глистов в первый день взрослой жизни (День 1).
- Примерно через 1 ч удалите взрослых червей из тарелки, оставив только яйца.
ПРИМЕЧАНИЕ: Случайное оставление червя является распространенной ошибкой. Оставшиеся черви продолжат откладывать яйца и нарушать синхронизацию. Черви созревают до взрослых особей 1-го дня примерно через 72 ч после откладки при инкубации при 20°C.
3. Монтажные червячки для визуализации
- При визуализации событий оплодотворения используйте взрослые в первый день, чтобы максимизировать возможности визуализации.
ПРИМЕЧАНИЕ: В 1-й день у взрослых ооцит оплодотворяется каждые ~23 минуты. Однако с возрастом овуляция замедляется, и типичный гермафродит прекращает откладывать яйца после 4-го дня. - Приготовьте раствор 3% агарозы в воде, смешав 3 г агарозы со 100 мл воды. Нагрейте раствор агарозы с помощью микроволновой печи до полного растворения агарозы. Чтобы повторно использовать застывший раствор, нагрейте до полного растворения. После нескольких использований сгенерируйте новое решение.
- Поместите пустое предметное стекло для визуализации между двумя другими предметными стеклами, на которые наложен один слой лабораторной ленты по длинной оси предметного стекла (см. Таблицу материалов). Лента создает прокладку для агарозной прокладки, обеспечивая равномерное распределение и равномерную ширину. Убедитесь, что три предметных стекла расположены в ряд так, чтобы длинные стороны соприкасались: два предметных стекла с лентой, которые обрамляют пустое предметное стекло микроскопа.
- Капните нагретый 3% раствор агарозы (~100-150 мкл) на центр предметного стекла микроскопа, который находится между скотчанными стеклами, с помощью пипетки объемом 1 мл.
- Быстро поместите новое предметное стекло микроскопа на агарозную каплю, убедившись, что новое предметное стекло перпендикулярно предметному стеклу с агарозной каплей и лежит поперек соседних скотчем предметных стекол.
- Аккуратно отделите горки. Избегайте разрыва прокладки.
- Подготавливайте агарозные подушечки свежими каждый день для визуализации. При подготовке к визуализации рекомендуется делать несколько подушечек, но воздерживаться от одновременного воздействия более чем на одну прокладку. Открытые подушечки будут быстро высыхать.
- С помощью пипетки объемом 20 мкл добавьте небольшую каплю (~7 мкл) 1 мМ левамизола в буфере M9 в центр агарозной подушечки, чтобы парализовать червей. Используйте стерилизованный фильтром 100 мМ стоковый раствор левамизола, чтобы получить рабочий раствор 1 мМ.
- Чтобы сделать буфер M9, смешайте 6 г Na2HPO4, 3 г KH2PO4, 0,5 г NaCl, 1 г NH4Cl и 1 л деионизированной воды в подходящей емкости (см. Таблицу материалов).
- Автоклавируйте раствор с использованием настроек цикла жидкой стерилизации и дайте раствору остыть до температуры RT перед использованием. Если вы используете емкость с завинчивающейся крышкой, ослабьте завинчивающуюся крышку примерно на четверть оборота для надлежащей вентиляции. Рекомендуется цикл стерилизации, установленный при температуре 121 °C в течение 30 минут.
- Выберите не менее 5 синхронизированных червей и аккуратно прикоснитесь «лапкой» к капельке левамизола, чтобы перенести всех червей. Используйте не менее 5 червей на предметное стекло, так как ориентация тела может привести к тому, что кишечник будет затемнять зародышевую линию, блокируя визуализацию кальциевой волны в ооците.
ПРИМЕЧАНИЕ: Убедитесь, что черви быстро переносятся, так как левамизол испарится, если оставить его на агарозной подушечке дольше 5 минут. - Тщательно накройте агарозную подушечку покровным листом. Проверьте расположение червей, так как покровная крышка может привести к рассеиванию червей от первоначального размещения. Пометьте предметное стекло микроскопа соответствующими деталями, такими как название штамма червя (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Убедитесь, что визуализация сделана как можно скорее после посадки на червей, так как длительное воздействие левамизола токсично.
4. Визуализация кальция во время оплодотворения у C. elegans
- Определите местонахождение червей с помощью маломощного объектива, например 4x, на выбранном вами микроскопе. Используйте светлопольное освещение.
- Используйте минимум 20-кратный воздушный объектив для четкой визуализации волны кальция в ооцитах. Используйте объектив с эффектом погружения 40x или больше.
- В зависимости от используемой системы, интенсивность возбуждения обычно является фиксированной величиной. Для оптимальной визуализации флуоресцентных репортеров отрегулируйте усиление или время экспозиции.
ПРИМЕЧАНИЕ: Постоянный свет высокой интенсивности может повредить образец и вреден для здоровья червей. При желании выключите лазер во время ожидания события оплодотворения, чтобы избежать непрерывного освещения GFP. Ознакомьтесь с отличительными признаками события по внесению удобрений в разделах 4.8 - 4.9. - Убедитесь, что канал GFP с длиной волны 488 нм настроен на мощность лазера, где сигнал репортера CaFE хорошо виден.
- Для фокуса лазерного сканирования Nikon ECLIPSE Ti2 обнаруживайте репортер CaFE при мощности лазера 30% для канала GFP и коэффициенте усиления 75. Размер отверстия для конфокального лазера Nikon ECLIPSE Ti2 составляет 30 мкм.
- Для конфокального вращающегося диска Andor Dragonfly с помощью камеры Zyla обнаружите репортер CaFE при мощности лазера 30% для канала GFP. Размер отверстия для конфокального вращающегося диска Andor Dragonfly составляет 40 мкм.
- Отрегулируйте настройки лазера и время экспозиции для каждого исследуемого образца.
- При использовании модели EAG28 (CaFE; PH-mCherry) или EAG25 (CaFE; H2B-mCherry), убедитесь, что красный канал настроен на мощность лазера, где сигнал mCherry легко виден в дополнение к каналу GFP.
- Для фокуса лазерного сканирования Nikon ECLIPSE Ti2 определите репортер mCherry при мощности лазера 15 для канала RFP и усилении 130.
- Для конфокального вращающегося диска Andor Dragonfly с помощью камеры Zyla обнаружите репортер mCherry при мощности лазера 30% для канала RFP.
- Отрегулируйте настройки лазера и время экспозиции для каждого исследуемого образца.
- Установите частоту кадров или кадров в секунду (кадры в секунду) настолько быстро, насколько это позволяет система.
ПРИМЕЧАНИЕ: Репортер CaFE обычно наблюдается со скоростью около 1 кадра в секунду для конфокального лазера Nikon ECLIPSE Ti2 и 10 кадров в секунду для конфокального диска Andor Dragonfly с камерой Zilla. - Выберите протокол замедленной съемки или временного ряда и настройте нужные параметры. Получайте цейтраферные изображения в течение 30 минут или меньше, установив для параметра «Повторы» значение «1».
ПРИМЕЧАНИЕ: Если событие оплодотворения происходит до завершения временного интервала, остановите видео, чтобы сохранить размер файла. - Найдите червей на предметном стекле и выберите червя там, где видна проксимальная гонада. Кишечник и гонада закручиваются друг вокруг друга внутри червя. Таким образом, плечо гонады часто закрыто кишечником, что препятствует визуализации оплодотворения. Если яйцеклетка -1 затемнена, выберите другого червя для визуализации. Чтобы увеличить вероятность того, что выбранный червь будет иметь видимое плечо гонад, установите минимум 5 червей на одну горку. Используйте ранние взрослые особи 1-го дня для визуализации оплодотворения.
- Исследуйте каждый -1 ооцит в рукавах гонад червя, чтобы определить, является ли событие оплодотворения неизбежным.
Примечание: До оплодотворения, во время мейотического созревания, ядро ооцита -1 мигрирует в заднюю часть ооцита, и ядерная оболочка растворяется. Эти события видны как в каналах Nomarksi, так и в GFP с помощью репортера CaFE, и такие события указывают на то, что овуляция произойдет в течение следующих ~10 минут. - После распада ядерной оболочки цитоскелет наиболее проксимального, -1 ооцита перестраивается, приобретает округлый вид и отделяется от -2 ооцита. В этот момент овуляция произойдет в скором времени. Начните запись видео сразу же, если эти события наблюдаются. Снимайте видео в широкоугольной камере.
Примечание: Если движение ядра или округление ооцита не заметны через 20 минут, овуляция маловероятна. Сосредоточьтесь на другом червяке и/или подготовьте свежую горку.
5. Количественное определение переходных процессов кальция при оплодотворении C. elegans
- Количественное определение переходных процессов кальция из видеороликов об оплодотворении с помощью системного программного обеспечения микроскопа, такого как Nikon NIS Elements (описано здесь). ImageJ/FIJI также подходят для анализа изображений11.
- Чтобы количественно оценить изменение флуоресценции видео с оплодотворением, используйте следующие значения сигнала: сигнал в момент времени 0, сигнал из интересующего кадра и базовый сигнал.
- Определите время и кадр, которые фиксируют первый всплеск флуоресценции, происходящий в -1 ооците. Определите этот кадр как время 0.
- Чтобы получить сигнал от исследуемой рамки, нарисуйте область интереса (ROI), охватывающую следующие области: -1 ооцит до оплодотворения, сперматеку и недавно оплодотворенный ооцит в матке. Сигнал, отображаемый в ROI, обозначается как F1.
ПРИМЕЧАНИЕ: Убедитесь, что ROI охватывает всю область, в которой ооцит перемещается. Рентабельность инвестиций должна быть одинаковой в каждом кадре анализируемой покадровой записи. - Определите пустую область изображения без флуоресценции, используя те же размеры, что и ROI, определенный на шаге 5.4, чтобы рассчитать фоновый сигнал в каждом кадре. Вычтите фоновый сигнал из каждого кадра.
- Чтобы получить сигнал базовой линии (F0), расположите кадр как минимум за 15 кадров до момента 0. Используя тот же ROI, что и в шаге 5.4, обратите внимание на сигнал на каждом кадре до момента 0. Усредняет сигналы (с вычитанием фона) от начального кадра до времени 0 для вычисления базового сигнала.
- Рассчитайте изменение флуоресценции (ΔF) по следующей формуле:
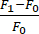 . F1 определяется в каждом кадре как сигнал в ROI без фонового сигнала. F0 — усредненный базовый флуоресцентный сигнал за ≥15 кадров до времени 0, рассчитанный в разделе 5.6.
. F1 определяется в каждом кадре как сигнал в ROI без фонового сигнала. F0 — усредненный базовый флуоресцентный сигнал за ≥15 кадров до времени 0, рассчитанный в разделе 5.6. - Определите скорость изменения между кадрами, вычитая изменение флуоресценции между 2 кадрами и деля на время.
6. РНК-интерференция у C. elegans
- Подготовка пластин РНК-интерференции
- Подготовьте планшеты в соответствии с шагом 1.1 и добавьте следующие дополнительные реагенты, чтобы обеспечить нокдаун гена с помощью РНК-интерференции на шаге 6.1.4.
- Добавьте 1 мл 1 М стерильно отфильтрованного изопропила β-d-1-тиогалактопиранозида (IPTG) (растворенного в деионизированной воде) для получения конечной концентрации 1 mM IPTG в среде (см. Таблицу материалов).
- Добавьте 1 мл 100 мг/мл стерильно отфильтрованного ампициллина (растворенного в деионизированной воде) до конечной концентрации 100 мкг/мл ампициллина в среде (см. Таблицу материалов). В качестве альтернативы можно использовать карбенициллин 40 мкг/мл12.
- Осторожно, но тщательно перемешайте и залейте тарелки, как описано в шагах 1.1.4 - 1.1.5.
- Приготовление насыщенной РНК-интерференцией культуры
- Рассчитайте количество насыщенной культуры, умножив количество необходимых засеянных пластин РНК-интерференции на 300 мкл при использовании планшетов размером 60 мм x 15 мм или на 100 мкл при использовании планшетов размером 35 мм x 10 мм.
- Используя стерильную методику, вырастите желаемые РНК-интерференционные бактерии в LB (описанные в шагах 1.2.1-1.2.3), содержащую 100 мкг/мл ампициллина, в течение ночи при 37 °C до насыщения. Включите бактериальный штамм, содержащий пустой вектор L4440 в качестве отрицательного контроля, и бактериальный штамм, содержащий положительный контроль РНК-интерференции (например, egg-5), чтобы убедиться, что РНК-интерференция работает. Кроме того, включите «пустое» условие, содержащее только LB, чтобы убедиться в отсутствии загрязнения в стандартном LB.
- Добавьте стерильно отфильтрованную IPTG до конечной концентрации 1 мМ к насыщенной в течение ночи культуре для индукции экспрессии дцРНК и инкубируйте не менее 2 ч 30 мин при 37 °C до посева. В качестве альтернативы можно разбавить насыщенную ночную культуру из логарифмической фазы перед индукцией с помощью ППЛГ.
ПРИМЕЧАНИЕ: IPTG входит как в планшеты, так и в насыщенную культуру для оптимальной экспрессии дцРНК. - Используя стерильную технику, перенесите 300 мкл индуцированной культуры на центр РНК-планшета размером 60 мм x 15 мм (затвердевшего). В качестве альтернативы используйте 100 мкл насыщенной культуры для планшета размером 35 мм x 10 мм.
- Дайте планшетам высохнуть при RT в течение 1-3 дней, пока бактериальное пятно РНК-интерференции не перестанет быть жидким. Перед использованием убедитесь, что пластины сухие и на них нет загрязнений. Храните тарелки при температуре 4 °C вверх дном для дальнейшего использования.
ПРИМЕЧАНИЕ: Используйте пластины РНК-интерференции как можно скорее для оптимального нокдауна, так как эффективность РНК-интерференции со временем снижается. Выбросьте, если возраст >1 месяц.
- Как описано в разделе 2, синхронизируйте червей на пластинах РНК-интерференции.
- Проверьте червей через 1-2 дня после синхронизации яйцекладки на задержки в развитии.
- Некоторые РНК-интерференции могут вызывать дефекты развития, когда нокдаун начинается в момент яйцекладки. При необходимости поместите червей на пластины РНК-интерференции на более поздней стадии, например, на L3.
- Как описано в разделах 3 и 4, установите черви и подготовьтесь к визуализации с помощью любой микроскопической системы, оборудованной для обнаружения флуоресценции GFP.
7. Визуализация кальция в раннем эмбриогенезе у C. elegans
- Синхронизируйте червей, как описано в разделе 2. Используйте штамм EAG28, который сочетает в себе репортер CaFE и маркер домена mCherry с гомологией Плекстрина, выделяющий границу плазматической мембраны. В качестве альтернативы, чтобы визуализировать оплодотворенные эмбрионы ex utero, аккуратно разрежьте червя вдоль матки с помощью стерильной иглы шприца, чтобы выпустить эмбрионы.
- Подготовьте червей или эмбрионы к визуализации, как описано в разделе 3, и следуйте тем же инструкциям, что и в разделе 4 для настройки параметров визуализации.
- Центрируйте интересующую область на матке червя, чтобы визуализировать эмбрионы или отложенное яйцо.
- Для эмбрионов в утробе матери убедитесь, что матка не находится позади кишечника, матка не переполнена и что отдельные клетки эмбриона прозрачны в фокальной плоскости.
- Для яиц ex utero убедитесь, что стадии клеток не выходят за рамки запятой жизненного цикла червя.
- Выберите протокол замедленной съемки или временного ряда и настройте нужные параметры.
- Для оптимальной визуализации транзиентов кальция в эмбрионе увеличьте временные настройки для продолжительных фильмов. Имейте в виду, что постоянное воздействие лазера наносит вред эмбриону в течение длительных периодов времени.
- Снимайте видео или изображения, фокусируясь на клетках эмбрионов на нужной стадии клеток.
- Для визуализации используйте объектив с 40-кратным погружением или выше, хотя переходные процессы легко обнаруживаются с помощью 20-кратного воздушного объектива.
Результаты
Используя протоколы, изложенные в данной рукописи, у C. elegans были изучены динамические паттерны передачи сигналов кальция при оплодотворении и эмбриогенезе.
Типичная последовательность оплодотворения у червей, содержащих репортер CaFE, показана на рисунке 2. Для облегчения анализа был использован штамм EAG28, который сочетает в себе репортер CaFE с трансгеном13 домена гомологии плекстрина (PH-mCherry). Маркер PH-mCherry локализуется на плазматической мембране и позволяет легче визуализировать клеточные границы, особенно в плече гонад. Штамм EAG28 был получен путем скрещивания штамма EAG16, содержащего репортер CaFE, с репортерным штаммом13 OD70 PH-mCherry. У C. elegans овуляция и оплодотворение происходят одновременно. Время 0 оплодотворения считается первым кадром, в котором в овулирующей ооците обнаруживается сигнал флуоресценции (рис. 2). Яркий всплеск флуоресценции происходит в месте слияния сперматозоидов, как только передний край ооцита входит в сперматеку, орган хранения сперматозоидов7. Сигнал появляется до того, как овуляция будет завершена. Кальциевая волна является двухфазной, с быстрым начальным всплеском, за которым следует волна флуоресценции от точки входа к противоположному полюсу. Весь ооцит становится флуоресцентным через <30 с.
Обратите внимание, что репортер CaFE находится в единственном экземпляре, и поэтому сигнал не такой яркий, как у других трансгенов. Интервальная съемка Z-стека не рекомендуется во время овуляции, если не доступен и не оптимизирован конфокальный вращающийся диск. Изображения стека Z могут быть получены до или после фильма, чтобы зафиксировать 3D-изменения морфологии гонады. Несмотря на то, что изображения здесь были получены с помощью конфокального микроскопа, переходные процессы также наблюдались с помощью широкопольной флуоресцентной микроскопии, которая более распространена и доступна, чем конфокальная. При использовании лазерного сканирующего конфокала частота кадров составляет примерно 1 кадр в секунду. При использовании фокусного вращающегося диска частота кадров составляет 10 кадров в секунду или выше. Фоновый сигнал репортера CaFE достаточен для освещения созревающих ооцитов в плече гонад. При оплодотворении обычно наблюдается увеличение интенсивности сигнала GFP в 1,5-2 раза.
Существует несколько альтернативных методов количественной оценки. Например, программное обеспечение для анализа изображений Imiris, созданное компанией Oxford Instruments (той же материнской компанией, что и конфокальный микроскоп с вращающимся диском Andor Dragonfly), имеет возможность количественно определять сигнал в каждом кадре только от проходящего ооцита, а не от большего ROI. Тем не менее, программное обеспечение Imaris не является бесплатным. Кроме того, детальная стратегия анализа изображений для измерения волн кальция в ооците была очень подробно описана Такаямой, Фудзитой и Онами и использует ImageJ, который находится в свободном доступе. С другой стороны, кимографы для иллюстрации волны флуоресцентного сигнала через один ооцит требуют более обширных манипуляций с изображениями, чем описано здесь, но описаны в Такаяме и Онами3.
Явным преимуществом C. elegans является его способность подавлять экспрессию практически любого гена, скармливая червям бактерии, экспрессирующие дцРНК для запуска эндогенной РНК-интерференции15,16. Для оптимальной экспрессии дцРНК как пластины РНК-интерференции, так и культура насыщенной РНК-интерференции содержат IPTG. ДцРНК образуется путем экспрессии интересующего гена с помощью фланкирующих промоторов. Здесь мы использовали библиотеку Арингера, которая нацелена на большую часть генома червя с использованием 16 256 штаммов бактерий17. Кроме того, ORFeome из ~11 000 клонов РНК-интерференции был создан лабораторией Vidal с использованием системы Gateway и доступен для покупки через Horizon Discovery18.
Чтобы продемонстрировать полезность репортера CaFE в сочетании с РНК-интерференцией, мы изучили преждевременную овуляцию. Частичная делеция в ipp-5 вызывает событие двойной овуляции, когда как -1 ооцит, так и -2 ооцит входят в сперматеку во время одной и той же овуляции19. IPP-5 – это фосфатаза, которая воздействует на IP3 и эффективно снижает уровень второго мессенджера IP3. Мы обнаружили, что нокдаун РНК-интерференции ipp-5 вызывает фенотип двойной овуляции, аналогичный мутантному.
Анализ репортера CaFE во время двойной овуляции, вызванной нокдауном ipp-5 RNAi, выявил новые аспекты OET. Во-первых, кальциевый сигнал наблюдался сразу после поступления в сперматеку в ведущем -1 ооците, но не в замыкающем -2 ооце (рис. 3). Несмотря на то, что происходит овуляция 2 ооцитов, ооцит -1 по-прежнему является единственным ооцитом, который демонстрирует признаки надлежащего созревания, в частности, разрыва ядерной оболочки (NEBD). Эти данные свидетельствуют о том, что, несмотря на то, что ооцит -2 находится в присутствии сперматозоидов, он не способен к оплодотворению, так как еще не созрел должным образом. Во-вторых, ооцит -2 проявляет задержку кальциевой волны, как правило, когда ооцит выходит из сперматеки в матку. Хотя созревание ооцитов обычно является предпосылкой для овуляции, эти данные свидетельствуют о том, что созревание ооцита и способность к оплодотворению все еще могут происходить после овуляции. Визуализация задержки кальциевой волны во время нокдауна ipp-5 подчеркивает преимущества репортера CaFE для исследования компетентности и выбора времени оплодотворения.
Кроме того, мы обнаружили, что репортер CaFE обнаруживается в отложенных яйцах и выявляет переходные процессы кальция в одиночных клетках во время раннего эмбриогенеза у C. elegans. Эмбрионы из синхронизированного 1-го дня взрослого EAG28 (CaFE; PH-mCherry) были визуализированы с использованием протоколов из разделов 1-5 с помощью конфокального диска Andor Dragonfly с использованием камеры Zyla (рис. 4). Переходные процессы кальция ограничены отдельными клетками и требуют меньше времени, чем волна оплодотворения кальция (~9 с, n=11). Тем не менее, кальциевая волна во время эмбриогенеза, по-видимому, не является двухфазной. Переходные процессы кальция не наблюдались до 8-клеточной стадии. Примечательно, что у C. elegans кальций не локализуется в борозде спайности, как это наблюдается у многих других организмов, включая человека и Xenopus 20,21,22. Одноклеточные кальциевые транзиенты наблюдались хорошо после гаструляции (~200 мин после оплодотворения) и в отложенных яйцах. Один эмбрион демонстрирует несколько переходных процессов кальция с течением времени, но в разных клетках и, как правило, в одной клетке за раз. Обратите внимание, что непрерывное воздействие лазерной стимуляции может повредить эмбрионы. Рекомендуется либо более низкая мощность светодиода/лазера, либо прерывистое облучение. Однако, поскольку волны кальция относительно короткие и составляют ~9 с, мы не рекомендуем делать перерыв менее 2 с между сеансами светодиодной/лазерной стимуляции.
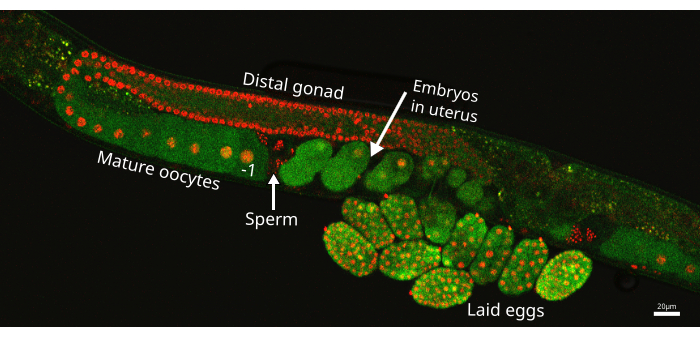
Рисунок 1: Плечо гонад C. elegans . Изображение одного плеча гонады из штамма червей EAG25, показывающее репортер CaFE GFP (зеленый) и маркер гистона 2B-mCherry (красный), который выделяет ядра в зародышевой линии. Проксимальный ооцит обозначается знаком -1 непосредственно перед сперматекой, где хранятся сперматозоиды (стрелка). Эмбрион, расположенный ближе всего к сперматеке, но внутри матки, является самым последним эмбрионом. Изображение было получено с помощью лазерного сканирующего конфокала Nikon ECLIPSE Ti2. Масштабная линейка = 20 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
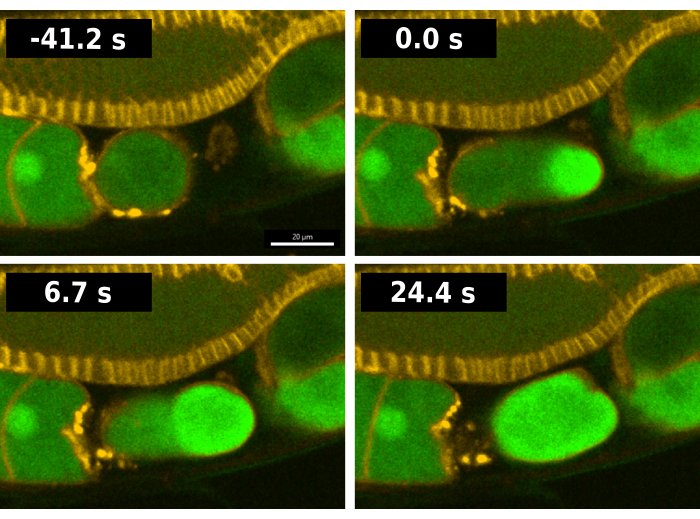
Рисунок 2: Визуализация кальциевой волны во время оплодотворения. Временные ряды изображений флуоресценции, отражающих внутриклеточный кальций во время оплодотворения в штамме червей EAG28. Штамм EAG28 содержит как репортер CaFE (зеленый цвет), так и слияние домена гомологии Плекстрина с mCherry (желтый цвет), который выделяет плазматические мембраны. Время 0 обозначает первый кадр, изображающий явное увеличение флуоресцентного сигнала в ооците. Время 24,4 с отражает первый кадр, показывающий флуоресценцию всего ооцита. Изображения временных рядов были получены с помощью конфокального вращающегося диска Andor Dragonfly с камерой Zilla. Масштабная линейка = 20 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
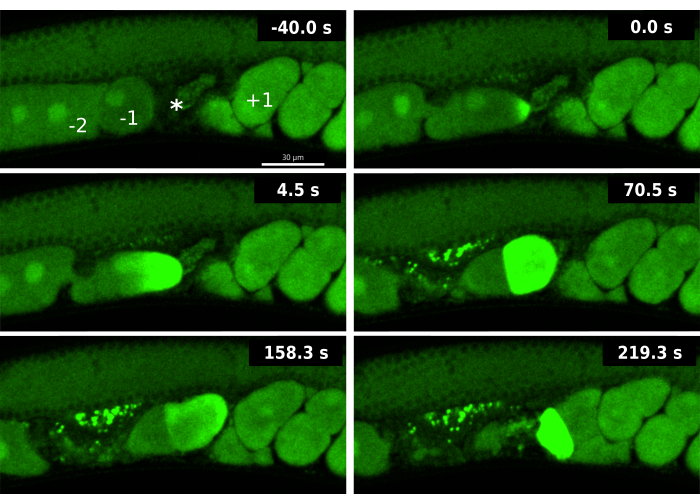
Рисунок 3: Кальциевые волны во время двойной овуляции, вызванной ipp-5 RNAi .Покадровая съемка последовательных кальциевых волн -1 ооцита и -2 ооцита в штамме EAG16 (CaFE зеленого цвета GFP), подвергшемся воздействию ipp-5 RNAi. Кадр -40,0 с включает метки для ооцита -1 (-1), -2 ооцита (-2), сперматеки (*) и +1 эмбриона (+1). Время 0 с показывает начальное увеличение флуоресценции волны кальция -1 ооцита. Время 4,5 с показывает, как волна кальция распространяется к противоположному полюсу в ооците -1. Время 70,5 с показывает флуоресценцию всей клетки в -1 ооците, сопровождающуюся -2 ооцитом при исходном сигнале GFP; Оба ооцита находятся в сперматетеке. Оплодотворенный -1 ооцит и неоплодотворенный -2 ооцит попадают в матку через 158,3 с. Через 219,3 с у -2 ооцита проявляется поздняя флуоресцентная волна кальция. Изображения были получены с помощью вращающегося диска Andor Dragonfly, конфокального с камерой Zilla. Масштабная линейка = 30 μM Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
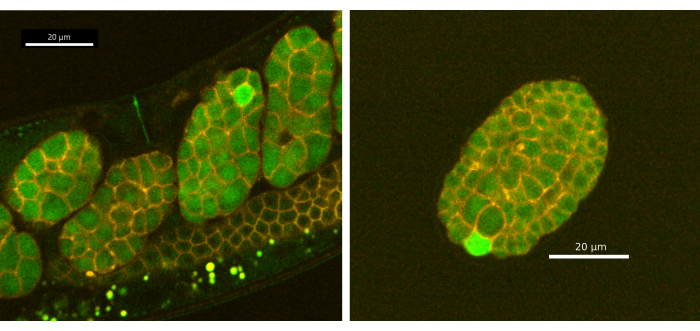
Рисунок 4: Переходные процессы кальция в одиночных клетках на ранних этапах эмбриогенеза. (А) эмбрионы в утробе матери и (В) ex utero (отложенное яйцо) проявляли флуоресцентный сигнал в одной клетке во время эмбриогенеза. Изображения были получены с помощью вращающегося диска Andor Dragonfly, конфокального с камерой Zilla. Масштабная линейка = 20 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Простой инструмент с надежным протоколом является мощной комбинацией для решения сложных научных вопросов. Здесь представлены методы визуализации кальция как легко обнаруживаемого прокси для внесения удобрений с помощью репортера CaFE. Этот же репортер сохраняется на ранних этапах эмбриогенеза, а также позволяет визуализировать кальциевые переходные процессы на более поздних этапах развития. Кальциевая сигнализация служит важным вторым посланником, который разграничивает основные сдвиги в клеточной функции, особенно для биологии развития. В ооците первая фаза всплеска кальциевой волны отмечает не только время оплодотворения, но и место слияния сперматозоидов. У C. elegans ось A-P также определяется по месту слияния сперматозоидов23. Таким образом, возможность визуализации кальция в ооцитах и эмбрионах позволяет исследовать сложные вопросы, которые являются центральными для клеточной биологии и биологии развития.
Описанный здесь метод с помощью репортера CaFE должен быть достаточно простым для новичков в нематоде. Предыдущие методы обнаружения кальциевых волн в ооцитах C. elegans основывались на введении красителя 3,8,14. Несмотря на то, что эти исследования были важными и информативными, инъекция красителя является трудоемкой задачей, а оборудование для инъекций доступно не в каждой лаборатории.
Представленные здесь протоколы были оптимизированы для здоровых червей. Чтобы максимизировать шансы на успех, убедитесь, что на червячной среде или на бактериальной лужайке, на которой питаются черви, нет загрязнения. Не подвергайте червей стрессовым условиям, таким как температура, так как это повлияет на овуляцию и оплодотворение. Кроме того, контроль эффективности РНК-интерференции должен быть включен в каждый эксперимент, поскольку эффективность со временем снижается. Используйте положительный контроль эффективности РНК-интерференции, такой как яйцо-5, которое генерирует эмбрионы, но не жизнеспособное потомство, поскольку образование яичной скорлупынарушено. Кроме того, параметры захвата изображения должны быть оптимизированы для каждой системы микроскопии. Наши технические характеристики приведены здесь в качестве справочных, но следует ожидать отклонений. Хотя эта система легко обнаруживает цитоплазматический кальций в качестве индикатора оплодотворения, она не обязательно представляет собой истинное событие слияния сперматозоидов и ооцитов.
Широкий спектр инструментов и мутантов, свободно распространяемых в сообществе червей, повышает полезность репортера CaFE. Репортер интегрирован в геном червя и легко скрещивается с другими мутантными или репортерными штаммами C. elegans 25. Сообщается о создании EAG25, экспрессирующего репортер CaFE с гистоновым маркером H2B-mCherry для визуализации ядер (рис. 1) и EAG28 как с репортером CaFE, так и с маркером домена гомологии плекстрина-mCherry, который выделяет периферию клетки (рис. 2)13,26. Оба штамма помогают в визуализации клеток в зародышевой линии и во время эмбриогенеза. Кроме того, способность РНК-интерференции в
C. elegans, при использовании с репортером CaFE, позволил получить новое представление о компетентности в области оплодотворения. Как показано на примере двойной овуляции, вызванной нокдауном ipp-5 РНК-интерференции на рисунке 3, присутствие сперматозоида и овулированной ооциты недостаточно для стимуляции оплодотворения.
Эти результаты указывают на то, что должен существовать другой сигнал или отсутствие ингибитора, который позволяет ооциту оплодотвориться. Преждевременно овулированный ооцит проявляет замедленный кальциевый транзиторный процессор, когда ооцит перемещается в матку. Эта поздняя волна кальция предполагает, что преждевременно овулированный -2 ооцит может со временем развить способность к оплодотворению. Мы ожидаем, что исследованиям по срокам оплодотворения, особенно в отношении межклеточной сигнализации и регуляции, будет способствовать использование репортера CaFE. Кроме того, репортер CaFE сохраняется в эмбриогенезе и отображает одноклеточные кальциевые транзиенты. Эта передача сигналов кальция в эмбрионе также была зарегистрирована в течение первых 24часов после развития рыбок данио. Роль кальциевых транзиентов неизвестна, но их присутствие предполагает клеточное сигнальное событие во время развития, которое еще не было изучено. Примечательно, что переходные процессы кальция не наблюдались у недавно оплодотворенных зигот. Таким образом, кальций не локализуется в борозде спайности, как это было задокументировано у нескольких других организмов, включая Xenopus и человека 20,21,22.
Важно отметить, что репортер CaFE достаточно прост в использовании студентами с минимальной подготовкой. Мы разработали и реализовали лабораторию CURE (исследовательский опыт бакалавриата на основе курса) с 1 кредитом для студентов-биологов с описанными здесь штаммами и протоколами. В течение семестра класс собирался один раз в неделю по 3 часа или два раза в неделю по 1 часу 30 минут каждый. Студентам был предоставлен выбор работать в одиночку или в группах по 2 человека. Каждый студент/пара выбирали свой ген для изучения из тщательно подобранного списка. Они провели РНК-интерференцию против выбранного гена в штамме EAG28 и исследовали червей на предмет влияния на плодовитость, оплодотворение и/или морфологию гонад. Основываясь на полученных результатах и прочтении первичной литературы, студенты разработали гипотезы, которые они могли проверить в последующих экспериментах. Этот итеративный дизайн имел решающее значение для повышения вовлеченности учащихся28. Студенты получили подлинный исследовательский опыт и навыки работы с модельными организмами, генетическим скринингом и флуоресцентной микроскопией. Учитывая простоту использования репортера CaFE, студенты без исследовательского опыта смогли добиться успеха. После этого студенты в подавляющем большинстве выразили предпочтение формату CURE перед традиционными лабораторными занятиями, причем многие студенты выразили желание продолжить исследования. В совокупности эти инструменты и протоколы помогают как в образовании, так и в исследованиях процессов раннего развития.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих или финансовых интересов.
Благодарности
KSKG был профинансирован за счет гранта Национального института детского здоровья и развития человека имени Юнис Кеннеди Шрайвер (R15HD111986). Некоторые штаммы были предоставлены CGC, который финансируется Управлением программ исследовательской инфраструктуры NIH (P40 OD4010440). Мы благодарим WormBase.
Материалы
| Name | Company | Catalog Number | Comments |
| Agar | Fisher Scientific | DF0140-07-4 | 2 kg; Powder dissolves easier than flakes |
| Agarose | MidSci | BE-A125 | 500 g |
| Alcohol lamp | Fisher Scientific | S13475 | Use with 95% ethanol |
| Ammonium chloride (NH4Cl) | Fisher Scientific | AAA1500030 | 250 g |
| Ampicillin | Fisher Scientific | BP1760-5 | 5 g |
| AMSCO 400 Series Small Steam Sterilizer | Steris Healthcare | N/A | |
| Bacto-peptone | Fisher Scientific | BP1420-500 | 500 g |
| Bacto-tryptone | Fisher Scientific | DF0123-17-3 | 500 g |
| Calcium chloride (CaCl2) | Fisher Scientific | C69-500 | 500 g |
| Cholesterol | Thermo Scientific | A11470.18 | 50 g |
| Dragonfly 200 spinning disk confocal | Oxford Instruments Andor | N/A | Used with Leica microscope |
| Fisherbrand Superfrost Cytogenics Microscope Slides | Fisher Scientific | 22-035-900 | 144 slides per pack |
| Flat Nose Pliers, Smooth Jaw | Home Depot | 305530604 | Ensure pliers are smooth jaw |
| Isopropyl β- d-1-thiogalactopyranoside (IPTG) | Fisher Scientific | BP1755-10 | 10 g; dioxane-free |
| Laboratory tape | Fisher Scientific | 15-901-10R | 0.5 inch tape is used to tape microscope slides |
| Levamisole | Fisher Scientific | AC187870100 | 10 g |
| Magnesium sulfate (MgSO4) | Fisher Scientific | M63-500 | 500 g |
| Microscope cover glass | Fisher Scientific | 12541016 | 1 oz pack |
| Nikon ECLIPSE Ti2 laser scanning confocal | Nikon | N/A | |
| Nikon NIS Elements software | Nikon | N/A | Confocal |
| OP50 Escherichia coli | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Platinum Wire | TriTech | PT-9010 | |
| Potassium phosphate dibasic (K2HPO4) | Fisher Scientific | P288-500 | 500 g |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | AA1159436 | 500 g |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | 500 g |
| Sodium phosphate dibasic heptahydrate (Na2HPO4) | Fisher Scientific | S471-3 | 3 kg |
| Stereo microscope | Leica | KL300 LED | |
| Sterile Petri dish (35 mm x 10 mm) | CellTreat | 229638 | 960 Petri dishes per case |
| Sterile Petri dish (60 mm x 15 mm) | CellTreat | 229665 | 500 Petri dishes per case |
| Strain EAG16 spn-4p::jGCaMP7s::pie-1u | Caenorhabditis Genetics Center (CGC) | EAG16 | Created by Kim Guisbert Lab |
| Strain EAG25 spn-4p::jGCaMP7s::pie-1u; ujIs113 II. | Caenorhabditis Genetics Center (CGC) | EAG25 | Created by Kim Guisbert Lab |
| Strain EAG28 spn-4p::jGCaMP7s::pie-1u; unc-119(ed3) III; ltIs44 V. | Caenorhabditis Genetics Center (CGC) | EAG28 | Created by Kim Guisbert Lab |
| Strain JIM113 ujIs113 II [pie-1p::mCherry::H2B::pie-1 3'UTR + nhr-2p::his-24::mCherry::let-858 3'UTR + unc-119(+)] | Caenorhabditis Genetics Center (CGC) | JIM113 | Created by E. Preston - Murray Lab |
| Strain OD70 unc-119(ed3) III; ltIs44 V [pie-1p::mCherry::PH(PLC1delta1) + unc-119(+)] | Caenorhabditis Genetics Center (CGC) | OD70 | Created by Audhya/Oegema - Greenstein Lab |
| Tritech Worm Pick Handle | TriTech | TWPH1 | |
| Yeast extract | IBI Scientific | IB49160 | 500 g |
Ссылки
- Stein, P., Savy, V., Williams, A. M., Williams, C. J. Modulators of calcium signalling at fertilization. Open Biol. 10 (7), 200118(2020).
- McAvey, B. A., Wortzman, G. B., Williams, C. J., Evans, J. P. Involvement of calcium signaling and the actin cytoskeleton in the membrane block to polyspermy in mouse eggs. Biolo Reprod. 67 (4), 1342-1352 (2002).
- Takayama, J., Onami, S. The sperm TRP-3 channel mediates the onset of a Ca 2+ wave in the fertilized C. elegans oocyte. Cell Rep. 15 (3), 625-637 (2016).
- Yamamoto, I., Kosinski, M. E., Greenstein, D. Start me up: Cell signaling and the journey from oocyte to embryo in C. elegans. Dev Dyn. 235 (3), 571-585 (2006).
- Hubbard, E. J. A., Greenstein, D. The Caenorhabditis elegans gonad: A test tube for cell and developmental biology. Dev Dyn. 218 (1), 2-22 (2000).
- Korta, D. Z., Hubbard, E. J. A. Soma-germline interactions that influence germline proliferation in Caenorhabditis elegans. Dev Dyn. 239 (5), 1449-1459 (2010).
- Toperzer, K. M., Brennan, S. J., Carroll, D. J., Guisbert, E. A., Kim Guisbert,, S, K. Visualization of the biphasic calcium wave during fertilization in Caenorhabditis elegans using a genetically encoded calcium indicator. Biol Open. 12 (9), 059832(2023).
- Samuel, A. D., Murthy, V. N., Hengartner, M. O. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol. 1 (1), 8(2001).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nat Methods. 16 (7), 649-657 (2019).
- Golden, N. L., Plagens, R. N., Kim Guisbert, K. S., Guisbert, E. Standardized methods for measuring induction of the heat shock response in Caenorhabditis elegans. J Vis Exp. (161), e61030(2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Kamath, R., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Kachur, T. M., Audhya, A., Pilgrim, D. B. UNC-45 is required for NMY-2 contractile function in early embryonic polarity establishment and germline cellularization in C. elegans. Dev Biol. 314 (2), 287-299 (2008).
- Takayama, J., Fujita, M., Onami, S. In vivo live imaging of calcium waves and other cellular processes during fertilization in Caenorhabditis elegans. Bio Protoc. 7 (7), e2205(2017).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391 (6669), 806-811 (1998).
- Conte, D., MacNeil, L. T., Walhout, A. J. M., Mello, C. C. RNA Interference in Caenorhabditis elegans. Curr Protoc Mol Biol. 109, 1-30 (2015).
- Kamath, R. S., et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421 (6920), 231-237 (2003).
- Reboul, J., et al. elegans ORFeome version 1.1: experimental verification of the genome annotation and resource for proteome-scale protein expression. Nat Genet. 34 (1), 35-41 (2003).
- Bui, Y. K., Sternberg, P. W. Caenorhabditis elegans inositol 5-phosphatase homolog negatively regulates inositol 1,4,5-triphosphate signaling in ovulation. Mol Biol Cell. 13 (5), 1641-1651 (2002).
- Muto, A., Kume, S., Inoue, T., Okano, H., Mikoshiba, K. Calcium waves along the cleavage furrows in cleavage-stage Xenopus embryos and its inhibition by heparin. J Cell Biol. 135 (1), 181-190 (1996).
- Paudel, S., Sindelar, R., Saha, M. Calcium signaling in vertebrate development and its role in disease. Int J Mol Sci. 19 (11), 3390(2018).
- Paudel, S., Yue, M., Nalamalapu, R., Saha, M. S. Deciphering the calcium code: A review of calcium activity analysis methods employed to identify meaningful activity in early neural development. Biomolecules. 14 (1), 138(2024).
- Goldstein, B., Hird, S. N. Specification of the anteroposterior axis in Caenorhabditis elegans. Development. 122 (5), 1467-1474 (1996).
- Johnston, W. L., Dennis, J. W. The eggshell in the C. elegans oocyte-to-embryo transition. Genesis. 50 (4), 333-349 (2012).
- Stevenson, Z. C., Moerdyk-Schauwecker, M. J., Jamison, B., Phillips, P. C. Rapid self-selecting and clone-free integration of transgenes into engineered CRISPR safe harbor locations in Caenorhabditis elegans. G3. 10 (10), Bethesda. 3775-3782 (2020).
- Zacharias, A. L., Walton, T., Preston, E., Murray, J. I. Quantitative differences in nuclear β-catenin and TCF pattern embryonic cells in C. elegans. PLoS Genet. 11 (10), e1005585(2015).
- Webb, S. E., Miller, A. L. Calcium signalling during zebrafish embryonic development. BioEssays. 22 (2), 113-123 (2000).
- Wiseman, E., Carroll, D. J., Fowler, S. R., Guisbert, E. Iteration in an inquiry-based undergraduate laboratory strengthens student engagement and incorporation of scientific skills. J Scholarsh Teach Learn. 20 (2), 99-112 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены