Method Article
כימות מיקרוסקופי בזמן אמת בתפוקה גבוהה של שחרור מלכודת נויטרופילים חוץ-תאית אנושית והערכת הפרמקולוגיה של אנטגוניסטים
In This Article
Summary
פרוטוקול מוגדר זה מתאר גישת מיקרוסקופיה בתפוקה גבוהה בזמן אמת כדי להמחיש ולכמת שחרור מלכודת נויטרופילים חוץ-תאית אנושית (NET) במבחנה. השיטה הניתנת לשחזור מאפשרת לחקור את המאפיינים והקינטיקה של שחרור NET בעת גירוי עם משפרי NETosis מובהקים ומאפשרת הערכה של הפרמקולוגיה של אנטגוניסטים של NETosis.
Abstract
נויטרופילים ממלאים תפקיד חשוב בהגנה החיסונית המולדת על ידי שימוש במספר אסטרטגיות, כולל שחרור מלכודות נויטרופילים חוץ-תאיות (NETs) בתהליך המכונה NETosis. עם זאת, בשני העשורים האחרונים התברר כי הצטברות NETs ברקמות תורמת לפתופיזיולוגיה של מחלות דלקתיות ואוטואימוניות מרובות. לכן, העניין בפיתוח אנטגוניסטים של NETosis עלה. במקביל פותחו שיטות משתנות ולא סטנדרטיות לאיתור וניתוח NETosis, שלכל אחת מהן יתרונות ומגבלות משלה. כאן, אנו מתארים שיטת מיקרוסקופיה בזמן אמת לכימות שחרור NET אנושי, המאפשרת לחקור NETosis כמו גם עיכוב NET בצורה בעלת תפוקה גבוהה. הניתוח האוטומטי למחצה המבוסס על שטח הפנים מזהה NETs ומבדיל אותם מניטרופילים המופעלים ללא רשת. אנו מדגימים כי משפרי NETosis שאינם פיזיולוגיים, סידן יונופור ופורבול-12-מיריסטט-13-אצטט (PMA), מעוררים שחרור של NETs בעלי מאפיינים וקינטיקה שונים. יתר על כן, אנו מראים כי גישה זו מאפשרת לחקור שחרור NET בתגובה לגירויים רלוונטיים למחלה, כולל קומפלקסים חיסוניים, N-פורמיל מתיונין-לאוציל-פנילאלנין (fMLF), גבישי מונוסודיום אוראט וגבישי סידן פירופוספט. כדי להדגים את התועלת של שיטה זו לחקר אנטגוניסטים של NETosis, השתמשנו ב-CIT-013, מעכב נוגדנים חד-שבטיים ראשון מסוגו של שחרור NET. CIT-013 מכוון להיסטון H2A ו-H4 מצומצם ומעכב ביעילות שחרור NET עם IC50 של 4.6 ננומטר. נוגדנים אחרים נגד היסטון שנבדקו חסרו יכולת מעכבת NETosis זו. בסך הכל, אנו מדגימים כי פרוטוקול זה מאפשר כימות ספציפי, אמין וניתן לשחזור בתפוקה גבוהה של NETs, ומשפר את המחקר של מאפייני שחרור NET, קינטיקה ופרמקולוגיה של אנטגוניסטים של NETosis.
Introduction
נויטרופילים נמצאים בשפע בדם ונודדים לרקמות עם זיהום או דלקת. הם ממלאים תפקיד חשוב בהגנה החיסונית המולדת על ידי שימוש בכלי נשק נרחבים כדי להגן על המארח מפני מיקרובים. נויטרופילים הורגים פתוגנים באמצעות פגוציטוזיס, דה-גרנולציה, יצירת מיני חמצן תגובתיים (ROS) ושחרור כרומטין מעובה המכונה מלכודות נויטרופילים חוץ-תאיות (NETs) בתהליך הנקרא NETosis1. NETs הם מבנים חוץ-תאיים של כרומטין המעוטרים, בין היתר, בחלבונים גרגירים וקלפרוטקטין 2,3, ומשתחררים עם גירוי עם ספקטרום רחב של מולקולות4. ניתן לסווג את NETosis באופן כללי לשני מסלולים עיקריים: NADPH אוקסידאז תלוי או עצמאי 5,6,7. בנוסף, ציטרולינציה של ארגינין של זנבות היסטון N-terminal על ידי פפטידיל ארגינין דימינאז 4 (PAD4) נקשר קשר הדוק ל-NETosis ומקדם עיבוי כרומטין שמוביל בסופו של דבר לגירוש כרומטין מפורק לסביבה החוץ-תאית.
למרות ששחרור NET מעורב בחיסול פתוגנים, מחקרים רבים הראו כי שחרור NET חריג וממושך קשור להתפתחות של הפרעות דלקתיות שונות, כולל פגיעה ריאתית חריפה8, דלקת מפרקים שגרונית (RA) 9, וסקוליטיס10 והידרדניטיס סופורטיבה11. התפקיד המזיק של NETs במחלה הוא רב פנים מכיוון ש-NETs הם פרו-דלקתיים, הם מקור לאוטואנטיגנים, הם ציטוטוקסיים לרקמות הסובבות, מעוררים אימונוטרומבוזיס ומקדמים התמיינות אוסטאוקלסטים ושחיקת עצם 9,12,13. עיכוב פרמקולוגי של מסלול NETosis על ידי מעכבי PAD4 מולקולות קטנות מדגים כי לטיפולים ממוקדי NETosis יש פוטנציאל כטיפולים למחלות שבהן הצטברות NET היא מניע חשוב לפתוגנזה14. במקום להתמקד באנזים PAD4, השתמשנו בנוגדנים חד-שבטיים של היסטון אנטי-ציטרולין, CIT-013, הנקשר באופן ספציפי להיסטונים ציטרולינים H2A ו-H415. ל-CIT-013 מנגנון פעולה כפול ייחודי על ידי עיכוב שחרור NET ושיפור NET פגוציטוזיס16 בתיווך מקרופאגים. CIT-013 ומולקולות קודמות הראו יעילות טיפולית במודלים מרובים של עכברים של דלקת הקשורה ל-NET17.
כדי לחקור את שחרור NET, פותחו במהלך השנים שיטות שונות, כגון אך לא רק 1) זיהוי DNA באמצעות עוקב DNA אטום לממברנת פלזמה בשילוב עם קורא צלחת אימונו-פלואורסצנטי, 2) זיהוי מבוסס בדיקת אימונוסורבנט מקושר לאנזים (ELISA) של DNA ומורכב DNA עם חלבונים ספציפיים ל-NET בסופרנטנטים, 3) לוקליזציה משותפת של מולקולות הקשורות ל-NET עם DNA חוץ-תאי באמצעות אימונוהיסטוכימיה, ו-4) גישות ציטומטריית זרימה לאיתור נויטרופילים ברשת. לכל השיטות הללו יתרונות ומגבלות משלהן. פיתחנו גישת תפוקה גבוהה בזמן אמת לכימות מיקרוסקופי של שחרור NET אנושי, המשתמשת בצבע DNA אטום לקרום פלזמה16,18. השיטה המתוארת מאפשרת לחקור את הקינטיקה והמאפיינים של NETosis בצורה קלה, אמינה וניתנת לשחזור ומאפשרת הערכה של הפרמקולוגיה של אנטגוניסטים של NETosis כגון CIT-013.
Protocol
כל תורמי הדם נתנו הסכמה מדעת בהתאם להצהרת הלסינקי, והמחקר בוצע בהתאם להנחיות האתיות של Citryll למחקר בבני אדם.
הערה: כל הפעילויות עם דם אנושי ונויטרופילים מבודדים צריכות להתבצע בתנאים סטריליים בארון זרימה למינרית. כאשר הגדרות הבלמים והתאוצה לצנטריפוגה אינן מוזכרות בפרוטוקול, ניתן לשקול אותן לכל היותר.
1. בידוד נויטרופילים מדם
- אסוף דם היקפי ממתנדבים בריאים בצינורות ליתיום-הפרין והעביר דם לשפופרת טרייה של 50 מ"ל.
- שטפו צינורות ליתיום-הפרין עם 1x DPBS והעבירו לאותו צינור של 50 מ"ל שאליו הועבר הדם. ודא שיחס הדם הסופי ל-DPBS הוא 1:1. מערבבים דם ו-DPBS על ידי פיפטינג לקבלת תמיסה הומוגנית.
- הוסף 13 מ"ל של תמיסת שיפוע צפיפות לצינור טרי אחר של 50 מ"ל והוסף לאט (עם פיפט של 25 מ"ל) את הדם המדולל 1:1 על גבי תמיסת שיפוע הצפיפות עד למקסימום של 50 מ"ל.
- צנטריפוגה ב-400 x גרם וטמפרטורת החדר (RT) למשך 40 דקות עם האצה ובלם מינימליים.
הערה: נוצרות שכבות. שכבות מלמעלה למטה הן כדלקמן: 1. פלזמה; 2. תאים חד-גרעיניים בדם היקפי (PBMCs); 3. פתרון שיפוע צפיפות; 4. אריתרוציטים/נויטרופילים. - ראשית, השליכו את הפלזמה עם פיפט של 10 מ"ל ולאחר מכן השליכו PBMCs ואת שכבת תמיסת שיפוע הצפיפות עם פיפט פסטר מפלסטיק ככל האפשר מבלי להפריע לשכבת האריתרוציט/נויטרופילים.
- השעו בעדינות את שכבת האריתרוציט/נויטרופילים על ידי ניעור והשעיה מחדש עם פיפט של 25 מ"ל ב-15 מ"ל של 1x DPBS.
- הוסף 25 מ"ל של תמיסת 6% דקסטרן/0.9% NaCl, ערבב עשר פעמים היפוך הצינור, והצב את הצינור זקוף למשך 25 דקות ב-RT.
הערה: נוצרות שכבות. שכבות מלמעלה למטה הן כדלקמן: 1. נויטרופילים; 2 אריתרוציטים. - מעבירים את שכבת הנויטרופילים לצינור טרי של 50 מ"ל עם פיפט של 10 מ"ל וצנטריפוגה למשך 10 דקות ב-500 x גרם ו-RT.
הערה: היזהר מכיוון שכדור הנויטרופילים עדיין מכיל כמה אריתרוציטים ואינו מחובר היטב לצינור. - השליכו את הסופרנטנט על ידי סילוק והשעיה מחדש של גלולת התא עם פיפט של 10 מ"ל ב-10 מ"ל של מאגר ליזה אמוניום-כלוריד-אשלגן (ACK) (155 מ"מ NH4Cl, 10 מ"מ KHCO3 ו-0.1 מ"מ Na2EDTA; pH = 7.2) ולאחר מכן הוסיפו מיד 40 מ"ל של מאגר ליזה ACK.
- דגירה ב-RT תוך היפוך רציף של הצינור עד שהתמיסה הופכת לשקופה (זה לוקח 1-5 דקות ועשוי להשתנות עבור כל תורם) וצנטריפוגה למשך 10 דקות ב-350 x g ו-RT.
- הסר את הסופרנטנט והוסף לאט וטיפתי 5 מ"ל של מדיום תרבית המכיל L-גלוטמין בתוספת 10% (v/v) סרום בקר עוברי מומת חום (FBS), 50 U/mL פניצילין ו-50 מיקרוגרם/מ"ל סטרפטומיצין (המכונה מדיום תרבית 10% להלן) על גבי כדור הנויטרופילים מבלי להביא את הנויטרופילים לתרחיף. זה יסיר ביעילות את רוב האריתרוציטים מכדור הנויטרופילים.
- סובב בעדינות את צינור ה-50 מ"ל עד שרוב האריתרוציטים, הנמצאים על גבי כדור הנויטרופיל, מושעים מחדש במדיום התרבית 10%. לאחר מכן, הסר את הסופרנטנט על ידי סילוק הצינור.
- השעו מחדש את גלולת הנויטרופילים ב-10 מ"ל של מדיום תרבית 10%, וכאשר הוא מושעה במלואו, הוסף עד 50 מ"ל של מדיום תרבית 10%. צנטריפוגה למשך 10 דקות ב-350 x גרם ו-RT.
- הסר את הסופרנטנט והשהה מחדש את כדור התא ב -10 מ"ל של מדיום תרבית 10%.
2. צביעת נויטרופילים לבדיקת טוהר על ידי ציטומטריית זרימה
- כדי לקבוע את ריכוז התאים, יש לדלל את תרחיף הנויטרופילים בתמיסה כחולה של 0.4% טריפאן (יחס 1:1) ולספור את הנויטרופילים עם מונה תאי שדה בהיר.
הערה: ניתן להשתמש גם בשיטות ספירה אחרות. - העבירו 1 x 105 נויטרופילים בתרבית בינונית 10% לבארות של צלחת V-bottom 96 בארות וצנטריפוגה למשך 3 דקות ב-400 x g ו-RT.
- השליכו את הסופרנטנט והשעו מחדש את התאים ב-50 מיקרוליטר של 1x DPBS בתוספת 1% (w/v) אלבומין בסרום בקר (BSA) ו-0.1% (v/v) NaN3 (המכונה מאגר מיון תאים מופעל פלואורסצנטי (FACS) להלן) המכיל בלוק קולטן Fc (מדולל פי 50).
- דגירה למשך 15 דקות ב-RT והוספת 50 מיקרוליטר של מאגר FACS המכיל נוגדן CD45 מצומד לעכבר APC-Cy7 מדולל פי 50, נוגדן CD16 מצומד לעכבר PerCP-Cy5.5 מדולל פי 600, נוגדן CD66b מצומד לעכבר מצומד FITC פי 133, וצבע כדאיות מדולל פי 500 eFluor 506.
הערה: CD45 מתבטא בלויקוציטים. CD66b מתבטא אך ורק בגרנולוציטים. CD16 מתבטא מאוד בנויטרופילים, מתבטא באופן נמוך באאוזינופילים, ואינו מתבטא בבזופילים. - דגירה למשך 30 דקות ב-RT בחושך וצנטריפוגה למשך 3 דקות ב-400 x g ו-RT.
- השליכו את הסופרנטנט, השעו מחדש את הנויטרופילים ב-175 מיקרוליטר של מאגר FACS, וצנטריפוגה למשך 3 דקות ב-400 x g ו-RT. חזרו על שלב זה פעם אחת.
- השליכו את הסופרנטנט והשעו מחדש את כדור הנויטרופילים ב-175 מיקרוליטר של מאגר FACS. לנתח דגימות באמצעות מערכת ציטומטריית זרימה ותוכנה נלווית.
3. ניתוח טוהר נויטרופילים באמצעות תוכנת ניתוח ציטומטריית זרימה
הערה: ניתוח נתוני ציטומטריית זרימה בוצע באמצעות תוכנת ניתוח ציטומטריית זרימה כפי שמצוין בטבלת החומרים.
- בצע שער על פי הנוהל הבא שלב אחר שלב.
- הגדר שער זמן בתרשים FSC-A לעומת זמן לבחירת אזור עם זרימת תאים מתאימה.
- הגדר שער תא בעלילה SSC-A לעומת FSC-A כדי לבחור תאים ולא לכלול פסולת.
- הגדר שער תא בר-קיימא בתרשים FSC-A לעומת AmCyan-A כדי לבחור תאים ברי קיימא.
- הגדר שער לויקוציטים בתרשים FSC-A לעומת APC-Cy7 כדי לבחור תאי CD45+.
- הגדר שער נויטרופילים בתרשים FITC לעומת PerCP-Cy5.5 כדי להבחין בין CD66b+CD16+ (נויטרופילים), CD66b-CD16+ (אאוזינופילים) ו-CD66b-CD16- (בזופילים, מונוציטים ולימפוציטים).
- הגדר שער תא בודד בתרשים FSC-H לעומת FSC-A כדי לבחור נויטרופילים בודדים.
- קבע את טוהר הנויטרופילים על ידי הצגת נויטרופילים בודדים כתדירות התאים (בשער התא).
הערה: כדי להמשיך, טוהר הנויטרופילים צריך לעלות על 85%.
4. מיקרוסקופ הדמיה חיה
הערה: בדיקה זו מותאמת למספר לוחות הדמיה של 96 בארות וגירויים ואנטגוניסטים שונים של NETosis. הפרוטוקול שלהלן מתאר תצוגה כללית של הגישה, אותה ניתן לציין באמצעות הטבלאות הכלולות.
- הכן תמיסת פולי-L-ליזין של 0.001% על ידי דילול של 0.01% פולי-L-ליזין ב-H2O סטרילי ביחס של 1:10.
- הוסף תמיסת פולי-L-ליזין של 0.001% לכל באר ודגירה לפחות שעה אחת ב-37 מעלות צלזיוס.
הערה: הנפח לבאר תלוי בלוחית ההדמיה של 96 הבארות (טבלה 1). - שטפו את הבארות 3 פעמים עם 200 מיקרוליטר DPBS כדי להסיר עודפי פולי-L-ליזין. בצע את כל השלבים בארון הזרימה הלמינרית. הסר את מכסה הצלחת וייבש את הבארות באוויר על ידי פתיחת הצלחת בארון הזרימה הלמינרית עד לייבוש (כשעה).
- לחשב את מספר הנויטרופילים הנדרשים לניסוי ולהעביר עודף לשפופרת של 15 מ"ל. צנטריפוגה למשך 10 דקות ב-350 x גרם ו-RT.
הערה: כמות הנויטרופילים בכל באר משתנה בהתאם לסוג לוחית ההדמיה של 96 בארות (טבלה 1). צפיפות התאים מותאמת כדי לאפשר הפרדה טובה של תאים בודדים, הנדרשת לניתוח נכון. אם צפיפות הנויטרופילים גבוהה מדי, תאים ו-NETs יחפפו לתאים סמוכים ול-NETs, מה שמשפיע על איכות הניתוח. - יש להשליך את הסופרנטנט ולהשעות מחדש את הנויטרופילים במדיום תרבית ללא פנול אדום בתוספת 2% (v/v) FBS, 50 U/mL פניצילין ו-50 מיקרוגרם/מ"ל סטרפטומיצין, 10 מ"מ HEPES ו-1 מ"מ CaCl2 (להלן מאגר בדיקת NET).
- הכן את פתרונות העבודה הבאים.
- הכן צבע DNA של 80 ננומטר במאגר בדיקת NET.
- הכן גירויים של NETosis במאגר בדיקת NET.
- הכן אנטגוניסטים של NETosis במאגר בדיקת NET.
הערה: שימו לב שהריכוזים של פתרונות העבודה שתוארו לעיל הם פי 4 מהריכוז הסופי הדרוש בבאר. הריכוזים המומלצים של גירויים של NETosis ואנטגוניסטים של NETosis משתנים (טבלה 2 וטבלה 3).
- הוסף פי 4 צבע DNA מרוכז במאגר בדיקת NET לכל באר.
- הוסף פי 4 גירויים מרוכזים של NETosis במאגר בדיקת NET לבארות המתאימות, והוסף מאגר בדיקת NET רק לבארות ללא גירוי או לבארות המכילות קומפלקסים חיסוניים מצופים (cIC; פרוטוקול בטבלה 2).
- הוסף אנטגוניסטים מרוכזים פי 4 של NETosis במאגר בדיקת NET לבארות המתאימות. הוסף מאגר בדיקת NET רק לבארות ללא אנטגוניסט.
- הוסף תרחיף נויטרופילים לכל באר.
הערה: הנפח של צבע DNA מרוכז פי 4, גירוי NETosis מרוכז פי 4 במאגר בדיקת NET, אנטגוניסט NETosis מרוכז פי 4 במאגר בדיקת NET, מספר הנויטרופילים ונפח תרחיף הנויטרופילים לבאר תלוי בלוחית ההדמיה של 96 בארות (טבלה 1). הימנע מהיווצרות בועות בעת פיפטינג. - צנטריפוגה של הצלחת למשך 2 דקות ב-100 x g ו-RT והכנס את לוחית ההדמיה של 96 בארות למערכת ניתוח מיקרוסקופ התאים החיים הממוקמת בחממה ב-37 מעלות צלזיוס ו-5% CO2.
הערה: עיבוי יכול להתפתח בתחתית לוחית ההדמיה של 96 הבארות במהלך הדקה הראשונה של הדגירה. יש להסיר זאת בעזרת טישו.
5. הגדרת תוכנת מערכת ניתוח מיקרוסקופיה של תאים חיים לרכישה
הערה: ניגודיות פאזה ותמונות אימונופלואורסצנטיות נרכשו על ידי מערכת ניתוח מיקרוסקופיה של תאים חיים הנשלטת על ידי תוכנת הניתוח שלה.
- פתח את תוכנת מערכת ניתוח המיקרוסקופיה של התא החי ולחץ על התחבר להתקן. הזן שם משתמש וסיסמה. לחץ על לוח זמנים כדי לרכוש ולחץ על כפתור הפלוס (הפעל הוסף כלי שיט). לאחר מכן, בחר סרוק לפי לוח זמנים ולחץ על הבא.
- כדי ליצור כלי חדש מאפס, בחר חדש במקטע Create Vessel ולחץ על Next. בחר רגיל במקטע סוג סריקה ולחץ על הבא.
- בחר את הגדרות הסריקה הבאות ולחץ על הבא: תא אחר תא: ללא; ערוצי תמונה: ניגודיות פאזה וירוק (זמן רכישה 100 אלפיות השנייה); מטרה: פי 20.
- בחר את סוג כלי השיט המתאים לסריקה במקטע בחירת כלי שיט ולחץ על הבא.
- אם אתה משתמש בצלחת 96 באר #1, בחר קורנינג, צלחת, 96, N/A, 3603, 96 בארות קורנינג (Blk/Wht), מיקרו-לוחות.
- אם אתה משתמש בצלחת 96 באר #2, בחר Nunc, Plate, 96, N/A, 152028, 96-well Nunc opt bottom (Blk/Wht), Microplates.
- ציין את מיקום הכלי במגירה ולחץ על הבא. בקטע דפוס סריקה , בחר את הבארות שצריך לסרוק, בחר את מספר התמונות לכל באר (סרוק 4 תמונות לכל באר כדי לקבל סקירה מייצגת) ולחץ על הבא.
הערה: אל תבחר בארות ריקות מכיוון שזה ישפיע על המיקוד האוטומטי. - ספק מידע על כלי השיט על ידי הכנסת, בין היתר, את שם הלוחית במקטע מחברת הכלי ולחץ על הבא. בחר דחה ניתוח למועד מאוחר יותר במקטע הגדרת ניתוח ולחץ על הבא.
- הגדר את לוח הזמנים לסריקה עבור כלי השיט במקטע לוח זמנים לסריקה . בחר צור לוח זמנים חדש עם סריקות במרווחי זמן של ובחר שעה אחת. בחר הפסק סריקה ו - 00:05 שעות לאחר הסריקה הראשונה. לחץ על הבא ולחץ על הוסף לתזמון כאשר פרטי הסריקה נכונים.
- כאשר יש צורך לערוך את לוח הזמנים של הסריקה, לחץ פעמיים על לוח הזמנים של הסריקה בחלק העליון של המסך. לחץ לחיצה ימנית על לוח הזמנים של הסריקה וערוך והתאם כרצונך. לחץ על סמל התקליטונים כדי לשמור את לוח הזמנים של הסריקה.
הערה: בעת הדמיית מספר כלי שיט (צלחות) באותו ניסוי, ניתן להוסיף כלי שיט נוספים ללוח הזמנים הקיים של הסריקה על ידי לחיצה על כפתור הפלוס (הפעל הוסף כלי שיט), בחירה בסריקה לפי לוח זמנים ולחיצה על הבא. צרו כלי חדש מאפס (ראו שלב 5.2 בפרוטוקול זה), העתיקו כלי קיים, או השתמשו בכלי שנסרק בעבר. התוצאה היא סריקה רציפה באותה תדירות והגדרות כמו הלוח הקודם.
- כאשר יש צורך לערוך את לוח הזמנים של הסריקה, לחץ פעמיים על לוח הזמנים של הסריקה בחלק העליון של המסך. לחץ לחיצה ימנית על לוח הזמנים של הסריקה וערוך והתאם כרצונך. לחץ על סמל התקליטונים כדי לשמור את לוח הזמנים של הסריקה.
6. ניתוח בדיקת מיקרוסקופיה הדמיה חיה NET באמצעות תוכנת ניתוח מיקרוסקופיה של תאים חיים
הערה: תוכנת ניתוח מיקרוסקופיה של תאים חיים שימשה לניתוח ניגודיות פאזה ותמונות אימונופלואורסצנטיות (טבלת חומרים). כאשר לא משתמשים במערכת זו, ניתן לבצע ניתוח NET דומה באמצעות חבילת תוכנה בנחלת הכלל 4,18,19,20.
- פתח את תוכנת ניתוח המיקרוסקופיה של התא החי ולחץ על התחבר להתקן. הזן שם משתמש וסיסמה ולחץ על הצג סריקות אחרונות. פתח את הניסוי הנבחר לניתוח על ידי לחיצה כפולה על שם כלי השיט של הניסוי.
- לחץ על הפעל ניתוח ובחר צור הגדרת ניתוח חדשה. לחץ על הבא.
- בחר מנתח בסיסי מהמקטע סוג ניתוח ולחץ על הבא. באזור 'ערוץ תמונה ', בחרו 'ירוק', בטלו את הבחירה ב'שלב' ולחצו על 'הבא'.
- פתחו את החלון Image Layers ובחרו Green ובטלו את הבחירה באפשרות Phase. כבה את קנה המידה האוטומטי במקטע הירוק והגדר ידנית את המינימום והמקסימום עבור הערוץ הירוק כדי להבחין בין NETs לרקע.
הערה: ניתן להפעיל ולכבות ניגודיות פאזה בעת הצורך. לדוגמה, כדי לקבוע אם NETs נפלטים בסביבה החוץ-תאית. - פתח את חלון זמני סריקת כלי השיט ובחר את זמן סריקת כלי השיט המתאים שבו NETs חייבים להיות נוכחים. בחר קבוצה של תמונות המייצגות את השונות בתוך הניסוי (תמונות מבארות בקרה חיוביות עם NETs ותמונות מבארות בקרה שליליות ללא NETs). תמונות אלה ישמשו לתצוגה מקדימה ולליטוש הניתוח. לחץ על הבא.
- פתח את החלון הגדרות הגדרת ניתוח והתחל להתאים את הגדרות הניתוח עבור הערוץ הירוק באופן שמבני ה- NET מתוארים מבלי ליצור NETs חיוביים מוטעים או שליליים מוטעים. השתמשו בקביעות הבאות ולחצו על 'תצוגה מקדימה נוכחית ' או ' תצוגה מקדימה של הכל ' כדי להחיל את הקביעות על התמונות הנוכחיות או על כל התמונות, בהתאמה.
- עבור שם אובייקט, בחר NETs.
- עבור פילוח, בחר ללא חיסור רקע - אדפטיבי.
- עבור סף GCU, בחר בין 3 ל-5 (תלוי בניסוי).
- עבור פיצול קצה, בחר ON (בין -10 ל- 0).
- לניקוי, בחר מילוי חורים: 100 מיקרומטר2 והתאם גודל: -1 פיקסלים.
- עבור מסננים, בחר בהתאם לניסוי, אך ערכי החיתוך המומלצים הם: שטח: >200 מיקרומטר2, עוצמה ממוצעת: <24.6, עוצמה משולבת: >7000.
הערה: מבנים שנבחרו על סמך ההגדרות שנעשה בהן שימוש מתוארים בצבע מגנטה. ריחוף עם העכבר מעל מבנים אלה ייתן מידע נוסף על הפרמטרים של האובייקטים (כלומר, שטח, אקסצנטריות, עוצמה משולבת ועוצמה ממוצעת), מה שעוזר לייעל את הניתוח הקשור לקריטריוני הכללה או אי הכללה עבור פרמטרים של NET. בדוק תמונות מרובות (מבארות בקרה חיוביות ושליליות) כדי לבדוק אם הגדרות הניתוח נכונות.
- כאשר ההגדרות עבור ניתוח NET נכונות, לחץ על הבא. בחר את נקודות הזמן והבארות לניתוח במקטע זמני סריקה ובארות ולחץ על הבא. הוסף את שם ההגדרה במקטע שמירה והחלה של הגדרת ניתוח ולחץ על הבא. לחץ על סיום כאשר פרטי הניתוח מאומתים ונכונים.
הערה: בעת ניתוח לוחות מרובים או שימוש בניתוחים מניסויים קודמים, הפעל ניתוח ובחר העתק הגדרת ניתוח קיימת או השתמש בהגדרת ניתוח קיימת ולחץ על הבא. בחר את הגדרת הניתוח הקיימת המתאימה ולחץ על הבא. עבור הליך הניתוח הבא, עבור לשלב 6.4 אם נבחרה הגדרת ניתוח קיימת של העתק , או לשלב 6.7 כאשר נבחר שימוש בהגדרת ניתוח קיימת . - פתח את ניתוח הניסוי על ידי לחיצה על הניתוח בתוך הכלי המבוקש. פתח את החלון מדדי גרף .
- לחץ על לחצן הפלוס (צור מדד). ניתן להציג נתונים כאחוז מפגש NET (אחוז שטח התמונה המסומן כ-NET) או אחוז נויטרופילים נטו (מספר ה-NETs חלקי מספר התאים).
- בעת הצגת נתונים כאחוז מפגש NET, בחר אזור במקטע מדד ובחר מפגש במקטע ערך . בעת הצגת נתונים כנויטרופילים נטו באחוזים, בחר ספירת אובייקטים במקטע מטרי ובחר לכל תמונה במקטע ערך .
- לחץ על OK. בחר NETs Area Confluence (%) או NETs Object Count per image (per image) במקטע User Defined Metrics . בחר את כל נקודות הזמן שיש לנתח במקטע בחר סריקות . בחר את כל הבארות שיש לנתח בקטע בחר בארות ולחץ על ייצוא נתונים.
- בחר את ההגדרות הבאות במקטע ייצוא גרפים .
- בחר הצג כל סריקה כטבלה משלה (עמודות: 1, 2... שורות: A, B...).
- בחר הצג תוויות שורה ועמודה.
- בחר כל הסריקות בקובץ אחד ולחץ על עיון כדי להתאים את מיקום הקובץ ואת שמו.
- בחר כלול פרטי ניסוי בכותרת העליונה.
- בחר חלק נתונים לתמונות בודדות.
- לחץ/י על ״ייצא ״ כדי לייצא את הנתונים כקובץ ״.txt״, שאותו ניתן לייבא ולנתח בגיליון אלקטרוני.
הערה: כדי לקבוע את אחוז הנויטרופילים ברשת, יש לקבוע את מספר הנויטרופילים ב-t = 0. לשם כך, המשך בשלבים הבאים של הפרוטוקול. - עבור לשלב 6.1 כדי להתחיל את הניתוח הנוסף הדרוש כדי לספור את מספר הנויטרופילים עבור תמונות ב-t = 0.
- בשלב 6.3, בחרו Phase ובטלו את הבחירה בירוק במקטע ערוץ התמונה.
- בשלב 6.4, בחר t = 0 בסעיף זמני סריקת כלי השיט.
- בשלב 6.5, בטל את הבחירה בירוק, בחר שלב והתאם את הגדרות ערוץ הפאזה בעת הצורך.
- בשלב 6.6, הוסף שם אובייקט, בחר מפגש קלאסי במקטע סגמנטציה והגדר את התאמת הפילוח ל- 0 (רקע), התאם את מילוי החורים ל- 100 מיקרומטר2 והתאם את השטח ל- 50 מיקרומטר2.
- בשלב 6.7, בחר t = 0 במקטע בחירת סריקות.
- בשלב 6.8, פתח ניתוח ספירת נויטרופילים.
- בשלב 6.9, בחר ספירת אובייקטים לתמונה (לכל תמונה) במקטע מדדים המוגדרים על-ידי המשתמש .
- לבסוף, השתמש בחישוב הבא כדי ליצור את אחוז הנויטרופילים ברשת: (מספר NETs / מספר הנויטרופילים ב- t = 0) x 100%.
תוצאות
מיקרוסקופיה בתפוקה גבוהה בזמן אמת, בשילוב עם צבע DNA אטום מאפשרת לחקור את הקינטיקה, המאפיינים והמסלולים הבסיסיים של NETosis ומאפשרת להעריך מעכבים פוטנציאליים של שחרור NET. בגישה זו, NETs הוגדרו כמבנים חיוביים לצבע DNA עם שטח פנים גדול משמעותית בהשוואה לשטח הפנים של נויטרופילים בריאים (איור 1A), מה שמצביע על כך שכרומטין נפלט לסביבה החוץ-תאית18. הניתוח מבוסס שטח הפנים איפשר לנו להבחין בין NETs לבין נויטרופילים מופעלים עם שלמות קרום פלזמה שנפגעה, המראים צביעת DNA תוך-תאית בהירה (איור 1A).
סידן יונופור (A23187) ו-PMA משמשים בדרך כלל לגרימת NETosis במבחנה. למרות היותם גירויים לא פיזיולוגיים, הם בעלי ערך מכיוון שהם מפעילים מסלולי NETosis מובהקים ומבטיחים אינדוקציה עקבית של NETosis עם שונות נמוכה בין תורמים. A23187 מעורר זרימת סידן, מה שמוביל להפעלת PAD4 ולשחרור של NETs עשירים בהיסטונים ציטרולין, בעוד ש-PMA מפעיל את קומפלקס NADPH אוקסידאז, וכתוצאה מכך ייצור מיני חמצן תגובתיים (ROS) ושחרור לאחר מכן של NETs עם רמות נמוכות של היסטונים ציטרולינים 5,16,21. המהירות והעוצמה של תגובת NETosis תלויים בריכוז של כל גירוי (איור 1B,C), כאשר A23187 גורם ל-NETosis מהיר יותר, ו-PMA גורם לשיעור גבוה יותר של נויטרופילים לשחרר NETs (איור 1D-F). NETs שנבעו מגירוי A23187 (איור 1D; חץ אדום) היו נבדלים מ-NETs המושרים על ידי PMA (איור 1D; חץ צהוב) בכך שהיו מפוזרים יותר מעבר לממברנת הפלזמה הנויטרופילית, בעוד ש-NETs המושרים על ידי PMA נשארו קרובים יותר לממברנת הפלזמה של הנויטרופילים. נוסף על כך, גירוי A23187 הביא לנויטרופילים חיוביים לצבע דנ"א חדירים שאינם נטו (איור 1D; חץ כחול), שלא הוציאו את הדנ"א שלהם לחלל החוץ-תאי. הזיהוי של נויטרופילים חדירים שאינם נטו היה תלוי בריכוז של A23187 (איור 1G) וכמעט נעדר ללא קשר לריכוז ה-PMA המשמש לגירוי NETosis (איור 1D,H). מלבד שימוש בגירויים הלא פיזיולוגיים של NETosis A23187 ו-PMA, בדיקה זו מתאימה גם לחקר טריגרים רלוונטיים למחלה של NETosis. לדוגמה, נויטרופילים המופעלים עם קומפלקסים חיסוניים מסיסים (sIC) או גבישים הקיימים במחלת נטיית סידן פירופוספט (CPPD) הראו שחרור NET מוגבר משמעותית בהשוואה ללא גירוי. מגמה של רמות NET גבוהות נצפתה כאשר נויטרופילים הופעלו עם קומפלקסים חיסוניים מצופים (cIC), fMLP וגבישי מונוסודיום אוראט (MSU) (איור 1I); עם זאת, עבור גירויים אלה, ראינו שונות ניכרת בין תורם לתורם.
עיכוב פרמקולוגי של מסלול NETosis ואנזימים הקשורים ל-NETosis הראה כי טיפולים ממוקדי NETosis יכולים להיות טיפולים יעילים למחלות שבהן הצטברות NET מניעה באופן משמעותי את הפתולוגיה 14,17,22,23,24. בדיקת NET מיקרוסקופית בזמן אמת זו היא גישה קלה, אמינה וניתנת לשחזור לחקר אנטגוניסטים של NETosis בצורה בעלת תפוקה גבוהה. כדי להדגים זאת, השתמשנו בנוגדנים חד-שבטיים אנושיים מהשורה הראשונה, CIT-013, המכוונים להיסטון H2A ו-H4 עם זיקה גבוהה15,16. A23187 מפעיל את מסלול NETosis, וכתוצאה מכך NETs המכילים היסטונים ציטרולינים אשר לאחר מכן ממוקדים על ידי CIT-013 לבצע את פונקציית מעכב NETosis16. ואכן, שחרור NET בתגובה ל-A23187 עוכב לחלוטין על ידי CIT-013 (איור 2A וסרטון משלים 1), עם IC50 של 4.6 ננומטר (איור 2B). היכולת מעכבת NETosis של CIT-013 היא ייחודית מכיוון שנוגדנים מסחריים אחרים המכוונים להיסטונים שונים (לא) ציטרולינים לא הצליחו לעכב שחרור NET (איור 2C).
בעבר, הראינו כי מולקולת מבשר דומה מאוד של CIT-013 (שתי חומצות אמינו שונות אך קושרת אפיטופים דומים עם זיקה שווה) חוסמת NETosis בתגובה לגירויים פיזיולוגיים כגון טסיות דם פעילות, נוזל סינוביאלי גאוט וכן נוזל סינוביאלי RA17. כאן, אנו מראים ששחרור NET המושרה על ידי sIC יכול להיות מעוכב על ידי CIT-013 (איור 2D). הרלוונטיות הטיפולית של עיכוב NETosis הנגרמת על ידי גירוי זה מודגשת על ידי זאבת, RA ומחלות אוטואימוניות אחרות, כאשר נוגדנים עצמיים בסרום או בנוזל הסינוביאלי תומכים ביצירת IC, המעורר NETosis25,26.
יחד, נתונים אלה מוכיחים כי גישת מיקרוסקופיה זו בזמן אמת מתאימה לחקר הקינטיקה והמאפיינים של שחרור NET ומאפשרת חקר מעכבי NETosis. למרות ששיטה זו עברה אופטימיזציה לשימוש בנויטרופילים אנושיים, עם שינויים היא עשויה להתאים גם לחקר נויטרופילים ממינים אחרים. הנתונים שנוצרו עם בדיקה זו הם אבן פינה של הרציונל של CIT-013 כטיפול חזק ויעיל למחלות מונעות NET.
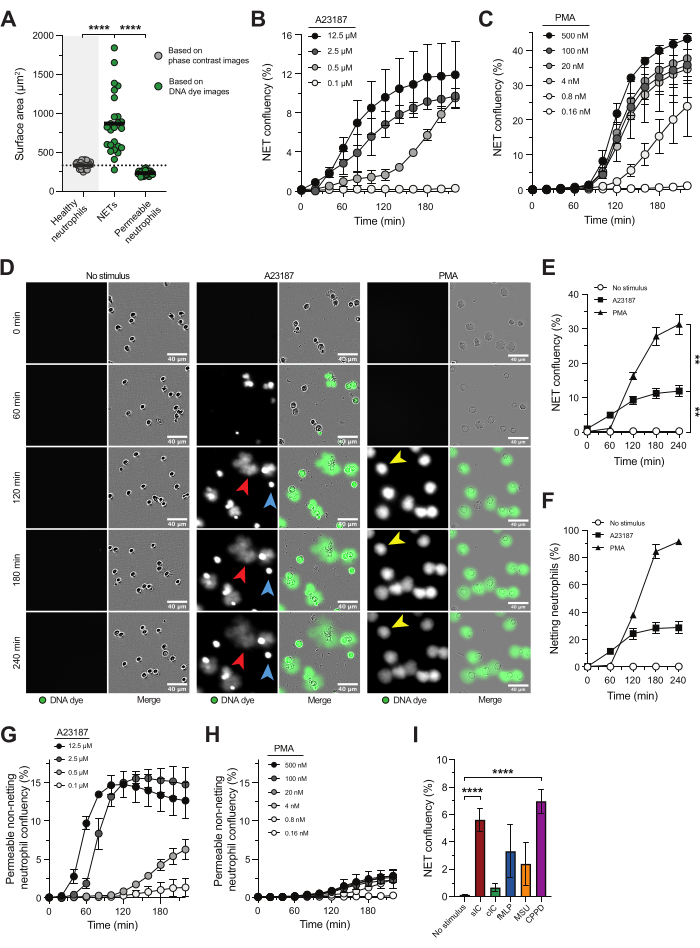
איור 1: מיקרוסקופיה בתפוקה גבוהה בזמן אמת עבור חקר שחרור NET. נויטרופילים שבודדו מדמם של מתנדבים בריאים עוררו עם A23187 או PMA כדי לעורר את מסלול NETosis. שחרור NET הודגם במיקרוסקופיה בתפוקה גבוהה בזמן אמת באמצעות צבע DNA אטום של ממברנת פלזמה וכומת על סמך שטח הפנים עם תוכנת מערכת ניתוח מיקרוסקופיה של תאים חיים. (A) ניתוח שטח הפנים של נויטרופילים בריאים לא מגורים (אפור), NETs חוץ-תאיים ונויטרופילים חדירים שאינם נטו עם צביעת DNA תוך-תאית (ירוק). (ב,ג) כימות שחרור NET לאורך זמן מנויטרופילים מגורים עם ריכוזי A23187 או PMA המצוינים (n = 2). (D) תמונות מייצגות של שחרור NET בתגובה ל-A23187 (חיצים אדומים) ו-PMA (חיצים צהובים) בנקודות זמן שונות. דוגמאות לנויטרופילים חדירים שאינם רשת מסומנים בחיצים כחולים. (ה) כימות שחרור NET לאורך זמן המוצג כאחוז של מפגש NET (n = 5). הסטטיסטיקה בוצעה על t = 240 דקות (F) כימות שחרור NET לאורך זמן הוצג כאחוז של נויטרופילים נטו (n = 2). (ז, ח) כימות של נויטרופילים חדירים שאינם נטו לאורך זמן מנויטרופילים שעוררו עם ריכוזי A23187 או PMA המצוינים (n = 2). (I) כימות שחרור NET ב-t = 240 דקות המושרה על ידי קומפלקסים חיסוניים מסיסים (sIC), IC מצופה (cIC), fMLP, גבישי מונוסודיום אוראט (MSU) וגבישים הקיימים במחלת סידן פירופוספט (CPPD) (n = 8-28). התוצאות מדווחות כממוצע ± שגיאת תקן של הממוצע. **P < 0.01, ו-****P < 0.0001, מדידות חוזרות ANOVA חד-כיווניות עם מבחן ההשוואות המרובות של דאנט (B), מבחן Kruskal-Wallis עם מבחן ההשוואות המרובות של דאן (I). לוחות A-F שונו באישור ואן דר לינדן ואחרים.16. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
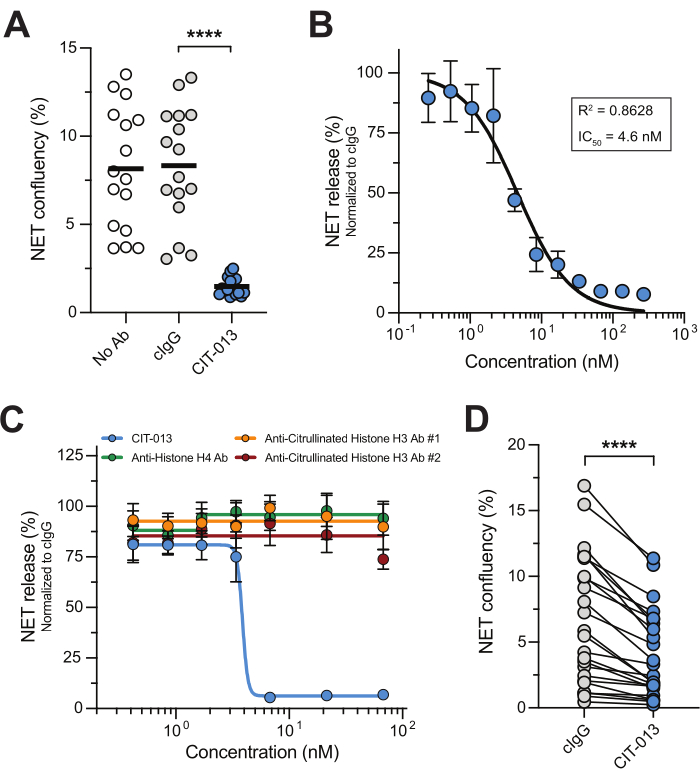
איור 2: CIT-013 מעכב שחרור NET. (A) כימות של שחרור NET המושרה על ידי A23187 ב-t = 240 דקות בהיעדר (No Ab) או נוכחות של CIT-013 או נוגדן בקרת איזוטיפ (cIgG). (B) עיכוב תלוי מינון של שחרור NET המושרה על ידי A23187 עם CIT-013 ב-t = 240 דקות (n = 3). הנתונים נורמלו ל-cIgG (הוגדר כשחרור NET של 100%). (C) כימות של שחרור NET המושרה על ידי A23187 ב-t = 240 דקות בנוכחות ריכוזים מצוינים של CIT-013, נוגדן H4 אנטי-היסטון, נוגדן היסטון H3 אנטי-ציטרולין #1, או נוגדן היסטון H3 אנטי-ציטרולין #2 (n = 6). (D) כימות שחרור NET ב-t = 240 דקות המושרה על ידי קומפלקסים חיסוניים מסיסים (ICs) בנוכחות CIT-013 או cIgG. התוצאות מדווחות כממוצע ± שגיאת תקן של הממוצע. P < 0.0001, מדידות חוזרות של ANOVA חד-כיווני עם ההשוואות המרובות של טוקי (A) או מבחן הדירוג החתום של זוגות מותאמים של Wilcoxon דו-זנב (D). לוחות A, B ו-D שונו באישור ואן דר לינדן ואחרים.16. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| צלחת 96 באר #1 | צלחת 96 בארות #2 | |
| נפח 0.001% תמיסת פולי-L-ליזין לבאר | 50 מיקרוליטר | 100 מיקרוליטר |
| נפח תרחיף נויטרופילים לבאר | 50 מיקרוליטר | 87.5 מיקרוליטר |
| מספר נויטרופילים לבאר | 2 x 104 תאים | 3.5 x 104 תאים |
| נפח 4x צבע DNA מרוכז (= 80 ננומטר) במאגר בדיקת NET לכל באר | 50 מיקרוליטר | 87.5 מיקרוליטר |
| גירוי NETosis מרוכז פי 4 במאגר בדיקת NET לכל באר | 50 מיקרוליטר | 87.5 מיקרוליטר |
| נפח 4x אנטגוניסטים מרוכזים של NETosis במאגר בדיקת NET לכל באר | 50 מיקרוליטר | 87.5 מיקרוליטר |
טבלה 1: נפחים ומספרי תאים המותאמים ללוחות הדמיה שונים של 96 בארות.
| פתרון עבודה מרוכז (מרוכז פי 4) | ריכוז סופי | |
| סידן יונופור (A23187) | 50 מיקרומטר | 12.5 מיקרומטר |
| PMA | 16 ננומטר | 4 ננומטר |
| fMLP | 4 מיקרומטר | 1 מיקרומטר |
| גבישי מונוסודיום אוראט (MSU). | 400 מיקרוגרם/מ"ל | 100 מיקרוגרם/מ"ל |
| גבישי מחלת סידן פירופוספט (CPPD) | 400 מיקרוגרם/מ"ל | 100 מיקרוגרם/מ"ל |
| קומפלקסים חיסוניים מסיסים (sIC) | 1. הוסף 5 מיקרוגרם/מ"ל אלבומין בסרום אנושי (HSA) ב-DPBS ל-282.5 מיקרוגרם/מ"ל נוגדן אנטי-HSA של ארנב רב-שבטי ב-DPBS. | |
| 2. דגירה לפחות 90 דקות בטמפרטורה של 37 מעלות צלזיוס. | ||
| 3. הומוגניזציה על ידי מערבולת והוספת תמיסת sIC של 50 מיקרוליטר לבארות המתאימות. | ||
| קומפלקסים חיסוניים מצופים (cIC) | 1. הוסף 10 מיקרוגרם/מ"ל HSA ב-DPBS בבארות המתאימות של צלחת 96 הבארות. | |
| 2. דגירה למשך הלילה בטמפרטורה של 4 מעלות צלזיוס. | ||
| 3. שטפו את הבארות 3 פעמים עם 200 מיקרוליטר 0.05% Tween-20 ב-DPBS (להלן PBS/0.05%Tween). | ||
| 4. חסום את הבארות עם 200 מיקרוליטר 1% (w/v) אלבומין בסרום בקר ב-PBS/0.05% טווין (המכונה להלן מאגר חוסם). | ||
| 5. דגירה למשך 120 דקות בטמפרטורת החדר ותסיסה עדינה (400 סל"ד). | ||
| 6. שטפו את הבארות 3 פעמים עם 200 מיקרוליטר PBS/0.05% טווין. | ||
| 7. הוסף נוגדן אנטי-HSA של ארנב רב-שבטי של 50 מיקרוליטר בחסימת מאגר לבארות המתאימות. | ||
| 8. דגירה למשך 60 דקות בטמפרטורת החדר ותסיסה עדינה (400 סל"ד). | ||
| 9. שטפו את הבארות 3 פעמים עם 200 מיקרוליטר PBS/0.05% טווין. | ||
| 10. לבסוף, שטפו את הבארות 3 פעמים עם 200 מיקרוליטר DPBS. בארות מוכנות כעת לשלב 4.7 בפרוטוקול. | ||
טבלה 2: ריכוזים מומלצים לגירוי NETosis.
| פתרון עבודה מרוכז (מרוכז פי 4) | ריכוז סופי | |
| נוגדן ליזוזים ביצת תרנגולת נגד תרנגולת (נוגדן בקרה; cIgG) | 80 ננומטר | 20 ננומטר |
| CIT-013 | 80 ננומטר | 20 ננומטר |
טבלה 3: ריכוזים מומלצים לאנטגוניסט NETosis.
סרטון משלים 1. נויטרופילים עוררו עם A23187 בנוכחות cIgG (משמאל) או CIT-013 (מימין), ושחרור NET הודגם לאורך זמן באמצעות צבע ה-DNA האטום של קרום הפלזמה. שחרור NET מעוכב בנוכחות CIT-013. הסרט הוא שכבת על של צבע DNA (ירוק) וניגודיות פאזה. סרטון זה הושג באישור ואן דר לינדן ואחרים.16. אנא לחץ כאן להורדת סרטון זה.
Discussion
מאז גילוי ה-NETs ב-2004, פותחו אסטרטגיות רבות לחקר שחרור NET במבחנה, כאשר מיקרו-קופי אימונופלואורסצנטי הוא הטכניקה הנפוצה ביותר לכימות NETosis27,28. למרות שמיקרוסקופיה שימושית להמחשת שחרור NET, יש לה מגבלות מכיוון שכימות מיקרוסקופי לא אוטומטי של תמונות נקודת זמן קבועה אינו מדויק למדי ויכול לסבול מהטיית צופה. טכניקה נוספת המשמשת לחקר שחרור NET היא ציטומטריית זרימת הדמיה מולטי-ספקטרלית29,30, המודדת מספר רב של נויטרופילים נטו ומאמצת ניתוח בלתי מוטה, אך מתמקדת בנויטרופילים בשלבים המוקדמים של NETosis ואינה מכמתת נויטרופילים ששחררו את ה-NETs שלהם. מחקרים רבים על קינטיקה של NETosis משתמשים בצבע DNA כדי לכמת שחרור NET בשילוב עם קורא לוחות פלואורסצנטי31. טכניקה זו אינה מסוגלת להבחין בין NETs לבין נויטרופילים מופעלים או גוססים עם צביעת DNA תוך תאית, ולכן אינה מתאימה לכימות שחרור NET ולחקר אנטגוניסטים של NETosis. האמור לעיל מדגיש כי גישות המשמשות כיום לחקר NETosis הן בעלות ערך אך יש להן מגבלות.
שיטת המיקרוסקופיה בזמן אמת המתוארת במחקר זה מטפלת בבעיות רבות שנמצאו בטכניקות שדווחו בעבר. הוא מציע כימות NET חסר פניות, אוטומטי למחצה, תפוקה גבוהה, ניתן לשחזור ומדויק. ואכן, גישה זו ממזערת חפצי פיפטינג, כמו המורפולוגיה המתוחה של NETs18, והיא מסוגלת להבחין בין NETosis לנמק ואפופטוזיס באמצעות המורפולוגיה והקינטיקה המובהקות של שחרור ה-DNA18,32. בנוסף, גישה זו מספקת הזדמנות לחקור מסלולים ביוכימיים שונים למוות תאי מווסת, כמו היווצרות NET בנויטרופילים נקרופטוטיים, המייצרים מבנים העומדים בקריטריונים התפקודיים והפנוטיפיים של NETs33.
ישנם מספר שלבים קריטיים בפרוטוקול זה שיש לבצע לכימות מוצלח של NETs. ראשית, המספר הנכון של תאים לבאר חשוב לכימות מדויק של NET. כאשר צפיפות הנויטרופילים גבוהה מדי, תאים ו-NETs יחפפו לתאים סמוכים ול-NETs, מה שמקשה על ההבחנה ביניהם, וכתוצאה מכך, הכימות יהפוך ללא מדויק. שנית, זהו תנאי מוקדם לשימוש בריכוז נמוך של צבע קשירת DNA אטום לקרום פלזמה לא רעיל כדי להכתים NETs כאשר הם מופרשים לסביבה החוץ-תאית. צבעי קשירת DNA חדירים לקרום פלזמה יכולים לגרום בקלות להפעלת נויטרופילים או למוות של תאים. שלישית, יש לסרוק מספר תמונות לכל באר לסקירה מייצגת של שחרור NET בקרב אוכלוסיית הנויטרופילים ההטרוגנית. רביעית, תמונת ניגוד הפאזה של נויטרופילים ב-t = 0 נחוצה כדי לתקן את מספר הנויטרופילים לתמונה ולחשב את אחוז הנויטרופילים ברשת.
למרות שלגישה זו של מיקרוסקופיה בזמן אמת עם תפוקה גבוהה יש יתרונות רבים על פני מבחני זיהוי NET אחרים, ישנן מגבלות לשיטה זו מכיוון שלמיטב ידיעתנו, אין צבעים פלואורסצנטיים זמינים לאיתור רכיבי NET נוספים כדי לאשר את שחרור ה-NETs. ניתן להשתמש בנוגדנים עם תווית פלואורסצנטית לזיהוי רכיבי NET נוספים, אך עלולות להיות להם השפעות לא רצויות מכיוון שמתחמים חיסוניים של נוגדנים משפיעים על הפעלת נויטרופילים ואולי NETosis. לכן, אנו מעדיפים לא להשתמש בנוגדנים נוספים במערך בדיקה זה וממליצים להשתמש במקום זאת בגירויים מעוררי NETosis ידועים. כאשר עדיין לא נעשה שימוש בגירויים של NETosis, אנו תומכים בשימוש ב-ELISA לאיתור DNA מורכב עם חלבונים ספציפיים ל-NET כגון היסטונים ציטרולינים לפני בדיקת ההדמיה החיה. שנית, שונות תוך-ובין בדיקות עשויה לנבוע משונות בין תורם לתורם, כאשר נויטרופילים מתורמים בריאים מגיבים באופן שונה לגירויים שונים של NETosis עקב הטרוגניות בתוך האוכלוסייה הבריאה. כדי למזער את השונות בבדיקה, יש לבודד נויטרופילים תוך שעה אחת מדם טרי שנשאב ולהשתמש בהם מיד בניסוי מכיוון שנויטרופילים הם קצרי חיים ולא ניתן לשמר אותם בהקפאה. יתר על כן, חשוב שפרוטוקול בידוד נויטרופילים יאושר ויאומץ כדי למזער את הפעלת הנויטרופילים. נויטרופילים הם תאים רגישים ויכולים לשנות את תגובתם לגירויים במהלך תהליך הטיהור עקב לחץ מכני וסוגים אחרים של מתח. מצב הפעלת הנויטרופילים ושחרור ה-NET יכולים להיות מושפעים מסוג המחט, צינורות איסוף הדם בהם נעשה שימוש, טמפרטורת הדגירה, מהירות הצנטריפוגה והזמן מאיסוף הדם לבידוד הנויטרופילים 34,35,36,37. שיטת בידוד נויטרופילים נוספת שניתן לשקול מתוארת על ידי Krémer et al.36 תוך שימוש בשיטת ברירה אימונומגנטית שלילית ללא ליזה של כדוריות דם אדומות. שיטה זו דומה לנויטרופילים שלא נגעו בהם בדם מלא ועשויה להתאים למניעת הפעלת נויטרופילים במהלך תהליך הטיהור. כל האמור לעיל צריך לשמש כדי להזהיר את התחום שיש להשוות נתונים מקבוצות מחקר שונות בזהירות רבה.
בסך הכל, שיטת המיקרוסקופיה המתוארת בזמן אמת בתפוקה גבוהה מאפשרת כימות מדויק של NETs בצורה ניתנת לשחזור ויעיל וניתן להשתמש בה כדי לחקור את המאפיינים, הגודל והקינטיקה של שחרור NET ומאפשרת לחקור את פעילותם של אנטגוניסטים של NETosis. כדוגמה לאחרון, השתמשנו בנוגדנים חד-שבטיים H2A ו-H4 CIT-013 שהואנשו נגד ציטרולין, שנמצא כעת בפיתוח קליני.
Disclosures
הכותבים הם עובדי סיטריל ויש להם אינטרסים כלכליים.
Acknowledgements
המחברים רוצים להודות לפול וינק על ניהול חלק מהפרויקט בנוגע לשיטת מיקרוסקופיית הדמיה חיה.
Materials
| Name | Company | Catalog Number | Comments |
| A-23187 Free Acid (Calcimycin) | Thermo Fisher | A1493 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | A9434 | |
| Anti-Hen egg lysozyme (control antibody; cIgG) | CrownBio | C0001 | |
| APC-Cy7-conjugated mouse anti-human CD45 antibody (Clone 2D1) | Biolegend | 368515 | Use at 1 µg/mL final concentration |
| BD FACSCantoTM II system + FACSDiva software (version 8.0.1) | BD | n/a | Flow cytometry system |
| Bovine Serum Albumin (BSA) Fraction V | Roche | 10735108001 | |
| CaCl2 (1 M) | VWR | E506 | |
| Calcium pyrophosphate disposition disease (CPPD) crystals | InvivoGen | lrl-cppd | |
| Cellometer Auto T4 Bright Field Cell Counter + analysis software (version 3.3.9.5) | Nexcelom Bioscience | n/a | Bright field cell counter |
| CIT-013 | Citryll B.V. | n/a | |
| Costar black 96-well plate, clear bottom | Corning | 3603 | 96-well plate #1 |
| Dextran T500 | Pharmacosmos | 551005009006 | |
| DPBS (1x) | Gibco | 14190-144 | |
| Fetal Bovine Serum (FBS) | Serena | S-FBS-SA-015 | |
| Ficoll | GE Healthcare | 17-1440-02 | Density gradient solution |
| FITC-conjugated mouse anti-human CD66b antibody (Clone G10F5) | eBioscience | 17-0666-42 | Use at 1.5 µg/mL final concentration |
| Fixable viability dye eFluor 506 | eBioscience | 65-0866-14 | |
| Flow cytometry analysis software | FLowJo | Version 10.8.0 | |
| fMLP | Sigma Aldrich | 47729-10MG-F | |
| HEPES (1M) | Gibco | 15630-080 | |
| Human serum albumin (HSA) | VWR | 31020 | |
| Human TruStain FcX | Biolegend | 422302 | Fc receptor block |
| IBIDI 96-well plate, clear bottom | IBIDI | 89626 | 96-well plate #2 |
| IncuCyte SX3 + analysis software (version 2022B Rev1) | Satorius | n/a | Live cell microscopic analysis system |
| Monosodium urate crystals | InvivoGen | tlrl-msu | |
| Mouse anti-histone H3 (citrulline R2 + R8 + R17) antibody | Cayman | 17939 | Clone 11D3; referred to as #1 |
| Mouse anti-histone H4 (K8Ac + K12Ac + K16Ac) antibody (Clone KM-2) | Absolute Antibodies | Ab01681-2.0 | |
| Na2EDTA | Sigma Aldrich | E5134 | |
| NaCl (0.9%) | B. Braun | 25900 | |
| Penicillin (5000 U/mL) - Streptomycin (5000 µg/mL) | Gibco | 15070-063 | |
| PerCP-Cy5.5-conjugated mouse anti-human CD16 antibody (Clone 3G8) | Biolegend | 302027 | Use at 0.33 µg/mL final concentration |
| PMA | Sigma Aldrich | P1585 | |
| Polyclonal rabbit anti-HSA antibody | Sigma Aldrich | A0433-2ml | |
| Poly-L-Lysine (0.01%) | Sigma Aldrich | P4832 | |
| Potassium bicarbonate (KHCO3) | Sigma Aldrich | 237205 | |
| Rabbit anti-histone H3 (citrulline R2 + R8 + R17) antibody | Abcam | ab281584 | Multiclonal; referred to as #2 |
| RPMI 1640 with GlutaMAXTM supplement | Gibco | 61870-010 | Culture medium containing L-glutamine |
| RPMI 1640 without phenol red | Gibco | 11835-030 | Culture medium without phenol red |
| Sodium azide (NaN3) | Sigma Aldrich | S2002 | |
| Sterile H2O | Gibco | 15230204 | |
| Sytox Green Nucleid Acid Stain | Thermo Fisher | S7020 | DNA dye |
| Trypan blue solution (0.4%) | Gibco | 15250-061 | |
| Tween-20 | Sigma Aldrich | P1379 | |
| Vacutainer blood tubes Li-Heparin (17 IU/mL) | BD | 367526 |
References
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- De Bont, C., Pruijn, G. J. M. Citrulline is not a major determinant of autoantibody reactivity to neutrophil extracellular traps. Philos Trans R Soc Lond B Biol Sci. 378 (1890), 20220249 (2023).
- Urban, C. F., et al. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans. PLoS Pathog. 5 (10), e1000639 (2009).
- Hoppenbrouwers, T., et al. In vitro induction of NETosis: Comprehensive live imaging comparison and systematic review. PLoS One. 12 (5), e0176472 (2017).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. ELife. 6, e24437 (2017).
- Parker, H., Dragunow, M., Hampton, M. B., Kettle, A. J., Winterbourn, C. C. Requirements for NADPH oxidase and myeloperoxidase in neutrophil extracellular trap formation differ depending on the stimulus. J Leukoc Biol. 92 (4), 841-849 (2012).
- Neeli, I., Radic, M. Opposition between PKC isoforms regulates histone deimination and neutrophil extracellular chromatin release. Front Immunol. 4, 38 (2013).
- Bosmann, M., Ward, P. A. Protein-based therapies for acute lung injury: targeting neutrophil extracellular traps. Expert Opin Ther Targets. 18 (6), 703-714 (2014).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 18 (2), 134-147 (2018).
- Shiratori-Aso, S., Nakazawa, D. The involvement of NETs in ANCA-associated vasculitis. Front Immunol. 14, 1261151 (2023).
- Byrd, A. S., et al. Neutrophil extracellular traps, B cells, and type I interferons contribute to immune dysregulation in hidradenitis suppurativa. Sci Transl Med. 11 (508), eaav5908 (2019).
- Kimball, A. S., Obi, A. T., Diaz, J. A., Henke, P. K. The emerging role of NETs in venous thrombosis and immunothrombosis. Front Immunol. 7, 236 (2016).
- O'Neil, L. J., et al. Neutrophil extracellular trap-associated carbamylation and histones trigger osteoclast formation in rheumatoid arthritis. Ann Rheum Dis. 82 (5), 630-638 (2023).
- Li, M., et al. A novel peptidylarginine deiminase 4 (PAD4) inhibitor BMS-P5 blocks formation of neutrophil extracellular traps and delays progression of multiple myeloma. Mol Cancer Ther. 19 (7), 1530-1538 (2020).
- Chirivi, R. G. S., et al. Anti-citrullinated protein antibodies as novel therapeutic drugs in rheumatoid arthritis. J Clin Cell Immunol. S6, 006 (2013).
- Van der Linden, M., et al. Anti-citrullinated histone monoclonal antibody CIT-013, a dual action therapeutic for neutrophil extracellular trap-associated autoimmune diseases. MAbs. 15 (1), 2281763 (2023).
- Chirivi, R. G. S., et al. Therapeutic ACPA inhibits NET formation: a potential therapy for neutrophil-mediated inflammatory diseases. Cell Mol Immunol. 18 (6), 1528-1544 (2021).
- Van der Linden, M., Westerlaken, G. H. A., Van Der Vlist, M., Van Montfrans, J., Meyaard, L. Differential signalling and kinetics of neutrophil extracellular trap release revealed by quantitative live imaging. Sci Rep. 7 (1), 6529 (2017).
- Hoffmann, J. H. O., Schaekel, K., Gaiser, M. R., Enk, A. H., Hadaschik, E. N. Interindividual variation of NETosis in healthy donors: introduction and application of a refined method for extracellular trap quantification. Exp Dermatol. 25 (11), 895-900 (2016).
- Silva, L. M., Moutsopoulos, N., Bugge, T. H., Doyle, A. Live imaging and quantification of neutrophil extracellular trap formation. Curr Protoc. 1 (7), e157 (2021).
- De Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochim Biophys Acta Mol Cell Res. 1865 (11 Pt A), 1621-1629 (2018).
- Gajendran, C., et al. Alleviation of arthritis through prevention of neutrophil extracellular traps by an orally available inhibitor of protein arginine deiminase 4. Sci Rep. 13 (1), 3189 (2023).
- Biron, B. M., Chung, C. -. S., O'Brien, X. M., Chen, Y., Reichner, J. S., Ayala, A. Cl-Amidine prevents histone 3 citrullination and neutrophil extracellular trap formation, and improves survival in a murine sepsis model. J Innate Immun. 9 (1), 22-32 (2017).
- Perdomo, J., et al. Neutrophil activation and NETosis are the major drivers of thrombosis in heparin-induced thrombocytopenia. Nat Commun. 10 (1), 1322 (2019).
- Lood, C., et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nat Med. 22 (2), 146-153 (2016).
- Kraaij, T., et al. A novel method for high-throughput detection and quantification of neutrophil extracellular traps reveals ROS-independent NET release with immune complexes. Autoimmun Rev. 15 (6), 577-584 (2016).
- De Buhr, N., Von Köckritz-Blickwede, M. How neutrophil extracellular traps become visible. J Immunol Res. 2016, 1-13 (2016).
- Brinkmann, V., Laube, B., Abu Abed, U., Goosmann, C., Zychlinsky, A. Neutrophil extracellular traps: How to generate and visualize them. J Vis Exp. (36), e1724 (2010).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. J Immunol Methods. 423, 104-110 (2015).
- Gavillet, M., et al. Flow cytometric assay for direct quantification of neutrophil extracellular traps in blood samples. Am J Hematol. 90 (12), 1155-1158 (2015).
- Sil, P., Yoo, D., Floyd, M., Gingerich, A., Rada, B. High throughput measurement of extracellular DNA release and quantitative NET formation in human neutrophils in vitro. J Vis Exp. (112), e52779 (2016).
- Gupta, S., Chan, D. W., Zaal, K. J., Kaplan, M. J. A high-throughput real-time imaging technique to quantify NETosis and distinguish mechanisms of cell death in human neutrophils. J Immunol. 200 (2), 869-879 (2018).
- D'Cruz, A. A., et al. The pseudokinase MLKL activates PAD4-dependent NET formation in necroptotic neutrophils. Sci Signal. 11 (546), eaao1716 (2018).
- Nash, G., Abbitt, K., Tate, K., Jetha, K., Egginton, S. Changes in the mechanical and adhesive behaviour of human neutrophils on cooling in vitro. Pflugers Arch. 442 (5), 762-770 (2001).
- Hundhammer, T., Gruber, M., Wittmann, S. Paralytic impact of centrifugation on human neutrophils. Biomedicines. 10 (11), 2896 (2022).
- Krémer, V., Godon, O., Bruhns, P., Jönsson, F., De Chaisemartin, L. Isolation methods determine human neutrophil responses after stimulation. Front Immunol. 14, 1301183 (2023).
- Freitas, M., Porto, G., Lima, J. L. F. C., Fernandes, E. Isolation and activation of human neutrophils in vitro. The importance of the anticoagulant used during blood collection. Clin Biochem. 41 (7-8), 570-575 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved