Method Article
Высокопроизводительное микроскопическое количественное определение высвобождения внеклеточной ловушки нейтрофилов человека в режиме реального времени и оценка фармакологии антагонистов
В этой статье
Резюме
Данный протокол описывает высокопроизводительный подход к микроскопии в режиме реального времени для визуализации и количественного определения высвобождения внеклеточной ловушки (НВЛ) нейтрофилов человека in vitro. Воспроизводимый метод позволяет исследовать характеристики и кинетику высвобождения НВЛ при стимуляции различными индукторами нетоза, а также дает возможность оценить фармакологию антагонистов нетоза.
Аннотация
Нейтрофилы играют важную роль во врожденной иммунной защите, используя несколько стратегий, включая высвобождение внеклеточных ловушек нейтрофилов (НВЛ) в процессе, называемом NETosis. Однако в последние два десятилетия стало ясно, что накопление НВЛ в тканях способствует патофизиологии множественных воспалительных и аутоиммунных заболеваний. Поэтому интерес к разработке антагонистов NETosis возрос. Вариативные и нестандартизированные методы обнаружения и анализа NETosis были разработаны параллельно, каждый из которых имеет свои преимущества и ограничения. В данной статье мы описываем метод микроскопии в реальном времени для количественной оценки высвобождения НВЛ у человека, позволяющий изучать NETosis, а также ингибирование НВЛ с высокой пропускной способностью. Полуавтоматический анализ на основе площади поверхности распознает НВЛ и отличает их от активируемых нейтрофилов, не образующих сеттинг. Мы показываем, что нефизиологические индукторы нетоза, ионофор кальция и форбол-12-миристат-13-ацетат (ПМА), запускают высвобождение НВЛ с различными характеристиками и кинетикой. Кроме того, мы показываем, что этот подход позволяет изучать высвобождение НВЛ в ответ на раздражители, связанные с заболеванием, включая иммунные комплексы, N-формилметионин-лейцилфенилаланин (fMLF), кристаллы урата натрия и кристаллы пирофосфата кальция. Чтобы проиллюстрировать полезность этого метода для изучения антагонистов нетоза, мы использовали CIT-013, первый в своем классе ингибитор моноклональных антител с высвобождением НВЛ. CIT-013 нацелен на цитруллинированные гистоны H2A и H4 и эффективно ингибирует высвобождение НВЛ с помощью IC50 4,6 нМ. Другие протестированные антигистонные антитела не обладали этой способностью к ингибированию нетоза. В целом, мы демонстрируем, что этот протокол обеспечивает специфичную, надежную и воспроизводимую высокопроизводительную количественную оценку НВЛ, улучшая изучение характеристик высвобождения НВЛ, кинетики и фармакологии антагонистов NETosis.
Введение
Нейтрофилы в изобилии присутствуют в крови и мигрируют в ткани при инфекции или воспалении. Они играют важную роль в врожденной иммунной защите, используя обширное оружие для защиты хозяина от микробов. Нейтрофилы убивают патогены посредством фагоцитоза, дегрануляции, образования активных форм кислорода (АФК) и высвобождения деконденсированного хроматина, называемого внеклеточными ловушками нейтрофилов (НВЛ) с помощью процесса, называемого NETosis1. НВЛ представляют собой внеклеточные структуры хроматина, украшенные, среди прочего, гранулированными белками и кальпротектином 2,3 и высвобождаемые при стимуляции широким спектром молекул4. NETosis можно в целом разделить на два основных пути: NADPH-оксидаза, зависимый или независимый 5,6,7. Кроме того, аргинин-цитруллинирование N-концевых хвостов гистонов пептидиларгининдеиминазой 4 (PAD4) тесно связано с NETosis и способствует деконденсации хроматина, что в конечном итоге приводит к вытеснению деконденсированного хроматина во внеклеточную среду.
Несмотря на то, что высвобождение НВЛ участвует в элиминации патогенов, многочисленные исследования показали, что аномальное и длительное высвобождение НВЛ связано с развитием различных воспалительных заболеваний, включая острое повреждение легких8, ревматоидный артрит (РА)9, васкулит10 и гнойный гидраденит11. Пагубная роль НВЛ в заболевании многогранна, поскольку НВЛ являются провоспалительными, являются источником аутоантигенов, цитотоксичны для окружающих тканей, вызывают иммунотромбоз и способствуют дифференцировке остеокластов и эрозии костей 9,12,13. Фармакологическое ингибирование пути NETosis низкомолекулярными ингибиторами PAD4 демонстрирует, что терапия, направленная на NETosis, имеет потенциал в качестве лечения заболеваний, при которых накопление NET является важным фактором патогенеза. Вместо нацеливания на фермент PAD4 мы использовали первое в своем классе NETosis, ингибирующее гуманизированное антицитруллинированное моноклональное антитело к гистонам, CIT-013, которое специфически связывается с цитруллинированными гистонами H2A и H415. CIT-013 обладает уникальным двойным механизмом действия, ингибируя высвобождение НВЛ и усиливая макрофаг-опосредованный фагоцитоз НВЛ16. CIT-013 и молекулы-предшественники показали терапевтическую эффективность на нескольких мышиных моделях воспаления, связанного с НВЛ17.
Для изучения высвобождения НВЛ на протяжении многих лет были разработаны различные методы, такие как: 1) обнаружение ДНК с использованием непроницаемого для плазматической мембраны индикатора ДНК в сочетании с иммунофлуоресцентным планшетным ридером, 2) обнаружение ДНК и комплексов ДНК с НВЛ-специфичными белками в надосадочной жидкости на основе иммуноферментного анализа (ИФА), 3) колокализация ассоциированных НВЛ молекул с внеклеточной ДНК с помощью иммуногистохимии, и 4) подходы проточной цитометрии для обнаружения нейтрофилов сетки. Все эти способы имеют свои преимущества и ограничения. Мы разработали высокопроизводительный подход в реальном времени для микроскопического количественного определения высвобождения НВЛ человека, в котором используется непроницаемый для плазматической мембраны краситель ДНК16,18. Описанный метод позволяет исследовать кинетику и характеристики нетоза простым, надежным и воспроизводимым способом, а также позволяет оценить фармакологию антагонистов нетоза, таких как CIT-013.
протокол
Все доноры крови дали информированное согласие в соответствии с Хельсинкской декларацией, а исследование проводилось в соответствии с этическими принципами Citryll для исследований на людях.
ПРИМЕЧАНИЕ: Все действия с человеческой кровью и выделенными нейтрофилами должны выполняться в стерильных условиях в ламинарном шкафу. Когда настройки тормоза и ускорения для центрифугирования не указаны в протоколе, их можно рассмотреть на максимуме.
1. Выделение нейтрофилов из крови
- Соберите периферическую кровь у здоровых добровольцев в литий-гепариновые пробирки и переложите кровь в свежую пробирку объемом 50 мл.
- Промойте литий-гепариновые пробирки 1x DPBS и переложите в ту же пробирку объемом 50 мл, куда была перенесена кровь. Убедитесь, что итоговое соотношение крови к DPBS составляет 1:1. Смешайте кровь и DPBS с помощью пипетирования, чтобы получить однородный раствор.
- Добавьте 13 мл раствора градиента плотности в другую свежую пробирку объемом 50 мл и медленно добавьте (с помощью пипетки на 25 мл) разбавленную кровь в соотношении 1:1 поверх раствора градиента плотности максимум до 50 мл.
- Центрифуга при 400 x g и комнатной температуре (RT) в течение 40 минут с минимальным ускорением и торможением.
ПРИМЕЧАНИЕ: Образуются слои. Слои сверху вниз следующие: 1. плазма; 2. мононуклеарные клетки периферической крови (ПМЦ); 3. решение градиента плотности; 4. Эритроциты/нейтрофилы. - Сначала отбраковывайте плазму с помощью пипетки объемом 10 мл, а затем отбрасывайте PBMC и слой раствора градиента плотности с помощью пластиковой пипетки Пастера в максимально возможной степени, не нарушая слой эритроцитов/нейтрофилов.
- Осторожно ресуспендируйте слой эритроцитов/нейтрофилов путем встряхивания и ресуспендируйте с помощью пипетки 25 мл в 15 мл 1x DPBS.
- Добавьте 25 мл 6% раствора декстрана/0,9% NaCl, перемешайте, десять раз перевернув пробирку, и установите пробирку вертикально на 25 минут при температуре RT.
ПРИМЕЧАНИЕ: Образуются слои. Слои сверху вниз следующие: 1. Нейтрофилы; 2 эритроцита. - Перенесите слой нейтрофилов в свежую пробирку объемом 50 мл с помощью пипетки объемом 10 мл и центрифугируйте в течение 10 минут при 500 x g и RT.
ПРИМЕЧАНИЕ: Будьте осторожны, так как гранула нейтрофила все еще содержит некоторое количество эритроцитов и не прикреплена прочно к трубке. - Утилизируйте надосадочную жидкость путем декантации и ресуспендирования клеточной гранулы с помощью пипетки 10 мл в 10 мл буфера для лизиса хлорида аммония и калия (ACK) (155 мМ NH4Cl, 10 мМ KHCO3 и 0,1 мМ Na2ЭДТА; pH = 7,2), а затем немедленно добавьте 40 мл буфера для лизиса ACK.
- Инкубируйте при РТ, непрерывно переворачивая пробирку, пока раствор не станет полупрозрачным (это занимает 1-5 минут и может варьироваться для каждого донора), и центрифугируйте в течение 10 минут при 350 x g и РТ.
- Удалите надосадочную жидкость и медленно и по каплям добавьте 5 мл питательной среды, содержащей L-глютамин, с добавлением 10% (v/v) инактивированной тепловой фетальной бычьей сыворотки (FBS), 50 ЕД/мл пенициллина и 50 мкг/мл стрептомицина (далее именуемого питательной средой 10%) поверх гранулы нейтрофилов, не вводя нейтрофилы в суспензию. Это позволит эффективно удалить большую часть эритроцитов из гранулы нейтрофилов.
- Осторожно вращайте пробирку объемом 50 мл до тех пор, пока большая часть эритроцитов, присутствующих поверх гранулы нейтрофилов, не будет ресуспендирована в культуральной среде на 10%. Впоследствии удалите надосадочную жидкость, сцедив трубку.
- Ресуспендировать гранулу нейтрофила в 10 мл питательной среды 10%, а при полной суспендии добавить до 50 мл питательной среды 10%. Центрифугируйте в течение 10 мин при 350 x g и RT.
- Удалите надосадочную жидкость и ресуспендируйте клеточную гранулу в 10 мл питательной среды 10%.
2. Окрашивание нейтрофилов для проверки чистоты методом проточной цитометрии
- Чтобы определить концентрацию клеток, разведите суспензию нейтрофилов в 0,4% растворе трипанового синего (соотношение 1:1) и подсчитайте нейтрофилы с помощью счетчика клеток яркого поля.
ПРИМЕЧАНИЕ: Можно использовать и другие методы подсчета. - Перенесите 1 x 105 нейтрофилов в питательной среде 10% в лунки 96-луночного планшета с V-образным дном и центрифугируйте в течение 3 мин при 400 x g и RT.
- Удалите надосадочную жидкость и ресуспендируйте клетки в 50 мкл 1x DPBS с добавлением 1% (w/v) бычьего сывороточного альбумина (BSA) и 0,1% (v/v) NaN3 (далее именуемого флуоресцентно-активируемым буфером для сортировки клеток (FACS)), содержащим Fc-рецепторную блокаду (в 50 раз разбавленной).
- Инкубировать в течение 15 мин при ОТ и добавить 50 мкл буфера FACS, содержащего 50-кратно разбавленное APC-Cy7-конъюгированное мышиное антитело к человеческому CD45, 600-кратное разбавленное PerCP-Cy5,5-конъюгированное мышиное антитело к человеческому CD16, 133-кратное разбавленное FITC-конъюгированное мышиное антитело к человеческому CD66b и 500-кратное разбавленное корректируемое жизнеспособное краситель eFluor 506.
ПРИМЕЧАНИЕ: CD45 экспрессируется на лейкоцитах. CD66b экспрессируется исключительно в гранулоцитах. CD16 высоко экспрессируется в нейтрофилах, низко экспрессируется в эозинофилах и не экспрессируется в базофилах. - Инкубировать в течение 30 мин при РТ в темноте и центрифугировать в течение 3 мин при 400 х г и РТ.
- Выбросьте надосадочную жидкость, ресуспендируйте нейтрофилы в 175 мкл буфера FACS и центрифугируйте в течение 3 мин при 400 x g и RT. Повторите этот шаг один раз.
- Выбросьте надосадочную жидкость и ресуспендируйте гранулу нейтрофила в 175 мкл буфера FACS. Анализируйте образцы с помощью системы проточной цитометрии и соответствующего программного обеспечения.
3. Анализ чистоты нейтрофилов с помощью программного обеспечения для анализа проточной цитометрии
ПРИМЕЧАНИЕ: Анализ данных проточной цитометрии был выполнен с использованием программного обеспечения для анализа проточной цитометрии, как указано в Таблице материалов.
- Выполните литникование в соответствии со следующей пошаговой процедурой.
- Установите временной гейт на графике FSC-A в зависимости от времени, чтобы выбрать область с правильным потоком ячеек.
- Установите элемент ячейки на графике SSC-A и FSC-A для выбора ячеек и исключения мусора.
- Установите жизнеспособный вентиль ячейки на графике FSC-A против AmCyan-A для выбора жизнеспособных клеток.
- Установите лейкоцитарный вентиль на графике FSC-A против APC-Cy7 для выбора клеток CD45+.
- Установите нейтрофильный гейт на графике FITC vs. PerCP-Cy5.5 , чтобы различать CD66b+CD16+ (нейтрофилы), CD66b-CD16+ (эозинофилы) и CD66b-CD16- (базофилы, моноциты и лимфоциты).
- Установите одноклеточный вентиль на графике FSC-H vs. FSC-A для выбора одиночных нейтрофилов.
- Определите чистоту нейтрофилов, представив одиночные нейтрофилы в виде частоты клеток (в клеточных воротах).
ПРИМЕЧАНИЕ: Для этого чистота нейтрофилов должна превышать 85%.
4. Микроскопия с визуализацией в реальном времени
ПРИМЕЧАНИЕ: Этот анализ оптимизирован для нескольких 96-луночных визуализирующих планшетов и различных стимулов и антагонистов нетоза. Приведенный ниже протокол описывает общий вид подхода, который может быть указан с помощью прилагаемых таблиц.
- Готовят 0,001% раствор поли-L-лизина путем разведения 0,01% поли-L-лизина в стерильномН2О в соотношении 1:10.
- Добавьте 0,001% раствор поли-L-лизина в каждую лунку и инкубируйте не менее 1 ч при 37 °C.
ПРИМЕЧАНИЕ: Объем на лунку зависит от 96-луночного визуализирующего планшета (Таблица 1). - Промойте лунки 3 раза 200 мкл DPBS для удаления избытка поли-L-лизина. Выполните все действия в ламинарном шкафу. Снимите крышку пластины и просушите лунки на воздухе, открыв пластину в ламинарном шкафу до полного высыхания (примерно 1 ч).
- Рассчитайте необходимое для эксперимента количество нейтрофилов и перенесите избыток в пробирку объемом 15 мл. Центрифугируйте в течение 10 мин при 350 x g и RT.
Примечание: Количество нейтрофилов в каждой лунке варьируется в зависимости от типа 96-луночного визуализирующего планшета (Таблица 1). Плотность клеток оптимизирована для обеспечения хорошего разделения отдельных клеток, что требуется для правильного анализа. Если плотность нейтрофилов слишком высока, клетки и НВЛ будут перекрываться с соседними клетками и НВЛ, что влияет на качество анализа. - Отбраковывают надосадочную жидкость и ресуспендируют нейтрофилы в культуральной среде без фенольного красного с добавлением 2% (v/v) FBS, 50 ЕД/мл пенициллина и 50 мкг/мл стрептомицина, 10 мМ HEPES и 1 мМ CaCl2 (далее именуемых буфером для анализа НВЛ).
- Подготовьте следующие рабочие растворы.
- Приготовьте 80 нМ краситель ДНК в буфере для анализа НВЛ.
- Приготовьте стимулы NETosis в буфере для анализа NET.
- Подготовьте антагонисты NETosis в буфере для анализа NET.
ПРИМЕЧАНИЕ: Имейте в виду, что концентрации вышеописанных рабочих растворов в 4 раза превышают конечную концентрацию, необходимую в скважине. Рекомендуемые концентрации стимулов NETosis и антагонистов NETosis варьируют (табл. 2 и табл. 3).
- Добавьте в каждую лунку 4x концентрированный краситель ДНК в буфере для анализа NET.
- Добавьте 4x концентрированные стимулы NETosis в буфере для анализа NET в соответствующие лунки и добавьте буфер для анализа NET только в лунки без стимула или в лунки, содержащие покрытые иммунные комплексы (cIC; протокол в таблице 2).
- Добавьте в соответствующие лунки 4х концентрированных антагонистов NETosis в буфере для анализа NET. Добавляйте буфер для анализа NET только в лунки без антагониста.
- Добавьте в каждую лунку суспензию нейтрофилов.
ПРИМЕЧАНИЕ: Объем 4x концентрированного ДНК-красителя, 4x концентрированных стимулов NETosis в буфере для анализа NET, 4x концентрированного антагониста NETosis в буфере для анализа NET, количество нейтрофилов и объем суспензии нейтрофилов на лунку зависят от 96-луночного визуализирующего планшета (Таблица 1). Не допускайте образования пузырьков при пипетировании. - Центрифугируйте планшет в течение 2 мин при 100 x g и RT и вставьте 96-луночный визуализирующий планшет в систему микроскопии живых клеток, помещенную в инкубатор при 37 °C и 5%CO2.
ПРИМЕЧАНИЕ: В течение первой минуты инкубации на дне 96-луночного планшета может образоваться конденсат. Это следует удалить с помощью салфетки.
5. Настройка программного обеспечения системы анализа микроскопии живых клеток для сбора данных
Фазово-контрастные и иммунофлуоресцентные изображения были получены с помощью системы микроскопии живых клеток, управляемой ее аналитическим программным обеспечением.
- Откройте программное обеспечение системы микроскопии живых клеток и нажмите «Подключиться к устройству». Введите логин и пароль. Нажмите «Запланировать» для приобретения и нажмите кнопку с плюсом (Launch add vessel). Затем выберите «Сканировать по расписанию » и нажмите «Далее».
- Чтобы создать новое судно с нуля, выберите «Новое » в разделе «Создать судно » и нажмите «Далее». Выберите «Стандартный » в разделе «Тип сканирования » и нажмите «Далее».
- Выберите следующие настройки сканирования и нажмите Далее: Ячейка за ячейкой: Нет; Каналы изображения: фазово-контрастный и зеленый (время захвата 100 мс); Цель: 20 раз.
- Выберите подходящий тип сосуда для сканирования в разделе «Выбор сосуда » и нажмите «Далее».
- При использовании 96-луночного планшета #1 выберите Corning, plate, 96, N/A, 3603, 96-луночный Corning (Blk/Wht), микропланшеты.
- Если вы используете 96-луночный планшет #2, выберите Nunc, Plate, 96, N/A, 152028, 96-луночный Nunc opt bottom (Blk/Wht), Microplates.
- Укажите местоположение судна в Ящике и нажмите Далее. В разделе «Шаблон сканирования » выберите скважины, которые необходимо отсканировать, выберите количество изображений на лунку (отсканируйте 4 изображения на лунку, чтобы получить репрезентативный обзор) и нажмите «Далее».
ПРИМЕЧАНИЕ: Не выбирайте пустые колодцы, так как это повлияет на автофокусировку. - Предоставьте информацию о судне, вставив, среди прочего, название таблички в раздел блокнота судна и нажмите «Далее». Выберите «Отложить анализ на потом» в разделе «Настройка анализа » и нажмите «Далее».
- Определите расписание сканирования для судна в разделе Расписание сканирования . Выберите Создать новое расписание со сканированием с интервалом в 1 час и выберите 1 час. Выберите Остановить сканирование и 00:05 часов после первого сканирования. Нажмите кнопку Далее и нажмите кнопку Добавить в расписание , если информация о сканировании будет правильной.
- Когда расписание сканирования необходимо отредактировать, дважды щелкните по расписанию сканирования в верхней части экрана. Щелкните правой кнопкой мыши по расписанию сканирования и выберите «Редактировать и настроить» по своему усмотрению. Нажмите на значок дискеты , чтобы сохранить расписание сканирования.
ПРИМЕЧАНИЕ: При визуализации нескольких сосудов (планшетов) в одном эксперименте можно добавить дополнительные сосуды к существующему расписанию сканирования, нажав кнопку с плюсом (Launch add vessel), выбрав Scan on Schedule и нажав Next. Либо создайте новое судно с нуля (см. шаг 5.2 в этом протоколе), скопируйте существующее судно, либо используйте ранее отсканированное судно. Это приводит к последовательному сканированию с той же частотой и настройками, что и предыдущая пластина.
- Когда расписание сканирования необходимо отредактировать, дважды щелкните по расписанию сканирования в верхней части экрана. Щелкните правой кнопкой мыши по расписанию сканирования и выберите «Редактировать и настроить» по своему усмотрению. Нажмите на значок дискеты , чтобы сохранить расписание сканирования.
6. Анализ анализа НЭО микроскопии в реальном времени с использованием программного обеспечения для микроскопии живых клеток
ПРИМЕЧАНИЕ: Для анализа фазово-контрастных и иммунофлуоресцентных изображений использовалось программное обеспечение для анализа микроскопии живых клеток (Таблица материалов). Когда эта система не используется, аналогичный анализ NET может быть выполнен с использованием общедоступного программного пакета 4,18,19,20.
- Откройте программное обеспечение для анализа живых клеток и нажмите «Подключиться к устройству». Введите имя пользователя и пароль и нажмите Просмотреть последние сканирования. Откройте выбранный эксперимент для анализа, дважды щелкнув по названию судна эксперимента.
- Нажмите кнопку Запустить анализ и выберите Создать новое определение анализа. Нажмите Далее.
- Выберите Basic Analyzer в разделе типа анализа и нажмите Next. В разделе «Канал изображения» выберите «Зеленый», снимите флажок «Фаза» и нажмите «Далее».
- Откройте окно «Слои изображения » и выберите «Зеленый », а затем снимите флажок «Фаза». Отключите автомасштабирование в зеленой секции и вручную установите min и max для зеленого канала, чтобы отличать NET от фона.
ПРИМЕЧАНИЕ: Фазовый контраст можно включать и выключать при необходимости. Например, чтобы определить, выводятся ли НВЛ во внеклеточную среду. - Откройте окно Время сканирования сосудов и выберите соответствующее время сканирования сосудов, в течение которого должны присутствовать NET. Выберите набор изображений, отражающих изменчивость в рамках эксперимента (изображения из положительных контрольных лунок с НВЛ и изображения из отрицательных контрольных лунок без НЭО). Эти изображения будут использоваться для предварительного просмотра и уточнения анализа. Нажмите Далее.
- Откройте окно Настройки Определения Анализа и начните настраивать параметры анализа для зеленого канала таким образом, чтобы структуры NET были очерчены, не создавая ложноположительных или ложноотрицательных NET. Используйте следующие настройки и нажмите «Предварительный просмотр текущего» или « Предварительный просмотр всех », чтобы применить настройки к текущему или ко всем изображениям соответственно.
- В поле Имя объекта выберите NETs.
- Для сегментации выберите Без вычитания фона — адаптивный.
- В качестве порогового значения GCU выберите от 3 до 5 (в зависимости от эксперимента).
- Для разделения ребер выберите ВКЛ (от -10 до 0).
- Для очистки выберите Заполнение отверстий: 100 мкм2 и Настройка размера: -1 пикселей.
- Для фильтров выбирайте в зависимости от эксперимента, но рекомендуемые пороговые значения: Площадь: >200мкм2, Средняя интенсивность: <24,6, Интегральная интенсивность: >7000.
ПРИМЕЧАНИЕ: Структуры, выбранные на основе используемых настроек, обводятся пурпурным цветом. Наведение курсора мыши на эти структуры даст больше информации о параметрах объектов (т.е. площади, эксцентриситете, интегральной интенсивности и средней интенсивности), что поможет оптимизировать анализ, связанный с критериями включения или исключения для параметров NET. Проверьте несколько изображений (из положительных и отрицательных контрольных скважин), чтобы проверить правильность настроек анализа.
- Если настройки для анализа NET верны, нажмите кнопку Далее. Выберите временные точки и скважины для анализа в разделе Время сканирования и скважины и нажмите кнопку Далее. Вставьте имя определения в раздел «Сохранить и применить определение анализа» и нажмите кнопку «Далее». Нажмите кнопку Готово, когда информация об анализе будет проверена и верна.
ПРИМЕЧАНИЕ: При анализе нескольких планшетов или использовании анализов из предыдущих экспериментов запустите анализ и выберите Копировать существующее определение анализа или Использовать существующее определение анализа и нажмите Далее. Выберите соответствующее существующее определение анализа и нажмите кнопку Далее. Для последующей процедуры анализа перейдите к шагу 6.4, если выбрано копирование существующего определения анализа , или к шагу 6.7, если выбрано использовать существующее определение анализа . - Откройте анализ эксперимента, щелкнув анализ в интересующем сосуде. Откройте окно Метрики графика .
- Нажмите кнопку с плюсом (Создать метрику). Данные могут быть представлены в виде процента слияния НЭО (процент площади изображения, отмеченной как НВЛ) или процента нейтрофилов сетки (количество НВЛ, деленное на количество клеток).
- При представлении данных в процентах от NET-слияние выберите «Площадь » в разделе «Метрика » и выберите «Confluence» в разделе «Значение ». При представлении данных в процентном соотношении нейтрофилов выберите «Количество объектов » в разделе «Метрика » и выберите «На изображение» в разделе «Значение ».
- Нажмите OK. Выберите NETs Area Confluence (%) или NETs Object Count Per Image (Per Image) в разделе Пользовательские метрики . Выберите все временные точки, которые необходимо проанализировать, в разделе Выбор сканов . Выберите все скважины, которые необходимо проанализировать, в разделе Выберите скважины и нажмите кнопку Экспорт данных.
- Выберите следующие параметры в разделе Экспорт графиков .
- Выберите Показать каждое сканирование как отдельную таблицу (столбцы: 1, 2... строки: A, B...).
- Выберите Показать метки строк и столбцов.
- Выберите «Все сканы в одном файле» и нажмите «Обзор», чтобы настроить расположение и имя файла.
- Выберите Включить сведения об эксперименте в заголовок.
- Выберите Разбить данные на отдельные изображения.
- Нажмите «Экспорт», чтобы экспортировать данные в виде файла «.txt», который можно импортировать и дополнительно проанализировать в электронной таблице.
Примечание: Чтобы определить процентное содержание нейтрофилов, необходимо определить количество нейтрофилов при t = 0. Для этого выполните следующие шаги протокола. - Перейдите к шагу 6.1, чтобы начать дополнительный анализ, необходимый для подсчета количества нейтрофилов для изображений при t = 0.
- На шаге 6.3 выберите «Фаза» и снимите флажок «Зеленый » в разделе канала изображения.
- На шаге 6.4 выберите t = 0 в разделе времени сканирования сосуда.
- На шаге 6.5 снимите флажок «Зеленый», выберите «Фаза» и при необходимости отрегулируйте параметры фазового канала .
- На шаге 6.6 добавьте Имя объекта, выберите Classic Confluence в разделе Segmentation и установите настройку сегментации на 0 (Background), настройте Hole Fill на 100 μm2 и установите Area на 50 μm2.
- На шаге 6.7 выберите t = 0 в разделе выбора сканов.
- На шаге 6.8 откройте функцию «Анализ количества нейтрофилов».
- На шаге 6.9 выберите Количество объектов на изображение (На изображение) в разделе Пользовательские метрики .
- Наконец, используйте следующий расчет для получения процента неттообразующих нейтрофилов: (количество НВЛ / количество нейтрофилов при t = 0) x 100%.
Результаты
Высокопроизводительная микроскопия в реальном времени в сочетании с непроницаемым ДНК-красителем позволяет изучить кинетику, характеристики и основные пути NETosis, а также позволяет оценить потенциальные ингибиторы высвобождения НВЛ. При таком подходе НВЛ определялись как структуры, положительные на ДНК-краситель со значительно большей площадью поверхности по сравнению с площадью поверхности здоровых нейтрофилов (рисунок 1А), что указывает на то, что хроматин был выброшен во внеклеточную среду18. Анализ по площади поверхности позволил нам различить НВЛ и активированные нейтрофилы с нарушенной целостностью плазматической мембраны, демонстрируя яркое окрашивание внутриклеточной ДНК (рис. 1А).
Ионофор кальция (A23187) и PMA обычно используются для индуцирования нетоза in vitro. Несмотря на то, что они являются нефизиологическими стимулами, они ценны, поскольку активируют различные пути нетоза и обеспечивают последовательную индукцию нетоза с низкой вариабельностью между донорами. A23187 вызывает приток кальция, что приводит к активации PAD4 и высвобождению НВЛ, богатых цитруллинированными гистонами, в то время как PMA активирует комплекс оксидазы NADPH, что приводит к образованию активных форм кислорода (АФК) и последующему высвобождению НВЛ с низким уровнем цитруллинированных гистонов 5,16,21. Скорость и величина ответа NETosis зависят от концентрации каждого стимула (рис. 1B,C), при этом A23187 индуцирует более быстрый NETosis, а PMA приводит к более высокой доле нейтрофилов, высвобождающих НВЛ (рис. 1D-F). НВЛ, полученные в результате стимуляции A23187 (рис. 1D; красная стрелка), отличались от НВЛ, индуцированных ФМА (рис. 1D; желтая стрелка), тем, что они были более диффузными за пределами плазматической мембраны нейтрофилов, в то время как индуцированные РМА оставались более прилегающими к плазматической мембране нейтрофилов. Кроме того, стимуляция A23187 приводила к образованию проницаемых нейтрофилов с положительной ДНК-красителями без сетки (рисунок 1D; синяя стрелка), которые не выбрасывали свою ДНК во внеклеточное пространство. Обнаружение проницаемых нейтрофилов ДНК, не содержащих красителей, зависело от концентрации A23187 (рис. 1G) и практически отсутствовало независимо от концентрации PMA, используемого для стимуляции нетоза (рис. 1D, H). Помимо использования нефизиологических стимулов NETosis A23187 и PMA, этот анализ также подходит для изучения триггеров NETosis, связанных с заболеванием. Например, нейтрофилы, активированные растворимыми иммунными комплексами (sIC) или кристаллами, присутствующими при болезни предрасположенности пирофосфата кальция (CPPD), показали значительно большее высвобождение НВЛ по сравнению с отсутствием стимула. Тенденция к повышению уровня НВЛ наблюдалась при активации нейтрофилов покрытыми иммунными комплексами (cIC), fMLP и кристаллами урата натрия (MSU) (рисунок 1I); Тем не менее, для этих стимулов мы наблюдали значительные вариации от донора к донору.
Фармакологическое ингибирование пути NETosis и ферментов, связанных с NETosis, показало, что терапия, направленная на NETosis, может быть эффективным методом лечения заболеваний, при которых накопление НВЛ в значительной степени стимулирует патологию 14,17,22,23,24. Этот микроскопический анализ в реальном времени представляет собой простой, надежный и воспроизводимый подход к изучению антагонистов NETosis с высокой пропускной способностью. Чтобы проиллюстрировать это, мы использовали первое в своем классе гуманизированное моноклональное антитело, CIT-013, которое нацелено на цитруллинированные гистоны H2A и H4 с высоким аффинностью15,16. A23187 активирует путь NETosis, в результате чего НВЛ, содержащие цитруллинированные гистоны, которые впоследствии становятся мишенью CIT-013 для выполнения своей ингибирующей функции NETosis16. Действительно, высвобождение НВЛ в ответ на A23187 было полностью ингибировано CIT-013 (рисунок 2A и дополнительное видео 1) с IC50 4,6 нМ (рисунок 2B). Ингибиторная способность CIT-013 к нетозу уникальна, поскольку другие коммерческие антитела, нацеленные на различные (не-) цитруллинированные гистоны, не способны ингибировать высвобождение НВЛ (рис. 2C).
Ранее мы показали, что очень похожая молекула-предшественник CIT-013 (отличающаяся двумя аминокислотами, но связывающая сходные эпитопы с одинаковым сродством) блокирует NETosis в ответ на физиологические стимулы, такие как активированные тромбоциты, синовиальная жидкость при подагре, а также синовиальная жидкостьRA 17. Здесь мы показываем, что высвобождение НВЛ, индуцированное sIC, может быть ингибировано CIT-013 (рисунок 2D). Терапевтическая значимость ингибирования нетоза, индуцированного этим стимулом, подчеркивается при СКВ, РА и других аутоиммунных заболеваниях, где аутоантитела в сыворотке или синовиальной жидкости поддерживают образование IC, который запускает NETosis25,26.
В совокупности эти данные демонстрируют, что этот подход к высокопроизводительной микроскопии в реальном времени подходит для изучения кинетики и характеристик высвобождения НВЛ и позволяет изучать ингибиторы NETosis. Хотя этот метод был оптимизирован для использования в нейтрофилах человека, с модификациями он также может быть подходящим для изучения нейтрофилов других видов. Данные, полученные с помощью этого анализа, являются краеугольным камнем обоснования использования CIT-013 в качестве мощной и эффективной терапии заболеваний, вызванных НЭО.
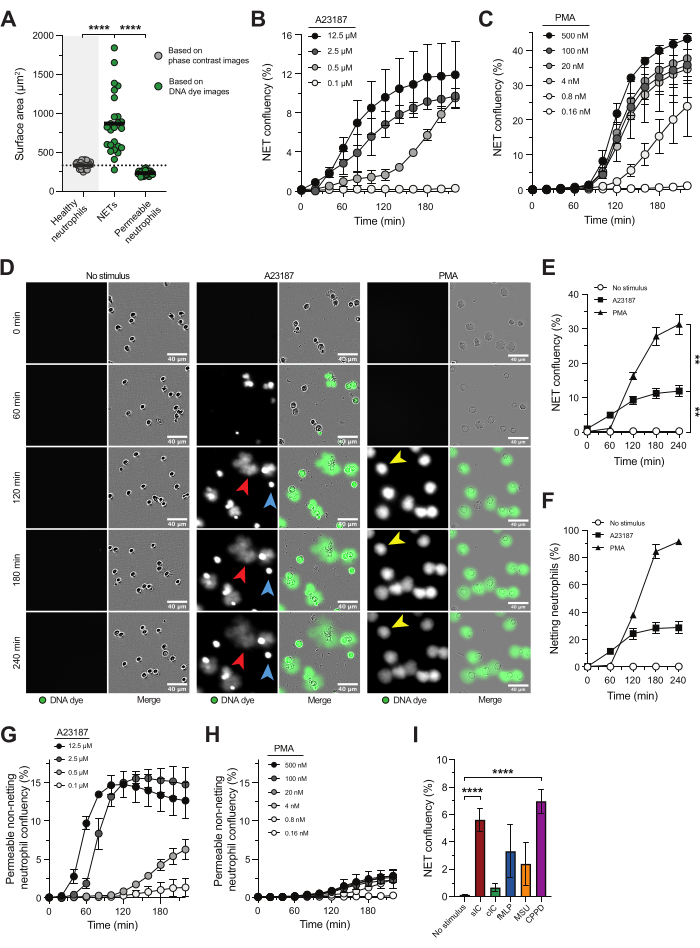
Рисунок 1: Высокопроизводительная микроскопия в реальном времени для изучения высвобождения НВЛ. Нейтрофилы, выделенные из крови здоровых добровольцев, стимулировали с помощью A23187 или PMA для запуска пути NETosis. Высвобождение НВЛ визуализировали с помощью высокопроизводительной микроскопии в реальном времени с использованием непроницаемого для плазматической мембраны красителя ДНК и количественно определяли на основе площади поверхности с помощью программного обеспечения системы микроскопии живых клеток. (А) Анализ площади поверхности нестимулированных здоровых нейтрофилов (серый), внеклеточных НВЛ и проницаемых нейтрофилов без сетки с внутриклеточным окрашиванием ДНК (зеленый). (В,В) Количественная оценка высвобождения НВЛ с течением времени из нейтрофилов, стимулированных указанными концентрациями A23187 или PMA (n = 2). (D) Репрезентативные изображения выпуска NET в ответ на A23187 (красные стрелки) и PMA (желтые стрелки) в разные моменты времени. Примеры проницаемых нейтрофилов без сетки обозначены синими стрелками. (E) Количественная оценка высвобождения НВЛ с течением времени, представленная в процентах от конфлюенции НВЛ (n = 5). Статистику проводили при t = 240 мин. (F) Количественная оценка высвобождения НВЛ с течением времени представлена в процентах от нейтрофилов сетки (n = 2). (Г, Ч) Количественная оценка проницаемых нейтрофилов без сетки с течением времени из нейтрофилов, которые были стимулированы указанными концентрациями A23187 или PMA (n = 2). (I) Количественная оценка высвобождения НВЛ при t = 240 мин, индуцированное растворимыми иммунными комплексами (sIC), покрытыми IC (cIC), fMLP, кристаллами урата натрия (MSU) и кристаллами, присутствующими при болезни нейтрализации пирофосфата кальция (CPPD) (n = 8-28). Результаты сообщаются как среднее ± стандартная ошибка среднего значения. **P < 0,01 и ****P < 0,0001, Повторные измерения одностороннего ANOVA с помощью теста множественных сравнений Даннетта (B), тест Крускала-Уоллиса с тестом множественных сравнений Данна (I). Панели A-F были изменены с разрешения van der Linden et al.16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
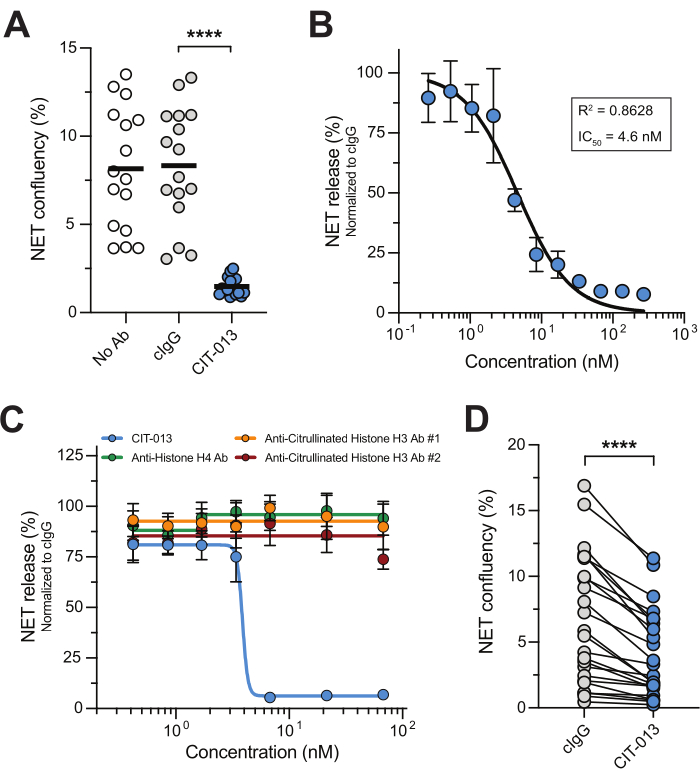
Рисунок 2: CIT-013 ингибирует высвобождение НВЛ. (A) Количественная оценка индуцированного A23187 высвобождения НВЛ при t = 240 мин в отсутствие (No Ab) или присутствия CIT-013 или контрольного антитела изотипа (cIgG). (B) Дозозависимое ингибирование индуцированного A23187 высвобождения НВЛ с помощью CIT-013 при t = 240 мин (n = 3). Данные были нормализованы до cIgG (установлено как 100% высвобождение NET). (C) Количественное определение индуцированного A23187 высвобождения НВЛ при t = 240 мин в присутствии указанных концентраций CIT-013, антитела против гистона H4, антитела против цитруллинированного гистона H3 #1 или антитела против цитруллинированного гистона H3 #2 (n = 6). (D) Количественная оценка высвобождения НВЛ при t = 240 мин, индуцированного растворимыми иммунными комплексами (ИК) в присутствии CIT-013 или cIgG. Результаты сообщаются как среднее ± стандартная ошибка среднего значения. P < 0,0001, Повторные измерения одностороннего ANOVA с множественным сравнением Тьюки (A) или двусторонними парами Вилкоксона со знаком рангового теста (D). Панели A, B и D были изменены с разрешения van der Linden et al.16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| 96-луночный планшет #1 | 96-луночная пластина #2 | |
| Объем 0,001% раствора поли-L-лизина на лунку | 50 μл | 100 мкл |
| Объем суспензии нейтрофилов на лунку | 50 μл | 87,5 мкл |
| Количество нейтрофилов в лунке | 2 x 104 ячейки | 3,5 x 104 ячейки |
| Объем 4x концентрированный (= 80 нМ) ДНК-краситель в буфере для анализа NET на лунку | 50 μл | 87,5 мкл |
| Объем 4x концентрированных стимулов NETosis в буфере для анализа NET на лунку | 50 μл | 87,5 мкл |
| Объем в 4 раза больше концентрированных антагонистов нетоза в буфере для анализа НВЛ на лунку | 50 μл | 87,5 мкл |
Таблица 1: Объемы и количество ячеек, оптимизированные для различных 96-луночных визуализирующих планшетов.
| Концентрационный рабочий раствор (4x концентрированный) | Конечная концентрация | |
| Ионофор кальция (A23187) | 50 мкМ | 12,5 мкМ |
| ПМА | 16 нМ | 4 нМ |
| fMLP | 4 мкМ | 1 мкМ |
| Кристаллы урата натрия (МГУ) | 400 мкг/мл | 100 мкг/мл |
| Кристаллы болезни предрасположенности пирофосфата кальция (СРПЛ) | 400 мкг/мл | 100 мкг/мл |
| Растворимые иммунные комплексы (sIC) | 1. Добавьте 5 мкг/мл сывороточного альбумина человека (HSA) в DPBS к 282,5 мкг/мл поликлональных антител кролика против HSA в DPBS. | |
| 2. Инкубировать не менее 90 минут при 37 °C. | ||
| 3. Гомогенизируйте методом вортексирования и добавьте 50 μл раствора sIC в соответствующие лунки. | ||
| Иммунные комплексы, покрытые оболочкой (cIC) | 1. Добавьте 10 мкг/мл HSA в DPBS в соответствующие лунки 96-луночного планшета. | |
| 2. Выдерживать в течение ночи при температуре 4 °C. | ||
| 3. Промойте лунки 3 раза 200 μл 0,05% Tween-20 в DPBS (далее PBS/0,05% Tween). | ||
| 4. Закупорьте лунки 200 μл 1% (w/v) бычьего сывороточного альбумина в PBS/0,05% Tween (далее – блокирующий буфер). | ||
| 5. Инкубировать в течение 120 минут при комнатной температуре и бережном перемешивании (400 об/мин). | ||
| 6. Промойте лунки 3 раза 200 μL PBS/0,05% Tween. | ||
| 7. Добавьте 50 мкл поликлонального антитела кролика против HSA в блокирующий буфер в соответствующие лунки. | ||
| 8. Инкубировать в течение 60 минут при комнатной температуре и осторожном перемешивании (400 об/мин). | ||
| 9. Промойте лунки 3 раза 200 μL PBS/0,05% Tween. | ||
| 10. Наконец, промойте лунки 3 раза 200 μL DPBS. Теперь скважины готовы к этапу 4.7 протокола. | ||
Таблица 2: Рекомендуемые концентрации для стимулов NETosis.
| Концентрационный рабочий раствор (4x концентрированный) | Конечная концентрация | |
| Антитела к лизоциму куриного яйца (контрольное антитело; cIgG) | 80 нМ | 20 нМ |
| ЦИТ-013 | 80 нМ | 20 нМ |
Таблица 3: Рекомендуемые концентрации антагониста NETosis.
Дополнительное видео 1. Нейтрофилы стимулировали A23187 в присутствии cIgG (слева) или CIT-013 (справа), а высвобождение НВЛ визуализировали с течением времени с использованием непроницаемого для плазматической мембраны красителя ДНК. Высвобождение НВЛ ингибируется в присутствии CIT-013. Фильм представляет собой наложение красителя ДНК (зеленого цвета) и фазового контраста. Это видео было получено с разрешения van der Linden et al.16. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
С момента открытия НВЛ в 2004 году было разработано множество стратегий для экспериментального исследования высвобождения НВЛ in vitro, при этом иммунофлуоресцентная микроскопия является наиболее распространенным методом количественной оценки NETosis27,28. Хотя микроскопия полезна для визуализации высвобождения НВЛ, она имеет ограничения, поскольку неавтоматизированная микроскопическая количественная оценка изображений фиксированных временных точек довольно неточна и может страдать от смещения наблюдателя. Другим методом, используемым для изучения высвобождения НВЛ, является мультиспектральная визуализационная проточная цитометрия29,30, которая измеряет большое количество нейтрофилов сетки и использует непредвзятый анализ, но фокусируется на нейтрофилах на ранних стадиях нетоза и не количественно оценивает нейтрофилы, высвобождающие свои НВЛ. Во многих исследованиях кинетики NETosis для количественного определения высвобождения НВЛ используется ДНК-краситель в сочетании со считывателем флуоресцентных пластин31. Этот метод не позволяет отличить НВЛ от активированных или умирающих нейтрофилов с внутриклеточным окрашиванием ДНК и, следовательно, не подходит для количественной оценки высвобождения НВЛ и изучения антагонистов нетоза. Вышесказанное подчеркивает, что используемые в настоящее время подходы к изучению NETosis ценны, но имеют свои ограничения.
Метод микроскопии в реальном времени, описанный в этом исследовании, решает многие проблемы, обнаруженные в ранее описанных методах. Он обеспечивает объективную, полуавтоматическую, высокопроизводительную, воспроизводимую и точную количественную оценку NET. Действительно, этот подход сводит к минимуму артефакты пипетирования, такие как растянутая морфология НВЛ18, и позволяет отличить NETosis от некроза и апоптоза благодаря различной морфологии и кинетике высвобождения ДНК18,32. Кроме того, этот подход дает возможность изучать различные биохимические пути регулируемой гибели клеток, такие как образование НВЛ в некроптотических нейтрофилах, которые генерируют структуры, отвечающие функциональным и фенотипическим критериям НВЛ33.
В этом протоколе есть несколько важнейших шагов, которые необходимо выполнить для успешной количественной оценки НВЛ. Во-первых, правильное количество ячеек в лунке важно для точного количественного определения NET. Когда плотность нейтрофилов слишком высока, клетки и НВЛ перекрываются с соседними клетками и НВЛ, что затрудняет их различие, и в результате количественная оценка становится неточной. Во-вторых, обязательным условием является использование низкой концентрации нетоксичного непроницаемого для связывания ДНК красителя плазматической мембраны для окрашивания НВЛ при попадании во внеклеточную среду. Проницаемые для плазматической мембраны ДНК-связывающие красители могут легко индуцировать активацию нейтрофилов или гибель клеток. В-третьих, необходимо сканировать несколько изображений на лунку для получения репрезентативного обзора высвобождения НВЛ среди гетерогенной популяции нейтрофилов. В-четвертых, фазово-контрастное изображение нейтрофилов при t = 0 необходимо для корректировки на количество нейтрофилов на изображении и расчета процента сетчатых нейтрофилов.
Несмотря на то, что этот подход к микроскопии в режиме реального времени с высокой пропускной способностью имеет много преимуществ по сравнению с другими анализами обнаружения НВЛ, у него есть ограничения, поскольку, насколько нам известно, не существует флуоресцентных красителей для обнаружения дополнительных компонентов НВЛ, подтверждающих высвобождение НВЛ. Флуоресцентные меченые антитела для обнаружения дополнительных компонентов НВЛ могут быть использованы, но могут иметь нежелательные эффекты, поскольку антитело-иммунные комплексы влияют на активацию нейтрофилов и, возможно, на нетоз. Поэтому мы предпочитаем не использовать дополнительные антитела в этой системе анализа и вместо этого рекомендуем использовать хорошо известные стимулы, индуцирующие NETosis. Когда используются еще не установленные стимулы NETosis, мы рекомендуем использовать ИФА для обнаружения ДНК, интегрированной с НВЛ-специфичными белками, такими как цитруллинированные гистоны, до проведения анализа в реальном времени. Во-вторых, вариации внутри и между анализами могут быть результатом вариабельности от донора к донору, при этом нейтрофилы от здоровых доноров по-разному реагируют на различные стимулы NETosis из-за гетерогенности в здоровой популяции. Чтобы свести к минимуму вариации анализа, нейтрофилы должны быть выделены в течение 1 ч из свежевзятой крови и немедленно использованы в эксперименте, поскольку нейтрофилы короткоживущие и не могут быть криоконсервированы. Кроме того, важно, чтобы протокол выделения нейтрофилов был валидирован и принят для минимизации активации нейтрофилов. Нейтрофилы являются чувствительными клетками и могут изменять свою реакцию на раздражители в процессе очищения из-за механических и других видов стресса. На статус активации нейтрофилов и высвобождение НВЛ могут влиять тип иглы, используемые пробирки для сбора крови, температура инкубации, скорость центрифугирования и время от сбора крови до выделения нейтрофилов 34,35,36,37. Дополнительный метод выделения нейтрофилов, который можно рассмотреть, описан Krémer et al.36 с использованием метода отрицательной иммуномагнитной селекции без лизиса эритроцитов. Этот метод напоминает нетронутые нейтрофилы в цельной крови и может быть подходящим для предотвращения любой активации нейтрофилов в процессе очистки. Все вышесказанное должно служить предупреждением для общественности о том, что данные различных исследовательских групп необходимо сравнивать с большой осторожностью.
В целом, описанный метод высокопроизводительной микроскопии в реальном времени позволяет точно количественно оценить НВЛ воспроизводимым и эффективным образом и может быть использован для изучения характеристик, величины и кинетики высвобождения НВЛ, а также позволяет исследовать активность антагонистов NETosis. В качестве примера последнего мы использовали гуманизированное антицитруллинированное гистоновое H2A и H4 моноклональное антитело CIT-013, которое в настоящее время находится в клинической разработке.
Раскрытие информации
Авторы являются сотрудниками Citryll и имеют финансовые интересы.
Благодарности
Авторы хотели бы поблагодарить Пола Винка за руководство частью проекта, касающегося метода микроскопии в реальном времени.
Материалы
| Name | Company | Catalog Number | Comments |
| A-23187 Free Acid (Calcimycin) | Thermo Fisher | A1493 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | A9434 | |
| Anti-Hen egg lysozyme (control antibody; cIgG) | CrownBio | C0001 | |
| APC-Cy7-conjugated mouse anti-human CD45 antibody (Clone 2D1) | Biolegend | 368515 | Use at 1 µg/mL final concentration |
| BD FACSCantoTM II system + FACSDiva software (version 8.0.1) | BD | n/a | Flow cytometry system |
| Bovine Serum Albumin (BSA) Fraction V | Roche | 10735108001 | |
| CaCl2 (1 M) | VWR | E506 | |
| Calcium pyrophosphate disposition disease (CPPD) crystals | InvivoGen | lrl-cppd | |
| Cellometer Auto T4 Bright Field Cell Counter + analysis software (version 3.3.9.5) | Nexcelom Bioscience | n/a | Bright field cell counter |
| CIT-013 | Citryll B.V. | n/a | |
| Costar black 96-well plate, clear bottom | Corning | 3603 | 96-well plate #1 |
| Dextran T500 | Pharmacosmos | 551005009006 | |
| DPBS (1x) | Gibco | 14190-144 | |
| Fetal Bovine Serum (FBS) | Serena | S-FBS-SA-015 | |
| Ficoll | GE Healthcare | 17-1440-02 | Density gradient solution |
| FITC-conjugated mouse anti-human CD66b antibody (Clone G10F5) | eBioscience | 17-0666-42 | Use at 1.5 µg/mL final concentration |
| Fixable viability dye eFluor 506 | eBioscience | 65-0866-14 | |
| Flow cytometry analysis software | FLowJo | Version 10.8.0 | |
| fMLP | Sigma Aldrich | 47729-10MG-F | |
| HEPES (1M) | Gibco | 15630-080 | |
| Human serum albumin (HSA) | VWR | 31020 | |
| Human TruStain FcX | Biolegend | 422302 | Fc receptor block |
| IBIDI 96-well plate, clear bottom | IBIDI | 89626 | 96-well plate #2 |
| IncuCyte SX3 + analysis software (version 2022B Rev1) | Satorius | n/a | Live cell microscopic analysis system |
| Monosodium urate crystals | InvivoGen | tlrl-msu | |
| Mouse anti-histone H3 (citrulline R2 + R8 + R17) antibody | Cayman | 17939 | Clone 11D3; referred to as #1 |
| Mouse anti-histone H4 (K8Ac + K12Ac + K16Ac) antibody (Clone KM-2) | Absolute Antibodies | Ab01681-2.0 | |
| Na2EDTA | Sigma Aldrich | E5134 | |
| NaCl (0.9%) | B. Braun | 25900 | |
| Penicillin (5000 U/mL) - Streptomycin (5000 µg/mL) | Gibco | 15070-063 | |
| PerCP-Cy5.5-conjugated mouse anti-human CD16 antibody (Clone 3G8) | Biolegend | 302027 | Use at 0.33 µg/mL final concentration |
| PMA | Sigma Aldrich | P1585 | |
| Polyclonal rabbit anti-HSA antibody | Sigma Aldrich | A0433-2ml | |
| Poly-L-Lysine (0.01%) | Sigma Aldrich | P4832 | |
| Potassium bicarbonate (KHCO3) | Sigma Aldrich | 237205 | |
| Rabbit anti-histone H3 (citrulline R2 + R8 + R17) antibody | Abcam | ab281584 | Multiclonal; referred to as #2 |
| RPMI 1640 with GlutaMAXTM supplement | Gibco | 61870-010 | Culture medium containing L-glutamine |
| RPMI 1640 without phenol red | Gibco | 11835-030 | Culture medium without phenol red |
| Sodium azide (NaN3) | Sigma Aldrich | S2002 | |
| Sterile H2O | Gibco | 15230204 | |
| Sytox Green Nucleid Acid Stain | Thermo Fisher | S7020 | DNA dye |
| Trypan blue solution (0.4%) | Gibco | 15250-061 | |
| Tween-20 | Sigma Aldrich | P1379 | |
| Vacutainer blood tubes Li-Heparin (17 IU/mL) | BD | 367526 |
Ссылки
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- De Bont, C., Pruijn, G. J. M. Citrulline is not a major determinant of autoantibody reactivity to neutrophil extracellular traps. Philos Trans R Soc Lond B Biol Sci. 378 (1890), 20220249 (2023).
- Urban, C. F., et al. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans. PLoS Pathog. 5 (10), e1000639 (2009).
- Hoppenbrouwers, T., et al. In vitro induction of NETosis: Comprehensive live imaging comparison and systematic review. PLoS One. 12 (5), e0176472 (2017).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. ELife. 6, e24437 (2017).
- Parker, H., Dragunow, M., Hampton, M. B., Kettle, A. J., Winterbourn, C. C. Requirements for NADPH oxidase and myeloperoxidase in neutrophil extracellular trap formation differ depending on the stimulus. J Leukoc Biol. 92 (4), 841-849 (2012).
- Neeli, I., Radic, M. Opposition between PKC isoforms regulates histone deimination and neutrophil extracellular chromatin release. Front Immunol. 4, 38 (2013).
- Bosmann, M., Ward, P. A. Protein-based therapies for acute lung injury: targeting neutrophil extracellular traps. Expert Opin Ther Targets. 18 (6), 703-714 (2014).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 18 (2), 134-147 (2018).
- Shiratori-Aso, S., Nakazawa, D. The involvement of NETs in ANCA-associated vasculitis. Front Immunol. 14, 1261151 (2023).
- Byrd, A. S., et al. Neutrophil extracellular traps, B cells, and type I interferons contribute to immune dysregulation in hidradenitis suppurativa. Sci Transl Med. 11 (508), eaav5908 (2019).
- Kimball, A. S., Obi, A. T., Diaz, J. A., Henke, P. K. The emerging role of NETs in venous thrombosis and immunothrombosis. Front Immunol. 7, 236 (2016).
- O'Neil, L. J., et al. Neutrophil extracellular trap-associated carbamylation and histones trigger osteoclast formation in rheumatoid arthritis. Ann Rheum Dis. 82 (5), 630-638 (2023).
- Li, M., et al. A novel peptidylarginine deiminase 4 (PAD4) inhibitor BMS-P5 blocks formation of neutrophil extracellular traps and delays progression of multiple myeloma. Mol Cancer Ther. 19 (7), 1530-1538 (2020).
- Chirivi, R. G. S., et al. Anti-citrullinated protein antibodies as novel therapeutic drugs in rheumatoid arthritis. J Clin Cell Immunol. S6, 006 (2013).
- Van der Linden, M., et al. Anti-citrullinated histone monoclonal antibody CIT-013, a dual action therapeutic for neutrophil extracellular trap-associated autoimmune diseases. MAbs. 15 (1), 2281763 (2023).
- Chirivi, R. G. S., et al. Therapeutic ACPA inhibits NET formation: a potential therapy for neutrophil-mediated inflammatory diseases. Cell Mol Immunol. 18 (6), 1528-1544 (2021).
- Van der Linden, M., Westerlaken, G. H. A., Van Der Vlist, M., Van Montfrans, J., Meyaard, L. Differential signalling and kinetics of neutrophil extracellular trap release revealed by quantitative live imaging. Sci Rep. 7 (1), 6529 (2017).
- Hoffmann, J. H. O., Schaekel, K., Gaiser, M. R., Enk, A. H., Hadaschik, E. N. Interindividual variation of NETosis in healthy donors: introduction and application of a refined method for extracellular trap quantification. Exp Dermatol. 25 (11), 895-900 (2016).
- Silva, L. M., Moutsopoulos, N., Bugge, T. H., Doyle, A. Live imaging and quantification of neutrophil extracellular trap formation. Curr Protoc. 1 (7), e157 (2021).
- De Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochim Biophys Acta Mol Cell Res. 1865 (11 Pt A), 1621-1629 (2018).
- Gajendran, C., et al. Alleviation of arthritis through prevention of neutrophil extracellular traps by an orally available inhibitor of protein arginine deiminase 4. Sci Rep. 13 (1), 3189 (2023).
- Biron, B. M., Chung, C. -. S., O'Brien, X. M., Chen, Y., Reichner, J. S., Ayala, A. Cl-Amidine prevents histone 3 citrullination and neutrophil extracellular trap formation, and improves survival in a murine sepsis model. J Innate Immun. 9 (1), 22-32 (2017).
- Perdomo, J., et al. Neutrophil activation and NETosis are the major drivers of thrombosis in heparin-induced thrombocytopenia. Nat Commun. 10 (1), 1322 (2019).
- Lood, C., et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nat Med. 22 (2), 146-153 (2016).
- Kraaij, T., et al. A novel method for high-throughput detection and quantification of neutrophil extracellular traps reveals ROS-independent NET release with immune complexes. Autoimmun Rev. 15 (6), 577-584 (2016).
- De Buhr, N., Von Köckritz-Blickwede, M. How neutrophil extracellular traps become visible. J Immunol Res. 2016, 1-13 (2016).
- Brinkmann, V., Laube, B., Abu Abed, U., Goosmann, C., Zychlinsky, A. Neutrophil extracellular traps: How to generate and visualize them. J Vis Exp. (36), e1724 (2010).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. J Immunol Methods. 423, 104-110 (2015).
- Gavillet, M., et al. Flow cytometric assay for direct quantification of neutrophil extracellular traps in blood samples. Am J Hematol. 90 (12), 1155-1158 (2015).
- Sil, P., Yoo, D., Floyd, M., Gingerich, A., Rada, B. High throughput measurement of extracellular DNA release and quantitative NET formation in human neutrophils in vitro. J Vis Exp. (112), e52779 (2016).
- Gupta, S., Chan, D. W., Zaal, K. J., Kaplan, M. J. A high-throughput real-time imaging technique to quantify NETosis and distinguish mechanisms of cell death in human neutrophils. J Immunol. 200 (2), 869-879 (2018).
- D'Cruz, A. A., et al. The pseudokinase MLKL activates PAD4-dependent NET formation in necroptotic neutrophils. Sci Signal. 11 (546), eaao1716 (2018).
- Nash, G., Abbitt, K., Tate, K., Jetha, K., Egginton, S. Changes in the mechanical and adhesive behaviour of human neutrophils on cooling in vitro. Pflugers Arch. 442 (5), 762-770 (2001).
- Hundhammer, T., Gruber, M., Wittmann, S. Paralytic impact of centrifugation on human neutrophils. Biomedicines. 10 (11), 2896 (2022).
- Krémer, V., Godon, O., Bruhns, P., Jönsson, F., De Chaisemartin, L. Isolation methods determine human neutrophil responses after stimulation. Front Immunol. 14, 1301183 (2023).
- Freitas, M., Porto, G., Lima, J. L. F. C., Fernandes, E. Isolation and activation of human neutrophils in vitro. The importance of the anticoagulant used during blood collection. Clin Biochem. 41 (7-8), 570-575 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены