Method Article
İnsan Nötrofil Hücre Dışı Tuzak Salınımının Gerçek Zamanlı, Yüksek Verimli Mikroskobik Miktar Tayini ve Antagonistlerin Farmakolojisinin Değerlendirilmesi
Bu Makalede
Özet
Bu tanımlanmış protokol, insan nötrofil hücre dışı tuzak (NET) salınımını in vitro olarak görselleştirmek ve ölçmek için gerçek zamanlı, yüksek verimli bir mikroskopi yaklaşımını tanımlar. Tekrarlanabilir yöntem, farklı NETosis indükleyicileri ile stimülasyon üzerine NET salınımının özelliklerinin ve kinetiğinin araştırılmasına olanak tanır ve NETosis antagonistlerinin farmakolojisinin değerlendirilmesini sağlar.
Özet
Nötrofiller, NETosis olarak adlandırılan bir süreçte nötrofil hücre dışı tuzakların (NET'ler) salınması da dahil olmak üzere çeşitli stratejiler kullanarak doğuştan gelen bağışıklık savunmasında önemli bir rol oynar. Bununla birlikte, son yirmi yılda, dokularda NET birikiminin çoklu inflamatuar ve otoimmün hastalıkların patofizyolojisine katkıda bulunduğu ortaya çıkmıştır. Bu nedenle, NETosis antagonistlerinin geliştirilmesine olan ilgi artmıştır. NETosis'i tespit etmek ve analiz etmek için değişken ve standartlaştırılmamış yöntemler eş zamanlı olarak geliştirilmiştir ve her birinin kendi avantajları ve sınırlamaları vardır. Burada, insan NET salınımının nicelleştirilmesi için gerçek zamanlı bir mikroskopi yöntemi açıklıyoruz ve bu da NETosis'in yanı sıra NET inhibisyonunu yüksek verimli bir şekilde incelemeye olanak tanıyor. Yüzey alanı tabanlı yarı otomatik analiz, NET'leri tanır ve bunları ağ oluşturmayan aktive edilmiş nötrofillerden ayırt eder. Fizyolojik olmayan NETosis indükleyicileri olan kalsiyum iyonofor ve forbol-12-miristat-13-asetatın (PMA) farklı özelliklere ve kinetiklere sahip NET'lerin salınımını tetiklediğini gösterdik. Ayrıca, bu yaklaşımın, bağışıklık kompleksleri, N-Formilmetiyonin-lösil-fenilalanin (fMLF), monosodyum ürat kristalleri ve kalsiyum pirofosfat kristalleri dahil olmak üzere hastalıkla ilgili uyaranlara yanıt olarak NET salınımının incelenmesine izin verdiğini gösteriyoruz. NETosis antagonistlerini incelemek için bu yöntemin faydasını örneklemek için, NET salınımının birinci sınıf bir monoklonal antikor inhibitörü olan CIT-013'ü kullandık. CIT-013, sitrüline histon H2A ve H4'ü hedefler ve 4.6 nM'lik bir IC50 ile NET salınımını etkili bir şekilde inhibe eder. Test edilen diğer anti-histon antikorları bu NETosis inhibitör kapasiteden yoksundu. Hep birlikte, bu protokolün NET'lerin spesifik, güvenilir ve tekrarlanabilir yüksek verimli nicelleştirmesini sağladığını ve NET salım özellikleri, kinetiği ve NETosis antagonistlerinin farmakolojisi üzerine yapılan çalışmaları geliştirdiğini gösteriyoruz.
Giriş
Nötrofiller kanda bol miktarda bulunur ve enfeksiyon veya iltihaplanma üzerine dokuya göç eder. Ev sahibini mikroplara karşı korumak için kapsamlı silahlar kullanarak doğuştan gelen bağışıklık savunmasında önemli bir rol oynarlar. Nötrofiller, fagositoz, degranülasyon, reaktif oksijen türlerinin (ROS) üretilmesi ve NETosis1 adı verilen bir işlemle nötrofil hücre dışı tuzaklar (NET'ler) olarak adlandırılan yoğunlaştırılmış kromatinin salınması yoluyla patojenleri öldürür. NET'ler, diğerlerinin yanı sıra granüler proteinler ve kalprotektin 2,3 ile süslenmiş hücre dışı kromatin yapılarıdır ve geniş bir molekül spektrumu4 ile uyarıldığında salınır. NETosis genel olarak iki ana yola ayrılabilir: NADPH oksidaza bağımlı veya bağımsız 5,6,7. Ek olarak, peptidil arginin deiminaz 4 (PAD4) ile N-terminal histon kuyruklarının arginin sitrülinasyonu, NETosis ile yakından bağlantılıdır ve sonuçta yoğunlaşmış kromatinin hücre dışı ortama atılmasına yol açan kromatin dekondensasyonunu teşvik eder.
NET salınımı patojen eliminasyonunda rol oynamasına rağmen, çok sayıda çalışma anormal ve uzun süreli NET salınımının akut akciğer hasarı8, romatoid artrit (RA)9, vaskülit10 ve hidradenitis suppurativa11 dahil olmak üzere çeşitli inflamatuar bozuklukların gelişimi ile bağlantılı olduğunu göstermiştir. NET'lerin hastalıktaki zararlı rolü, NET'lerin proinflamatuar olması, otoantijen kaynağı olması, çevre dokulara sitotoksik olması, immünotrombozu tetiklemesi ve osteoklast farklılaşmasını ve kemik erozyonunu teşvik etmesi nedeniyle çok yönlüdür 9,12,13. NETosis yolunun küçük moleküllü PAD4 inhibitörleri tarafından farmakolojik inhibisyonu, NETosis hedefli terapötiklerin, NET birikiminin patogenezin önemli bir itici gücü olduğu hastalıklar için tedavi potansiyeli olduğunu göstermektedir14. PAD4 enzimini hedeflemek yerine, sitrüline histonlar H2A ve H415'e spesifik olarak bağlanan insanlaştırılmış anti-sitrülinli histon monoklonal antikoru CIT-013'ü inhibe eden birinci sınıf bir NETosis kullandık. CIT-013, NET salınımını inhibe ederek ve makrofaj aracılı NET fagositozunu artırarak benzersiz bir ikili etki mekanizmasına sahiptir16. CIT-013 ve öncü moleküller, NET ile ilişkili inflamasyonun çoklu fare modellerinde terapötik etkinlik göstermiştir17.
NET salınımını incelemek için, yıllar içinde aşağıdakiler gibi farklı yöntemler geliştirilmiştir, ancak bunlarla sınırlı değildir: 1) bir immünofloresan plaka okuyucu ile kombinasyon halinde bir plazma zarı geçirimsiz DNA izleyici kullanarak DNA tespiti, 2) süpernatanlarda NET'e özgü proteinlerle DNA ve DNA kompleksli DNA'nın enzime bağlı immünosorbent testi (ELISA) tabanlı tespiti, 3) NET ile ilişkili moleküllerin immünohistokimya yoluyla hücre dışı DNA ile birlikte lokalizasyonu, ve 4) ağ nötrofillerini tespit etmek için akış sitometrisi yaklaşımları. Tüm bu yöntemlerin kendi avantajları ve sınırlamaları vardır. İnsan NET salınımının mikroskobik miktar tayini için plazma zarı geçirimsiz DNA boyası16,18 kullanan gerçek zamanlı yüksek verimli bir yaklaşım geliştirdik. Açıklanan yöntem, NETosis kinetiğinin ve özelliklerinin kolay, güvenilir ve tekrarlanabilir bir şekilde araştırılmasına olanak tanır ve CIT-013 gibi NETosis antagonistlerinin farmakolojisinin değerlendirilmesini sağlar.
Protokol
Tüm kan bağışçıları Helsinki Bildirgesi'ne uygun olarak bilgilendirilmiş onam verdiler ve çalışma, insan araştırmaları için Citryll etik yönergelerine göre gerçekleştirildi.
NOT: İnsan kanı ve izole nötrofillerle yapılan tüm aktivitelerin laminer akış kabininde steril koşullar altında gerçekleştirilmesi gerekir. Santrifüjleme için fren ve hızlanma ayarları protokolde belirtilmediğinde, bunlar maksimum olarak kabul edilebilir.
1. Kandan nötrofil izolasyonu
- Sağlıklı gönüllülerden periferik kanı lityum-heparin tüplerinde toplayın ve kanı 50 mL'lik taze bir tüpe aktarın.
- Lityum-heparin tüplerini 1x DPBS ile durulayın ve kanın aktarıldığı aynı 50 mL'lik tüpe aktarın. Son kan-DPBS oranının 1:1 olduğundan emin olun. Homojen bir çözelti elde etmek için kan ve DPBS'yi pipetleme ile karıştırın.
- Başka bir taze 50 mL tüpe 13 mL yoğunluk gradyan çözeltisi ekleyin ve 1: 1 seyreltilmiş kanı yoğunluk gradyan çözeltisinin üzerine maksimum 50 mL'ye kadar yavaşça (25 mL'lik bir pipet ile) ekleyin.
- Minimum hızlanma ve frenleme ile 40 dakika boyunca 400 x g ve oda sıcaklığında (RT) santrifüjleyin.
NOT: Katmanlar oluşur. Yukarıdan aşağıya katmanlar aşağıdaki gibidir: 1. plazma; 2. periferik kan mononükleer hücreleri (PBMC'ler); 3. yoğunluk gradyan çözümü; 4. Eritrositler / nötrofiller. - İlk olarak, plazmayı 10 mL'lik bir pipet ile atın ve ardından PBMC'leri ve yoğunluk gradyan çözelti katmanını eritrosit / nötrofil tabakasını bozmadan mümkün olduğunca plastik bir Pasteur pipeti ile atın.
- Eritrosit / nötrofil tabakasını çalkalayarak nazikçe yeniden süspanse edin ve 15 mL 1x DPBS'de 25 mL'lik bir pipet ile yeniden süspanse edin.
- 25 mL% 6 Dekstran /% 0.9 NaCl çözeltisi ekleyin, tüpü ters çevirerek on kez karıştırın ve tüpü RT'de 25 dakika dik olarak ayarlayın.
NOT: Katmanlar oluşur. Yukarıdan aşağıya katmanlar aşağıdaki gibidir: 1. Nötrofiller; 2 eritrosit. - Nötrofil tabakasını 10 mL'lik bir pipet ile 50 mL'lik taze bir tüpe aktarın ve 500 x g ve RT'de 10 dakika santrifüjleyin.
NOT: Nötrofil peleti hala bazı eritrositler içerdiğinden ve tüpe sıkıca bağlı olmadığından dikkatli olun. - 10 mL Amonyum-Klorür-Potasyum (ACK) lizis tamponunda (155 mMNH4Cl, 10 mM KHCO3 ve 0.1 mM Na2EDTA; pH = 7.2) hücre peletini 10 mL'lik bir pipetle boşaltarak ve yeniden süspanse ederek süpernatanı atın ve ardından hemen 40 mL ACK lizis tamponu ekleyin.
- Çözelti yarı saydam hale gelene kadar tüpü sürekli olarak ters çevirirken RT'de inkübe edin (bu 1-5 dakika sürer ve her donör için değişebilir) ve 350 x g ve RT'de 10 dakika santrifüjleyin.
- Süpernatanı çıkarın ve nötrofilleri süspansiyona getirmeden nötrofil peletinin üzerine% 10 (h / h) ısıyla etkisiz hale getirilmiş fetal sığır serumu (FBS), 50 U / mL penisilin ve 50 μg / mL streptomisin (bundan sonra %10 kültür ortamı olarak anılacaktır) ile desteklenmiş L-glutamin içeren 5 mL kültür ortamını yavaşça ve damla damla ekleyin. Bu, eritrositlerin çoğunu nötrofil peletinden verimli bir şekilde çıkaracaktır.
- 50 mL'lik tüpü, nötrofil peletinin üzerinde bulunan eritrositlerin çoğu kültür ortamında% 10 oranında yeniden süspanse edilene kadar hafifçe döndürün. Daha sonra, tüpü boşaltarak süpernatanı çıkarın.
- Nötrofil peletini 10 mL kültür ortamında% 10 yeniden süspanse edin ve tamamen yeniden süspanse edildiğinde, 50 mL'ye kadar kültür ortamı% 10 ekleyin. 350 x g ve RT'de 10 dakika santrifüjleyin.
- Süpernatanı çıkarın ve hücre peletini 10 mL kültür ortamında% 10 yeniden süspanse edin.
2. Akış sitometrisi ile saflığı kontrol etmek için nötrofil boyama
- Hücre konsantrasyonunu belirlemek için, nötrofil süspansiyonunu %0.4 tripan mavisi çözeltisinde (oran 1: 1) seyreltin ve nötrofilleri parlak bir alan hücresi sayacı ile sayın.
NOT: Diğer sayma yöntemleri de kullanılabilir. - Kültür ortamında 1 x 105 nötrofilleri% 10 V tabanlı 96 oyuklu bir plakanın kuyucuklarına aktarın ve 400 x g ve RT'de 3 dakika santrifüjleyin.
- Süpernatanı atın ve hücreleri% 1 (a / h) sığır serum albümini (BSA) ve% 0.1 (h / h) NaN3 (floresanla aktive edilen hücre sıralama (FACS) tamponu olarak anılacaktır) ile desteklenmiş 50 μL 1x DPBS'de yeniden süspanse edin Fc reseptör bloğu (50x seyreltilmiş) içerir.
- RT'de 15 dakika inkübe edin ve 50x seyreltilmiş APC-Cy7-konjuge fare anti-insan CD45 antikoru, 600x seyreltilmiş PerCP-Cy5.5 konjuge fare anti-insan CD16 antikoru, 133x seyreltilmiş FITC konjuge fare anti-insan CD66b antikoru ve 500x seyreltilmiş sabitlenebilir canlılık boyası eFluor 506 içeren 50 μL FACS tamponu ekleyin.
NOT: CD45 lökositler üzerinde eksprese edilir. CD66b sadece granülositlerle ifade edilir. CD16, nötrofillerde yüksek oranda eksprese edilir, eozinofillerde düşük eksprese edilir ve bazofillerde eksprese edilmez. - Karanlıkta RT'de 30 dakika inkübe edin ve 400 x g ve RT'de 3 dakika santrifüjleyin.
- Süpernatanı atın, nötrofilleri 175 μL FACS tamponunda yeniden süspanse edin ve 400 x g ve RT'de 3 dakika santrifüjleyin. Bu adımı bir kez tekrarlayın.
- Süpernatanı atın ve nötrofil peletini 175 μL FACS tamponunda yeniden süspanse edin. Bir akış sitometri sistemi ve ilgili yazılım kullanarak numuneleri analiz edin.
3. Akış sitometrisi analiz yazılımı kullanılarak nötrofil saflık analizi
NOT: Akış sitometrisi verilerinin analizi, Malzeme Tablosunda belirtildiği gibi akış sitometrisi analiz yazılımı kullanılarak gerçekleştirilmiştir.
- Aşağıdaki adım adım prosedüre göre geçit işlemi gerçekleştirin.
- Uygun hücre akışına sahip bir alanı seçmek için FSC-A ve Zaman grafiğinde bir zaman kapısı ayarlayın.
- Hücreleri seçmek ve kalıntıları hariç tutmak için SSC-A ve FSC-A çiziminde bir hücre kapısı ayarlayın.
- Canlı hücreleri seçmek için FSC-A ve AmCyan-A grafiğinde uygun bir hücre kapısı ayarlayın.
- CD45+ hücrelerini seçmek için FSC-A ve APC-Cy7 grafiğinde bir lökosit kapısı ayarlayın.
- CD66b+CD16+ (nötrofiller), CD66b-CD16+ (eozinofiller) ve CD66b-CD16- (bazofiller, monositler ve lenfositler) arasında ayrım yapmak için FITC ve PerCP-Cy5.5 grafiğinde bir nötrofil kapısı ayarlayın.
- Tek nötrofilleri seçmek için FSC-H ve FSC-A grafiğinde tek bir hücre kapısı ayarlayın.
- Tek nötrofilleri hücrelerin frekansı olarak sunarak (hücre kapısında) nötrofil saflığını belirleyin.
NOT: Devam etmek için nötrofil saflığının %85'i aşması gerekir.
4. Canlı görüntüleme mikroskobu
NOT: Bu test, birden fazla 96 oyuklu görüntüleme plakaları ve çeşitli NETosis uyaranları ve antagonistleri için optimize edilmiştir. Aşağıdaki protokol, dahil edilen tablolar kullanılarak belirtilebilecek yaklaşımın genel bir görünümünü açıklamaktadır.
- % 0.01 poli-L-lizini steril H2O içinde 1:10 oranında seyrelterek% 0.001'lik bir poli-L-lizin çözeltisi hazırlayın.
- Her oyucuğa% 0.001 poli-L-lizin çözeltisi ekleyin ve 37 ° C'de en az 1 saat inkübe edin.
NOT: Kuyu başına hacim, 96 oyuklu görüntüleme plakasına bağlıdır (Tablo 1). - Fazla poli-L-lizini çıkarmak için kuyuları 200 μL DPBS ile 3 kez yıkayın. Laminer akış kabinindeki tüm adımları gerçekleştirin. Plakanın kapağını çıkarın ve plakayı laminer akış kabininde kuruyana kadar (yaklaşık 1 saat) açarak kuyuları havayla kurutun.
- Deney için gereken nötrofil sayısını hesaplayın ve fazlalığı 15 mL'lik bir tüpe aktarın. 350 x g ve RT'de 10 dakika santrifüjleyin.
NOT: Her bir oyuktaki nötrofil miktarı, 96 oyuklu görüntüleme plakasının tipine göre değişir (Tablo 1). Hücre yoğunluğu, uygun analiz için gerekli olan tek tek hücrelerin iyi bir şekilde ayrılmasına izin verecek şekilde optimize edilmiştir. Nötrofil yoğunluğu çok yüksekse, hücreler ve NET'ler bitişik hücreler ve NET'lerle örtüşür ve bu da analizin kalitesini etkiler. - Süpernatanı atın ve nötrofilleri% 2 (h / h) FBS, 50 U / mL penisilin ve 50 μg / mL streptomisin, 10 mM HEPES ve 1 mM CaCl2 ile desteklenmiş fenol kırmızısı olmayan bir kültür ortamında yeniden süspanse edin (bundan sonra NET tahlil tamponu olarak anılacaktır).
- Aşağıdaki iş çözümlerini hazırlayın.
- NET tahlil tamponunda 80 nM DNA boyası hazırlayın.
- NET tahlil tamponunda NETosis uyaranlarını hazırlayın.
- NET tahlil tamponunda NETosis antagonistlerini hazırlayın.
NOT: Yukarıda açıklanan iş çözeltilerinin konsantrasyonlarının, kuyuda ihtiyaç duyulan nihai konsantrasyonun 4 katı olduğunu unutmayın. NETosis uyaranlarının ve NETosis antagonistlerinin önerilen konsantrasyonları değişiklik gösterir (Tablo 2 ve Tablo 3).
- Her oyuğa NET tahlil tamponunda 4x konsantre DNA boyası ekleyin.
- NET tahlil tamponunda 4x konsantre NETosis uyaranını karşılık gelen kuyucuklara ekleyin ve NET tahlil tamponunu yalnızca uyaransız kuyucuklara veya kaplanmış bağışıklık kompleksleri içeren kuyucuklara ekleyin (cIC; tablo 2'deki protokol).
- NET tahlil tamponunda 4x konsantre NETosis antagonistlerini ilgili kuyucuklara ekleyin. NET tahlil tamponunu yalnızca bir antagonisti olmayan kuyucuklara ekleyin.
- Her kuyucuğa nötrofil süspansiyonu ekleyin.
NOT: NET tahlil tamponunda 4x konsantre DNA boyası, 4x konsantre NETosis uyaranının hacmi, NET tahlil tamponunda 4x konsantre NETosis antagonisti, nötrofil sayısı ve oyuk başına nötrofil süspansiyonunun hacmi 96 oyuklu görüntüleme plakasına bağlıdır (Tablo 1). Pipetleme sırasında kabarcık oluşumunu önleyin. - Plakayı 100 x g ve RT'de 2 dakika santrifüjleyin ve 96 oyuklu görüntüleme plakasını 37 ° C ve% 5 CO2'de bir inkübatöre yerleştirilmiş canlı hücre mikroskobu analiz sistemine yerleştirin.
NOT: İnkübasyonun ilk dakikasında 96 oyuklu görüntüleme plakasının altında yoğuşma oluşabilir. Bu bir doku ile çıkarılmalıdır.
5. Satın alma için canlı hücre mikroskobu analiz sistemi yazılımının ayarlanması
NOT: Faz kontrastı ve immünofloresan görüntüleri, analiz yazılımı tarafından kontrol edilen bir canlı hücre mikroskobu analiz sistemi tarafından elde edilmiştir.
- Canlı hücre mikroskobu analiz sistemi yazılımını açın ve Cihaza bağlan'a tıklayın. Kullanıcı adı ve şifreyi girin. Almak için Planla'ya tıklayın ve artı düğmesine tıklayın (Gemi ekle'yi başlat). Ardından, Scan on Schedule (Zamanlamaya Göre Tara ) seçeneğini belirleyin ve Next (İleri) düğmesini tıklatın.
- Sıfırdan yeni bir gemi oluşturmak için, Gemi Oluştur bölümünde Yeni'yi seçin ve İleri'ye tıklayın. Scan Type (Tarama Türü) bölümünde Standard (Standart) seçeneğini seçin ve Next (İleri) düğmesini tıklatın.
- Aşağıdaki tarama ayarlarını seçin ve İleri'ye tıklayın: Hücre hücre: Yok; Görüntü Kanalları: Faz kontrastı ve Yeşil (çekim süresi 100 ms); Amaç: 20x.
- Gemi Seçimi bölümünde taranacak uygun tekne tipini seçin ve İleri'ye tıklayın.
- 96 oyuklu plaka #1 kullanılıyorsa, Corning, plaka, 96, N/A, 3603, 96 oyuklu Corning (Blk/Wht), Mikroplakalar'ı seçin.
- 96 oyuklu bir plaka #2 kullanıyorsanız, Nunc, Plaka, 96, N/A, 152028, 96 oyuklu Nunc opt alt (Blk/Wht), Mikroplakalar'ı seçin.
- Çekmecede teknenin konumunu belirtin ve İleri'ye tıklayın. Tarama Modeli bölümünde, taranması gereken kuyucukları seçin, kuyucuk başına görüntü sayısını seçin (temsili bir genel bakış elde etmek için kuyu başına 4 görüntüyü tarayın) ve İleri'ye tıklayın.
NOT: Otomatik odaklamayı etkileyeceği için boş kuyuları seçmeyin. - Diğerlerinin yanı sıra, gemi not defteri bölümüne plaka adını girerek gemi hakkında bilgi verin ve İleri'ye tıklayın. Analysis Setup (Analiz Ayarı) bölümünde Ertele analysis is later (Analizi daha sonraya ertele) seçeneğini belirleyin ve Next (İleri) düğmesini tıklatın.
- Tarama Programı bölümünde tekne için tarama programını tanımlayın. Aralıklarla taramalarla yeni zamanlama oluştur'u seçin ve 1 saat'i seçin. Taramayı durdur ve ilk taramadan 00:05 saat sonra öğesini seçin. İleri'ye tıklayın ve tarama bilgileri doğru olduğunda Zamanlamaya Ekle'ye tıklayın.
- Tarama programının düzenlenmesi gerektiğinde, ekranın üst kısmındaki Tarama Programına çift tıklayın. Tarama Programına sağ tıklayın ve istediğiniz gibi Düzenleyin ve Ayarlayın. Tarama zamanlamasını kaydetmek için Disket simgesini tıklatın.
NOT: Aynı deneyde birden fazla damar (plaka) görüntülenirken, artı düğmesine (Gemi ekle başlat) tıklanarak, Programa Göre Tara seçilerek ve İleri'ye tıklanarak mevcut tarama programına ek kaplar eklenebilir. Sıfırdan yeni bir gemi oluşturun (bu protokoldeki adım 5.2'ye bakın), mevcut bir gemiyi kopyalayın veya daha önce taranmış bir gemiyi kullanın. Bu, önceki plaka ile aynı frekans ve ayarlarda sıralı tarama ile sonuçlanır.
- Tarama programının düzenlenmesi gerektiğinde, ekranın üst kısmındaki Tarama Programına çift tıklayın. Tarama Programına sağ tıklayın ve istediğiniz gibi Düzenleyin ve Ayarlayın. Tarama zamanlamasını kaydetmek için Disket simgesini tıklatın.
6. Canlı görüntüleme mikroskobu NET tahlil analizi, canlı hücre mikroskobu analiz yazılımı kullanılarak
NOT: Faz kontrastı ve immünofloresan görüntülerini analiz etmek için canlı hücre mikroskobu analiz yazılımı kullanılmıştır (Malzeme Tablosu). Bu sistem kullanılmadığında, benzer bir NET analizi, kamuya açık bir yazılım paketi 4,18,19,20 kullanılarak gerçekleştirilebilir.
- Canlı hücre mikroskobu analiz yazılımını açın ve Cihaza bağlan'a tıklayın. Kullanıcı adınızı ve parolanızı girin ve Son taramaları görüntüle'ye tıklayın. Deneyin kap adını çift tıklatarak analiz etmek için tercih edilen denemeyi açın.
- Analizi başlat'a tıklayın ve Yeni analiz tanımı oluştur'u seçin. Sonrakine tıkla.
- Analiz türü kısmından Basic Analyzer'ı seçiniz ve Next'e tıklayınız. Görüntü Kanalı bölümünde, Yeşil'i seçin, Faz seçimini kaldırın ve İleri'yi tıklatın.
- Görüntü Katmanları penceresini açın ve Yeşil'i seçin ve Faz'ın seçimini kaldırın. Yeşil bölümde Otomatik Ölçeklendirme'yi kapatın ve NET'leri arka plandan ayırt etmek için yeşil kanal için min ve max'ı el ile ayarlayın.
NOT: Faz kontrastı gerektiğinde açılıp kapatılabilir. Örneğin, NET'lerin hücre dışı ortamda dışarı atılıp atılmadığını belirlemek için. - Gemi Tarama Süreleri penceresini açın ve NET'lerin bulunması gereken uygun gemi tarama zamanını seçin. Deney içindeki değişkenliği temsil eden bir dizi görüntü seçin (NET'li pozitif kontrol kuyularından gelen görüntüler ve NET'siz negatif kontrol kuyularından gelen görüntüler). Bu görüntüler, analizi önizlemek ve iyileştirmek için kullanılacaktır. Sonrakine tıkla.
- Analiz Tanımı Ayarları penceresini açın ve yeşil kanal için analiz ayarlarını, yanlış pozitif veya yanlış negatif NET'ler oluşturmadan NET yapıları ana hatlarıyla belirtilecek şekilde ayarlamaya başlayın. Aşağıdaki ayarları kullanın ve ayarları sırasıyla geçerli veya tüm görüntülere uygulamak için Geçerli Olanı Önizle veya Tümünü Önizle'yi tıklatın.
- Nesne adı için NET'leri seçin.
- Segmentasyon için Arka Plan Çıkarma Yok - Uyarlanabilir'i seçin.
- Eşik GCU için 3 ile 5 arasında seçim yapın (denemeye bağlı olarak).
- Kenar bölme için AÇIK (-10 ile 0 arasında) öğesini seçin.
- Temizleme için Delik Doldurma: 100μm2 ve Boyutu ayarla: -1 piksel'i seçin.
- Filtreler için, deneye bağlı olarak seçim yapın, ancak önerilen kesme değerleri şunlardır: Alan: >200 μm2, Ortalama yoğunluk: <24,6, Entegre yoğunluk: >7000.
NOT: Kullanılan ayarlara göre seçilen yapılar macenta ile çerçevelenmiştir. Fare ile bu yapıların üzerine gelmek, nesnelerin parametreleri (yani alan, eksantriklik, entegre yoğunluk ve ortalama yoğunluk) hakkında daha fazla bilgi verir ve bu da NET parametreleri için dahil etme veya hariç tutma kriterleriyle ilgili analizi optimize etmeye yardımcı olur. Analiz ayarlarının doğru olup olmadığını test etmek için birden fazla görüntüyü (pozitif ve negatif kontrol kuyularından) kontrol edin.
- NET çözümlemesi için ayarlar doğru olduğunda, İleri'yi tıklatın. Tarama süreleri ve kuyucuklar bölümünde analiz edilecek zaman noktalarını ve kuyuları seçin ve İleri'ye tıklayın. Analiz tanımını kaydet ve uygula bölümüne tanım adını girin ve İleri'ye tıklayın. Analiz bilgileri doğrulandıktan ve doğru olduğundan Son'a tıklayın.
NOT: Birden fazla plakayı analiz ederken veya önceki deneylerden analizleri kullanırken, analizi başlatın ve Mevcut analiz tanımını kopyala veya Mevcut analiz tanımını kullan'ı seçin ve İleri'ye tıklayın. Uygun mevcut analiz tanımını seçin ve İleri'ye tıklayın. Sonraki analiz prosedürü için, mevcut analiz tanımını kopyala seçilmişse adım 6.4'e veya mevcut analiz tanımını kullan seçilmişse adım 6.7'ye gidin. - İlgilendiğiniz gemideki analize tıklayarak deney analizini açın. Grafik Metrikleri penceresini açın.
- Artı düğmesini (Metrik oluştur) tıklayın. Veriler, NET birleşme yüzdesi (NET olarak işaretlenmiş görüntü alanının yüzdesi) veya yüzde netleştirme nötrofilleri (NET sayısının hücre sayısına bölünmesi) olarak sunulabilir.
- Verileri NET birleşme yüzdesi olarak sunarken, Ölçüm bölümünde Alan'ı seçin ve Değer bölümünde Birleşim'i seçin. Verileri yüzde netleştirme nötrofilleri olarak sunarken, Metrik bölümünde Nesne Sayısı'nı seçin ve Değer bölümünde Görüntü Başına'yı seçin.
- Tamam'a tıklayın. Kullanıcı Tanımlı Ölçümler bölümünde NETs Area Confluence (%) veya NETs Object Count Per Image (Per Image) öğesini seçin. Select Scans (Taramaları Seç) bölümünde analiz edilmesi gereken tüm zaman noktalarını seçin. Kuyu Seç bölümünde analiz edilmesi gereken tüm kuyuları seçin ve Verileri Dışa Aktar'a tıklayın.
- Graphing Export (Grafik Dışa Aktarma) bölümünde aşağıdaki ayarları seçin.
- Her taramayı kendi tablosu olarak göster'i seçin (sütunlar: 1, 2... satırlar: A, B...).
- Satır ve sütun etiketlerini göster'i seçin.
- Tüm taramalar tek bir dosyada'yı seçin ve dosya konumunu ve adını ayarlamak için Gözat'ı tıklatın.
- Deneme ayrıntılarını üst bilgiye dahil et'i seçin.
- Verileri tek tek görüntülere ayır'ı seçin.
- Verileri ".txt" dosyası olarak dışa aktarmak için Dışa Aktar'ı tıklayın, bu dosya içe aktarılabilir ve bir elektronik tabloda daha fazla analiz edilebilir.
NOT: Net nötrofillerin yüzdesini belirlemek için, t = 0'daki nötrofil sayısının belirlenmesi gerekir. Bunu yapmak için protokolün aşağıdaki adımlarıyla devam edin. - t = 0'daki görüntüler için nötrofil sayısını saymak için gerekli ek analizi başlatmak için adım 6.1'e gidin.
- Adım 6.3'te, Faz'ı seçin ve görüntü kanalı bölümünde Yeşil'in seçimini kaldırın.
- Adım 6.4'te, damar tarama süreleri bölümünde t = 0'ı seçin.
- Adım 6.5'te Yeşil'in seçimini kaldırın, Faz'ı seçin ve gerektiğinde Faz Kanalı Ayarlarını yapın.
- Adım 6.6'da, Nesne Adı'nı ekleyin, Segmentasyon bölümünde Classic Confluence'ı seçin ve segmentasyon ayarını 0 (Arka Plan) olarak ayarlayın, Delik Dolgusu'nu 100μm2'ye ayarlayın ve Alan'ı 50μm2'ye ayarlayın.
- Adım 6.7'de, taramaları seç bölümünde t = 0'ı seçin.
- Adım 6.8'de Nötrofil Sayısı Analizi'ni açın.
- 6.9. adımda, Kullanıcı Tanımlı Ölçümler bölümünde Görüntü Başına Nesne Sayısı (Görüntü Başına) öğesini seçin.
- Son olarak, netleştirme nötrofillerin yüzdesini oluşturmak için aşağıdaki hesaplamayı kullanın: (NET sayısı / t = 0'daki nötrofil sayısı) x %100.
Sonuçlar
Geçirimsiz bir DNA boyası ile birlikte gerçek zamanlı yüksek verimli mikroskopi, NETosis'in kinetiğini, özelliklerini ve altta yatan yolaklarını incelemeye olanak tanır ve NET salınımının potansiyel inhibitörlerinin değerlendirilmesini sağlar. Bu yaklaşımla, NET'ler, sağlıklı nötrofillerin yüzey alanına kıyasla önemli ölçüde daha büyük bir yüzey alanına sahip DNA boyası için pozitif yapılar olarak tanımlandı (Şekil 1A), bu da kromatinin hücre dışı ortama atıldığını gösterir18. Yüzey alanına dayalı analiz, NET'ler ile plazma zarı bütünlüğü bozulmuş aktive nötrofiller arasında ayrım yapmamızı sağladı ve parlak hücre içi DNA boyaması gösterdi (Şekil 1A).
Kalsiyum iyonofor (A23187) ve PMA, in vitro olarak NETosis'i indüklemek için yaygın olarak kullanılır. Fizyolojik olmayan uyaranlar olmalarına rağmen, farklı NETosis yolaklarını aktive ettikleri ve donörler arasında düşük değişkenlik ile tutarlı NETosis indüksiyonu sağladıkları için değerlidirler. A23187, kalsiyum akışını tetikleyerek PAD4 aktivasyonuna ve sitrülinli histonlar açısından zengin NET'lerin salınmasına yol açarken, PMA, NADPH oksidaz kompleksini aktive ederek reaktif oksijen türleri (ROS) üretimine ve ardından düşük sitrüline histon seviyelerine sahip NET'lerin salınmasına neden olur 5,16,21. NETosis yanıtının hızı ve büyüklüğü, her bir uyaranın konsantrasyonuna bağlıdır (Şekil 1B,C), A23187 daha hızlı NETosis'i indükler ve PMA, NET'leri serbest bırakan nötrofillerin daha yüksek bir oranıyla sonuçlanır (Şekil 1D-F). A23187 stimülasyonundan kaynaklanan NET'ler (Şekil 1D; kırmızı ok), nötrofil plazma zarının ötesine daha yaygın olmasıyla PMA'nın neden olduğu NET'lerden (Şekil 1D; sarı ok) farklıyken, PMA'nın neden olduğu NET'ler nötrofil plazma zarına daha bitişik kalmıştır. Ek olarak, A23187 stimülasyonu, DNA'larını hücre dışı boşluğa atmayan geçirgen olmayan DNA boya pozitif nötrofiller (Şekil 1D; mavi ok) ile sonuçlandı. Geçirgen olmayan netleşmeyen DNA boya pozitif nötrofillerin tespiti, A23187 konsantrasyonuna bağlıydı (Şekil 1G) ve NETosis'i uyarmak için kullanılan PMA konsantrasyonundan bağımsız olarak neredeyse yoktu (Şekil 1D, H). Fizyolojik olmayan NETosis uyaranları A23187 ve PMA'nın kullanılmasının yanı sıra, bu test aynı zamanda NETosis'in hastalıkla ilgili tetikleyicilerini incelemek için de uygundur. Örnek olarak, kalsiyum pirofosfat eğilim hastalığında (CPPD) bulunan çözünür bağışıklık kompleksleri (sIC) veya kristaller ile aktive edilen nötrofiller, hiçbir uyarana kıyasla önemli ölçüde artmış NET salınımı gösterdi. Nötrofiller kaplanmış immün kompleksler (cIC), fMLP ve monosodyum ürat (MSU) kristalleri ile aktive edildiğinde yüksek NET seviyelerine doğru bir eğilim gözlenmiştir (Şekil 1I); Bununla birlikte, bu uyaranlar için donörden donöre önemli farklılıklar gözlemledik.
NETosis yolağının ve NETosis ile ilişkili enzimlerin farmakolojik inhibisyonu, NETosis hedefli terapötiklerin, NET birikiminin patolojiyi önemli ölçüde yönlendirdiği hastalıklar için etkili tedaviler olabileceğini göstermiştir 14,17,22,23,24. Bu gerçek zamanlı mikroskopi NET testi, NETosis antagonistlerini yüksek verimli bir şekilde incelemek için kolay, güvenilir ve tekrarlanabilir bir yaklaşımdır. Bunu örneklemek için, yüksek afiniteye sahip sitrüline histon H2A ve H4'ü hedef alan birinci sınıf insanlaştırılmış bir monoklonal antikorolan CIT-013'ü kullandık 15,16. A23187, NETosis yolunu aktive eder, bu da daha sonra NETosis inhibitör işlevini gerçekleştirmek için CIT-013 tarafından hedeflenen sitrülinli histonlar içeren NET'lerle sonuçlanır16. Gerçekten de, A23187'ye yanıt olarak NET salınımı,4.6 nM'lik bir IC 50 ile CIT-013 (Şekil 2A ve Ek Video 1) tarafından tamamen inhibe edildi (Şekil 2B). CIT-013'ün NETosis inhibitör kapasitesi benzersizdir, çünkü farklı (olmayan) sitrülinlenmiş histonları hedefleyen diğer ticari antikorlar NET salınımını inhibe edememiştir (Şekil 2C).
Daha önce, CIT-013'ün oldukça benzer bir öncü molekülünün (iki amino asidi farklı ancak benzer epitopları eşit afiniteye sahip) aktive edilmiş trombositler, gut sinovyal sıvısı ve RA sinovyal sıvısı17 gibi fizyolojik uyaranlara yanıt olarak NETosis'i bloke ettiğini göstermiştik. Burada, sIC tarafından indüklenen NET salınımının CIT-013 tarafından inhibe edilebileceğini gösteriyoruz (Şekil 2D). Bu uyaran tarafından indüklenen NETosis'i inhibe etmenin terapötik önemi, serum veya sinovyal sıvıdaki otoantikorların NETosis'i tetikleyen IC oluşumunu desteklediği SLE, RA ve diğer otoimmün hastalıklar tarafından vurgulanmaktadır25,26.
Birlikte, bu veriler bu gerçek zamanlı yüksek verimli mikroskopi yaklaşımının NET salınımının kinetiğini ve özelliklerini incelemek için uygun olduğunu ve NETosis inhibitörlerinin incelenmesine izin verdiğini göstermektedir. Bu yöntem insan nötrofillerinin kullanımı için optimize edilmiş olsa da, modifikasyonlarla diğer türlerden nötrofilleri incelemek de uygun olabilir. Bu tahlil ile elde edilen veriler, NET kaynaklı hastalıklar için güçlü ve etkili bir tedavi olarak CIT-013'ün mantığının temel taşıdır.
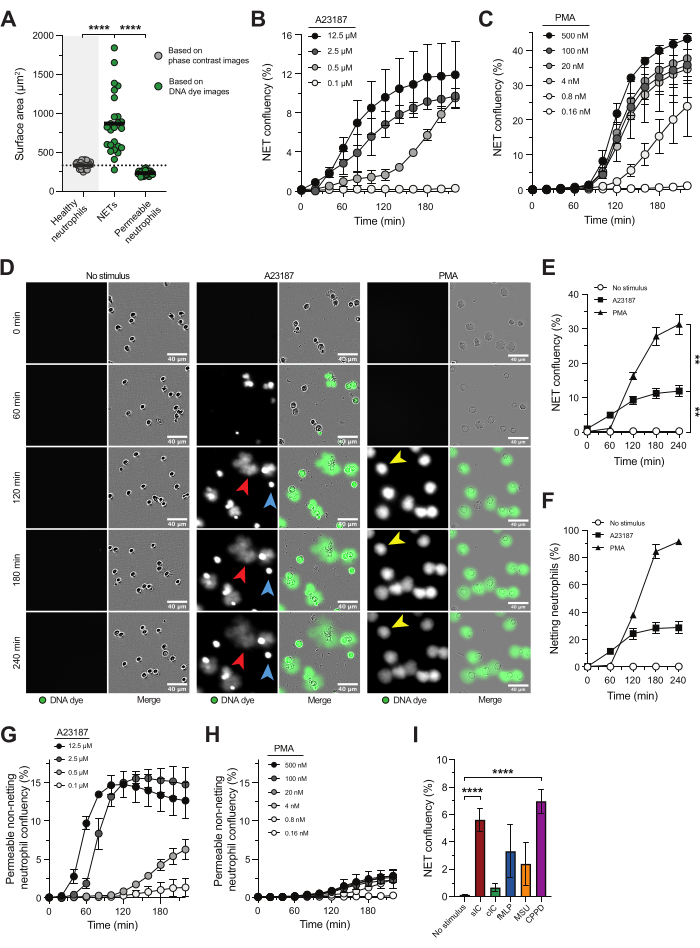
Şekil 1: NET sürümünü incelemek için gerçek zamanlı yüksek verimli mikroskopi. Sağlıklı gönüllülerin kanından izole edilen nötrofiller, NETosis yolunu tetiklemek için A23187 veya PMA ile uyarıldı. NET salınımı, plazma zarı geçirimsiz DNA boyası kullanılarak gerçek zamanlı yüksek verimli mikroskopi ile görselleştirildi ve canlı hücre mikroskobu analiz sistemi yazılımı ile yüzey alanına dayalı olarak ölçüldü. (A) Uyarılmamış sağlıklı nötrofillerin (gri), hücre dışı NET'lerin ve hücre içi DNA boyaması (yeşil) ile geçirgen ağ oluşturmayan nötrofillerin yüzey alanının analizi. (B,C) Belirtilen A23187 veya PMA konsantrasyonları (n = 2) ile uyarılan nötrofillerden zaman içinde NET salınımının miktarının belirlenmesi. (D) Farklı zaman noktalarında A23187 (kırmızı oklar) ve PMA'ya (sarı oklar) yanıt olarak NET sürümünün temsili görüntüleri. Geçirgen olmayan ağ oluşturmayan nötrofillerin örnekleri mavi oklarla belirtilmiştir. (E) NET birleşmesinin yüzdesi olarak sunulan zaman içindeki NET salınımının nicelleştirilmesi (n = 5). İstatistikler t = 240 dakika üzerinde yapıldı. (F) Zaman içinde NET salınımının nicelleştirilmesi, netleştirme nötrofillerinin yüzdesi olarak sunuldu (n = 2). (G, H) Belirtilen A23187 veya PMA konsantrasyonları (n = 2) ile uyarılmış nötrofillerden zaman içinde geçirgen net olmayan nötrofillerin miktarının belirlenmesi. (I) Kalsiyum pirofosfat eğilim hastalığında (CPPD) bulunan çözünür bağışıklık kompleksleri (sIC), kaplanmış IC (cIC), fMLP, monosodyum ürat (MSU) kristalleri ve kristaller tarafından indüklenen t = 240 dakikada NET salınımının miktarının belirlenmesi (n = 8-28). Sonuçlar ortalama ± ortalamanın standart hatası olarak rapor edilir. **P < 0.01 ve ****P < 0.0001, Dunnett'in çoklu karşılaştırma testi (B) ile tekrarlanan tek yönlü ANOVA ölçümleri, Dunn'ın çoklu karşılaştırma testi (I) ile Kruskal-Wallis testi. Paneller A-F, van der Linden ve ark.16'nın izniyle değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
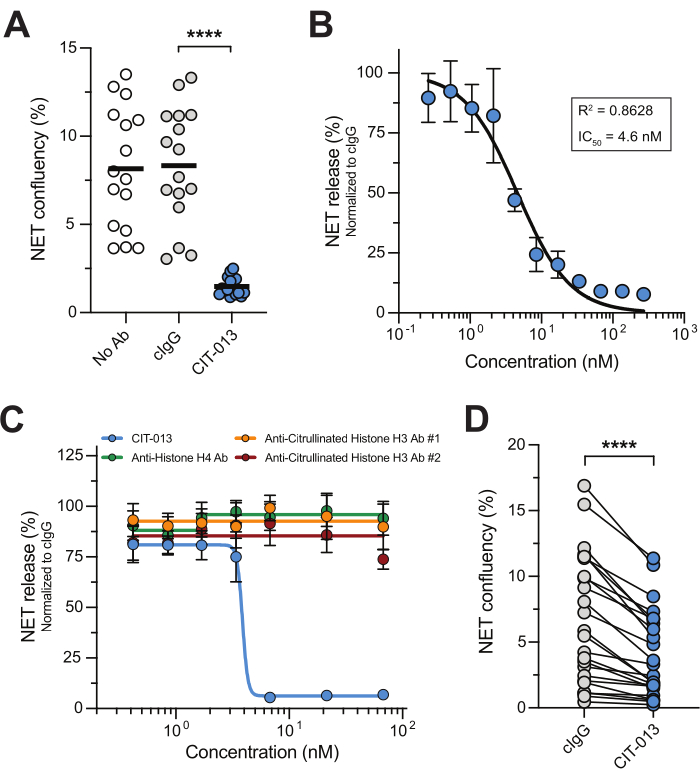
Şekil 2: CIT-013 NET salınımını engeller. (A) CIT-013 veya izotip kontrol antikorunun (cIgG) yokluğunda (Ab Yok) veya varlığında t = 240 dakikada A23187 ile indüklenen NET salınımının miktarının belirlenmesi. (B) T = 240 dakikada (n = 3) CIT-013 ile A23187 ile indüklenen NET salınımının doza bağlı inhibisyonu. Veriler cIgG'ye normalleştirildi (%100 NET sürümü olarak ayarlandı). (C) Belirtilen CIT-013, anti-histon H4 antikoru, anti-sitrüline histon H3 antikoru #1 veya anti-sitrüline histon H3 antikoru #2 (n = 6) varlığında t = 240 dakikada A23187 ile indüklenen NET salınımının nicelleştirilmesi. (D) CIT-013 veya cIgG varlığında çözünür bağışıklık kompleksleri (IC'ler) tarafından indüklenen t = 240 dakikada NET salınımının miktarının belirlenmesi. Sonuçlar ortalama ± ortalamanın standart hatası olarak rapor edilir. P < 0.0001, Tukey'in çoklu karşılaştırmaları (A) veya iki kuyruklu Wilcoxon eşleştirilmiş çiftler işaretli sıra testi (D) ile tekrarlanan tek yönlü ANOVA ölçümleri. A, B ve D panelleri, van der Linden ve ark.16'nın izniyle değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| 96 kuyulu plaka #1 | 96 kuyulu plaka #2 | |
| Hacim: Kuyucuk başına% 0.001 poli-L-lizin çözeltisi | 50 μL | 100 μL |
| Kuyucuk başına nötrofil süspansiyon hacmi | 50 μL | 87,5 μL |
| Kuyucuk başına nötrofil sayısı | 2 x 104 hücreli | 3,5 x 104 hücreli |
| Hacim 4x konsantre (= 80 nM) DNA boyası, kuyucuk başına NET tahlil tamponunda | 50 μL | 87,5 μL |
| Kuyu başına NET tahlil tamponunda hacim 4x konsantre NETosis uyaranı | 50 μL | 87,5 μL |
| Kuyucuk başına NET tahlil tamponunda hacim 4x konsantre NETosis antagonistleri | 50 μL | 87,5 μL |
Tablo 1: Farklı 96 oyuklu görüntüleme plakaları için optimize edilmiş hacimler ve hücre sayıları.
| Konsantrasyon çalışma çözümü (4x konsantre) | Son konsantrasyon | |
| Kalsiyum iyonofor (A23187) | 50 μM | 12,5 μM |
| PMA | 16 nM | 4 nM (4 nM ) |
| fMLP (İngilizce) | 4 μM | 1 μM |
| Monosodyum ürat (MSU) kristalleri | 400 μg/mL | 100 μg/mL |
| Kalsiyum pirofosfat eğilim hastalığı (CPPD) kristalleri | 400 μg/mL | 100 μg/mL |
| Çözünür bağışıklık kompleksleri (sIC) | 1. DPBS'de 5 μg / mL insan serum albümini (HSA) DPBS'de 282.5 μg / mL poliklonal tavşan anti-HSA antikoruna ekleyin. | |
| 2. 37 °C'de en az 90 dakika inkübe edin. | ||
| 3. Girdaplama ile homojenize edin ve ilgili kuyucuklara 50 μL sIC çözeltisi ekleyin. | ||
| Kaplamalı immün kompleksler (cIC) | 1. 96 oyuklu plakanın ilgili kuyucuklarında DPBS'ye 10 μg / mL HSA ekleyin. | |
| 2. Gece boyunca 4 °C'de inkübe edin. | ||
| 3. Kuyuları DPBS'de 200 μL %0.05 Tween-20 ile 3 kez yıkayın (bundan sonra PBS /%0.05 Tween olarak anılacaktır). | ||
| 4. Kuyucukları PBS /% 0.05 Tween'de 200 μL% 1 (a / h) sığır serum albümini ile bloke edin (bundan sonra bloke edici tampon olarak anılacaktır). | ||
| 5. Oda sıcaklığında 120 dakika inkübe edin ve hafif çalkalayın (400 rpm). | ||
| 6. Kuyuları 200 μL PBS /% 0.05 Tween ile 3 kez yıkayın. | ||
| 7. İlgili kuyucuklara bloke edici tamponda 50 μL poliklonal tavşan anti-HSA antikoru ekleyin. | ||
| 8. Oda sıcaklığında 60 dakika inkübe edin ve hafif çalkalayın (400 rpm). | ||
| 9. Kuyuları 200 μL PBS /% 0.05 Tween ile 3 kez yıkayın. | ||
| 10. Son olarak, kuyuları 200 μL DPBS ile 3 kez yıkayın. Wells artık protokoldeki 4.7 adımına hazır. | ||
Tablo 2: NETosis uyaranları için önerilen konsantrasyonlar.
| Konsantrasyon çalışma çözümü (4x konsantre) | Son konsantrasyon | |
| Anti-Tavuk yumurtası lizozim antikoru (kontrol antikoru; cIgG) | 80 nM | 20 nM |
| CIT-013 | 80 nM | 20 nM |
Tablo 3: NETosis antagonisti için önerilen konsantrasyonlar.
Ek Video 1. Nötrofiller, cIgG (solda) veya CIT-013 (sağda) varlığında A23187 ile uyarıldı ve plazma zarı geçirimsiz DNA boyası kullanılarak zaman içinde NET salınımı görselleştirildi. NET salınımı CIT-013 varlığında engellenir. Film, DNA boyası (yeşil) ve faz kontrastının bir katmanıdır. Bu video van der Linden ve ark.16'nın izniyle elde edilmiştir. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
2004 yılında NET'lerin keşfinden bu yana, NET salınımını in vitro olarak deneysel olarak araştırmak için birçok strateji geliştirilmiştir ve immünofloresan mikrokopi NETosis'i ölçmek için en yaygın tekniktir27,28. Mikroskopi, NET salınımını görselleştirmek için yararlı olsa da, sabit zaman noktası görüntülerinin otomatik olmayan mikroskobik nicelemesi oldukça yanlış olduğundan ve gözlemci yanlılığından muzdarip olabileceğinden sınırlamaları vardır. NET salınımını incelemek için kullanılan başka bir teknik, çok sayıda ağ nötrofilini ölçen ve tarafsız analizi benimseyen, ancak NETosis'in erken evrelerinde nötrofillere odaklanan ve NET'lerini salan nötrofillerin miktarını belirlemeyen multispektral görüntüleme akış sitometrisidir29,30. NETosis kinetiği üzerine yapılan birçok çalışma, bir floresan plaka okuyucu31 ile kombinasyon halinde NET salınımını ölçmek için bir DNA boyası kullanır. Bu teknik, NET'leri hücre içi DNA boyaması ile aktive olmuş veya ölmekte olan nötrofillerden ayırt edemez ve bu nedenle NET salınımının niceliklendirilmesi ve NETosis antagonistlerinin incelenmesi için uygun değildir. Yukarıdakiler, NETosis'i incelemek için şu anda kullanılmakta olan yaklaşımların değerli olduğunu ancak sınırlamaları olduğunu vurgulamaktadır.
Bu çalışmada açıklanan gerçek zamanlı mikroskopi yöntemi, daha önce bildirilen tekniklerde bulunan birçok sorunu ele almaktadır. Tarafsız, yarı otomatik, yüksek verimli, tekrarlanabilir ve doğru NET nicelemesi sunar. Gerçekten de, bu yaklaşım, NET'lerin18'in gerilmiş morfolojisi gibi pipetleme artefaktlarını en aza indirir ve DNA salınımının farklı morfolojisi ve kinetiği yoluyla NETosis'i nekroz ve apoptozdan ayırt edebilir18,32. Ek olarak, bu yaklaşım, NET'lerin33'ün fonksiyonel ve fenotipik kriterlerini karşılayan yapılar oluşturan nekrototik nötrofillerde NET oluşumu gibi, düzenlenmiş hücre ölümü için farklı biyokimyasal yolları inceleme fırsatı sağlar.
Bu protokolde, NET'lerin başarılı bir şekilde ölçülmesi için izlenmesi gereken birkaç kritik adım vardır. İlk olarak, doğru NET nicelemesi için oyuk başına doğru hücre sayısı önemlidir. Nötrofil yoğunluğu çok yüksek olduğunda, hücreler ve NET'ler bitişik hücreler ve NET'lerle örtüşür, bu da onları ayırt etmeyi zorlaştırır ve sonuç olarak nicelik ölçümü yanlış hale gelir. İkincisi, hücre dışı ortama salgılandığında NET'leri lekelemek için düşük konsantrasyonda toksik olmayan plazma zarı geçirimsiz DNA bağlayıcı boya kullanmak bir ön koşuldur. Plazma zarı geçirgen DNA bağlayıcı boyalar kolayca nötrofil aktivasyonunu veya hücre ölümünü indükleyebilir. Üçüncüsü, heterojen nötrofil popülasyonu arasında NET salınımına temsili bir genel bakış için kuyu başına birden fazla görüntü taranmalıdır. Dördüncüsü, t = 0'daki nötrofillerin faz kontrast görüntüsü, görüntü başına nötrofil sayısını düzeltmek ve netleştirme nötrofillerinin yüzdesini hesaplamak için gereklidir.
Bu gerçek zamanlı, yüksek verimli mikroskopi yaklaşımının diğer NET algılama testlerine göre birçok avantajı olmasına rağmen, bu yöntemin sınırlamaları vardır, çünkü bildiğimiz kadarıyla, NET'lerin salınımını doğrulamak için ek NET bileşenlerini tespit etmek için floresan boyalar mevcut değildir. Ek NET bileşenlerini tespit etmek için floresan işaretli antikorlar kullanılabilir, ancak antikor bağışıklık kompleksleri nötrofil aktivasyonunu ve muhtemelen NETosis'i etkilediğinden istenmeyen etkilere sahip olabilir. Bu nedenle, bu test kurulumunda ek antikorlar kullanmamayı tercih ediyoruz ve bunun yerine iyi bilinen NETosis'i indükleyen uyaranları kullanmanızı öneriyoruz. Henüz belirlenmemiş NETosis uyaranları kullanıldığında, canlı görüntüleme testinden önce sitrülinlenmiş histonlar gibi NET'e özgü proteinlerle kompleks haline getirilmiş DNA'yı tespit etmek için bir ELISA'nın kullanılmasını savunuyoruz. İkinci olarak, tahlil içi ve tahliller arası varyasyon, donörden donöre değişkenlikten kaynaklanabilir ve sağlıklı donörlerden alınan nötrofiller, sağlıklı popülasyon içindeki heterojenlik nedeniyle çeşitli NETosis uyaranlarına farklı yanıt verir. Test varyasyonunu en aza indirmek için, nötrofiller taze çekilmiş kandan 1 saat içinde izole edilmeli ve nötrofiller kısa ömürlü olduğundan ve kriyoprezervasyon yapılamadığından deneyde hemen kullanılmalıdır. Ayrıca, nötrofil aktivasyonunu en aza indirmek için bir nötrofil izolasyon protokolünün doğrulanması ve benimsenmesi önemlidir. Nötrofiller hassas hücrelerdir ve mekanik ve diğer stres türleri nedeniyle saflaştırma işlemi sırasında uyaranlara tepkilerini değiştirebilirler. Nötrofil aktivasyon durumu ve NET salınımı, iğne tipi, kullanılan kan alma tüpleri, inkübasyon sıcaklığı, santrifüj hızı ve kan alımından nötrofil izolasyonuna kadar geçen süreden 34,35,36,37 etkilenebilir. Göz önünde bulundurulabilecek ek bir nötrofil izolasyon yöntemi, Krémer ve ark.36 tarafından kırmızı kan hücresi lizizi olmadan negatif bir immünomanyetik seçim yöntemi kullanılarak tanımlanmıştır. Bu yöntem, tam kandaki el değmemiş nötrofillere benzer ve saflaştırma işlemi sırasında herhangi bir nötrofil aktivasyonunu önlemek için uygun olabilir. Yukarıdakilerin tümü, farklı araştırma gruplarından gelen verilerin büyük bir özenle karşılaştırılması gerektiği konusunda alanı uyarmaya hizmet etmelidir.
Genel olarak, açıklanan gerçek zamanlı yüksek verimli mikroskopi yöntemi, NET'lerin tekrarlanabilir ve verimli bir şekilde doğru bir şekilde ölçülmesini sağlar ve NET salınımının özelliklerini, büyüklüğünü ve kinetiğini incelemek için kullanılabilir ve NETosis antagonistlerinin aktivitesinin araştırılmasını sağlar. İkincisine bir örnek olarak, şu anda klinik geliştirme aşamasında olan insanlaştırılmış anti-sitrülinli histon H2A ve H4 monoklonal antikoru CIT-013'ü kullandık.
Açıklamalar
Yazarlar Cithill'in çalışanlarıdır ve finansal çıkarları vardır.
Teşekkürler
Yazarlar, canlı görüntüleme mikroskobu yöntemiyle ilgili projenin bir bölümünü yönettiği için Paul Vink'e teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| A-23187 Free Acid (Calcimycin) | Thermo Fisher | A1493 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | A9434 | |
| Anti-Hen egg lysozyme (control antibody; cIgG) | CrownBio | C0001 | |
| APC-Cy7-conjugated mouse anti-human CD45 antibody (Clone 2D1) | Biolegend | 368515 | Use at 1 µg/mL final concentration |
| BD FACSCantoTM II system + FACSDiva software (version 8.0.1) | BD | n/a | Flow cytometry system |
| Bovine Serum Albumin (BSA) Fraction V | Roche | 10735108001 | |
| CaCl2 (1 M) | VWR | E506 | |
| Calcium pyrophosphate disposition disease (CPPD) crystals | InvivoGen | lrl-cppd | |
| Cellometer Auto T4 Bright Field Cell Counter + analysis software (version 3.3.9.5) | Nexcelom Bioscience | n/a | Bright field cell counter |
| CIT-013 | Citryll B.V. | n/a | |
| Costar black 96-well plate, clear bottom | Corning | 3603 | 96-well plate #1 |
| Dextran T500 | Pharmacosmos | 551005009006 | |
| DPBS (1x) | Gibco | 14190-144 | |
| Fetal Bovine Serum (FBS) | Serena | S-FBS-SA-015 | |
| Ficoll | GE Healthcare | 17-1440-02 | Density gradient solution |
| FITC-conjugated mouse anti-human CD66b antibody (Clone G10F5) | eBioscience | 17-0666-42 | Use at 1.5 µg/mL final concentration |
| Fixable viability dye eFluor 506 | eBioscience | 65-0866-14 | |
| Flow cytometry analysis software | FLowJo | Version 10.8.0 | |
| fMLP | Sigma Aldrich | 47729-10MG-F | |
| HEPES (1M) | Gibco | 15630-080 | |
| Human serum albumin (HSA) | VWR | 31020 | |
| Human TruStain FcX | Biolegend | 422302 | Fc receptor block |
| IBIDI 96-well plate, clear bottom | IBIDI | 89626 | 96-well plate #2 |
| IncuCyte SX3 + analysis software (version 2022B Rev1) | Satorius | n/a | Live cell microscopic analysis system |
| Monosodium urate crystals | InvivoGen | tlrl-msu | |
| Mouse anti-histone H3 (citrulline R2 + R8 + R17) antibody | Cayman | 17939 | Clone 11D3; referred to as #1 |
| Mouse anti-histone H4 (K8Ac + K12Ac + K16Ac) antibody (Clone KM-2) | Absolute Antibodies | Ab01681-2.0 | |
| Na2EDTA | Sigma Aldrich | E5134 | |
| NaCl (0.9%) | B. Braun | 25900 | |
| Penicillin (5000 U/mL) - Streptomycin (5000 µg/mL) | Gibco | 15070-063 | |
| PerCP-Cy5.5-conjugated mouse anti-human CD16 antibody (Clone 3G8) | Biolegend | 302027 | Use at 0.33 µg/mL final concentration |
| PMA | Sigma Aldrich | P1585 | |
| Polyclonal rabbit anti-HSA antibody | Sigma Aldrich | A0433-2ml | |
| Poly-L-Lysine (0.01%) | Sigma Aldrich | P4832 | |
| Potassium bicarbonate (KHCO3) | Sigma Aldrich | 237205 | |
| Rabbit anti-histone H3 (citrulline R2 + R8 + R17) antibody | Abcam | ab281584 | Multiclonal; referred to as #2 |
| RPMI 1640 with GlutaMAXTM supplement | Gibco | 61870-010 | Culture medium containing L-glutamine |
| RPMI 1640 without phenol red | Gibco | 11835-030 | Culture medium without phenol red |
| Sodium azide (NaN3) | Sigma Aldrich | S2002 | |
| Sterile H2O | Gibco | 15230204 | |
| Sytox Green Nucleid Acid Stain | Thermo Fisher | S7020 | DNA dye |
| Trypan blue solution (0.4%) | Gibco | 15250-061 | |
| Tween-20 | Sigma Aldrich | P1379 | |
| Vacutainer blood tubes Li-Heparin (17 IU/mL) | BD | 367526 |
Referanslar
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- De Bont, C., Pruijn, G. J. M. Citrulline is not a major determinant of autoantibody reactivity to neutrophil extracellular traps. Philos Trans R Soc Lond B Biol Sci. 378 (1890), 20220249 (2023).
- Urban, C. F., et al. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans. PLoS Pathog. 5 (10), e1000639 (2009).
- Hoppenbrouwers, T., et al. In vitro induction of NETosis: Comprehensive live imaging comparison and systematic review. PLoS One. 12 (5), e0176472 (2017).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. ELife. 6, e24437 (2017).
- Parker, H., Dragunow, M., Hampton, M. B., Kettle, A. J., Winterbourn, C. C. Requirements for NADPH oxidase and myeloperoxidase in neutrophil extracellular trap formation differ depending on the stimulus. J Leukoc Biol. 92 (4), 841-849 (2012).
- Neeli, I., Radic, M. Opposition between PKC isoforms regulates histone deimination and neutrophil extracellular chromatin release. Front Immunol. 4, 38 (2013).
- Bosmann, M., Ward, P. A. Protein-based therapies for acute lung injury: targeting neutrophil extracellular traps. Expert Opin Ther Targets. 18 (6), 703-714 (2014).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 18 (2), 134-147 (2018).
- Shiratori-Aso, S., Nakazawa, D. The involvement of NETs in ANCA-associated vasculitis. Front Immunol. 14, 1261151 (2023).
- Byrd, A. S., et al. Neutrophil extracellular traps, B cells, and type I interferons contribute to immune dysregulation in hidradenitis suppurativa. Sci Transl Med. 11 (508), eaav5908 (2019).
- Kimball, A. S., Obi, A. T., Diaz, J. A., Henke, P. K. The emerging role of NETs in venous thrombosis and immunothrombosis. Front Immunol. 7, 236 (2016).
- O'Neil, L. J., et al. Neutrophil extracellular trap-associated carbamylation and histones trigger osteoclast formation in rheumatoid arthritis. Ann Rheum Dis. 82 (5), 630-638 (2023).
- Li, M., et al. A novel peptidylarginine deiminase 4 (PAD4) inhibitor BMS-P5 blocks formation of neutrophil extracellular traps and delays progression of multiple myeloma. Mol Cancer Ther. 19 (7), 1530-1538 (2020).
- Chirivi, R. G. S., et al. Anti-citrullinated protein antibodies as novel therapeutic drugs in rheumatoid arthritis. J Clin Cell Immunol. S6, 006 (2013).
- Van der Linden, M., et al. Anti-citrullinated histone monoclonal antibody CIT-013, a dual action therapeutic for neutrophil extracellular trap-associated autoimmune diseases. MAbs. 15 (1), 2281763 (2023).
- Chirivi, R. G. S., et al. Therapeutic ACPA inhibits NET formation: a potential therapy for neutrophil-mediated inflammatory diseases. Cell Mol Immunol. 18 (6), 1528-1544 (2021).
- Van der Linden, M., Westerlaken, G. H. A., Van Der Vlist, M., Van Montfrans, J., Meyaard, L. Differential signalling and kinetics of neutrophil extracellular trap release revealed by quantitative live imaging. Sci Rep. 7 (1), 6529 (2017).
- Hoffmann, J. H. O., Schaekel, K., Gaiser, M. R., Enk, A. H., Hadaschik, E. N. Interindividual variation of NETosis in healthy donors: introduction and application of a refined method for extracellular trap quantification. Exp Dermatol. 25 (11), 895-900 (2016).
- Silva, L. M., Moutsopoulos, N., Bugge, T. H., Doyle, A. Live imaging and quantification of neutrophil extracellular trap formation. Curr Protoc. 1 (7), e157 (2021).
- De Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochim Biophys Acta Mol Cell Res. 1865 (11 Pt A), 1621-1629 (2018).
- Gajendran, C., et al. Alleviation of arthritis through prevention of neutrophil extracellular traps by an orally available inhibitor of protein arginine deiminase 4. Sci Rep. 13 (1), 3189 (2023).
- Biron, B. M., Chung, C. -. S., O'Brien, X. M., Chen, Y., Reichner, J. S., Ayala, A. Cl-Amidine prevents histone 3 citrullination and neutrophil extracellular trap formation, and improves survival in a murine sepsis model. J Innate Immun. 9 (1), 22-32 (2017).
- Perdomo, J., et al. Neutrophil activation and NETosis are the major drivers of thrombosis in heparin-induced thrombocytopenia. Nat Commun. 10 (1), 1322 (2019).
- Lood, C., et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nat Med. 22 (2), 146-153 (2016).
- Kraaij, T., et al. A novel method for high-throughput detection and quantification of neutrophil extracellular traps reveals ROS-independent NET release with immune complexes. Autoimmun Rev. 15 (6), 577-584 (2016).
- De Buhr, N., Von Köckritz-Blickwede, M. How neutrophil extracellular traps become visible. J Immunol Res. 2016, 1-13 (2016).
- Brinkmann, V., Laube, B., Abu Abed, U., Goosmann, C., Zychlinsky, A. Neutrophil extracellular traps: How to generate and visualize them. J Vis Exp. (36), e1724 (2010).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. J Immunol Methods. 423, 104-110 (2015).
- Gavillet, M., et al. Flow cytometric assay for direct quantification of neutrophil extracellular traps in blood samples. Am J Hematol. 90 (12), 1155-1158 (2015).
- Sil, P., Yoo, D., Floyd, M., Gingerich, A., Rada, B. High throughput measurement of extracellular DNA release and quantitative NET formation in human neutrophils in vitro. J Vis Exp. (112), e52779 (2016).
- Gupta, S., Chan, D. W., Zaal, K. J., Kaplan, M. J. A high-throughput real-time imaging technique to quantify NETosis and distinguish mechanisms of cell death in human neutrophils. J Immunol. 200 (2), 869-879 (2018).
- D'Cruz, A. A., et al. The pseudokinase MLKL activates PAD4-dependent NET formation in necroptotic neutrophils. Sci Signal. 11 (546), eaao1716 (2018).
- Nash, G., Abbitt, K., Tate, K., Jetha, K., Egginton, S. Changes in the mechanical and adhesive behaviour of human neutrophils on cooling in vitro. Pflugers Arch. 442 (5), 762-770 (2001).
- Hundhammer, T., Gruber, M., Wittmann, S. Paralytic impact of centrifugation on human neutrophils. Biomedicines. 10 (11), 2896 (2022).
- Krémer, V., Godon, O., Bruhns, P., Jönsson, F., De Chaisemartin, L. Isolation methods determine human neutrophil responses after stimulation. Front Immunol. 14, 1301183 (2023).
- Freitas, M., Porto, G., Lima, J. L. F. C., Fernandes, E. Isolation and activation of human neutrophils in vitro. The importance of the anticoagulant used during blood collection. Clin Biochem. 41 (7-8), 570-575 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır