ציטומטריית זרימה ומיון תאים המופעלים על-ידי פלואורסצנטיות (FACS): בידוד של לימפוציטים מסוג Splenic B
Overview
מקור: פרצ'טתיבו 1,2,3, מונירסילבן 1,2,3, סופי נובאלט4, רחל גולוב1,2,3
יחידה אחת ללימפופוליס, המחלקה לאימונולוגיה, מכון פסטר, פריז, צרפת
2 INSERM U1223, פריז, צרפת
3 100é Paris Diderot, סורבון פריז סיטה, צ'רול פסטר, פריז, צרפת
4 פלטפרום ציטומטריה זרימה, ציטומטריה וסמנים ביולוגיים UtechS, המרכז למדע תרגום, מכון פסטר, פריז, צרפת
הפונקציה הכללית של המערכת החיסונית היא להגן על הגוף מפני אורגניזמים זיהומיים ופולשים אחרים. תאי דם לבנים, או לויקוציטים, הם שחקני המפתח של מערכת החיסון. לאחר זיהום, הם מופעלים וליזום תגובה חיסונית. ניתן לחלק לויקוציטים לתת-אוכלוסיות שונות (למשל, תאים מיאלואידיים, לימפוציטים, תאים דנדריטיים) בהתבסס על פרמטרים שונים שיכולים להיות ביולוגיים, פיזיים ו/או פונקציונליים (למשל, גודל, פירוט והפרשה). דרך אחת לאפיין לויקוציטים היא באמצעות חלבוני השטח שלהם, שהם בעיקר קולטנים. כל אוכלוסיית לויקוציטים מבטאת שילוב מסוים של קולטנים (למשל, ציטוטוקסיים, הפעלה, קולטני הגירה) שיכולים להגדיר תת-קבוצות בקרב אוכלוסיות. מכיוון שמערכת החיסון מקיפה מגוון רחב של אוכלוסיות תאים, חיוני לאפיין אותן כדי לפענח את השתתפותן בתגובה החיסונית.
ציטומטריית זרימה (FC או FCM) היא שיטה נפוצה לניתוח הביטוי של פני השטח של התא ומולקולות תאיות, אפיון והגדרת סוגי תאים שונים בתערובת תאים הטרוגניים. ציטומטרי זרימה מורכבים משלוש תתי-מערכות עיקריות: נוזלים, אופטיקה ואלקטרוניקה. מערכת הנוזלים מעבירה את התאים בזרם כך שהם עוברים מול לייזר בזה אחר זה. מערכת האופטיקה מורכבת ממקורות אור (לייזרים) להארת החלקיקים, מסננים אופטיים לכוון את האור המתקבל, ואותות פלואורסצנטיים לגלאים מתאימים. לבסוף, מערכת האלקטרוניקה ממירה את אותות האור שזוהו לאותות אלקטרוניים שניתן לעבד על ידי המחשב. כאשר תא בודד עובר מול קרן הלייזר, הוא מפזר אור. גלאי מול הקרן מודד פיזור קדימה (FS) ומספר גלאים לצד למדוד פיזור צד (SC). ה- FS מתואם עם גודל התא ו- SC הוא פרופורציונלי לפרטיון התאים. באופן זה, אוכלוסיות תאים לעתים קרובות ניתן להבחין בהתבסס על הבדלים בגודלם ובגרגריותם בלבד.
בנוסף לניתוח גודלו, צורתו ומורכבותו של התא, ציטומטריית הזרימה נמצאת בשימוש נרחב לזיהוי הביטוי של קולטני פני התא (1). זה מושג באמצעות נוגדנים חד שבטיים בעלי תווית פלואורוכרום אשר נקשרים לקולטנים ידועים ספציפיים לתא. עם עירור, פלואורוכרום קשור זה פולט אור של אורך גל מסוים, הנקרא אורך גל פליטה, אשר ניתן לזהות ולהבקיע. מדידות פלואורסצנטיות מספקות נתונים כמותיים ואיכותיים על קולטני פני תא המסומנים בפלואורוכרום. המטולוגים היו הראשונים להשתמש FC למעקב טיפולי של אוכלוסיות תאי החיסון (2). עכשיו, הוא משמש עבור מגוון רחב של יישומים כגון אימונופנוטיפינג, כדאיות תאים, ביטוי גנים, ספירת תאים, וניתוח GFP.
FACS (פלואורסצנטי מופעל Cell Sorter) הוא סוג מיוחד של ציטומטריית זרימה, אשר ממיין אוכלוסייה של תאים לתוך תת-אוכלוסייה באמצעות תיוג פלואורסצנטי. בדיוק כמו ציטומטריית זרימה קונבנציונלית, נתונים ראשונים FS, SC, פלואורסצנטי נאספים. לאחר מכן, המכונה מחילה מטען (שלילי או חיובי) ומערכת הסטה אלקטרוסטטית (אלקטרומגנטים) מקלה על איסוף טיפות טעונות המכילות תאים לצינורות מתאימים.
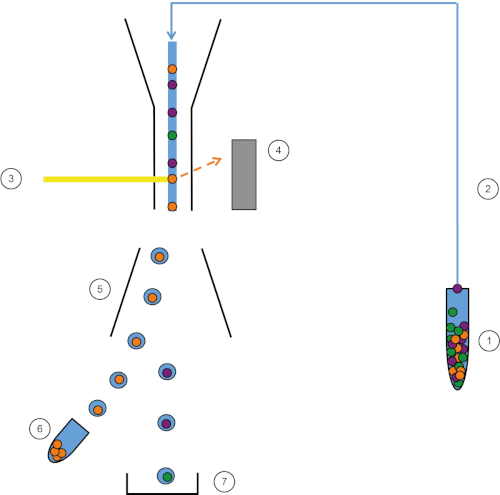
איור 1: ייצוג סכמטי של FACS. מדגם (1) שאפתן ב- FACS (2) ומועבר מול הלייזר (3). פלואורסצנטיות של תאים חשה בגלאי פלואורסצנטיות (4). לבסוף, התאים משולבים בטיפות ותאי העניין נוטים על ידי לוחות הסטה (5) ונאספים בצינור איסוף (6). התאים הנותרים נכנסים לפח (7). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
היבט המיון של ה- FACS מציג יתרונות רבים. בדיקות רבות יכולות לעזור להבין את תפקידם של תאים ספציפיים במערכת החיסון, כגון ניתוחים של ביטוי גנים כמו RT-qPCR, מחזור תאים או הפרשת ציטוקינים. עם זאת, יש לטהר תאים במעלה הזרם כדי לקבל תוצאות ברורות וספציפיות. כאן, FACS מגיע שימושי ואת התאים הרצויים ניתן למיין עם טוהר גדול, מניב תוצאות אמינות מאוד לשחזור. FACS יכול לשמש גם כדי למיין תאים המבוססים על כתמים תאיים גרעיניים או אחרים ועל פי נוכחות, היעדר, וצפיפות של קולטני פני השטח. FACS היא כעת טכניקה סטנדרטית לטיהור של תת-אוכלוסיות של תאים ויש לה את היכולת למיין עד ארבע אוכלוסיות בו זמנית.
תרגיל מעבדה זה מדגים כיצד לבודד לויקוציטים בטחול ולאחר מכן כיצד למיין באופן ספציפי תאי לימפה B מתערובת תאי לויקוציטים בטחול באמצעות FACS.
Procedure
1. הכנה
- לפני שתתחילו, לבשו כפפות מעבדה וביגוד מגן מתאים.
- לחטא את כל כלי הניתוח, תחילה עם חומר ניקוי ולאחר מכן עם 70% אתנול ולאחר מכן יבש ביסודיות.
- הכן 50 מ"ל מתמיסת המלח המאוזנת של האנק (HBSS) המכילה סרום עגל עוברי 2% (FCS).
2. ניתוח
- באמצעות מערכת אספקת פחמן דו חמצני, להרדים את העכבר על ידי היפוקסיה. אבטחו את העכבר המתת חסד על צלחת ניתוח בתנוחת העפרוניזציה ובצעו לפרוסטומיה אורך באמצעות מספריים ומלקחיים.
- באמצעות מלקחיים, להזיז את המעיים ואת הבטן בצד ימין של הבטן כדי לחשוף את הבטן ואת הטחול. הטחול מחובר לקיבה.
- באמצעות מלקחיים, לנתק בזהירות את הטחול מהבטן ומניחים אותו בצלחת פטרי המכילה 5 מ"ל של HBSS 2% FCS.
3. בידוד תאי מערכת החיסון
- מניחים את הטחול במסננת תא 40μm מעל אותה צלחת פטרי. למחוץ את הטחול עם בוכנה כדי לנתק אותו באותה מנה.
- מעבירים את הטחול המנותק ואת הנוזל לצינור צנטריפוגה 15 מ"ל.
- צנטריפוגות הצינור ב 370 x g במשך 7 דקות ב 10 מעלות צלזיוס ולהשליך את supernatant, הימנעות הכדור.
- resuspend הכדור ב 2mL של אשלגן אצטט ליזה אריתרוציטים. המתן 2 דקות ולאחר מכן האיפור את עוצמת הקול עד 15 מ"ל באמצעות HBSS 2% FCS.
- צנטריפוגות הצינור שוב ב 370 x גרם במשך 7 דקות ב 10 מעלות צלזיוס. להשליך את supernatant ו resuspend הכדור ב 5mL של HBSS 2% FCS.
- ספירת התאים באמצעות בדיקות כתמים כחולות טריפן ולהתאים את ריכוז התא הסופי ל 107 תאים / מ"ל באמצעות נפח מתאים של HBSS 2% FCS.
4. כתמי תאים
- העבר 200μL של השעיית התא לתוך שישה צינורות FACS, שכותרתו 1 עד 6.
- צנטריפוגות הצינורות ב 370 x גרם במשך 7 דקות ב 10 מעלות צלזיוס ולהשליך את supernatant הימנעות הכדור.
- לאחר מכן, להכין שישה תערובות נוגדנים חדשניים על ידי הוספת כמות מתאימה של נוגדן 200μL HBSS 2% FCS על פי טבלה 1.
- לאחר מכן, העבר תערובות נוגדנים אלה לצינורות FACS ממוספרים המתאימים.
- לדגור על התליות התא מעורבב עם הנוגדנים במשך 20 דקות על קרח בחושך.
- הוסף 1mL של HBSS 2% FCS לכל צינור ולאחר מכן צנטריפוגה שוב ב 370 x g במשך 3 דקות ב 10 °C.
- להשליך את supernatant ו resuspend הכדור ב 200μL של HBSS 2% FCS.
- העבר את הכדורים המחודשים לצינורות FACS חדשים.
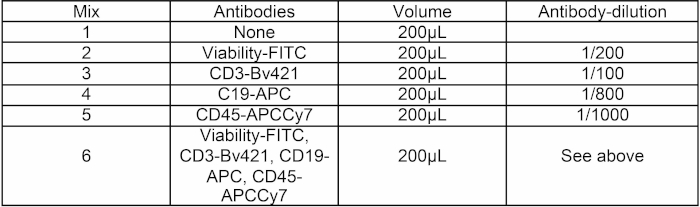
טבלה 1: קומפוזיציה לערבב נוגדנים. שישה תערובות של 200μL של נוגדן HBSS + הוכנו לניסוי. Mix 1 מיועד להגדרת PMT, ערבובים 2 עד 5 מיועדים להגדרות פיצוי, ומיקס 6 מיועד למיון תאים.
5. כיול FACS
- ראשית, הפעל את הממיין ובצע את"הפעלה Fluidics."
- הפעל את הנחל ולאחר מכן לחכות 15 דקות עבור הזרם להתייצב.
- התאם את המשרעת של הזרם כדי לקבל היווצרות טיפה מנותקת. לאחר מכן לחץ על "הנקודה המתוקה" כדי להשלים את התאמת המשרעת.
- שים את מסנן הצפיפות הניטרלית (N.D. ) - 1.0 ופתח את ממשק "CST" אשר מייצג התקנה ומעקב cytometer.
- כדי לבצע בקרת איכות יומית, תחילה לדלל את חרוזי CST עם בינוני FACS בעקבות הוראות היצרן ולאחר מכן, בצע את פקד CST.
- לאחר השלמת בקרת CST, החלף את מסנן N.D. 1.0 במסנן N.D. 2.0 בציטומטר.
- לאחר מכן, לדלל חרוזי השהיית טיפה במדיום FACS בהתאם להוראות היצרן ולאחר מכן לטעון לתוך FACS.
- כדי להבטיח ביצוע מיון נכון -
- תחילה לחץ על "מתח" ולאחר מכן על "מסנן אופטי". הרביע הימני צריך להיות שווה ל-100%. במידת הצורך, להתאים את בורג הלייזר האדום על cytometer שמאל או ימין כדי להשיג 100% ברביע הימני.
- לאחר מכן, בצע מיון בדיקה כדי להבטיח שהזרם נופל לתוך צינור האיסוף. כדי לעשות זאת, לחץ על "מגירת פסולת" ולהתחיל "מיון מבחן". תבדוק שזרמים צדדיים נופלים לצינורות איסוף. אם הם לא, להתאים מתח עד שהם עושים.
- נווט אל תבנית הניסוי. לאחר מכן, פתח את הניסוי "עיכוב שחרור אקרופרופ" ולחץ על "פריסת מיון".
- שנה את קצב הזרימה כדי להשיג 1000 עד 3000 אירועים לשניה.
- לחץ על "מתח" ולאחר מכן על "מסנן אופטי". הרביע השמאלי צריך להיות שווה ל-0 ורביע ימין ל-100.
- בחלון "פריסת מיון" לחץ על "מיון" ולאחר מכן לחץ על "ביטול". הרביע השמאלי צריך להיות שווה ל-100 ורביע ימין ל-0. אם הרביע השמאלי קטן מ- 95 לחץ על "השהיה אוטומטית" כדי להתאים אותו באופן אוטומטי.
6. ציטומטריה של זרימה ובקרת טוהר
- התחל ציטומטריית זרימה על ידי התחלה עם הצינור 1 (תאים לא מזוהמים) כדי להגדיר את מורפולוגיה התא ואת הפסגות השליליות של פלואורכרום. הגדר את הפיזור קדימה ואת הצד ולהגדיר את המתחים של כל פרמטר פלואורסצנטי. מקם את האוכלוסייה השלילית בעשור הראשון באמצעות הרשתות בכל חלקת נקודות.
- לאחר מכן, עומס צינור 2 (בקרת צבע יחיד) בציטומטר. התאם את החפיפה הספקטרלית עד חציוני האוכלוסייה השליליים והחיוביים מיושרים או משתמשים בתוכנת החישוב האוטומטית. חשוב לשמור על האות בקנה מידה. בקרות פיצוי חייבות להתאים להגדרות הפלורוכרום והגלאים הניסיוניים. להקליט 10,000 אירועים.
- חזור על שלבים אלה באמצעות צינור 3, 4 ו- 5 (פקדי צבע בודדים אחרים).
- לאחר מכן, עומס צינור 6 (תאים מוכתמים) ולהגדיר אוכלוסיות תאים של עניין באמצעות אסטרטגיית gating ספציפית.
- בחלון פריסת מיון, בחר את אוכלוסיית התאים בעלי עניין. בחר את סף התא ב "אירועי יעד" ואת רמת הדיוק ב "דיוק". כאן רק אוכלוסייה אחת ממוינת, עם זאת, ניתן למיין ארבע אוכלוסיות שונות בו זמנית.
- לאחר שתוכן לחץ על "מיין" ועל "אישור", ולאחר מכן המתן למיון תאים.
- לאחר השלמת מיון התאים, בצע בקרת טוהר על ידי צנרת ראשונה של 10μL של תאים ממוינים לתוך צינור FACS חדש עם 90 microliters של HBSS 2% FCS.
- לאחר מכן, לטעון את הצינור cytometer. להקליט ולנתח את הפנוטיפים של התאים כדי לוודא כי אסטרטגיית gating עבד כמתוכנן.
7. ניתוח נתונים
- פתח את תוכנת 'FlowJo' וגרור את הקבצים עבור כל צינור בחלון "כל הדוגמה".
- לחץ פעמיים על קובץ כדי לפתוח אותו בחלון חדש.
- לחץ על "מצולע" ושחזור אסטרטגיית הגטינג ששימשה בעבר.
- חזור על השלבים עם כל הקבצים האחרים.
- כדי להמחיש את התוויות הנקודות, לחץ על "עורך הפריסה" וגרור את האוכלוסיות העניין מצינור 6 ובקרת טוהר בכרטיסיה עורך הפריסה. התאים אמורים להופיע רק באוכלוסיית העניין בבקרת טוהר (ראו איור 2).
- כדי לבדוק את הטוהר של לימפוציטים B בתאים ממוינים, לחץ על "עורך השולחן". גרור אוכלוסיית לימפוציטים B מצינור 6 ובקרת טוהר בטבלה.
- בתפריט "סטטיסטיקה" בחר את התדירות של CD45+ תאים כדי לבדוק את הטוהר של אוכלוסיית תאים זו ולאחר מכן לחץ על "צור טבלה".
- ערכי פרמטר מופיעים בטבלה חדשה. בחלון בקרת טוהר, בדוק את התדירות של לימפוציטים B בתוך CD45+ תאים, אשר צריך להיות גבוה מ 98% (ראה איור 2, הלוח התחתון).
Results
בפרוטוקול זה, טיהרנו לימפוציטים מסוג B באמצעות טכנולוגיית FACS. תחילה בודדנו לויקוציטים מהטחול והכתמנו אותם. באמצעות שילוב של סמני משטח של תאי B, יצרנו אסטרטגיית גיטינג כדי למיין אותם (איור 2, החלונית העליונה). בסוף הניסוי אימתנו אם תאים בצינור האיסוף היו תאי B באמצעות "בדיקת טוהר". שמרנו על אותה אסטרטגיית גטינג והבחנו שיותר מ-98% מהתאים אכן היו תאי B (איור 2, לוח תחתון). לכן, FACS הוא פרוטוקול יעיל כדי לבודד אוכלוסיות תאי החיסון עם רמה גבוהה של טוהר. לאחר מכן ניתן להשתמש בתאים שנאספו לניסויים במורד הזרם כגון תרבית תאים, RT-qPCR ובוחות ציטוקסיה.
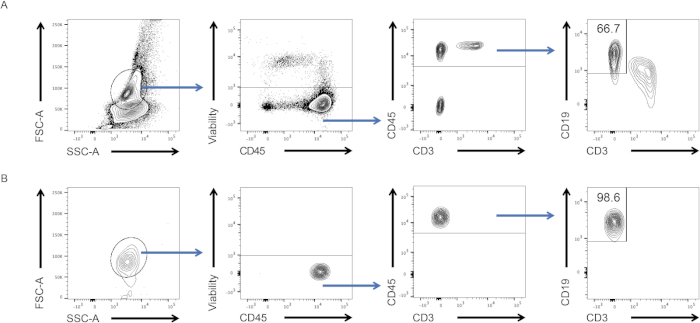
איור 2: אסטרטגיית גיטינג ובדיקת טוהר לאחר מיון. (A) תאים היו מגודרים תחילה בהתבסס על המורפולוגיה שלהם (משמאל: FSC-A, SSC-A), ואז רק חיים (שמאל אמצעי: כדאיות, CD45), CD45+ תאים (CD45, CD3) היו מותווים נגד CD19 ו- CD3. רק CD19+ תאים מוינו. (ב) תוצאות בדיקת טוהר של שבריר תאים שהושגו לאחר מיון תאים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Application and Summary
ציטומטריית זרימה היא טכניקה ממקור ראשון לאפיון ומיון אוכלוסיות תאי החיסון עם רמה גבוהה של טוהר. זהו כלי קדמוני בתחום המחקר שכן הוא מאפשר העשרה של אוכלוסיות תאים ספציפיות ולפענח את התגובה החיסונית לפתוגנים. עם הגידול במספר פלואורוכרום זמין וציטומטרים, מספר הפרמטרים הניתנים לזיהוי גדל מאוד. כתוצאה מכך, ניתוח ביואינפורמטי של נתוני FACS החל לצוץ ופתח אופקים חדשים לציטומטריה זורמת (3). ציטומטריית זרימה מציעה יישומים אחרים בהמטולוגיה ואונקולוגיה (4) שם היא משמשת לפיתוח כלי אבחון.
Tags
Skip to...
Videos from this collection:

Now Playing
ציטומטריית זרימה ומיון תאים המופעלים על-ידי פלואורסצנטיות (FACS): בידוד של לימפוציטים מסוג Splenic B
Immunology
93.2K Views

מיון תאים המופעל מגנטי (MACS): בידוד של לימפוציטים T תימיים
Immunology
23.0K Views

אליסה אסייס: עקיפה, כריך ותחרותי
Immunology
239.2K Views

אליספוט אסאי: זיהוי של IFN-γ הפרשת טחול
Immunology
28.8K Views

אימונוהיסטוכימיה ואימונוציטוכימיה: הדמיית רקמות באמצעות מיקרוסקופיה קלה
Immunology
79.1K Views

יצירת נוגדנים: ייצור נוגדנים חד שבטיים באמצעות היברידיות
Immunology
43.6K Views

מיקרוסקופיה חיסונית: כתמי אימונופלואורסצנטיות של מקטעי רקמות משובצים בפרפין
Immunology
53.9K Views

מיקרוסקופיית פלואורסצנטיות קונפוקלית: טכניקה לקביעת לוקליזציה של חלבונים בפיברובלסטים של עכברים
Immunology
43.4K Views

טכניקות מבוססות אימונופרציפיטציה: טיהור חלבונים אנדוגניים באמצעות חרוזי אגרוז
Immunology
87.8K Views

ניתוח מחזור התא: הערכת התפשטות תאי CD4 ו- CD8 T לאחר גירוי באמצעות כתמי CFSE וציטומטריית זרימה
Immunology
24.3K Views

העברת תאים מאמצת: הצגת טחול עכבר תורם לעכבר מארח והערכה של הצלחה באמצעות FACS
Immunology
22.5K Views

ת לבדיקת מוות בתא: כרום שחרר את ההסתה של היכולת הציטוטוקסית
Immunology
151.5K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved