העברת תאים מאמצת: הצגת טחול עכבר תורם לעכבר מארח והערכה של הצלחה באמצעות FACS
Overview
מקור: מונירסילבן 1,2,3, פרצ'טתיבו 1,2,3, סופינובולט 4, רחל גולוב1,2,3
יחידה אחת ללימפופוליס, המחלקה לאימונולוגיה, מכון פסטר, פריז, צרפת
2 INSERM U1223, פריז, צרפת
3 100é Paris Diderot, סורבון פריז סיטה, צ'רול פסטר, פריז, צרפת
4 פלטפרום ציטומטריה זרימה, ציטומטריה וסמנים ביולוגיים UtechS, המרכז למדע תרגום, מכון פסטר, פריז, צרפת
העברת תאים מאמצת היא שיטה להכנסת תאים לחולה או לאורגניזם מחקרי על מנת לטפל במחלה או ללמוד תהליך ביולוגי, כגון המטופיס. מטרות ההעברה המאמצת שונות; זה יכול לשמש בביולוגיה בסיסית, כמו גם במדעי הרפואה (1, 2). במודלים של עכבר, העברה והפצה של תאים שהועברו ניתן ללמוד ואחריו מערכת מעקב (סמן משטח תא, כתמים על ידי CFSE, וכו '). במחקרי סרטן על מודלים עכבר, העברה של אוכלוסיות תאים ספציפיות יכולה לשמש כטיפול ניסיוני נגד גידולים. דוגמה נוספת לטכניקה זו היא יצירת עכברים כימריים על ידי העברת תאי מח עצם לעכברים או עכברים מוקרן עם פנוטיפ חיסוני חמור. מודל עכבר זה יכול לשמש כדי להעריך את ההשפעה של מחיקת גנים על אוכלוסיית תאים ספציפית למשל. העברת תאי השאלת עצם משמשת גם בטיפול רפואי אנושי. כאשר חולים מוקרנים במקרה של טיפול בסרטן, העברה מאמצת של מח עצם מאפשרת שחזור מערכת החיסון.
הצעד הראשון בטכניקה זו הוא להשיג את אוכלוסיית התאים של עניין. הטכניקה שנבחרה לבודד אוכלוסייה זו תלויה ברמת הספציפיות של האוכלוסייה הממוקדת. רמת הבחירה הגדולה ביותר היא האיבר כולו, שבו נלקחות כל אוכלוסיות התאים הקיימות באיבר. שיטה מדויקת יותר היא בחירה של אוכלוסיית תאי יעד, שנבחרה לעתים קרובות על-ידי סמן משטח תא אחד. השיטה האידיאלית למיין תאים במקרה זה היא על ידי מיון מגנטי. לבסוף, הרמה המחמירה ביותר היא בחירת התאים על ידי מספר סמני פני השטח של התא כדי למיין אוכלוסיות תאים ספציפיות מאוד. מיון ציטומטריית זרימה היא השיטה הפופולרית ביותר עבור רמה זו של בחירה. לאחר קבלת אוכלוסיית העניין, ניתן להעביר אותה למארח. לפני העברה מאמצת זה חיוני כדי להבטיח תאימות בין המארח לתורם. ואכן, ללא קשר למטרת ההעברה, התאימות חיונית כדי להבטיח אימוץ תאים על ידי המארח ללא דחיית תאים.
בתרגיל מעבדה זה, אנו מדגימים את טכניקת העברת התאים המאמצת על ידי העברת טחול מעכבר CD45.2 לעכבר CD45.1 Ragγc (חסר לימפוציטים) וארבעה ימים לאחר מכן מאשרים את העברת הטחול באמצעות ציטומטריית זרימה (ראה איור 1).
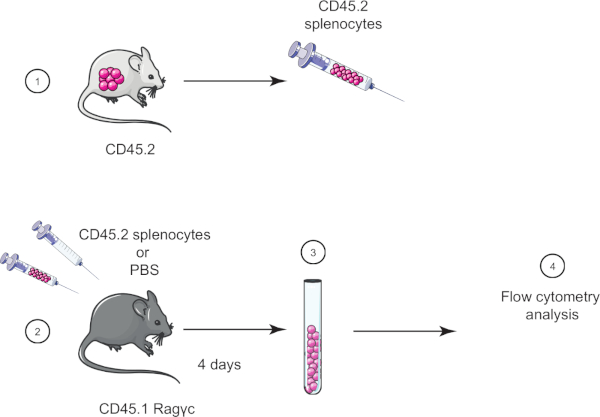
איור 1: ייצוג סכמטי של העברה מאמצת. (1) ספלוציטים מבודדים מעכברי CD45.2 ו- (2) מועברים בעכבר CD45.1 Ragγc, עכבר בקרה מוזרק ל- PBS בלבד. (3) 4 ימים לאחר העברה מאמצת, טחול הם התאוששו מעכברים ו (4) מנותח על ידי cytometry זרימה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Procedure
1. הכנה
- לפני שתתחילו, לבשו כפפות מעבדה וביגוד מגן מתאים.
- לחטא את כל כלי הניתוח, תחילה עם חומר ניקוי ולאחר מכן עם 70% אתנול ולאחר מכן יבש ביסודיות.
- הכן 50 מ"ל מתמיסת המלח המאוזנת של האנק (HBSS) המכילה סרום עגל עוברי 2% (FCS).
2. ניתוח
- באמצעות מערכת אספקת פחמן דו חמצני, להרדים את העכבר על ידי היפוקסיה. אבטחו את העכבר המתת חסד על צלחת ניתוח בתנוחת העפרוניזציה ובצעו לפרוסטומיה אורך באמצעות מספריים ומלקחיים.
- באמצעות מלקחיים להזיז את המעיים ואת הבטן בצד ימין של הבטן כדי לחשוף את הבטן ואת הטחול. הטחול מחובר לקיבה.
- באמצעות מלקחיים בזהירות לנתק את הטחול מן הבטן ומניחים אותו על צלחת פטרי המכיל 5 מ"ל של HBSS 2% FCS.
3. בידוד תאי מערכת החיסון
- מניחים את הטחול על מסננת תא 40 מיקרומטר מעל צלחת פטרי. למחוץ את הטחול עם בוכנה כדי לנתק אותו.
- לשחזר את התאים דבק על ידי שטיפה הבוכנה ואת מסננת עם 1 מ"ל של HBSS 2% FCS.
- מעבירים את הטחול והמנותק לצינור צנטריפוגה של 15 מ"ל.
- לשטוף את צלחת פטרי עם 5 מיליליטר של HBSS 2% FCS ולהעביר את הנוזל לצינור 15 מ"ל.
- צנטריפוגות הצינור ב 370 x g במשך 7 דקות ב 10 מעלות צלזיוס ולהשליך את supernatant הימנעות הכדור.
- resuspend הכדור ב 2 מ"ל של אשלגן אמוניום כלוריד צינור מעלה ומטה כדי resuspend הכדור ולזר את אריתרוציטים.
- המתן 2 דקות והוסף HBSS 2% FCS לכדור resuspended כדי להשיג את הנפח עד 14 מ"ל.
- צנטריפוגות הצינור שוב ב 370 x גרם במשך 7 דקות ב 10 מעלות צלזיוס. להשליך את supernatant ו resuspend הכדור ב 5 מ"ל של HBSS 2% FCS על ידי צנרת למעלה ולמטה.
- ספירת התאים באמצעות בדיקות כתמים כחולות טריפן והתאמת ריכוז התא הסופי ל- 107 תאים/מ"ל באמצעות נפח מתאים של HBSS 2% FCS.
4. העברה מאמצת
- העברה 2 מ"ל של השעיית תא המתקבלת בצינור איסוף 5 מ"ל.
- צנטריפוגות הצינור ב 370 x g במשך 7 דקות ב 10 מעלות צלזיוס ולאחר מכן להשליך את supernatant.
- resuspend הכדור ב 2 מ"ל של PBS וצנטריפוגה הצינור ב 370 x גרם במשך 7 דקות ב 10 מעלות צלזיוס.
- להשליך כדורי supernatant ו resuspend ב 200 μL של PBS.
- באמצעות מזרק 0.5 מ"ל עם מחט 29G להזריק 200 μL של השעיית תא לתוך העכבר הניסיוני תוך ורידי לתוך סינוס הדם רטרו-מסלולית.
- כמו שליטה, להזריק עכבר שני באותו סינוס דם עם 200 μL של תמיסת מלח חוצץ פוספט.
5. תאים קציר וכתמים
- ארבעה ימים לאחר ההעברה המאמצת, להרדים עכברים ולהסיר את הטחול.
- קוצר את הטחול כמתואר בסעיף 3.
- העבר 100 μL של השעיות תא מכל עכבר לשני צינורות FACS, שכותרתו "שליטה" ו "הועבר".
- צנטריפוגות הצינור ב 370 x g במשך 7 דקות ב 10 מעלות צלזיוס ולאחר מכן להשליך את supernatants.
- הכן תערובת המכילה את ארבעת הנוגדנים בדילול המפורט בטבלה 1.
| נוגדנים | פלואורוכרום | דילול |
| CD45.1 | BV711 | 1/200 |
| CD45.2 | נגמ"ש7 | 1/400 |
| CD4 | BV786 | 1/1600 |
| CD3 | BV421 | 1/200 |
טבלה 1: קומפוזיציה לערבב נוגדנים. ארבעה קוקטיילים נוגדנים הכנה באמצעות מצומדים נוגדנים-פלואורסצנטיים מרוכזים ו- HBSS.
- מוסיפים 100 μL של התערובת לכל צינור, ולאחר מכן לדגור במשך 20 דקות על קרח בחושך.
- הוסף 1 מ"ל של HBSS 2%FCS ולאחר מכן צנטריפוגות הצינורות ב 370 x גרם במשך 3 דקות ב 10 °C.
- להשליך את supernatants ו resuspend הכדורים ב 200 μL של HBSS 2% FCS.
- העבר את התאים המותפנים מחדש לצינורות FACS חדשים ומסומנים בתווית.
- באמצעות ציטומטריית זרימה, כפי שמוצג בפרוטוקול FACS, להעריך את נוכחותם של לימפוציטים חיוביים CD45.2.
6. ניתוח נתונים
- פתח את תוכנת "FlowJo" וגרור את הקבצים עבור כל צינור בחלון "כל הדוגמה".
- לחץ פעמיים על הקובץ "הועבר" כדי להציג את התאים שנרשמו מאותה דגימה על חלקת נקודות המציגה פיזור קדימה "SSC-A" על ציר Y ופיזור צדדי "FSC-A" על ציר X.
- לחץ על "מצולע" וצור אסטרטגיית הגינג לבחירת לימפוציטים, לאחר מכן הבחין בין תאים תורמים ומארחים באמצעות סמני פני השטח של התא (CD45.1, CD45.2) ולאחר מכן מאפיין את CD45.2+ אוכלוסיית התאים (CD3, CD4).
- חזור על שלבי הניתוח עם קובץ "עכבר הבקרה".
- כדי להציג באופן חזותי אוכלוסיית תאים, לחץ על "עורך הפריסה".
- גרור את "התאים שהועברו" ואת " האוכלוסייה "תאים שהועברו CD4" מ "הועבר" ו "פקד" קבצים אל " הכרטיסיהעורך פריסה".
- תיימת נקודות המייצגת CD45.2+ תאים ולימפוציטים CD4 תופיע.
- תאים שהועברו על - CD45.2 אמורים להופיע רק ב" עכברהמועבר" בתכנון הנקודות .
Results
לעכברי ראג'ק יש הרכב שונה של מערכת החיסון, בעיקר חסר לימפוציטים. העברה מאמצת של טחול מאפשרת הכנסת אוכלוסייה חסרה כגון תאי T ו- B. הכתמים שלנו כללו סמני משטח תא CD45.1 ו- CD45.2 כדי להבחין בין תאים מארחים ותורם בהתאמה (איור 2A). הוא כלל גם סמן אחר של פני התא כדי להדגיש אוכלוסיות תאים הנעדרות מעכברי ראג'ק, כגון תאי CD4 T(איור 2B). כצפוי, לעכבר הבקרה לא היו תאים חיוביים ל- CD45.2(איור 2B,חלוניות עליונות) והעכבר המועבר עשה זאת (איור 2B, חלוניות תחתונות, 71.2% מכלל התאים). אנו יכולים גם לזהות באופן ספציפי תאי CD4 T בתוך תאים שהועברו (22.1% מתאי CD45.2).
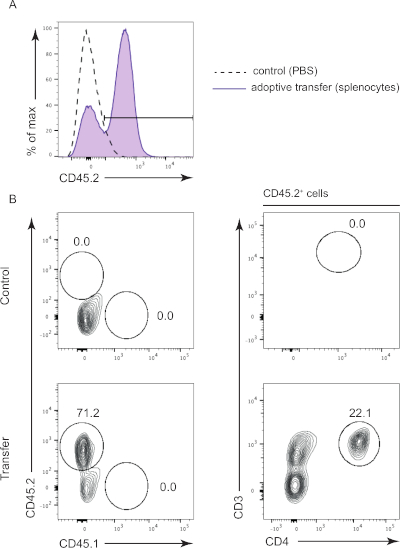
איור 2: תוצאות מייצגות של העברה מאמצת. (א) היסטוגרמה של תאי CD45.2 מעכברים שהוזרקו עם PBS (קבוצת ביקורת) (מקווקו) ועכברים מוזרקים עם טחול CD45.2 (קבוצת בדיקה) (קו מוצק). (B) אסטרטגיית גיטינג של CD45.2 תאים חיוביים בעכברים בקרה מוזרק עם PBS (לוחות עליונים) ועכברים מוזרק CD45.2 טחול (לוחות תחתון). תאים תורמים ומארחים נבדלים באמצעות סמני פני השטח של התא (CD45.1, CD45.2), ואז מאופיינים אוכלוסיית תאים חיוביים CD45.2 (CD3, CD4). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Application and Summary
העברה מאמצת היא טכניקה תרגומית בתחומי מדע שונים, עם יישומים ברפואה. טכניקה זו יכולה לשמש כדי ללמוד נדידת תאים וטרופיזם או שכיחות של מחסור בחלבון באוכלוסיות תאים ספציפיות. במקרה האחרון, ניתן להשתמש בטכנולוגיות שונות, במיוחד עכברי GMO שבהם אוכלוסיות תאים ספציפיות חסרות באופן מהותי. עם זאת, בנייה גנטית כדי להשיג עכברים מהונדסים גנטית יכולה להיות תהליך מורכב וארוך מאוד. במקרה זה, העברה מאמצת של אוכלוסיית תאים לקויה קלה ומהירה יותר.
העברות אימוץ יש יישומים ישירים ברפואה. לדוגמה, שתלי מח עצם בחולים מוקרנים במהלך טיפול בסרטן משמשים לשחזור המערכת החיסונית. לאחרונה נעשה שימוש ביישומים אחרים של העברה מאמצת בתחום הרפואי. תאי T מלאכותיים (הנקראים תא T CAR) נועדו לזהות ולחסל כמה סוגי סרטן. בנוסף, תאים מהונדסים אלה בנויים כדי לדכא את סיכון הדחייה על ידי המארח. העברת תאי CAR T נבדקת כעת בניסויים קליניים.
References
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).
Tags
Skip to...
Videos from this collection:

Now Playing
העברת תאים מאמצת: הצגת טחול עכבר תורם לעכבר מארח והערכה של הצלחה באמצעות FACS
Immunology
22.5K Views

ציטומטריית זרימה ומיון תאים המופעלים על-ידי פלואורסצנטיות (FACS): בידוד של לימפוציטים מסוג Splenic B
Immunology
93.1K Views

מיון תאים המופעל מגנטי (MACS): בידוד של לימפוציטים T תימיים
Immunology
22.9K Views

אליסה אסייס: עקיפה, כריך ותחרותי
Immunology
238.9K Views

אליספוט אסאי: זיהוי של IFN-γ הפרשת טחול
Immunology
28.5K Views

אימונוהיסטוכימיה ואימונוציטוכימיה: הדמיית רקמות באמצעות מיקרוסקופיה קלה
Immunology
79.1K Views

יצירת נוגדנים: ייצור נוגדנים חד שבטיים באמצעות היברידיות
Immunology
43.6K Views

מיקרוסקופיה חיסונית: כתמי אימונופלואורסצנטיות של מקטעי רקמות משובצים בפרפין
Immunology
53.9K Views

מיקרוסקופיית פלואורסצנטיות קונפוקלית: טכניקה לקביעת לוקליזציה של חלבונים בפיברובלסטים של עכברים
Immunology
43.3K Views

טכניקות מבוססות אימונופרציפיטציה: טיהור חלבונים אנדוגניים באמצעות חרוזי אגרוז
Immunology
87.8K Views

ניתוח מחזור התא: הערכת התפשטות תאי CD4 ו- CD8 T לאחר גירוי באמצעות כתמי CFSE וציטומטריית זרימה
Immunology
24.3K Views

ת לבדיקת מוות בתא: כרום שחרר את ההסתה של היכולת הציטוטוקסית
Immunology
151.4K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved