אימונוהיסטוכימיה ואימונוציטוכימיה: הדמיית רקמות באמצעות מיקרוסקופיה קלה
Overview
מקור: מייקל ס. לי1 וטניה ג'יי ווב1
1 המחלקה למיקרוביולוגיה ואימונולוגיה, בית הספר לרפואה של אוניברסיטת מרילנד ומרכז הסרטן המקיף מרלן וסטיוארט גרינבאום, בולטימור, מרילנד 21201
אימונוהיסטוכימיה (IHC) ואימונוציטוכימיה (ICC) הן טכניקות המשמשות להדמיית הביטוי והלוקליזציה של אנטיגנים ספציפיים המשתמשים בנוגדנים. השימוש הראשון שפורסם ב- IHC היה בשנת 1941 כאשר אלברט קונס השתמש בטכניקה כדי לדמיין את נוכחותו של אנטיגן פנאומוקוק בחלקי רקמות מעכברים נגועים בפנאומוקוק (1). השם, אימונוהיסטוכימיה, נגזר מהשורשים "אימונו-", בהתייחס לנוגדנים, ו"היסטו-", בהתייחס למקטעי הרקמה המשמשים ב- IHC. השורש "ציטו-" בחיסון מדגיש את ההבדל העיקרי בין ICC ו- IHC. בעוד IHC משתמש בחלקים של רקמה שלמה, ICC משתמש בתאים כי כבר מבודדים רקמה או גדלו בתרבית. ההבדל בדגימות המשמשות פירושו הכנת מדגם מבחינה טכנית שונה בין IHC לבית הדין הפלילי הבינלאומי, אבל אחרת הפרוטוקולים עבור ICC ו- IHC זהים ואחד ימצא את המונחים משמשים לעתים קרובות לסירוגין.
הן ב- IHC והן ב- ICC, נוגדנים עם תגים כימיים או פלואורסצנטיים, כגון פרוקסידאז או רודמין, בהתאמה, משמשים להדמיה של כל אנטיגן של עניין באמצעות כריכה ספציפית של הנוגדן המתויג לאנטיגן. במקרה של IHC, פרוסות דקות של רקמה משותקות בשקופית כדי לשמור על מבנה הרקמה לפני שהוכתמה, ומאפשרת הדמיה של אנטיגנים בהקשר של רקמות שלמות (איור 1). במקרה של ICC, תאים מופצים באופן שווה על שקופית לפני שהם מוכתמים, ומאפשר הדמיה של הפצת אנטיגן בתוך תאים בודדים, אבל לא בתוך המבנה של כל רקמה ספציפית. בשל הדמיון בין שני הפרוטוקולים, פרוטוקול זה יתמקד ב- IHC כדי לטפל במורכבויות הנוספות של הכנת מדגם המעורבות ב- IHC.
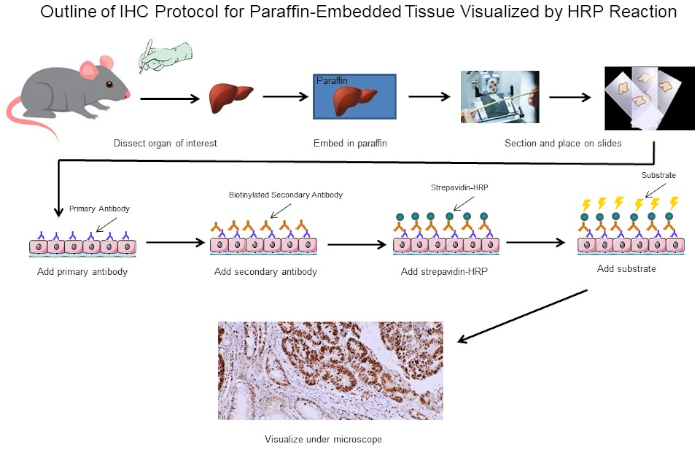
איור 1: חלוקה לרמות של פרוטוקול IHC. קו מיתאר חזותי של פרוטוקול IHC עבור רקמה מוטבעת פרפין ניתח מעכבר. פרוטוקול זה משתמש בנוגדן משני ביוטיניל וסטרפדין-HRP כדי לדמיין את המיקום של כריכת נוגדנים. אפשרויות אחרות, כגון נוגדנים מתויגים פלואורסצנטית, אפשריות גם כן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ההחלטה העיקרית הראשונה בעת ביצוע IHC היא כיצד להכין את קטעי הרקמה על מנת לשמור על מבנה הרקמה לאורך כל תהליך הכתמים. שתי האפשרויות העיקריות הן קטעים קבועים פורמלין של רקמה מוטבעת פרפין או חלקים טריים של רקמה קפואה. אין תשובה פשוטה באיזו שיטה להשתמש כפי שהוא תלוי מה ניתוח במורד הזרם יבוצע. קיבוע פורמלין של רקמות מוטבעות פרפין נחשב בדרך כלל כדי לשמר טוב יותר את מורפולוגיה של רקמות להדמיה אופטימלית בעוד הקפאת רקמה טרייה יכולה לשמר את תפקוד החלבון לבדיקות הבאות מחוץ ל- IHC. בנוסף, סעיפי רקמות קפואות טריות הוכחו כמתאימים יותר לניתוח ביטוי גנים (2). שיקול שלישי הוא האם הנוגדנים לאנטיגן שלך מתאימים לחלקי רקמות קבועים או קפואים, שכן נוגדנים מסוימים עברו אופטימיזציה רק לסוג מסוים של מקטע וייתכן שאינם מתאימים לאחרים. לבסוף, אחד גם צריך לקבוע כמה זמן הם צריכים לאחסן את קטעי הרקמות, כמו דגימות קפוא טרי חייב להישמר ב -80 מעלות צלזיוס ולא יכול להימשך מעבר לשנה אחת בעוד חלקים קבועים ניתן לאחסן הרבה יותר זמן בטמפרטורת החדר. אלה הם כמה מהשיקולים העיקריים לקביעת אם להשתמש בקטעים קבועים פורמלין של רקמה מוטבעת פרפין או חלקים טריים של רקמה קפואה. בסופו של דבר, אם לאחד יש מספיק רקמה, אולי עדיף רק שיהיו לך כמה משניהם.
בניסוי זה, יצאנו לקבוע אם ביטוי ציקלין D1 הוגדל בטחול מוגדל ממודל עכבר ספונטני של התפתחות לימפומה. דגימות רקמת הטחול בודדו תחילה מעכברים מסוג בר, עכברים מהונדסים שאין להם לימפומה, או עכברים מהונדסים שפיתחו לימפומה באופן ספונטני. דגימות רקמת הטחול תוקנו בפרפורמלדהיד, מוטבעות בפרפין, בחתך, מוכתמות באמצעות נוגדן ראשוני נגד ציקלין D1 של עכבר ואחריו נוגדן משני נגד עכברים, ופותחו באמצעות 3,3-דיאמינובנזידין (DAB). לאחר מכן, המקטעים הוטענו בפתרון האריס המטוקסילין ואז המקטעים צולמו בהגדלה של פי 20.
ריאגנטים
מקטעים מוטבעים בפרפין
- 4% Paraformaldehyde (PFA)
- אתנול (דנטורה נטולת מים, ציון היסתולוגי 100%, 95%, 80%, 75%, ו -50%). ניתן לדלל מ-100% מלאי באמצעות מים מזוקקים כפולים (ddH2O)
- קסילן
- שקופית זכוכית תואמת IHC כדי להבטיח שסעיף הרקמות יישאר מחובר לאורך כל ההליך. שקופיות זכוכית תואמות IHC כוללות ציפוי מיוחד והן זמינות בקלות מקמעונאים מרובים. אם אתה מבצע ICC, השתמש בשקופית עם תאים. שקופיות צמודות מאפשרות לזרע תאים בתאים ולהניח אותם באינקובטור עד שהתאים מתחברים לשקופית ומגיעים להשפעה נאותה, ובשלב זה ניתן להסיר את התאים ולהכתים יכולים להמשיך באותו אופן כמו IHC.
- פרפין
- 0.3% מי חמצן (H2O2)/מתנול: כדי להכין, להוסיף 1 מ"ל 30% H2O2 עד 99 mL מתנול. יש לאחסן ב-20°C
- מאגר אחזור אנטיגן: IHC ציטוט מאגר pH 6.0
חלקים קפואים טריים
- טמפרטורת חיתוך אופטימלית (OCT) הטמעה תרכובת
- קיבוע אופטימלי: 4% PFA או אצטון כי כבר מקורר כדי -20°C
כתמים
- מאגר חסימה: יש לקבוע על-ידי המשתמש. דוגמה אחת היא סרום סוס מדולל ב- PBS 1X
- נוגדן ראשי מדולל: ראה מפרטי היצרן
- נוגדן משני דילול ביוטיניל: ראה מפרט היצרן
- פרוקסידאז אבידין-חזרת מדולל (HRP): רק להדמיה של פרוקסידאז. ראה מפרטי היצרן.
- DAB או מצע תואם אחר
- tain נגדי (אופציונלי)
- אתנול (דנטורוס נטול מים, ציון היסתולוגי 100% ו-95%)
- קסילן
- הר אורגנו/לימונן
Procedure
1. הכנת תאים לאימונוציטוכימיה
- תאי זרעים מעניינים על מגלשות תאים או כיסויים מקוביים על ידי הוספת 0.5 מ"ל של השעיית תאים לבארות של צלחת תרבות 24 היטב.
הערה: תאים מסוימים עשויים לדרוש צמיחה על כיסויים מטופלים, כגון כיסויים שטופלו פולי-ליזין. תנאי טיפול אופטימליים צריכים להיקבע על ידי המשתמש בהתאם לסוג התא המשמש. - מניחים את הצלחת לתוך אינקובטור CO2 לח ולאפשר לתאים לגדול ב 37 מעלות צלזיוס עד 50-70% confluent.
- ברגע התאים להגיע למפגש אופטימלי
Results
ל-IHC ול-ICC יש מגוון עצום של יישומים. לדוגמה, שימוש אחד ב- IHC הוא לבחון את הביטוי של אונקוג'נים במודלים ספונטניים של התפתחות הגידול. באיור 2, יצאנו לקבוע אם ביטוי ציקלין D1 הוגדל בטחול מוגדל במודל עכבר ספונטני של התפתחות לימפומה. דגימות רקמת הטחול תוקנו בפרפורמל...
Application and Summary
אימונוהיסטוכימיה (IHC) ואימונוציטוכימיה (ICC) הן טכניקות המשמשות להדמיית הביטוי והלוקליזציה של אנטיגנים ספציפיים המשתמשים בנוגדנים. רקמות נחתכות תחילה לחלקים דקים השומרים על מורפולוגיה של הרקמה ומונחות על שקופית. לאחר מכן מוסיפים את הנוגדנים ויקשרו את האנטיגן של העניין ומצוידים בתג ספציפי...
References
- Coons, A. H. Creech, H. J., Jones, N. and Berliner, E. The Demonstration of Pneumococcal Antigen in Tissues by the Use of Fluorescent Antibody, The Journal of Immunology, 45 (3), 159-170 (1942).
- Ripoli, F. L., Mohr, A., Hammer, S. C., Willenbrock, S., Hewicker-Trautwein, M., Hennecke, S., Escobar, H. M. and Nolte, I. A comparison of fresh frozen vs. Formalin-fixed, paraffin-embedded specimens of canine mammary tumors via branched-DNA assay. International Journal of Molecular Sciences, 17 (5) (2016).
Tags
Skip to...
Videos from this collection:

Now Playing
אימונוהיסטוכימיה ואימונוציטוכימיה: הדמיית רקמות באמצעות מיקרוסקופיה קלה
Immunology
79.1K Views

ציטומטריית זרימה ומיון תאים המופעלים על-ידי פלואורסצנטיות (FACS): בידוד של לימפוציטים מסוג Splenic B
Immunology
93.2K Views

מיון תאים המופעל מגנטי (MACS): בידוד של לימפוציטים T תימיים
Immunology
23.0K Views

אליסה אסייס: עקיפה, כריך ותחרותי
Immunology
238.9K Views

אליספוט אסאי: זיהוי של IFN-γ הפרשת טחול
Immunology
28.6K Views

יצירת נוגדנים: ייצור נוגדנים חד שבטיים באמצעות היברידיות
Immunology
43.6K Views

מיקרוסקופיה חיסונית: כתמי אימונופלואורסצנטיות של מקטעי רקמות משובצים בפרפין
Immunology
53.9K Views

מיקרוסקופיית פלואורסצנטיות קונפוקלית: טכניקה לקביעת לוקליזציה של חלבונים בפיברובלסטים של עכברים
Immunology
43.3K Views

טכניקות מבוססות אימונופרציפיטציה: טיהור חלבונים אנדוגניים באמצעות חרוזי אגרוז
Immunology
87.8K Views

ניתוח מחזור התא: הערכת התפשטות תאי CD4 ו- CD8 T לאחר גירוי באמצעות כתמי CFSE וציטומטריית זרימה
Immunology
24.3K Views

העברת תאים מאמצת: הצגת טחול עכבר תורם לעכבר מארח והערכה של הצלחה באמצעות FACS
Immunology
22.5K Views

ת לבדיקת מוות בתא: כרום שחרר את ההסתה של היכולת הציטוטוקסית
Immunology
151.4K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved