Method Article
Il modello Monoiodoacetate di osteoartrite Pain in the mouse
In questo articolo
Riepilogo
L'osteoartrite (OA), o malattia degenerativa delle articolazioni, è una condizione debilitante associata a dolore che rimane solo parzialmente controllato da analgesici disponibili. I modelli animali sono state sviluppate per migliorare la nostra comprensione dei meccanismi del dolore OA-related. Qui si descrive la metodologia per il modello monoiodoacetate di dolore OA nel topo.
Abstract
Un importante sintomo di pazienti con osteoartrosi (OA) è il dolore che viene attivato da cambiamenti periferici così come centrali all'interno delle vie del dolore. Gli attuali trattamenti per il dolore OA, come FANS o oppiacei non sono né sufficientemente efficace né privo di effetti collaterali dannosi. Modelli animali di OA sono stati sviluppati per migliorare la nostra comprensione dei meccanismi del dolore OA connessi e definire nuovi bersagli farmacologici per la terapia. Attualmente i modelli disponibili di OA nei roditori sono gli interventi chirurgici e chimiche in un ginocchio. Il modello monoiodoacetate (MIA) è diventato uno standard per la modellazione di interruzione comune nel OA in entrambi i ratti e topi. Il modello, che è più facile da eseguire nel ratto, prevede l'iniezione di MIA in un ginocchio che induce risposte rapide dolore come dell'arto omolaterale, il cui livello può essere controllato mediante iniezione di diverse dosi. iniezione intra-articolare di MIA sconvolge condrociti glicolisi inibendo glyceraldeide deidrogenasi-3-fosfatasi e provoca la morte condrociti, neovascolarizzazione, necrosi ossea subcondrale e collasso, così come l'infiammazione. I cambiamenti morfologici della cartilagine articolare e dell'osso interruzione sono riflettenti di alcuni aspetti della patologia del paziente. Insieme a danno articolare, MIA induce iniezione di cui sensibilità meccanica nei omolaterale zampa posteriore e peso deficit portanti che sono misurabili e quantificabili. Questi cambiamenti comportamentali assomigliano alcuni dei sintomi riferiti dal popolazione di pazienti, convalidando così l'iniezione MIA nel ginocchio come un modello preclinico utili e pertinenti del dolore OA.
Lo scopo di questo articolo è quello di descrivere la metodologia di iniezioni intra-articolari di Mia et le registrazioni comportamentali dello sviluppo associato di ipersensibilità con una mente per evidenziare i passi necessari per dare registrazioni coerenti e affidabili.
Introduzione
Clinicamente, osteoartrite (OA), o malattia degenerativa delle articolazioni, è una condizione dolorosa e debilitante caratterizzata da una progressiva perdita di cartilagine articolare, lieve infiammazione dei tessuti in ed intorno alle articolazioni, e, talvolta, formazione di osteofiti e cisti ossee. I pazienti con OA riferiscono dolore persistente 1 e il display maggiore sensibilità alla pressione e stimoli nocivi nel artritico giunto 2-4. Allo stato attuale, non vi è alcuna cura per l'OA con approcci terapeutici disponibili e analgesici sono prescritti per alleviare il dolore associato a questa condizione, con un certo grado di successo 5. Tuttavia, il dolore OA rimane una clinica modelli di emissione e di animali di OA sono stati sviluppati per migliorare la nostra comprensione dei meccanismi del dolore OA legati e rivelare nuovi bersagli per la terapia.
Ci sono diversi modelli animali di OA disponibili con caratteristiche diverse 6. metodi chirurgici, come anteriorcrociato transezione legamento, può essere utilizzato. Tuttavia, esse comportano l'intervento chirurgico abile e sono principalmente eseguiti nel ratto, mentre destabilizzazione mediale del menisco (DMM) viene utilizzato nel topo. Sviluppo spontaneo di OA si verifica in cavia e degenerazione articolare spontaneo è stato riportato in C57 topi nero da 3 a 16 mesi di 7,8 anni. Modelli OA spontanee non comporta alcun intervento per indurre la condizione, ma hanno variabilità intrinseca, e, come tale, incorrere in numero maggiore e un costo di 9,10. modelli indotto chimicamente, d'altra parte, richiedono meno invasive procedure chirurgiche rispetto ai modelli, e come tali, sono più facili da implementare e permettono lo studio delle lesioni OA in diverse fasi. Questi modelli includono singole iniezioni nel ginocchio di agenti infiammatori, immunotossine, collagenasi, la papaina, o monoiodoacetate, che può essere tossico se fuggono spazio articolare. Di tutti i modelli chimici di OA, MIA è quello più spesso utilizzato, particularly per testare l'efficacia di agenti farmacologici per trattare il dolore, come questo modello genera un fenotipo riproducibile, robusta e rapida del dolore simile che può essere classificato alterando MIA dosaggio 11-15.
iniezione intra-articolare di MIA nei roditori riproduce lesioni OA-like e la compromissione funzionale che può essere analizzato e quantificato. MIA è un inibitore della gliceraldeide-3-fosfatasi, interrompendo la glicolisi cellulare e, infine, con conseguente morte delle cellule 16,17. Iniezione intra-articolare di MIA provoca la morte delle cellule di condrociti, che porta a degenerazione della cartilagine e successive modifiche osso subcondrale come aspetto di osso osteofiti 18,19.
Poiché l'utilità di MIA nel ratto è stato descritto in precedenza 20, in questo lavoro ci concentriamo sulla metodologia di OA MIA indotta in topi questo modello viene utilizzato sempre con la disponibilità di topi knock-out. Descriviamo una procedura per l 'iniezionezione di volumi molto piccoli nel ginocchio e metodi di misurazione sensibilità agli stimoli nocivi e non nocivi agli arti posteriori.
La ripartizione della metodologia contribuirà a ridurre la variabilità, e come tale, raffinare il modello e ridurre il numero di animali necessari per lo studio.
Protocollo
Le procedure che coinvolgono soggetti animali sono stati approvati dal Comitato Etico al King College di Londra e sono conformi al Regno Unito la casa Regolamenti ufficio (Animali procedure scientifiche Act 1986).
1. iniezione intra-articolare del Monoiodoacetate in ginocchio
- House 8 -. 10 settimane di età topi in gruppi di 5 sotto un ciclo di 12 ore luce / buio (luci sulla alle 7:00 AM) con cibo e acqua ad libitum Lasciate che i topi acclimatarsi per 1 settimana prima di iniziare l'esperimento.
- Randomize e topi gabbia in gruppi di 5. Utilizzare il numero degli animali come codici di accecare lo sperimentatore di trattamenti. Utilizzare pesi corporei come parametri per randomizzazione.
- Il giorno dell'iniezione, appena preparare la soluzione di monoiodoacetate in soluzione fisiologica sterile (0.9% NaCl) alle concentrazioni desiderate. Utilizzare soluzione salina sterile per iniezioni in un gruppo separato di topi di controllo. La dose massima raccomandare di MIA è di 1 mg in 10 ml.
Attenzione: Monoiodoacetate è very tossici. Pertanto, si raccomanda di guanti e maschera sono indossati durante la manipolazione della polvere e preparare la soluzione. La soluzione deve essere sterile filtrato con un filtro da 0,22 micron. - Anestetizzare topo, utilizzando un carrello anestetico prima immissione in una camera di fornitura di 2% isoflurano in O 2 miscela (portata 1,5 L / min) e poi trasferire topi alla sezione cono terminale, che fornisce anche la miscela 2% isoflurano-O 2 , e come tale, mantiene anestesia durante l'iniezione. Mettere veterinario pomata sugli occhi per evitare la loro essiccazione mentre sotto anestesia. Indossare abito chirurgico, guanti e maschera durante l'esecuzione di procedura di iniezione.
- Conferma anestesia controllando mancanza dell'animale di risposta ad uno stimolo pinch sulle zampe posteriori.
- Una volta che l'animale è sotto anestesia, posizionarlo sul dorso. Tagliare e pulire l'area circostante l'articolazione del ginocchio con l'alcol. Povidone iodio o clorexidina può essere utilizzato come pure fo la disinfezione. Il tendine rotuleo (linea bianca muggito la rotula) diventerà visibile.
- Al fine di stabilizzare il sito di iniezione, tenere il ginocchio ancora, in una posizione piegata, mettendo il dito indice sotto del ginocchio e il pollice sopra la superficie anteriore della caviglia. preferenza comune non è necessaria.
- Per trovare il sito preciso dell'iniezione, eseguire un ago 26 G attaccato ad una siringa orizzontalmente lungo il ginocchio (per non perforare la pelle con la punta) finché non trova allo spiraglio della rotula. Applicare una leggera pressione per contrassegnare l'area e quindi sollevare l'ago e la siringa in verticale per l'iniezione. Inserire l'ago nella zona segnata, attraverso il tendine rotuleo, perpendicolarmente alla tibia. Nessuna resistenza deve essere sentito.
- Utilizzare pollice come guida e iniettare superficiale al sito di ingresso. Dopo l'iniezione, massaggiare il ginocchio per garantire una distribuzione uniforme della soluzione. Gettare l'ago immediatamente la nettas bin.
- Mettere i topi di nuovo in una gabbia casa pulita su una stuoia riscaldata e permettere loro di recuperare. Mantenere una costante vigilanza sugli animali fino a che riprendano conoscenza adeguata, che viene misurata da loro riconquistare decubito sternale. Una volta che gli animali sono recuperati, tornare alla loro gabbia.
Nota: Si consiglia per i migliori fare pratica e di formazione che un colorante è utilizzato ed immediata la dissezione post mortem eseguita per confermare la corretta localizzazione di iniezione.
2. Misure di ipersensibilità meccanica (Allodinia)
Nota: soglie di ritiro meccaniche statiche sono valutati applicando peli von Frey alla superficie plantare del zampa posteriore.
- Portare i topi nella stanza comportamentale e lasciare che gli animali sfrenato acclimatare in cubicoli acrilici (8 centimetri x 5 cm x 10 cm) in cima a una griglia di rete metallica.
- topi Train di manipolazione e 2 ore assuefazione alle cabine per due giorni prima di applicare capelli von Frey, al fineper limitare lo stress e deambulazione durante l'applicazione di peli von Frey. Nei giorni di test, habituate animali ai box per un massimo di 60 minuti prima del test. Indossare camici, guanti e maschere durante tutti gli esperimenti comportamentali.
- Applicare calibrate peli von Frey (fibre di nylon flessibili di diametro crescente che esercitano livelli di forza definita come calibrata dalla casa costruttrice ed espressa come grammi (g)) alla superficie plantare della zampa posteriore finché le curve di fibre. Utilizzare 0,008, 0,02, 0,04, 0,07, 0,16, 0,4, 0,6, e 1,0 g di fibre durante la prova.
- Tenere ogni capelli in posizione per 3 secondi o finché la zampa viene ritirata, quest'ultimo definendo una risposta positiva. Partendo da una forza di stimolo di 0,07 g, applica peli secondo il metodo "up-down" 21: marchio come X risposta ritiro e O un'assenza di risposta. Applicare in ordine crescente di forza, fino a 1 g (forza cut-off), fino al rilevamento di una risposta.
- Ri-testare la zampa ripetendopunto 2.2.1, iniziando con il filamento che esercita una forza inferiore a quello che ha prodotto un prelievo.
- Quindi, applicare le rimanenti filamenti in modo sequenziale, con la forza scendendo, fino a quando non si verifica alcun ritiro. Riapplicare filamenti crescente fino osservata una risposta. Continuare finché una sequenza di sei risposte è ottenuto (ad esempio, OXOXOX), al fine di ottenere il valore 'k' facendo riferimento alla tabella valori 21.
- Esprimere i valori di ritiro zampa fino al 50% le soglie di ritiro zampa in grammi. Utilizzare la formula (10 [Xr + K δ]) / 10.000 dove Xr = valore dello scorso filamento von Frey utilizzato nella sequenza (in unità di registro), k = valore tabellare, e δ = differenza media in forze tra le fibre. Quando viene rilevata alcuna risposta, utilizzare la risposta massima di 1 g 21,22.
- Seguendo la procedura sopra descritta (2.2.1-2.2.4), valutare soglie meccaniche di entrambe le zampe posteriori prima MIA iniection come valori basali. Dopo l'iniezione, valutare le soglie delle zampe ipsilaterale e controlaterale ad intervalli regolari al giorno per diverse settimane dopo MIA per accertare lo sviluppo di allodinia meccanica.
Nota: Per esempio, riportiamo le soglie misurate 0, 3, 5, 7, 10, 14, 21, e 28 giorni dopo l'iniezione MIA. Gli animali vengono considerati allodinia quando si visualizza una risposta a 0,1 go meno. risposte normali rientrano 0.6 - campo di 1 g.
3. Misurazione del peso che porta Deficit
Nota: Le variazioni di peso che porta sono misurati con un tester peso incapacitance.
- Addestrare ogni mouse per entrare in una camera di Plexiglass sull'apparato e sedersi nella casella di partecipazione. Posizionare il mouse nella parte anteriore della scatola holding, sollevare l'ingresso fino a 45 °, e lasciare il mouse per entrare e chiudere la scatola. Consentire agli animali di muoversi liberamente fino a che non adottano una postura seduta. Questa formazione richiede almeno due giorni e garantisce che l'animale è ancora e non lIGNIFICATO su entrambi i lati della camera. Calibrare lo strumento prima dell'uso con un peso di controllo 100 g (o secondo istruzioni apparecchiature).
- Assicurarsi che ogni zampa posteriore è posizionato sulla rampa di registrazione appropriata 11. La durata di ciascuna misurazione richiede 1 sec, secondo le istruzioni del produttore.
- Raccogliere tre misurazioni del peso sopportato su ogni zampa posteriore dal pad di registrazione per ciascuna sessione di registrazione e utilizzare il valore medio per calcolare la differenza di peso carico zampe ipsilaterale e controlaterale. I valori espressi come differenza tra le zampe controlaterale e omolaterale in grammi.
- Valutare i cambiamenti di peso cuscinetto prima dell'iniezione MIA come valori basali. Poi, le valutazioni ripetute ad intervalli regolari per diverse settimane per accertare lo sviluppo di cambiamenti di gate. Ad esempio, si riportano soglie misurate su 0, 3, 5, 7, 10, 14, 21, e 28 giorni dopo l'iniezione MIA.
Nota: Un peso normale bil valore earing del 50% rappresenta una distribuzione dei pesi pari attraverso degli arti posteriori ipsilaterale e controlaterale. Animali considerato visualizzazione ipersensibili un cuscinetto di peso cambiamento di circa il 45%. Le misurazioni delle soglie meccanici e deficit di peso cuscinetto possono essere eseguite nello stesso topo, in quanto né punto finale colpisce l'altro. Per la valutazione farmacologica, ogni gruppo di animali deve essere testato a orari prestabiliti dopo la somministrazione in linea con il profilo farmacocinetico del composto utilizzato.
Risultati
Abbiamo recentemente riportato che l'iniezione di 0,5 - 1 mg MIA nel ginocchio del mouse induce miste di cui ipersensibilità meccanica (allodinia) nella zampa posteriore ipsilaterale e peso che porta il deficit fino a 4 settimane, anche se insorgenze sono dose-dipendenti 23.
I dati riportati nella Figura 1 costituiscono un esempio dell'andamento nel tempo di ipersensibilità meccanica MIA indotta nelle zampe posteriori ipsilaterale dopo un intervallo di dosi iniettate nel ginocchio. In particolare, la dose minima di MIA (0,5 mg / topo) ha indotto una diminuzione del 50% delle soglie rispetto alla iniezione di soluzione salina al giorno 10, e soglie scesa al 70% di quelli dei controlli saline dal giorno 28 dopo l'iniezione. La dose intermedia di 0,75 mg di MIA ha determinato una graduale diminuzione delle soglie che erano inferiori di 80% che le soglie di controllo Salina il giorno 10 ed è rimasto basso fino a giorno 28. La più alta dose di 1 mg MIA è stato associato con un segnocalo ificant della soglia il giorno 5 e un ulteriore calo il giorno 10, che è stata sostenuta fino a giorno 28.
I dati riportati in figura 2 forniscono esempi di variazioni di peso cuscinetto che sono associati con iniezione MIA delle articolazioni del ginocchio. In questa serie di esperimenti, mentre la dose MIA 0,5 mg non ha indotto variazioni significative del peso recanti per tutta la durata di 28 giorni dello studio, la dose MIA 0,75 mg ha determinato una significativa riduzione del peso carico zampa ipsilaterale dal giorno 10 in poi. In particolare, il peso che porta asimmetria associata a 0,75 mg di MIA può produrre risultati variabili e incoerenti tra studi 23. Invece, la dose di 1 mg MIA induce generalmente peso riproducibile cuscinetto asimmetria ei dati nella Figura 2 dimostrano significativa riduzione del peso sopportato sulla zampa posteriore ipsilaterale dal giorno 3 fino alla fine del periodo di osservazione. Come previsto, Salianimali ne-trattati hanno mostrato alcun peso recanti modifiche.
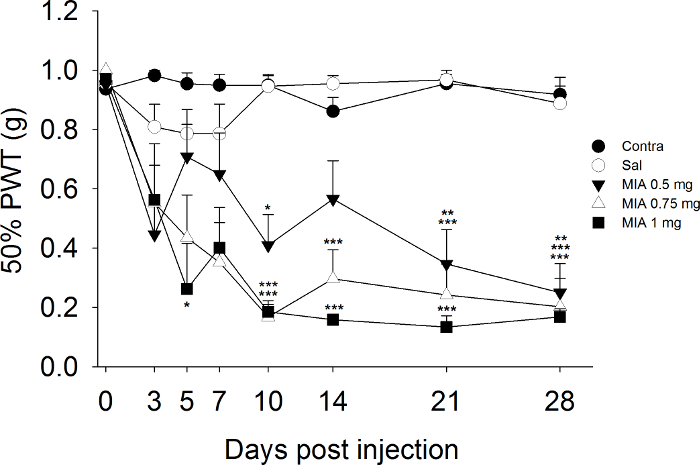
Figura 1. Sviluppo di Allodinia meccanica Messaggio MIA iniezione. Soglie Paw ritiro delle zampe posteriori ipsilaterale e controlaterale sono stati valutati prima e dopo l'iniezione di MIA (0,5, 0,75 e 1 mg / mouse) e soluzione salina (0,9% NaCl), n = 8 - 10 topi / gruppo. * P <0.05, ** P <0.01, *** P <0.001 rispetto gruppo salina trattato; A due vie misure ripetute ANOVA seguita da Student Newman-Keuls post hoc test. Cliccate qui per vedere una versione più grande di questa figura.
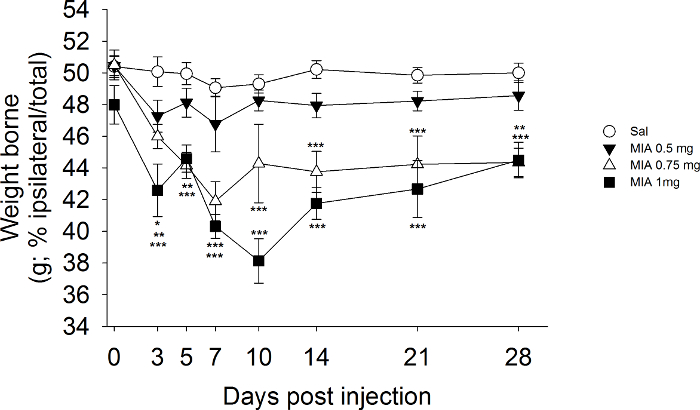
Figura 2. Sviluppo di peso che porta Deficits Messaggio MIA iniezione. Cambiamenti nella distribuzione del peso corporeo tra le due arti posteriori sono stati calcolati come [(peso a carico sulla ipsilaterale zampa / somma del peso sopportato sulle zampe ipsilaterale e controlaterale) * 100] sono stati valutati prima e dopo l'iniezione di MIA ( 0,5, 0,75 e 1 mg / topo) e soluzione salina (0,9% NaCl), n = 8 - 10 topi / gruppo. * P <0.05, ** P <0.01, *** P <0.001 rispetto gruppo salina-trattata. A due vie misure ripetute ANOVA seguita da Student Newman-Keuls post hoc test. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Con questa metodologia, si descrive un metodo preferito per indurre il dolore OA-come nel topo da una iniezione intra-articolare di MIA in un ginocchio e la valutazione della sensibilità agli stimoli non nocivi e nocivi agli arti posteriori. iniezione MIA è associata a un comportamento dolore persistente, ovvero alterato il peso degli arti posteriori del cuscinetto e lo sviluppo di ipersensibilità meccanico di cui (allodinia). Tali misure statiche possono essere integrati da analisi del cammino su un tapis roulant o mediante l'analisi passerella in animali liberi di muoversi. Modelli MIA sono sensibili alle terapie convenzionali antidolorifiche 24, che indica che essi possono essere utili per discernere approcci terapeutici. Mentre l'iniezione di MIA non è tecnicamente difficile, la capsula può essere forata durante l'iniezione, con conseguente fuoriuscita di MIA fuori della capsula, e di successivo mancato indurre tossicità dei condrociti. In effetti, l'iniezione sistemica di MIA può essere fatale nei roditori unND possibili effetti di MIA sui tessuti e cellule diverse da condrociti possono confondere i risultati, oltre ad essere indesiderabile. Come tale, va sottolineato che la grande cura deve essere data per l'iniezione del MIA, in quanto è un componente critico del modello, e la fiducia deve essere dato che l'iniezione avviene nello spazio articolare. Questo protocollo consente di raggiungere questo obiettivo.
I protocolli descritti qui mirano ad assicurare gli animali forniscono risposte al dolore come costanti per tutto il periodo di prova. Inoltre, essi consentono la regolazione della gravità della malattia, modificando la dose di MIA usato per indurre la patologia 15,23. La rapida induzione della sia stato di malattia e il comportamento del dolore simile a consentire una valutazione tempestiva dei composti dolore modificanti. Questo è vantaggioso rispetto agli attuali chirurgica e spontaneamente lo sviluppo di modelli di OA, che può richiedere un periodo di tempo più lungo per sviluppare ipersensibilità. Inoltre, in particolare per i modelli spontanee, la malattia Pathollogia non si manifesta in tutti gli animali (circa 20 - 80% 7), mentre il modello MIA è associata con una significativa incidenza di responder. Inoltre, i modelli spontanei non sono adatti per le misurazioni di cambiamenti nel cuscinetto di peso, come OA sviluppa in entrambe le ginocchia. Quando si considera le misure comportamentali, gli animali devono essere tenuti calmo e rilassato durante le valutazioni. Questo risultato è ottenuto, come indicato nel protocollo, per la formazione iniziale prima che le misure di registrazione e la movimentazione ripetitiva, che permette gli animali di familiarizzare con lo sperimentatore. Un punto chiave per ridurre lo stress è quello di utilizzare lo stesso sperimentatore per la prova comportamentale tutto, costante cambiamento indurrà i problemi precedentemente menzionati. Come qualsiasi modello, il modello di MIA OA porta limitazioni, come la rapidità di interruzione giunto, che non assomiglia lento sviluppo di OA patologia in pazienti. Un modo per superare questo problema potrebbe essere quella di integrare questo modello con un sumodello rgical di OA. L'uso del modello chimica MIA nello sviluppo compound consente l'uso di protocolli preventivi e terapeutici sullo sviluppo e manutenzione del dolore OA-like. Infine, il modello MIA andrebbe ad integrare gli studi di tratti fenotipici di topi knock-out, aiutando a capire meglio la malattia OA.
Divulgazioni
None of the authors have competing interests or conflicting interests.
Riconoscimenti
JSV è sostenuto da una borsa di collaborazione per MM dalla Commissione europea (GAN 603191-PAINCAGE).
Materiali
| Name | Company | Catalog Number | Comments |
| Monoiodoacetate | Sigma-Aldrich | I-2512-25G | ≥ 98% purity |
| 0.9% Saline | Mini-Plasco basic | 365 4840 | |
| Isoflurane | Merial | DNI 4090/1 | |
| 26 G Needle | Fisher Scientific | 12947606 | |
| 50 μl Hamilton Syringe | Sigma-Aldrich | 20701 | |
| Von Frey Hairs | Linton Instruments | NC 122775-99 | |
| Incapacitance tester | Linton Instruments | Delivery on Request | |
| Testing Cage Rack | Ugo Basile | 37450 | |
| Compact Anesthetic system | Vet-Tech | AN001B | |
| Medical O2 | BOC | 101-F | |
| Aldasorbers | Vet -Tech | AN006A |
Riferimenti
- Farrell, M., Gibson, S., McMeeken, J., Helme, R. Pain and hyperalgesia in osteoarthritis of the hands. J. Rheumatol. 27 (2), 441-447 (2000).
- Kuni, B., Wang, H., Rickert, M., Ewerbeck, V., Schiltenwolf, M. Pain threshold correlates with functional scores in osteoarthritis patients. Acta. Orthop. 86 (2), 215-219 (2015).
- Wylde, V., Hewlett, S., Learmonth, I. D., Dieppe, P. Persistent pain after joint replacement: prevalence, sensory qualities, and postoperative determinants. Pain. 152 (3), 566-572 (2011).
- Wylde, V., Palmer, S., Learmonth, I. D., Dieppe, P. Test-retest reliability of Quantitative Sensory Testing in knee osteoarthritis and healthy participants. Osteoarthr. Cartil. 19 (6), 655-658 (2011).
- Hunter, D. J. Pharmacologic therapy for osteoarthritis--the era of disease modification. Nat. Rev. Rheumatol. 7 (1), 13-22 (2011).
- Lampropoulou-Adamidou, K., et al. Useful animal models for the research of osteoarthritis. Eur. J. Orthop. Surg. Traumatol. 24 (3), 263-271 (2014).
- Yamamoto, K., Shishido, T., Masaoka, T., Imakiire, A. Morphological studies on the ageing and osteoarthritis of the articular cartilage in C57 black mice. J. Orthop. Surg. (Hong Kong). 13 (1), 8-18 (2005).
- Huebner, J. L., Hanes, M. A., Beekman, B., TeKoppele, J. M., Kraus, V. B. A comparative analysis of bone and cartilage metabolism in two strains of guinea-pig with varying degrees of naturally occurring osteoarthritis. Osteoarthr. Cartil. 10 (10), 758-767 (2002).
- Thysen, S., Luyten, F. P., Lories, R. J. Targets, models and challenges in osteoarthritis research. Dis Model Mech. 8 (1), 17-30 (2015).
- Longo, U. G., et al. Osteoarthritis: new insights in animal models. Open. Orthop. J. 6, 558-563 (2012).
- Bove, S. E., et al. Weight bearing as a measure of disease progression and efficacy of anti-inflammatory compounds in a model of monosodium iodoacetate-induced osteoarthritis. Osteoarthr. Cartil. 11 (11), 821-830 (2003).
- Pomonis, J. D., et al. Development and pharmacological characterization of a rat model of osteoarthritis pain. Pain. 114 (3), 339-346 (2005).
- Schuelert, N., McDougall, J. J. Grading of monosodium iodoacetate-induced osteoarthritis reveals a concentration-dependent sensitization of nociceptors in the knee joint of the rat. Neurosci. Lett. 465 (2), 184-188 (2009).
- Vonsy, J. L., Ghandehari, J., Dickenson, A. H. Differential analgesic effects of morphine and gabapentin on behavioural measures of pain and disability in a model of osteoarthritis pain in rats. Eur. J. Pain. 13 (8), 786-793 (2009).
- Im, H. J., et al. Alteration of sensory neurons and spinal response to an experimental osteoarthritis pain model. Arthritis Rheum. 62 (10), 2995-3005 (2010).
- Sabri, M. I., Ochs, S. Inhibition of glyceraldehyde-3-phosphate dehydrogenase in mammalian nerve by iodoacetic acid. J. Neurochem. 18 (8), 1509-1514 (1971).
- van der Kraan, P. M., Vitters, E. L., van de Putte, L. B., van den Berg, W. B. Development of osteoarthritic lesions in mice by 'metabolic' and 'mechanical' alterations in the knee joints. Am. J. Pathol. 135 (6), 1001-1014 (1989).
- Guingamp, C., et al. Mono-iodoacetate-induced experimental osteoarthritis: a dose-response study of loss of mobility, morphology, and biochemistry. Arthritis Rheum. 40 (9), 1670-1679 (1997).
- Janusz, M. J., et al. Moderation of iodoacetate-induced experimental osteoarthritis in rats by matrix metalloproteinase inhibitors. Osteoarthr. Cartil. 9 (8), 751-760 (2001).
- Marker, C. L., Pomonis, J. D. The monosodium iodoacetate model of osteoarthritis pain in the rat. Methods Mol. Biol. 851, 239-248 (2012).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J. Neurosci. Methods. 53 (1), 55-63 (1994).
- Dixon, W. J. Efficient analysis of experimental observations. Ann. Rev. Pharmacol. Toxicol. 20, 441-462 (1980).
- Ogbonna, A. C., Clark, A. K., Gentry, C., Hobbs, C., Malcangio, M. Pain-like behaviour and spinal changes in the monosodium iodoacetate model of osteoarthritis in C57Bl/6 mice. Eur. J. Pain. 17 (4), 514-526 (2013).
- Fernihough, J., Gentry, C., Malcangio, M., Fox, A., Rediske, J., Pellas, T., Kidd, B., Bevan, S., Winter, J. Pain related behaviour in two models of osteoarthritis in the rat. Pain. 112 (1-2), 83-93 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon