Method Article
Isolamento di singole comunità batteriche intracellulari generati da un modello murino di infezione delle vie urinarie per analisi unicellulare a valle
In questo articolo
Riepilogo
Questo protocollo descrive un metodo semplice isolare cellule epiteliali singole, vescica infettati da un modello murino di infezione delle vie urinarie.
Abstract
In questo articolo, descriviamo una procedura utilizzata per isolare singole comunità batterica intracellulare da un mouse che è stato infettato sperimentalmente nell'apparato urinario. Il protocollo possa essere suddivisi in tre sezioni: l'infezione, vescica delle cellule epiteliali raccolta e micropipetting di bocca per isolare singole cellule epiteliali infettate. L'isolato delle cellule epiteliali contiene cellule batteriche vitali ed sono quasi privo di contaminanti batteri extracellulari, che lo rende ideale per analisi di singola cellula a valle. Il tempo impiegato dall'inizio dell'infezione per ottenere una singola comunità batterica intracellulare è circa 8 h. Questo protocollo è poco costoso da distribuire e utilizza materiali ampiamente disponibili, e possiamo anticipare che può essere utilizzato anche in altri modelli di infezione per isolare singole cellule infettate da miscele di cella, anche se tali cellule infette sono rari. Tuttavia, a causa di un rischio potenziale in micropipetting bocca, questa procedura non è consigliata per agenti altamente contagiosi.
Introduzione
Infezioni delle vie urinarie (UTIs) sono una delle più comuni infezioni batteriche. Circa il 40-50% delle donne si pensano che avvertano almeno un'infezione delle vie urinarie (UTI) durante il loro ciclo di vita1. Uno dei principali agenti di UTI è uropathogenic Escherichia coli (UPEC), che rappresenta oltre il 70% di semplice UTIs2. Inoltre, circa un quarto di coloro che hanno un UTI avrà un'infezione ricorrente, spesso causata dallo stesso sforzo, nonostante il trattamento antibiotico adatto3. L'alta incidenza di UTI rappresenta un onere notevole sui sistemi sanitari, costano più di $ 2 miliardi all'anno in US4. Inoltre, l'uso di antibiotici per trattare UTIs conduce anche all'aumento dei tassi di resistenza agli antibiotici, che è una preoccupazione di salute pubblica importante5.
Di conseguenza, un grande sforzo è stato inserito nella comprensione dei meccanismi con cui UPEC infetta le vie urinarie, come pure la sua capacità di causare infezioni ricorrenti6,7,8. In particolare, è stato utilizzato un modello murino di infezione per esaminare batterico e host caratteristiche che contribuiscono a UTI8. Questo modello del topo ha il vantaggio di essere applicabile a non modificati ceppi clinici isolati da pazienti umani. Questo modello ha portato anche alla scoperta delle vie batteriche potenzialmente trattabili importante istituzione di UTI, ad esempio il tipo 1 pilus9 e ferro acquisizione sistemi10.
Rispetto a questi successi nello studiare i primi eventi in UTI, la conoscenza dei meccanismi che UTI ricorrente manca ancora11. Un'ipotesi è che UPEC elude la terapia antibiotica e provoca infezioni ricorrenti nella vescica formando comunità batteriche intracellulari (IBCs) all'interno delle cellule epiteliali della vescica. I GIR sono stati identificati sia in modelli murini di infezione umana UTI pazienti12,13. La presenza di Gir in campioni di urina da pazienti pediatrici UTI è stata associata con più alti tassi di ricorrenza14,15. Tuttavia, isolando i GIR e studiando i batteri all'interno di essi ha dimostrato di essere tecnicamente impegnativo a causa della loro rarità; si stima che una vescica murina infettata in genere ha solo 10-100 gir16. Inoltre, le cellule epiteliali della vescica sono relativamente grandi (50-120 µm)17, rendendolo difficile da distribuire fluorescenza assistita ordinamento delle cellule (FACS) dato che tipico FACS ugelli sono progettati con un diametro di 70 µm o 100 µm. Così, le cellule grandi come le cellule epiteliali della vescica sono spesso rimossi per filtrazione prima del FACS per evitare l'intasamento della fluidica.
Il nostro laboratorio ha recentemente descritto un metodo generale ed economico per isolare cellule rare infetti da miscele come raschiate cellule epiteliali della vescica18. Per isolare in modo efficace i GIR, abbiamo usato il pipettaggio tradizionale bocca. Micropipetting di bocca è una tecnica che è stato a lungo utilizzata per micromanipolazione di singole cellule ed embrioni per analisi a valle19,20,21,22,23, 24 , 25. bocca tradizionale pipettaggio di grandi volumi di liquidi (in millilitri) è stata spesso la causa di incidenti correlate a laboratory, e la tecnica giustamente è stata evitata da gran parte della comunità di ricerca di fuori della tradizionale embriologia e applicazioni di singola cellula. Il nostro protocollo si ispira le versioni singola cella di questa tecnica19,20, che mitigare il rischio fornendo un buffer di grandi dimensioni (> 2 mL) d'aria tra il ricercatore e il campione rispetto al volume del liquido trasferito (< 1 Μ L). Questo metodo si avvale del controllo bene anche quella bocca micropipetting fornisce, che si traduce in un basso volume finale delle circostanti soluzione trasferito ed elevata purezza delle cellule isolate. La tecnica utilizza materiali poco costosi (< 50 dollari) e quindi dovrebbe essere fattibile per implementare in tutti i laboratori.
Questo protocollo visual descrive la nostra tecnica di isolamento di IBC, fornendo un riferimento per assistere altri ricercatori che cercano di replicare questa tecnica. Il ricercatore sarà necessario accedere a un microscopio per dissezione fluorescente (o apparecchiature simili) che può essere utilizzato per visualizzare singole cellule epiteliali e i batteri fluorescenti durante la formazione immagine dal vivo, con una fase di formazione immagine aperta e accessibile per micropipetting (Vedi la Tabella materiali per i dettagli del microscopio usato, anche se possono essere utilizzati anche altri modelli di strumento equivalente). Mentre questo protocollo si concentrerà su GIR in un modello murino di UTI, metodi simili dovrebbero essere applicabili per isolare le cellule infettate da sospensioni cellulari in altri modelli di infezione.
Protocollo
Tutti i metodi descritti di seguito per quanto riguarda la gestione degli animali sono stati approvati dal istituzionale Animal Care e uso Committee (IACUC) del Genome Institute di Singapore e centro di risorse biologiche dell'Agenzia per la scienza, tecnologia e ricerca, Singapore.
1. Mouse infezione
-
Preparazione di tubi capillari in vetro
- Luce di una sorgente di fiamma libera (becco Bunsen o bruciatore ad alcool).
- Tenere un bicchiere capillare con due mani pinzando saldamente entrambe le estremità, quindi la metà del tubo di calore in modo uniforme fino a quando il vetro va morbido. Ruotare il vaso capillare delicatamente avanti e indietro lungo il suo asse per facilitare anche il riscaldamento del vetro.
- Rimuovere il capillare di vetro dalla fonte di calore e immediatamente separare le mani, pur mantenendo la presa su entrambe le estremità del tubo. La lunghezza finale ideale del capillare tirato è 3-5 cm più lungo di un capillare unpulled per garantire un adeguato diametro interno per isolare le cellule epiteliali della vescica singolo.
Attenzione: Il tubo rimane ancora estremamente caldo per un periodo di tempo, quindi impostare il capillare da parte su una superficie di calore-cassaforte per pochi minuti raffreddare prima di procedere al passaggio successivo. - Controllare per vedere se la metà del vetro capillare è diventata più ristretto (Figura 1A) e che l'interno del tubo è ancora vuoto (Figura 1B). Per l'isolamento di IBC, una dimensione di foro di 200-400 µm è utilizzabile.
- Prendere un'estremità del capillare tirato con una sola mano. Tenere un paio di pinze con l'altra mano e utilizzarlo per raccogliere il vetro tirato capillare nel suo punto più stretto. Garantire che le pinze sono brandite con forza sufficiente per afferrare saldamente il capillare senza romperla.
- Utilizzare un rapido movimento di torsione dalla mano che tiene il forcipe per far scattare il capillare tirato al punto più stretto per creare una micropipetting bocca capillare.
Nota: Usando le dita invece di forcipe è anche accettabile, finché viene utilizzata un'adeguata protezione da schegge di vetro. - Ripetere i passaggi 1.1.2-1.1.6 almeno 4 volte più a produrre sufficiente capillari di ricambio micropipetting e fornire una gamma di diametri per l'isolamento di IBC. Se più di un gruppo di infezione è anticipato, preparare 5 capillari micropipetting aggiuntive per ogni gruppo ulteriore infezione.
Attenzione: Non dimenticate di spegnere la fiamma aperta. - Posizionare i capillari tirati in un 100mm di Petri ed esporre il piatto ai raggi UV per 30 min sterilizzare i vasi capillari.
- Rimettere il coperchio sul piatto Petri dopo la sterilizzazione UV e memorizzare la capsula di Petri con i capillari a temperatura ambiente.
-
Preparazione dei cateteri prima dell'infezione
- Preparare i cateteri urinarii per infezione come descritto in Hung et al.8 e Conover et al.26 almeno un giorno prima dell'infezione.
-
Preparazione di fluorescente uropathogenic Escherichia coli cultura
- Crescere il selezionato uropathogenic fluorophore-esprimendo batterica ceppo secondo i protocolli stabiliti.
Nota: Le scelte di ceppo e fluoroforo dipendono in larga misura il microscopio e ceppi disponibili nei singoli laboratori. In questo esempio, utilizziamo un ceppo derivato da UTI89, che è un isolato clinico originariamente da un paziente con cistiti ricorrenti. Questo ceppo, SLC-638, trasporta un plasmide (pSLC-77) che esprime sia vsfGFP-9 e kanamicina resistenza18. SLC-638 è coltivato in libbra di brodo a 37 ° C, completati con kanamicina di 50 µ g/mL. - Inoculare il ceppo SLC-638 su un Luria Bertani (LB)-piastra di agar completato con kanamicina di 50 µ g/mL. Incubare la piastra a 37 ° C durante la notte.
- (Opzionale) Mostra la piastra sul microscopio per dissezione per confermare l'espressione di marcatori fluorescenti prima di selezionare una colonia.
- Utilizzando un ciclo di inoculazione batterica, trasferire la colonia selezionata in una beuta da 125 mL con 10 mL di brodo LB completato con kanamicina di 50 µ g/mL. Incubare la beuta in modo statico a 37 ° C per 24 h.
- Sottocultura i batteri da questa boccetta prendendo 10 µ l di cultura dal pallone e diluirla in 10 mL di brodo LB completati con 50 kanamicina µ g/mL in un pallone di fresca 125 mL (una diluizione di 1: 1000). Incubare la beuta secondo staticamente a 37 ° C per altre 24 ore.
- Rotazione verso il basso la coltura batterica per 5 min a 5.000 x g a 4 ° C.
- Decantare il supernatante e risospendere il pellet batterico in PBS freddo OD600 pari a 0,5.
Nota: Anche se può variare da cultura a cultura, in genere 1 mL di coltura statica dà circa 4-5 mL di OD600 = 0,5 coltura batterica. Il volume totale di inoculo batterico necessario per ogni ceppo può essere calcolato come segue: 50 µ l è necessaria per ogni mouse e 50 µ l è da imbottitura per la testa dell'ago. Un ulteriore 10-20% (minimo 50 µ l) dell'inoculo è consigliato per contabilizzare il volume morto nella siringa. - Utilizzare la miscela batterica rimanente per determinarne il titolo di infezione, come descritto in Hung et al.8.
Nota: Questo passaggio può essere ritardato per un paio d'ore memorizzando la miscela batterica a 4 ° C.
- Crescere il selezionato uropathogenic fluorophore-esprimendo batterica ceppo secondo i protocolli stabiliti.
-
Modello murino di infezione delle vie urinarie
- Infettare i topi come descritto da Hung et al.8, con un gruppo sperimentale per ogni ceppo di fluorescente e. coli, coltivate nella sezione 1.3.
Nota: Vedere anche Conover et al.26 per assistenza visiva. - Nota il tempo di inoculazione batterica per il mouse o la gabbia.
- Infezioni ricorrenti per l'intero gruppo sperimentale.
Nota: Il catetere di infezione può essere riutilizzato per tutti i mouse nello stesso gruppo. - 1.4.1-1.4.3 Ripetere i passaggi per ogni gruppo sperimentale progettato, assicurando che un catetere fresco e nuovo gel lubrificante è preparato per ogni gruppo.
Nota: Per esperimenti con un gran numero di animali, si consiglia di dividere gli animali in gruppi di cinque e scaglionare le infezioni tale che ogni gruppo è infettato circa 30 min a 1 h apart. Ciò fornirà abbastanza tempo per le fasi successive (sezioni 2 e 3).
- Infettare i topi come descritto da Hung et al.8, con un gruppo sperimentale per ogni ceppo di fluorescente e. coli, coltivate nella sezione 1.3.
2. vescica cellule epiteliali raccolta per ottenere una sospensione cellulare
-
Raccolta e invertendo murini vesciche
- Preparare tre provette coniche da 50 mL riempite con 45 mL di etanolo al 70% per la sterilizzazione di strumenti chirurgici.
- In due dei tubi preparati al punto 2.1.1, posto un paio di forbici e un paio di pinze ogni. Il terzo tubo, inserire due paia di pinze (uno preferibilmente più stretto e con una punta arrotondata, per l'inversione della vescica).
Nota: Gli strumenti nel primo tubo verranno utilizzati sulla regione esterna, gli strumenti nel secondo verranno utilizzati nella raccolta della vescica e le due paia di pinze nell'ultima volontà di tubo utilizzato nell'inversione della vescica. - A 6 h post infezione, i topi infetti secondo protocolli stabiliti di IACUC dell'istituzione di eutanasia.
Nota: Il nostro protocollo IACUC chiede l'eutanasia tramite dislocazione cervicale eseguita mentre il mouse si trova nell'ambito dell'anestesia (isoflurano). - Appoggiare gli animali sul loro spalle e utilizzare un flacone spray riempito con etanolo al 70% per sterilizzare la zona addominale.
- Utilizzando un paio di pinze e forbici chirurgiche dal primo tubo (preparata al punto 2.1.2), fare una piccola incisione trasversa sulla pelle circa 1 cm sopra l'uretrale apertura. Espandere l'incisione diagonalmente verso gli arti superiori del mouse, creando un taglio a forma di V lungo l'intero anteriore del mouse che espone il contenuto del peritoneo. Garantire che durante questo processo, le forbici non tagliano attraverso l'intestino del mouse (Figura 2A, B).
- Passare al secondo set di strumenti (preparata al punto 2.1.2). Utilizzando le lame delle forbici o gli alberi delle pinze, spingere delicatamente verso il basso sui cuscinetti di grasso vicino alla regione pelvica del mouse.
Nota: Questo passaggio fa sì che la vescica a sporgere verso l'esterno e garantisce una visibilità per la raccolta. - Afferrare la vescica esposta all'apice con un paio di pinze (Figura 2C).
- Mantenere una salda presa sull'apice della vescica con il forcipe, tagliare e libera la vescica dal resto dell'animale (tagliando via l'uretra e ureteri) usando le forbici chirurgiche. Non rilasciare il forcipe che ancora tiene la vescica.
- Passaggio dalle forbici per il forcipe arrotondato stretto da terzo conica tube (dal punto 2.1.2), inserire la punta di un albero delle pinze arrotondate nell'apertura della vescica dove è stato appena tagliato nel passaggio precedente (Figura 2D). Con la punta delle pinze arrotondate in modo sicuro inserite nell'apertura della vescica, rilasciare la coppia di pinze di presa l'apice della vescica e restituirlo al secondo tubo conico.
- Utilizzando la seconda coppia di pinzette dal terzo tubo, girare delicatamente la vescica prima tirando l'estremità esterna della bocca della vescica lontano il forcipe arrotondato (Figura 2D, freccia 1) e guidandolo intorno e sopra l'altra punta di "inside out" il forcipe arrotondato (Figura 2D, freccia 2).
Nota: L'azione può essere paragonata alla rimozione di un calzino da un piede e tirando sopra l'altro.- Durante il processo di inversione, mantenere la prima coppia arrotondata di forcipe quasi completamente chiuso. Questo fornisce sufficiente libertà di movimento per tirare la vescica fuori dall'albero primo delle pinze arrotondate, ma anche porta il secondo pozzo delle pinze arrotondate più vicino al primo e consente di essere trasferiti facilmente la vescica. Il risultato finale di questa fase è che la vescica dovrebbe concludere in su essere invertito e sulla punta dell'albero secondo della prima coppia di pinze (Figura 2E).
- Utilizzando il secondo paio di pinze, coassiale delicatamente la vescica invertita largo della punta della pinza in 1 mL di PBS freddo.
Nota: (Opzionale) Questo è il momento opportuno per prendere le immagini dell'intero invertito, infettato della vescica per osservare la frequenza generale e la distribuzione di GIR, se presente.
- Ripetere i passaggi 2.1.1-2.1.10 per ogni vescica nel gruppo sperimentale (per un massimo di cinque animali).
-
Vescica delle cellule epiteliali raschiando
- Utilizzando due paia di pinze di pulire, raschiare delicatamente l'esterno della vescica invertita (che è lo strato interno delle cellule epiteliali). Il PBS circostante dovrebbe apparire torbida come raschiare proventi e cellule epiteliali vengono rilasciate nella soluzione PBS.
- (Opzionale) Verificare visivamente che la raschiatura della vescica ha rilasciato le cellule nella soluzione utilizzando un microscopio per dissezione. Figura 3 A, B). Il PBS dovrebbe apparire nuvoloso ad occhio nudo, e le cellule epiteliali raschiata vescica individuali possono essere visto a 10 ingrandimenti.
- Ripetere i passaggi 2.2.1-2.2.2 per ogni raccolto della vescica dal punto 2.1.
3. intracellulare isolamento comunità batteriche (IBC): bocca pipettaggio di Gir
Nota: Tutti i metodi descritti in questa sezione sono stati sottoposti a una valutazione del rischio istituzionale. Pipettaggio di bocca trasporta il rischio inerente di ingestione della soluzione che viene trasferita. Questo rischio è limitato in gran parte dai volumi nanolitro che utilizza questo protocollo, e si consiglia di prestare attenzione a tutti gli utenti del protocollo pay per precauzione e note pratiche elencate qui e nella discussione.
-
Dopo che le cellule hanno stato raschiato in PBS, impostare l'apparato micropipetting (Figura 3C).
- Inserire l'estremità più spessa del vetro tirato capillare (unpulled fine) il tappo di gomma (estremità bianca) del tubo aspiratore.
- Inserire l'estremità più stretta di punta di una pipetta da 1 mL in altre (rossa) estremità aperta del tubo aspiratore, assicurando che ci sia una perfetta aderenza.
- Inserire l'estremità sottile di 2 mL aspirando pipetta nell'estremità aperta, più ampio della punta della pipetta 1ml, ancora assicurando che ci sia una stretta misura.
Nota: La configurazione risultante consente al ricercatore di pipetta bocca dall'estremità più ampia, aperta della pipetta aspirante per creare una forza di aspirazione delicata da estremità stretta del capillare a altra estremità dell'apparecchio. - Testare l'apparato di micropipetting bocca finale utilizzando una capsula di Petri 100 mm contenente acqua deionizzata. Una leggera azione di aspirazione all'estremità aperta della pipetta aspirante (simile a sorseggiando un drink con una cannuccia) dovrebbe aumentare il livello del liquido nel capillare, ma non causare l'acqua deionizzata di overflow nel tubo aspiratore. Utilizzare una mano per controllare il tubo capillare, mentre con l'altra mano per regolare la posizione del piatto Petri.
Nota: La forza di aspirazione necessaria per bocca-pipettaggio un IBC singola varia tra i ricercatori. Tuttavia, è consigliabile che ogni ricercatore di tentare questa tecnica inizia con un'aspirazione debole e aumentarla lentamente se nessun liquido sta fluendo fino il capillare. Non c'è alcun bisogno di una forza maggiore di succhiare su una cannuccia per bere. Se il capillare non sembra essere raccogliendo liquido durante il test nel passaggio 3.1.4, è possibile che il capillare o il tubo aspirante è occlusa e deve essere sostituito. Si raccomanda inoltre che tutti i nuovi ricercatori prima pratica controllo aspirazione nell'apparato bocca pipettaggio utilizzando sterilizzati acqua. Inoltre, si noti che il controllo del volume preso dall'apparato di pipettaggio di bocca è attraverso l'uso di lingua del ricercatore. La lingua può finemente regolare la forza di aspirazione applicato, nonché fungere da un arresto di emergenza. - Dopo aver raggiunto successo assorbimento di liquido, testare la capacità di espellere dal capillare soffiando delicatamente nell'estremità aperta della pipetta aspirante. Assicurarsi che nessun bolle sono creato in procinto di espellere il liquido per evitare la contaminazione del GIR durante passaggio 3.5.
Nota: Come con aspirazione, la forza di pressione positiva applicata da parte del ricercatore di espellere l'IBC nella provetta da centrifuga varia tra i ricercatori. È consigliabile per i ricercatori di nuovi al presente protocollo al passaggio di pratica 3.1 pochi giorni prima dell'infezione effettivo. Un suggerimento per praticare micropipetting di bocca è di pratica trasferimento di piccoli volumi di acqua sterilizzata mescolato con qualche goccia di colorante alimentare (per visibilità) utilizzando l'apparato di una micropipetta di bocca.
- Posizionare la sospensione cellulare raschiato sotto il microscopio per dissezione e identificare il GIR come grandi aggregati fluorescenti (Figura 3A, B). La gamma di ingrandimento ideale è 20-40 x. Immergere l'estremità bene del vaso capillare di vetro in una nuova provetta di PBS per 1 s per ridurre l'assorbimento del volume indesiderati attraverso l'azione capillare.
- Guardando attraverso il microscopio, identificare l'IBC di interesse e portare lentamente l'estremità aperta del tubo capillare verso l'IBC. Utilizzare alla fine fine del vetro capillare per spazzare via le cellule supplementari vicino ogni IBC per impedire l'aspirazione di due o più celle, o la rottura apart più grandi aggregati di cellule.
- Mentre si osserva attraverso il microscopio, è necessario applicare una forza di aspirazione molto piccola sul fondo (con una pipetta aspirante) dell'apparato micropipetting bocca per guidare l'IBC nel capillare di vetro.
- Dopo aver raccolto l'IBC, spostare il capillare in una provetta da centrifuga vuoto 1,5 mL e applicare una leggera pressione positiva ad espellere la goccia e l'IBC nella provetta da centrifuga (Figura 3D).
- Ripetere i passaggi da 3.3-3.6 su come molti GIR sono necessari dalla vescica corrente, prima di procedere alla vescica successiva. Modificare aspirazione pipette e capillari frequentemente per evitare l'accumulo di saliva.
Attenzione: Quando si lavora con infettive (o clinici) ceppi di batteri, monitorare costantemente il livello della soluzione nel capillare. Non lasciare che il livello del liquido viene pipettato overflow dal bordo del vaso capillare nel tubo aspiratore. In questo caso, immediatamente passare ad un tubo aspiratore diversi e scartare il precedente set up. - Ripetere i passaggi da 3.2-3.6 su tutti i serbatoi di raccolti, o fino a quando un numero sufficiente di campioni biologici è stati raccolti per il gruppo sperimentale.
- (Opzionale) Ripetere i passaggi 3.6 e 3.7 tutti i gruppi sperimentali (o topi) sono stata eutanasia e sufficienti campioni biologici sono state raccolte da ogni gruppo.
Risultati
Oltre alla conferma (Figura 3D) della presenza di un singolo isolato IBC nel tubo di raccolta tramite il microscopio per dissezione, la purezza del GIR isolato può essere confermata anche mediante microscopia confocale. Come mostrato in Figura 4A, le cellule isolate dovrebbero macchiare per e. coli e uroplachine e sono la dimensione prevista per i GIR (50-120 µm)17. Inoltre, la macchiatura di e. coli non è presente nel liquido circostante. Base ai nostri dati, oltre il 90% delle cellule isolate con questa tecnica sono i GIR18. Dopo l'isolamento, la presenza e la vitalità delle cellule batteriche nel IBC individuali può essere confermate attraverso enumerazione di Colonia che forma unit (CFU) (Figura 4B) o reazione a catena della polimerasi quantitativa (qPCR) per equivalenti genomici ( Figura 4 C). Figura 4C dimostra anche che non infette cellule epiteliali isolate con lo stesso protocollo non abbia quantificabili quantità di batteri. Basato su questi dati, si stima che la gamma di CFUs in un singolo IBC è2-10 103 nel modello murino di infezione delle vie urinarie. Uno dei principali obiettivi del singolo isolamento IBC è quello di eseguire analisi a valle, quali sequenze di RNA. Per verificare che il nostro metodo di isolamento è in grado di ottenere RNA da batteri in gir per analisi, abbiamo effettuato la quantificazione di trascrizione d'inversione quantitativa della polimerasi reazione a catena (qRT-PCR) dei tre geni (16S, cyoB e frdA) per un gamma di Gir singolarmente isolati e messi in comune (Figura 4D). Tutti i dati riportati nella Figura 4 è stato adattato con il permesso di Giulio et al.18. Una schematica panoramica del nostro protocollo di isolamento IBC può essere visto in Figura 5, che è riprodotto da Giulio et al.18.

Figura 1 : Capillari tirata a mano mantengono strette aperture. (A) campioni di tubi capillari tirata a mano vengono visualizzati su uno sfondo nero per contrasto. Dal basso verso l'alto, un capillare unpulled, un capillare che non è stato tirato in misura sufficiente, vengono visualizzati un capillare che può essere utilizzato per la raccolta delle cellule epiteliali del singola vescica e un capillare che è stato tirato troppo sottile (e quindi separato in due pezzi). Un righello 15 cm è collocato nella parte inferiore dell'immagine per la scala. Il punto stimato per scattare fuori il capillare utilizzabile è indicato sulla figura dalla freccia rossa. (B) immagine scattata con un microscopio per dissezione confermando il diametro interno vuoto di un capillare tirato (in basso). Un unpulled capillare è posizionato sopra per dimostrare la differenza di dimensioni relative dei due capillari. Barra della scala = 4,0 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
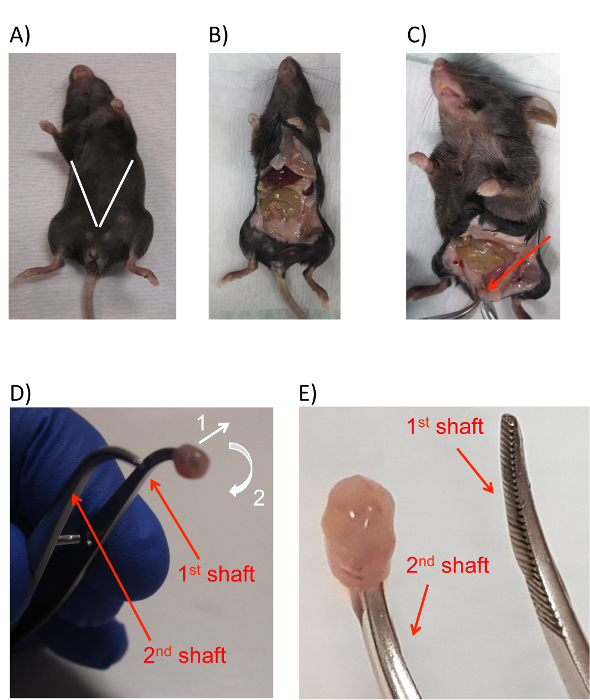
Figura 2 : Dissezione del mouse per raccogliere le cellule epiteliali della vescica. (A) un'immagine di un mouse con linee bianche aggiunto per indicare la posizione stimata e l'angolo delle incisioni per esporre la cavità peritoneale murino e la vescica. Post-incisione di (B) un'immagine di parte esposta del mouse cavità peritoneale. (C), un'immagine della parte esposta della vescica (freccia rossa) sporgente tra i cuscinetti adiposi. (D), un'immagine della vescica murina con la punta della pinza inserita nel lumen, con le frecce per indicare la direzione di movimento necessaria per invertire la vescica. La vescica è tirata leggermente verso l'esterno, quindi intorno e fuori il primo albero della pinza. Le direzioni di movimento per entrambe le azioni sono come indicato dalle frecce bianche numerate 1 e 2. (E) un'immagine che mostra la posizione finale della vescica invertita inserita sull'albero secondo delle pinze. Gli alberi delle pinze sono etichettati in entrambi i pannelli D ed E con frecce rosse e testo. Clicca qui per visualizzare una versione più grande di questa figura.
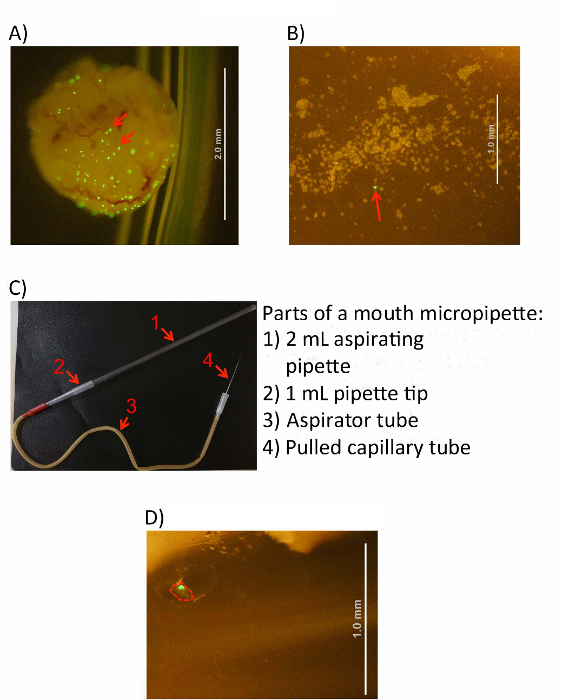
Figura 3 : IBC raccolta dalle cellule della vescica. (A) una vescica infettata e invertita in soluzione di PBS freddo prima cella raschiatura. (B) un'immagine che mostra raschiati cellule della vescica come visto sotto un microscopio. IBC possono essere identificati come grandi aggregati fluorescenti verdi in entrambe le immagini (vedi frecce rosse). Apparato micropipetting (C), un'immagine di debitamente compilato. La pipetta aspirante, puntale, aspiratore tubo e tubo capillare tirato sono identificati con frecce numerate, come indicato sulla destra. (D) un'immagine di un singolo isolato IBC all'interno di un tubo di raccolta di 1,5 mL (evidenziato in rosso). Barre della scala (come indicato) sono rappresentati da linee bianche nei pannelli A, B e D. Clicca qui per visualizzare una versione più grande di questa figura.
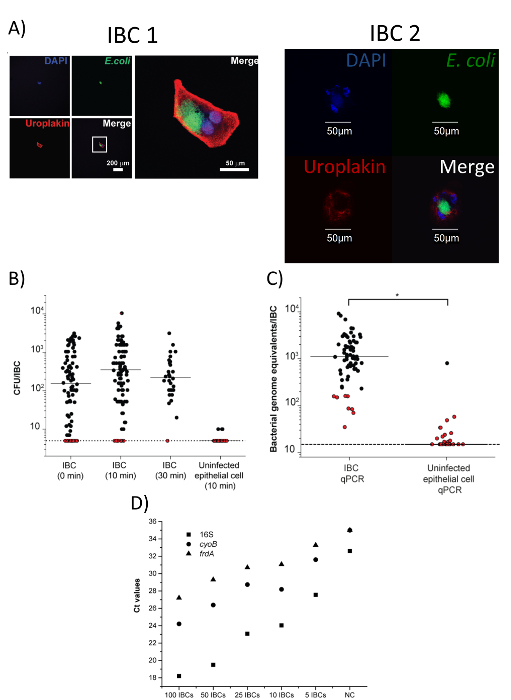
Figura 4 : Raccolto GIR sono puro e può essere utilizzato per l'analisi a valle. Questa figura è stata modificata con il permesso di Giulio et al.18. (A) le immagini di due isolate cellule GFP-positive che sono state macchiate con gli anticorpi anti-uroplachine e anti - die. coli . La prima cella (IBC 1) propone immagini di singoli canali (a basso ingrandimento) sulla sinistra, e un'immagine unita ad alto ingrandimento è sulla destra. La seconda cella (IBC 2) è mostrata in alto ingrandimento nei canali Unite e individuali. Barre della scala sono come indicato. Il DNA è macchiato con 4 ′, 6-diamidino-2-phenylindole (DAPI) e rappresentato nel canale blu. Anti -Escherichia coli è macchiato con un anticorpo secondario coniugato di isotiocianato di fluorescina (FITC) e rappresentata nel verde del canale. Anti-uroplachine è macchiato con un anticorpo secondario coniugato di tetrametilrodamina isotiocianato (TRITC) e rappresentata nel canale del rosso. (B) batterica CFUs da Gir isolato. Gir erano trattati immediatamente, o incubati nello 0,1% Triton-X per 10 o 30 min conteggi Pooled CFU dei singoli gir isolato da n = 3 esperimenti separati sono mostrati. Limite di rilevazione = 0,7 log10 CFUs/IBC. Puntini rossi tracciati al limite di rilevamento indicano i campioni per i quali sono stati recuperati senza colonie. Tutti i campioni contenenti IBC non sono significativamente differenti (p > 0.05, test di Mann-Whitney); le cellule epiteliali non infette sono significativamente diverse da quelli IBC (10 min) (p < 0,001, test di Mann-Whitney). (C) qPCR quantificazione dei batteri sui singoli GIR e cellule epiteliali non infette dopo un'incubazione di 10 min in 0,1% Triton-X (*, p < 0,0001, test di Mann-Whitney, n = 4). Limite di rilevazione = 1.18 log10 genoma batterico equivalenti/IBC. Punti rossi indicano i campioni per i quali non colonie sono stati recuperati sulla titolazione nel pannello b. (D) quantificazione dei geni 16S rRNA, cyoB e frdA per diversi numeri di Gir singolarmente isolati e messi in comune (n = 1 esperimento, ognuna delle quali punto indica la media dei 3 replicati tecnici). NC non = nessun controllo negativo del DNA. Clicca qui per visualizzare una versione più grande di questa figura.
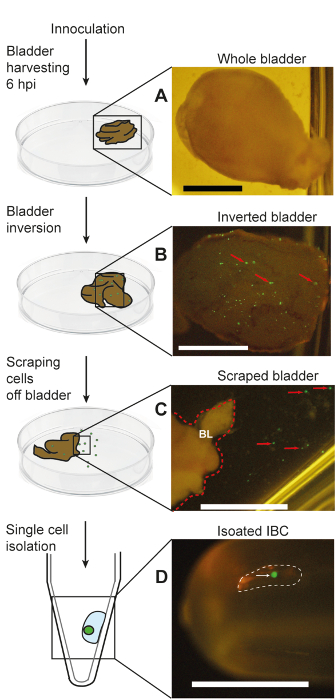
Figura 5 : Un disegno schematico e relative fotografie associati che rappresenta l'isolamento dei GIR via micropipetting di bocca da infettati vesciche topi. Questa figura è riprodotto da Giulio et al.18. (A), A raccolte intera vescica; (B) un invertito intera vescica esponendo la GFP esprimendo Gir; (C), un primo piano del bordo di una vescica raschiata risultati individuali Gir in sospensione nel buffer adiacenti; (D) un singolo isolato IBC pipettati in un tubo. Frecce rosse nel pannello B indicano esempi di GIR di GFP-positive sulla superficie luminale della vescica. La linea rossa tratteggiata nel pannello C indica il bordo destro della vescica invertito (indicato come "BL"); frecce rosse nel pannello C indicano apparente singole cellule epiteliali di GFP-positive hanno state raschiate la superficie della vescica. Linea tratteggiata bianca nel pannello D indica una gocciolina di micropipetted sub-microliter contenente un IBC isolato, che è indicato da una freccia bianca. Scala bar = 2 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo che abbiamo descritto consente l'isolamento del singolo Gir da un modello murino di UTI. Questo protocollo consente di isolare i GIR contenenti batteri intracellulari vitali, che possono essere verificati da coltura per CFU. I risultati di protocollo in batteri intracellulari da Gir con piccola contaminazione da batteri extracellulari, permettendo per ulteriore descrizione di entrambi i batteri e ospitano delle cellule da un IBC (Figura 4C). Mostriamo anche i batteri da un singolo IBC possono essere utilizzati in applicazioni a valle quali qPCR (Figura 4C), suggerendo che la nostra tecnica può essere utilizzata al processo gir per altre analisi in vitro. Mettendo in comune i batteri raccolti da poco più di 5 GIR, noi dimostrare ulteriormente la nostra capacità di effettuare analisi qRT-PCR su tre geni batterici, suggerendo che il RNA di buona qualità può essere raccolto dai batteri in nostri gir isolato (Figura 4D). Combinati, i dati che abbiamo indicato indicano che analisi genoma RNA (ad esempio di sequenziamento di RNA) su gir singolo può essere possibile utilizzando questa tecnica di isolamento.
In questo protocollo, ci siamo concentrati sul punto di tempo di 6 h perché è il momento di picco di IBC numeri in vesciche di neri 6 topi infettati da UTI8927. Inoltre, abbiamo anche utilizzato un sistema di coltura batterica statica per migliorare il livello di espressione di pilus di tipo 1 in UTI89. L'espressione di pilus di tipo 1 è fondamentale per e. coli per connettere a e infettare la vescica cellule epiteliali28. Tuttavia, questa espressione è strettamente regolato29 e stimoli ambientali sono conosciuti per alterare e30. Al fine di mantenere un fenotipo coerente infezione e un numero sufficiente di GIR, si consiglia di utilizzare una coltura batterica statica 2 x 24 h (leggermente modificato da Hung et al.8) e il punto di tempo di 6 h infezione quando lavorando con precedentemente testato Escherichia coli ceppi come NU14 e UTI8928,29. Tuttavia, è possibile che queste variabili dovranno essere corretti in altri ceppi UTI o in altri ceppi di topi per ottenere il numero ideale di Gir da ogni infezione.
Mentre il protocollo da Hung et al.8 utilizza solo topi femmina, altri protocolli stabiliti per l'instaurazione dell'infezione delle vie urinarie in di topo maschio sono stati segnalati31. In questo modello, cistite in di topo maschio ha seguito anche la via IBC. Come le vesciche di topi maschi e femmine sono simili per dimensioni, possiamo anticipare che il nostro protocollo di isolamento IBC può essere utilizzato su topi infettati maschi pure.
La tecnologia relativamente semplice utilizzata nel presente protocollo assicura inoltre che può essere distribuito nella maggior parte dei laboratori. Uno dei passaggi chiavi coinvolti in questo protocollo è l'estrazione di tubi capillari in vetro per creare microcapillari per selezionare il tipo di cella di interesse. Questo passaggio consente flessibilità nei diametri di microcapillari creato, e quindi il metodo può essere esteso a più tipi di cella di destinazione diversi. Tuttavia, a causa della variazione inerente nella creazione di questi capillari, deve prestare attenzione per assicurarsi che il diametro finale viene in una gamma utilizzabile. Se i capillari sono troppo stretti, riescono a raccogliere la cella di interesse, ma se sono fatti troppo ampie, in un singolo tentativo potrebbero essere selezionate più celle. Inoltre, l'uso di fiamme libere durante il processo di tirare capillare comporta un rischio intrinseco di ustioni ed incendio, così il ricercatore tentando di creare microcapillari dovrebbe aver cura di evitare che tali eventi si verifichi. Per ridurre la variabilità come pure il rischio di incendio aperto coinvolti nella realizzazione di questi capillari, il ricercatore potrebbe fare uso di una micropipetta tradizionale tirando la macchina, come quelli usati per esperimenti elettrofisiologici (ad es., PC-100, gruppo Narishige). Come queste macchine fanno uso di gravità o di piattaforme robotiche per tirare i capillari, ma possono essere adattati per soddisfare le esigenze del modello di infezione. Tuttavia, la vasta gamma della micropipetta tirando macchine disponibili significa che il singolo ricercatore sarà necessario passare attraverso alcuni tentativi ed errori per determinare il diametro capillare finale adatto per l'uso con questo protocollo.
Il protocollo presentato fa uso di batteri esprimendo un fluorescente tag per identificare visivamente la IBC. Quindi, questa tecnica è limitata dalla capacità dei ricercatori di modificare geneticamente l'organismo infettivo. Specificamente per UPEC, IBC-formare ceppi come CFT073 e NU14 sono state trasformate con successo con GFP-esprimendo plasmidi32,33,34; Questi dovrebbero pertanto essere utilizzabili nel protocollo stesso. Basato sulla zona del mouse della vescica (70 mm2)35, la lunghezza di singole cellule epiteliali (50-120 µm)17e la frequenza di IBC in un singolo vescica16, una stima conservativa per l'incidenza di Gir è circa 1 in 1.000 celle (o 0.1%). Questa stima mette in mostra l'utilità del nostro protocollo di isolamento delle cellule di indirizzare gli eventi rari. La precisione della selezione della cella attraverso il nostro protocollo e l'ampia gamma di diametri capillare che possa essere tirato e suggeriscono che questo protocollo può essere usato per isolare i batteri intracellulari da altri modelli in vivo e in vitro di infezione. Infatti, noi abbiamo utilizzato con successo questa tecnica per isolare cellule epiteliali coltivate infettato della vescica (dati non mostrati).
Uno dei più tecnicamente impegnativi passaggi nel protocollo è invertendo la vescica per esporre le cellule epiteliali per raschiare. Abbiamo trovato che è anche possibile fare un'incisione su di esso di strombatura per raschiare la vescica. Tuttavia dovuto cura dovrebbe essere presa per ridurre il danno alle cellule epiteliali della vescica durante il processo di taglio aperto; idealmente un unico taglio dovrebbe essere utilizzato per l'apertura della vescica di strombatura. Inoltre, il taglio deve essere effettuato in PBS freddo, per evitare la perdita accidentale delle cellule o del tessuto della vescica durante il processo.
Bocca di pipettaggio di Gir in questo protocollo fornisce maggiore controllo sul processo di selezione di cella, come pure limitando il volume finale della soluzione trasferito insieme alla cella. Il controllo fine e grande separazione della soluzione dalla bocca dei ricercatori inoltre massimizza la sicurezza del ricercatore, come i volumi trasferiti sono all'interno del nanolitro per microliter gamma. Al contrario, la nostra esperienza con la micropipetta moderna è che tende a trasferire più liquido circostante e cellule con l'IBC, potrebbe condurre alla contaminazione con batteri luminal extracellulari. La nostra individuazione che bocca pipettaggio fornisce una performance superiore sopra altri unicellulare metodi di isolamento è stato segnalato anche da altri laboratori22,23,24. Oltre a isolamento di singole cellule, bocca pipettaggio è anche stato utilizzato in elettroporazione di singola cellula per neuroni25, che dimostra ulteriormente l'utilità e il controllo dei minuti che un ricercatore addestrato può raggiungere con la tecnica. Tuttavia, la sicurezza è di primaria importanza, e consigliamo di potenziali misure supplementari che possono essere adottate a seconda degli agenti patogeni utilizzati: (i) l'estensione del buffer tra il ricercatore e il materiale biologico, ad esempio utilizzando un aspirando aria pipetta con un più grande volume (ad esempio, 5 mL), o (ii) l'aggiunta di un filtro fisico come ovatta nella pipetta aspirante ad agire come una barriera aggiuntiva.
Nei casi in cui una valutazione del rischio porta alla conclusione che la bocca pipettaggio è ancora troppo rischioso, configurazioni robotici commercialmente disponibili (ad esempio quelli utilizzati per nanoinjections) possono essere combinati con le altre sezioni della nostra tecnica per fornire un metodo più sicuro per isolamento di cellule infette da popolazioni miste. Va notato che la nostra esperienza con l'utilizzo di un micromanipolatore robotico ha dimostrato una diminuzione del tasso di isolamento IBC rispetto al pipettaggio di bocca, come la grande variazione intra-sperimentale nel formato delle cellule epiteliali della vescica rende impegnativo per l'utente di un braccio robotico per determinare la forza necessaria per ritirare il singolo Gir. Tuttavia, rimane un'opzione praticabile, anche se più costoso, per coloro che lavorano con gli agenti altamente contagiosi di malattia.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questa ricerca è stata sostenuta dal National Research Foundation, ufficio, Singapore del primo ministro, sotto sua NRF Research Fellowship Scheme (NRF premio no. NRF-RF2010-10); National Medical Research Council del Ministero della salute Singapore (NMRC/CIRG/1358/2013); e il Genome Institute di Singapore (GIS) / Agenzia per la scienza, la tecnologia e la ricerca (A * STAR).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL eppendorf tube | For static bacterial culture and OD measurement | ||
| 100% ethanol | For Alcohol Burner | ||
| 15 mL conical tube | For static bacterial culture and OD measurement | ||
| 1 mL Tuberculin Syringe | BD Biosciences | 302100 | |
| 3% Bacterial Agar | For static bacterial culture and OD measurement | ||
| 70% ethanol | For static bacterial culture and OD measurement | ||
| Aesculap anatomic forceps | Braun/Kruuse | BD222R | For initial dissection of mouse (skin, fascia) |
| Alcohol Burner | Wheaton | 237070 | |
| Aspirating pipette | BD Biosciences | 357558 | |
| Aspirator tube | Sigma-Aldrich | A5177 | |
| Bacterial loops | For static bacterial culture and OD measurement | ||
| Benchtop centrifuge | Eppendorf | 5424 | Any centrifuge for 1.5ml eppendorf tubes |
| Conical flasks | For static bacterial culture and OD measurement | ||
| Digital camera for microscope | Olympus | DP71 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Glass Capillaries | Kimax | 6148K07 | |
| Iris Scissors STR SS 110MM | Braun | BC110R | |
| Isoflurane (Isothesia) | Henry Schein Animal Health | 29405 | |
| Kanamycin Sulfate | Calbiochem | 420311 | For static bacterial culture and OD measurement |
| LB broth (Miller) | Thermo/Gibco | 10855021 | For static bacterial culture and OD measurement |
| Light source unit for microscope | Olympus | LG-PS2 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Lubricant | KY | Any similar commercial medical lubricant will suffice | |
| Macro fluorescence microscope | Olympus | MVX10 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Micropipette + micropipette tips | For static bacterial culture and OD measurement | ||
| PBS 1x | For static bacterial culture and OD measurement | ||
| Pipette controller + Pipettes | For static bacterial culture and OD measurement | ||
| Polyethylene Tubing | BD Intramedic | 427401 | |
| Precision Glide needle 30 G | BD Biosciences | 305107 | Possibly under new catalogue number (305106) |
| Splinter forceps curved | Braun | BD312R | |
| Spray bottle (for ethanol) | For static bacterial culture and OD measurement | ||
| Square cuvettes | Elkay | 127-1010-400 | For static bacterial culture and OD measurement |
| Sterilgard III Advance Safety Cabinet | Baker | SG403 | Any biosafety cabinet with a UV irridiator |
| Sterilin 90mm Standard Petri Dish | Thermo | 101VR20 | Any sterile petri dish |
| Stevens, vascular and tendon scissors, curved, delicate, 110 mm | Braun | OK366R | Recommended for harvesting of bladder |
| Surgical Scissors STR S/B 105MM | Braun | BC320R | |
| Tabletop Centrifuge | Eppendorf | 5810R | Any refridgerated centrifuge for 15ml conicals |
| WPA C08000 cell density meter | Biowave (Biochrom) | 80-3000-45 | For static bacterial culture and OD measurement |
Riferimenti
- Barber, A. E., Norton, P. J., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Flores-Mireles, A. L., Walker, J. N., Caparon, M., Hultgren, S. J. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nature Reviews Microbiology. 13, 269-284 (2015).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80, 331-333 (1990).
- Foxman, B., Barlow, R., D'Arcy, H., Gillespie, B., Sobel, J. D. Urinary tract infection: self-reported incidence and associated costs. Annals of Epidemiology. 10 (8), 509-515 (2000).
- Zowawi, H. M., et al. The emerging threat of multidrug-resistant Gram-negative bacteria in urology. Nature Reviews Urology. 12, 570-584 (2015).
- Silverman, J. A., Schreiber, H. L., Hooton, T. M., Hultgren, S. J. From physiology to pharmacy: developments in the pathogenesis and treatment of recurrent urinary tract infections. Current Urology Reports. 14, 448-456 (2013).
- Sivick, K. E., Mobley, H. L. T. Waging war against uropathogenic Escherichia coli: winning back the urinary tract. Infection and Immunity. 78, 568-585 (2010).
- Hung, C. -. S., Dodson, K. W., Hultgren, S. J. A murine model of urinary tract infection. Nature Protocols. 4, 1230-1243 (2009).
- Cusumano, C. K., et al. Treatment and prevention of urinary tract infection with orally active FimH inhibitors. Science Translational Medicine. , (2011).
- Alteri, C. J., Hagan, E. C., Sivick, K. E., Smith, S. N., Mobley, H. L. T. Mucosal Immunization with Iron Receptor Antigens Protects against Urinary Tract Infection. PLoS Pathogens. , (2009).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. , (2006).
- Hunstad, D. A., Justice, S. S. Intracellular lifestyles and immune evasion strategies of uropathogenic Escherichia coli. Annual Review of Microbiology. 64, 203-221 (2010).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Medicine. , (2007).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- Schwartz, D. J., Chen, S. L., Hultgren, S. J., Seed, P. C. Population dynamics and niche distribution of uropathogenic Escherichia coli during acute and chronic urinary tract infection. Infection and Immunity. 79, 4250-4259 (2011).
- Keshtkar, A., Keshtkar, A., Lawford, P. Cellular morphological parameters of the human urinary bladder (malignant and normal). International Journal of Experimental Pathology. 88, 185-190 (2007).
- Duraiswamy, S., Chee, J. L. Y., Chen, S., Yang, E., Lees, K., Chen, S. L. Purification of Intracellular Bacterial Communities during Experimental Urinary Tract Infection Reveals an Abundant and Viable Bacterial Reservoir. Infection and Immunity. , (2018).
- Kurimoto, K., Yabuta, Y., Ohinata, Y., Saitou, M. Global single-cell cDNA amplification to provide a template for representative high-density oligonucleotide microarray analysis. Nature Protocols. 2, 739-752 (2007).
- Tang, F., et al. Deterministic and stochastic allele specific gene expression in single mouse blastomeres. PLoS One. , (2011).
- Wells, J. M., Melton, D. A. Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development. 127, 1563-1572 (2000).
- Guo, H., et al. Profiling DNA methylome landscapes of mammalian cells with single-cell reduced-representation bisulfite sequencing. Nature Protocols. 10 (5), 645-659 (2015).
- Zhao, R., et al. The establishment of clonally derived chicken embryonic fibroblast cell line (CSC) with high transfection efficiency and ability as a feeder cell. Journal of Cellular Biochemistry. , (2018).
- Tang, F., et al. RNA-Seq analysis to capture the transcriptome landscape of a single cell. Nature Protocols. 5 (3), 516-535 (2010).
- Wiegert, J. S., Gee, C. E., Oertner, T. G. Single-Cell Electroporation of Neurons. Cold Spring Harbor Protocols. , (2017).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), 52892 (2015).
- Justice, S. S., et al. Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 101 (5), 1333-1338 (2004).
- Mulvey, M. A., et al. Induction and Evasion of Host Defenses by Type 1-Piliated Uropathogenic Escherichia coli. Science. 282 (5393), 1494-1497 (1998).
- Zhang, H., Susanto, T. T., Wan, Y., Chen, S. L. Comprehensive mutagenesis of the fimS promoter regulatory switch reveals novel regulation of type 1 pili in uropathogenic Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), 4182-4187 (2016).
- Gally, D. L., Bogan, J. A., Eisenstein, B. I., Blomfield, I. C. Environmental regulation of the fim switch controlling type 1 fimbrial phase variation in Escherichia coli K-12: effects of temperature and media. Journal of Bacteriology. 175 (19), 6186-6193 (1993).
- Olson, P. D., Hruska, K. A., Hunstad, D. A. Androgens Enhance Male Urinary Tract Infection Severity in a New Model. Journal of the American Society of Nephrology. 27 (6), 1625-1634 (2016).
- Garofalo, C. K., et al. Escherichia coli from Urine of Female Patients with Urinary Tract Infections Is Competent for Intracellular Bacterial Community Formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Berry, R. E., Klumpp, D. J., Schaeffer, A. J. Urothelial cultures support intracellular bacterial community formation by uropathogenic Escherichia coli. Infection and Immunity. 77 (7), 2762-2772 (2009).
- Holden, N., Totsika, M., Dixon, L., Catherwood, K., Gally, D. L. Regulation of P-fimbrial phase variation frequencies in Escherichia coli CFT073. Infection and Immunity. 75 (7), 3325-3334 (2007).
- Jost, S. P. Postnatal growth of the mouse bladder. Journal of Anatomy. 143, 39-43 (1985).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon